Академический Документы
Профессиональный Документы
Культура Документы
Soluciones Mezclas Homogeneas
Загружено:
I.E.S.T.P. HIPOLITO UNANUEИсходное описание:
Оригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Soluciones Mezclas Homogeneas
Загружено:
I.E.S.T.P. HIPOLITO UNANUEАвторское право:
Доступные форматы
Mezcla homognea (uniforme) de dos o ms sustancias, compuesta de partculas tan pequeas que no se pueden distinguir a simple vista, como
lo son: Soluto: Sustancia dispersa, lo que se va a diluir y se encuentra en menor proporcin. Solvente: Medio dispersor, en lo que se diluye, por lo general es el agua y se encuentra en mayor proporcin.
Video
Solucin Gaseosa Liquida Liquida Liquida
Solvente Gas Liquido Liquido Liquido
Soluto Gas Liquido Gas Slido
Ejemplos Aire Alcohol en agua Agua mineral CO2 en H2O Agua de mar NaCl en H2O
Diluida: Cantidad de soluto muy pequea en relacin son la cantidad de solvente. Soluciones Empricas: NO interesa conocer la cantidad exacta. Soluciones Soluciones Valoradas: SI Interesa conocer la cantidad exacta y la naturaleza. Concentrada: Mayor cantidad de soluto en comparacin a la diluida. Saturada: Aumenta la cantidad de soluto, se agita continuamente hasta que llega el momento en que el solvente ya no diluye al soluto. Sobresaturada: Contiene ms soluto que una solucin saturada, se forma al calentar una solucin saturada agregndole ms soluto. Porcentuales: En Peso, Volumen y Peso Volumen. Molales: Interviene el numero del moles. Molares: Interviene el nmero de moles. Normales: Interviene el peso equivalente de los compuestos.
Es la cantidad de soluto disuelta en una cantidad dada de solvente. Se puede expresar de las siguientes formas: Densidad Porcentaje Molalidad Molaridad Normalidad
Para las formulas se utilizan las siguientes abreviaturas: S: Soluto St: Solvente Sn: Solucin n: nmero de mol Peq: Peso Equivalente
Concentracin % Peso Peso (% P)
Definicin Peso del Soluto disuelto entre Peso de la Solucin
Frmulas % P= (Peso S / Peso Sn) x 100 % V= (Vol S / Vol Sn) x 100 % P- V= (Peso S / Vol Sn) x 100 m = n / Kg de Solvente M = n / Litros de Solucin
% Volumen Volumen Volumen del Soluto disuelto (% V) entre volumen de la Solucin % Peso Volumen (% P- V) Molalidad (m) Molaridad (M) Peso del Soluto disuelto entre volumen de la solucin Moles de Soluto disueltos en kilogramos de solvente Moles de soluto disueltos en litros de solucin
Normalidad (N)
Peso equivalente del soluto N = Peq / Litros de Solucin disuelto en un litro de solucin
Recuerda: Peso de Solucin = Peso Soluto + Peso Solvente Volumen de Solucin = Volumen Soluto + Volumen Solvente
Ejemplo: Una muestra de 0.892g de cloruro de potasio (KCl) se disuelve en 54.6g de Agua. Cul es el porcentaje en masa de KCl en esta solucin?
% P de KCl= (P soluto / P Solucin) x 100 % P de KCl= (0.892 / (0.892 + 54.6)) x 100 % P de KCl= (0.892 / 55. 492) x 100
% P de KCl= 1.61 %
Ejemplo: Cul es el porcentaje en volumen del etanol en una solucin que contiene 35 ml de etanol disueltos en 115 ml de agua? % V = (V soluto / V solucion) x 100 % V = (35 / (35 + 115)) x 100 % V = (35 / 150) x 100 % V = 23.33 % de Etanol
Ejemplo: Tienes 1500 ml de una solucin blanqueadora. El % en P- V del soluto en hipoclorito de sodio (NaClO) es de 3.62%. Cuntos gramos de NaClO hay en la solucin? % P- V = (P soluto / V solucin) x 100 Despejando la frmula P soluto = (% P- V x V solucin) / 100
P soluto = (% P- V x V solucin) / 100 P soluto = (3. 62 x 1500) / 100
P soluto = 54. 3 g de NaClO
Ejemplo: En el laboratorio, un estudiante agrega 4.5 g de cloruro de sodio (NaCl) a 100 g de agua. Calcula la molalidad de la solucin Peso Molecular de NaCl= 23 + 35.5 = 58.5 g Numero de moles (n) = 4.5 / 58.5 = 0.769 mol Conversin de gramos de agua a kilogramos 1 Kg 100 g = 0.1 kg de Agua 1000 g
m = moles de soluto / kg de solvente m = 0.769 mol / 0.1 kg de agua
m = 7.69 mol / kg
Ejemplo:
Una solucin intravenosa de 100.5 ml contiene 5.10 g de glucosa (C6H12O6). Cul es la molaridad de esta solucin?
Peso molecular de glucosa C = 12 x 6 = 72 H = 1 x 12 = 12 O = 16 x 6 = 96 PM = 72 + 12 + 96 = 180 g / mol
Nmero de moles (n) = Peso soluto / PM n = 5.10 / 180 = 0.0283 mol Conversin de ml a litros 100.5 ml 1 litro = 0.1005 litros 1000 ml M = moles de soluto / litros de solucin M = 0.0283 / 0.1005 = 0.2815 M = 0.2815 mol / L
Ejemplo: Qu normalidad tendr una solucin si 600 ml de la misma contiene 60 g de acido fosfrico (H3PO4)? Primero hay que determinar que tipo de compuesto es, puede ser acido, base o sal y utilizar la frmulas de peso equivalente. Peq acido = PM / Cantidad de iones de H
Peso Molecular de H3PO4 H=1x3=3 P = 35 x 1 = 35 O = 16 x 4 = 64 PM = 3 + 31 + 64 = 98 g/ mol Peq acido = 98 / 3 iones de H = 32.66 g/eq N = P soluto / (V x Peq) N = 60 / (0.6 L x 32.66) N = 3. 06 eq / L
El examen solo contempla hasta soluciones porcentuales. Cualquier duda que tengas lo puedes hacer por medio del blog en la seccin de comentarios. A estudiar se ha dicho
Вам также может понравиться
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadОт EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadОценок пока нет
- Crecimiento Poblacional (Informe)Документ13 страницCrecimiento Poblacional (Informe)Mariano Garay CarlosОценок пока нет
- Informe SapoДокумент8 страницInforme SapoJuanJosé Flores Garcia0% (1)
- 1 - Informe de Bioquimica 1Документ7 страниц1 - Informe de Bioquimica 1Carlos SKОценок пока нет
- Ficha Llanten MayorДокумент6 страницFicha Llanten MayorCatta Arellano100% (1)
- Análisis Cuantitativo de Tabletas de Aspirina Por Espectrometría UVДокумент7 страницAnálisis Cuantitativo de Tabletas de Aspirina Por Espectrometría UVLezkatheZapataОценок пока нет
- 7 FRUTO Guía de Práctica Laboratorio Biología Vegetal I 201720Документ4 страницы7 FRUTO Guía de Práctica Laboratorio Biología Vegetal I 201720Paul MarquezОценок пока нет
- Transpiracion 06 PDFДокумент9 страницTranspiracion 06 PDFJeanKeinerWyLopezОценок пока нет
- Manual Analitica AreliДокумент78 страницManual Analitica AreliGabriel Borboa Marquez33% (3)
- ColorantesДокумент2 страницыColorantesSaulОценок пока нет
- Practica de Observacion de Plantas Con LupaДокумент2 страницыPractica de Observacion de Plantas Con LupaJoel FuentesОценок пока нет
- Preparacion de SolucionesДокумент5 страницPreparacion de SolucionesDe Hoyos BrayanОценок пока нет
- Guía Potencial HidricoДокумент5 страницGuía Potencial HidricoJose CavicheОценок пока нет
- Laboratorio Transpiración VegetalДокумент9 страницLaboratorio Transpiración Vegetalmarena loorОценок пока нет
- Informe de HelechosДокумент4 страницыInforme de HelechosYuli Santos TeránОценок пока нет
- Informe Lab Citología MohosДокумент6 страницInforme Lab Citología MohosFernando VillegasОценок пока нет
- Invertebrados DulceacuicolasДокумент24 страницыInvertebrados DulceacuicolasCata VerdugoОценок пока нет
- Bitacora 13 AlelopatiaДокумент6 страницBitacora 13 AlelopatiaSponja75Оценок пока нет
- Informe Botanica 1Документ5 страницInforme Botanica 1davidОценок пока нет
- Ficha Crasuláceas, Un Ejemplo de Adaptación PDFДокумент2 страницыFicha Crasuláceas, Un Ejemplo de Adaptación PDFevaОценок пока нет
- Calor de Formacion Etanol y AspirinaДокумент4 страницыCalor de Formacion Etanol y AspirinaValentina Cabal RestrepoОценок пока нет
- Cattleya TrianeДокумент2 страницыCattleya TrianeoscarОценок пока нет
- Manual de Practicas de BioquímicaДокумент45 страницManual de Practicas de BioquímicaKIMI ANGEL CAMPOS COSTILLAОценок пока нет
- Lab 1 Introduccion Biologia VegetalДокумент6 страницLab 1 Introduccion Biologia VegetalAndrea hurtadoОценок пока нет
- Informe Practica 4Документ12 страницInforme Practica 4Emelyn SaldivarОценок пока нет
- GasesДокумент4 страницыGasesDavid RodriguezОценок пока нет
- 4 - Guía de Laboratorio 4 Morfología y Anatomía de RaízДокумент3 страницы4 - Guía de Laboratorio 4 Morfología y Anatomía de RaízAОценок пока нет
- Macroalgas PDFДокумент6 страницMacroalgas PDFJarvisAntonioFuenmayorDiazОценок пока нет
- Version Final PDF LQIДокумент6 страницVersion Final PDF LQIJhonathan Alexander SerranoОценок пока нет
- Los Plastidios, Practica de Laboratorio UNFV.Документ13 страницLos Plastidios, Practica de Laboratorio UNFV.Jovan López ArósteguiОценок пока нет
- Insecticida Casero A Base de AjíДокумент2 страницыInsecticida Casero A Base de AjíAnderson SalamancaОценок пока нет
- Infografia KVRДокумент1 страницаInfografia KVRVannia A VerásteguiОценок пока нет
- MANUAL BOTÁNICA 2022-PRACTICA 1 CorregidoДокумент12 страницMANUAL BOTÁNICA 2022-PRACTICA 1 CorregidoSANCHEZ MONTERO JESUS ALCIDES SANCHEZ MONTERO JESUS ALCIDESОценок пока нет
- Informe MorfologíaДокумент5 страницInforme MorfologíarockterineОценок пока нет
- Práctica 4. Aislamiento Micro. Del Suelo y TemperaturaДокумент7 страницPráctica 4. Aislamiento Micro. Del Suelo y TemperaturaMatimenaОценок пока нет
- Protocolo de Monitoreo Plagas y Enfermedades de Las HortalizasДокумент16 страницProtocolo de Monitoreo Plagas y Enfermedades de Las HortalizasGojuryu64Оценок пока нет
- Marco Teórico Lab 1Документ3 страницыMarco Teórico Lab 1Paul MarquezОценок пока нет
- Practica 2. Propiedades de Los Carbohidratos FДокумент8 страницPractica 2. Propiedades de Los Carbohidratos FKaren Alejandra Maigual CastilloОценок пока нет
- Practica de Laboratorio FotosintesisДокумент6 страницPractica de Laboratorio Fotosintesisisabela diazОценок пока нет
- Práctica 3 - MacroalgasДокумент10 страницPráctica 3 - MacroalgasWero BcОценок пока нет
- Informe NogalДокумент6 страницInforme NogalKristley CeliОценок пока нет
- Clase Metabolitos Secundarios. Glicosidos CardiacosДокумент58 страницClase Metabolitos Secundarios. Glicosidos CardiacosAlejandra RuizОценок пока нет
- Determinacion e Identificacion de Carica - OficialДокумент16 страницDeterminacion e Identificacion de Carica - OficialYasmy Medina ValdiviaОценок пока нет
- Determinación de Presencia de CatalasaДокумент10 страницDeterminación de Presencia de CatalasaAlejandra Sánchez TorresОценок пока нет
- Botánica Tipos de FloresДокумент6 страницBotánica Tipos de FloresjamilОценок пока нет
- INFORMEДокумент2 страницыINFORMEkendry piñero100% (1)
- Pigmentos VegetalesДокумент14 страницPigmentos VegetalesLaura Gomez AnzaldoОценок пока нет
- FICHA de SEGURIDAD 9. Acido ClorhidricoДокумент7 страницFICHA de SEGURIDAD 9. Acido ClorhidricoVale AlarconОценок пока нет
- Fisiología Vegetal - Manual de Prácticas..Документ61 страницаFisiología Vegetal - Manual de Prácticas..Carlos Arturo Ibañez Borrero0% (1)
- ENRVManual de Practicas Histologia VegetalДокумент56 страницENRVManual de Practicas Histologia Vegetalana salvatoriОценок пока нет
- Escala de PHДокумент8 страницEscala de PHAnnita JhoanОценок пока нет
- Tema 9. Familia CyperaceaeДокумент30 страницTema 9. Familia CyperaceaeWILSON RAMÍREZ PÉREZОценок пока нет
- Consulta Terpenos FinalДокумент21 страницаConsulta Terpenos FinalGaby PachacamaОценок пока нет
- Lab 2. Soluciones AmortiguadorasДокумент7 страницLab 2. Soluciones AmortiguadorasSharon Dayan CubasОценок пока нет
- PRÁCTICA NoДокумент10 страницPRÁCTICA NoEmely Suhuchery Alfonso DiazОценок пока нет
- Odonata, Protura, ColembolaДокумент19 страницOdonata, Protura, ColembolaCreteys Valera Bernal0% (1)
- Soluciones EmpiricasДокумент18 страницSoluciones EmpiricasNecrotemor NecrosОценок пока нет
- Teoria de SolucionesДокумент18 страницTeoria de SolucionesCesar Gianfranco Morales CamposОценок пока нет
- QUIMICA-Clase 07-Soluciones - Unidades de ConcentraciónДокумент44 страницыQUIMICA-Clase 07-Soluciones - Unidades de ConcentraciónDavid VasquezОценок пока нет
- 2013 Clase Soluciones Modo de CompatibilidadДокумент47 страниц2013 Clase Soluciones Modo de CompatibilidadValerie LagosОценок пока нет
- Reglamento de Experiencias Formativas en Situaciones Reales de Trabajo YO Prácticas Pre - ProfesionalesДокумент68 страницReglamento de Experiencias Formativas en Situaciones Reales de Trabajo YO Prácticas Pre - ProfesionalesI.E.S.T.P. HIPOLITO UNANUEОценок пока нет
- Atencion Farmacéutica Especilizada Urgencias Paciente Crític...Документ52 страницыAtencion Farmacéutica Especilizada Urgencias Paciente Crític...I.E.S.T.P. HIPOLITO UNANUEОценок пока нет
- Tincion de GramДокумент18 страницTincion de GramI.E.S.T.P. HIPOLITO UNANUEОценок пока нет
- Vigilancia ESAVI Leve y Moderado - DIGEMIDДокумент48 страницVigilancia ESAVI Leve y Moderado - DIGEMIDI.E.S.T.P. HIPOLITO UNANUEОценок пока нет
- Parasitrologia Clinica - Craig - FaustДокумент320 страницParasitrologia Clinica - Craig - FaustI.E.S.T.P. HIPOLITO UNANUE50% (2)
- Gestión Del Almacén en Un Hospital Nacional de LimaДокумент94 страницыGestión Del Almacén en Un Hospital Nacional de LimaI.E.S.T.P. HIPOLITO UNANUEОценок пока нет
- Inmunizaciones (Minsa)Документ22 страницыInmunizaciones (Minsa)I.E.S.T.P. HIPOLITO UNANUEОценок пока нет
- E.T.S. : Enfermedades de Transmision SexualДокумент39 страницE.T.S. : Enfermedades de Transmision SexualI.E.S.T.P. HIPOLITO UNANUEОценок пока нет
- Manual Enfermeria PDFДокумент166 страницManual Enfermeria PDFjuan fernandezОценок пока нет
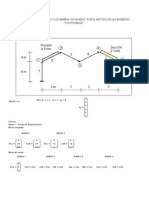
- Vigas de TechoДокумент9 страницVigas de TechoMario Javier Cobeñas BallesОценок пока нет
- Características Generales de Los DientesДокумент22 страницыCaracterísticas Generales de Los DientesJose Sin Limites100% (10)
- Patente Capsulas HidrosolublesДокумент40 страницPatente Capsulas HidrosolublesShakira PorrasОценок пока нет
- Ondas Superficiales en El MarДокумент29 страницOndas Superficiales en El MarPedro Daniel Muñoz CarranzaОценок пока нет
- Orden Sugerido para El Desarrollo Del Programa de Sociedad de JóvenesДокумент6 страницOrden Sugerido para El Desarrollo Del Programa de Sociedad de JóvenesJEZHU H.GОценок пока нет
- Identidades TrigonometricasДокумент15 страницIdentidades Trigonometricasel_johanОценок пока нет
- Unidades para Medir La EnergiaДокумент2 страницыUnidades para Medir La EnergiaMichelle Reyes17% (6)
- 4 Analisis andДокумент26 страниц4 Analisis andhaiku258Оценок пока нет
- Desgaste Por CavitaciónДокумент6 страницDesgaste Por CavitaciónDaniel RobalinoОценок пока нет
- Practica 2Документ5 страницPractica 2Martha MendozaОценок пока нет
- Indicadores de BrotesДокумент2 страницыIndicadores de BrotesHenry BritoОценок пока нет
- Examen 2Документ6 страницExamen 2HUMBERTOОценок пока нет
- Mathcad - TareaContinuidadfinalДокумент6 страницMathcad - TareaContinuidadfinalFrancisco GoFlesОценок пока нет
- Analisis - PH y Acidez TotalДокумент6 страницAnalisis - PH y Acidez TotalTony VillanuevaОценок пока нет
- Hidraulica - Ecuación Fundamental de Las Turbinas de ReacciónДокумент15 страницHidraulica - Ecuación Fundamental de Las Turbinas de ReacciónJulian AlonsoОценок пока нет
- Practica Nro 3 - Propiedades de La RocaДокумент2 страницыPractica Nro 3 - Propiedades de La RocaMirko Calderon RamosОценок пока нет
- Materia y División de La MateríaДокумент7 страницMateria y División de La MateríajjreolОценок пока нет
- Practica 6 FisicaДокумент8 страницPractica 6 Fisicaanon_883253491Оценок пока нет
- Diseño de Elementos Sometidos A Cargas EstaticasДокумент11 страницDiseño de Elementos Sometidos A Cargas EstaticasLuis Rodriguez DunnОценок пока нет
- Practica Movimiento RelativoДокумент7 страницPractica Movimiento RelativoJoel MaldonadoОценок пока нет
- 01-Ecuacion de ContinuidadДокумент15 страниц01-Ecuacion de ContinuidadRita Olmedo MoralesОценок пока нет
- Parcial 1 PatologiaДокумент8 страницParcial 1 PatologiaDiegoОценок пока нет
- LEVANTAMIENTO TOPOGRAFICO EN LINEA DE TRANSMISION (Rev 08ago)Документ4 страницыLEVANTAMIENTO TOPOGRAFICO EN LINEA DE TRANSMISION (Rev 08ago)La creatividad de Adriana c.cОценок пока нет
- El Sistema No AisladoДокумент1 страницаEl Sistema No AisladoYuliОценок пока нет
- GUIA RESUMEN Primero MedioДокумент7 страницGUIA RESUMEN Primero MedioconyОценок пока нет
- Bbi BinocularesДокумент15 страницBbi Binocularesarepacfr8797Оценок пока нет