Академический Документы
Профессиональный Документы
Культура Документы
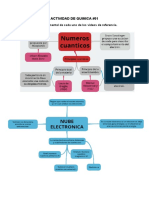
Números Cuánticos
Загружено:
Juan K MarroquinОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Números Cuánticos
Загружено:
Juan K MarroquinАвторское право:
Доступные форматы
Universidad de San Carlos de Guatemala
Escuela de Formacin de Profesores de Enseanza Media
Programa Acadmico Preparatorio
Curso: Qumica
NMEROS CUNTICOS
PAP-QUMICA
Lic. Juan Carlos Marroqun
PRINCIPIO DE DUALIDAD
LOS ELECTRONES ,
AL IGUAL QUE LOS
FOTONES (CUANTOS
DE ENERGA
LUMINOSA) SE
COMPORTAN COMO
PARTCULAS (masa) Y
COMO
ONDAS(energa)
LOUIS DE BROGLIE
Afirmaba que un haz de electrones
debera mostrar caractersticas
ondulatorias y comportarse como un
haz de luz. Esta explicacin sobre la
naturaleza ondulatoria del electrn le
vali el premio Nobel en 1929.
PRINCIPIO DE INCERTIDUMBRE DE
HEISENBERG
Heisenberg afirmaba que era
imposible establecer con precisin
tanto la posicin como la energa
de un electrn.
Principio de Heisenberg es
imposible establecer la trayectoria
especfica de un electrn
Werner Heisenberg (1925)
Asocia a cada variable dinmica
(posicin, momento, energa, etc.) una
cantidad matemtica de doble
entrada, conocida ahora como matriz.
Como resultado de su propuesta,
obtiene una desigualdad matemtica
que es conocida como Principio de
Incertidumbre
2
> A A p x
La Mecnica Cuntica Ondulatoria
Erwin Schrdinger (1925)
Estudi el trabajo de L. de Broglie y
propuso una ecuacin de onda que
permita describir el
comportamiento de la onda de
materia. La forma de esa ecuacin
es:
( ) ( )
t
i t x t x V
m c
c
= + V
, ,
2
2
2
El principio de Incertidumbre es un resultado
terico entre magnitudes conjugadas (posicin
- momento, energa-tiempo, etctera). Un error
muy comn es decir que el principio de
incertidumbre impide conocer con infinita
precisin la posicin de una partcula o su
cantidad de movimiento. Esto es falso. El
principio de incertidumbre nos dice que no
podemos medir simultneamente y con infinita
precisin un par de magnitudes conjugadas.
Es decir, nada impide que midamos con
precisin infinita la posicin de una partcula,
pero al hacerlo tenemos infinita incertidumbre
sobre su momento.
Por otra parte, las partculas en Fsica
Cuntica no siguen trayectorias bien
definidas. No es posible conocer el valor de
las magnitudes fsicas que describen a la
partcula antes de ser medidas. Por lo tanto
es falso asignarle una trayectoria a una
partcula. Todo lo ms que podemos es decir
que hay una determinada probabilidad de
que la partcula se encuentre en una posicin
ms o menos determinada.
La Paradoja de Schrdinger es un experimento
imaginario para exponer uno de los aspectos ms
extraos, a priori, de la Mecnica Cuntica.
Supongamos un sistema formado por una caja cerrada y
opaca que contiene un gato, una botella de gas
venenoso, una partcula radiactiva con un 50% de
probabilidades de desintegrarse y un dispositivo tal
que, si la partcula se desintegra, se rompe la botella y
el gato muere. Al depender todo el sistema del estado
final de un nico tomo que acta segn la mecnica
cuntica, tanto la partcula como el gato forman parte
de un sistema sometido a las leyes de la Mecnica
Cuntica.
Siguiendo la
interpretacin de
Copenhague, mientras
no abramos la caja, el
gato est en un estado
tal que est vivo y
muerto a la vez. En el
momento en que
abramos la caja, la sola
accin de observar al
gato modifica el estado
del gato, haciendo que
pase a estar solamente
vivo, o solamente
muerto.
Esto se debe a una propiedad
fsica llamada Superposicin
Cuntica.
Los nmeros cunticos son variables involucradas
en la ecuacin de onda de Schrdinger.
Dependiendo de los valores de los nmeros
cunticos, se obtienen diferentes soluciones para la
ecuacin de onda.
Estas soluciones permiten conocer los lugares de
mxima probabilidad para ubicar a un electrn
dentro de un tomo.
NMEROS CUNTICOS
Los nmeros cunticos obtenidos de la ecuacin de
onda son tres:
- El nmero cuntico principal.
- El nmero cuntico secundario, tambin llamado
nmero cuntico azimutal o nmero cuntico de
momento angular.
- El nmero cuntico magntico.
NMEROS CUNTICOS
Nmero Cuntico Principal
El nmero cuntico principal, se denota con
un una letra n y su valor indica la rbita o
nivel energtico en el que se encuentra el
electrn, mientras mayor sea el valor de n,
ms alejado esta el electrn del ncleo, y
mayor es su contenido energtico.
Nmero Cuntico Principal
Los valores que adquiere n, son nmeros enteros mayores
de cero; as por ejemplo:
Cuando n = 1, el electrn se encuentra en la rbita 1
Cuando n = 2, el electrn se encuentra en la rbita 2
Cuando n = 3, el electrn se encuentra en la rbita 3
.
.
Cuando n = x, el electrn se encuentra en la rbita x
Nmero Cuntico Secundario
El nmero cuntico secundario, se denota con una
letra l y su valor indica la subrbita o subnivel de
energa en el que se encuentra el electrn.
Dicha subrbita o subnivel energtico, tambin
llamado orbital, se puede entender como la forma
geomtrica que describe el electrn al moverse
dentro del tomo.
Nmero Cuntico Secundario
Para cada valor de n, l adquiere diferentes valores
enteros, que van desde cero hasta n-1; as por
ejemplo:
Cuando n = 1, l adquiere un solo valor: 0
Cuando n = 2, l adquiere dos valores: 0 y 1
Cuando n = 3, l adquiere tres valores: 0, 1 y 2
.
.
Nmero Cuntico Secundario
Como se mencion anteriormente, los
orbitales son formas geomtricas que
describen los electrones al moverse en el
interior del tomo. Estas formas geomtricas
son diferentes para cada valor de l y a cada
orbital se le asigna una literal.
Nmero Cuntico Secundario
l = 0
Orbital s
l = 1
Orbital p
l = 2
Orbital d
Nmero Cuntico Secundario
Cuando l = 3, los orbitales son del tipo f; cuando l =
4, los orbitales son del tipo g y a partir de aqu, se
van asignando las letras siguientes del abecedario.
Conforme aumenta el valor de l, aumenta la
complejidad de la figura geomtrica que describe el
electrn; de hecho, an no se han determinado las
formas que presentan los orbitales del tipo g.
Nmero Cuntico Magntico
El nmero cuntico magntico, se denota
con una letra my sus valores indican las
orientaciones que tienen los orbitales en el
espacio.
Nmero Cuntico Magntico
Para cada valor de l, madquiere diferentes valores
enteros que van desde l hasta +l, pasando por cero;
as por ejemplo:
Cuando l = 0, m adquiere un solo valor: 0
Cuando l = 1, m adquiere tres valores: 1, 0 y
+1
Cuando l = 2, m adquiere cinco valores: 2, 1,
0, +1 y +2
1a.
rbita
2a. rbita 3a. rbita
n
1 2 3
l
(Orbital)
0
(s)
0
(s)
1
(p)
0
(s)
1
(p)
2
(d)
m
0 0 -1 0 +1 0 -1 0 +1 -2 -1 0 +1 +2
Con base en lo anterior, para las tres primeras rbitas
de un tomo, se puede establecer la tabla siguiente:
1a. rbita
X
Y
Z
Orbital 1s
1a. rbita 2a. rbita 3a. rbita
n 1 2 3
l
(Orbital)
0
(s)
0
(s)
1
(p)
0
(s)
1
(p)
2
(d)
m 0 0 -1 0 +1 0 -1 0 +1 -2 -1 0 +1 +2
2a. rbita
X
Y
Z
Orbital 2s
X
Y
Z
Orbital 2p
x
X
Y
Z
Orbital 2p
y
X
Y
Z
Orbital 2p
z
1a. rbita 2a. rbita 3a. rbita
n 1 2 3
l
(Orbital)
0
(s)
0
(s)
1
(p)
0
(s)
1
(p)
2
(d)
m 0 0 -1 0 +1 0 -1 0 +1 -2 -1 0 +1 +2
3a. rbita
X
Y
Z
Orbital 3s
X
Y
Z
Orbital
3p
X
X
Y
Z
Orbital 3p
Y
X
Y
Z
Orbital 3p
Z
X
Y
Z
Orbital 3d
XY
X
Y
Z
Orbital 3d
XZ
X
Y
Z
Orbital 3d
YZ
X
Y
Z
Orbital 3d
X
2
-Y
2
X
Y
Z
Orbital 3d
Z
2
Al emplear los parmetros n, l y men la ecuacin de onda
de onda de Schrdinger, se logr conocer los lugares de
mxima probabilidad (orbitales) para ubicar a un electrn
dentro de un tomo, esto fue un gran avance para conocer la
estructura electrnica del tomo y permiti justificar muchas
caractersticas fsicas y qumicas de los elementos; sin
embargo, fue necesario introducir un cuarto nmero cuntico,
para tomar en cuenta los efectos relativistas y poder explicar el
diamagnetismo y paramagnetismo que presentan los tomos
de los elementos.
Nmero Cuntico de Espin
El cuarto nmero cuntico se denota con una letra s y se le denomina
nmero cuntico de espin o de giro del electrn. Este nmero tiene dos
valores por cada valor del nmero cuntico m; los valores son + y -, y
denotan los dos posibles giros del electrn alrededor de su propio eje.
El cuarto nmero cuntico se denota con una letra sy se le
denomina nmero cuntico de espin o de giro del electrn.
Nmero Cuntico de Espin
Norte magntico
Sur magntico Norte magntico
Sur magntico
DIAMAGNETISMO Y
PARAMAGNETISMO
Cuando en una sustancia todos los orbitales contienen dos electrones
(electrones apareados), se observa que al colocar dicha sustancia bajo
la influencia de un campo magntico externo, es dbilmente repelida y
se dice entonces que es una sustancia diamagntica; en contraste, una
sustancia que contiene uno o ms orbitales con un solo electrn
(electrones desapareados), es atrada por un campo magntico
externo, y se dice que es una sustancia paramagntica.
Nmeros Cunticos
Hidrgeno:
Orbital
1s
N
S
Nmeros cunticos del
electrn
n = 1
l = 0
m = 0
s = +1/2
PARAMAGNTICO
Nmeros Cunticos
Helio:
Orbital
1s
N
S
N
S
Nmeros cunticos de
los electrones
n = 1 n = 1
l = 0 l = 0
m = 0 m = 0
s = +1/2 s = -1/2
DIAMAGNTICO
Nmeros Cunticos
Litio:
Orbitales 1s
N
S
N
S
Nmeros cunticos de
los electrones
n = 1 n = 1
l = 0 l = 0
m = 0 m = 0
s = +1/2 s = -1/2
2s
N
S
n = 2
l = 0
m = 0
s = +1/2
PARAMAGNTICO
Nmeros Cunticos
Berilio:
Orbitales
1s
S
N
N
S
2s
S
N
N
S
DIAMAGNTICO
Boro:
Orbitales
1s
S
N
N
S
2s
S
N
N
S
2p
x
N
S
2p
y
2p
z
PARAMAGNTICO
n = 1 n = 1
l = 0 l = 0
m = 0 m = 0
s = +1/2 s = -1/2
n = 2 n = 2
l = 0 l = 0
m = 0 m = 0
s = +1/2 s = -1/2
n = 2 n = 2
l = 0 l = 0
m = 0 m = 0
s = +1/2 s = -1/2
n = 1 n = 1
l = 0 l = 0
m = 0 m = 0
s = +1/2 s = -1/2
n = 2
l = 1
m = -1
s = +1/2
Elemento
n l m s
Carbono
2 1 -1 -1/2
Nitrgeno
2 1 0 +1/2
Oxgeno
2 1 0 -1/2
Fluor
2 1 1 +1/2
Nen
2 1 1 -1/2
Sodio
3
Magnesio
3
Aluminio
3
Silicio
3
NMEROS CUNTICOS
Nmero
Cuntico
Rango de
valores
Describe
Principal, n 1, 2, 3, .... Nivel energtico
Secundario, l,
Desde 0 hasta n-
1
Forma del orbital
Magntico, m Desde - l hasta + l
Orientacin
espacial
Espn, s 1/2
Espn del
electrn
MODELO ATMICO DE
SOMMERFELD
SOMERFIELD MODIFICA EL
MODELO DE BOHR.
INTRODUCE EL CONCEPTO DE
SUBNIVELES PARA EXPLICAR LA
UBICACIN DE LOS ELECTRONES
EN LOS DIFERENTES NIVELES DE
ENERGA.
INDICADOS POR EL NMERO
CUNTICO l SUBNIVELES: s,p,d y f
EXPLIC QUE LOS NIVELES NO
SOLO ERAN CIRCULARES SINO
TAMBIEN ELPTICOS
Вам также может понравиться
- Edu Trends - MOOCДокумент23 страницыEdu Trends - MOOCJuan K MarroquinОценок пока нет
- Puerto Rico y América LatinaДокумент72 страницыPuerto Rico y América Latinaflopez-2Оценок пока нет
- Evaluar maquetas instrumentoДокумент1 страницаEvaluar maquetas instrumentoJuan K Marroquin100% (1)
- 6th Central Pay Commission Salary CalculatorДокумент15 страниц6th Central Pay Commission Salary Calculatorrakhonde100% (436)
- Guia No.3 DCC IДокумент1 страницаGuia No.3 DCC IJuan K MarroquinОценок пока нет
- Guia No.5 DCC IДокумент1 страницаGuia No.5 DCC IJuan K MarroquinОценок пока нет
- EduTrends Mentoring PDFДокумент32 страницыEduTrends Mentoring PDFChristian Rodríguez AmpueroОценок пока нет
- Guia No.4 DCC IДокумент1 страницаGuia No.4 DCC IJuan K MarroquinОценок пока нет
- EduTrends Mentoring PDFДокумент32 страницыEduTrends Mentoring PDFChristian Rodríguez AmpueroОценок пока нет
- Guia 17. Desarrollo de La Competencia Física IДокумент13 страницGuia 17. Desarrollo de La Competencia Física IJuan K MarroquinОценок пока нет
- Veterinaria. Contenidos BiologíaДокумент3 страницыVeterinaria. Contenidos BiologíaJuan K MarroquinОценок пока нет
- 01 Otros Sist de Numer ApuntesДокумент19 страниц01 Otros Sist de Numer ApuntesCastañeta EdgarОценок пока нет
- Guía 11. Matemática 1. División AlgebraicaДокумент10 страницGuía 11. Matemática 1. División AlgebraicaJuan K MarroquinОценок пока нет
- Practica 5 - El CapacitorДокумент3 страницыPractica 5 - El CapacitorJuan K MarroquinОценок пока нет
- EprintДокумент26 страницEprinteladowskiОценок пока нет
- Capítulo 35 Audesirk Nutrición y DigestiónДокумент131 страницаCapítulo 35 Audesirk Nutrición y DigestiónJuan K MarroquinОценок пока нет
- Conductores y AislanteДокумент6 страницConductores y Aislanteruthflores119310Оценок пока нет
- Desarrollo Del PensamientoДокумент4 страницыDesarrollo Del PensamientoJuan K MarroquinОценок пока нет
- Practica 1 - El OsciloscopioДокумент3 страницыPractica 1 - El OsciloscopioJuan K Marroquin0% (1)
- Modelo de Regresion Lineal Múltiple 1Документ6 страницModelo de Regresion Lineal Múltiple 1Juan K MarroquinОценок пока нет
- Capítulo 7 Audesirk FotosíntesisДокумент86 страницCapítulo 7 Audesirk FotosíntesisJuan K MarroquinОценок пока нет
- Cnaudesirkcapitulo08 120508184213 Phpapp02Документ62 страницыCnaudesirkcapitulo08 120508184213 Phpapp02Mabel LlamasОценок пока нет
- Propiedades números realesДокумент24 страницыPropiedades números realesJuan K MarroquinОценок пока нет
- NOMENCLATURAДокумент27 страницNOMENCLATURAAlvaro Aguilar0% (2)
- Cómo Elaborar Un Diagrama de FlujoДокумент4 страницыCómo Elaborar Un Diagrama de FlujoJuan K MarroquinОценок пока нет
- Capacitación INFOUSAC 2019Документ23 страницыCapacitación INFOUSAC 2019Juan K MarroquinОценок пока нет
- NOMENCLATURAДокумент27 страницNOMENCLATURAAlvaro Aguilar0% (2)
- Ciencias Asociadas A La QuímicaДокумент2 страницыCiencias Asociadas A La QuímicaJuan K Marroquin100% (1)
- BIOLOGÍA II. Organización de Actividades Segunda Parte 2018Документ1 страницаBIOLOGÍA II. Organización de Actividades Segunda Parte 2018Juan K MarroquinОценок пока нет
- Pruebas Estandarizadas No Miden Calidad Educativa PophamДокумент11 страницPruebas Estandarizadas No Miden Calidad Educativa PophamManuel Sanchez100% (1)
- El ElectrónДокумент27 страницEl ElectrónAlex YujraОценок пока нет
- Exámen Febrero 1S 2020Документ5 страницExámen Febrero 1S 2020Marco García GarcíaОценок пока нет
- G01 - 2023-IIQ - Guía Estructura AtómicaДокумент7 страницG01 - 2023-IIQ - Guía Estructura AtómicaMelisa CroceОценок пока нет
- Materiales FerromagneticosДокумент7 страницMateriales FerromagneticosAnonymous b4aB7zhuОценок пока нет
- Informe de QuimicaДокумент14 страницInforme de QuimicaMAYRA ALEXANDRA KARPITE ALCIVARОценок пока нет
- Clase 11. Presentación - Números CuánticosДокумент14 страницClase 11. Presentación - Números CuánticosFernando ZambranoОценок пока нет
- QuimicaxdДокумент4 страницыQuimicaxdEvelyn Fernanda Parra CamposОценок пока нет
- Actividad Numeros CuanticosДокумент3 страницыActividad Numeros CuanticosDaniela Rodríguez Del ValleОценок пока нет
- Numeros CuanticosДокумент1 страницаNumeros CuanticosHenrry R. GutierrezОценок пока нет
- Biofísica I - Modulo IIДокумент139 страницBiofísica I - Modulo IIAzul AmiamaОценок пока нет
- Unidad 1 Actividad 2 Estructura de La MateriaДокумент25 страницUnidad 1 Actividad 2 Estructura de La MateriaDaniela LunaОценок пока нет
- Secuencia Didactica Biologia Segundo MedioДокумент5 страницSecuencia Didactica Biologia Segundo Medio5211241Оценок пока нет
- Modelo Atomico CuanticoДокумент7 страницModelo Atomico CuanticoMariano Ambrosio100% (1)
- Q - Sem - 5 - Estructura Atómica y Números CuánticosДокумент4 страницыQ - Sem - 5 - Estructura Atómica y Números Cuánticoseo salaОценок пока нет
- LN CuanticosДокумент6 страницLN CuanticosEngler Puente AquijeОценок пока нет
- Unidad 4 Teoría Cuántica y Configuración ElectrónicaДокумент18 страницUnidad 4 Teoría Cuántica y Configuración ElectrónicaiWant PS PludОценок пока нет
- Guía química: principios básicosДокумент13 страницGuía química: principios básicosJesa DuranОценок пока нет
- Clasificacion de Los Numeros Cuanticos para Quinto de Secundaria PDFДокумент4 страницыClasificacion de Los Numeros Cuanticos para Quinto de Secundaria PDFBertha Rendon100% (1)
- Examen. Quimica. Caliz.Документ2 страницыExamen. Quimica. Caliz.Joel LopezОценок пока нет
- Color de La LlamaДокумент10 страницColor de La LlamaNåThý InОценок пока нет
- Configuración electrónicaДокумент18 страницConfiguración electrónicaAnthony HuacachiОценок пока нет
- Electrones de ValenciaДокумент4 страницыElectrones de ValenciaStephanie BalcedoОценок пока нет
- Teoría ElectrónicaДокумент12 страницTeoría ElectrónicaIvánCastilloGarcíaОценок пока нет
- SUPERSIMETRIA. Teoria Del Campo UnificadoДокумент112 страницSUPERSIMETRIA. Teoria Del Campo UnificadoJu MOmo50% (2)
- PDFДокумент103 страницыPDFLuisa Dominguez100% (1)
- Grupo B - RespasoДокумент2 страницыGrupo B - RespasoJose Alfredo Cervantes ZacariasОценок пока нет
- Química General para BiólogosДокумент34 страницыQuímica General para BiólogosManuel Ortega CanoОценок пока нет
- Trabajo de Quimica 1Документ6 страницTrabajo de Quimica 1CAMILO ERNESTO HERRAN TOROОценок пока нет
- Documento Sin TítuloДокумент7 страницDocumento Sin TítuloYeison David100% (1)
- 13 Tarea Quimica 5°añoДокумент10 страниц13 Tarea Quimica 5°añocarlos ruizОценок пока нет