Академический Документы
Профессиональный Документы
Культура Документы
Bromacion benceno catalizada acido
Загружено:
hairmonИсходное описание:
Оригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Bromacion benceno catalizada acido
Загружено:
hairmonАвторское право:
Доступные форматы
DATOS Y RESULTADOS
Bromacion del benceno.
Reactivos
Cantidad utilizada en
Bromacion benceno catalizada por acido.
Reactivos Cantidad utilizada en (mL+0.1 mL) Cantidad utilizada en (g+0.01 g)
(mL+ 0.1 mL)
Agua de bromo 5 Benceno 0.5 Tabla 1. Cantidad de reactivos utilizados en la
bromacion del benceno
Observaciones: no hubo reaccin quedando dos fases en la solucin. Bromacion fenol
Reactivos Cantidad utilizada en (mL+0.1 mL) Cantidad utilizada en (g+0.01 g)
Agua de 5 bromo Benceno 2 Hierro -----------Tabla 2. Cantidad de reactivos
bromacion del benceno catalizada.
-------------0.8
utilizados en la
Observaciones: si hubo reaccin y la solucin se decoloro Formacin del cido bencensulfonico
Reactivos Cantidad utilizada en (mL+0.1 mL) Cantidad utilizada en (g+0.01 g)
Agua de 5 ------bromo Fenol ------0.1 Tabla 2. Cantidad de reactivos utilizados en la
bromacion del fenol
cido sulfrico
0.8
Observaciones: si hubo reaccin formndose un precipitado blanco en una solucin incolora
Bromacion del ciclo hexeno.
Reactivos Cantidad utilizada en (mL+0.1 mL)
DISCUSIN
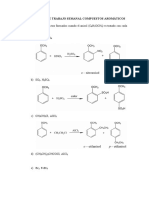
La sustitucin electrofnica aromtica es la reaccin ms importante de los compuestos aromtico atreves de esta es posible introducir al anillo muchos sustituyentes distintos. Si se elige el reactivo apropiado pueden efectuarse reacciones de bromacin, cloracin, nitracin, sulfonacin, alquilacin y acilacin, estas seis son reacciones directas, y a partir de ellas se pueden introducir otros grupos [1].
Agua de 5 bromo ciclo 1 hexeno Tabla 3. Cantidad de reactivos utilizados en la
bromacion del ciclo hexeno
Observaciones: si hubo reaccin la solucin paso de amarillo intenso a incolora
En la prctica se hizo reaccionar el benceno con agua de bromo en donde no hubo reaccin ya que el benceno es normalmente inerte en presencia de halgenos, debido a que los halgenos no son lo suficientemente electrfilos para destruir su aromaticidad por otra parte se hizo reaccionar el hexeno con agua de bromo en donde hubo una decoloracin de la sustancia por tanto si hubo reaccin. Despus se hizo reaccionar el fenol con agua de bromo en donde se form un precipitado blanco y la solucin se torn incolora y una liberacin de HBr gaseoso. El hecho de que el ciclohexeno sea ms reactivo que le benceno ya que este no reacciono y el ciclohexeno si se puede explicar partiendo de la estructura de Kekul para el benceno sta presenta tres dobles enlaces que nos presentaran al benceno como un trieno cclico conjugado, por lo cual cabra esperar que reaccionase de forma similar en las reacciones tpicas de los polienos. Sin embargo, sus reacciones son muy diferentes y en condiciones donde los alquenos reaccionan rpidamente, el benceno no reacciona, o solo lo hace muy lentamente [1]. Como podemos observar en las siguientes reacciones que se presentan en el esquema 1, donde se compara la reactividad de benceno con la reactividad del ciclohexeno.
Esquema 1. Reactividad del bencenos
frente a la del ciclohexeno
Esta gran estabilidad que presenta el benceno viene confirmado por el hecho de que su calor de hidrogenacin es menor que el del 1,3-ciclohexadieno. Si consideramos que la energa de hidrogenacin del ciclohexeno es de 28,6 kcal/mol tericamente la energa del benceno partiendo de la estructura de Kekul debera ser 75,8 kcal/mol, cuando en realidad es de 49,8 kcal/mol, lo indica que presenta una energa de resonancia de 36 kcal/mol. Todo ello indica que el anillo de benceno es excepcionalmente inerte, ya que para hidrogenarlo se requieren presiones y temperaturas altas adems de que la estructura real del benceno no es ninguna de las de Kekul presento sino la del hbrido de resonancia que se representa con un hexgono con un crculo[1]. Figura 1.
En donde el producto principal es el trans-1,2-dibromociclohexano [2] Anteriormente se dijo que el benceno es normalmente inerte en presencia de halgenos, debido a que los halgenos no son lo suficientemente electrfilos para destruir su aromaticidad, sin embargo, los halgenos pueden activarse mediante cidos de Lewis como los haluros de hierro o de aluminio para dar electrfilos ms potentes. Para realizar en la prctica la bromacion del benceno se utiliz el hierro como catalizador en donde se sigue el siguiente mecanismo [1]
Figura 1. Representacin de las estructuras
de resonancia del benceno
Finalmente, la estabilidad excepcional del benceno no tiene nada de excepcional: ya que esta es la que se espera de un hibrido de estructuras equivalentes. Las 36 kcal de energa que el benceno no contiene comparado con el ciclohexatrieno es energa de resonancia, Estas 36 kcal de energa de estabilizacin de resonancia son las responsables del conjunto de propiedades llamadas propiedades aromticas. Las reacciones tpicas del anillo bencnico son aquellas tales que el anillo sirve de fuente electrnica para reactivos electrofllicos (cidos). Debido a la estabilizacin por resonancia del anillo bencnico. Esas reacciones llevan a la sustitucin, en la cual se conserva el carcter aromtico del anillo mientras que la reaccin caracterstica de los alquenos es la adicin electrofilica como se muestra en el mecanismo de la raccion de agua de bromo con el ciclohexeno
1.
Activacion de bromo:
2.
Ataque electrfilo sobre el benceno
3.
El FeBr4 formado en la etapa anterior acta como base abstrayendo el protn del catin hexadienilo
Esquema 2. Mecanismo de bromacion del
benceno catalizada por hierro
Esquema 3. Mecanismo de reaccin de la bromacion del ciclohexeno
En donde la primera etapa es una activacin del bromo por parte de hierro para asi hacerlo un electrfilo ms potente capas de abstraer un electrn de anillo bencnico formando as un intermediario de adicin electrofilica como se puede ver en la segunda etapa. En la tercera etapa El FeBr4 formado en la etapa anterior acta como base abstrayendo el protn del catin hexadienilo para asi formar el anillo
aromtico y como resultado un producto de sustitucin en donde el bromobenceno es el producto mayoritario en esta reaccin. El diagrama de energa de la bromacion del benceno muestra que el primer paso es endotrmico y el segundo paso es fuertemente exotrmico, la reaccin global es exotrmica, pero el ataque electrfilo es el paso limitante por que el anillo pierde su aromaticidad
Por tanto al adicionarle agua de bromo al fenol, la bromacion ocurre rpidamente ya que el grupo hidroxilo activa al anillo hasta el punto que esta reaccin ocurre sin necesidad de un catalizador.
Esquema 4. Reaccin de bromacion del
fenol
En donde el mecanismo de esta reaccin es:
Figura 2. Esquema de energa en la bromacion
del benceno.
Como se observ en la prctica el fenol es mucho ms reactivo que el benceno este hecho se debe a que el grupo hidroxilo presente en el anillo aromtico es un grupo fuertemente activador del anillo bencnico debido a estos los fenoles son sustratos muy reactivos a la sustitucin aromtica electrfila. El grupo hidroxilo del fenol es un activante muy fuerte y dirige hacia las posiciones orto y para. El ataque en estas posiciones a un carbono que lleva a un sustituyente hidroxilo da como resultado un catin estabilizado por efecto de resonancia por el par de electrones no compartidos del oxgeno. En las posiciones orto y para tiene lugar la forma de resonancia ms estable ya que, todos los tomos participantes tienen el octeto de electrones. Esta estabilidad produce que se formen rpidamente el producto, obteniendo el fenol una velocidad ms rpida en la sustitucin aromtica electrfila que el benceno [1]
Esquema 5. Mecanismo de bromacion del
fenol
PREGUNTAS
1. cules productos se obtienen en la sulfonacin del fenol? Los productos que se forman son el acido o-fenolsulfonico y acido pfenolsulfonico[1].
Las estructuras resonantes que se dan en el intermediario electrofilico son las mismas para la posicin orto y para. Figura 1. Acido o-fenolsulfonico 2. si los anteriores experimentos se realizaran con tolueno, cuales productos se obtendran? Escriba las ecuaciones correspondientes. Para la primera reaccin con bromo solo no se presenta reaccin.
Figura 2. Acido p-fenolsulfonico
Figura 3.
En la segunda reaccin cuando se le adiciona el hierro en polvo como catalizador la reaccin procede de la siguiente manera:
Figura 4.
Figura 5.
Figura 7. Para la ultima reaccin con acido sulfrico se lleva a cabo una sulfonacin como lo muestra la siguiente ecuacin [1].
Figura 6.
Figura 9. Figura 8. 3. la alquilacin de friedel crafts es una importante reaccin para la formacin de alquilbencenos, sin embargo tiene sus limitaciones sintticas. Para la formacin de nbutilbenceno, se puede pensar en emplear cloruro de butilo, y benceno, sin embargo, durante la reaccin se forman ismeros del nbutilbenceno, siendo el secbutilbenceno uno de ellos. a) ilustre con mecanismos como se formara el sec-butilbenceno, explicando la transposicin de carbocation que se da. En la alquilacin de friedel crafts con nBuCl no se forma el n-butilbenceno si no que por el contrario se forma de secbutilbenceno esto sucede por que en el momento en que el grupo alquilo se rompe su enlace con e cloro se forma un carbocation primario, pero debido a una transposicin de hidruro se forma la carga positiva queda en el carbono vecino el cual forma un carbocation secundario el cual es mas estable que el primero y por lo tanto este es el que reacciona con el doble enlace del benceno para dar el sec-butilbenceno[1]. b) se conoce que la acilacion de friedel crafts resuelve algunos de los problemas de la alquilacin de friedel crafts, segun esto, proponga la formacin del n-butilbenceno desde la acilacion de friedel crafts. Recuerde que en la acilacion de friedel crafts debe usar un haluro de acilo. El haluro de acilo reacciona con el benceno para formar una cetona, despus se trata el grupo carbonil de la cetona y se trasforma en un con una reduccin de clemmensen, para as generar el n-butilbenceno, el cual es el producto deseado [1].
Figura 10. 4. explique los siguientes hechos: El bromuro de bencillo ( ) reacciona con etoxido de sodio (NaOEt) en etanol para dar el bencil etil ter ( ). La velocidad de la reaccin depende tanto de la concentracin de bromuro de bencilo como de la concentracin de etoxido de sodio. Sin embargo, en condiciones idnticas, el bromuro de p-metoxibencilo genera el p-
metoxibencil
ter (p) presenta una velocidad de reaccin mayor a la del bromuro de bencilo. Para Las dos reacciones se podra presumir que su mecanismo de reaccin es , esta sospecha radica en que la reaccin depende de la concentracin del compuesto halogenado y del etoxido, pero es claro que debe haber alguna diferencia que permita mayor velocidad en la segunda reaccin. la diferencia en las velocidades de reaccin es producto primero de que el disolvente es etanol el cual es polar y favorece pero no es un efecto tan marcado para hacer que la segunda reaccin proceda por este mecanismo, por lo que la razn fundamental esta en el metoxi ubicado en posicin para, este es un liberador poderoso de electrones y estabiliza el catin benclico este efecto produce un cambio en el mecanismo de reaccin y hace que reaccione a travs de con formacin de un carbocation segundario en el anillo benclico, producto de la transposicin de hidruro al metilo atacado en la reaccin y este por la estabilidad que le confiere el metoxi hace que la reaccin sea ms veloz[1].
etil
el fenol tiene un grupo hidroxilo en el anillo bencnico el cual lo hace mucho mas reactivo que el benceno debido a que este grupo hidroxilo es fuertemente activador orto y para
Referencia
[1]. Morrison, R; Boyd, R. quimica organica; 5ta ed., Boston, E.U.A. 1998; pp 457-460, 490-500, 980-995 [2]. MACY, R. qumica orgnica simplificada. 3ra ed., editorial reverte. S. A., 1992 pp 163- 165
Conclusiones
Los anillos aromtico son mucho ms estables que los polienos (trienos conjugados cclico) y ciclo alquenos debido a su aromaticidad La adicin de un grupo funcional al anillo bencnico cambia su reactividad la cual depende de las propiedades del grupo si es activante (orto, para) o desactivante (meta)
Вам также может понравиться
- Reacciones de adición 1QM2Документ5 страницReacciones de adición 1QM2Odalhyz CabreraОценок пока нет
- Informe de Analisis de Carbonatos y FosfatosДокумент5 страницInforme de Analisis de Carbonatos y FosfatoshairmonОценок пока нет
- CAUSAS de RoboДокумент2 страницыCAUSAS de RoboIbrahim Alcala59% (27)
- Acetileno Informe FinalДокумент10 страницAcetileno Informe Finalfabio boteroОценок пока нет
- Informe 7 OrgánicaДокумент6 страницInforme 7 OrgánicaNatalia FernándezОценок пока нет
- Hidrocarburos AromáticosДокумент15 страницHidrocarburos AromáticosElvis Leonel Temoche SandovalОценок пока нет
- Obtencion de Acetileno1Документ6 страницObtencion de Acetileno1Miguel Angel MejiaОценок пока нет
- Sustituciòn electrofilica aromaticaДокумент10 страницSustituciòn electrofilica aromaticathelma orellanaОценок пока нет
- El Mecanismo de La Sustitución Electrófila AromáticaДокумент28 страницEl Mecanismo de La Sustitución Electrófila AromáticaNellyGarciaSuarezОценок пока нет
- AcetilenoДокумент6 страницAcetilenoRosemary EricksonОценок пока нет
- Informe 1 de Orgánica II Nitración Del BencenoДокумент8 страницInforme 1 de Orgánica II Nitración Del BencenoKevin NaviaОценок пока нет
- Trabajo de Alquilacion F-CДокумент4 страницыTrabajo de Alquilacion F-CSamuel Espinoza GarciaОценок пока нет
- AromaticidadДокумент32 страницыAromaticidadAlex Sotelo ContrerasОценок пока нет
- Sustitución Electrofílica AromáticaДокумент61 страницаSustitución Electrofílica AromáticavilmaОценок пока нет
- Ozonòlisis de AlquenosДокумент26 страницOzonòlisis de AlquenosLorenzo MinayaОценок пока нет
- Explicación Experimento No. 1. Alquilación de Friedel y CraftsДокумент7 страницExplicación Experimento No. 1. Alquilación de Friedel y CraftsPAULINA PEREZ CAMPOSОценок пока нет
- 3CAP 16 Quimica Del Benceno Sustitucion Electrofilica NXPowerLiteДокумент62 страницы3CAP 16 Quimica Del Benceno Sustitucion Electrofilica NXPowerLiteAndrew stevensonОценок пока нет
- Cuaderno de Trabajo de Quimica Organica IIДокумент20 страницCuaderno de Trabajo de Quimica Organica IIrosa0% (1)
- benceno marco teoricoДокумент8 страницbenceno marco teoricoairlet orozcoОценок пока нет
- Compuestos AromáticosДокумент105 страницCompuestos AromáticosJaznine FloresОценок пока нет
- Sustitucion Electrofilica AromaticaДокумент20 страницSustitucion Electrofilica AromaticaEzequiel HernándezОценок пока нет
- Reacciones de Sustitución Aromática SEAДокумент24 страницыReacciones de Sustitución Aromática SEAMirthza Aguilar YeОценок пока нет
- Hidrocarburos AromaticosДокумент7 страницHidrocarburos AromaticosJohanna GalanОценок пока нет
- Departamento de Química Laboratorio de Química OrgánicaДокумент8 страницDepartamento de Química Laboratorio de Química OrgánicaMelviisaОценок пока нет
- Reacciones químicas mecanismos sustituciónДокумент7 страницReacciones químicas mecanismos sustituciónFrank RodgersОценок пока нет
- Teroria Del Benceno - Quimica Organica UfpsДокумент22 страницыTeroria Del Benceno - Quimica Organica Ufpslauratmb1211Оценок пока нет
- Benceno y DerivadosДокумент47 страницBenceno y DerivadosRoberto Carlos EspinozaОценок пока нет
- Teoría Qo 05 Mat Abr.23 2023-IДокумент24 страницыTeoría Qo 05 Mat Abr.23 2023-IAlvaro CotrinaОценок пока нет
- Bromación del benceno con FeBr3Документ3 страницыBromación del benceno con FeBr3LADY DANNIS CABALLERO PORTOОценок пока нет
- Presentacion Benceno Power PointДокумент30 страницPresentacion Benceno Power PointADRIANA MAGDALENA ROMERO DE LA CRUZОценок пока нет
- Reacciones AromáticasДокумент14 страницReacciones AromáticasLUCIA RODRIGO FLORESОценок пока нет
- Sustitución Electrofílica AromáticaДокумент24 страницыSustitución Electrofílica AromáticaDiego Polanco100% (1)
- Reacciones Del BencenoДокумент13 страницReacciones Del BencenoSoledad CárdenasОценок пока нет
- Aromaticos 2Документ41 страницаAromaticos 2Verito VillotaОценок пока нет
- Pruebas para HidrocarburosДокумент10 страницPruebas para Hidrocarburosjavier elias salcedo ramosОценок пока нет
- Problemas Tema 5Документ65 страницProblemas Tema 5Geraldine D. FernándezОценок пока нет
- Informe Hidrocarburos AromáticosДокумент8 страницInforme Hidrocarburos AromáticosJUAN PABLO OCAMPO SANCHEZОценок пока нет
- Alquilación Friedel-Crafts: Síntesis de alquilbencenosДокумент32 страницыAlquilación Friedel-Crafts: Síntesis de alquilbencenosJahuey UnalescoОценок пока нет
- Química orgánica: El benceno y reacciones de sustitución electrofílica aromáticaДокумент27 страницQuímica orgánica: El benceno y reacciones de sustitución electrofílica aromáticaPercy PaucarОценок пока нет
- QOI. 2023 Carbanion-EnolatoДокумент25 страницQOI. 2023 Carbanion-Enolatoivan camilliОценок пока нет
- Folleto de Hidrocarburos Aromaticos 2022Документ24 страницыFolleto de Hidrocarburos Aromaticos 2022EDUARDO JOSUE BLANDON LARGAESPADAОценок пока нет
- Practica Nº6 BenzofenonaДокумент8 страницPractica Nº6 BenzofenonaLucia Rafaela Paredes MamaniОценок пока нет
- ALQUENOS y ALQUINOSДокумент13 страницALQUENOS y ALQUINOSFranco BorgatelloОценок пока нет
- Propiedades de Hidrocarburos AromaticosДокумент5 страницPropiedades de Hidrocarburos AromaticosConverseОценок пока нет
- 2 Obtención de Acetileno y Propiedades de Alquinos y AlcanosДокумент6 страниц2 Obtención de Acetileno y Propiedades de Alquinos y AlcanosOscar Ivan Burbano GarciaОценок пока нет
- Reactividad de Aldehídos y CetonasДокумент19 страницReactividad de Aldehídos y CetonasDaniel GámezОценок пока нет
- Obtencion de Acetileno y Propiedades de Alquinos y AlcanosДокумент5 страницObtencion de Acetileno y Propiedades de Alquinos y AlcanosLuisa ValenciaОценок пока нет
- Propiedades químicas hidrocarburos aromáticosДокумент5 страницPropiedades químicas hidrocarburos aromáticosPaola L. Mejia50% (2)
- COOQ Resumen T.5Документ15 страницCOOQ Resumen T.5Alba Rivas GuijarroОценок пока нет
- Hidrocarburos AromáticosДокумент45 страницHidrocarburos AromáticosIan RepettoОценок пока нет
- Informe Laboratorio Acetofenona y Acido Benzoico Castillo, CampoverdeДокумент13 страницInforme Laboratorio Acetofenona y Acido Benzoico Castillo, CampoverdeJohanna CastilloОценок пока нет
- Sintesis de Difenil CarbinolДокумент4 страницыSintesis de Difenil CarbinolSantiago SogamosoОценок пока нет
- Obtencion AcetilenoДокумент6 страницObtencion AcetilenoAndres Joaqui100% (1)
- Preinforme AldehidosДокумент2 страницыPreinforme Aldehidosanon_225112333Оценок пока нет
- Propiedades de Los HidrocarburosДокумент9 страницPropiedades de Los HidrocarburosLuisaFernandaОценок пока нет
- Reacciones de Comp. AromaticosДокумент19 страницReacciones de Comp. AromaticosOscar Soto RuizОценок пока нет
- Mecanismo de Reacción.Документ21 страницаMecanismo de Reacción.carlitosvelasquezОценок пока нет
- Anexo 2 - Tarea 3 - Grupo - 266 - Yulima - AcostaДокумент18 страницAnexo 2 - Tarea 3 - Grupo - 266 - Yulima - Acostayulima1409Оценок пока нет
- Pruebas generales de alcoholes, fenoles y éteresДокумент11 страницPruebas generales de alcoholes, fenoles y éteresEliana picoОценок пока нет
- Determinación electroquímica de ΔHДокумент4 страницыDeterminación electroquímica de ΔHhairmonОценок пока нет
- IntroducciónДокумент2 страницыIntroducciónhairmonОценок пока нет
- Como Se Calculan Las Capacidad CaloríficaДокумент2 страницыComo Se Calculan Las Capacidad CaloríficahairmonОценок пока нет
- Discusion de EspectrosДокумент4 страницыDiscusion de EspectroshairmonОценок пока нет
- Analisis GravimétricoДокумент4 страницыAnalisis Gravimétricohairmon0% (3)
- AnilinaДокумент10 страницAnilinahairmonОценок пока нет
- Carga y Descarga de Un CondensadorДокумент11 страницCarga y Descarga de Un CondensadorhairmonОценок пока нет
- Lineas Equipotenciales Original. InformeДокумент7 страницLineas Equipotenciales Original. InformehairmonОценок пока нет
- Laboratirio Efecto JДокумент5 страницLaboratirio Efecto JhairmonОценок пока нет
- Analisis LoiДокумент2 страницыAnalisis LoiDaniel Vargas CeliОценок пока нет
- Garantias Cientificas Del PansiДокумент2 страницыGarantias Cientificas Del PansiBILKO GARCIA100% (1)
- Género, ciudadanía y derechos humanos en América LatinaДокумент4 страницыGénero, ciudadanía y derechos humanos en América LatinaAlicia IpiñaОценок пока нет
- Tema - 1 Principios Básicos de La EconomíaДокумент4 страницыTema - 1 Principios Básicos de La EconomíaMiquel DrudisОценок пока нет
- Control Total de PèrdidasДокумент2 страницыControl Total de Pèrdidaslchira3424100% (2)
- Factores internos y externos en la elección de carreraДокумент8 страницFactores internos y externos en la elección de carreraMaelit MPОценок пока нет
- Lo Oculto de La Falsa Profeta Elena GДокумент35 страницLo Oculto de La Falsa Profeta Elena GAntonio MarteОценок пока нет
- Proyecto de Administración IIДокумент14 страницProyecto de Administración IIJennifer AlanisОценок пока нет
- Mamani Yurica Garcia YeseniaДокумент131 страницаMamani Yurica Garcia YeseniaYane LyОценок пока нет
- Valores éticos para directoresДокумент48 страницValores éticos para directoresFlor PerezОценок пока нет
- El Sublime Maestre y El Hermano MayorДокумент43 страницыEl Sublime Maestre y El Hermano MayorVíctor Alan100% (1)
- Identificar Los Conceptos Más Relevantes Del TextoДокумент2 страницыIdentificar Los Conceptos Más Relevantes Del TextoFrancisca RetamalesОценок пока нет
- Casita de Los MártiresДокумент157 страницCasita de Los MártiresCarolina MonzonОценок пока нет
- Práctica Número 10 Conservación de La Energía MecánicaДокумент4 страницыPráctica Número 10 Conservación de La Energía MecánicaKarlo Guillemro Ponce BozaОценок пока нет
- Dokumen - Tips Doce Capas Del Adn KryonДокумент117 страницDokumen - Tips Doce Capas Del Adn KryonMichelleVintreet100% (1)
- USTA Taller Pre Parcial 1Документ3 страницыUSTA Taller Pre Parcial 1Paola RinconОценок пока нет
- Desarrollo, dependencia, marginaciónДокумент37 страницDesarrollo, dependencia, marginaciónAnonymous v8EQ497yОценок пока нет
- Guia Los MayasДокумент5 страницGuia Los MayasVICTORIA ORELLANAОценок пока нет
- Perfil Del DocenteДокумент17 страницPerfil Del DocenteEisela Luna Ga100% (1)
- Guía para una buena confesiónДокумент6 страницGuía para una buena confesiónpaulina povedaОценок пока нет
- ContraindicacionesДокумент13 страницContraindicacionesjose3152071289Оценок пока нет
- Manual Cal 5055 ElectricДокумент2 страницыManual Cal 5055 ElectriceservinОценок пока нет
- La Complejidad de Los Derechos Humanos. Bases Teóricas para Una Definición Crítica PDFДокумент34 страницыLa Complejidad de Los Derechos Humanos. Bases Teóricas para Una Definición Crítica PDFLeandro LozanoОценок пока нет
- Calculo 1Документ6 страницCalculo 1Giselle NavarroОценок пока нет
- Hora Santa Con Todos Los Santos PDFДокумент4 страницыHora Santa Con Todos Los Santos PDFMARTHA ALICIA BERDINES TERANОценок пока нет
- La AnemiaДокумент4 страницыLa AnemiaNanYeni100% (5)
- Evidencia 1 Estudio de CasoДокумент3 страницыEvidencia 1 Estudio de CasoAndrea foreroОценок пока нет
- Recuperacion de Conferencia InauguralДокумент2 страницыRecuperacion de Conferencia Inauguralmariel CarrascoОценок пока нет
- Rubrica para Evaluar Comportamiento 1 LcalderonДокумент2 страницыRubrica para Evaluar Comportamiento 1 LcalderonMartín Ariel Dávila PonceОценок пока нет