Академический Документы
Профессиональный Документы
Культура Документы
Análisis Instrumental Algunos Métodos Fotométricos y Electrométricos Apuntes de Clase1
Загружено:
lilipuОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Análisis Instrumental Algunos Métodos Fotométricos y Electrométricos Apuntes de Clase1
Загружено:
lilipuАвторское право:
Доступные форматы
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
1
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS
APUNTES DE CLASE
FEDERMN CASTRO EUSSE
INSTRUMENTAL
ANLISIS
Infrarrojo
Visible
Ultravioleta
Rojo
Anaranjado
Amarillo
Verde
Azul
Ail
Violeta
Luz blanca
Prisma
Longitudes de onda
400 mm
760 mm
Relacin
supuesta
Relacin
real
Concentracin
informada
C
A
Concentracin
real
S
E
A
L
S
ref
C
s
%
tr
a
s
m
is
i
n
3500 3000 2500 2000 1800 1600
CH
3
OCH CH C CH II
C H
O
I
III
O
CH
3
C C C CH
3
O
n cm
-1
Fuente luminosa
Luz ordinaria
vibrando en todas las
direcciones
Polarizador
Celda para la
muestra
Analizador
Observador
OJO
a
a
Posicin real de la moneda
La moneda se ve aqu
y
y
x
x
z
z
E
E
H
H
D
irre
c
i
n
d
e
p
ro
p
a
g
a
c
i
n
Na
+
Cl
-
Cl
Na
110v A.C.
Ctodo de
gasa de Pt
Anodo de Pt
Motor
A
V
6 a 12 voltios cd
Ampermetro
Voltmetro
7
0
0
0
7
0
0
7
0
4
1
0
1
4
p
H
m
V
Control de
temperatura
Calibracin
a cero
2
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Tecnlogo Qumico U.T.P.
Licenciado en educacin
Tecnologa Qumica U.T.P.
Especialista en
Instrumentacin Fsica
U.T.P.
Magster en Docencia
Universitaria U.P.N
rea de desempeo
Docente Qumica Analtica
Profesor Titular
Federmn Castro Eusse
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
3
ANLISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS
APUNTES DE CLASE
PROFESOR FEDERMN CASTRO EUSSE
4
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
5
AGRADECIMIENTOS
A Dios por haberme concedido la vida, la salud, el trabajo, el amor a la
docencia y la experiencia para poder extractar estos apuntes de los muchos y
valiosos contenidos existentes sobre las tcnicas analticas tratadas.
A mis compaeros profesores y estudiantes por sus observaciones y
recomendaciones y a mi sobrino Miguel ngel Puentes Castro por la
diagramacin del libro.
6
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
7
ndice
INTRODUCCIN
PRIMERA UNIDAD
1. Contextualizacin de la asignatura en el campo de la qumica analtica y los programas acadmicos de
Tecnologa en Qumica y Qumica Industrial.
1.1 Qu es la Qumica Analtica?
1.1.1 Cul es la funcin del Qumico Analista?
Cuadro 1.1 Relaciones de qumica analtica con otras ramas de la qumica y otras ciencias.
1.2 Generalidades sobre la Instrumentacin Qumica.
1.2.1 Clasifcacin general de los mtodos instrumentales de anlisis.
1.2.1.1 Mtodos Fotomtricos y Espectrofotomtricos: Fundamentados en la interaccin de las
radiaciones electromagnticas con la materia.
1.2.1.2 Mtodos Electromtricos: Fundamentados en la electroqumica la cual se ocupa de las
interacciones entre las especies qumicas con los campos elctricos o electrones y en el estudio de las
propiedades electroqumicas de las soluciones.
1.2.1.3 Mtodos extractivos: Basados en los fenmenos de transferencia de masa originada por diversos
mecanismos.
1.2.1.4 Otros mtodos: activacin y dilucin isotpicas: Basados en las propiedades radiactivas.
1.3 Confguracin de los instrumentos o equipos.
Cuadro 1.1 seales utilizadas en los mtodos Instrumentales y clsicos
Figura 1.1 componentes de un instrumento (fotometro)
1.4 Criterios de calidad analtica.
1.4.1 Seleccin de una Tcnica o mtodo analtico
1.4.1.1 Defnicin del problema
1.4.1.2 Caractersticas de funcionamiento de los instrumentos; parmetros de calidad
Cuadro 1.2 Criterios numricos para seleccionar mtodos analticos
Cuadro 1.3 Parmetros de calidad para la precisin de los mtodos analticos.
Figura 1.2 Intervalo lineal de un mtodo analtico L.D. = limite de deteccin, L.C. = limite de
cuantifcacin, L.L. = limite de linealidad.
29
33
35
36
38
39
40
40
40
41
41
42
42
43
44
45
46
46
47
47
49
8
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Tabla 1.1 Cambio en la seal de un instrumento por el cambio en la concentracin
Figura 1.3 Grfca ideal de la relacin de la seal del instrumento con la concentracin
Figura 1.4 Grfcas de desviaciones
1.5.1 Calibracin de los Instrumentos
1.5.1.1 curva de calibracin
1.5.1.2 Adicin estndar
1.5.1.3 Patrn interno
1.6 Glosario de Trminos
1.7 Taller
Bibliografa
SEGUNDA UNIDAD
2. Radiaciones Electromagnticas (REM)
Figura 2.1 Campo elctrico, (Vector elctrico E) y Campo magntico (vector magntico H) de una onda
electromagntica de plano polarizado, de longitud de onda l y amplitud a
2.1 Descripcin matemtica de una onda
Figura 2.2 Vector giratorio para representacin de una onda sinusoidal
Figura 2.3 Representacin de 2 ondas sinusoidales con iguales amplitudes y
frecuencia, con un ngulo de fase entre ellas
Figura 2.4 Representacin de una radiacin electromagntica considerando solo el vector elctrico
(campo elctrico), y la identifcacin de algunas de sus propiedades
2.2 Conceptos y relaciones matemtica de las propiedades de las radiaciones electro magnticas:
2.2.1 Velocidad
Figura 2.5 efecto del cambio de medio en un haz de radiacin electromagntica monocromtica.
2.2.2 Amplitud (a)
2.2.3 Frecuencia ()
Figura 2.6 Ilustracin de la relacin de frecuencia con la longitud de onda l
2.2.4 Angulo de fase
49
50
51
51
51
52
52
53
54
56
57
59
59
60
61
61
62
62
62
63
63
63
64
64
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
9
Figura 2.7 a y b Superposicin de ondas sinusoidales (a) A
1
<A
2
,
1
-
2
= -20,
1
=
2
,(b) A
1
<A
2
,
1
-
2
=-200,
1
=
2
. En cada caso, la curva de trazo continuo resulta de la combinacin de las dos curvas
de trazo discontinuos
Figura 2.8 Otra ilustracin de interferencia. La curva B esta 70 fuera de fase con relacin a la curva A.
La curva C es la onda resultante
Figura 2.9 Superposicin de dos ondas de frecuencia diferente pero amplitud idntica. (a) la onda 1 tiene
un perodo de 1/
1
. La onda 2 tiene un perodo de 1/
2
;
2
=1,25
1
.(C)modelo ondulatorio combinado.
La superposicin de
1
y
2
produce un modelo cclico con un periodo de 1/ en el que =
1
2
.
2.2.5 Direccin de propagacin y Polarizacin
2.2.6 Energa
2.2.7 Longitud de onda
2.2.8 Nmero de onda
2.2.9 Potencia
2.2.10 Intensidad
2.3. Unidades de longitud, energa y frecuencia de uso frecuente con las radiaciones electromagnticas
2.3.1 Unidades de Longitud
Tabla 2.1 unidades de longitud de uso frecuente con las radiaciones electromagnticas
2.3.2 Unidades de energa
Tabla 2.2 Unidades de energa de uso frecuente con las radiaciones electromagnticas
2.3.3 frecuencia
2.4. Conversin de unidades
2.4.1 Ejemplo
2.4.2 Para la conversin inversa entre longitud de onda y energa se utiliza la ecuacin
2.4.2.1 Ejemplo
2.4.3 Factores de conversin para radiacin electromagntica
Cuadro 2.1 Factores de conversin para radiacin electromagntica
2.4.3.1 Ejemplo
2.5. Espectro electromagntico
Figura 2.10 descomposicin de la luz blanca mediante un prisma
64
65
65
65
65
66
66
66
66
67
67
67
68
68
68
68
68
69
69
69
70
70
71
71
10
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Cuadro 2.2. Resumen de las regiones del espectro electromagntico, considerando: las fuentes de
radiaciones de las diferentes regiones, los rangos aproximados de longitudes de onda y frecuencia
como tambin el comportamiento de la energa
Cuadro 2.3 Resumen de las regiones, subregiones y rangos de longitud de onda (l ), nmero de
onda (), frecuencia (), y energa (), de la radiaciones electromagnticas de uso frecuente en
instrumentacin qumica
2.6 Interaccin de las radiaciones electromagnticas con la materia
2.6.1 conceptualizacin de trminos
Figura 2.11 Diagrama resumen de las interacciones de las radiaciones electromagnticas con la materia
2.7 Taller
Bibliografa
TERCERA UNIDAD
Refractometra
3.1 Generalidades
Figura 3.1 Ilustraciones sobre el fenmeno de la refraccin: a una fotografa que muestra la refraccin y
la refexin en un plano aire agua, b una representacin utilizando rayos, c una observacin cotidiana
Figura 3.2 En la fgura a N (lnea a trazos) es la normal, la lnea horizontal continua representa la
interfase,
1 ngulo de incidencia,
2 ngulo de refraccin
, M
1 medio menos denso,
M
2 medio ms denso
. En la fgura b, medio menos
denso el aire, medio ms denso el agua, lnea a trazos normal
Cuadro 3.1 Ilustracin de la variacin del ndice de refraccin del agua con la longitud de onda y la
temperatura
3.2 Leyes de la refraccin: al enunciar las leyes de la refaccin se defne la normal como la
perpendicular a la superfcie en el punto de refraccin, Ver fguras3.1 b, 3.2 a y b. Todos los ngulos se
miden a partir de la normal
3.2.1 Primera ley
Figura 3.3 Ilustracin leyes de la refraccin
3.2.2 Segunda ley
3.2.3 Demostracin de la ley de Snell: Mediante las fguras 3.4 y 3.5 se explicar paso a paso la
demostracin de la citada ley
Figura 3.4
72
73
73
73
74
75
77
79
81
81
81
83
83
84
84
84
84
84
85
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
11
Figura 3.5 El rayo es perpendicular al frente de las ondas, y la normal es perpendicular a la superfcie de
separacin
3.3 Instrumentos para medir el ndice de refraccin (n)
3.3.1 Refractmetros de ngulo crtico
Figura 3.6 a ilustracin del ngulo crtico
c
, y el rayo crtico A O C; b vista del extremo mostrando lmite
preciso entre los campos oscuro e iluminado formados en el ngulo crtico
Figura 3.7 Prisma amic para compensacin de la dispersin ocasionada por la muestra. Obsrvese que
la trayectoria de la radiacin amarilla ( lnea D del sodio ) no es desviada por el prisma
Figura 3.8 Ilustracin del ngulo emergente
3.3.1.1 Refractmetro de Abb
3.3.1.2 Partes de un Refractmetro de Abb
Cuadro 3.3 Caractersticas tcnicas de algunos refractmetros
Figura 3.9 Esquema de las partes de un refractmetro de Abb
3.3.1.3 Calibracin
3.3.1.4 Refractmetro Abbe-3L Fisher Scientifc
3.3.1.4.1 Instrucciones de manejo, Calibracin y Medicin
3.3.1.4.2 Error Instrumental
Figura 3.10 Refractmetro de Abbe Referencia Abbe 3 L marca Fisher
3.4 Aplicaciones de refractometra
3.4.1 Anlisis cualitativo
Cuadro 3.3 ndice de refraccin de varios compuestos
Cuadro 3.4 Refracciones atmicas
3.4.2 Anlisis Cuantitativo
3.5 Taller
Bibliografa
86
86
86
87
88
89
90
90
91
92
93
94
94
95
96
97
97
98
98
99
101
105
12
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
CUARTA UNIDAD
Polarimetra
4.1 Generalidades
Figura 4.1 Ilustracin del giro de luz polarizada en un plano ocasionado por una sustancia pticamente
activa
4.1.1 Luz polarizada
Figura 4.2 a) Vista de un haz de radiacin no polarizado, algunos de los vectores de un haz con
trayectoria perpendicular al papel, Las vibraciones del vector elctrico se muestran sin resolver, b)
Descomposicin de un vector del plano XY en dos componentes perpendiculares entre s. C) resultante
de todos los vectores ( diagrama no escalado)
Figura 4.3 Deteccin de una radiacin de un plano de polarizacin. a) Disco polaroid (fltro polaroid)
orientado de tal manera que su plano vibratorio sea paralelo al de la radiacin. b) Disco polaroid alineado
en tal forma que su plano de vibracin sea perpendicular al de la radiacin (condicin para la extincin)
4.1.2 Obtencin de luz polarizada
Figura 4.4 obtencin de luz polarizada por refexin
4.1.2.1 Birrefringencia
Cuadro 4.1 ndices de refraccin de los rayos ordinarios y extraordinarios de cristales birrefringentes
4.2.1.2 Sustancias isotrpicas y anisotrpicas
4.2.1.3 Obtencin de luz polarizada con el prisma de Nicol
Figura 4.5 Prisma de Nicol
4.3 Sustancia pticamente activa
Figura 4.4 a) ordenaciones posibles de de los cuatro radicales de una molcula con un carbono quiral,
b) tomo de carbono con cuatro sustituyentes diferentes y su imagen especular, c)isomera ptica
del gliceraldehido y su imagen especular y su analoga con las manos, d) accin de los compuestos
ptimamente activos sobre la luz polarizada
4.4 Instrumentos para medir la rotacin de la luz polarizada
4.4.1 Medicin del ngulo de giro
Figura 4.5 Diagrama simplifcado de un polarmetro
Figura 4.6 Esquema de las partes del Polarmetro de circulo Aux Jena
4.4.2 Partes del polarmetro y su funcin (Polarmetro de circulo Aux jena)
4.4.2 Manejo del polarmetro de circulo Aux Jena
107
109
109
110
111
112
112
113
113
113
114
115
115
116
116
117
118.
118
119
120
120
121
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
13
4.4.2.1 Caractersticas tcnicas
4.4.2.2 Instalacin y limpieza
4.4.2.3 Calibracin
4.4.2.4 Instrucciones de manejo
Figura 4.7 Polarmetro de crculo Aux Jena (anlogo) confguracin externa
Figura 4.8 Posiciones de los campos
Figura 4.9 Ilustracin de la escala de lectura polarmetro Aux Jena, la medicin indica 170.5 angulares
correspondiente a la escala de unidades y decimales
4.5 Aplicaciones analticas
4.5.1 Anlisis Cualitativo
Cuadro 4.1 Rotacin especfca de algunas compuestos pticamente activos
4.5.2 Anlisis Cuantitativo
4.2.5.1 Error Instrumental Polarimtrico
Figura 4.10 Diagrama polarmetro digital Polax L
4.6 Aplicaciones Generales
4.7 Taller
Bibliografa
QUINTA UNIDAD
5. Fotometra de absorcin
5.1 Generalidades
Figura 5.1 Transiciones electrnicas que originan las series de Lyman, Balmer y paschen del espectro
del Hidrgeno
Figura 5.2 tomos 1 y 2 de diferentes elementos con estructuras electrnicas ms complejas que
originan mayor nmero de transiciones electrnicas y por consiguiente ms lneas de emisin
5.2 Absorcin de Radiaciones ultravioleta y Visible por las Molculas
Figura 5.3 a representacin de una molcula diatmica, b representacin de la molcula diatmica de
hidrgeno
121
121
122
122
122
124
124
125
125
125
126
127
128
128
129
133
135
137
137
138
139
141
141
14
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Figura 5.4 a Representacin de los orbitales moleculares de enlace y anti-enlace utilizando un diagrama
de nube de cargas y b diagramas
Figura 5.5 Representacin de un orbital molecular sin enlace, orbital n
Figura 5.6 a representacin de la transicin, b transicin en la molcula del Hidrgeno
Figura 5.7 espectros en la regin UV y VIS de diferentes compuestos
Figura 5.8 (a) espectro de absorcin del permanganato de potasio y (b ) del cloruro de cobalto) en la
regin visible
5.2.1 Terminologa
Cuadro 5.1 rangos aproximados de longitud de onda donde se ubican los colores
5.3 Leyes de la absorcin
Figura 5.9 Ilustracin de un haz de radiacin que incide y emerge de una solucin
Figura 5.10 absorcin de radiacin por una solucin de concentracin unidad dispuesta en dos celdas
5.3.1 Ley de Lambert
5.3.2 Ley de Beer
Figura 5.11 disposicin ptica ilustrativa de la ley de Beer
Figura 5.12 Relacin entre transmitancia y concentracin
Figura 5.13 Ilustracin de la relacin entre transmitancia y concentracin
5.3.3 Ley de Beer Lambert
Figura 5.14 Grfca de calibracin A Vs C
Figura 5.15 Conjunto de patrones externos para Cu
2
+
con la respectiva grfca de
calibracin
5.3.4 Obtencin de la ley de Beer mediante integracin
Figura 5.16 Atenuacin de una radiacin con una potencia inicial
0
P por una disolucin que contiene C
moles por litro de soluto absorbente y con un camino ptico de b cm.
0
P P <
5.3.5 Aditividad de absorbancia
5.3.6 Desviaciones de la ley de Beer
Figura 5.17 Ilustracin de las desviaciones de la Ley de Beer
142
143
143
145
147
147
149
150
151
151
152
152
152
153
153
154
156
157
158
159
161
161
162
1
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
15
5.3.6.1 Error fotomtrico
5.3.6.2 Desviaciones instrumentales
Figura 5.18 Ilustracin ancho de bandas y mximos de absorcin relacionados con
las desviaciones instrumentales de la ley Beer
5.3.6.3 desviaciones qumicas
5.3.6.3.1 Efecto de la temperatura
5.3.6.3.2 Efecto del solvente
5.3.6.3.3 Efecto del tiempo
Figura 5.19 Ilustracin de la variacin de la absorbancia de una especie absorbente con el tiempo
5.3.6.3.4 Efectos de los equilibrios asimtricos
5.4 Instrumentacin para fotometra de absorcin
5.4.1 Consideraciones generales
Figura 5.20 Diagrama de bloques que ilustra las partes que conforman un espectrofotmetro sencillo
5.4.2 Descripcin de las caractersticas de los elementos constitutivos de un fotmetro
y algunos detalles de su diseo con relacin a la regin del espectro en que se han de
emplear
5.4.2.1 Fuentes de radiacin
Figura 5.21 espectro de emisin de lneas
Figura 5.22 Ilustracin del espectro de emisin continuo de dos fuentes de radiaciones:
a la izquierda el espectro de una lmpara de arco de deuterio. A la derecha el espectro
de una lmpara con flamento de tungsteno
5.4.2.2 Filtros y monocromadores
Figura 5.23a Ilustracin del ancho de banda
Figura 5.23b Ilustracin del ancho de banda
5.4.2.2.1 Monocromadores de prismas
Figura 5.24 Ilustracin de la dispersin de radiaciones por un prisma
Figura 5.25 Ilustracin del fenmeno de la dispersin mediante un prisma de cornu
Figura 5.26 Ilustracin del fenmeno de la dispersin mediante un prisma de Littrow
Figura 5.27 Ilustracin del poder de resolucin de un monocromador
162
164
164
165
165
165
165
166
166
168
168
170
170
170
171
172
173
173
174
175
175
176
176
177
16
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
5.4.2.2.2 Monocromadores de rejilla o red de difraccin
Figura 5.28 Ilustracin del corte de una red tipo escalerilla
Figura 5.29 Ilustracin de la sobre posicin de rdenes de espectros en una rejilla de refexin
5.4.2.3 Sistemas monocromadores
Figura 5.30 Partes que integran un monocromador utilizando un prisma como elemento dispersante
Figura 5.31 Disposicin de los componentes en dos sistemas monocromadores diferentes: a Tipo Ebert,
b tipo Zcerney Turner
5.4.2.3 Cubetas o celdas
Figura 5.32 Celdas: a de paredes planas, b cilndricas
5.4.2.4 Sistema de medicin
Figura 5.33 Ilustracin grfca de la repuesta de una fotocelda comparada con la respuesta del ojo normal
5.4.2.4.1.1 Celdas fotovoltaicas
Figura 5.34 Esquema de una celda fotovoltaica
5.4.2.4.1.2 Fototubos
Figura 5.35 Fototubo y circuito elctrico auxiliar
5.4.2.1Fototubo multiplicador
Figura 5.36 a Esquema de un fototubo multiplicador, b esquema de un circuito de amplifcacin
5.4.2.4.1.4 Detectores de diodo de silicio
Figura 5.37 a Ilustracin de un diodo de silicio, b Polarizacin inversa
5.4.2.4.1.5 Detectores para la regin infrarroja
Figura 5.38 Detectores Infrarrojos: a Termopar o termocupla, b bolmetro, c clula neumtica de Golay
5.4.2.4.2 Amplifcadores y sistemas de lectura
Figura 5.39 escalas de %T y A graduadas en un galvanmetro
5.4.3 Equipos de un solo haz, de doble haz y haz dividido
Figura 5.40 diagrama de un espectrofotmetro de un solo haz
Figura 5.41 Diagrama de un espectrofotmetro de doble haz con haces divididos o separados en el
espacio
Figura 5.42 Espectrofotmetro de doble haz, con haces separados en el tiempo espectrofotmetro
178
178
179
181
181
183
183
184
185
185
186
186
187
187
188
189
189
190
190
191
192
193
194
194
195
196
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
17
5.4.2 Instrucciones genricas de manejo y calibracin de un espectrofotmetro
5.4.3.1 Ajustes generales
Figura 5.43 Curva espectral de una solucin acuosa de cloruro de cobalto 0.25 M comparada con un
blanco fotomtrico de agua destilada
Figura 5.44 Curva espectral de absorcin de una solucin de dicromato de potasio preparada disolviendo
120 mg de K
2
Cr
2
O
7
en 1 L de H
2
SO
4
0.01 N, comparada con un blanco fotomtrico de una solucin de
H
2
SO
4
0.01 N en cubetas de 1 cm de espesor
Cuadro 5.2 Coefcientes molares de absorcin del cromato de potasio en KOH 0.05M
Figura 5.45 Curva espectral de absorcin del cristal de didimio
5.4.4. Equipos comerciales
5.4.4.1 Diagramas e instrucciones de manejo de los espectrofotmetros Spectronic 20D
Figura 5.46 Espectrofotmetro Espectronic: a 20 D y b diagrama ptico
5.4.4.2 Generalidades de los Spectronic
5.4.4.3 Diagramas e instrucciones de manejo del espectrofotmetro Genesys 5
Figura 5.47 Espectrofotmetro Genesys 5: a vista frontal,b vista posterior,c diagrama ptico
5.5.1 Lecturas: Motivacin al Anlisis Espectroscpico (fotomtrico)
Lectura 5.5.1.1
5.5.1.2 Balanzas? No Algo Mejor
5.6 Taller
Bibliografa
SEXTA UNIDAD
6. Introduccin a la espectroscopia Infrarroja
6.1 Breve resea histrica y consideraciones generales
6.1.1 Grupos funcionales orgnicos
Cuadro 6.1 Principales grupos de compuestos
6.2 Regin infrarroja del espectro electromagntico
6.2.1 Subregiones
Cuadro 6.2 Regiones sistemticas del espectro IR
196
197
198
198
198
199
199
200
200
200
203
203
208
208
213
217
225
227
229
229
232
233
235
235
237
18
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
6.3 cuadro resumen de las zonas espectrales
6.3 Absorcin de radiaciones de la regin IR del espectro electromagntico por las molculas
6.3.1 La frecuencia natural de vibracin de la molcula ha de coincidir con la de la
radiacin incidente (longitud de onda correcta)
6.3.1.1 movimientos de vibracin de las molculas
Figura 6.1 Movimientos de estiramiento
Figura 6.2 movimientos de fexin o deformacin dentro del plano
Figura 6.3 movimientos de fexin fuera del plano, la lnea discontinua denota el plano
Figura 6.4 Ilustracin de los modos normales de vibracin de una molcula triatmica lineal, como la de
dixido de carbono CO
2
Figura 6.5 Ilustracin modos normales de vibracin de la molcula de H
2
O
Figura 6.6 ilustracin modos normales de vibracin del grupo metilo en el metanol, los movimientos de
tensin del CH
3
originan en el espectro las bandas a 2840 cm
-1
y 2940 cm
-1
, uno de estos movimientos
es de modo simtrico y el otro asimtrico. La vibracin por fexin se encuentra alrededor de 1400cm
-1
Figura 6.7 Ilustracin de los modos vibracionales del grupo CH
2
(+ y - indican el movimiento
perpendicular con respecto al plano de la pgina)
Cuadro 6.4 Resumen de los movimientos de vibracin de las molculas
6.3.2 La frecuencia de la vibracin debe satisfacer la ecuacin E = h
6.3.2.1 Analoga de los movimientos vibracionales de las molculas con el movimiento mecnico del
oscilador armnico simple
Figura 6.8 Ilustracin oscilador armnico simple y diagrama de energa potencial
Figura 6.9 Modelo mecnico del oscilador con dos masas
Figura 6.10 desplazamiento de las masas con relacin a la posicin de equilibrio
Figura 6.11 Diagrama de energa potencial
Figura 6.12 Vibraciones y frecuencias caractersticas del acetaldehdo
6.3.3 Los cambios de vibracin deben estimular variaciones del momento dipolar de la molcula
Figura 6.13 Cargas fraccionarias sobre los tomos de carbono e hidrgeno del formaldehdo
238
239
239
242
242
243
243
244
244
245
246
247
247
247
248
250
250
251
252
253
253
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
19
6.3.4 La intensidad de la absorcin ha de ser proporcional al cuadrado de la velocidad de cambio del
dipolo
6.4 Aplicaciones analticas de la espectroscopia infrarroja (IR)
6.4.1 Anlisis Cualitativo
6.4.1.1 Frecuencias de Absorcin Caractersticas de algunos Compuestos orgnicos
Cuadro 6.5 divisin sistemtica de la regin espectral del infrarrojo fundamental
Cuadro 6.6 Frecuencias de diferentes grupos atmicos en orden descendente del nmero de onda
Cuadro 6.7 tabla de correlacin simplifcada de vibraciones moleculares por tipo
Cuadro 6.8 Frecuencias caractersticas de grupos inorgnicos poliatmicos
6.9 Coleccin de espectros analizados
6.10 Espectros de referencia
Cuadro 6.9 Lista de los Espectros de referencia
6.4.2 Anlisis Cuantitativo
Figura 6.14 ilustracin de La lnea base
6.4.3 Limitaciones Analticas
6.4.4 Manipulacin y tratamiento de las muestras
6.4.4.1 Gases
6.4.4.2 Lquidos y soluciones
6.4.4.3 Pelculas
6.4.4.4 Emulsiones
6.4.4.5 Tcnica de la Pastilla
6.4.4.6 Espesor de la Celda
6.4.4.7 Refectancia Interna
Taller 6.5
Bibliografa
254
254
254
256
262
263
264
265
266
277
287
287
289
290
292
292
292
295
295
295
296
297
300
332
20
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
SEPTIMA UNIDAD
Potenciometria
Introduccin a la electro-analtica
7. Generalidades:
7.1 La celda electroqumica
Figura 7. 1 Semicelda
7.1.1 El Puente salino
Figura 7. 2 Celda completa: El puente salino (un tubo en U invertido) contiene una disolucin de KCl
(o un Gel con el electrolito) que proporciona un medio conductor elctrico entre las dos disoluciones.
Los orifcios del tubo en U se taponan con algodn para evitar que la solucin de KCl fuya hacia los
recipientes, al tiempo que se permite el paso de aniones y cationes. Los electrones fuyen al exterior
desde el electrodo de Zn (nodo) hacia el electrodo de Cu (ctodo), de tal manera que se transmite la
corriente elctrica
7.1.2 Medida de potenciales de semiceldas
Figura 7.3 diagrama de un electrodo estndar de hidrgeno cuya representacin es
PtH
2
(P=1 Atm)H
+
( 1.00 M)
Figura 7.4 Diagrama de acoplamiento de una semicelda, con el electrodo estndar de hidrgeno para
medir su potencial representada por el diagrama
M (s) M
n+
(xM) H
+
(1 M)H
2
(P=1atm)Pt
Tabla 7.1 Potenciales estndar de electrodo a 25C
7.2 Tipos de semiceldas
7.2.1 Metal-in metlico
7.2.2 Electrodo inerte en contacto con iones de otros elementos en diferentes estados de Oxidacin.
7.2.3 Electrodo gaseoso
7.2.4 Celdas de Concentracin
7.3 Convenio de Signos
7.4 Escala de Actividad
Cuadro 7. 1 Escala de actividad de algunos metales
7.5 La ecuacin de Nernst
Figura 7.5 Relaciones entre
0
G , K y
0
E
7.5.1 Actividad y Coefcientes de Actividad
335
337
337
337
338
338
341
341
341
342
343
344
345
345
345
346
346
347
347
348
349
349
351
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
21
7.6 Potenciales Estndar
7.7 Semiceldas de referencia
7.7.1 Electrodo de Calomelanos
Figura 7.6 Electrodo de referencia de calomel (comercial tpico)
Cuadro 7.2 especifcaciones de los potenciales de los electrodos de calomel de referencia.
7.7.2 Semicelda de plata Cloruro de Plata
7.8 Potenciometria
7.8.1 Instrumentos para la medida de potencial
Figura 7.7 Esquema de un potencimetro: C, hilo metlico uniforme; D, batera para suministrar un
voltaje constante; G, galvanmetro; S, semicelda y V voltmetro
Figura 7. 8 Circuito elctrico que ilustra la relacin entre resistencia y cada de potencial
7.9 Aplicaciones
7.9.1 Medida directa de la concentracin de un metal
7.9.2 Medicin del pH
7.9.2.1 Instrumentos para la medicin del pH
7.9.2.1.1 Principio de funcionamiento del pH-metro analgico
Figura 7.9 Diagrama del principio de funcionamiento del pH-metro analgico
7.9.2.1.2 Principio de funcionamiento del pH-metro con Microprocesador
Figura 7.10 Diagrama del principio de funcionamiento del pH-metro con microprocesador
Figura 7.11 Relaciones de resistencia en un circuito de medicin
7.9.2.1.3 Resistencia de la membrana en dependencia de la temperatura
Figura 7.12 Resistencia de la membrana y su dependencia de la temperatura
7.9.2.1.4 Conexin a tierra
7.9.2.1.5 Blindaje
7.9.2.1.6 Cable y conectores
7.9.2.1.7 Sensores para medicin de pH
7.9.2.1.7.1 Electrodo de vidrio para pH
353
354
354
355
356
356
357
358
359
359
361
361
363
363
363
363
364
365
366
366
366
367
367
367
368
368
22
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Figura 7.13 Electrodo de membrana de vidrio indicador de H
+
para la medicin del pH
Figura 7.14 estructura bsica de un electrodo de vidrio
7.9.2.1.7.2 Electrodo de referencia
7.9.2.1.7.3 Electrodos combinados
Figura 7.15 Esquema de un electrodo combinado para la medicin del pH
7.9.2.1.7.4 Potencial del electrodo combinado (E)
Figura 7.16 Curva caracterstica ideal del sistema de electrodos, que muestra la ecuacin ideal del
electrodo de medicin a 25C
7.9.2.1.7.5 Necesidad de la calibracin
Tabla 7.2 Correcin del pH de las soluciones tampon por efecto de la temperatura
7.9.2.2 Medicin del pH
7.9.3 Partes del potencimetro medidor de pH anlogo o digital
7.9.3.1 Manejo del pH-metro
7.9.3.1.1 Instalacin y limpieza
7.9.3.1.2 Puesta en funcionamiento y calibracin
7.9.3.1.3 Medicin de pH
Figura 7.17 instrucciones de manejo pH-metro Fisher AB15
Figura 7.18 Medidor de pH SCHOTT CG 824
7.9.3.1.4 Manejo y cuidado de los electrodos
7.9.3.1.4.1 Almacenaje
7.9.3.1.4.2 Envejecimiento y duracin
7.9.3.1.4.3 Regeneracin
7.9.3.1.4.4 Limpieza
7.9.3.1.5 Medicin del pH bajo condiciones especiales
7.9.3.1.5.1 Soluciones muy cidas
7.9.3.1.5.2 Soluciones muy bsicas
7.9.3.1.5.3 Altas temperaturas
369
370
370
371
371
372
374
375
377
377
380
382
382
383
383
384
385
385
385
386
386
386
386
386
387
387
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
23
7.9.3.1.5.4 Bajas temperaturas
7.9.3.1.5.5 Concentraciones extremas de iones
7.9.3.1.5.6 Soluciones qumicamente reactivas
7.9.3.1.5.7 Suspensiones y emulsiones
7.9.3.1.5.8 Sustancias abrasivas
7.9.3.1.5.9 Sustancias slidas
7.9.3.1.5.10 Medidas en medios no acuosos
7.9.3.1.5.11 Medidas en muestras de agua
7.9.3.1.5.12 Medidas en carne, queso, frutas, etc
7.9.3.1.5.13 Medidas de Superfcie
7.9.3.1.5.14 Medidas de muestras de volumen muy pequeo
7.9.3.1.5.15 Medidas en ungentos, cremas y pastas. (productos cosmticos, farmacuticos y artculos
alimenticios)
7.9.3.1.5.16 Medidas en melazas, conftura, miel, etc
7.9.3.1.5.17 Medidas en suero sanguneo, leche, yogur, comidas preparadas, etc
7.9.3.1.5.18 Medidas en lacas, pinturas, suspensiones
7.9.3.1.5.19 Medidas generales
7.9.3.1.6 Tratamiento de los electrodos despus de la medida
7.9.3.1.4 Medicin de potenciales redox (mV)
7.9.3.1.4.1 Electrodo combinado Para la medicin de potenciales redox
Figura 7.19 Electro combinado de platino para medicin de potenciales redox. A electrodo de alambre
de platino, B electrodo de referencia
7.9.3.1.4.2 Medicin de mV
7.9.3.1.4.2 Electrodo de membrana
7.9.3.1.4.2.1 Electrodos selectivos de iones y sus aplicaciones
Tabla 7.3 Electrodos selectivos y sus aplicaciones
7.9.3.1.4.3 Electrodos con puente salino
7.9.4 Aplicaciones analticas de la potenciometra
387
387
388
388
388
388
389
389
390
390
390
391
391
391
391
392
392
392
392
393
393
394
395
395
396
396
24
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
7.9.4.1 Determinacin del pH
7.9.4.2 Titulaciones potenciomtricas
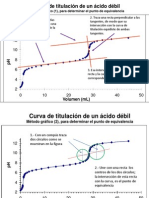
Figura 7.20 Mtodo de la semialtura para la determinacin del punto fnal en una valoracin potenciomtrica
Figura 7.21 Mtodo de la primera derivad para la determinacin del punto fnal en una valoracin
potenciomtrica
Figura 7.22 Mtodo de la segunda derivad para la determinacin del punto fnal en una valoracin
potenciomtrica
Figura 7.23 Mtodo de construccin geomtrica para la determinacin del punto fnal en una valoracin
potenciomtrica
7.9.4.2.1 Potenciomtricamente se puede realizar los siguientes tipos de titulaciones: cido Base, oxido-
reduccin, precipitacin y complexomtricas
7.9.4.3 Determinaciones con electrodos selectivos
7.9.4.3.1 Curvas de calibracin mV vs C con electrodos para iones selectivos
Figura 7.24 Grfca tpica de calibracin para la determinacin de aniones o cationes con electrodos
selectivos
7.9.5 Equipos para medicin del pH y titulaciones potenciomtricas
Figura 7.25 a diferente modelos de medidores de pH existentes en los laboratorios de qumica, b equipo
para titulaciones potenciomtricas integrado por un potencimetro medidor de pH y mV al cual se
puede acoplar un electrodo combinado para medidas de pH con su respectivo sensor de temperatura
o un electrodo combinado de platino para medir mV en valoraciones de oxido reduccin, una placa con
agitacin magntica, una barra de agitacin magntica, una bureta, un soporte para la bureta
7.10 Taller
Bibliografa
OCTAVA UNIDAD
Electrogravimetra y Culombimetra
8 Generalidades
8.1 Electrolisis y depsito electroltico
8.1.1 Potencial de descomposicin
Figura 8.1 Electrodeposicin de Cu de una solucin 0.001 molar en Ion Cu
2+
preparada a partir de
CuSO
4
en cido sulfrico 1.0x 10
-4
M utilizando Electrodos de platino, aplicando con una fuente de
corriente continua el potencial necesario. En el ctodo se deposita Cu
y en el nodo se desprende O
2
Cuadro 8.1 Supervoltaje para formacin de hidrgeno en varios electrodos a 25 C
396
396
397
397
398
399
400
.
400
401
401
402
402
403
405
407
409
409
409
410
412
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
25
Grafca 8.1, Ilustra la diferencia entre el voltaje calculado tericamente y el valor experimental
8.1.2 Electrlisis con corriente constante
8.1.3 Electrolisis con potencial de ctodo constante
8.2 Efectos de variables experimentales
8.2.1 Desprendimiento de gas
8.2.2 Densidad de corriente
8.2.3. Agitacin
8.2.4 Temperatura
8.2.5 Variables qumicas
8.2.5.1 Efecto de pH
8.2.5.2 Efecto de agentes formadores de complejos
8.3 Reacciones electrdicas
8.3.1 Reacciones andicas
8.3.2 Reacciones catdicas
8.3.3 Efectos del pH en las reacciones andicas y catdicas
8.4 Instrumentacin para realizar electrodepsitos con fnes analticos
Figura 8.2 diagrama de un equipo simplifcado para electrodepsitos con fnes analticos
8.4.1 Electrodos
Figura 8.3 Ilustracin del montaje de un equipo para anlisis electroqumico
8.4.2 Manejo del equipo electrolizador
8.4.2.1 Instalacin y limpieza
8.5 Aplicaciones analticas
Figura 8.4 Ilustracin de la electrodeposicin a potencial controlado
8.6 Culombimetra
8.6.1 Aplicaciones analticas de la Culombimetra
8.7 Aplicaciones de los electrodepsitos y la columbimetra en el anlisis qumico
8.7.1 Para la determinacin del contenido de cobre en un mineral, despus de triturar y tamizar la
414
415
416
417
417
418
418
418
418
418
419
419
420
420
420
421
421
421
422
423
423
424
425
426
428
428
428
26
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
muestra, se tomaron 25 g y se le realiz el tratamiento requerido
Taller 8.1
Bibliografa
NOVENA UNIDAD
Conductimetra
9. Generalidades
9.1 Conductividad
9.1.1 Conductancia equivalente en dilucin infnita
Cuadro 9.1 Conductancias inicas equivalentes a 25C
9.2 Medicin de la conductividad
Cuadro 9.2 Unidades utilizadas en conductimetra
9.2.1 La conductividad y su medicin depende de los siguientes Factores
9.2.2 Conceptos y relaciones matemticas conductimtricas
9.2.2.1 Conductancia L
9.2.2.3 Conductancia especifca k
Tabla 9.1 Valores de conductividad a diferentes temperaturas y concentraciones de KCl
9.2.2.4 Conductancia equivalente,
Tabla 9.3 Conductividades equivalentes de diferentes sales en solucin acuosa a 25C (unidades S cm
2
equiv
-1
)*
9.2.2.5 Conductividad y concentracin inica
9.3 Instrumentos para medir la conductividad
9.3.1 Una fuente de energa
9.3.2 Un recipiente
9.3.2.1 Electrodos
Figura 9.1. Diferentes modelos de celdas para medir la conductividad: a, c, e diseos tpicos para
determinacin de conductividades, b, f, h diseos para inmersin en la solucin; c, g diseos para
titulaciones., d diseo para detector conductimtrico en cromatografa de intercambio inico y medicin
de la conductividad en fuidos lquidos para el control de procesos
428
430
431
433
435
435
435
435
437
437
438
438
439
439
439
440
440
441
441
442
443
443
443
444
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
27
9.3.3 Control de temperatura
9.3.4 Sistema para titulaciones
9.3.5 Un dispositivo electrnico para medir la resistencia
9.3.5.1 Puente de Wheatstone
Figura 9.2 Circuito de un puente de Wheatstone
9.3.5.2 Amplifcador operacional
Figura 9.3 Amplifcador operacional utilizado para mediciones de resistencia y conductancia
9.4 Aplicaciones analticas de las mediciones conductimtricas
9.4.1 Las tcnicas conductimetricas son usadas en procesos para controlar
9.4.2 Titulaciones conductimtricas
9.4.2.1 Titulaciones de neutralizacin cido- base
9.4.2.1.1 Titulacin de cidos o bases fuertes
Figura 9.4 Titulacin conductimtrica de un cido fuerte HCl Con una base fuerte NaOH. La lnea continua
representa la curva de titulacin, corregida por un cambio de volumen. Las lneas discontinuas indican la
contribucin de las especies individuales, corregidas tambin por cambio de volumen, a la conductancia de la
solucin
9.4.2.1.1.2 Titulacin de cidos o bases dbiles
Figura 9.5 Curvas tpicas de titulaciones conductimtricas: a titulacin de un cido muy dbil con
hidrxido de sodio, b un cido dbil con hidrxido de sodio
Figura 9.6 Curvas tpicas de titulaciones conductimtricas: c un cido dbil (K
a
10
-5
) con hidrxido de
amonio, d la sal de un cido dbil
9.4.2.1.1.3 Titulacin de sales de cidos o bases dbiles
Figura 9.7 e, grfca de una titulacin de una mezcla HCl y CH
3
COOH Con NaOH. f ion cloruro con
nitrato de plata
9.4.2.1.1.4 Precipitacin y titulaciones de formacin de complejos
9.4.3 Curvas de calibracin
9.5 Instrumentos comerciales para medir la conductividad
Figura 9.8 Conductmetro digital CG 857 y CG 858
9.5.1 Caractersticas Tcnicas
9.5.2 Medicin de resistencias hmicas
445
445
445
446
446
447
447
447
449
449
451
451
452
452
453
454
454
455
455
456
456
456
456
457
28
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
9.5.3 Indicaciones y aclaraciones importantes respecto a la medicin de la conductividad elctrica
9.5.3 Instrucciones de manejo
Figura 9.9 Conductmetro Fisher Scientifc accumet AB 30
9.6 Taller
Bibliografa
Anexos
457
458
459
460
463
464
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
29
El presente material docente sobre Anlisis Instrumental denominado Algunos
Mtodos Fotomtricos y Electromtricos Apuntes de clase, no pretende
ser una obra original del profesor con relacin a sus contenidos. Es sencillamente un resumen
y ordenamiento didctico del Curso de Anlisis Instrumental I de los Programas en
Tecnologa Qumica y Qumica Industrial de la Escuela de Tecnologa Qumica de la Facultad
de Tecnologa de la Universidad Tecnolgica de Pereira, sobre mtodos fotomtricos y
electromtricos.
En los temas tratados se encuentra una adaptacin personal por parte del profesor para su
desarrollo, llevando una secuencia que le permita al estudiante ver objetivamente la relacin
de los mismos para su estudio y aprendizaje. Algunos son transcripciones mientras que otras
son adaptaciones de muchos textos, catlogos y artculos, de diferentes autores y casas
productoras de equipos sobre la materia.
El profesor espera con la preparacin de este material facilitar al estudiante y a otras
personas que les pueda ser de utilidad, una informacin y metodologa que fundamente
los conceptos, principios, leyes, instrumentacin y aplicaciones de las tcnicas analticas
tratadas.
La complejidad de la gran cantidad de informacin existente sobre los temas tratados en
diferentes publicaciones y textos con distintos enfoques, hace que el estudiante no tenga
acceso a unos contenidos bsicos de las tcnicas analticas del programa de la asignatura;
se estima que con base en estos fundamentos pueda posteriormente analizar los temas
con mayor profundidad en los diferentes documentos de estudio.
Tambin pretende el profesor que con el desarrollo de estos contenidos temticos, el
estudiante pueda dedicar mayor tiempo de su atencin en la clase a las explicaciones que a
la toma de apuntes y a la elaboracin de esquemas y grfcas.
Introduccin
30
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Los Temas tratados estn ordenados en Unidades siguiendo la misma secuencia del programa
y la extensin y profundidad de los contenidos adaptados a los objetivos, metodologa,
intensidad horaria de la asignatura y a la valoracin acadmica en horas crdito. Los talleres
incluidos en cada unidad facilitan la revisin y el estudio extraclase.
Adems, si se presentaran imprevistos en el desarrollo normal del curso por situaciones de
anormalidad acadmica durante el semestre, no pudindose cumplir con el programa en el
cien por ciento, el estudiante tiene disponibilidad de los materiales que le permiten apropiarse
de estos conocimientos.
Las unidades tratadas son las siguientes: Unidad uno Contextualizacin de la
asignatura en el campo de la qumica analtica y los programas
acadmicos de Tecnologa en Qumica y Qumica Industrial, Los
Mtodos Fotomtrico son tratados en las unidades: unidad dos Radiaciones
Electromagnticas, unidad tres Refractometra, unidad cuatro Polarimetra,
unidad cinco Fotometra Visible, unidad Seis Fotometra Infrarroja.
Los Mtodos Electromtricos se tratan en las unidades: unidad siete
Potenciomtria, unidad ocho Electrogravimtria y Culombimtria, unidad
nueve Conductimetria. Los diagramas de los equipos y sus instrucciones de manejo
corresponden a algunos de los equipos existentes en los laboratorios de la escuela de
tecnologa qumica de la UTP.
Al fnal de cada unidad se informa la bibliografa consultada. Dado que todos los temas son
tratados en la mayora de los libros de Qumica Analtica y anlisis Instrumental, no se hace
uso de bibliografa indexada.
El profesor agradece a sus compaeros profesores y alumnos sus comentarios y aportes
para el mejoramiento del material.
Cordialmente
Federmn Castro Eusse
Profesor
Agosto 8 de 2011
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
31
32
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
33
PRIMERA
UNIDAD
34
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
35
PRIMERA UNIDAD
1
1. Contextualizacin de la asignatura en el campo de la qumica analtica
y los programas acadmicos de Tecnologa en Qumica y Qumica
Industrial.
Cuando se opta por ser un profesional en la qumica, se espera que el estudiante para
tomar dicha decisin haya realizado un anlisis de los programas, contenidos, perfles
profesionales y ocupacionales de las diferentes profesiones afnes a la qumica y haya
tomado una determinacin consciente del programa que desea cursar.
Las profesiones afnes a la qumica como lo son la qumica pura, la ingeniera qumica,
la qumica industrial, la qumica farmacutica, la licenciatura en qumica, la tecnologa en
qumica, la tcnica qumica, la qumica emprica; ofrecidas por universidades, instituciones
tecnolgicas y tcnicas como tambin el fruto de la experiencia (universidad de la vida), cada
una de ellas ubican al profesional en un campo que muchas veces pasa desapercibido por
el empleador colocando al profesional en una actividad laboral a la cual no corresponde su
formacin en la qumica.
La formacin del qumico esta enfocada hacia la investigacin, el ingeniero qumico hacia
el diseo y procesos, el qumico industrial hacia la administracin y procesos en la industria
qumica, el tecnlogo qumico al control de calidad y control de procesos, el licenciado en
qumica a la docencia etc. Cada uno debe laborar en el campo para el cual ha sido formado,
pero desafortunadamente en la mayora de los casos esto no se cumple y un profesional es
contratado para desarrollar las actividades de otro invadiendo su campo lo cual acepta por la
necesidad del empleo.
1 Materiales recopilados y organizados por el profesor Federmn Castro Eusse Para la Asignatura Anlisis Instrumental I.
36
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Con el siguiente anlisis me permito aclarar un poco las opiniones anteriores: S se requiere
investigar sobre una planta que por tradicin se conoce que tiene propiedades teraputicas
medicinales, el profesional ms idneo para enfrentar el anlisis para la identifcacin de la
parte activa es el qumico, si por sus propiedades benfcas el compuesto debe ser sintetizado
es el mismo profesional quien debe abordar el trabajo. Si se requiere extraer o sintetizar
grandes cantidades de dicho compuesto debe ser el ingeniero qumico quien disee los
mtodos y controles de produccin, los tecnlogos quimicos y los quimicos farmacuticos
quienes realicen las labores del control de calidad, del proceso y direccin cientifca.
El Tecnlogo en qumica y el Qumico Industrial formados en la Escuela de
Tecnologa Qumica de La Universidad Tecnolgica de Pereira, recibe una formacin como
analista, fundamentada en la qumica analtica de la cual hacen parte las asignaturas
de instrumentacin qumica.
Los cursos de Instrumentacin Qumica le permiten al Tecnlogo Qumico y Qumico
Industrial aprender las tcnicas analticas de uso ms frecuente, hacindolo competente para
aplicarlas en el anlisis Qumico y el control de calidad en materias primas, productos en
proceso y productos terminados que las normas exijan, como tambin en el campo de la
investigacin.
1.1 Qu es la Qumica Analtica?
Existen muchas defniciones de qumica analtica pero, quiz, la ms representativa es aquella
que considera como objeto de la qumica analtica la caracterizacin cualitativa y
cuantitativa de la materia. Esta amplia defnicin contiene muchas de las funciones
llevadas a cabo por los qumicos analistas, pero tambin incluye otras, propias de
muchos cientfcos. Algunas ilustraciones de estas funciones pueden ayudar a defnir este
campo de la qumica.
Una de las tareas fundamentales del qumico analista es la determinacin cualitativa
y cuantitativa de los elementos que integran un compuesto qumico. Con este tipo de
determinaciones se pueden asignar formulas empricas a nuevos tipos de sntesis, productos
naturales, derivados de tejidos vivos y nuevas drogas o plsticos.
El paso siguiente es la elucidacin de la estructura molecular de compuestos como los
indicados anteriormente, o la determinacin de contaminantes o impurezas existentes en
productos tan variados como aguas potables, agua de lagos, arroyos o del mar, alimentos,
medicinas, aceites de motores y humo de cigarrillos. Estas impurezas afectan el medio
ambiente y, actualmente, se contina estudiando sus efectos. La qumica analtica
juega un papel importante en la determinacin de los mismos.
A veces es importante determinar algunas propiedades fsicas. As, por ejemplo, la cristalinidad
tiene una gran infuencia sobre la resistencia mecnica de los polmeros. El fabricante que
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
37
utiliza polmeros debe conocer su resistencia a la rotura; se romper fcilmente si se trata de
la envoltura de un paquete de cigarrillos pero no debe hacerlo si constituye el embalaje de un
instrumento cientfco. En qu direccin se romper? Cunto tiempo expuesto a la lluvia y al
sol?. Si se utiliza en la decoracin de viviendas, tanto en interiores como exteriores, es desear
que su vida sea lo mas larga posible y que cuando, al fn, se retire pueda descomponerse
fcilmente para evitar problemas de desperdicios slidos. Las mismas cuestiones pueden
plantearse con barnices o pinturas y, lgicamente, es el qumico analista quien debe
responderlas.
Otro problema que debe resolver el qumico analista es la determinacin de pesos
moleculares. Cuando la muestra es un compuesto puro y por tanto, solo hay que determinar
un peso molecular, no se plantea difcultades. Sin embargo, si se trata de una mezcla de
molculas distintas, el problema se complica ya que, en este caso, es necesario obtener toda
una gama de pesos moleculares. Esto es particularmente importante en el caso de polmeros
y productos naturales relacionados con la vida vegetal y animal.
Es tambin labor del qumico analista la determinacin cualitativa de mezclas as como
la cantidad de cada uno de sus componentes. Esta informacin es valiosa para ingenieros y
metalrgicos que han de conocer la composicin de las aleaciones.
Las compaas fabricantes de jabones y detergentes necesitan conocer la proporcin de
productos biodegradables, en la legislacin existente se exige que todos los jabones y
detergentes sean biodegradables. Es decir, cuando los jabones utilizados en las casas y
lavanderas se eliminan por los desages y llegan a los ros, es preciso que no persistan por
mucho tiempo, sino que sean atacados por bacterias y degradados a otras sustancias.
Si el jabn no fuera degradado, se ocasionaran en nuestros ros problemas de espumas
y contaminacin del agua potable que, en casos extremos, exterminaran la vida vegetal y
animal. El analista puede determinar la velocidad con que se degrada un detergente en ros
o aguas residuales.
En Medicina, se estudia el efecto de la presencia de trazas metlicas en el cuerpo humano y
se trata de establecer una relacin con ciertas enfermedades. El qumico analista que
trabaja en investigacin mdica es el encargado de proporcionar tcnicas para identifcar y
determinar esas trazas metlicas.
Durante muchos aos, la qumica analtica estuvo ntimamente relacionada con
las propiedades qumicas de las sustancias analizadas. Se disolva la muestra, se hacia
reaccionar el compuesto problema y se media la extensin de la reaccin. De esta medida
se calculaba la cantidad de componente presente en la muestra. Este mtodo, basado en
reacciones qumicas, ha sido durante muchos aos una herramienta muy importante para
el qumico analista y sobre el se han construido esquemas de anlisis cualitativo y
cuantitativo. Entre los campos analticos ms importante pueden citarse las volumetrias
y gravimetras. Sin embargo, estos mtodos requieren una gran destreza y mucho
38
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
cuidado por parte del operador, si se quieren obtener resultados correctos. Puede decirse
que el qumico analista que trabajaba con xito en estos campos era un artista, ya
que, cuidado y paciencia son condiciones indispensables para obtener
buenos resultados.
La industria moderna ha crecido tan rpidamente y el control de los productos manufacturados
ha llegado a ser tan importante y amplio que los especialistas en qumica analtica no pueden
proporcionar la informacin necesaria oportunamente sin la ayuda de instrumentos. Cada da
se precisan grandes cantidades de datos en distintos campos de la vida. As, por ejemplo,
en los hospitales, el diagnostico de las enfermedades depende, en gran parte, del qumico
analista. Qu persona no se ha hecho un anlisis de sangre para determinar su contenido
de glucosa o Hierro? En la industria, el control de calidad es necesario en cada etapa de la
fabricacin si se quieren obtener buenos productos.
El contratar mas personas para completar los anlisis basados en reacciones qumicas no
es una solucin del problema, ya que, probablemente, los nuevos analistas no tendrn el
inters ni la habilidad necesarios. Por otra parte, el tiempo requerido por una volumetra o una
gravimetra es muy largo.
Por ello, el qumico analista ha desarrollado nuevos mtodos de anlisis basados, en
general, en las propiedades fsicas de las sustancias. Se han realizados profundos
y extensos estudios destinados a una mejor comprensin y medida de los efectos de la
interaccin entre radiacin y materia. Estas medidas permiten conocer los componentes de
una muestra y la cantidad de cada uno de ellos. Basados en estas interacciones, se han
desarrollado equipos o instrumentos para llevar a cabo anlisis rpidos y continuos.
Para obtener las respuestas que el qumico analista necesita, ha sido necesaria la
conjugacin de importantes campos de la Fsica y la Qumica. Los procedimientos
desarrollados compiten en complejidad. Algunos mtodos son completamente automticos
y exigen muy poca atencin por parte del operador; pero hay otros que requieren una gran
habilidad. Adems, el equipo proporciona resultados que no podran ser obtenidos por otros
mtodos.
A veces, un qumico analista es reclamado para emitir un juicio sobre la autenticidad de una
obra de arte. El mtodo a seguir no ha de ser destructivo, no debe deteriorar la obra.
Por ste y otros casos, los mtodos no destructivos han adquirido una
importancia creciente en los ltimos aos.
1.1.1 Cul es la funcin del Qumico Analista?
La primera funcin del qumico Analista es suministrar datos a otros cientfcos,
qumicos, bioqumicos, bilogos, mdicos, agrnomos, metalrgicos, ingenieros, tcnicos en
sanidad y alimentacin, etc. Para ello ha de conocer las posibilidades de todos los mtodos
analticos de que dispone para, en cada caso, aplicar el ms adecuado.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
39
Cuadro 1.1 Relaciones de qumica analtica con otras ramas de la qumica y otras
ciencias.
Para que un cientfco pueda sacar el mayor partido posible de la Qumica Analtica,
debe conocer la informacin que puede conseguir a travs de ella y, lo que es casi tan
importante, la que no puede obtener. Si el cientfico conoce los fundamentos de
los distintos campos analticos, sabr si puede obtener la informacin deseada y
la mejor forma de hacerlo. De lo contrario, puede malgastar mucho tiempo tratando de obte-
ner informacin por caminos indirectos. El conocimiento de la Qumica Analtica es
importante en todos los campos de la ciencia.
Para facilitar la labor del qumico analista, el cientfco debe proporcionarle muestras para
analizar que sean de confanza y que den resultados reproducibles. Tambin es importante
que el analista disponga de toda informacin posible acerca de la muestra ya que, de esta
forma, se establece con ms rapidez el mtodo analtico ms adecuado.
Q
U
M
I
C
A
A
N
A
L
T
I
C
A
INGENIERA
MEDICINA
CIENCIA DE MATERIALES
CIENCIAS SOCIALES
AGRICULTURA
CIENCIAS AMBIENTALES
GEOLOGA
BIOLOGA
FSICA
QUMICA
BIOQUMICA
QUMICA INORGNICA
QUMICA ORGNICA
QUMICA-FSICA
ASTROFSICA
ASTRONOMA
BIOFSICA
CIVIL
QUMICA
ELCTRICA
MECNICA
QUMICA CLNICA
QUMICA MEDICA
FARMACIA
TOXICOLOGA
METALURGIA
POLMEROS
ESTADO SOLIDO
ARQUEOLOGA
ANTROPOLOGA
MEDICINA FORENSE
AGRONOMA
CIENCIA ANIMAL
CIENCIA DE LOS CULTIVOS
CIENCIA DE LOS ALIMENTOS
HORTICULTURA
EDAFOLOGA
ECOLOGA
METEOROLOGA
OCEANOGRAFA
GEOFSICA
GEOQUMICA
PALEONTOLOGA
PALEOBIOLOGA
BOTNICA
GENTICA
MICROBIOLOGA
BIOLOGA MOLECULAR
ZOOLOGA
{
{
{
{
{
{
{
{
{
{
{
40
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Cuando el qumico analista se dedica a la investigacin (programas de formacin
avanzada, maestras o doctorados), realiza una funcin en cierto modo diferente. Debe estar
preparado para contribuir a nuevos progresos en Qumica y Fsica. Su papel ms importante
es aplicar estos desarrollos cientfcos a la qumica analtica, as como proporcionar
fuentes de nueva o ms rpida informacin y mtodos ms sensibles y con mejores limites
de deteccin y cuantifcacin para obtener dicha informacin.
1.2 Generalidades sobre la Instrumentacin Qumica.
El avance de la Fsica y de la Fsico-qumica ha conducido al desarrollo de poderosos mtodos
de anlisis mediante instrumentos rpidos, sensibles, precisos, exactos, selectivos, seguros,
robustos, slidos, con menores limites de deteccin y cuantifcacin.
El proceso de separacin de los cientos de componentes de una gasolina por destilaciones
fraccionadas sucesivas que puede consumir miles de horas, es fcilmente realizado por
Cromatografa de Gas, en unas pocas horas.
La determinacin de la estructura de algunas sustancias complejas, requiri muchos aos de
esfuerzo investigativo, mientras que nuevas sustancias de estructuras aun ms complejas
se han estudiado con alta perfeccin en pocas semanas con la ayuda de los Mtodos
Espectroscpicos.
Mtodos como la Absorcin Atmica, los Electromtricos y otros facilitan las labores de
anlisis cuantitativo y logran alta sensibilidad en la determinacin de trazas del orden de
partes por billn.
No obstante, la balanza y la bureta de los mtodos de anlisis tradicionales
o clsicos siguen ocupando lugar de primordial importancia como instrumentos de
anlisis, una buena bureta digital o una buena balanza de precisin analtica puede ser tan
costosa como un equipo instrumental.
El uso de los mtodos fsicos en la identifcacin de sustancias y en la medicin de la pureza,
se ha extendido desde la simple determinacin de la densidad o del punto de fusin, hasta
los modernos mtodos instrumentales que los podramos agrupar as:
1.2.1 Clasificacin general de los mtodos instrumentales de anlisis.
1.2.1.1 Mtodos Fotomtricos y Espectrofotomtricos: Fundamentados en
la interaccin de las radiaciones electromagnticas con la materia.
Refractometra: Aplican el fenmeno de cambio de velocidad de un rayo de luz al pasar
de un medio a otro.
Polarimetra: Aplica el fenmeno de rotacin del plano de la luz polarizada que presentan
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
41
ciertas sustancias.
Fotometra de Absorcin: Aplica los fenmenos de absorcin de radiaciones
electromagnticas por las sustancias; incluye el estudio de las regiones del infrarrojo, visible,
ultravioleta y rayos X.
Fotometra de Emisin: Aplica los fenmenos de emisin de radiaciones
electromagnticas por las sustancias que han sido excitadas. Incluye la fuorescencia, la
fosforescencia, el efecto Ramn, la fotometra de llama y la espectroscopa de emisin (arco,
chispa, plasma), propiamente dicha, incluyendo los rayos X.
Turbidemetra Nefelometra: Aplican el fenmeno de dispersin de la luz al pasar por
un medio no homogneo.
1.2.1.2 Mtodos Electromtricos: Fundamentados en la electroqumica la cual se
ocupa de las interacciones entre las especies qumicas con los campos elctricos o electrones
y en el estudio de las propiedades electroqumicas de las soluciones.
Potenciometra: Aplica el fenmeno de produccin de una fuerza electromotriz como
efecto de un potencial qumico.
Electrodeposicin y Culombimetra: Aplican la diferencia de peso y las leyes de
Faraday en la electrlisis de soluciones inicas.
Conductimetra: Aplica el fenmeno de conductividad elctrica de las soluciones
inicas.
Amperometra: Aplica los fenmenos de variacin de intensidad de corriente elctrica en
procesos electrolticos.
Voltametra: Aplica los fenmenos de variacin de voltaje en los procesos electrolticos.
Polarografa: Aplica la combinacin de los dos fenmenos anteriores (Amperometra y
voltametra).
1.2.1.3 Mtodos extractivos: Basados en los fenmenos de transferencia de masa
originada por diversos mecanismos.
Cromatografa: Aplica los fenmenos de separacin selectiva de sustancias en razn de
diferencias en velocidades de migracin, por efectos del medio en que se mueven.
Electrofresis: Aplica los fenmenos de separacin selectiva de sustancias en razn de
diferencias en velocidades de migracin cuando se mueven bajo un campo elctrico.
42
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Intercambio inico: Aplica los fenmenos de separacin selectiva de sustancias por
efectos de intercambios inicos con resina especiales.
1.2.1.4 Otros mtodos: activacin y dilucin isotpicas: Basados en las propiedades
radiactivas.
Espectroscopia de Resonancia Magntica Nuclear (RMN). Fundamentada
en las propiedades magnticas de los ncleos atmicos.
Espectrometra de masa: fundamentada en la relacin masa a carga.
Mtodos Termomtricos: Fundamentados en las propiedades trmicas, estos mtodos
cobran gran importancia da a da en los laboratorios de Investigacin avanzada.
Mtodos Cinticos: Fundamentados en la velocidad de reaccin.
El estudio de los principios bsicos de funcionamiento, de la conformacin de los instrumentos y
de las aplicaciones de los mtodos de anlisis instrumental es de creciente inters en la qumica
moderna y el objetivo principal de las diferentes asignaturas de Anlisis Instrumental.
1.3 Configuracin de los instrumentos o equipos.
Un instrumento para el anlisis qumico se puede considerar como un medio de comunicacin
entre el sistema en estudio y el analista, que puede ser una interaccin en una investigacin
realizada por un cientfco o un anlisis qumico realizado por un qumico analista; el instrumento
convierte la seal analtica que no es fcil de detectar y comprender en una forma observable
y entendible por el ser Humano.
Los equipos o instrumentos para el anlisis qumico en su mayora estn constituidos por
cuatro componentes fundamentales:
1. Generador de la seal, produce una seal que denota la presencia y, con
frecuencia tambin, la concentracin del analito. En muchos casos, el generador de
seales es simplemente un compuesto o un ion generado a partir del propio analito.
Para un anlisis por emisin atmica, el generador de seales son los tomos excitados
o los iones del analito que emiten fotones de radiacin. En una determinacin de pH, la
seal es la actividad del ion hidrgeno de una disolucin de la muestra.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
43
seal Mtodos Instrumentales
Emisin de radiacin Espectroscopia de emisin (rayos X, UV, VIS, fuorescencia, fosforescencia).
Absorcin de radiacin Espectroscopia de absorcin (rayos X, UV, VIS, IR, RMN, AA).
Dispersin de radiacin Turbidimetra, nefelometria, espectroscopia Ramn.
Refraccin de radiacin Refractometra, Interferometra.
Difraccin de radiacin Mtodos de difraccin de rayos X y de electrones.
Rotacin de radiacin Polarimetra, dispersin rotatoria ptica.
Potencial elctrico Potenciometra
Carga elctrica Culombimetra
Corriente elctrica Polarografa, amperometra.
Resistencia elctrica Conductimetra
Masa Gravimetra
Volumen Volumetra
Razn masa a carga Espectrometra de masas
Velocidad de reaccin
Mtodos cinticos
Propiedades Trmicas Gravimetra y volumetra trmica
Radiactividad Mtodos de activacin y dilucin isotpica
Cuadro 1.1 seales utilizadas en los mtodos Instrumentales y clsicos
Sin embargo, en muchos otros instrumentos el generador de la seal est considerablemente
ms elaborado. As, el generador de seales de un instrumento de anlisis por absorcin
infrarroja incluye, adems de la muestra, una fuente de radiacin infrarroja, un Monocromador,
un divisor y un cortador (chopper) del haz, un atenuador de la radiacin y un recipiente de
muestra.
2. Transductor de entrada o detector, es un dispositivo que convierte un tipo de
energa (o seal) en otro. Como ejemplos, pueden mencionarse el termopar, que convierte
una seal de calor radiante en un voltaje elctrico; la fotoclula o fotocelda, que convierte la
luz en una corriente elctrica; o el brazo de una balanza, que convierte una diferencia de masa
en un desplazamiento del brazo de la balanza respecto a la horizontal. Los transductores
que actan sobre una seal qumica se denominan detectores. La mayor parte
de los detectores convierten las seales analticas en un voltaje o corriente elctrica que se
amplifcan o modifcan fcilmente para accionar un dispositivo de lectura. Sin embargo, hay
que tener en cuenta que hay detectores que originan seales no elctricas.
3. procesador de la seal, modifca la seal transducida procedente del detector de
tal forma que se adece al funcionamiento del dispositivo de lectura. Quizs la modifcacin
ms comn sea la amplifcacin un proceso en el que la seal se multiplica por una constante
mayor que la unidad o la atenuacin en la cual se multiplica por una constante menor que
la unidad.
En una balanza de dos platillos, el procesador de la seal es una aguja en una escala cuyo
desplazamiento es considerablemente mayor que el desplazamiento del propio brazo. La
amplifcacin conseguida mediante una pelcula fotogrfca es muy grande; en este caso, un
solo fotn puede originar hasta 10
12
tomos de plata. En efecto, las seales elctricas, se
44
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
amplifcan fcilmente por un factor de 10
12
o incluso superior.
Tambin se realizan de forma habitual muchas otras modifcaciones de las seales elctricas,
se fltran para reducir el ruido, se integran, se derivan o se aumentan exponencialmente.
Otras operaciones realizan la conversin en una corriente alterna. La rectifcacin para dar
una seal de corriente continua, la comparacin de la seal transducida con una de referencia
y la transformacin de la corriente en un voltaje o viceversa.
4. Transductor de salida o dispositivo de lectura, puede ser anlogo o digital,
convierte una seal procesada en una seal que puede ser entendida por un observador
humano. Por lo general, la seal transducida toma la forma de la posicin de una aguja en un
medidor de escala, de una salida de un tubo de rayos catdicos, de un trazo en un registrador
de papel, de una serie de nmeros en una pantalla digital, o del ennegrecimiento de una placa
fotogrfca. En algunas ocasiones, el dispositivo de lectura da directamente la concentracin
de analito cuando el instrumento ha sido previamente programado.
Un instrumento es simplemente una extensin de los sentidos, en un equipo sumamente
sencillo para anlisis aproximados que no requieren de una alta exactitud como lo es una
determinacin de cloro en el agua de una piscina mediante un comparador colorimetrico,
podemos encontrar los cuatro componentes fundamentales haciendo la siguiente analoga:1)
La seal analtica es originada por la luz solar y el color de la solucin. 2) El transductor
de entrada o detector es el ojo humano que recibe la seal (intensidad del color), el
nervio ptico la convierte en impulsos elctricos y la enva al cerebro. 3) El procesador
es el cerebro humano quien compara la intensidad del color de la muestra con el
color de referencia 4) el transductor de salida o dispositivo de lectura es la
respuesta al color, se puede manifestar el resultado de la comparacin en forma oral, escrita o
sealando, determinando as la concentracin. Cuando un analito es muy concentrado o muy
diluido o hay pequeos cambios en la concentracin y con nuestros sentidos no podemos
determinarlos, acudimos a los instrumentos o equipos para ampliar nuestras capacidades,
por lo cual podemos decir que son un extensin de nuestros sentidos, as el ojo humano
es remplazado en un equipo como en el espectrofotmetro por una fotocelda o un foto tubo
como detectores.
Figura 1.1 componentes de un instrumento (fotometro)
Generador de
seales
Transductor
de entrada o
detector
Procesador de
seales
Registrador
Medidor o
escala
Unidad
digital
Seal
analtica
Seal de
entrada
mecnica
o
elctrica
Transductor de
salida o lectura
12,301
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
45
En la confguracin de los instrumentos encontramos generalmente los siguientes sistemas:
1) ptico, constituido por lmparas, lentes, espejos de diferentes formas geomtricas,
prismas, redes o rejillas, rendijas, fltros, polarizadores, cortadores pticos etc. Los
sistemas pticos son delicados y de alto costo. 2) Mecnico en el cual encontramos,
poleas, correas, resortes, levas, engranajes, tornillos micromtricos etc. Utilizados para
transmisin de movimiento son de alta precisin y sumamente costosos. 3) Elctrico
electrnico, conformados por fuentes de energa, cables conductores, motores,
resistencias, condensadores, diodos, transistores, bobinas, amplifcadores operacionales,
circuitos integrados, controladores etc. 4) Un sistema computarizado con el cual se
pueden automatizar todas o algunas funciones del equipo, programar secuencias de anlisis,
con el software respectivo se pude cualifcar, cuantifcar, manejar datos estadsticamente,
hacer los reporte, manejar y enviar informacin. 5) Neumtico algunos equipos como
los utilizados para las tcnicas de cromatografa de gases, espectroscopia de absorcin
y emisin atmica tienen un sistema neumtico constituido por un compresor, cilindros,
vlvulas, manmetros, rotametros, reguladores, mangueras, tuberas, racores, etc. Para el
manejo de los gases. 6) Trmico en equipos para cromatografa de gases se encuentran
hornos, sistemas de inyeccin y detectores que trabajan a diferentes temperaturas.
Comercialmente se puede adquirir los equipos con una confguracin bsica para los anlisis
y complementarlos cuando se requiera con una gran variedad accesorios para tratamiento
y soporte de las de las muestras, celdas para las muestras, muestreadores automticos,
sistemas termostatizados para estudios fsicoqumicos, valoraciones volumtricas midiendo
el parmetro fsico, extraccin de gases etc.
Los equipos se pueden adquirir desde los ms sencillos operados manualmente, pasando por
los semi-automticos hasta los ms sofsticados que operan automticamente y con cierta
inteligencia que les permite la auto calibracin y el auto diagnostico de su funcionamiento
por lo cual los costos son muy variables y su adquisicin depende de las necesidades
analticas.
1.4 Criterios de calidad analtica.
Para adquirir el conocimiento de una tcnica analtica se debe seguir una metodologa que
comprende el estudio de: 1) Fenmeno o propiedad fsica o fisicoqumica en la
cual se fundamenta, sus conceptos tericos, principios y ley en la cual se rige y la aplicacin
de dicha ley en la solucin de problemas analticos. 2) Instrumento o equipo para
conocer las partes que lo conforman, funcionamiento y operacin. Para no considerarlos
como una caja negra manipulada mecnicamente. 3) Aplicaciones y limitaciones.
Adems desde el punto de vista prctico la aplicacin de una tcnica analtica comprende
los procedimientos relacionados con la toma y el tratamiento de la muestra para adecuarla a
la forma de introduccin en el equipo, preparacin de estndares o patrones de referencia,
blanco para el ajuste de la seal, tratamiento estadstico de datos para obtener los resultados
46
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
y la confabilidad de los mismo para su reporte; lo cual exige estudios adicionales.
Para la solucin de un problema analtico el analista puede disponer en el laboratorio de una
gran cantidad de tcnicas analticas por lo cual debe tener claridad en los criterios para
seleccionar correctamente la ms adecuada.
1.4.1 Seleccin de una Tcnica o mtodo analtico
1.4.1.1 Definicin del problema
Para poder seleccionar correctamente un mtodo analtico, es esencial defnir con claridad
la naturaleza del problema analtico, y esta defnicin requiere contestar a las siguientes
preguntas:
1. Qu exactitud se requiere?
2. De cunta muestra se dispone?
3. En qu intervalo de concentraciones est el analito?
4. Qu componentes de la muestra interferen?
5. Cules son las propiedades fsicas y qumicas de la matriz de la muestra?
6. Cuntas muestras hay que analizar?
Es de vital importancia la respuesta a la primera pregunta, ya que determina el tiempo y
el esmero que requerir el anlisis. Las respuestas a la segunda y tercera determinan lo
sensible que debe ser el mtodo y al intervalo de concentraciones al que debe adaptarse.
La respuesta a la cuarta, pregunta determina qu selectividad se requiere. Es importante la
respuesta a la quinta pregunta porque algunos de los mtodos analticos del cuadro
1.1 sirven para disoluciones de analito (normalmente acuosas).
Otros se aplican con mayor facilidad a muestras gaseosas, mientras que otros mtodos son
ms adecuados para el anlisis directo de slidos.
Una consideracin importante desde un punto de vista econmico es el nmero de muestras
que hay que analizar (pregunta sexta). Si es elevado, se puede invertir ms tiempo y dinero en
la instrumentacin, en el desarrollo del mtodo y en la calibracin. Adems, si el nmero fuera
muy elevado, debera elegirse un mtodo que precisara del mnimo tiempo de dedicacin
del operador a cada muestra. Por otro lado, si slo se han de analizar pocas muestras, la
eleccin adecuada suele ser la de un mtodo ms sencillo, aunque sea ms largo y que
requiera poco o ningn tratamiento previo.
Teniendo en cuenta las respuestas a los seis interrogantes anteriores, se puede escoger
un mtodo, siempre que se conozcan las caractersticas de funcionamiento de los distintos
mtodos instrumentales.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
47
1.4.1.2 Caractersticas de funcionamiento de los instrumentos;
parmetros
2
de calidad
En el cuadro 1.2 se enumeran los criterios cuantitativos de funcionamiento de los
instrumentos, criterios que se pueden utilizar para decidir si un determinado mtodo
instrumental es o no adecuado para resolver un problema analtico. Estas caractersticas
se expresan en trminos numricos y se denominan parmetros de calidad. Para
un problema analtico dado, los parmetros de calidad permiten reducir la eleccin de los
instrumentos a tan slo unos pocos y entonces la seleccin entre ellos ya se hace con los
criterios cualitativos de funcionamiento sealados en el cuadro 1.2
Criterio
Precisin Sesgo Sensibilidad Limite de
deteccin
Intervalo de concentracin Selectividad
Parmetro
de calidad
Desviacin estndar
absoluta, desviacin
estndar relativa,
coefciente de
variacin, varianza.
Error absoluto
sistemtico,
error relativo
sistemtico.
Sensi bi l i dad
de calibracin,
s ens i bi l i dad
analtica.
Blanco ms tres veces
la desviacin estndar
del blanco
Concentracin entre el lmite de
cuantifcacin (L.C) y el lmite de
de linealidad (L.L)
Coefciente de
selectividad.
Cuadro 1.2 Criterios numricos para seleccionar mtodos analticos
Otras caractersticas a tener en cuenta en la seleccin del mtodo son: 1) velocidad, 2)
facilidad y comodidad, 3) habilidad del operador, 4) costo y disponibilidad del equipo, 5) costo
por muestra.
Precisin: la precisin de los datos analticos se defne como el grado de concordancia
mutua entre los datos que se han obtenido de una misma forma. La precisin indica la
medida del error, aleatorio, o indeterminado, de un anlisis. Los parmetros de calidad de la
precisin son la desviacin estndar absoluta, desviacin estndar relativa, coefciente de
variacin y la varianza. Estos trminos se defnen en la cuadro 1.3.
Trminos Desviacin estndar absoluta, s. Desviacin estndar relativa (DER) Coefciente de variacin, CV Varianza
Definicin*
S=
1
1
2
_
|
.
|
\
|
=
N
x x
N
i
i
x
S
* x
i = valor numrico de la isima medida.
Cuadro 1.3 Parmetros de calidad para la precisin de los mtodos analticos.
Sesgo: el sesgo mide el error sistemtico, o determinado, de un mtodo analtico. El
sesgo se defne mediante la ecuacin Sesgo = - x
t
donde es la media de la poblacin
de la concentracin de un analito en una muestra cuya concentracin verdadera es x
t
.
Para determinar la exactitud hay que analizar uno o varios materiales de referencia cuya
concentracin de analito es conocida. Al desarrollar un mtodo analtico, los esfuerzos se
2 Ver concepto en el glosario de trminos pg 53
x
S
% 100 X
x
S
CV=
% 100 X
x
S
% 100 X
x
S
DER=
% 100 X
x
S
2
48
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
dirigen hacia la identifcacin de la causas del sesgo y a su eliminacin o correccin mediante
el uso de blancos y el calibrado del instrumento.
Sensibilidad: La sensibilidad de un instrumento o de un mtodo es una medida de su
capacidad de diferenciar pequeas variaciones en la concentracin del analito. Dos factores
limitan la sensibilidad: la pendiente de la curva de calibrado y la reproducibilidad o precisin
del sistema de medida. Entre dos mtodos que tengan igual precisin, ser ms sensible
aquel cuya curva de calibrado tenga mayor pendiente. Un corolario a esta afrmacin es que
si dos mtodos tienen curvas de calibrado con igual pendiente ser ms sensible aquel que
presente la mejor precisin.
La defnicin, cuantitativa de sensibilidad, aceptada por la Unin Internacional de Qumica
Pura y Aplicada (IUPAC) es la de sensibilidad de calibrado, que se defne como la pendiente
de la curva de calibrado a la concentracin objeto de estudio. La mayora de las curvas de
calibrado que se usan en qumica analtica son lineales y se pueden representar mediante la
ecuacin S = mc + S
bl
en la que S es la seal medida, c es la concentracin del analito,
S
bl
, es la seal instrumental de un blanco y m es la pendiente de la lnea recta. El valor S
bl
ser la interseccin de la recta con el eje y. En dichas curvas, la sensibilidad de calibrado
es independiente de la concentracin c y es igual a m. La sensibilidad de calibrado como
parmetro de calidad tiene el inconveniente de no tener en cuenta la precisin de las medidas
individuales.
Lmite de deteccin: Es la mnima concentracin o la mnima cantidad de analito que
puede ser detectada con una tcnica analtica aplicada por un analista; en la cual aquella
concentracin o mnima cantidad de analito proporciona una seal en el instrumento
signifcativamente diferente de la seal de una muestra en blanco o seal de
fondo.
En la bibliografa de la qumica analtica es comn encontrar defniciones como las siguientes:
1) se entiende por lmite deteccin la mnima concentracin o cantidad del analito que hace
que la relacin del cociente seal a ruido sea igual a 2. 2) Es la concentracin de analito que
proporciona una seal igual a la seal del blanco ms dos veces la desviacin estndar del
blanco aunque otros organismos recomiendan que sea ms tres veces la desviacin estndar
del blanco. En la prctica existe poco acuerdo entre los analistas y organizaciones sobre el
lmite de deteccin, el cual toma importancia cuando es necesario detectar la presencia de
sustancias que en concentraciones sumamente pequeas (trazas) son toxicas para los seres
vivos, o nocivas para un proceso y es necesario confrmar su presencia o ausencia.
Intervalo lineal: La Figura 1.2 ilustra la defnicin del intervalo lineal de un mtodo analtico,
que va desde la concentracin ms pequea que se puede analizar en medidas cuantitativas
(lmite de cuantifcacin L.C.) hasta la concentracin en la cual la curva de calibrado se
desva de la linealidad (limite de linealidad L.L.). Para las medidas cuantitativas se Toma
como lmite inferior, en general, la que corresponde a diez veces el limite de deteccin. Para
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
49
que un mtodo analtico sea til, debe tener un amplio intervalo de linealidad.
Figura 1.2 Intervalo lineal de un mtodo analtico L.D. = limite de deteccin, L.C. =
limite de cuantificacin, L.L. = limite de linealidad.
Selectividad: La selectividad de un mtodo analtico indica el grado de ausencia de
interferencias con otras especies que contiene la matriz de la muestra. Ningn mtodo
analtico est totalmente libre de interferencias y por lo tanto, es necesario, realizar diversos
procedimientos para minimizar sus efectos al aplicarlo. La selectividad se evala mediante
el coefciente de selectividad que indica una respuesta relativa del mtodo aplicado a
especies diferentes.
Robustez: Un mtodo analtico es robusto cuando se puede aplicar a un analito que se
encuentra en diferentes matrices sin interferencias.
Solidez: Un mtodo analtico es slido cuando soporta cambios en variables fsicas como
la temperatura, presin, tiempo etc.
Manejo de datos:
Los instrumentos o equipos nos suministran datos los cuales manipula el analista para
obtener la informacin qumica cualitativa o cuantitativa deseada. Dependiendo de la
exactitud y precisin requerida en el anlisis, los datos se pueden manejar por medio de
tablas, grficas o expresiones matemticas (ecuaciones); en condiciones ideales
se espera un comportamiento lineal del cambio en la seal ( S ), parmetro o dato dado por
el instrumento con relacin al cambio en la concentracin ( C ) as: ver tabla 1.1
concentracin
0C C 2C 3C 4C C
x
Seal dato - parmetro 0S S 2S 3S 4S S
x
Tabla 1.1 Cambio en la seal de un instrumento por el cambio en la concentracin
Intervalo lineal
R
e
s
p
u
e
s
t
a
d
e
l
I
n
s
t
r
u
m
e
n
t
o
L.D. L.C.
L.L.
Concentracin
50
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Figura 1.3 Grfica ideal de la relacin de la seal del instrumento con la
concentracin
La seal, parmetro o dato dado por el instrumento, puede ser un ndice de refraccin dado
por un refractmetro, un ngulo de giro B dado por un polarmetro, un valor de absorbancia
dado por un espectrofotmetro, la intensidad dada por un equipo de emisin, el rea bajo la
curva dada por un cromatgrafo, el voltaje dado por un potencimetro, la conductividad dada
por un conductmetro etc.
La grfca corresponde a una lnea recta cuya ecuacin es y=mx+b en la cual y=S,
m=s/c = pendiente, que tambin es igual a la sensibilidad de calibracin,
b es igual a la interseccin de la lnea con el eje y. Dicha expresin matemtica denota
que S es directamente proporcional a C, (S C) por lo tanto para resolver la
proporcionalidad es necesario introducir una constante K, luego S=KC siendo K=m y b=0,
pues si la concentracin C es igual a cero (C=0), la seal o parmetro S ser igual a
cero (S=0). Es la expresin matemtica ms utilizada y solo cambia el nombre de la seal
o parmetro. As: la seal o parmetro usado en la tcnica Refractomtrica es el ndice
de refraccin, simbolizado por n
D
que representa el ndice refraccin medido con la
lnea D del sodio de 589 nm a 20C por tanto n
D
= mc + b, en la tcnica Polarimtrica
el parmetro es el ngulo de giro representado por B, siendo B=lc donde
l=m, en las tcnicas Espectrofotomtricas de Absorcin el parmetro es
la Absorbancia simbolizada por A, por consiguiente A=bc en la cual b=m, en
las tcnicas Espectrofotomtricas de emisin el parmetro es la Intensidad,
simbolizada por I, I=mc m=constante, igualmente se manejan muchos otros
parmetros relacionados con las dems tcnicas analticas.
Las grfcas pueden sufrir desviaciones positivas, negativas, a bajas concentraciones o por
-
-
-
-
----
4
3
2
1
4 3 2 1
S
e
a
l
d
e
l
I
n
s
t
r
u
m
e
n
t
o
Concentracin
Relacin entre la seal del instrumento y la concentracin
Y = X
0
0
20
20
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
51
mal ajuste del cero de la seal instrumental con el blanco. Observar grfcas figura 1.4
Figura 1.4 Grficas de desviaciones
1.5.1 Calibracin de los Instrumentos
La calibracin es la concordancia de la seal del instrumento con la concentracin del analito
en un patrn de referencia. Los mtodos instrumentales, requieren una calibracin, lo cual
no es ms que el proceso que relaciona la seal analtica medida con la concentracin del
analito. Los mtodos ms utilizados para la calibracin son:
1.5.1.1 curva de calibracin
Para la curva de calibracin se introducen en el instrumento varios patrones que
contienen concentraciones exactamente conocidas del analito y se registra la seal
instrumental. Normalmente esta seal se corrige con la correspondiente seal obtenida con
el blanco. En condiciones ideales el blanco contiene todos los componentes de la muestra
original excepto el analito. Los datos obtenidos se representan para obtener una grafca de
la seal corregida del instrumento frente a la concentracin de analito.
La Figura 1.3 muestra una curva de calibracin caracterstica (tambin denominada curva
patrn o curva analtica). A menudo se obtienen representaciones grfcas como sta que
son lineales en un amplio intervalo de concentracin (intervalo til) lo cual es deseable, ya
S
e
a
l
I
n
s
t
r
u
m
e
n
t
a
l
S
e
a
l
I
n
s
t
r
u
m
e
n
t
a
l
S
e
a
l
I
n
s
t
r
u
m
e
n
t
a
l
S
e
a
l
I
n
s
t
r
u
m
e
n
t
a
l
Concentracin
Concentracin
Concentracin
Concentracin
Desviacin positiva + Desviacin negativa -
Desviacin por ajuste del
cero en la seal
Desviacin a bajas concentraciones
52
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
que estn menos sujetas a error que las curvas no lineales, sin embargo no es raro encontrar
representaciones grfcas no lineales, las cuales requieren un elevado nmero de datos de
calibracin para establecer con precisin la relacin entre la respuesta del instrumento y la
concentracin. Si todos los datos no caen sobre la lnea de la grfca de calibracin, se ajusta
la lnea por el mtodo de mnimos cuadrados, Se obtiene la ecuacin, la cual
permite calcular directamente la concentracin del analito en las muestras. El software
de muchos equipos hacen estos manejos matemticos automticamente construyendo las
tablas de datos, las grfcas, hacen el ajuste por mnimos cuadrados, calculan la ecuacin
o interpolan en la grfca y una vez calibrados reportan directamente la concentracin del
analito en las muestras y algunos parametros estadisticos.
El xito del mtodo de la curva de calibrado depende, en gran medida, de la exactitud que ten-
gan la concentracin de los patrones y de lo que se parezca la matriz de los patrones a la de
las muestras que se analizan. Lamentablemente reproducir la matriz de muestras complejas
suele ser difcil o imposible y sus efectos dan lugar a errores por interferencias.
Para minimizarlas, a menudo, es necesario separar el analito del interferente antes de
medir la seal en el instrumento.
1.5.1.2 Adicin estndar
El mtodo de la adicin estndar es especialmente til para analizar muestras complejas en
las que la probabilidad de que se produzcan efectos debidos a la matriz es considerable.
Este mtodo puede aplicarse de diferentes formas. Una de las ms habituales implica la
adicin de diferentes volmenes de una disolucin patrn a varias alcuotas de la muestra del
mismo tamao. Este proceso se conoce como adicin de muestra. Despus, cada disolucin
se diluye a un volumen fjo antes de efectuar la medida. Hay que tener en cuenta que cuando
la cantidad de muestra es limitada, las adiciones estndar se pueden llevar a cabo por adicio-
nes sucesivas de volmenes del patrn a un nico volumen del problema exactamente
medido. Las medidas, se van haciendo en la muestra original y despus de cada adicin del
patrn en la muestra. En la mayora de las versiones del mtodo de la adicin estndar, la
matriz de la muestra es casi idntica despus de cada adicin y la nica diferencia es la
concentracin de analito, o Ia concentracin de reactivo en el caso de que se aada un
exceso de un reactivo analtico. Como los patrones se preparan en alcuotas de la muestra,
todos los dems componentes de la mezcla de la solucin sern iguales.
1.5.1.3 Patrn interno
Un patrn interno es un compuesto que al aadirlo en una concentracin o cantidad
conocida y constante a los patrones de calibracin, blanco y muestras, no produce interferencias
y da una seal constante; para construir curvas de calibracin relativas en las cuales
en el eje y se representa el cociente de la seal del patrn (analito) con relacin a la seal
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
53
del patrn interno y en el eje x el cociente de la concentracin del patrn (analito) con
relacin a la concentracin del patrn interno, presentndose como ventaja se puedan
compensar algunos errores aleatorios o sistemticos ya que si ambas seales cambian de
igual manera por efecto de la matriz o fuctuaciones del mtodo, se compensan.
1.6 Glosario de Trminos:
Anlisis: Proceso que proporciona informacin fsica o qumica a cerca de los componentes
de una muestra.
Analito: elemento o compuesto a determinar en un anlisis.
Blanco: Sustancia o mezcla que contiene todos los componentes de la muestra original
menos el analito; el cual es utilizado para ajustar a cero la seal instrumental.
Compuestos concomitantes: Sustancias que acompaan al analito.
Determinacin: Anlisis de una muestra para simplemente identifcarla o identifcarla
hallar su concentracin o las propiedades del analito
Interferencias: Todo lo que impida determinar la verdadera cantidad o concentracin del
analito.
Matriz: Conjunto de los distintos componentes que constituyen una muestra analtica.
Parmetro: Es una cantidad de una variable que puede tomar diferentes valores y
caracterizar un proceso, operacin, resultado o compuesto en determinadas condiciones.
Ruido Instrumental: Es toda perturbacin que afecta el buen funcionamiento de un
dispositivo electrnico ocasionando distorsiones en la seal dada por el mismo.
Transductor: Es todo artifcio, dispositivo o instrumento capaz de convertir una propiedad
fsica, no medible directamente, en una seal elaborable y ofrecer informacin sobre la
naturaleza y magnitud de la propiedad fsica que incide en el transductor.
54
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
1.7 Taller
1.7.1.En su calidad de Tecnlogo Qumico o Qumico Industrial Qu actividades laborales
le corresponde realizar como Analista Qumico?
1.7.2.Cul es la importancia que tiene la instrumentacin qumica en la qumica
analtica?
1.7.3.Los instrumentos son un medio de comunicacin entre el cientfco o el analista y la
materia objeto de estudio, cmo se logra este objetivo?
1.7.4.Qu son los parmetros de calidad analtica?
1.7.5.Una solucin de Cr
6+
cuya concentracin es de 10 mg/ L dio en un instrumento
una seal de 0.25 unidades dentro de un rango lineal de 0.0 a 0.95. Cul ser la
concentracin de Cr
6+
, en las siguientes muestras de aguas residuales procedentes
de una curtimbre segn los datos de la tabla 1.2.
No. muestra 1 2 3 4
Unidades de la seal instrumental
0.17 0.43 0.65 0.87
Concentracin en mg/L de Cr
6+
Tabla 1.2 Resultados analticos de las muestras de aguas residuales
1.7.6.Para construir en el laboratorio una curva de calibracin para la determinacin de
nitritos (NO
2
-
) en derivados crnicos se obtuvieron los datos de la tabla 1.3.
No. Patrn
1
(Blanco)
2 3 4 5 6 mx
Concentracin del patrn en mg/L
0.00 0.25 0.50 0.75 1.00 1.25 C
x
Unidades de la seal instrumental
0.00 0.18 0.40 0.61 0.79 0.94 0.53
Tabla 1.3 Datos para la construccin de una curva de calibracin.
Construya en papel milimetrado la grfca seal del instrumento versus concentracin
(S Vs C).
Recuerde que la variable dependiente es la seal del instrumento la cual se grfca en el eje
Y, la variable independiente es la concentracin que se grfca en el eje X.
1.7.6.1 Si es necesario haga el ajuste por mnimos cuadrados (ver instruccin 1.8.2
Manual de prcticas de laboratorio de anlisis instrumental I pgina 31)
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
55
1.7.6.2 Obtenga los valores de m y b para la ecuacin y=mx+b
1.7.6.3 Cul es la sensibilidad de calibracin?
1.7.6.4 Calcule la concentracin C
x
de la muestra problema m.
1.7.6.5 Si la concentracin real de la muestra problema mx es 0.700 mg/l; calcular
con las frmulas siguientes el error absoluto, el error relativo y el porcentaje de error
relativo.
D
R
= dato real D
E
= dato experimental D
R
D
E
= error absoluto
DE DR
=
Error relativo %E= porcentaje de error relativo %E
=
DE
DR
x 100
D
R
D
R
1.7.6.6 Cmo podra calcular el lmite de deteccin y el lmite de cuantifcacin?
1.7.6.7 Si la mnima seal instrumental observable es 0.008 cul es limite de deteccin
y el limite de cuantifcacin del anlisis?
56
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Bibliografa
HARRIS, C Daniel. Anlisis qumico cuantitativo. (3a Ed.) Espaa : Editorial Reverte S.A.,
c2007.
HARVEY, David Qumica Analtica Moderna (1.Ed). Espaa. ED Mcgraw-Hill 2002.
MARN VILLADA, Fabio. Conferencias Anlisis Instrumental. Material mimeografado UTP.
SKOOG, Douglas A. WEST Donald M. HOLLER F. James. Qumica Analtica (6a. Ed).
Colombia: ED Mcgraw-Hill 1.999.
SKOOG, Douglas A. ,LEARY, James J. Anlisis Instrumental (4a. ed ) Espaa: ED, McGraw-
Hill 1.994.
SKOOG, Douglas A; Holler F James; Nieman Timothy A. Principios de Anlisis Instrumental
(5. Ed). Madrid: ED Mcgraw-Hill 2000.
SKOOG, Douglas A; Holler F James; Crouch, Stanley R. Principios de Anlisis Instrumental (6.
Ed). Mxico: ED Cengage Learning 2008.
STROBEL, Howard A. Instrumentacin Qumica (1a. ed.). Mxico: Limusa, S.A., 1982.
WILLARD, Hobart H., Merritt, Lynnel., y Dean John A. Mtodos
Instrumentales de Anlisis (7a. ed ).Mxico: ED, Grupo Editorial Iberoamrica, 1.991.
MILLER N. James, MILLER C. Jane. Estadstica y Quimiometra para Qumica Analtica (4
a
.
Ed).Madrid: ED Prince Hall 2002.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
57
SEGUNDA
UNIDAD
58
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
59
SEGUNDA UNIDAD
31
2. Radiaciones Electromagnticas (REM): Es un tipo de energa que se propaga
por campos magnticos y elctricos en vibracin, se transmite por el espacio a grandes
velocidades; no requiere medio de apoyo para su transmisin, adopta varias formas siendo
las ms reconocidas la luz o radiaciones visibles (VIS) y el calor radiante o radiaciones
infrarrojas (IR); manifestaciones menos evidentes son los rayos gamma (g), rayos X, la luz
ultravioleta ( radiaciones UV), micro ondas, ondas de radio y TV, ondas de corriente
alterna.
La energa radiante se asocia con las radiaciones electromagnticas, las cuales para explicar
su comportamiento dual en algunos casos es necesario por su naturaleza ondulatoria
describirlas como ondas y en otros casos como corpsculos o partculas denominadas
tambin fotones o quantum. Con el modelo ondulatorio o modelo clsico de onda sinusoidal
se explican algunos fenmenos y con el corpuscular otros.
Figura 2.1 Campo elctrico, (Vector elctrico E) y Campo magntico (vector
magntico H) de una onda electromagntica de plano polarizado, de longitud de
onda l y amplitud a.
3 Para el desarrollo de la segunda unidad es necesario considerar los siguientes aspectos: 1) El tema relacionado con las radia-
ciones electromagntcas es extenso y complejo, por lo cual el programa de la asignatura solo tene en cuenta lo fundamental
para entender la instrumentacin basada en las interacciones de las radiaciones electromagntcas con la materia. 2) Los
estudiantes de qumica industrial por haber cursado la fsico III, se les facilita ms el desarrollo del tema el cual fue objeto de
estudio en este curso; mientras que los estudiantes de Tecnologa en Qumica en sus cursos de fsica no estudian dicho tema;
por lo tanto, se debe estudiar de una manera clara y sencilla para que se puedan apropiar de estos conocimientos.
y
y
x
x
z z
D
i
r
r
e
c
i
n
d
e
p
r
o
p
a
g
a
c
i
n
l
a
E
E
H
H
60
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
La radiacin electromagntica se trata convenientemente como un campo elctrico oscilante
en el espacio, asociado con el campo elctrico, pero perpendicular a el, hay un campo
de fuerza magntica; as las propiedades se representan por dos vectores: un vector
elctrico y otro vector magntico, los dos vectores son sinusoidales y perpendiculares
a la direccin de propagacin de la onda; Tanto el campo magntico como el campo elctrico
se describen como una onda sinusoidal. El campo elctrico es el que interacta con
los electrones de la materia y es el responsable de los fenmenos de: transmisin, refexin,
dispersin, refraccin, absorcin, emisin. Por lo cual la radiacin solo se representa por el
vector elctrico; por esta razn en el estudio de la mayora de la instrumentacin qumica
nicamente se considera el vector elctrico, y el campo magntico (vector magntico)
solo se tiene en cuenta en la tcnica analtica qumica relacionada con la absorcin de las
ondas de radiofrecuencia en la espectroscopa de resonancia magntica nuclear (RMN),
Resumiendo:
Energa radiante Radiacin electromagntica
2.1 Descripcin matemtica de una onda
En la representacin de la onda el eje de abscisas (x) se puede tomar como tiempo o como
distancia, si se toma el tiempo como una variable la onda puede describirse por la ecuacin
de una onda sinusoidal, nombre que recibe la grfca de la funcin seno, o sea
Y=a senx ver figuras 2.1, 2.2 , 2.3 y 2.4 donde:
Y=E= magnitud del campo elctrico en el tiempo.
a= A
e
= amplitud mxima del campo elctrico, mximo valor del vector elctrico.
x= T+ donde: = frecuencia angular (nmero de rotaciones completas por unidad de
tiempo),
Vector elctrico responsable
de los fenmenos de:
Transmisin
Refraccin
Reflexin
Dispersin
Absorcin
Emisin
{
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
61
T=tiempo, = ngulo de fase que justifca el hecho de que la magnitud del campo elctrico
deba ser cero en T=0.
Por lo cual E= A
e
sen(T+) La frecuencia angular se relaciona con la frecuencia ptica
de la radiacin electromagntica () mediante la expresin: =2p ya que =2p/
entonces = 2p(1/), 1/= donde = periodo, por consiguiente E= A
e
sen(2pT+),
el campo magntico H puede describirse con una ecuacin idntica H= A
h
sen(2pT+).
Figura 2.2 Vector giratorio para representacin de una onda sinusoidal.
Figura 2.3 Representacin de 2 ondas sinusoidales con iguales amplitudes y
frecuencia, con un ngulo de fase entre ellas.
Una onda electromagntica se caracteriza por varias propiedades fundamentales: 1)
velocidad (V)
4
1
. 2) amplitud (a), 3) frecuencia (), 4) ngulo de fase (), 5) polarizacin y
direccin de propagacin (). Otras propiedades secundarias son: 6) Energa (E), 7) longitud
de onda (), 8) nmero de onda ( ), 9) potencia (P) ,10) intensidad (I); cuando se da
la amplitud (a), frecuencia (),y el ngulo de fase (), de la onda sinusoidal, esta queda
completamente especifcada.
4 Los smbolos entre parntesis son los mas utlizados para abreviar la representacin de cada una de estas propiedades de
las radiaciones electromagntcas. El smbolo de nmero de onda lleva una pequea lnea en la parte superior.
1
2
1
2
F
90
0 180
270
p
2
p
3
p
2 p
2
2
Tiempo
l
v
p
F
62
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Cresta
Valle
Longitud de Onda
Nodo
V
e
c
t
o
r
e
l
c
t
r
i
c
o
-
C
a
m
p
o
e
l
e
c
t
r
i
c
o
+
Periodo
Tiempo o Distancia
A
m
p
l
i
t
u
d
A
e
Figura 2.4 Representacin de una radiacin electromagntica considerando
solo el vector elctrico (campo elctrico), y la identificacin de algunas de sus
propiedades.
2.2 Conceptos y relaciones matemtica de las propiedades de las
radiaciones electromagnticas:
2.2.1 Velocidad: Es la velocidad con la cual se propaga una radiacin electromagntica
a travs de un medio, el medio puede ser el vaco, el aire, el agua, el vidrio, una sustancia
etc.
La velocidad en un medio i (V
i
) es igual al producto de la frecuencia () por la longitud de
onda en el medio (
i
) expresada en cm. (V
i
)= ()X(
i
). La velocidad depende de la
longitud de onda en el medio la cual cambia, la frecuencia se conserva. Cuando el medio es
el vaco todas las radiaciones se propagan con igual velocidad, dicha velocidad se simboliza
por la letra ( C ), conocida como la constante de la velocidad de la luz por lo tanto
( C )= (V
vaco
) = ()X(
vaco
) = 2.9979 X 10
10
cms
-1
aproximadamente igual a 3 X 10
10
cms
-1
; valor utilizado para los clculos en los cuales interviene dicha constante. La velocidad
de la radiacin en un medio, tambin esta relacionada con el ndice de refraccin que se
simboliza por la letra (n) y es igual a la relacin de la velocidad de la radiacin en el vaco
(V
vaco
), con relacin a la velocidad de la radiacin en el medio (V
i
), valor que es constante
a una longitud de onda y temperatura constante, cuando el medio es un gas la presin debe
ser tambin constante. n= V
vaco
/ V
i
luego V
i
= V
vaco
/ n por consiguiente
i
=
vaco
/ n; siendo
i
la longitud de onda en el medio.
Cresta
Valle
Longitud de Onda
Nodo
V
e
c
t
o
r
e
l
e
c
t
r
i
c
o
C
a
m
p
o
e
l
e
c
t
r
i
c
o
+
Periodo
Tiempo o Distancia
A
m
p
l
i
t
u
d
A
e
-
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
63
Figura 2.5 efecto del cambio de medio en un haz de radiacin electromagntica
monocromtica.
Se observa en la grfca 2.5 que la longitud de onda (l ) cambia al pasar el haz de
radiaciones de un medio a otro pero la frecuencia (), se conserva.
2.2.2 Amplitud (a): Es la longitud del vector elctrico en el mximo de la
onda ver figura 2.4. a= A
e
, en otros trminos es el valor mximo de una cantidad
variable respecto de su valor medio o de base; en el caso de una onda es la mitad del valor
entre un mximo y un mnimo. La amplitud esta relacionada con la potencia y la intensidad
de la onda.
2.2.3 Frecuencia (): Es el nmero de oscilaciones o ciclos completos por segundo.
La unidad habitual es la inversa del segundo s
-1
o hertz que corresponde a un ciclo por
segundo. La frecuencia permanece invariable y est directamente relacionada con la energa
(E) ; (E)(),tambin se defne la frecuencia como el inverso del periodo ()o sea que
=1/. La frecuencia se relaciona con ( C ) y () mediante la expresin = C/ .
La frecuencia en otros trminos es el nmero de ondas que pasan por un punto en un segundo,
al observar la figura 2.6 se aprecia que de las 2 radiaciones una que tiene una de 10
metros y la otra 1 metro, movindose a la velocidad de la luz, la de mayor frecuencia es la de
menor , ya que un segundo despus por un punto dado han pasado ms ciclos de la onda
de menor que la de la mayor ; por lo tanto la frecuencia es inversamente proporcional a ;
esto es a mayor frecuencia menor longitud de onda. 1/ .
A
m
p
l
i
t
u
d
A
Vidrio
Aire Aire
Distancia
= 500 mn
= 330 mn = 500 mn
= 6,0 x 10
14
Hz = 6,0 x 10
14
Hz = 6,0 x 10
14
Hz
0
64
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Figura 2.6 Ilustracin de la relacin de frecuencia con la longitud de onda
2.2.4 Angulo de fase (): Es la diferencia de fases; signifca que el vector de una onda
esta retrazado o adelantado con relacin a otra. Ver figura 2.3; la fase se entiende como
la etapa en un ciclo que una onda ha alcanzado en un momento dado tomada a partir de
cierto punto de referencia.
Dos ondas estn en fase si coinciden sus mximos y sus mnimos en el tiempo, tienen la
misma , la misma , pueden tener diferente amplitud. Si la diferencia de fase entre dos
ondas es 0, 2p, 4p, etc. Ambas estn en fase y se produce una interferencia constructiva
mxima o sea se refuerzan produciendo una onda de mayor amplitud.
Si es p, 3p, 5p, etc. Estn desfasadas o en antifase o fases opuestas y se produce
una interferencia destructiva mxima. El proceso de la interferencia o superposicin
de ondas (ver figuras a y b 2.7, 2.8, 2.9) juega un papel importante en numerosas
seales instrumentales.
Figura 2.7 a y b Superposicin de ondas sinusoidales (a) A
1
<A
2
,
1
2
= -20,
1
=
2
,(b) A
1
<A
2
,
1
2
=-200,
1
=
2
. En cada caso, la curva de trazo continuo resulta de
la combinacin de las dos curvas de trazo discontinuos.
Punto dado
Punto dado
Longitud de onda larga
10 m
1 m
Longitud de onda corta
1 ciclo
10 ciclos
En tiempo cero Despus de un segundo
(1)
Tiempo Tiempo
0
0
y
y
(1)
(2)
(2)
(a)
(b)
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
65
Figura 2.8 Otra ilustracin de interferencia. La curva B esta 70 fuera de fase con
relacin a la curva A. La curva C es la onda resultante.
Figura 2.9 Superposicin de dos ondas de frecuencia diferente pero amplitud idntica.
(a) la onda 1 tiene un perodo de 1/
1
.
La onda 2 tiene un perodo de 1/
2 ;
2
=1,25
1
.(C)modelo ondulatorio combinado. La
superposicin de
1
y
2
produce un modelo cclico con un periodo de 1/ en el que
=
1
2.
2.2.5 Direccin de propagacin y Polarizacin (): La direccin se relaciona
con el sentido de propagacin de la onda y la polarizacin con la restriccin de las
vibraciones en una onda transversal de modo que la vibracin ocurra en un solo plano.
2.2.6 Energa (E): Es la energa radiante asociada a las radiaciones electromagnticas,
la E es directamente proporcional a la frecuencia E , para resolver la proporcionalidad
se introduce la constante de Planck simbolizada por la letra h la cual es igual
6.62 x 10
-27
ergios s, o 6.62 x 10
-34
julio s, as entonces E=h, pero
= C/ por lo cual E=h C/ . La unidad de energa ms usada es el julio (joule) del SI
(sistema internacional de unidades) aunque se utilizan otras como el ergio.
A
C
B D
e
s
p
l
a
z
a
m
i
e
n
t
o
Direccin de propagacin
Onda 1
Onda 2
(a)
(b)
(c)
(c)
(c)
2
10 cm
1
1
1
=
P
b
Ciclo
66
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
2.2.7 Longitud de onda (): Es la distancia entre dos mximos (ver figura 2.4)
o dos mnimos consecutivos; tambin es defnida como la distancia entre los extremos de
un ciclo completo de la onda. La longitud de onda esta relacionada con la energa, a menor
longitud de onda mayor energa.
2.2.8 Nmero de onda (): Es el inverso de la longitud de onda expresado en
centmetros a la menos uno.
=1/ .
cm
, cm
-1
.En otros trminos es el nmero de ondas que hay en un centmetro. El
nmero de onda se relaciona con C y la frecuencia mediante las siguientes expresiones
=1/ ., la = C/ , despejando de ambas expresiones e igualando tenemos: =1/ ,
= C/, entonces 1/ = C/; =/C. El nmero de onda es muy utilizado en la regin
infrarroja y en algunos libros le dan una denominacin como si fuera igual a la frecuencia lo
cual no es correcto, es necesario tenerlo muy claro para evitar confusiones. La importancia
del nmero de onda radica en que la energa es directamente proporcional al nmero de
onda, pues a mayor nmero de onda mayor energa E ; E=h C/ o sea que E=h C
1/ pero 1/ = entonces E=h C siendo h y C constantes.
2.2.9 Potencia (P): La potencia de una radiacin o de un haz de radiaciones es la
energa del haz que llega a un rea dada por segundo. P= E siendo E=energa del
fotn y =Flujo fotnico, entendindose por fujo fotnico el nmero de fotones por
unidad de tiempo. Como E=h entonces P= h. En la instrumentacin qumica es muy
importante la potencia ya que los detectores disponibles no tienen repuesta a la frecuencia
lo sufcientemente rpida para medir la amplitud de una onda. En su lugar se determina la
potencia (P), la cual es proporcional al cuadrado de la amplitud y representa la cantidad de
energa transmitida en forma de radiacin electromagntica por unidad de tiempo.
2.2.10 Intensidad(I): Se designa como la potencia radiante que procede de una fuente
puntual por unidad de ngulo slido. La potencia algunas veces suele designarse como
intensidad pero tienen diferencias.
Es usual manejar la intensidad en las tcnicas espectroscpicas de absorcin y emisin
tanto atmica como molecular, exceptuando la espectroscopa infrarroja donde se maneja la
potencia. Los trminos intensidad y potencia no deben conducir a confusiones.
En la onda de la figura 2.4 encontramos los trminos: Perodo simbolizado por la letra
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
67
griega minscula Tau (), para no confundirlo con la potencia (P), pues algunos libros
simbolizan el perodo con la P. El perodo es el tiempo requerido para un ciclo completo
de una oscilacin, es el inverso de la frecuencia y se relaciona con la frecuencia angular
mediante la expresin =2p/. El es el punto de oscilacin mnima. Nodo: Se denominan
as en una onda estacionaria los puntos donde la amplitud tiene un valor mnimo de cero y
estn separados por media longitud de onda.
En la instrumentacin qumica estudiaremos las fuentes de ondas de radiaciones
electromagnticas y con ellas algunos trminos asociados con las mismas como:
Frente de onda: Superfcie continua asociada con una radiacin ondulatoria, en la cual
todas las vibraciones que entran estn en fase.
Haz paralelo: Haz conformado por un frente de ondas planas.
Coherentes: Ondas o fuentes que estn siempre en fase. Un ejemplo es el laser que
es una fuente de radiacin coherente, constituido por un haz de radiaciones monocromticas
en fase, paralelo e intenso portador de una gran cantidad de energa; el cual tiene mltiples
aplicaciones. La palabra laser es el acrstico de los trminos en ingles: L Light, A amplifcatin,
S stimulated, E emissin, R radiation. Lo cual es interpretado como amplificacin de
luz por emisin de radiacin estimulada.
2.3. Unidades de longitud, energa y frecuencia de uso frecuente con
las radiaciones electromagnticas.
2.3.1 Unidades de Longitud:
Unidad smbolo
equivalencia en
metros
equivalencia en
centmetros
Regin de
mayor uso
angstrom
10
-10
m 10
-8
cm Radiaciones gamma
nanmetro nm 10
-9
m 10
-7
cm Ultravioleta y visible
micrometro m 10
-6
m 10
-4
cm Infrarroja
milimetro mm 10
-3
m 10
-1
cm Radio Fm
centmetro cm 10
-2
m 1 cm Microondas, Tv
Tabla 2.1 unidades de longitud de uso frecuente con las radiaciones
electromagnticas.
68
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
2.3.2 Unidades de energa:
Unidad
smbolo Equivalencia en J
Joule (julio) J
ergio erg 10
-7
calora cal 4,2
Electrn voltio eV 1,6021917 X 10
-19
Tabla 2.2 Unidades de energa de uso frecuente con las radiaciones
electromagnticas.
Otras unidades: Energa por mol de fotones, es decir, Nmero de avogadro de fotones;
para lo cual se utilizan calora / mol y Kcal / mol, una kilocalora es igual a 1000 caloras
(Kcal=1000cal).
2.3.3 frecuencia: La unidad de frecuencia del SI es el hertz cuyo smbolo es Hz
defnido como un ciclo u oscilacin completa en un segundo por lo cual tambin se expresa
la frecuencia en ciclos/ segundo (ciclos/s) o s
-1
.
2.4. Conversin de unidades: En qumica y particularmente el qumico analista debe
conocer la conversin reciproca de las distintas unidades empleadas en espectroscopia, de
tal manera que se pueda ubicar en cualquier regin del espectro electromagntico, tanto en
unidades de energa, frecuencia, longitud de onda o nmero de onda ya que las radiaciones
se describen en trminos de estas unidades.
2.4.1 Ejemplo: Para una radiacin en el vaco con una longitud de onda de 500 nm
correspondiente a la regin visible del espectro electromagntico calcular: a) su frecuencia,
b) su energa y c) el nmero de onda.
Desarrollo:
a) = C/ remplazando
b) E=h remplazando
E=6.62 x 10
-34
js x 6 x 10
14
s
-1
=3.972x10
-19
j
=
3 x 10
10
3 x 10
17
cm
s
s
-1
500nm x 10
-7
cm
nm
500
= = 6 x 10
14
s
-1
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
69
c) =1/ .
cm
remplazando
2.4.2 Para la conversin inversa entre longitud de onda y energa se
utiliza la ecuacin:
ya que pero = C/ remplazando en (1) y (2) se
tiene : (3) (4) dividiendo, (4) entre (3) nos queda:
luego
2.4.2.1 Ejemplo: calcular la longitud de onda de un fotn que tiene una energa de 4,5
x 10
-19
J, si una radiacin con una longitud de onda de 1 nm le corresponde una energa de
1.986 x 10
-16
j.
Desarrollo: remplazando en tenemos
luego entonces
Tambin se puede calcular
2
teniendo en cuenta que E=h C/ remplazando tenemos:
2.4.3 Factores de conversin para radiacin electromagntica.
Cuando se ha entendido la lgica de las relaciones directas e inversas de las diferentes
propiedades o caractersticas de las radiaciones electromagnticas se aplica los factores
de conversin para obtener ms rpidamente los resultados, lo importante es no hacer los
clculos de una forma mecnica sin entender su propsito. En el cuadro 2.1 se resumen
los factores de conversin y mediante ejemplos se ilustra la forma de utilzarlos.
=
1
500nm x 10
-7
=
cm
nm
20000 cm
-1
E1 = h
1
(1) E2 = h
2
(2)
E
1
=
E
2
l 2
l 1
E
1
= h
l 1
C
E
2
= h
l 2
C
E
1
= h
l 1
C
E
2
= h
l 2
C
E
1
=
E
2
l 2
l 1
E
1
=
E
2
l 2
l 1
=
4.5x10
-19
J
2
1
1.986x10
-16
J
=
2.265861x10
-3
l 2
1
2.265861x10
-3
1
= 441.33nm
4.5x10
-19
j=6.62x10
-34
j s
3x10
10
cms
-1
l 2
x10
-7
cm
nm
= 441.33nm
70
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Unidades
de x
Frecuencia
Hz
Numero de onda
cm
1
Energa
Kcal/mol eV
Longitud de onda
Cm nm
Hz
1.00 x 3.33 x 10
11
x 9.54 x 10
-14
x 4.14 x 10
-15
x
3.00 x 10
10
x
3.00 x 10
17
x
cm
-1
3.00 x 10
10
x 1.00 x 2.86 x 10
-3
x 1.24 x 10
-4
x 1.00
x
1.00 x 10
7
x
Kcal/mol 1.05 x 10
13
x 3.50 x 10
2
x 1.00 x 4.34 x 10
-2
x 2.86 x 10
-3
x
2.86 x 10
4
x
eV 2.42 x 10
14
x 8.07 x 10
3
x 2.31 x 10
1
x 1.00 x 1.24 x 10
-4
x
1.24 x 10
3
x
cm 3.00 x 10
10
x
1.00
x
2.86 x 10
-3
x
1.24 x 10
-4
x
1.00 x 1.00 x 10
7
x
nm 3.00 x 10
17
x
1.00 x 10
7
x
2.86 x 10
4
x
1.24 x 10
3
x
1.00 x 10
-7
x 1.00 x
Cuadro 2.1 Factores de conversin para radiacin electromagntica.
Para convertir datos en unidades de x mostradas en la primera columna en las unidades
indicadas en las restantes columnas se multiplica o se divide como esta indicado.
2.4.3.1 Ejemplo: a) Convertir 500nm a Hz.
Desarrollo: En la segunda columna de izquierda a derecha, columna de frecuencia
y en la ultima fla se encuentra la expresin: , para la cual x es igual a los 500nm
que se van a convertir en Hz, por lo tanto , comparar ste desarrollo
con el del desarrollo del ejemplo 2. 4.1.
b) Convertir el nmero de onda 3600 cm
-1
a Hz .
Desarrollo: se aplica factor 3.00x10
10
x, por lo tanto 3.00x10
10
x 3600= 1.08x10
14
Hz.
c) Convertir 200 cm a eV.
Desarrollo: Se aplica el factor , remplazando
x queda: =6.2x10
-7
eV
d) Convertir 279 nm a Kcal/mol.
Desarrollo: Usamos el factor , remplazando x queda:
3.00x10
17
x
3.00x10
17
500
= 6
14
Hz
1.24x10
-4
x
1.24x10
-4
200
2.86x10
4
x
2.86x10
4
279
=102.5Kcal/mol
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
71
2.5. Espectro electromagntico: Como la radiacin electromagntica tiene
propiedades ondulatorias, debe ser posible tener toda una serie que vari en longitud de onda
o en frecuencia; por lo tanto puede tomar cualquier valor dentro de un rango dado. Al conjunto
de posibles valores de la longitud de onda (o de la frecuencia), se denomina espectro
de la radiacin electromagntica. Con el nombre de espectro se designa, en
general, la distribucin de valores que puede tomar cualquier cantidad fsica.
Las ondas electromagnticas ms conocidas son las que ocupan una regin muy pequea
del espectro, denominada regin visible. Corresponde a las frecuencias (o longitudes
de onda) que puede resolver el ojo humano y que llamamos colores. Las otras radiaciones
se comportan de la misma manera que la luz, presentan: Refraccin, Refexin, difraccin,
interferencia y polarizacin en condiciones apropiadas.
Cuando vemos en la naturaleza el arco iris o los colores cuando la luz blanca la
descomponemos con un prisma (ver figura 2.10) observamos la regin visible (abreviada
VIS) del espectro electromagntico.
El rango de valores de la regin visible algunos lo toman de 400 a 800 nm, otros de 350 a 700
nm; por lo cual no hay fronteras rgidas. En el arco iris no podemos decir exactamente en
que punto termina un color y comienza el siguiente. Un espectro que tiene esta caracterstica
se denomina espectro continuo; todos los valores de la cantidad fsica son posibles. A
ambos lados de la regin visible se encuentran otras.
Figura 2.10 descomposicin de la luz blanca mediante un prisma.
A medida que la longitud de onda disminuye (l -0), encontramos la regin ultravioleta
Infrarrojo
Visible
Ultravioleta
Rojo
Anaranjado
A
m
arillo
V
e
rd
e
A
z
u
l
A
il
V
io
le
ta
Luz blanca
Prisma
Longitudes de onda
400 nm
760 nm
72
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
(abreviada UV), la cual se subdivide para su estudio en dos regiones: UV vaco y UV
cercano o del cuarzo, en algunos otros campos la subdividen como radiaciones: UV-
A, UV-B y UV-C; la regin de los rayos X y la regin de los rayos gamma gcuya longitud
tan pequea se expresa en unidades , a la derecha de la regin visible (l ), se encuentra
la regin del infrarrojo (abreviada IR) la cual se divide en tres franjas o subregiones: IR
cercano (near), IR mediano (medium) o fundamental, IR lejano (far); luego estn
las regiones de micro ondas (microwave), ondas de radio, ondas de televisin (TV)
y ondas de corriente alterna. Cada una de las regiones antes mencionada tiene diferente
origen y aplicabilidad. De acuerdo con la fuente que produce la radiacin electromagntica
sta tendr una longitud de onda que se localizar en alguna de las regiones del espectro. Ver
cuadro 2.2 en el cual se encuentran algunas fuentes de radiaciones electromagnticas, tipo
de radiacin o regin a la cual corresponden, longitud de onda creciente en el sentido
ascendente de la fecha, aumento de la frecuencia en el sentido descendente
de la fecha, aumento de la energa en el sentido descendente de la fecha.
Cuadro 2.2. Resumen de las regiones del espectro electromagntico, considerando:
las fuentes de radiaciones de las diferentes regiones, los rangos aproximados de
longitudes de onda y frecuencia como tambin el comportamiento de la energa.
Baja energa
A
u
m
e
n
t
o
d
e
l
a
e
n
e
r
g
a
d
e
r
a
d
i
a
c
i
n
Alta energa
Tipo de radiacin E-M Fuente de radiacin Longitud de onda Frecuencia
Corriente elctrica
oscilante
Corriente alterna
de 50 ciclos
Molculas vibrantes (calor)
Oscilaciones de los
electrones en los lmites de
los tomos
Oscilaciones de los
electrones que aumentan
dentro de los tomos
Fisin nuclear y
reacciones de fusin
(radiactividad)
Radio de onda
larga
Radio AM
Radio FM
TV
Microondas
Infrarrojo
Visible
Ultravioleta
Rayos X
Rayos gamma
o csmicos
Kilmetros
Metros
nm
mm
cm
Fracciones pequeas
de angstroms
10
0
seg- 1
10
5
seg- 1
10
11
seg- 1
10
14
seg- 1
10
16
seg- 1
10
20
seg- 1
10
22
seg- 1
{
{
mm
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
73
Para las tcnicas analticas relacionadas con nuestro curso de anlisis instrumental I solo nos
interesan las regiones UV, VIS e IR del espectro electromagntico cuyo rangos de ,,
y E se resumir el cuadro 2.3.
Regin
Rango en l
Rango en
Rango en Rango en
UV 10 a 400 nm
10
6
a 25x10
3
cm
-1
3x10
16
a 7.5 x 10
14
s
-1
7.5x10
14
a 4.965x10
-19
J
Sub-regin UV vaco 10 a 200 nm 10
6
a 5x10
4
cm
-1
3x10
16
a 1.5 x 10
15
s
-1
1.986x10
-17
a 9.93x10
-19
J
Sub-regin UV del cuarzo o cercano 200 a 400 nm 5x10
4
cm
-1
a 25x10
3
cm
-1
1.5 x 10
15
a 7.5 x 10
14
s
-1
9.93x10
-19
a 4.96 x10
-9
J
VIS 400 a 800 nm 25x10
3
a 12500 cm
-1
7.5 x 10
14
a 3.75 x 10
-14
s-
1
4.96 x10
19
a 2.48x10
-19
J
IR 0.75 a 300 m 13300 a 33 cm
-1
4x10
14
a 1x10
12
s
-1
2.64x10
-19
a 6.62x10
-22
J
Sub-regin IR cercano 0.75 a 2.5 m 13300 a 4000 cm-
1
4x10
14
a 1.2x10
14
s
-1
6.62x10
-22
a 7.94x10
-20
J
Sub-regin IR fundamental 2.5 a 25 m 4000 a 400 cm-
1
1.2x10
14
a 1.2x10
13
s
-1
7.94x10
-20
a 7.94x10
-21
J
Sub-regin IR lejano 25 a 300 m 400 a 33 cm
-1
1.2x10
13
a 1x10
12
s
-1
7.94x10
-21
a 6.62x10
-22
J
Cuadro 2.3 Resumen de las regiones, subregiones y rangos de longitud de onda (l ),
nmero de onda (), frecuencia (), y energa (), de la radiaciones electromagnticas
de uso frecuente en instrumentacin qumica.
2.6 Interaccin de las radiaciones electromagnticas con la materia.
Las radiaciones electromagnticas pueden interactuar con la materia: tomos, iones o
molculas, ocasionando como consecuencia los fenmenos de transmisin, refraccin,
refexin, dispersin, absorcin o interferencia.
2.6.1 conceptualizacin de trminos:
a) Transmisin: La radiacin se transmite cuando al pasar a travs de un medio no
hay desviacin ni absorcin signifcativa. Lo cual se manifesta experimentalmente cuando la
radiacin pasa por una sustancia transparente. Se observa que la velocidad de propagacin en
dicha sustancia es menor que en el vaco, dependiendo de las caractersticas y concentracin
de tomos, iones o molculas del medio; por consiguiente se deduce que la radiacin debe
interactuar de alguna forma con la materia; al no observarse un cambio en la frecuencia (ver
figura 2.5), la interaccin no puede involucrar una transferencia permanente de energa.
b) Refraccin: La radiacin se refracta cuando al incidir de un medio a otro en forma
no perpendicular, se desva de su direccin y cambia su velocidad. En forma experimental,
se observa un cambio brusco en la direccin, cuando la radiacin incide con un ngulo en
74
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
la interfase entre dos medios transparentes que tienen densidades diferentes, fenmeno
conocido como refraccin y que analizaremos con mayores detalles en el estudio de la
tcnica analtica refractomtrica.
C) Reflexin: La radiacin se refeja al encontrar la frontera entre dos medios rebotando
para seguir en el primer medio. La refexin se produce cuando la radiacin atraviesa una
interfase entre medios con diferente ndice de refraccin.
d) Dispersin: Un haz de radiaciones se dispersa cuando al pasar de un medio a otro,
cada radiacin se desva con un ngulo diferente. En otros trminos se denomina dispersin
a la variacin del ndice de refraccin de una sustancia con la variacin de la longitud de onda
o la frecuencia.
e) Absorcin: Se presenta absorcin de radiacin cuando de un haz de radiaciones que
incide sobre una sustancia, ciertas radiaciones de determinada longitud de onda o frecuencia,
pueden ser eliminadas selectivamente del haz al ser absorbidas por la sustancia.
f) Interferencia: Efecto que producen radiaciones electromagnticas semejantes que
pasan por la misma regin.
g) Difraccin de radiacin: La radiacin electromagntica normalmente se desplaza
en lnea recta. Sin embargo, cuando pasa por un borde agudo o por una abertura estrecha se
desva ocasionndose el fenmeno de difraccin, una parte aparece en reas que deben
encontrarse en la sombra del objeto en su trayectoria, esta desviacin de la radiacin es una
forma de difraccin, y es consecuencia directa de la interferencia.
Figura 2.11 Diagrama resumen de las interacciones de las radiaciones
electromagnticas con la materia
UV
VIS
IR
Materia:
tomos
Iones
Molculas
Consecuencia:
Transmisin
Refraccin
Reflexin
Dispersin
Absorcin
Interferencia
Radiacin
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
75
2.7 Taller
Para el Qumico analista en sus trabajos con tcnicas espectroscpicas es de gran
importancia saber ubicar cada una de las regiones del espectro electromagntico (en que trabajan
los equipos, absorben y emiten los tomos, iones y molculas) en longitud de onda (), nmero de
onda (), Frecuencia (), y energa (). Para lo cual debe conocer las unidades, equivalencias,
manejar los factores de conversin y las relaciones matemticas para hacer los clculos. Los ejercicios
propuestos en el presente taller tienen esta fnalidad. Aplicando los conceptos y relaciones explicadas
en la clase realice los siguientes ejercicios:
2.7.1. Calcule la frecuencia () en hertz (Hz) y el nmero de onda () en cm
-1
para:
a) Un haz monocromtico de rayos X con longitud de onda (l ) de 7.0 ngstrom (.)
b) La lnea D del sodio de 589.0 nm.
c) Un pico de absorcin infrarroja en 15.6 m.
d) Un haz de microondas de longitud de onda 180 cm.
e) Las lneas de emisin de cobre de 324.7 nm y del potasio de 766.5 nm.
f) Las lneas de absorcin del calcio de 422.7 nm y la del hierro de 248.3 nm.
g) El mximo de absorcin en la regin ultravioleta de la acetona a 279 nm.
h) El mximo de absorcin en la regin del visible de una solucin de cloruro de cobalto a 510 nm.
i) El mximo de absorcin del grupo carbonilo a 5.88 m en la regin infrarroja.
Ij) Las lneas C y F del hidrgeno 656 y 486 nm respectivamente.
2.7.2. Calcule la energa de cada uno de los fotones del ejercicio 1 en Julios por fotn (J/ fotn),
Kcal por mol (Kcal/mol), y eV.
2.7.3. Mediante relaciones matemticas demuestre que :
2.7.4. Calcule la velocidad (V), longitud de onda (l ) y la frecuencia () de la lnea D del sodio (5890
en el vaco) cuando se transmite por:
a) aire ndice de refraccin
D
n (1.00027),
b) una solucin de ndice de refraccin (
D
n ) de 1.4352.
c) un slido de ndice de refraccin (
D
n ) de 2.3758.
Calcule velocidad (V), la longitud de onda (l ) y la frecuencia () de la lnea del litio (670.8 nm
l medio
=
l
vacio
n
=
76
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
en el vaco) cuando se transmite por:
a) Agua ndice de refraccin de 1.3330
b) Vidrio ndice de refraccin de 1.5137
Qu conclusin obtiene del presente ejercicio (4)?
2.7.5. Para confrmar los datos del cuadro 2.3 calcule el rango en: (l ), () , () , (). de las
siguientes regiones del espectro-electromagntico
a) Ultravioleta (UV) Vaco.
b) Ultravioleta (UV) cercano o del cuarzo.
c) Regin visible (VIS).
d) Regin Infrarroja (IR): (IR) cercana, (IR) fundamental y (IR) lejano.
2.7.6. Defna los siguientes trminos relacionados con las radiaciones electromagnticas e identifque
aquellos por el smbolo con el cual se representan: Radiacin electromagntica, energa radiante,
onda, fotn, quantum, refraccin, dispersin, difraccin, refexin, polarizacin, absorcin, emisin,
interferencia, interferencia constructiva, interferencia destructiva , fase, ngulo de fase, coherencia,
amplitud, nmero de onda, frecuencia angular, frecuencia ptica, longitud de onda, periodo, energa,
intensidad, potencia, constante de Planck, velocidad de la radiacin, ndice de refraccin, haz de luz,
frente de ondas, lser, ergio, julio, calora mol, kilo calora mol, electrn voltio, hertz, ciclo, nanmetro,
micrmetro, espectro electromagntico, regin de: rayos gamma, rayos x, regin de radiaciones:
ultravioleta, visible, infrarroja, micro-ondas.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
77
Bibliografa
CHERIM, Stanley M. Qumica aplicada (1a Ed.) Mxico: ED. Interamericana S.A., 1974.
HARRIS, C Daniel. Anlisis qumico cuantitativo. (3a Ed.) Espaa : Editorial Reverte S.A.,
c2007.
HARVEY, David Qumica Analtica Moderna (1.Ed). Espaa. ED Mcgraw-Hill 2002.
MARN VILLADA, Fabio. Conferencias Anlisis Instrumental. Material mimeografado UTP.
RESNICK, Robert; Halliday David. Fsica Tomos I, II. (4a. ed). Mxico: ED, Continental,
1982
SKOOG, Douglas A. WEST Donald M. HOLLER F. James. Qumica Analtica (6a. Ed).
Colombia: ED Mcgraw-Hill 1.999.
SKOOG, Douglas A. ,LEARY, James J. Anlisis Instrumental (4a. ed ) Espaa: ED, McGraw-
Hill 1.994.
SKOOG, Douglas A; Holler F James; Nieman Timothy A. Principios de Anlisis Instrumental
(5. Ed). Madrid: ED Mcgraw-Hill 2000.
SKOOG, Douglas A; Holler F James; Crouch, Stanley R. Principios de Anlisis Instrumental
(6. Ed). Mxico: ED Cengage Learning 2008.
STROBEL, Howard A. Instrumentacin Qumica (1a. ed.). Mxico: Limusa, S.A., 1982.
WILLARD, Hobart H., Merritt, Lynnel., y Dean John A. Mtodos
Instrumentales de Anlisis (7a. ed ).Mxico: ED, Grupo Editorial Iberoamrica, 1.991.
78
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
79
TERCERA
UNIDAD
80
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
81
TERCERA UNIDAD
5
1
Refractometra
3.1 Generalidades: Cuando la radiacin atraviesa un medio transparente, se produce
accin reciproca entre el campo elctrico de la radiacin y los electrones de enlace de la
materia, como consecuencia la velocidad de propagacin del haz es menor que en el vaco.
(c)
Figura 3.1 Ilustraciones sobre el fenmeno de la refraccin: a una fotografa que
muestra la refraccin y la reflexin en un plano aire agua, b una representacin
utilizando rayos, c una observacin cotidiana.
5 Materiales recopilados y organizados por el profesor Federmn Castro Eusse para la asignatura Anlisis Instrumental I.
Posicin real de la moneda
La moneda se ve aqu
82
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
La radiacin se refracta cuando al incidir de un medio a otro en forma no perpendicular,
se desva de su direccin y cambia su velocidad. En forma experimental, se observa un
cambio brusco en la direccin, cuando la radiacin incide con un ngulo en la interfase entre
dos medios transparentes que tienen densidades diferentes; fenmeno conocido como
refraccin el cual es el fundamento de la tcnica analtica refractomtrica ver figura
3.1.
El ndice de refraccin que se simboliza por la letra (n) es igual a la relacin de la velocidad
de la radiacin en el vaco (V
vaco
), con relacin a la velocidad de la radiacin en el medio i,
(V
i
) valor que es constante a una longitud de onda (l ) y a una temperatura dada, cuando el
medio es un gas la presin debe ser tambin constante. n= V
vaco
/ V
i
; Cuando el medio es
el vaco todas las radiaciones se propagan con igual velocidad, dicha velocidad se simboliza
por la letra ( C ), conocida como la constante de la velocidad de la luz = 2.9979 X 10
10
cm s
-1
aproximadamente igual a 3 X 10
10
cms
-1
; por lo tanto n= C / V
i
. Relacin conocida
tambin como constante de refraccin.
El ndice de refraccin (n) no tiene unidades, por ser una relacin de velocidades las
unidades se cancelan, es igual o mayor que la unidad, es difcil encontrar una sustancia
donde la radiacin tenga una velocidad mayor que en el vaco para que ste fuera menor que
la unidad. El ndice de refraccin varia para muchos lquidos entre 1.3 y 1.8 y en slidos entre
1.3 y 2.5; en conjunto con La densidad, el punto de fusin y el punto de ebullicin, el ndice de
refraccin es una de las constantes fsicas usadas para describir una especie qumica. Aunque
es una propiedad no especfca, pocas sustancias tienen ndices de refraccin idnticos a
una temperatura y longitud de onda dada. As, esta constante es til para confirmar la
identidad de un compuesto y medir su pureza; Por ejemplo, el ndice de refraccin
del agua es 1.3330 medido a 20 C y a una longitud de onda de 589 nm, el del benceno
es 1.4979 medido en iguales condiciones, cualquier desviacin de estos valores puede
atribuirse a impurezas presentes en la sustancia. Adems es empleado para el anlisis
cuantitativo de mezclas o soluciones.
Combinado con otras mediciones, como la refraccin especfca, la refraccin molar y la
refraccin molar calculada mediante las refracciones atmicas, el ndice de refraccin brinda
informacin sobre la estructura y peso molecular de una sustancia.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
83
a b
Figura 3.2 En la figura a N (lnea a trazos) es la normal, la lnea horizontal continua
representa la interfase,
1 ngulo de incidencia,
2 ngulo de refraccin
, M
1 medio menos denso,
M
2 medio ms denso
.
En la figura b, medio menos denso el aire, medio ms denso el agua, lnea a trazos
normal.
El ndice de refraccin de una sustancia pura depende de la naturaleza de la sustancia,
de la longitud de onda de la radiacin con que se mida, de la temperatura y en los
gases y vapores es necesario considerar la presin (ver cuadro 3.1). Para el caso de
sustancias en solucin depende adems, de la concentracin. Generalmente el ndice
de refraccin se mide con la luz amarilla del sodio de 589.3 nm (conocida como la lnea D
del sodio o como doblete del sodio 589.3 589.6 nm), a 20 C y se simboliza como
n
20
,
notacin que se interpreta como ndice de refraccin medido a 20 C con la lnea
D del sodio y con relacin al aire. Para medir dicho parmetro el instrumento ms
empleado es el refractmetro Universal de Abb. (Abb: Fsico Alemn conocido
por sus trabajos sobre ptica y por la construccin del celebre refractmetro que lleva su
nombre).
Cuadro 3.1 Ilustracin de la variacin del ndice de refraccin del agua con la longitud
de onda y la temperatura.
N
M
2
M
1
interfase
2
Angulo en el aire
Angulo en el agua
D
Longitud de la onda
COLOR
Smbolo
o lnea de
Fraunhofer
Elemento de
la fuente
nm
Rojo C H 656.3
Amarillo D Na 589.3
Azul F H 486.1
Violeta G Hg 435.8
G H 434.0
Temperatura
o
C
D
n
20
n
l
1.3312
1.3330
1.3371
1.3403
1.3404
10
20
30
40
50
1.3337
1.3330
1.3320
1.3306
1.3290
84
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
3.2 Leyes de la refraccin: al enunciar las leyes de la refaccin se defne la normal
como la perpendicular a la superfcie en el punto de refraccin, Ver figuras3.1 b, 3.2 a y
b. Todos los ngulos se miden a partir de la normal.
3.2.1 Primera ley: El rayo refractado esta en el mismo plano que el rayo incidente y la
normal ver figura 3.3
Figura 3.3 Ilustracin leyes de la refraccin
3.2.2 Segunda ley: El seno del ngulo de incidencia dividido por el seno del ngulo de
refraccin es constante para una longitud de onda dada y un par de medios dado; los ngulos
estn a los lados opuestos de la normal ver figura 3.3. La segunda ley es conocida como
la ley de Snell (1.591-1.626 geometra y fsico Holands descubridor de las leyes de la
refraccin, llamado Snellius). Y enunciada como: n= sen i / sen r.
Segn la figura 3.2 el ndice de refraccin del agua se calcula como
n
=
----------------------------------------- = ----------------------------------- = -------------= 1.3330
3.2.3 Demostracin de la ley de Snell: Mediante las figuras 3.4 y 3.5 se
explicar paso a paso la demostracin de la citada ley.
rayo
incidente
Primer medio
Refraccin
Segundo
medio
normal
SUPERFICIE
seno del ngulo en el aire
Seno del ngulo en el agua
Seno de 20 10
Seno de 15 00
0.345
0.2588
i
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
85
Figura 3.4
El frente de ondas AB que avanza en el medio 1 (aire) al tocar el medio 2 (agua) en
el punto A, en el medio 2 se propaga ms lentamente.
En la figura 3.5 vemos que el ngulo i (ngulo de incidencia) es igual al ngulo
BMA, por tener los ngulos BMA y POB los lados perpendiculares.
El ngulo de refraccin r es igual al ngulo AMN por tener los ngulos QOS y AMN
los lados perpendiculares.
Por la definicin de seno:
sen i = BM/MA
sen r = AN/ MA
n
1
V
1
c
=
B
P
M
MEDIO 1 = Aire
0
i
i
r
A
N
Q
S
r
MEDIO 2 = Agua
n
2
V
2
c
=
86
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Mientras en el medio 1 en un
tiempo t avanza una distancia
BM, en el medio 2 avanza AN.
v=distancia/tiempo
Si V
1
es la velocidad en el medio 1
y V
2
la velocidad en el medio 2:
n
1
= C / V
1
n
2
= C / V
2
BM = V
1
t
AN = V
2
t
Figura 3.5 El rayo es perpendicular al frente de las ondas, y la normal es
perpendicular a la superficie de separacin.
Dividiendo sen i entre sen r obtenemos:
2
1
V
V
Senr
Seni
=
1
2
2
1
n
n
n
C
n
C
Senr
Seni
= =
Senr n Seni n
2 1
=
Luego:
Senr
Seni
V
V
n
n
= =
2
1
1
2
(ecuacin 3.1)
3.3 Instrumentos para medir el ndice de refraccin (n): Hay dos tipos los
refractomtricos y los interferomtricos; los refractomtricos se basan en la
medicin del llamado ngulo crtico o en la determinacin del desplazamiento de
una imagen. Los interferomtricos utilizan el fenmeno de la interferencia para obtener
ndices de refraccin diferenciales con una precisin muy alta y son utilizados en la medicin
de ndice de refraccin de gases. Los ms usados son los de ngulo crtico.
3.3.1 Refractmetros de ngulo crtico: Se defne el ngulo crtico como
el ngulo de refraccin en un medio cuando el ngulo de la radiacin incidente es de 90
grados (denominado tambin ngulo rasante), ver figura 3.6, es decir cuando sen i
en la ecuacin 3.1 es 90 grados, seno r se convierte en el ngulo crtico
c
as
B
P
M
0
i
i
r
A
N
Q
S
r
2
1
V
V
Senr
Seni
=
BM
MA
MA
AN
BM
AN
=
V
2
t
V
1
t
=
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
87
tenemos que : n
2
/ n
1
= sen 90 / sen
c
= 1 / sen
c
. La figura 3.6 a ilustra
el ngulo crtico que se forma cuando el rayo crtico se acerca a la superfcie del
medio M
2
a 90 grados con relacin a la normal y es refractado en cierto punto O de la
superfcie.
Debe observarse que si pudiera verse el medio en el extremo, como en la figura 3.6 b el
rayo crtico aparecera como el lmite entre un campo oscuro y un campo iluminado. Pero la
ilustracin no es real por que los rayos se representan como entrando en el medio
en un solo punto O; en realidad, se esperara que entraran en todos los puntos a lo largo de
la superfcie y crearan as una familia entera de rayos crticos con el mismo ngulo
c
, se
necesita una lente condensadora o enfocadora para producir un solo lmite oscuridad luz tal
como el representado en la figura 3.6.
Es interesante entender que el ngulo crtico depende de la longitud de onda. As, s se
emplea radiacin policromtica, no se observa un solo lmite ntido como el de la figura 3.6
b, si no que hay una reaccin cromtica difusa entre las reas de luz y oscuridad; as,
es imposible el establecimiento preciso del ngulo crtico. Difcultad que es superada
con el uso de radiacin Monocromtica; por lo cual muchos refractmetros de ngulo
Figura 3.6 a ilustracin del ngulo crtico
c
, y el rayo crtico A O C; b vista del extremo
mostrando lmite preciso entre los campos oscuro e iluminado formados en el ngulo
crtico.
crtico contienen un compensador que permite el uso de radiacin de una fuente de tungsteno,
que compensa la dispersin resultante de tal modo que da un ndice de refraccin en funcin
de la lnea D del sodio. El compensador consta de uno o dos prismas de Amic (Amic:
Fsico optmetra diseador del prisma) como se ve en la figura 3.7. Las propiedades de
Aire
0
A
B
C
D
B
D
C
Rayo
critico
M
2
(a) (b)
88
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
este complejo prisma son tales que la radiacin dispersada converge dando un haz de luz
blanca que se desplaza en la trayectoria de la lnea amarilla D del sodio.
Figura 3.7 Prisma amic para compensacin de la dispersin ocasionada por la
muestra. Obsrvese que la trayectoria de la radiacin amarilla ( lnea D del sodio ) no
es desviada por el prisma.
Cuando se mide el ndice de refraccin de una sustancia en un refractmetro de Abb, lo que
realmente se mide es el ngulo a emergente ver figura 3.8 ya que el ngulo de refraccin
se forma dentro del prisma de medicin lo cual hace que no sea medible.
Para la medicin del ndice de refraccin segn la ley de Snell y considerando el ngulo
de incidencia rasante y el ngulo critico se tiene: n
2
/ n
1
= sen i / sen r,
luego n
2
/ n
1
= sen90 /sen r luego, n
2
/ n
1
= 1 / sen r, por consiguiente si se
conoce n
1
o n
2
, el otro puede encontrarse mediante la medicin del ngulo crtico en
el medio 2. Al hacer la observacin para medir el ndice de refraccin, el medio 1 es
generalmente la muestra, y el 2 un prisma de ndice de refraccin conocido. El
prisma de medicin del refractmetro de Abb tiene un ndice de refraccin conocido
que normalmente es de 1.700 en algunos instrumentos y en otros de 1.7100.
Es conveniente aclarar que el ndice de refraccin del prisma de medicin limita el
mximo ndice de refraccin que se puede medir con el instrumento. No puede medirse el
ndice de refraccin de una sustancia que tenga un ndice de refraccin mayor que el ndice
de refraccin del prisma de medicin ya que el resultado es una refexin total.
Como ejemplo, cuando medimos el ndice de refraccin del agua a 20 C con la lnea D del
sodio el cual es de 1.3330, lo que realmente se mide es un ngulo 513748. Dato que se
deduce de:
luz
dispersada
Rojo
Azul
Amarillo Luz blanca
Vidrio en hojas
Vidrio en hojas
Vidrio duro
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
89
senr n
n 1
1
2
=
senr
1
3330 . 1
700 . 1
=
7841 . 0
700 . 1
3330 . 1
= = senr
51.63 que equivale a 513748. En la escala del instrumento leemos un valor equivalente
a 1.3330.
Los instrumentos usados para la determinacin del ndice de refraccin son: El refractmetro
de Abb, el refractmetro de inmersin, el refractmetro de Pulfrich, el sacarmetro, el
interfermetro y el refractmetro registrador electrnico. Hay diseos de refractmetros de
bolsillo, manuales, semiautomticos, automticos etc.
El refractmetro de Abb es el ms comnmente usado, su sensibilidad es de 0.0001 (cambio
en el n) y normalmente cubre el rango de 1.3000 a 1.7100, puede operar con luz de lmpara
de sodio o con luz blanca comn y corriente, requiere slo dos o tres gotas de muestra para
efectuar la determinacin del ndice de refraccin.
Figura 3.8 Ilustracin del ngulo emergente
El refractmetro de inmersin se usa para anlisis en serie su sensibilidad es de 0.00001
(cambio en el n) y normalmente cubre el rango de 1.3254 a 1.6470 pero usando varios juegos
de prismas que deben cambiarse segn la parte del rango que interese, no da directamente
la lectura del ndice de refraccin, sino una lectura sobre una escala dividida en 100 partes
y requiere el uso de tablas especiales de conversin, se necesitan entre 10 y 15 mililitros de
muestra para hacer la medicin y puede operar con luz blanca o con lmpara de sodio.
r = al arco cuyo seno es 0.7841
sen
-1
0.7841 = 51.63
Visor telescpico
de campo
Muestra
Prisma de
refraccin X
M
90
o
f
c
90
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
El refractmetro de Pulfrich da una sensibilidad de 0.00002 (cambio en el n), pero requiere el
uso de luz monocromtico (de una sola longitud de onda) y entre 3 y 5 mililitros de muestra.
El sacarmetro es un refractmetro compacto que usa un sistema similar al refractmetro
de Abb, especialmente diseado para determinar el contenido de azcar en soluciones.
El interfermetro hace la medicin con base al efecto que el poder refractivo de la
sustancia ejerce sobre las lneas de interferencia de una rendija de difraccin. Su sensibilidad
es de 0.0000001 (cambio en el n), y no requiere control tan riguroso de la temperatura como
en los otros instrumentos. Usa luz blanca de una lmpara de tungsteno.
El refractmetro registrador convierte la diferencia entre el ndice de refraccin de la
sustancia a analizar y el de una lente de referencia en una seal electrnica, la cual una vez
amplifcada mueve un sistema registrador calibrado para indicar el ndice de refraccin de la
sustancia a analizar.
Existen muchas casa productoras de refractmetros a nivel mundial entre las cuales se
pueden citar: American optical, Bausch and Lomb (americana), Bellinghan and Stanley
(Inglesa), Carl Zeiss (Alemana), y otras ms. En el cuadro 3.3 se puede observar las
caractersticas tcnicas de algunos otros modelos de refractmetros. Existen en el mercado
una gran variedad de modelos tanto de ngulo crtico como de desplazamiento de imagen,
con diseos especiales desde los ms sencillos de bolsillo para medir el Brix en la industria
alimentara y laboratorio clnico, como los de diseos especiales usados como detectores
en equipos cromatogrfcos (Tcnica de Schlieren), Tambin existen los refractmetros foto
elctricos y de lectura digital.
3.3.1.1 Refractmetro de Abb
Es un instrumento que sirve para determinar el ndice de refraccin de una sustancia con la lnea
D del sodio, as como sus propiedades dispersivas, usando luz blanca o luz solar. La
luz blanca es una mezcla de radiaciones con longitudes de onda desde 400 hasta 800 nm.
3.3.1.2 Partes de un Refractmetro de Abb.
Independientemente del modelo, diseo o marca, un refractmetro de Abbe consta de las
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
91
1.30 a 1.70
1.30 a 1.70
1.30 a 1.60
1.30 a 1.84
(3 prismas)
1.325 a 1.367
1.325 a 1.647
(10 prismas)
Sin lmites
__
1.30 a 1.90
Lquidos
Gas, celda larga
__
siguientes partes esenciales:
a) Fuente de luz blanca: la luz solar, un bombillo o una lmpara. (Observar fgura 3.9)
b y c) Dos primas de vidrio (calidad ptica: Crown glass o Flint glass)
o cuarzo: entre estos dos prismas se coloca la sustancia cuyo ndice de refraccin se va a
determinar, requirindose muy poca cantidad de muestra, una gota puede ser sufciente. El
prisma b se denomina prisma de iluminacin, se distingue por que la superfcie que toca la
sustancia no es pulida. No debe ser pulida para que produzca luz difusa que penetre a la sustan-
cia a analizar en diferentes direcciones.
Cuadro 3.3 Caractersticas tcnicas de algunos refractmetros.
El prisma c se denomina prisma de medicin y tiene la superfcie pulida. Es esencial conser-
varla pulida, no se debe rozar con pipetas de vidrio u objetos que puedan rayarla.
d) Espejo giratorio: Sobre este espejo llegan los rayos que se refractan al pasar de la
sustancia al prisma de medicin y producen una zona iluminada y una zona oscura
donde no llega ningn rayo.
Principio de operacin
y tipo
Mediciones del ndice de refraccin
Absoluta Diferencial
Tamao de
muestra
lquida, mL
Mejor aplicacin
Alcance Presicin Alcance Presicin
Angulo critico
1. Abbe
2. Abbe de precisin
3. Pulfrich
4. De inmersin
Desplazamiento de imagen
1. Espectrmetro de
prisma
2. Diferencial
3. Fisher
Interferencia
1. Interfermetro
2. Refractmetro de
interferencia (con
microscopio)
1 x 10
-4
1 x 10
-5
1 x 10
-4
1 x 10
-5
1 x 10
-6
__
2 x 10
-3
__
+
+
+
+
+
+
__
__
0.05
__
__
0.001
__
0.050
0.0000
0.00005
0.002
__
__
3 x 10
-5
__
__
3 x 10
-6
2 x 10
-5
2 x 10
-7
3 x 10
-8
2 x 10
-6
__
+
+
0.05 a 0.10
0.05 a 0.10
0.5 a 5
5 a 30
10 a 25
5
0.05
0.10
8
1
Analtica rutinaria
Analtica de presicin
Mediciones diferenciales y
dispersin
Pruebas rutinarias de precisin
de productos lquidos
Mediciones absolutas de alta
precisin
Diferencial preciso
Trabajos cualitativos
Mediciones diferenciales de alta
precisin
Mediciones de alta precisin
{
celda corta
celda larga
92
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
La posicin del lmite de las dos zonas depende del ndice de refraccin de la sustancia que se
coloque entre los prismas. El control que gira este espejo se llama perilla de medicin.
Girando el espejo se puede hacer que el rayo llegue hasta el ocular.
e) Escalas de lectura: Hay una escala de ndices de refraccin y otra en porcentaje
que corresponde a grados Brix o porcentaje de slidos en solucin acuosa. Estas escalas
van unidas al espejo que se mueven cuando el espejo gira.
f) Prismas Amici giratorios o Compensador de dispersin: Con base en el giro
de estos prismas se pueden determinar las propiedades dispersivas de la sustancia, as:
la luz blanca al refractarse se dispersa en los colores que la componen; por eso el lmite entre
la zona oscura y la zona iluminada aparece coloreado. Girando el compensador de dispersin
se vuelven a mezclar los colores hasta obtener un lmite bien defnido y no coloreado. La
magnitud de giro necesario se lee en una escala y se denomina factor de dispersin Z.
Figura 3.9 Esquema de las partes de un refractmetro de Abb
i
e
h
f
g
d
c
b
a
Ocular
Campo de
visin
Telescopio
fijo
Lente
Rayos
Criticos
Muestra
Bisagra
Luz blanca
Rayos no
Criticos
Prismas
Amici
ajustables
Ocular
para leer la
escala
Escala
graduada
Montaje del
prisma
rotatorio
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
93
La dispersin media D, se calcula como A + Bb. (caractersticas de cada aparato). El
valor de las constantes A y B se obtienen de tablas con base en el dato del ndice de refrac-
cin de la sustancia, la constante b se obtiene de tablas con base en el dato del factor de
dispersin.
(g, h, i) Lente de calibracin, retculo y ocular de enfoque: El retculo h son
dos lneas muy fnas que se cortan en cruz, trazadas sobre un vidrio esmerilado que sirve
como pantalla receptora del rayo de luz.
Aqu observamos la zona oscura y la zona iluminada si miramos por el ocular de enfoque,
i.
3.3.1.3 Calibracin:
El Refractmetro se puede calibrar usando un lquido o un vidrio de ndice de refraccin
conocido que normalmente viene con el instrumento.
La calibracin con el vidrio tiene como ventaja que es un slido y es menos afectado por
la temperatura, pero tiene el inconveniente que es necesario utilizar un liquido de contacto que
tenga un ndice de refraccin entre el ndice de refraccin del slido y el prisma de medicin,
normalmente se utiliza la bromo naftalina que tiene un n
20
de 1.6580 Pero tiene un
olor desagradable y es cancerigena, por lo cual se prefere la calibracin con un lquido. El liquido
puede ser tolueno que tiene un n
20
de de 1.4969 o metilciclohexano cuyo n
20
es
1.4231 dichas sustancias son certifcadas por Nacional Bureau of standards siendo
muy costosas. Por estas razones cuando no se requiere una alta exactitud y precisin en la
medicin, el refractmetro se calibra con agua de alta pureza pudindose usar agua destilada,
cuyo n
D
se conoce mediante tablas a diferentes temperaturas; lo cual permite una calibracin
rpida cuando no se tiene un sistema termostatizado que estabilice la temperatura a 20 C que
seria la condicin ideal. El ndice de refraccin medido a una sustancia con el refractmetro as
calibrado se corrige a 20 C mediante la siguiente frmula:
n
20 =
n
t
+ 0.0004(t - 20) , donde n
20
es el ndice de refraccin del compuesto corregido a
20 C,
t
D
n es el ndice de refraccin del compuesto medido a la temperatura t , 0.0004 es un
factor de correccin promedio aplicado a la gran mayora de los compuestos orgnicos, (para el
agua el factor es 0.0001), t es la temperatura de medicin.
D
D D
D D D
94
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Cuadro 3.2 ndice de refraccin del agua de 15 a 26 C medido con la lnea del
sodio.
3.3.1.4 Refractmetro Abbe-3L Fisher Scientific
3.3.1.4.1 Instrucciones de manejo, Calibracin y Medicin
1. Ubique el refractmetro en un lugar frme y seguro.
2. Retire la funda protectora. No olvide colocarla nuevamente despus de su uso.
3. Conecte la clavija del cable a la red 110 V. Conecte el circuito de refrigeracin
del refractmetro a un sistema Termosttico. Seleccione preferiblemente una
temperatura de 20 grados centgrados.
4. Levante el prisma de iluminacin y limpie los prismas con agua y etanol o acetona
usando un papel o tela suave y absorbente, con el cuidado de no rayar los prismas.
Deposite unas 2 3 gotas de agua destilada sobre la superfcie del prisma de medicin
cierre los prismas. Espere de 3 a 5 segundos para que la temperatura se equilibre y
estabilice.
5. Gire el ocular, ajuste la lmpara de iluminacin hasta ver ntido el campo claro
oscuro, gire el corrector de dispersin hasta eliminar los colores interferentes y se
pueda observar ntido el claro oscuro.
6. Gire el control de medicin hasta observar que el lmite entre los campos claro y oscuro
coincida con el cruce del retculo.
7. Presione suavemente la clavija del interruptor hacia abajo y mantenindola sostenida
observe en la escala el
D
n y lea su valor con una precisin de 0.0001 unidades de
D
n .
Temperatura C
n
D
Temperatura C
n
D
15
20
19
18
17
16
1.3335
1.3330
1.3331
1.3332
1.3333
1.3334
1.3329
1.3324
1.3325
1.3326
1.3327
1.3328
21
26
25
24
23
22
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
95
8. El refractmetro se encuentra calibrado. Si para el agua el valor del es 1.3330
(a 20
C ). Si la temperatura es diferente a 20 grados C. debe dar un valor de
1.3330 ms o menos 0.0001 unidades de
D
n por grado centgrado por encima o por
debajo de dicho valor. Recuerde: el
D
n es inversamente proporcional a la temperatura.
(Ver cuadro 3.2).
9. Si el refractmetro no est calibrado rote el control de medicin hasta que el lmite
del claro oscuro coincida con el cruce del retculo, como se puede apreciar en la
figura 3.10.
10. Con la llave de calibracin (allen de 5/64) gire el tornillo de calibracin en el
sentido que sea necesario, se fja en la escala el n
D
a la temperatura de trabajo, la cual
debe ser estable, de esta forma el refractmetro queda calibrado.
11. Para medir el ndice de refraccin de una sustancia realice los pasos 4, 5, 6, y 7,
remplazando el agua por la muestra.
12. Para medir % de slidos (brix), siga los pasos 4, 5, 6 y 7 pero en lugar de leer en la
escala de n
D
, haga la lectura en la escala de grados brix.
13 No olvide dejar el equipo limpio, desconectado y con su funda protectora.
3.3.1.4.2 Error Instrumental
El error instrumental en las curvas de calibracin asumiendo un comportamiento lineal, en el
cual n = mc + b, derivando se tiene dn = mdc luego dc= dividiendo ambos miembros
por c
se tiene: = la desviacin dn es atribuible al azar ( error instrumental
el cual es indeterminado), entonces el valor
ser el error relativo en dc luego:
100
1
100 100 100 %
1 2
1 2
1 2
1 2
1 2
1 2
= =
c
dn
n n
c c
c
c c
n n
dn
c
c c
n n
dn
c
c
n
dn
mc
dn
E
Donde E es el error. %E = porcentaje de error relativo, n es ndice de refraccin, m es la
pendiente de la grfca de calibracin, c es la concentracin de la muestra problema, n
1
y
n
2
los ndices de refraccin tomados como referencia para calcular la pendiente, C
1
y C
2
las
D
n
20
D
n
m
dc
c
dn
mc
dc
c
dn
mc
dn dn 1
dn
c
2
c
1
dn
96
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
concentraciones de los patrones tomados como referencia para calcular la pendiente.
Figura 3.10 Refractmetro de Abb Referencia Abbe 3 L marca Fisher
Componentes:
1. Lmpara de iluminacin
2. Prisma de iluminacin
3. Prisma de medicin
4. Soporte prisma de medicin
5. Ventana para luz reflejada
6. Compensador de dispersin
7. Termmetro
8. Entrada agua de refrigeracin
9. Tornillo de calibracin
10. Control de medicin
11. Interruptor y lectura
12. Manguera de conexin
13. Salida agua de refrigeracin
14. Campo claro
15. Campo oscuro
16. Escala de indice de refraccin
17. Escala de grados Brix
18. Cruce del retculo
19. Ocular
10
9
19
7
6
4
8
3
2
5
1
12
13
11
14
15
17
65 70
1.450 1.460 1.470
17 18
18
16
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
97
3.4 Aplicaciones de refractometra.
La refractometra al igual que cualquier tcnica analtica tiene aplicaciones para cualifcar, es
decir, identifcar sustancias y cuantifcar o sea determinar la cantidad o concentracin de una
sustancia.
3.4.1 Anlisis cualitativo: Se realiza determinando el ndice de refraccin (n
20
)
de la sustancia desconocida, el cual se confronta con las tablas de ndices de refraccin
existentes en la literatura, ver cuadro 3.3, o ordenando a un computador interfasado
con el refractmetro, compararlos para hallar el posible o posibles compuestos a los
cuales corresponde; logrndose de esta forma la identidad del compuesto; o eliminar una
gran cantidad de la lista para luego mediante otros pruebas confrmar a que compuesto
corresponde.
La refraccin especfica (r) y refraccin molar (R) calculadas mediante la
relacin de Lorentz Lorenz, como tambin el clculo de la refraccin molar
mediante las refracciones atmicas, pueden servir para confirmar la identidad
de la sustancia.
Relacin de Lorentz Lorenz:
( )
( ) d n
n
r
1
2
1
2
2
=
, la refraccin molar (R) es igual a la
refraccin especfca (r) multiplicada por el peso molecular (M), luego M r R = . En la
relacin de Lorentz n es el ndice de refraccin del compuesto, d es la densidad. La frmula
de Lorentz es una relacin emprica que no cambia con la temperatura, tiene una base
terica para ciertas clases de lquidos y ha sido muy empleada en estudios estructurales.
El clculo de la refraccin molar mediante las refracciones atmicas se determina sumando las
refracciones atmicas correspondientes a cada uno de los elementos del posible compuesto,
multiplicndolas por el nmero de tomos de cada elemento. Las refracciones atmicas
se encuentran tabuladas en la literatura qumica ver cuadro 3.4. As cuando para un
compuesto coinciden el ndice de refraccin, la refraccin especfca, la refraccin molar y la
refraccin calculada mediante las refracciones atmicas hay una alta probabilidad de que se
trata de dicho compuesto.
La diferencia entre los ndices de refraccin para diferentes longitudes de onda es otro
importante valor caracterstico de la naturaleza de un compuesto. Se denomina dispersin
de la sustancia, y existen tres formas principales de relacionarla.
D
98
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Dispersin media ( )
4
2
1
10 * n n D =
Coeficiente de dispersin
O nmero de Abb
Dispersin especfica
Siendo n
1
el ndice de refraccin a l
1
y n
2
el ndice de refraccin a l
2
, (l
1
<l
2
) y d la
densidad de la sustancia. Generalmente l
1
es la lnea F del hidrgeno (486.1 nm), l
2
es la lnea C del hidrgeno (653.6 nm) y los ndices de refraccin correspondientes se
denominan n
f
y n
c
.
Cuadro 3.3 ndice de refraccin de varios compuestos
Cuadro 3.4 Refracciones atmicas
10
ACETONA
AGUA
CARBONO TETRACLORURO
CICLOHEXANO
CLOROFORMO
DICLOROMETANO
1,4-DIOXANO
ETANOL ABSOLUTO
METIL ETIL CETONA
GLICERINA
n-HEXANO
METANOL
n-PENTANO
1-PROPANOL
2-PROPANOL
METIL ISOBUTIL CETONA
TOLUENO
Sustancia n
D
20
p. ebull. c
densidad
g/ mL
F
C
H
O en OH
O en ester OR
O=
Cl
Br
I
S en SH
S en R
2
S
S en RCNS
S en R
2
S
2
O en ter
Nitrgeno en
en aminas alifticas primarias
en aminas alifticas secundarias
en aminas alifticas terciarias
en aminas aromticas primarias
en aminas aromticas secundarias
en aminas aromticas terciarias
Hidroxilaminas
Hidracinas
Cianuros alifticos
Cianuros aromticos
Oximas alifticas
Amidas
Amidas secundarias
Amidas terciarias
1.0
2.42
1.10
1.52
1.64
2.21
5.97
8.86
13.90
7.69
7.97
7.91
8.11
1.64
2.32
2.49
2.84
3.21
3.59
4.36
2.48
2.47
3.05
3.79
3.93
2.65
2.27
2.71
Grupo nitro en
Compuestos nitroaromticos
Nitroaminas
Nitroparafinas
Nitritos de alquilo
Nitratos de alquilo
Grupo nitroso en
Nitritos
Nitrosaminas
Unidades estructurales
Doble enlace
Sin radicales
RCH = CH
2
RCH = CHR
R
2
C = CHR
R
2
C = CR
2
Tripe enlace
Anillo de tres miembros
anillo de cuatro miembros
Grupo diazo
N
C
N
N
N
N
7.30
7.51
6.72
7.44
7.59
5.91
5.37
1.51
1.60
1.75
1.88
2.00
2.40
0.71
0.48
8.43
7.47
Elemento Elemento Na
D
Na
D
Referencias: Cohen, organic chemistry, vol II, pp. 17 - 40. 1921.
Gilman, organic chemistry, Vol II, p. 1751, 1943.
1.359
1.333
1.461
1.426
1.448
1.424
1.422
1.361
1.381
1.475
1.375
1.329
1.358
1.385
1.378
1.396
1.496
56.1
100.0
76.7
81.0
62.0
40.0
101
79.0
80.0
290
69.0
65.0
36.0
96.0
82.0
116.2
110.6
0.791
1.000
1.594
0.780
1.487
1.325
1.034
0.791
0.806
1.230
0.660
0.792
0.622
0.904
0.785
0.801
0.867
=
=
2
1
1
n n
n
D
=
4 2 1
10 *
d
n n
S
=
10
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
99
En una serie homologa de compuestos orgnicos la dispersin vara ms que el ndice
de refraccin. Por ejemplo, el etilbenceno ( n
20
= 1.49577) y el p-xileno
(n
20
= 1.49577), son prcticamente indistinguibles por sus ndices de refraccin
sin embargo, los valores de la dispersin media y de la dispersin especfca si permiten
diferenciarlos, porque:
Dispersin media D
20
Dispersin Especfica S
Etilbenceno 197.8 228.1
p-xileno 205.1 238.2
3.4.2 Anlisis Cuantitativo: Se realiza mediante la construccin de tablas o de grfcas
(curvas de calibracin), generalmente sencillas y a temperatura constante, del ndice de
refraccin versus concentracin buscando un amplio rango lineal con una
pendiente adecuada lo cual se puede lograr variando los parmetros de concentracin
hasta optimizar la grfca para el anlisis. Se interpola en la tabla o la grfca el valor del ndice
de refraccin de la muestra problema para hallar su concentracin o se calculan los valores
de m y b para la ecuacin b mc n
t
D
+ = mc + b y mediante ella se calcula la concentracin C,
t
D
n
ndice de refraccin de la muestra,
c
n
m
t
D
= , que es la pendiente e igual a la sensibilidad de
calibracin, b es el intercepto con el eje Y, como el ndice de refraccin no toma valores
menores que la unidad la lnea de la grfca no puede pasar por cero. Algunos de los requisitos
para obtener un anlisis seguro son:
a) Precisin instrumental apropiada para la medicin del ndice de refraccin.
b) Una composicin constante excepto para los constituyentes de inters.
c) Una curva de calibracin de buena linealidad del ndice de refraccin contra el parmetro de
concentracin utilizado.
d)Una variacin representativa del ndice de refraccin con pequeos cambios en
concentracin.
e) Una pendiente signifcativa de la grfca de calibracin para obtener la mayor sensibilidad
D
D
100
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Para el anlisis de mezclas binarias de lquidos que se acercan al comportamiento ideal, el ndice
de refraccin varia en forma lineal con la concentracin expresada en porcentaje volumen
volumen, por lo cual se puede aplicar la siguiente relacin matemtica:
Vt
V n V n
n
Dm
2 2 1 1
+
=
donde
Dm
n es el ndice de refraccin de la mezcla de la muestra,
1
n ndice refraccin del
compuesto 1 puro,
2
n ndice refraccin del compuesto 2 puro,
1
V volumen del compuesto 1,
2
V volumen del compuesto 2,
t
V Volumen total igual
1
V ms
2
V ; ( )
2 1
V V V
t
+ =
Las aplicaciones analticas son tiles tanto en investigacin como en control de
calidad y el control de procesos. La tcnica refractomtrica es usada en:
1. Confrmacin de la identidad de sustancias.
2. Determinar el grado de pureza de las sustancias.
3. Determinar la cantidad o concentracin de sustancias en mezclas binarias y an terciarias
combinando el ndice de refraccin y concentracin con algn otro parmetro fsco como
la densidad o el punto de ebullicin.
4. Anlisis de muestras y corrientes en proceso tales como en la destilacin y
evaporacin.
5. Clculo de propiedades de polmeros tales como el peso molecular, tamao y forma.
6. Clculo de propiedades fsicas tales como refexin y dispersin.
7. Como sistema de deteccin en equipos cromatogrfcos.
8. Para medir el Brix (porcentaje de slidos en soluciones acuosas).
Sus mltiples aplicaciones estn en las industrias de: licores, azcar, alimentos, bebidas,
solventes orgnicos, farmacutica, laboratorio clnico etc. Adems por ser una tcnica sencilla
y de bajo costo se puede aplicar al control de calidad de una gran cantidad de productos
comerciales; dependiendo de la capacidad y habilidad que tenga el analista qumico para
hacer uso de ella y adaptarla.
D
m
Vt
D
m
t
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
101
3.5
6
2
Taller
3.5.1.Una sustancia A tiene un ndice de refraccin de 1.3435, una sustancia B tiene un
ndice de refraccin de 1.4953.
a) Para cual de las dos ser mayor el ngulo de refraccin de un rayo que
proviene del aire.
b) Cunto vale este ngulo para la sustancia A.
c) Si el rayo pasara de la sustancia A hacia la sustancia B con un ngulo de
incidencia de 30 cul ser el valor del ngulo de refraccin?
d) S i el rayo pasar de la sustancia B hacia la sustancia A con un ngulo
de incidencia de 30 que ocurrira y que ngulo tomara el rayo despus de
chocar con la interfase.
e) Para el cloroformo que tiene un n
20
= 1.4476 calcular en grados, minutos
y segundos el ngulo de refraccin emergente medido en el refractmetro
cuando el ndice de refraccin del prisma de medicin del instrumento es de
1.7000.
3.5. 2. La refraccin molar, R, de un compuesto se defne como:
R =
d
M
n
n
|
|
.
|
\
|
+
2
1
2
2
Donde n es el ndice de refraccin, M es el peso molecular, y d es la densidad. Una
buena aproximacin para calcular la refraccin molar de un compuesto, es la suma de
las refracciones a las que contribuye cada tomo de la molcula. En algunos libros de
consulta como el Handbook of Chemistry and Physics pueden encontrarse tablas
de las contribuciones atmicas a la refraccin molar. Por ejemplo, el carbono contribuye
a una refraccin de 2.42, el hidrgeno 1.1, el oxgeno (doble enlace) 2.21 y el cloro 5.97,
oxgeno en OH 1.52, oxgeno en ster OR 1.64, oxgeno en ter 1.64. (ver cuadro 3.4)
a) Calcular la refraccin molar del mesiteleno a partir de los datos del problema 4 y
compararlos con respecto al valor calculado a partir de las contribuciones atmicas.
b) Calcular la refraccin molar de CCI
4
a partir de sus contribuciones atmicas.
6 Ejercicios propuestos por el profesor Federmn Castro Eusse para la asignatura Anlisis Instrumental I.
D
102
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
c) Utilizando los siguientes datos n
20
= 1.4664 y M = 153.82, calcular la densidad
del CCl
4
.
Comparar el valor calculado con el valor observado de 1.5942 g/ml.
3.5.3. Una sustancia de carcter orgnico cuya frmula emprica es C
4
H
8
O
2
tiene un ndice
refraccin 1,4188 y una densidad 1.035 g/mL a 28 C, cul ser su ndice refraccin
a:
a) 25 C y a 15 C
b) Cual ser su ndice de refraccin, su refraccin molar, su refraccin especfca, y
su refraccin molar mediante las refracciones atmicas a 20 C. si su densidad
es 1.0356.
c) a que posible compuesto corresponde?
d) Para las muestras problema 1 y 2 cuyos ndices de refraccin se determinaron
en la demostracin, corregir el ndice de refraccin a 20C, consultar las tablas
para defnir a que posibles compuestos corresponden y calcular para cada una
la refraccin especfca, la refraccin molar y la refraccin molar mediante las
refracciones atmicas, analizar los datos y sacar conclusiones.
3.5.4. En las mezclas binarias de lquidos que se acercan al comportamiento ideal, el
ndice de refraccin vara en forma lineal con la composicin expresada en porcentaje de
volumen. El mesitileno y el pentano se comportan en esta forma. Para el mesitileno,
n
20
= 1.4998, el peso molecular es 120.20 y la densidad es 0.8642 g/ml (todas estas
constantes, a 20C). Para el pentano, n
20
= 1.3579, el peso molecular es de 72.15, y la
densidad es de 0.6262 g/ml. Calcular la molaridad del pentano en una mezcla de pentano
y mesitileno cuyo ndice de refraccin es de 1.4522. Hallar el dato: a. matemticamente
usando la frmula
m
n =
2 1
2 2 1 1
V V
n V n V
+
+
. b. Grfcamente. c. Mediante la ecuacin
mc + b.
3.5.5.Las mezclas binarias de lquidos que no forman soluciones ideales presentan
ndices de refraccin que son una compleja funcin de la composicin. Una de las funciones
ms simples se puede aplicar a la solucin de acetona y tetracloruro de carbono, cuyo
ndice de refraccin est dado por la ecuacin mc + b, donde c es la concentracin
D
D
D
D
m
b mc n
t
D
+ =
b mc n
t
D
+ =
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
103
molar de la acetona y m y b son constantes. Para la acetona, n
20
= 1.3588,
el peso molecular es de 58.08 y la densidad es de 0.7908 g/ml (todas las constantes a
20C). Para el tetracloruro de carbono, n
20
= 1.4664, el peso molecular es de 153.82
y la densidad es de 1.5942 g/ml. Calcular el ndice de refraccin de una solucin de
acetona 3.00 M en CCl
4
. Hallar el dato: a. matemticamente usando la frmula
=
2 1
2 2 1 1
V V
n V n V
+
+
. b. Grfcamente. c. Mediante la ecuacin mc + b.
3.5.6. La frmula condensada de una sustancia es C
3
H
6
O. Su n
20
es 1.3588. Defnir si es
alcohol etlico, acetona, aldehdo propionico en xido de propileno.
3.5.7.En algunos casos la sustancia a analizar se extrae con un solvente especial y la
concentracin se determina con base en el cambio en el ndice de refraccin del
solvente.
Por ejemplo, para determinar el contenido de grasa en productos alimenticios se usa
la siguiente frmula
( )
( )
100 x
n n m
n n d V
X
f
s f s
=
X= porcentaje de grasa, V
s
= volumen del solvente, d
f
= densidad de la grasa, n
f
=
ndice de refraccin de la grasa pura, n = ndice de refraccin del solvente puro,
n
s
= ndice de refraccin de la solucin de la grasa extrada, m = peso de muestra
analizada.
En la extraccin de la grasa de una muestra de cacao, se pesaron 1.5 gramos de
cacao en polvo y se trataron con 2.5 ml de monobromo naftaleno, el n
20
de la
solucin fue 1.6570. El n
20
del monobromo naftaleno puro es 1.6385. El n
20
de la
grasa de cacao pura es 1.4630 y su densidad 0.926 g/mL. Calcular el % de grasa en
el Cacao.
3.5.8.Para el anlisis cuantitativo de una muestra de un solvente industrial constituido
por una mezcla de metiletil cetona tolueno se prepar una serie de patrones a los
cuales se les determin el ndice de refraccin cuyos datos se consignaron en la
tabla 3.1.
D
D
D
D
D D
m
n
D
m
b mc n
t
D
+ =
104
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Tabla 3.1 Datos para construir la curva de calibracin n
20
Vs C (en %
v/v asumiendoVolmenes Aditivos), para determinar la concentracina
una muestra problema de una mezcla metil etilcetona (mecK)tolueno.
Patrones % V/V tolueno %V/V meck
1
0.00 100.00 pura 1.3814
2
20.00
80.00 1.3995
3
40.00
60.00 1.4249
4
60.00
40.00 1.4455
5
80.00
20.00 1.4695
6 100.00 puro
0.00 1.4961
Muestra problema
?
? 1.4348
a. Construir la grfca en papel milimetrado
b. Calcular la ecuacin:
b mc n
t
D
+ =
mc + b.
c. Calcular la concentracin de la muestra problema mediante interpolacin
matemtica.
d. Calcular la concentracin de la muestra problema mediante la ecuacin.
e. Determinar la concentracin de la muestra problema mediante la interpolacin en la
grfca.
f. Determinar la concentracin de la muestra problema aplicando la frmula del
ejercicio 4.
g. Aplicar la frmula del ejercicio 4 a un patrn para verifcar su cumplimiento.
h. Calcular: la sensibilidad, el lmite de deteccin, el lmite de cuantifcacin para un
de 1.3815, el % de error instrumental en la determinacin de la concentracin
de la muestra, con una incertidumbre de 1x10
-4,
(dn).
9. Consultar en los catalogos de equipos para instrumentacin Quimica o en
internet sobre los ltimos modelos de refractmetros y sus aplicaciones
en el control de calidad y de procesos.
D
D
n
20
D
n
20
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
105
3.6 Bibliografa
Catalogos de los refractmetros
GARCA, Castaeda Mauricio; Ewert, De-Geus Jeannine. Introduccin a la Fsica Moderna (2a.
ed), Bogot: ED, Centro Editorial Universidad Nacional de Colombia 1.997
HARRIS, C Daniel. Anlisis qumico cuantitativo. (3a Ed.) Espaa : Editorial Reverte
S.A., c2007.
MARN VILLADA, Fabio. Conferencias Anlisis Instrumental. Material mimeografado UTP
RESNICK, Robert; Halliday David. Fsica Tomos I, II. (4a. ed). Mxico: ED, Continental,
1982
SKOOG, Douglas A. West, Donal M. Anlisis Instrumental ( 1a. ed.). Mexico: ED,
Interamericana, 1.975.
SKOOG, Douglas A. West, Donal M. Anlisis Instrumental ( 2a. ed.). Mexico: ED,
Interamericana..
STROBEL, Howard A. Instrumentacin Qumica (1a. ed.). Mxico: Limusa, S.A., 1982.
WILLARD, Hobart H., Merritt, Lynnel., y Dean John A. Mtodos Instrumentales de
Anlisis (7a. ed). Mxico: ED, Grupo Editorial Iberoamrica, 1.991.
106
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
107
CUARTA
UNIDAD
108
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
109
CUARTA UNIDAD
Polarimetra
7
1
4.1 Generalidades: La polarimetra es una Tcnica Analtica que tiene su fundamento
en la interaccin de las radiaciones electromagnticas con la materia, las radiaciones tienen
su comportamiento como ondas; teniendo como base la medicin de la rotacin que se
produce en un haz de luz polarizada al pasar por una sustancia pticamente activa. La
actividad ptica rotatoria de una sustancia, tiene su origen en la asimetra estructural de las
molculas.
El termino polarimetra, tal como es usado por muchos qumicos, puede defnirse como
el estudio de la rotacin de la luz polarizada por sustancias pticamente activas y
transparentes.
Cuando un rayo polarizado atraviesa sustancias pticamente activas, ocurre una interaccin
entre las radiaciones y las molculas de la sustancia ocasionando un giro del rayo fuera de
su plano de oscilacin original ver (Fig 4.1). Sustancias pticamente activas son las que
hacen girar el plano de vibracin de la luz polarizada. Se dice que la sustancia
es dextrgira (o positiva, +) si el giro ocurre en el sentido de las agujas del reloj para
un observador que mira hacia la fuente de luz, y levgira (-) si el giro ocurre en sentido
contrario.
La direccin y el grado de rotacin denominado potencia rotatoria ptica,
llamada ms comnmente rotacin especfica y simbolizada por a es til para el
anlisis cualitativo y cuantitativo, y para la elucidacin de estructuras qumicas.
7 Materiales recopilados y organizados por el profesor Federmn Castro Eusse para la asignatura Anlisis Instrumental I.
110
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Figura 4.1 Ilustracin del giro de luz polarizada en un plano ocasionado por una
sustancia pticamente activa.
La rotacin especfca a depende de la longitud de onda (l ) y de la temperatura
( t ) a la cual se mida a
t
, como tambin de la naturaleza de la sustancia, adems del solvente
y la concentracin si se encuentra en solucin. Su forma de simbolizarla considerando las
variables () y (t) es: a
20
cuyo signifcado es rotacin especfca a medida con la lnea D
del sodio de 589 nm a 20 grados centgrados. La rotacin molecular
100
pm
M
a
= donde pm
es el peso molecular de la sustancia.
La rotacin especfca no es un parmetro especfco de cada sustancia por lo tanto al igual
que el ndice de refraccin pueden existir varias sustancias que presenten la misma rotacin
especfca en igualdad de condiciones.
La variacin de la rotacin especifica a con la () y la (t), debe ser estudiada
experimentalmente para cada sustancia en particular. No se pueden hacer generalizaciones de
un comportamiento con una relacin directa o inversa como con el ndice de refraccin.
Hay sustancias cuya rotacin especifca aumenta con el aumento de la temperatura y para
otras disminuye, igualmente puede suceder con los cambios en (), (el cambio de la rotacin
especfca con () se denomina dispersin especfca); an ms con dichos cambios pueden
pasar de dextrgiras a levgiras o viceversa. Para las sustancias pticamente activas en
solucin la rotacin especifca puede cambiar poco o mucho con los cambios de concentracin,
por lo cual para el anlisis cuantitativo mediante curvas de calibracin se debe determinar
muy bien experimentalmente el rango de comportamiento lineal.
Fuente luminosa
Luz polarizada
Sustancia opticamente
Activa
Angulo de giro
Luz ordinaria
vibrando en todas
las direcciones
Polarizador
Celda para la muestra
Analizador
Observador
OJO
a
a
l
D
apm
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
111
Para comprender la polarimetra es necesario tener claros dos conceptos: 1) luz polarizada
y 2) sustancia ptimamente activa.
4.1.1 Luz polarizada:
Un haz de luz ordinaria consta de un gran nmero de ondas electromagnticas vibrando en
todas las direcciones posibles, la amplitud de las vibraciones se distribuye por igual en una
serie de planos centrados a lo largo de la trayectoria del haz; planos perpendiculares a la
direccin de propagacin del rayo.
Si por algn medio sacamos un haz de rayos que vibren en un solo plano eliminando los
dems, obtendremos un haz de luz polarizada: Luz polarizada es aquella que
consta de radiaciones que vibran en un solo plano.
Vistos de frente, los vectores elctricos se observaran como en la figura 4.2 (a). El
vector de cualquier plano, como xy figura 4.2 (b), puede dividirse en dos componentes
perpendiculares entre si, AB y CD, como estn representados en la figura 4.2 (c), si
se combinan los dos componentes de cada plano, el resultado tiene el aspecto mostrado en
la figura 4.2 (b). La eliminacin de uno de los dos planos de vibracin resultantes en la
figura 4.2(c) produce un haz polarizado plano. La vibracin del vector elctrico de
un haz polarizado plano ocupa un solo plano en el espacio.
La radiacin electromagntica polarizada plana es producida por ciertas fuentes de energa
radiante.
Por ejemplo las ondas de radio que emanan de una antena poseen comnmente esta
caracterstica.
Presumiblemente, la radiacin originada por un solo tomo o molcula es polarizada; pero
como las fuentes luminosas comunes contienen gran nmero de estas partculas en todas
las orientaciones, el haz resultante es uno que vibra en todas las direcciones alrededor del
eje de la trayectoria.
La absorcin de radiacin por ciertos tipos de materiales depende del plano de polarizacin
de la radiacin. Por ejemplo, cuando son apropiadamente orientados hacia un haz, los
cristales anisotrpicos absorben selectivamente radiaciones que vibran en un plano,
112
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
pero no en el otro. As, una hoja polarizante de estos cristales, apropiadamente orientada
absorbe todos los componentes de, por ejemplo CD y transmite completamente el campo
AB ver figuras 4.2 (c) y 4.3.
Figura 4.2 a) Vista de un haz de radiacin no polarizado, algunos de los vectores de
un haz con trayectoria perpendicular al papel, Las vibraciones del vector elctrico
se muestran sin resolver, b) Descomposicin de un vector del plano XY en dos
componentes perpendiculares entre s. C) resultante de todos los vectores ( diagrama
no escalado).
Una hoja polarizante o fltro polarizador (fltro polaroid), cualquiera que sea su orientacin,
elimina aproximadamente 50% de radiacin de un haz no polarizado y transmite la otra mitad
como un haz de plano polarizado.
( a) ( b)
Figura 4.3 Deteccin de una radiacin de un plano de polarizacin. a) Disco polaroid
(filtro polaroid) orientado de tal manera que su plano vibratorio sea paralelo al de
la radiacin. b) Disco polaroid alineado en tal forma que su plano de vibracin sea
perpendicular al de la radiacin (condicin para la extincin).
D
A
C
B
Y
X
D
Y
B
C
A
X
(a)
(c)
(b)
Polarizador
Detector Detector
Polarizador
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
113
El plano de polarizacin del haz transmitido depende de la orientacin del fltro respecto al
haz incidente, cuando dos fltros polarizantes, orientados en ngulo de 90 grados uno con
relacin al otro, son colocados perpendicularmente a la trayectoria del haz no se transmite
radiacin ver figura 4.3 b.
La rotacin de un fltro produce un aumento continuo de la transmisin hasta que se alcanza
un mximo cuando las molculas de los dos fltros tienen la misma alineacin. La forma en
que se transmite, refeja, refracta y dispersa la radiacin por ciertas sustancias depende
tambin de la direccin de la polarizacin. Como consecuencia, se ha elaborado un grupo de
mtodos analticos cuya selectividad se basa en la interaccin de estos compuestos con la
luz de una polarizacin particular bien sea plana, circular o elptica.
4.1.2 Obtencin de luz polarizada:
La luz polarizada se puede obtener por refexin (ver figura 4.4) o mediante, lminas,
pelculas, o fltros polarizantes denominados fltros polaroid, los cuales se construyen de
plsticos con partculas dicroicas y sometidos a tensin para alinear las molculas, pero
la luz polarizada obtenida de esta forma no tiene la calidad requerida en los instrumentos
polarimtricos, por lo cual se prefere aprovechar las propiedades birrefringentes de los
slidos cristalinos anisotrpicos como el cuarzo y el espato de Islandia o calcita ( carbonato
de calcio) para su obtencin
Figura 4.4 obtencin de luz polarizada por reflexin
4.1.2.1 Birrefringencia: esta relacionada con la doble refraccin de la luz, fenmeno
que se manifesta en cristales que hacen ver doble, lo cual fue observado desde 1669 por
un mdico Dans Erasmus Bartolinus quien public sus observaciones sobre un
cristal que le haba llegado de Islandia y que lo sorprendi bastante, pues al observar los
objetos a travs del mismo no vea una sola imagen, como ocurre con los cristales comunes,
Haz Polarizado
114
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
sino dos. Llam a este fenmeno doble refraccin de la luz o birrefringencia, pues
es evidente que a cada rayo incidente corresponden dos rayos refractados; observ, adems,
que haciendo girar el cristal llamado espato de Islandia o calcita, una de las imgenes
permaneca inmvil mientras que la otra giraba alrededor de la fja. A los rayos que forman
la imagen fja los denomin rayos ordinarios y a los otros rayos extraordinarios.
Observ tambin que la velocidad de propagacin del rayo ordinario es diferente
de la del rayo extraordinario; como la velocidad de propagacin de la luz en un medio
es inversamente proporcional al ndice de refraccin
n
C
V =
, concluye:
a) el cristal tiene un ndice de refraccin para el rayo ordinario ( n
o
), y otro ndice de refraccin
diferente para el rayo extraordinario ( n
e
) ver cuadro 4.1.
b) Como la imagen dada por el rayo ordinario permanece fja al hacer girar el cristal, su ndice
de refraccin es constante e independiente de la direccin de propagacin, por lo cual lo
llam ordinario, pues, se comporta como un rayo refractado por un medio monorrefringente
aire- agua.
C) Por el contrario, el ndice de refraccin del rayo extraordinario depende de su direccin, lo
que signifca diferentes velocidades de propagacin para cada direccin.
d) En el cristal existe una direccin privilegiada en la cual no se produce
birrefringencia, es decir, el rayo ordinario y extraordinario se propagan con igual
velocidad y se ha denominado eje ptico.
Los slidos que tienen estas propiedades son los cristales anisotropicos, como el espato de
Islandia o calcita (CaCO
3
), el cuarzo, el hielo, la turmalina, el berilio, etc.
Cristal n
o
n
e
Calcita 1.6583 1.4864
Cuarzo
1.544 1.553
Hielo
1.306 1.307
Cuadro 4.1 ndices de refraccin de los rayos ordinarios y extraordinarios de
cristales birrefringentes
Los cristales se dividen en unixicos y bixicos, segn que tengan un solo eje ptico o dos
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
115
ejes pticos. En los unixicos se encuentra los cristales birrefringentes ya citados, entre los
bixicos estn la turquesa y el topacio.
4.2.1.2 Sustancias isotrpicas y anisotrpicas: Las isotrpicas son aquellas
cuyas partculas se encuentran distribuidas simtricamente a lo largo de la trayectoria,
Transmiten las radiaciones en todas las direcciones a igual velocidad, independientemente
de la polarizacin de la radiacin. Ejemplo de estas sustancias son los gases y lquidos
homogneos, los slidos que cristalizan en forma cbica y los no cristalinos como el vidrio, y
muchos tipos de polmeros.
Por el contrario las sustancias anisotrpicas tienen sus partculas distribuidas
asimtricamente, transmiten la radiacin a diferentes velocidades segn la relacin
angular entre el plano de polarizacin y un eje determinado del cristal. Ejemplos de
ellos son los cristales no cbicos como el cuarzo, la calcita y el hielo.
4.2.1.3 Obtencin de luz polarizada con el prisma de Nicol.
Aprovechando las propiedades anisotropicas de la calcita Nicol construy un prisma,
dispositivo utilizado para obtener luz polarizada de ptima calidad.
La calcita (CaCO
3
) presenta dos ndices de refraccin, 1.4864 y 1.6583. El cristal se parte
en dos mitades por la diagonal menor formando un ngulo 68 ver figura 4.5 y luego se
sueldan con un cemento isotrpico cuyo ndice de refraccin sea lo ms parecido posible
a 1.4864, se suele usar blsamo de Canad sustancia transparente con un ndice
de refraccin de 1.54 que es intermedio entre los dos ndices de refraccin de la calcita,
se coloca entre las dos mitades del cristal. Esta capa es totalmente refectora para el rayo
ordinario con su mayor ndice de refraccin, pero, como se ve en la figura 4.5, transmite el
rayo extraordinario casi sin cambio.
En esta forma el rayo extraordinario sale polarizado. El prisma de Nicol y el prisma
de Glan-Thompson son de este tipo.
116
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Figura 4.5 Prisma de Nicol
4.3 Sustancia pticamente activa:
La isomera ptica relacionada con la actividad ptica fue descubierta y descrita por el
fsico Francs Jean - Baptiste Biot en 1.811. Los ismeros (del griego isos: igual,
meros: partes), en algunos casos no pueden explicarse mediante frmulas estructurales
y bidimensionales por lo cual, es indispensable considerar la estructura de la molcula en
forma tridimensional, denominndose esterisomeros; la ciencia encargada de su estudio es
la estereoqumica (del griego stero: slido), que estudia los aspectos tridimensionales de las
estructuras moleculares y su efecto en el comportamiento qumico.
La estereoisomeria es de dos tipos: geomtrica y ptica. La actividad ptica se origina
en la asimetra estructural de las molculas, las cuales deben tener un centro quiral, es
decir, un tomo de carbono unido a cuatro grupos diferentes ver figura 4.4 a, a veces
llamado carbono quiral o carbono asimtrico (para diferenciarlo del nitrgeno quiral
o del fsforo quiral).
La quiralidad (quiralidad: en griego signifca sentido de las manos, refrindose a sus
imgenes especulares que no son superponibles ver figura 4.4.c), es condicin necesaria
y sufciente para la existencia de los enantimeros (del griego enantios: opuestos,
meros: partes), es decir, un compuesto cuyas molculas son quirales puede existir
como enantimeros (compuestos cuya estructura no es superponible con su imagen
especular y que existen guardando la misma relacin de la mano izquierda con respecto
a la derecha ver figura 4.4.c); son ismeros pticos o compuestos que no tienen un
plano de simetra y pueden existir en forma dextrgira y levgira siendo imgenes
especulares
8
2
la una de otra. Los ismeros pticos poseen el mismo esqueleto de anillo
8 Imagen especular: forma que es idntca a otra salvo en que su estructura est invertda como si se mirase en un espejo,
de manera que las dos no se pueden superponer. Por ejemplo, la mano izquierda es la imagen especular de la mano dere-
cha.
Rayo ordinario
Rayo extraordinario
eje ptico
Capa balsmica del
Canad
Rayo no
polarizado
B
D
C
A
68
0
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
117
o de sistema de cadena y contiene los mismos grupos (ver figura 4.4 b).
La actividad ptica se presenta en dos tipos diferentes de especies qumicas: a) compuestos
cristalizados, que pierden su actividad ptica cuando dicho cristal se transforma en un lquido,
un gas, o una solucin (el cuarzo es el ejemplo clsico de este tipo de actividad ptica); b)
los compuestos en los que la actividad ptica es una propiedad que reside en sus mismas
molculas y en los que el fenmeno se observa con independencia del estado fsico del
compuesto.
Figura 4.4 a) ordenaciones posibles de de los cuatro radicales de una molcula con
un carbono quiral, b) tomo de carbono con cuatro sustituyentes diferentes y su
imagen especular, c)isomera ptica del gliceraldehido y su imagen especular y su
analoga con las manos, d) accin de los compuestos ptimamente activos sobre la
luz polarizada.
Dos ismeros pticos pueden tener puntos de fusin y ebullicin idnticos y la misma
solubilidad en los mismos disolventes pero se diferencian en su accin sobre la luz polarizada
(ver figura 4.4.d). Es necesario comprender la isomera ptica para saber las propiedades
y comportamiento de muchos compuestos qumicos tales como los carbohidratos,
protenas y los aminocidos, pues estos compuestos estn constituidos por unidades
cada una de las cuales es un ismero ptico que presenta actividad ptica y de all la
b
Espejo
CH
C
OH
CH
HO
H H
C
HOOC
COOH
Acido D-lctico
Acido L-lctico
a
b
d
c
a
c
d
E
s
p
e
j
o
Atomo
de
carbono
Atomo
de
carbono
a
b
Espejo
CHO
C
H
CH
2
OH OH
CHO
C
H
HO
(a)
(b)
C
CHO
OH
CH
2
OH
C
CHO
OH
CH
2
OH
H H
c
Luz polarizada
horizontalmente
Muestra
Nueva direccin
de polarizacin
(d)
(L)
Destro
gira
Levo
gira
Rotacin
Rotacin
d
= =
CH
2
OH
118
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
importancia de la polarimetra para su estudio.
Las mezclas equimolares de enantimeros (igual concentracin molar de los compuestos
dextrgiros y levgiros) es pticamente inactiva por que se anulan sus efectos
individuales de los giros, los giros ocasionados por unas molculas hacia la izquierda lo anulan
las molculas que causan el giro a la derecha, estas mezclas se denominan racmicas.
Los compuestos pticamente activos, pueden cambiar su actividad ptica con el tiempo
fenmeno conocido como mutarrotacin.
4.4 Instrumentos para medir la rotacin de la luz polarizada.
El polarmetro es el instrumento diseado para medir el ngulo de giro en grados angulares
ocasionado a la luz polarizada, por sustancias pticamente activas, para lo cual existen equipos
anlogos y digitales con diseos para usos especfcos como los polarmetros manuales y de
bolsillo (ver figuras 4.5, 4.6, 4.10) para uso en anlisis en los laboratorios clnicos hasta
los ms automatizados y sofsticas utilizados en los laboratorios de investigacin, laboratorios
de control de calidad y en el control de procesos. Existen polarmetros que cubren rangos de
0.00 a 90.00 y de 0.00 a 180.00 grados angulares, siendo los de 180 grados los de mayor
uso.
4.4.1 Medicin del ngulo de giro
La medicin del ngulo de giro se basa en el siguiente hecho: Si delante de un prisma
polarizador se coloca otro, girado 90 respecto del primero, este refejar totalmente el rayo
polarizado. Si entre los dos prismas se coloca una sustancia pticamente activa que hace
girar el rayo polarizado un ngulo B, el segundo prisma (prisma analizador) se deber
girar B grados ms para que nuevamente refeje totalmente el rayo, o sea que si el observador
est frente al prisma analizador, deber girarlo hasta que no vea nada de luz, y luego leer el
ngulo girado.
Como el ojo humano es mejor para igualar intensidades de luz, que para defnir
cuando hay oscuridad total, se usan los llamados dispositivos de media sombra
para facilitar la medicin. estos son de diferentes tipos y funcionan polarizando la mitad del
haz luminoso en determinado plano y la otra mitad en un plano ligeramente diferente. Luego
si el observador gira el prisma analizador para que refeje totalmente la mitad del haz, pasar
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
119
algo de la otra mitad, ver la mitad del campo ptico oscura, y la otra un poco iluminada,
girando muy poco ms, refejar la segunda y pasar algo de la primera. Devolvindolo
muy lentamente encontrar un punto intermedio en el que el campo ptico esta uniforme y
dbilmente iluminado (ver figura 4.8). En este punto de equilibrio podr leer el ngulo de
giro. Los prismas Jellett-Cornu y los prismas Lippich aplican este principio.
Figura 4.5 Diagrama simplificado de un polarmetro
Otro sistema es colocar despus del prisma polarizador, afectando parte del haz, una sustancia
pticamente activa dbil, que haga girar un poco dicha parte; o sea que nuevamente se
obtendr un haz polarizado en dos planos ligeramente diferentes. La placa de Laurent,
que es de cuarzo, se utiliza en sistemas de este tipo.
Lente ocular
Cristal analaizador
rotatorio
El ismero en solucin hace girar el plano de luz
polarizada
Polarizador
Luz
Escala rotatoria
+
-
0
90
180
90
120
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
1. Fuente luminosa 6. Tubo de observacin 11. Escalas de lectura y nonio
2. Lente de iluminacin 7. Filtro analizador 12. Control de enfoque
3. Filtro de luz 8. Objetivo del anteojo
4. Filtro polarizador 9. Ocular del anteojo
5. Placa de Laurent 10. Lupa de lectura
Figura 4.6 Esquema de las partes del Polarmetro de circulo Aux Jena
4.4.2 Partes del polarmetro y su funcin (Polarmetro de circulo Aux jena)
1. Fuente luminosa: Es una lmpara espectral de sodio, que se conecta a la
red elctrica por medio de una fuente y un estabilizador de voltaje.
2. Lente de iluminacin: Su funcin es hacer que los rayos que procedan de
la fuente contine con una trayectoria paralela. Por tal razn, la fuente debe
ubicarse a la distancia focal de sta lente.
3. Filtro de Luz: Su funcin es dejar pasar solamente la lnea D del Sodio
(589 nm) y eliminar otras radiaciones que haya podido producir la lmpara.
4. Dispositivo polarizador (filtro): Su funcin es producir un haz de luz
polarizada. Consta de un prisma Nicol o de un filtro polarizador.
5. Divisor de campo (placa de Laurent): Su funcin es producir un efecto
secundario sobre parte del haz luminoso para facilitar la lectura del ngulo
de giro, creando una franja central del campo ptico que al equilibrarla da la
posicin en que se debe tomar la lectura ver figura 4.8.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
121
6. Tubo de observacin: Este tubo tiene una ventana de vidrio y un empaque
de caucho en cada extremo, dentro de l se coloca la solucin a analizar. La
longitud del tubo viene a ser el espesor L de la solucin analizada.
7. Dispositivo analizador (filtro): Consta de un disco con divisiones en grados
angulares, en cuyo centro se halla un prisma Nicol o un filtro similares a los
del dispositivo polarizador. Girando ste disco se puede determinar y leer el
ngulo de giro.
8. Objetivo: Lente o combinacin de lentes para visualizar posicin de los
campos.
9. Ocular del Sistema de Enfoque: Lente o combinacin de lentes cercanos al ojo
para facilitar la visualizacin de los campos. (8,9), a travs de ellos mira el observador y los
ajusta para enfocar y ver ntida la imagen producida por el rayo.
10. Lupa: Amplia la escala de lectura del instrumento.
11. Escala de lectura: Permite leer unidades y decimales en grados angulares.
12. Control de enfoque: Permite hacer los ajustes para ver ntida la imagen de los
campos.
4.4.2 Manejo del polarmetro de circulo Aux Jena
4.4.2.1 Caractersticas tcnicas:
Graduacin circular hacia ambos lados... 0.00 hasta 180.00 grados
Indicacin del nonio 0.05 grados
Lmite de error.0.05 grados
Longitudes de los tubos de observacin en milmetros 200.00 - 192.60 - 190.1 - 150.3 - 100.00
4.4.2.2 Instalacin y limpieza:
El polarmetro se debe ubicar en un sitio frme y seguro, preferiblemente oscuro. Se retira la
122
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
funda protectora contra el polvo y se limpian cuidadosamente las lentes con Xilol o cualquier
otro solvente voltil y una mota de algodn o papel suave. Se lava el tubo de observacin y se
limpian las ventanas de vidrio; Se observa que se encuentren en buen estado e igualmente que
las tapas posean los empaques correspondientes, se tiene en cuenta la longitud del tubo que es
necesaria para los clculos.
Se limpian con un aceite suave (tres en uno) las escalas de lecturas y se lubrica el mecanismo,
se realiza un reconocimiento de las partes internas y externas Ver figuras 4.6 y 4.7.
4.4.2.3 Calibracin: el polarmetro se calibra con una placa de cuarzo cristalino de espesor
constante (100 micrmetros), y ngulo de giro conocido cuando los datos requieren gran
exactitud y precisin.
El costo de las placas es elevado por lo cual se prefere calibrarlo con cualquier sustancia
pticamente inactiva, siendo la ms utilizada el agua destilada por su fcil
adquisicin y bajo costo, con la cual se ajusta a 0.00 angulares la lectura en la escala
del polarmetro.
4.4.2.4 Instrucciones de manejo:
a. Se conecta el estabilizador a la lnea. (se debe cerciorar que el voltaje es el adecuado
220 V).
b. Se prende la lmpara colocando el interruptor en la posicin de encendido, la lmpara
espectral de sodio se debe iluminar dbilmente. Se deja calentar durante 15 minutos.
Figura 4.7 Polarmetro de crculo Aux Jena (anlogo) configuracin externa
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
123
c. Se llena el tubo de observacin con agua destilada, (el tubo tiene una ventana de vidrio
en cada extremo y dentro de l se coloca la solucin a analizar. La longitud del tubo
viene a ser el espesor L de la solucin a analizar), con las siguientes precauciones:
- Se quita cuidadosamente la tapa de uno de los extremos, ya que el vidrio que posee viene
generalmente suelto y puede caerse.
- Se llena completamente el tubo, con cuidado de no humedecer las estras de la rosca,
para facilitar la operacin siguiente.
- Se tapa deslizando el vidrio sobre el extremo del tubo girando la tapa lentamente, para
que no se derrame el lquido y para que salga el aire retenido. Se ajusta la tapa pero
sin hacerle mucho esfuerzo. Si la estra de la rosca se humedece, se difculta la salida
del aire. Si se aprieta demasiado la tapa, se producen distorsiones pticas en el vidrio
de la ventana.
- No deben quedar burbujas tan grandes que no se puedan alojar completamente en el
ensanchamiento del extremo del tubo, cuando se inclina el tubo a la posicin de trabajo.
- Se seca externamente el tubo y los vidrios de los extremos con un papel suave o algodn,
que no deje motas, antes de llevarlo al instrumento.
d. Se ubica el tubo de observacin en el instrumento y se cierra la tapa del
compartimiento.
e. Se debe verifcar que la lmpara de sodio este bien enfocada hacia el Polarmetro.
f. Mirando por el ocular y ajustando el anteojo (9 figura. 4.6) se enfoca el campo
ptico hasta verlo ntido.
g. Se gira la perilla de medicin localizando el punto alrededor del cual ocurren los
cambios que se indican en la figura 4.8
124
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Figura 4.8 Posiciones de los campos
1. Posicin no balanceada (parte central oscura).
2. Posicin balanceada (igual iluminacin en todo el campo).
3. Posicin no balanceada (partes laterales oscuras).
h. Con el control de enfoque (12 figura 4.6), se ajusta el anteojo para ver ntido el campo
y con la perilla de medicin se ubica el punto de balance del campo ptico.
i. Se lee el ngulo de giro , en el Crculo de graduacin. Las dcimas de grado las
lee en el nonio, buscando la lnea del nonio que coincide con una lnea del crculo de
graduacin ver figura 4.9. Para facilitar la lectura se hace uso de las pequeas lupas
(ver figura 4.6 -10) dispuestas a lado y lado del ocular.
Figura 4.9 Ilustracin de la escala de lectura polarmetro Aux Jena, la medicin indica
170.5 angulares, correspondiente a la escala de unidades y decimales.
2
0
1
0
0
1
7
0
1
6
0
2
0
1
0
0
1
7
0
1
6
0
1
0
8
6
4
2
0
1
0
8
6
4
2
0
I
I
I
1 2 3
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
125
4.5 Aplicaciones analticas:
La polarimetra es una tcnica que sirve para analizar sustancias pticamente activas, con base
en la medicin del giro que ocasionan a un rayo de luz polarizada en un plano.
4.5.1 Anlisis Cualitativo: La rotacin ptica de un compuesto puro en un conjunto
especifcado de condiciones proporciona una constante fsica bsica que es til para fnes
de identifcacin, de igual modo que su punto de fusin, su punto de ebullicin o su ndice
de refraccin. La actividad ptica es caracterstica de muchas sustancias naturales como
aminocidos, esteroides, alcaloides y carbohidratos, ver cuadro 4.1, la polarimetra
representa un valioso instrumento para identifcar dichos compuestos y obtener informacin
sobre sus estructuras. En la literatura existen tablas de la rotacin especfca de un gran nmero
de compuestos medidos con la lnea D del sodio a 20C y en un solvente determinado, cuando
la temperatura de medicin del ngulo de giro es diferente de 20C se debe hacer la correccin
a 20 usando la siguiente expresin matemtica: ( )
2 1
2 1
t t n
t
D
t
D
+ = a a (ecuacin 4.1) donde n
es la pendiente de la grfca a Vs t
t
n
=
a
, la cual se debe calcular experimentalmente.
Para la identidad de una sustancia pticamente activa usando la tcnica polarimtrica, si es un
slido o un liquido puro, se procede primero a preparar una solucin de concentracin conocida
en un solvente que no sea pticamente activo ( la actividad ptica es aditiva) se lee en
el polarmetro el ngulo de giro a diferentes temperaturas, se calcula mediante la ecuacin
4.2 el valor de a a cada temperatura, se grafcan dichos valores de a contra la temperatura; se
calcula el valor de la pendiente n, se aplica la ecuacin 4.1 para hacer la correccin a 20C,
de cada valor de a diferente a 20C, se promedian los datos y el valor obtenido se compara
con los de tablas (cuadros) existentes en la literatura. Ver cuadro 4.1.
Si se requiere mayor exactitud en el clculo de a se construye una grafca en un rango lineal de
B vs C, se calcula la pendiente, se despeja el valor a y se hace la respectiva correccin por
efecto de la temperatura. Cuando se tienen lquidos puros sin dilucin, la concentracin C es
igual a la densidad en g/mL para aplicar la ecuacin 4.2.
Sustancia Sustancia
Galactosa + 79 -81 Sacarosa + 66.5
maltosa + 131 Acido Tartrico + 13.4
Lactosa + 52.4 Tartrato de sodio y potasio + 29.8
Glucosa + 52 Acido L-glutmico +31.2
Fructuosa - 93 Acido L-aspartco +24.6
Cuadro 4.1 Rotacin especfica de algunas compuestos pticamente activos
a a
a
a
20
D
a
20
D
126
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
4.5.2 Anlisis Cuantitativo: La magnitud del ngulo de giro depende del poder rotatorio
caracterstico de la sustancia, del espesor de la capa de solucin atravesada por la luz y de
la concentracin de la (s) sustancia (s), (la actividad ptica es aditiva) pticamente activa (s)
en la solucin.
La ecuacin bsica de la polarimetra B = aLC ( ecuacin 4.2), conocida tambin como
la ecuacin de Biot es una relacin emprica donde: es el ngulo de giro medido en
grados angulares, a es la rotacin especfca, L el espesor de la capa de solucin o muestra
lquida expresada en decmetros, C es la concentracin expresada en gramos sobre mililitro
g/mL. Si el compuesto es un lquido puro C es igual a la densidad en g/ml.
Otra ecuacin utilizada es:
. Con esta ecuacin, L debe expresarse en centmetros
y C en gramos de sustancia por 100 mL de solucin.
Las mediciones polarimtricas se adaptan fcilmente al anlisis cuantitativo de compuestos
pticamente activos. Se emplean curvas de calibracin empricas que relacionan la rotacin
ptica con la concentracin.
Estas grfcas pueden ser lineales, parablicas o hiperblicas, frecuentemente se construyen
con el ngulo de giro () Vs concentracin, buscando una relacin lineal de acuerdo
con la ecuacin y = mx + b donde y=B, , b=0 ; ya que si C=0 entonces B=0, pues, la
relacin es directamente proporcional. Es decir, BaC. Se preparan patrones de concentracin
conocida, se les determina el ngulo de giro en el polarmetro, se construye la grfca de
calibracin en un rango lineal y se interpola el ngulo de giro de la muestra problema para hallar
su concentracin. Para futuros anlisis o en anlisis de rutina se obtiene la ecuacin y con ella
se calcula la concentracin de la muestra desconocida as:
, trabajando en la regin lineal
se puede hacer la siguiente relacin para abreviar los clculos
x
x
p
p
C C
=
luego
p
x p
x
C
C
=
,
Donde:
p
es el ngulo de giro del patrn,
p
C concentracin del patrn,
x
ngulo de giro de
la muestra de concentracin desconocida,
x
C concentracin de la muestra desconocida.
De esta forma se puede programar un polarmetro que tenga el software para dar directamente
la concentracin. Si el valor del ngulo de giro de la muestra no esta dentro del rango lineal,
para su interpolacin, no se debe suponer que la grfca continua lineal y aplicar la relacin
matemtica; por que se puede cometer un error, lo mejor es hacer una dilucin de la muestra
para llevar el ngulo de giro dentro del rango o preparar patrones ms concentrados para
aLC
B =
1000
C =
aL
B
m =
DC
DB
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
127
verifcar si la relacin lineal se conserva. Es de aclarar que uno es el comportamiento qumico
del sistema y otro el matemtico.
Para la dilucin se pueden aplicar las siguientes relaciones:
f f i i
V C V C = , como el ngulo de giro
B es directamente proporcional a la concentracin se puede usar la expresin:
f f i i
V V =
donde:
i
C es la concentracin inicial,
i
V el volumen inicial,
f
C la concentracin fnal ,
f
V
volumen fnal,
i
ngulo de giro inicial,
f
ngulo de giro fnal. Se puede calcular un factor de
dilucin teniendo en cuenta que
i
f
D
V
V
F =
donde: =
D
F Factor de dilucin.
Ejemplo 4.1: En un tubo de observacin de 200 mm se analiz una solucin de sacarosa
a 20C. El ngulo de giro obtenido ( ) fue 18.5. Calcular la concentracin de sacarosa en
g/100 mL y en g/L
Desarrollo: Usando la ecuacin (4.2) , tenemos:
B = 18.5
a
20
= 66.56 (cuadro 4.1)
L = 200mm = 2 dm
C = B/L = 18.5/66.56 X 2 = 0.138 g/mL
C = 13.8 g/ 100 mL, C = 138 g/L
4.2.5.1 Error Instrumental Polarimtrico.
En una grfca de calibracin partiendo de la ecuacin de Biot B = aLC asumiendo
un comportamiento lineal y = mx + b, cuando C = 0 , B = 0 y derivando la ecuacin
B = aLC se obtiene: dB =aLdC , despejando dC= , dividiendo ambos miembros por
C , se tiene: , pero aLC = B entonces
ser el error relativo en la concentracin ocasionado por el error en la medicin del ngulo de
giro
d
. Luego el 100 % X
d
E
= , donde d es la incertidumbre en la medida del ngulo
de giro dado por el instrumento, que para la mayora de los polarmetros es de 0.05
0
A
05 . 0 y es
el ngulo de giro medido a la muestra problema.
D
B = aLC
aL
dB
aLC
dB
C
dC
=
B
dB
C
dC
=
128
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Figura 4.10 Diagrama polarmetro digital Polax L
4.6 Aplicaciones Generales: En los laboratorios de investigacin, laboratorios
de control de calidad, laboratorios clnicos, en el control de procesos; como sistema de
deteccin en otros equipos, en el seguimiento de reacciones (cintica qumica).
En la industria azucarera, en la industria alimenticia para asegurar la calidad de los
productos midiendo la concentracin y la pureza de compuestos alimenticios tales como:
cereales, jarabes a base de azcar. Carbohidratos: fructuosa, glucosa, lactosa, levulosa,
maltosa, raffnosa, xilosa, almidones, monosacridos naturales, disacaridos. Anlisis de
carbohidratos en frutas, etc.
En la industria farmacutica para el control de calidad de: Analgsicos, antibiticos,
alcaloides, sueros, esteroides, tranquilizantes, vitaminas, barbitricos
Inspeccin de materias primas de: gomas, aceites esenciales (de lavanda, de limn, de
naranja, de menta, etc).
Para la caracterizacin de biopolmeros (polmeros naturales, polmeros sintticos).
Dispositivo de
mededia sombra
Muestra (tubo de
observacin)
Analizador
Filtro
Polarizador
Espejo
Led
Emisor de luz
(linea D del sodio)
Clavija
AC
Entrada de
coriente
alterna
Fuente de
corriente
continua
DC
C.P.U
23.45
Motor
Intercambiador
de
Escala
Circuitos tablero
Principal
Exhibicin lectura
ngulo de giro
Operacin del
Conmutador
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
129
4.7 Taller
9
3
4.7.1. En un tubo de observacin de 190 mm se analiz una solucin de sacarosa (a
20
=66.5).
El ngulo de giro obtenido fue de 11.75 A.Calcular la concentracin de sacarosa en g/mL,
g/100mL, g/L y moles/L.
4.7.2. Una solucin al 6% m/v de un compuesto desconocido, se le determin el ngulo de
giro a 25C obtenindose un valor de 1.75A en un tubo de observacin de 20 cm, luego en
el mismo tubo pero a 22C se determin nuevamente su ngulo de giro dando un valor de
1.65A cul es el posible compuesto.
4.7.3. Se midi el ngulo de giro a una solucin de un compuesto pticamente activo en
un solvente pticamente activo, a 20C en un tubo de observacin de 2 dm de longitud, si
el ngulo de giro fue de 7A y la rotacin especfca es (a
20
+13.4) y el ngulo de giro del
solvente solo fue de 2A cul es la concentracin del compuesto.
4.7.4. Una solucin de lisina que contena 1 g/50 mL de HCl 6 N se introdujo en un tubo de
40 cm y dio un ngulo de giro (rotacin ptica) de 1.652.
Cul es su rotacin especfca? R= 20.65
4.7.5. Si el d(+) triptfano tiene rotacin especfca de + 32.45, qu ngulo de giro (rotacin
ptica) ha de esperarse de una solucin que contenga 0.7536 g/150 mL si se emplea un tubo
de observacin de 20 cm? R= 0.326
4.7.6. La rotacin especfca de la d(+) histidina es (a
20
= +39.8), si se utiliza un tubo de
observacin de 20 cm y se obtiene una rotacin ptica (ngulo de giro) de 2.11. Cul es su
concentracin? R= 0.0265
4.7.7. Con los datos de la siguiente tabla grafque la rotacin especfca contra la longitud de
onda. Deduzca de la curva el valor de la rotacin especfca para la fructosa a 490 y 600
nm.
nm 447 479 508 589 656
20
-166 -151 -137 -90 -76 R= -144.73, - 94.93
9 Ejercicios propuestos por el profesor Federmn Castro Eusse para asignatura Anlisis Instrumental I
D
D
D
D
130
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
4.7.8. Con los datos de la siguiente tabla grafque la rotacin especfca contra la temperatura.
Deduzca de la grfca la rotacin especfca a 25 para el cido mlico. Deduzca a que
temperatura el cido no ser pticamente activo.
T C 10 20 30 R= 0.219 28C
D
1.31 0.54 -0.12
4.7.9. Una mandarina con un alto grado de maduracin dio un peso de 180 g, se exprimi se
fltr y se decolor el jugo. El jugo dio un volumen de 53 mL. Se tomaron 10 ml de dicho jugo
y se ajusto con agua un volumen de 50 ml, se midi en el polarmetro (Aux Jena) en un tubo
de observacin de 20 cm su ngulo de giro, obtenindose un valor de 173 medido en un
polarimetro de 180 A. Qu posible compuesto es s su
20
es 93 y cul es el porcentaje
de dicho compuesto en la mandarina. R= 5.44%
Nota: En un polarimetro de 180A un compuesto levgiro da un ngulo de giro mayor
de 90A, por lo cual se debe restar -180A para obtener el ngulo negativo (173A - 180A
= -7A )para el presente caso.
4.7.10. Una solucin de cido l(-) glutmico, con 1.085 g/20 mL de HCl 0.37N produjo una
rotacin de -1.63, en un tubo de 100 mm. Calclese la rotacin especfca del cido glutmico.
R= -29.69
4.7.11. La l(-) diyodotirosina tiene rotacin, especfca de +2.89 cul sera la rotacin ptica
esperada para una solucin que contenga 4.41 g/60mL de HCl 1.1N si se utilizara un tubo de
5 cm? R=0.106
4.7.12. La rotacin especfca de la l(+) alanina es (
20
= 14.7) Cul ser la concentracin
de alanina en la solucin si con el uso de tubos de 20 cm se observ una rotacin ptica (B)
de + 1.70? R= 0.057
4.7.13. La rotacin especfca del cido l(+) asprtico es de 24.6 a 24C. Si la misma solucin
di una actividad de 22.3 a 18C. cul ser su rotacin especfca a 20C?. R= 22.1
4.7.14. La l(-) cistina tiene rotacin especfca de -214.0 a 24.35C. A 20C, 0.997 g/200 mL
dieron una rotacin de -2.0A en un tubo de 20 cm cul ser la rotacin especifca a 30C?.
R= -231.4
D
D
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
131
4.7.15. Cul es la diferencia de la luz no polarizada y polarizada en un plano.
4.7.16. Cul es la diferencia entre los haces de radiacin ordinario y extraordinario.
4.7.17. Defna los siguientes trminos: a) Cristal isotrpico, b) Cristal anisotrpico,
c) Birrefringencia, d) eje ptico, e) Rayo ordinario, f) Rayo extraordinario g) prisma de Nicol,
h) placa de Laurent, i) enantimero, j) dextrgiro, k) levgiro, l) mutarrotacin, m) Centro
quiral, n) Carbono asimtrico, o) isomero, p) imagen especular .
4.7.18. Qu es la dispersin ptica rotatoria?
4.7.19. Describir dos mtodos para producir radiacin polarizada en un plano.
4.7.20. Consultar en que consiste la escala internacional del azcar.
4.7.21. Para la sacarosa, C
12
H
22
0
11
,
20
=+66.5.
a) Calcular la rotacin molecular de la sacarosa.
b) Calcular el ngulo de rotacin esperado para una solucin de sacarosa cuya
concentracin es de 5.0 g/litro, medida en una celda de 10cm.
c) Una solucin de sacarosa, que originalmente tena una concentracin de
5.0 g/100 mL, presenta un valor de B = 1.75A , en una celda de 10 cm despus de
un periodo de calentamiento con cido.
Calcular la fraccin y el % de sacarosa que se ha hidrolizado.
(reaccin C
12
H
22
O
11
+ H
2
O
_______
C
6
H
12
O
6
+ C
6
H
12
O
6
)
Sacarosa glucosa fructosa
20
= +66.5 +52.7 -92.4
D
D
cido
132
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
4.7.22.
No.
Patrn
Concentracin
g / 100mL
Angulo
de giro A
1 2.0 2.60
2 4.0 5.10
3 6.0 7.15
4 8.0 9.45
Mp ? 6.31
Tabla 4.1 Datos para construir la curva de calibracin de B Vs C de glucosa para
determinar la concentracin de glucosa en una muestra, medida en un tubo de
observacin de 200 mm a 24C y en un polarmetro con una incertidumbre en la
medida de 0.05 A.
4.7.22.1 Construir la grfca del ngulo de giro versus concentracin (B Vs C)
4.7.22.2 Calcular la pendiente, el intercepto y obtener de ecuacin.
4.7.22.3 Cul es la concentracin de la muestra problema de glucosa, si el ngulo de giro
de la tabla corresponde a una solucin de 20 mL de la muestra original diluida con
agua hasta 50 ml.
4.7.22.4 Calcular la rotacin especfca para la glucosa, corregirla a 20C, teniendo en
cuenta que la rotacin especfca de la glucosa a 18C es (
18
= 42.2
), compararla
con el valor Bibliogrfco y hallar el % de error con el cual se determin.
4.7.22.5 Calcular la sensibilidad, el lmite de deteccin, el lmite de cuantifcacin, el error
Instrumental para la concentracin de la muestra, El % de error total si la concentracin
real de la muestra problema es del 12.8 % (g/100 mL).
4.7.22.6 Qu ventajas presenta la cuantifcacin de un compuesto ptimamente activo,
mediante la construccin de curvas de calibracin, sobre la cuantifcacin mediante la
utilizacin de la Frmula
4.7.23 Consultar en los catalogos de equipos para instrumentacin Quimica o en
internet sobre los ltimos modelos de polarmetros y sus aplicaciones en el
control de calidad y de procesos.
B = aLC.
D
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
133
4.8 Bibliografa
Catlogos Polarmetros
EWIN, Galen W. Mtodos Instrumentales de anlisis Qumico. Mxico: ED, Mcgraw-Hill.
GARCA, Castaeda Mauricio; Ewert, De-Geus Jeannine. Introduccin a la Fsica
Moderna (2a. ed), Bogot: ED, Centro Editorial Universidad Nacional de Colombia
1.997
HARRIS, C Daniel. Anlisis qumico cuantitativo. (3a Ed.) Espaa : Editorial Reverte S.A., c2007.
MCMURRY, John. Qumica Orgnica (5.ed), Mxico: ED, Internacional Thomson Editores 2001
MARN VILLADA, Fabio. Conferencias Anlisis Instrumental. Material mimeografado UTP
RESNICK, Robert; Halliday David. Fsica Tomos I, II. (4a. ed). Mxico: ED, Continental,
1982
MELOAN, Clifton E. Kiser, Robert W. Problemas y Experimentos en Anlisis Instrumental (1.
ed.). Mxico: ED Reverte, 1973
SKOOG, Douglas A. West, Donal M. Anlisis Instrumental (1a. ed.). Mxico: ED, Interamericana,
1.975.
SKOOG, Douglas A. West, Donal M. Anlisis Instrumental ( 2a. ed.). Mexico: ED,
Interamericana.
STROBEL, Howard A. Instrumentacin Qumica (1a. ed.). Mxico: Limusa, S.A., 1982.
THORNTON, Morrison Robert; Neilson Boyd Robert. Qumica orgnica. Mxico: ED
Fondo Educativo Interamericana S.A.
WILLARD, Hobart H., Merritt, Lynnel., y Dean John A. Mtodos Instrumentales de
Anlisis (7a. ed ).Mxico: ED, Grupo Editorial Iberoamrica, 1.99
134
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
135
QUINTA
UNIDAD
136
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
137
QUINTA UNIDAD
5. Fotometra de absorcin.
10
1
5.1 Generalidades
La fotometra de absorcin se refere al estudio de la absorcin de radiaciones
electromagnticas por las sustancias: El fenmeno en s, el comportamiento de las
radiaciones como corpsculos o partculas, el equipo utilizado, las relaciones, ley o
ecuaciones que se han establecido, las aplicaciones analticas y limitaciones.
Interaccin
Por estar muy relacionados con los fenmenos de absorcin y para un mayor
entendimiento se presenta un resumen del fenmeno opuesto: la emisin de
radiaciones.
Cuando la materia (molculas o tomos) se excita adecuadamente mediante radiacin,
calor, electricidad u otras formas de energa, puede emitir radiaciones; si se considera un
tomo sencillo con su ncleo y un electrn en su primer nivel de energa, como el
tomo de la Figura 5.1, este se encuentra en su estado basal o de menor energa
denominado estado fundamental, lo cual es simboliza por E
0
.
La energa del tomo es cuantificada y el electrn(es) solo puede(n) ubicarse en
determinados niveles energticos permitidos.
10 Materiales recopilados y organizados por el profesor Federmn Castro Eusse para la asignatura Anlisis Instrumental I de
los programas en Qumica Industrial y Tecnologa Qumica, de la Escuela de Tecnologa Qumica de la Facultad de Tecnologas
de la UTP.
Materia:
tomos
Iones
Molculas
Consecuencia
Radiacin
Absorcin
UV
VIS
IR
138
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Los crculos 2, 3, 4, 5, 6 nos estn representando otros posibles niveles energticos,
pero no corresponden al estado fundamental, sino que pueden ser alcanzados cuando el
tomo se excita. Para que un electrn pase de un nivel energtico a otro permitido, la
energa suministrada debe ser justamente igual a la diferencia entre las energas de los
dos niveles: El electrn no puede excitarse poco a poco, sino de un salto a uno de los niveles
permitidos. En la figura 5.1 se ilustra las posibles transiciones de un electrn a
diferentes niveles de excitacin permitidos.
Si al tomo en estado fundamental se le suministra la energa necesaria para promover el
electrn del nivel de menor energa (nivel 1) a otro de mayor energa (nivel
2), el tomo pasa del estado fundamental a un estado excitado o de mayor energa
simbolizado como E
1
, lo cual signifca que el tomo ha pasado de un estado de menor
energa E
0
a otro de mayor energa E
1.
Figura 5.1 Transiciones electrnicas que originan las series de Lyman, Balmer y
paschen del espectro del Hidrgeno.
El estado excitado es inestable y el electrn tiende a regresar espontnea e
instantneamente a su estado normal (en un lapso aproximado de 10
-8
segundos),
pasando el tomo del estado de mayor energa E
1
al estado de menor energa E
0
emitiendo la energa sobrante. Esta energa se emite en forma de una radiacin cuya
frecuencia es tal que la energa cuntica de la radiacin es igual a la diferencia energtica de
los dos estados. E=E
1
-E
0
= h
1
.
Siendo E
1
la energa del nivel de excitacin; E
o
la energa del nivel normal;
1
la frecuencia
Ncleo
+
Energa alta
ultravioleta
Infrarojo
Energa baja
Niveles
de energa
Luz visible
Rojo
Azul
Ail
Violeta
1
2
3
4
5
6
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
139
de la radiacin y h la constante de Planck.
Por supuesto que si la energa suministrada es la adecuada para excitarlo a un nivel superior,
digamos E
2
, se puede emitir otra radiacin de mayor frecuencia. E=E
2
-E
0
= h
2.
La estructura de los tomos de los diferentes elementos no es tan sencilla como la
considerada sino mucho ms compleja, (ver figura 5.2) por lo cual pueden existir varios
estados excitados los cuales originan gran cantidad de radiaciones electromagnticas que
constituyen los espectros de emisin por los cuales se caracterizan los elementos.
tomo 1 tomo 2
Figura 5.2 tomos 1 y 2 de diferentes elementos con estructuras electrnicas
ms complejas Que originan mayor nmero de transiciones electrnicas y por
consiguiente ms lneas de emisin.
Los electrones de los niveles internos del tomo, requerirn energas de excitacin elevadas
y producirn emisiones de alta frecuencia.
Adems cada nivel energtico est dividido en subniveles de acuerdo a los nmeros
cunticos (principal, magntico y de spin), lo cual aumenta las posibilidades de excitacin y
de emisin.
En los elementos de alto peso atmico los niveles energticos son ms compactos, ms
numerosos y complejos, y las posibilidades de absorcin y de emisin de energa se
multiplican.
{
{
Excitacin
Estados
excitados
Estado fundamental Estado fundamental
Estados
excitados
Emisin
Energa luminosa
l 3
l 2
l 1
140
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
En las molculas tambin las posibilidades son muchas, pues adems de los niveles
permitidos para los electrones de los diferentes tomos, aparecen nuevos niveles energticos
cuantifcados correspondientes a los diferentes movimientos de rotacin y de vibracin de los
tomos de la molcula unos respecto de otros.
Se concluye entonces, que si excitamos un material, tendremos un foco o fuente
de radiaciones (ver diagrama del espectro electromagntico cuadro 2.2
segunda unidad) cuyas frecuencias sern altas o bajas, y de una variedad de frecuencias
ms o menos amplia dependiendo del material y del grado de excitacin a que se les
someta. As por ejemplo, para producir radiaciones del ultravioleta se usan lmparas de
hidrgeno, deuterio; para el visible sirve el sol o un bombillo de tungsteno,
halgeno o xenn y para el infrarrojo sirve un filamento de nicromo, un cuerpo
incandescente de Nernst o el globar.
En el fenmeno de absorcin si una radiacin proveniente de una fuente o foco
incide sobre otra sustancia (tomo, molcula, in), y su energa cuntica es
exactamente la necesaria para que se produzca una excitacin en alguno de los niveles
energticos permitidos de la sustancia, la radiacin podr ser absorbida produciendo la
excitacin correspondiente.
Cuando la radiacin pasa a travs de una capa de un slido, un lquido o un gas, ciertas
frecuencias () pueden eliminarse selectivamente por absorcin, un proceso en el que
la energa radiante se transfere a los tomos, iones o molculas constitutivas
de la muestra. La absorcin promueve a estas partculas desde su estado normal a
temperatura ambiente, o estado fundamental, a uno o varios estados excitados de
energa ms elevada.
Segn la teora cuntica, los tomos, iones o molculas solo tienen un nmero
limitado de niveles de energa discretos y, por tanto, para que se produzca la absorcin
de la radiacin, la energa de los fotones excitadores debe coincidir exactamente con
la diferencia de energa entre el estado fundamental y uno de los estados excitados de las
especies absorbentes. Estas diferencias de energa son caractersticas para cada especie,
el estudio de las frecuencias de la radiacin absorbida proporciona un medio de caracterizar
a los constituyentes de una muestra de materia denominado espectro de absorcin
que puede ser atmico o molecular, los cuales presentan diferencias fundamentales si
corresponden a tomos de un elemento o molculas de un compuesto, o
para el caso de las molculas si han sido registrados en diferentes regiones del espectro
electromagntico.
Cada sustancia segn la naturaleza energtica de su estructura podr absorber determinadas
radiaciones: el n-hexano absorbe radiaciones de 230 nm (UV), el cobre atmico absorbe
las de 324.7 nm (UV), el in cobre en solucin acuosa absorbe las de 610 nm (VIS), el
grupo CH de los hidrocarburos saturados absorbe a 3.5 m (IR).
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
141
Las molculas son estructuras que se encuentran en continuo movimiento en las cuales
encontramos los movimientos de: Translacin, rotacin, vibracin y electrnico,
asociados a las energas de traslacin, rotacin, vibracin y electrnica; por lo cual pueden
absorber radiaciones de las diferentes regiones del espectro electromagntico. Las radiaciones
UV y VIS afectan la energa electrnica que es la energa asociada con la energa
potencial y cintica de los electrones de las molculas originando transiciones
electrnicas y la radiacin IR afecta la energa vibracional originando transiciones
vibracionales.
5.2 Absorcin de Radiaciones ultravioleta y Visible por las Molculas.
Fundamentado en la teora del orbital molecular, las molculas de manera anloga a los tomos,
tienen niveles de energa electrnica asociados con las mismas que se denominan orbitales
moleculares. Estos se originan en la interaccin entre los orbitales atmicos de los
tomos que forman la molcula. La interaccin de los orbitales atmicos da lugar
a un orbital de baja energa denominado orbital de enlace y otro de alta energa que se
denomina orbital anti-enlace. El orbital que no interacciona se denomina orbital de no
enlace.
Los orbitales P pueden interactuar extremo a extremo o lado a lado para formar
respectivamente, los orbitales moleculares p y .
En la representacin de una molcula diatmica Figura 5.3a los orbitales S de los
tomos A y B interaccionan entre s para producir dos orbitales moleculares AB. Uno de
los orbitales producidos es de menor energa y el otro de mayor energa que los
orbitales originales.
a b
Figura 5.3 a representacin de una molcula diatmica, b representacin de la
molcula diatmica de hidrgeno.
s
s
tomo A
tomo B
Molcula AB
E
H
H
H
2
1
s
1
s
s
Orbital antienlace
mayor energa
s*
s*
Orbital antienlace
menor energa
Orbital antienlace
mayor energa
Orbital antienlace
menor energa
1
142
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
La molcula diatmica del H
2
(ver figura 5.3b) es ms estable debido a que los
electrones se encuentran en un nivel de energa inferior y cuanto menor es la energa ms
estabilidad presenta el sistema.
Los orbitales moleculares de enlace y anti-enlace tanto como p se representan tambin
utilizando un diagrama de nube de cargas como lo muestra la figura 5.4 a, o utilizando los
diagramas anteriores Ver figura 5.4 b.
Los orbitales son simtricos en cuanto a la rotacin alrededor del enlace mientras que los
orbitales p no lo son.
Cuanto mayor es la interaccin entre los orbitales atmicos que forman los orbitales moleculares,
mayor es la separacin entre los orbitales moleculares de enlace y anti-enlace. La
interaccin de los orbitales P para formar un orbital molecular es mayor que para la interaccin
p (ver figura 5.4).
Un orbital atmico que no interacciona con otros orbitales atmicos se representa en el diagrama
de orbital molecular con la misma energa que tena en el tomo. Este tipo de orbital se denomina
orbital molecular sin enlace (n), (ver figura 5.5).
a b
Figura 5.4 a Representacin de los orbitales moleculares de enlace y anti-enlace
utilizando un diagrama de nube de cargas y b diagramas.
Distribucin de electrones en orbitales moleculares
sigma y pi
Orbital s Orbital s*
Orbital p
Orbital p*
Orbitales antienlazantes
Mayor energa
Orbitales antienlazantes
Menor energa
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
143
Figura 5.5 Representacin de un orbital molecular sin enlace, orbital n.
El espectro electrnico de una molcula resulta de una transicin entre dos niveles de
energa electrnica molecular diferentes, la cual se designa con la siguiente notacin
*
(que se lee sigma, sigma anti-enlazante)
o con un diagrama, ver figura 5.6 a y la transicin electrnica se
observa en la figura 5.6 b.
*
b
Figura 5.6 a representacin de la transicin, b transicin en la molcula del
Hidrgeno
Que representa la transicin desde el orbital molecular de enlace hasta el orbital
molecular de anti-enlace igual notacin se utiliza para las transiciones p y n (pp
*
,
n
*
,np
*
).
Los electrones en las molculas se encuentran girando en niveles de energa bien defnidos.
En condiciones normales la molcula no est excitada y los electrones se encuentran en
el orbital ms bajo, se dice entonces que la molcula (M) se encuentra en su
estado fundamental. Si una molcula absorbe una cantidad discreta de energa radiante
(h) los electrones del orbital de menor energa u orbital de enlace pasan a otro de mayor
energa u orbital anti-enlace. En el nuevo estado tanto la molcula como el electrn
se encuentran excitados (M
), luego de la absorcin y en un corto periodo de tiempo
py
px
px n
sin
enlace
H H
H
2
s*
s
s
Transicin electrnica
144
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
regresa al estada fundamental (M) liberando la energa absorbida como luz o calor.
M + h M
M + calor, luz (emisin, fluorescencia)
Absorcin Excitacin Relajacin
Cuando se emite luz se presenta el fenmeno de luminiscencia que puede comprender
la fuorescencia o la fosforescencia, fenmenos utilizados en la industria del papel, los detergentes
etc. Ocasionados por los denominados blanqueadores pticos. La fuorescencia puede ser de
resonancia cuando la longitud de onda de radiacin emitida es igual a la longitud de onda de
la radiacin absorbida o no resonante si son diferentes; por lo cual son aprovechados en la
tcnica analtica de fuorescencia molecular.
Por la accin de las radiaciones tambin se puede presentar descomposicin de la muestra
ocasionada por fotorreacciones lo que da origen a la fotoqumica.
Los niveles de energa electrnica se encuentran perfectamente defnidos y cuantifcados lo
cual hace que se permitan transiciones electrnicas solo entre ciertos niveles de energa por
absorcin de radiacin UV o VIS.
La frecuencia de la radiacin absorbida se relaciona con la energa mediante la ecuacin
E = h, (siendo la =C/ y 1/= , por consiguiente E = hc , donde h es la constante de
Planck igual a 6.62 x10
-34
julios segundo, C es la velocidad de la luz igual a 3x10
10
cm/s, la longitud de onda y el nmero de onda). La cantidad de energa necesaria para
un trnsito electrnico desde el estado fundamental, E
o
, a un estado excitado, E
1
, viene dada
por la ecuacin E=E
1
- E
o
= h.
Si se examina la absorcin de radiacin UV o VIS debida a un gran nmero de molculas de
un compuesto dado, se observa que distintas molculas exigen cantidades diferentes de energa
para su excitacin, esto es a consecuencia de la diferencia de energa vibratoria o
rotatoria que existe entre ellas. Por esto, la absorcin de energa se produce sobre un amplio
rango de frecuencias, obtenindose bandas de absorcin en lugar de lneas que seran de esperar
si la absorcin se produjera a una sola frecuencia. En las molculas solo estn permitidos unos
pocos niveles de energa y los espectros de absorcin son, por tanto, sencillos y cubren
un amplio rango de longitudes de onda como los mostrados en la figura 5.7.
En las molculas orgnicas se distinguen tres tipos de electrones. En primer lugar, los
electrones que intervienen en los enlaces saturados, como son los que existen entre
carbono e hidrgeno en las parafnas. Estos enlaces se llaman enlaces . La energa
necesaria para excitarlos es elevada y se requieren radiaciones con longitudes de onda inferiores
a 150 nm que se encuentran en el UV vaco. Por esta razn las parafnas no absorben en el
UV del cuarzo y son muy adecuadas como disolventes; presentan transiciones
*
compuestos como el pentano, hexano, y en general compuestos con enlaces:
- CC-, - CH.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
145
Figura 5.7 espectros en la regin UV y VIS de diferentes compuestos
Un segundo tipo de electrones son los que forman enlaces no saturados en los
hidrocarburos. Estos enlaces constan de un enlace y un enlace p Ejemplos caractersticos
de compuestos con enlace p son los trienos conjugados y los compuestos
aromticos. Originan transiciones pp
*
a longitudes de onda entre 180 y 700 nm
denominados bandas k que presentan desplazamiento batocrmico con el aumento de
la polaridad del solvente y son de alta absortividad con valores mayores de
10.000 L cm
-1
mol
-1
.
Ejemplos:
CH
2
= CH - CH = CH
2
, C = C, C C -
Finalmente existen electrones que no estn implicados en ningn enlace y se
conocen como electrones n. Los hidrocarburos saturados no poseen ningn electrn
n, ya que tanto los cuatro electrones ms externos del carbono como el nico del hidrgeno,
intervienen en la formacin de enlaces. Los compuestos orgnicos con tomos de nitrgeno,
1.0
0.8
0.6
0.4
0.2
0
350 400 400 500 550 600 650
0
250 270 290 310 330 350
O
O
N
N
N
N
CH
3
CH
3
Cafena
b - caroteno
0
250 270 290 310 330 350
O
C
CH
3
cido acetil salicilico
(aspirina)
CH
C
O
O
0
210 230 250 270 290 350
CH
3
Acetona
C
O
CH
3
310 330
Longitud de onda, nm UV
A
b
s
o
r
b
a
n
c
i
a
A
b
s
o
r
b
a
n
c
i
a
A
b
s
o
r
b
a
n
c
i
a
1.0
0.8
0.6
0.4
0.2
1.0
0.8
0.6
0.4
0.2
1.0
0.8
0.6
0.4
0.2
A
b
s
o
r
b
a
n
c
i
a
Longitud de onda, nm UV
Longitud de onda, nm UV
Longitud de onda, nm UV-VIS
146
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
azufre, oxgeno, Halgenos, tienen todos electrones no enlazantes. Como estos
electrones n son excitados por radiacin UV; todo compuesto que los posea absorbe dicha
radiacin.
Los electrones n originan transiciones n
*
y n p
*
, Las transiciones n
*
se producen
entre longitudes de onda de 150 a 250 nm. Las absortividades molares
asociadas con este tipo de absorcin son intermedias en magnitud y generalmente varan de 100
a 3000 L cm
-1
mol
-1
. Los mximos de absorcin sufren desplazamiento hipsocrmico,
en presencia de solventes polares como el agua o etanol. Ejemplos de grupos de tomos que
originan dichas transiciones son:
--C O - , - C S-- --C N -- , -- C Cl:
Las transiciones np
*
denominadas bandas R, requieren de un grupo funcional
insaturado para proporcionar los orbitales p. Se producen en un rango de longitudes
de onda 200 a 700 nm. La energa requerida para producir este tipo de transiciones es
muy baja con absortividades molares que varan desde 10 a 100 L cm
-1
mol
-1
, presentan
desplazamiento hipsocrmico al aumentar la polaridad del disolvente, estas transiciones al
igual que las n
*
son de gran utilidad en las aplicaciones espectroscpicas de las regiones
del UV y VIS ya que se requieren bajas energas para que se produzcan. El grupo
carbonilo (-C = O -) presenta transicin np
*
.
Los espectros (ver figuras 5.7 y 5.8) son representados en un plano de coordenadas en
cuya abscisa se encuentra en forma lineal el nmero de onda (), o la longitud de
onda () expresada en nanmetros. En el eje de ordenadas comnmente se representa
la absorbancia, pero tambin es usual encontrar el porcentaje de transmitancia
(%T), la absortividad molar o el logaritmo de la absortividad molar (Log
). El mximo de absorcin es caracterstico de la transicin electrnica que es ocasionada y
esta a su vez del grupo cromforo que la ha originado. El mximo de absorcin o longitud
de onda del mximo se ve afectada por el medio electrnico que acompaa el cromforo y
por la polaridad del solvente utilizado.
Los espectros de las molculas simples en estado gaseoso consisten en picos de absorcin
estrechos, representando cada uno de los mismos una transicin desde una combinacin
particular de niveles vibracionales y rotacionales en el estado bsico electrnico hasta una
combinacin correspondiente en el estado excitado. El benceno y muchos de sus homlogos se
caracterizan por un espectro con una estructura fna originada por los subniveles de absorcin
vibracional sobre la cual queda superpuesta la absorcin electrnica.
..
..
..
..
.. ..
..
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
147
a b
Figura 5.8 (a) espectro de absorcin del permanganato de potasio y (b ) del cloruro
de cobalto) en la regin visible
En resumen las tres transiciones consideradas implican:
1. Electrones , p y n en los compuestos orgnicos.
2. Electrones d y f en los tomos de los elementos de transicin cuyas sales
presentan coloraciones caractersticas y absorben fuertemente en la regin del visible.
3. Electrones de transferencia de carga en los compuestos de coordinacin metal
liqando o complejos de elementos; formados para el anlisis de una gran cantidad
de elementos, aniones y cationes. Donde el electrn pasa del metal al ligando o
tambin puede pasar del ligando al metal, M-L + h C/ M
+
+ L
-
(M= metal,
L= ligando).
La absorcin por transferencia de cargas es de gran importancia, ya que
produce absorbancias muy grandes que permiten la utilizacin de mtodos analticos
mucho ms sensibles para la deteccin de concentraciones por el orden de dcimas y
centsimas de partes por milln de muchos compuestos, elementos, aniones y cationes.
Un ejemplo importante es la determinacin del Fe
2+
mediante la formacin de un
complejo con la 1,10 ortofenantrolina cuyo espectro en la regin visible
presenta una fuerte banda de absorcin con un mximo a 540 nm.
5.2.1 Terminologa: algunos Trminos utilizados en Espectroscopia UV y VIS son
defnidos as:
Cromforo: Grupo insaturado covalentemente que es responsable de la absorcin
electrnica.
2.090
0.031
350.0 700.0
350.0 700.0
-0.010
1.265
526.0
2.030
510.0
1.265
Longitud de onda, nm VIS Longitud de onda, nm VIS
A
b
s
o
r
b
a
n
c
i
a
A
b
s
o
r
b
a
n
c
i
a
148
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Con este trmino se designan los grupos que absorben radiaciones en las regiones ultravioleta y
visible, describe el sistema que contiene los electrones responsables de la absorcin.
Ejemplo: C = O, C = C , NO
2
, - C = 0 -, N=N
Auxocromo: Grupos saturados que cuando se encuentran unidos a un cromforo; altera
tanto la longitud de onda como la intensidad del mximo de absorcin.
Ejemplo: OH, NH
2
, NO
2
, C-NH
2
, COH, CBr
Desplazamiento Batocrmico: (Desplazamiento rojo). Desplazamiento de un mximo
de absorcin a una mayor longitud de onda, ocasionado por efecto del solvente o un
sustituyente.
Desplazamiento hipsocrmico: (Desplazamiento azul). Desplazamiento de un mximo
de absorcin a una menor longitud de onda, ocasionado por efecto del solvente o un
sustituyente.
Efecto Hipercrmico: Aumento de la intensidad en un mximo de absorcin ocasionado
por efecto del solvente o un sustituyente.
Efecto Hipocrmico: Disminucin de la intensidad en un mximo de absorcin
ocasionado por efecto del solvente o un sustituyente.
Espectroscopia: Del latn Spectrum (imagen) y del griego Skopio (observar), es la
parte de la fsica que estudia los espectros. Tcnicas diseadas para la obtencin y anlisis
de espectros de radiaciones electromagnticas emitidas o absorbidas por las sustancias,
(tomos, iones o molculas).
Espectro: Un espectro es una representacin grfca de las transiciones electrnicas o
vibracionales de absorcin o emisin de tomos, iones o molculas en las regiones UV, VIS
o IR, en un plano de coordenadas en cuyo eje de ordenadas o eje Y se puede encontrar
la absorbancia (A), el porcentaje de transmitancia (%T), la absortividad molar ( ), el
logaritmo de la absortividad molar (Log ), o la intensidad, y en el eje de abscisas o eje X,
se puede encontrar la longitud de onda (), la frecuencia () o el nmero de onda (); el cual
es utilizado para cualifcar (identifcar), y cuantifcar ( determinar la cantidad o concentracin)
de un elemento, in o molcula. Por lo tanto los espectros comnmente tienen representacin
bidimensional, pero tambin existe la representacin tridimensional. Cuando se analiza
un espectro es interesante examinar cuidadosamente la posicin y la intensidad de la (s)
banda(s), ya que a partir de ellas se obtiene la informacin qumica requerida.
En la regin visible del espectro electromagntico, es interesante analizar el
fenmeno del color entendido como la interpretacin que hace nuestro sistema visual
de determinadas longitudes de onda de la luz visible, la percepcin del color es un proceso
neurofisiolgico sumamente complejo, por lo cual solo se considera lo fundamental para
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
149
entender la fotometra visible y los diferentes colores estudiados por la teora del color.
Vemos diariamente, la luz blanca que es la sensacin que percibimos cuando a la retina
llegan mezcladas las radiaciones de todas las longitudes de onda de la regin visible del
espectro (de 400 a 800 nm). Cuando a la retina no llega ninguna radiacin del visible
tenemos el color negro (o negacin de color). Para la explicacin de los dems colores,
es conveniente el anlisis del cuadro 5.1, teniendo en cuenta que de cada uno de los
colores hay varias tonalidades.
La primera columna del cuadro es el rango de longitudes de onda de los colores que aparecen
en la segunda columna. La columna Color complementario indica que si de una luz
blanca (mezcla de todos los colores) quitamos un color, la mezcla de los colores restantes nos
dar la sensacin del color indicado. Por color complementario se entiende cualquier
pareja de colores que al mezclarse en proporciones adecuadas dan el color blanco; como
colores primarios se conocen los tres colores (rojo, verde, azul), empleados como
base para producir todos los colores. En los pigmentos se utilizan los denominados primarios
sustractivos (magenta, amarillo, cian).
Por ejemplo si a la retina llega una radiacin de 475 nm la ver de color azul, si llega una
mezcla de todos los colores menos los de 575 nm tambin la percibir azul.
Rango aprox. De longitud
de longitud onda nm
Color
Color
complementario
400-450
Violeta Amarillo-verde
450-480 Azul Amarillo
480-490 Azul verdoso Naranja
490-500 Verde azuloso Rojo
500-560 Verde Prpura
560-575 Amarillo verdoso Violeta
575-590 Amarillo Azul
590-625 Naranja Azul verdoso
625-750 Rojo Verde azuloso
Cuadro 5.1 rangos aproximados de longitud de onda donde se ubican los colores.
Por eso si iluminamos con luz blanca una solucin de in cobre, la cual absorbe preferiblemente
el color naranja, a la retina le llega la sensacin del color azul verdoso para esta solucin, el
cual no es realmente color azul verdoso, sino una mezcla.
Existen objetos transparentes y objetos opacos. En los objetos transparentes la luz es
transmitida a travs de ellos, en los opacos la luz es reflejada. Una pared es
roja bien porque absorbe todos los colores y refleja solo el rojo, o porque refleja una
mezcla que da la sensacin de rojo. Un vidrio es rojo si deja transmitir el rojo o una mezcla
que da esta sensacin.
150
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
La fenolftalena en medio cido no absorbe radiaciones del visible, pero si le agregamos
una base su estructura cambia y aparecen niveles energticos que pueden absorber
radiaciones del visible y percibimos un color rosado.
Observando una solucin de sulfato de cobre, su color azul ser ms intenso a medida que
aumente la concentracin de ion Cu
2+
, este se debe a que cada vez absorbe ms color
naranja. Podra relacionar la concentracin de in cobre de una solucin desconocida
con la intensidad del color azul que percibimos o con la cantidad de color naranja
que absorbe: en el primer caso bastara preparar varias soluciones patrn de diferente
concentracin conocida, comparar con ellas la desconocida y ver a cual corresponde. Esta
tcnica es usada en el laboratorio en muchas ocasiones y es la base de los dispositivos
llamados comparadores colorimtricos muy utilizados para hacer anlisis aproximados
de aguas potables y aguas para piscinas, como tambin en laboratorios de control de calidad
en la industria.
En el segundo caso no podramos iluminar con luz blanca la solucin, sino con la luz
naranja para ver como cambia su intensidad segn que se absorba mas o menos de
acuerdo con la concentracin.
Esta segunda alternativa es la que se prefere en los mtodos instrumentales
Fotomtricos, ya que como se ha observado da mayor exactitud en el anlisis, permite
diferenciar las sustancias segn la frecuencia o longitud de onda de la luz que absorben y
permite analizar mezclas de sustancias.
La importancia de los colores complementarios se pone de manifesto en el anlisis
qumico mediante la espectroscopia visible cuando el elemento, In o compuesto a analizar
en la regin del visible, no presenta coloracin, siendo necesaria la formacin de un
complejo cuyo color es el color complementario del que presenta el rango en el cual se
ubica la longitud de onda analtica. Ver cuadro 5.1. Es necesario tener en cuenta
que para los anlisis en las regiones UV e IR, no se requiere que la muestra y los patrones
presenten alguna coloracin caracterstica, estos pueden ser coloreados o incoloros,
pero en la regin del visible se requiere que tanto la muestra como los patrones
presenten la misma coloracin caracterstica pero de diferente intensidad.
5.3 Leyes de la absorcin
Cuando un haz pasa a travs de una solucin que absorbe radiacin, parte del haz es
absorbido. La cantidad de luz absorbida se encuentra bien defnida y se ajusta a ciertas leyes
fsicas. As por ejemplo, si I es la intensidad de un haz de radiacin monocromtica
que incide sobre una solucin, e
1
I es la intensidad de la radiacin emergente
(figura 5.9), la relacin entre
1
I e I recibe el nombre de transmitancia cuya expresin
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
151
matemtica es:
I
I
T
1
= donde T es la transmitancia o fraccin de luz transmitida por la
solucin. La relacin
I
I
1
es independiente de I . Por lo tanto el porcentaje de transmitancia
(%T), es igual a
I
I
1
multiplicado por 100. Luego, 100 %
1
X
I
I
T =
Figura 5.9 Ilustracin de un haz de radiacin que incide y emerge de una solucin
Si en lugar de examinar el fenmeno en trminos de la cantidad de luz transmitida, se
estudia la cantidad de luz absorbida, se obtiene una relacin de forma distintita.
Supongamos que una solucin de concentracin unidad y de 1 centmetro de espesor
absorbe el 50% de la radiacin de longitud de onda, l , que incide sobre ella. Entonces
unidades
I
I
100
50
1
= .
Si se coloca detrs de la primera una segunda solucin similar, de 1 centmetro de espesor
y que absorbe tambin el 50% , solo 50 unidades de luz inciden sobre ella y, por tanto,
emergen 25 unidades ver figura 5.10.
Figura 5.10 absorcin de radiacin por una solucin de concentracin unidad
dispuesta en dos celdas
Solucin
Haz de radiacin incidente
Haz de radiacin emergente
I
I
50
1 cm 1 cm
50%
absorcin
50%
absorcin
=100
1
=50
2
=25 I
I I
1
152
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
La relacin es logartmica y viene dada por:
1
10
1
10 10 10
log
1
log
I
I
Log
I
I
Log T
T
A = = = =
Ecuacin 5.1, siendo A la
absorbancia o densidad ptica I la intensidad original de la radiacin e
1
I la
intensidad de la radiacin despus de la absorcin.
5.3.1 Ley de Lambert
La ecuacin 5.1 constituye la base de la ley de Lambert (tambin conocida como ley
de Bouguer). Para una solucin de concentracin unidad, la relacin puede ponerse en la
forma:A= ab, donde a es la absortividad del lquido y b la longitud del recorrido ptico.
La relacin mutua de estas medidas viene dada por:
1
1
log log
I
I
I
I
Log T ab A = = = =
luego
ab
I
I
Log =
1
, entonces
ab
I
I
10
1
=
y
ab
I I
= 10
1
o bien
cada una
de estas relaciones es una expresin matemtica de la ley de lambert e indican que
la cantidad de luz absorbida depende de la absortividad del lquido y de la longitud
del trayecto ptico a travs de la solucin, en el supuesto de que la longitud de onda y la
muestra permanezcan constantes, mostrando que existe una relacin logartmica entre la
transmitancia y el recorrido ptico a travs de la muestra. Por tal razn si y a permanecen
constantes A es directamente proporcional a b ( A
a
b ) para resolver la proporcionalidad
se introduce una constante a que recibe el nombre de absortividad especfca y por lo tanto
A= ab.
5.3.2 Ley de Beer
Hay otra relacin similar entre la transmitancia y la concentracin de la solucin.
Considerando un dispositivo ptico como el de la figura 5.11 donde la radiacin
incidente, I , es 100 unidades. La emergente
1
I es 50 y la concentracin de
la solucin 0.1 g. por 100 mL.
Figura 5.11 disposicin ptica ilustrativa de la ley de Beer
=100 I
1
=50 I
0.1 g
por
100ml
incidente
emergente
10 10 10 10
ab
10
ab
10
-
ab
10
ab
ab
ab
I I 10
1
=
ab
I I 10
1
=
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
153
S se coloca un segundo recipiente similar en el trayecto de la luz que emerge, la intensidad
de la radiacin,
1
I , que sale de este ltimo, es 25 unidades figura 5.12
Figura 5.12 Relacin entre transmitancia y concentracin
Si se cambian ahora las condiciones, de tal modo que el primer recipiente contenga todo el
material absorbente, es decir, que su concentracin sea 0.2 g. por 100 mL; al
medir la intensidad de la radiacin que emerge se obtiene un valor de 25 unidades ver
figura 5.13.
Figura 5.13 Ilustracin de la relacin entre transmitancia y concentracin
0.1 g
por
100ml
0.1 g
por
100ml
1
=50 I
=100 I
incidente
1
=25 I
emergente emergente e incidente
1
=100 I
1
=50 I
0.1 g
por
100ml
incidente
emergente
=100 I
1
=25 I 0.2 g
por
100ml
incidente
emergente
154
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
En consecuencia, para un trayecto ptico dado, la absorcin vendr dada por: ac A = ,
siendo c la concentracin del material absorbente, A la absorbancia y a la absortividad
de la muestra. Al igual que antes las relaciones son:
1
1
log log
I
I
I
I
Log T ac A = = = =
adems,
ac
I
I
Log =
1
y
ac
I I
= 10
1 o bien
ac
I I 10
1
= estas expresiones,
son todas ellas, formas de la Ley de Beer y muestran la relacin entre el grado de
absorcin y la concentracin para una longitud de onda y espesor dados. Por tal razn si
y a permanecen constantes A es directamente proporcional a C ( A a C ), para resolver
la proporcionalidad se introduce una constante a que recibe el nombre de absortividad
especfca y por lo tanto A= aC.
5.3.3 Ley de Beer Lambert
La combinacin de las leyes de Beer y Bouguer da lugar a la ley de Beer-Bouguer,
ms conocida como la ley de Beer- Lambert simplemente Ley de Beer.
La combinacin de las dos relaciones permite escribir que:
T I
I
I
I
T abc A
1
log log log log
1
1
=
|
|
.
|
\
|
= |
.
|
\
|
= = = luego abc
I
I
=
|
|
.
|
\
|
1
log entonces
abc
I
I
10
1
=
|
|
.
|
\
|
o bien
abc
I I
= 10
1
e
abc
I I 10
1
= en conclusin en la ley de
beer abc A = o bc A e = bc ecuacin 5.2.
Estas expresiones muestran que existe una relacin lineal entre la absorbancia A, la
concentracin, C , y el espesor de la trayectoria ptica de una solucin dada, ( A C ),
para resolver la proporcionalidad se introduce una constante que es
igual
ab entonces abc A = , supuestas constantes la longitud del trayecto ptico y la
longitud de onda.
Las consecuencias analticas de esta relacin son muy importantes.
Midiendo la relacin |
.
|
\
|
I
I
1
se puede determinar la absorbancia y con ella calcular C .
10
10
10
ac
10
-ac
10
ac
ac
= 10
ac
ac
ac
I
I
10
1
=
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
155
El trmino absortividad especfica a es utilizado cuando la concentracin se expresa
en g / litro o mg/ mililitro y absortividad molar , cuando la concentracin se
expresa en moles / litro; de tal manera que aXpm = e siendo pm el peso molecular de
la especie absorbente; luego
pm
a
e
=
. La absortividad molar o la absortividad especfca
expresan la capacidad que tiene una sustancia de absorber determinadas radiaciones del
espectro electromagntico. El trayecto ptico o espesor de la celda que contiene la
especie absorbente, b se expresa en centmetros. Cuando el valor de b no se especifca,
se entiende que es de 1 cm.
En la relacin lineal representada por la ecuacin de la lnea recta Y= mx + b, Y = A,
m= ab, x = C y b= 0, por lo tanto si 0 = C , A debe ser igual a 0 . Por lo cual la lnea
recta debe pasar por el origen, y el intercepto b de la lnea con el eje Y es igual a cero,
cuando en una grfca de calibracin de absorbancia ( A) versus concentracin ( C ), se
presenta esta condicin se dice que se cumple la Ley de Beer, ver figura 5.14. La
pendiente m de la grfca es igual a la absortividad por el espesor de la trayectoria
ptica las cuales permanecen constantes.
Para construir la grfca de calibracin se preparan patrones de diferentes concentraciones,
ver figura 5.15, preferiblemente mltiplos de la concentracin del primer patrn lo cual
permite visualizar rpidamente el comportamiento con la absorbancia para establecer la
regin lineal considerando el trabajo experimental. Se determina la absorbancia de cada
patrn a la longitud de onda adecuada y usando celdas de igual espesor, se grfca la A vs
C. La grfca debe ser una lnea recta que al ser extrapolada pasa por el origen, condicin
ideal figura 5.17. Cuando hay desviaciones no da la lnea recta. La desviacin puede
ser positiva si la absorbancia da mayor que lo normal o negativa si da menor, cuando a
pesar de dar una lnea recta su extrapolacin no pasa por el origen indica que hay desviaciones
en la zona de bajas concentraciones que luego se puede estabilizar ver figura 5.17.
Otra manera de saber si se cumple la ley de Beer es calcular la absortividad especfca o
la absortividad molar con los datos de cada patrn si el valor aparece constante la conclusin
es afrmativa. Cuando un sistema absorbente no cumple la ley Beer, no se debe
aplicar la ecuacin abC A = ni las relaciones derivadas de sta. El recurso para hacer un
anlisis cuando esto ocurre es utilizar la misma grfca de A contra C, como curva de
calibracin, se mide la absorbancia de la solucin desconocida y en ella se determina su
concentracin.
El cero de absorbancia o 100% de transmitancia se ajusta en el instrumento con
un blanco fotomtrico: Cuando se va a determinar el poder absorbente de una sustancia,
esta se encuentra generalmente dentro de un medio formado por el solvente, los reactivos
agregados, u otras sustancias que la acompaan, todo lo cual puede llegar a interferir un
pm
156
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
poco la medida, al igual que la dispersin y la refexin en las paredes de celda. Para corregir
estos fenmenos en la medicin, es necesario disponer de una base de comparacin que es
una solucin que contiene las sustancias que pueden causar interferencia, todos los reactivos
adicionados pero no contiene la especie absorbente que se va a determinar; o si la contiene,
esta debe estar en otro estado de oxidacin que no interfera. A dicha solucin se denomina
blanco fotomtrico, y es utilizado tambin para compensar las prdidas por dispersin
y refexin ocasionadas por el material de la celda y partculas ver figura 5.17.
Figura 5.14 Grfica de calibracin A Vs C .
2 4 6 8 10 12
0
0.25
0.50
1.0
0.75
Concentracin (mg/L)
A
b
s
o
r
b
a
n
c
i
a
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
157
Figura 5.15 Conjunto de patrones externos para Cu
2+
con la respectiva grfica de
calibracin.
Cuando se cumple la ley de Beer, es aplicable la siguiente relacin: sean dos
soluciones de la misma sustancia absorbente, una de concentracin conocida y otra de
concentracin desconocida, ambas absorben el mismo color complementario o la misma
0,000 0,002000 0,004000 0,006000 0,008000
Concentracin de Cu
2+
(M)
0,00
0,0100
0,0200
0,0300
0,0400
0,0500
0,0600
0,0700
0,0800
0,0900
0,1000
0,1100
0,1200
0,1300
0,1400
0,1500
0,1600
0,1700
0,1800
0,1900
0,2000
0,2100
0,2200
0,2300
0,2400
A
b
s
o
r
b
a
n
c
i
a
158
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
l . Relacionndolas tenemos:
1 1 1 1
C b A e = (1)
2 2 2 2
C b A e = (2), ambas sustancias son de un sistema que cumple la
ley de Beer.
1
C = concentracin conocida
2
C = concentracin desconocida
2 1
e e = absortividad molar
2 1
b b = espesor de celda
2 1
C C
Dividiendo (1) entre (2)
2 2 2 2
1 1 1 1
C b A
C b A
e
e
=
=
, Simplifcando queda
2
1
2
1
C
C
A
A
= luego
2
2
1
1
C
A
C
A
=
S
1
A =
P
A =Absorbancia del patrn
1
C =
P
C = Concentracin del patrn
2
A =
m
A = Absorbancia de la muestra
m
C C =
2
= Concentracin de la muestra (concentracin desconocida).
La relacin quedar:
m
m
p
p
C
A
C
A
=
entonces
P
m
P m
A
A
C C =
Este mtodo de clculo de concentraciones a partir de medidas de absorbancia es muy
utilizado en espectroscopia. Si bien la Ley de Beer se mantiene a bajas concentraciones, es
frecuente observar desviaciones a concentraciones ms elevadas. No obstante esta ley es
piedra angular de los campos de espectroscopia de absorcin tales como la UV, VIS, IR.
Tanto atmica como molecular.
5.3.4 Obtencin de la ley de Beer mediante integracin
La Ecuacin 5.2 representa la ley de Beer. Esta relacin puede explicarse como
sigue. Consideremos el bloque de material absorbente (slido, lquido o gas) que se muestra
en la Figura 5.16 Un haz de radiacin monocromtico paralelo de potencia
0
P choca
contra el bloque de forma perpendicular a la superfcie; despus de pasar a travs de una lon-
gitud b de material, que contiene n tomos, iones o molculas absorbentes, su potencia
disminuye hasta un valor P como resultado de la absorcin.
Consideremos ahora una seccin transversal del bloque de rea S y espesor infnitesimal
e e
e e
e
e
1
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
159
x
d . Esta seccin contiene
n
d partculas absorbentes; asociada a cada partcula, se puede
imaginar una superfcie en la cual tendr lugar la captura del fotn. Es decir, si un fotn,
por casualidad, alcanza una de estas reas, inmediatamente tendr lugar la absorcin. La
proyeccin del rea total de estas superfcies de captura dentro de la seccin se designa
como
s
d ; la relacin entre el rea de captura y el rea total, ser entonces . En un
promedio estadstico, esta relacin representa la probabilidad de captura de fotones en el
interior de la seccin.
Figura 5.16 Atenuacin de una radiacin con una potencia inicial
0
P por una
disolucin que contiene C moles por litro de soluto absorbente y con un camino
ptico de b cm.
0
P P <
La potencia del haz que entra en la seccin,P
x
, es proporcional al nmero de fotones por
centmetro cuadrado y dp
x
representa la cantidad absorbida en la seccin; la fraccin
absorbida ser, entonces
, y esta relacin tambin es igual a la probabilidad media de
captura. El signo menos indica que P sufre una disminucin. As, = ecuacin
5.3.
Se recuerda, ahora, que
s
d es la suma de las reas de captura de las partculas que se
encuentran en la seccin; por tanto, deber ser proporcional al nmero de partculas, o
adn d
s
= ecuacin 5.4, donde dn es el nmero de partculas y a es una constante de
proporcionalidad, que puede denominarse seccin transversal de captura. Combinando
las Ecuaciones 5.3 y 5.4 e integrando para un intervalo comprendido entre 0 y n ,
obtenemos,
P
1
S
P
dx
b
-dp
x
p
x d
s
S
dp
x
p
x
S
d
s
1
a
160
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Que, al integrar, da, Ln
Transformando en logaritmos decimales e invirtiendo la fraccin para cambiar el signo, obte-
nemos
S
n
P
P
Log
303 . 2
0
a
=
ecuacin 5.5
Donde n es el nmero total de partculas en el bloque mostrado en la Figura 5.16. El rea
de la seccin transversal S puede expresarse en trminos de volumen del bloque V en cm
3
y su longitud b en cm. As, cm
2
.
Al sustituir esta cantidad en la ecuacin 5.5 se obtiene:
Se observa que como
V
n
tiene unidades de concentracin, es decir, nmero de
partculas por centmetro cbico, podemos convertir
V
n
en moles por litro. As, el
nmero de moles viene dado por
mol partculas X
s npartcula
les nmerodemo
/ 10 02 , 6
23
=
Partculas en el numerador y denominador se cancelan y C en
L
mol
viene dado por:
L mol
V X
n
Vcm
L cm
molX
X
n
C /
10 02 , 6
000 . 1 / 000 . 1
10 02 , 6
23 3
3
23
= =
cm
3
se cancelan en el numerador y denominador.
Combinando esta relacin con la ecuacin 5.5 se obtiene:
000 . 1 303 , 2
10 02 . 6
23
0
X
abC X
P
P
Log =
Finalmente, las constantes en esta ecuacin pueden agruparse en para dar
000 . 1 303 , 2
10 02 , 6
23
X
a X
= e
luego: A bC
P
P
Log = = e
0
bC = A la cual es una formulacin de la ley de
Beer.
dn
S
dP
x
P
x
n
0
P
1
P
=
S
an
P
P
Ln =
0
2
cm
b
V
S =
V
anb
P
P
Log
303 , 2
0
=
6,02X10
23
6,02X10
23
6,02X10
23
V
cm
6,02X10
23
6,02X10
23
a
P
1
-
P
1
P
1
P
1
P
1
a n
a n P
a
nmerodemoles=
partculas/mol
C mol X
V cm
3
mol/ L
Log
P
bC
pm
a
e
=
pm
a
e
=
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
161
En el procedimiento desarrollado se consider la potencia del haz de radiacin,
denominando a P la potencia del haz incidente y
P1
la potencia del Haz emergente, por lo
cual
0
P
P
T =
y 100 % TX T = TX100 luego 100 %
0
X
P
P
T = y LogT A = , entonces
0
P
P
Log A =
, cambiando signo
bC
P
P
Log A e = =
0
bC
, es de aclarar que la potencia y la intensidad
son diferentes (ver conceptos en la segunda unidad donde se trata lo relacionado con las
radiaciones electromagnticas), aunque algunos tratados utilizan los trminos como si fueran
lo mismo, ya que es muy usual en las regiones UV y VIS manejar la intensidad y en la regin
IR la potencia.
El % de absorcin llamado absortancia es la diferencia entre el 100% de la intensidad
o la potencia del haz incidente y el % de la intensidad o la potencia del haz emergente; por lo
tanto es muy diferente de la absorbancia. As para un haz que incide sobre una solucin
con una intensidad del 100% y emerge un 50%, la absorcin es del 50%, (ver figura
5.11).
5.3.5 Aditividad de absorbancia
La ley de Beer tambin se puede aplicar a un medio que contenga ms de una clase de
sustancias absorbentes. Siempre que no haya interaccin entre las distintas especies, la
absorbancia total para un sistema multicomponente viene dada por:
n n n total
bC bC bC A A A A e e e + + + = + + + = ....... ........
2 2 1 1 2 1
1
bC
1
+
2
bC
2
+...... +
n
bC
n
. Donde los subndices
se referen a los componentes absorbentes 1,2,.n.
5.3.6 Desviaciones de la ley de Beer
La ley de Beer puede presentar desviaciones positivas, negativas, a bajas concentraciones
o por un mal ajuste del cero de absorbancia con el blanco fotomtrico ocasionado por ruido
instrumental (ver figura 5.17). Para el cumplimiento de la ley de Beer se considera que
se deben satisfacer las siguientes condiciones:
1. Que el rayo incidente esta constituido solamente por fotones que pueden ser
absorbidos, o sea, que el rayo debe ser monocromtico (constituido por
radiaciones de una sola longitud de onda), de lo contrario la disminucin de la
intensidad no seria proporcional al numero de choques.
P
1 P
1
P
1
P
1
162
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Figura 5.17 Ilustracin de las desviaciones de la Ley de Beer
2. El corte transversal de la celda debe ser uniforme, y la disolucin debe ser homognea;
si estas condiciones no se cumplen la absorcin no ser linealmente proporcional al
espesor de la capa.
3. La solucin no debe ser tan concentrada que haya efecto de pantalla de unas
partculas sobre las otras, adems al diluir la solucin no debe haber variacin ni
fsica ni qumica de la naturaleza de la sustancia, de lo contrario la absorcin no ser
linealmente proporcional a la concentracin.
Por otra parte, la respuesta del equipo de medicin debe ser proporcional a la intensidad
del rayo. Al respecto existe una limitacin sobre el rango de absorbancia que produce el
mnimo de error del instrumento, o error fotomtrico; este error surge de imperfecciones
elctricas o mecnicas del instrumento; estas imperfecciones se manifestan muchas veces
como pequeas seales denominadas ruido de fondo. Por ejemplo: si la absorbancia es
muy alta, la intensidad del rayo transmitido puede ser insufciente para operar adecuadamente
la fotocelda, o la seal puede ser tan dbil que se confunda con el ruido de fondo del
instrumento. Si la absorbancia es baja, pequeos errores en la medicin pueden representar
un error relativo grande en la magnitud medida.
5.3.6.1 Error fotomtrico
Partiendo de la ecuacin 5.2 abC A = y remplazando LogT A = , se tiene que
abC LogT = y despejando C obtenemos:
ab
LogT
C
=
, representando por T la
incertidumbre o error instrumental de la medicin de la transmitancia, el cual conducir a un
error C en el clculo de la concentracin. Derivando la ecuacin anterior:
Concentracin
IDEAL
- DESVIACIN NEGATIVA
DESVIACIN POSITIVA +
DESVIACIN POR MALA CALIBRACIN
DEL CERO DE ABSORBANCIA
DESVIACIN
A BAJAS
CONCENTRACIONES
abC A =
A
b
s
o
r
b
a
n
c
i
a
0.0
0.0
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
163
dc =
T
dT
ab
dc
3 . 2
1
= dividiendo por C ambos trminos y remplazando abC por LogT
tenemos:
TLogT
dT
T
dT
abC C
dC
3 . 2 3 . 2
1
= = ecuacin 5.6, Escribiendo esta relacin en
forma de incrementos:
TLogT
T
C
C
3 . 2
=
. O sea que el error relativo de la concentracin,
C
C
, para un error dado del instrumento, T , es funcin de la transmitancia T .
Ejemplo 5.1: Un fotmetro tiene una incertidumbre en la medicin de la transmitancia de
1% (o sea que T = 0.01); calcular el porcentaje de error en la determinacin de una
concentracin si la lectura de la transmitancia dio 60%.
Solucin:
Error relativo
036 . 0
6 . 0 6 . 0 3 . 2
01 . 0
=
=
Log X C
C
. El porcentaje de error es igual a
% 06 . 3 100 036 . 0 = X
3.06%
Hallando matemticamente el valor mnimo de la ecuacin 5.6, o trazando una grafca
de error contra transmitancia, se puede concluir que el error mnimo se presenta cuando la
absorbancia es 0.4343, o sea 36.8% de transmitancia o 0.368 de T . Por otra parte, el
error fotomtrico aumenta rpidamente para valores de transmitancia superiores al 70%, o
inferiores al 15% (0.16 y 0.82 de absorbancia respectivamente, valores que por comodidad
para manipular los datos experimentales se redondea a un rango de 0.2 a 0.8 de A)
Ejercicio 5.1: Repetir el calculo del ejemplo anterior para diferentes valores de
transmitancia. Trazar una grafca de porcentaje de error contra transmitancia,
y deducir dentro que valores de transmitancia se debe operar para que el error fotomtrico no
supere el 3%, con dicho instrumento.
Cuando no se cumple la ley de Beer, el clculo del error fotomtrico se hace con el
procedimiento de Ringbom, el cual puede ser consultado por quienes estn
interesados en Ayres, Gilbert H. Anlisis Qumico cuantitativo.
Adems del error fotomtrico que depende en parte de la calidad del instrumento y que
ocurre aunque el equipo este funcionando normalmente, se presentan desviaciones de
la ley de Beer debidas a que las condiciones de operacin no son correctas o a fallas o
defciencias del aparato; por otro lado, pueden presentarse desviaciones de origen
qumico.
Estas desviaciones se manifestan al trazar la grafca de absorbancia contra concentracin a
d
abC A =
T
d
C
dT dT
0.01
1
2.3 T
164
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
espesor de celda constante. Sin embargo, para distinguir si la desviacin es de origen
instrumental o de origen qumico, se puede hacer una grafica de absorbancia contra
espesor de la celda a concentracin constante; cualquier desviacin de la linealidad
indicara que el error es de origen instrumental, al menos en parte.
5.3.6.2 Desviaciones instrumentales
No monocromaticidad: La ley de Beer presupone que se trabaje con luz
monocromtica, pero al discutir el funcionamiento de los fltros y de los monocromadores
se observar que estos dispositivos no proporcionan luz verdaderamente monocromtica,
sino que dan un ancho de banda ms o menos amplio segn el diseo y calidad. Para analizar
este factor se debe considerar como la curva espectral plantea exigencias al ancho de banda
adecuado (Figura 5.18), as: como la respuesta del detector depende de la intensidad de
la radiacin, de la sensibilidad del detector para cada longitud de onda, luego si la luz no es
monocromtica, la transmitancia indicada por el instrumento, ser un promedio de las
transmitancias de las diferentes radiaciones.
Figura 5.18 Ilustracin ancho de bandas y mximos de absorcin relacionados con
las desviaciones instrumentales de la ley Beer
Pero como el logaritmo de un promedio de varias magnitudes no es lo mismo que el promedio
de los logaritmos, entonces la absorbancia obtenida de la lectura de transmitancia promedia
no ser la absorbancia promedia.
Por esta razn si el anlisis se hace con una longitud de onda que se halle en una pendiente
de la curva espectral, (banda B, Figura. 5.18) se presentan desviaciones de la ley
de Beer. En los mximos de la curva espectral hay un rango de longitudes de onda en que
la absorbancia es constante; con lo cual, si el ancho de banda producido por el
monocromador no se sale de dicho rango, se elimina el error (banda A, Figura. 5.18).
Si el mximo es agudo nuevamente se presenta el error de absorbancias promedio; en este
caso se requerir un ancho de banda mas angosto (banda C figura 5.18), que se ajuste
a la amplitud de la infexin del mximo.
Longitud de onda Longitud de onda Concentracin
A
b
s
o
r
b
a
n
c
i
a
A
b
s
o
r
b
a
n
c
i
a
A
b
s
o
r
b
a
n
c
i
a
Banda B
Banda A Banda A
Banda B
Banda C
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
165
Las desviaciones de no monocromaticidad aumentan al aumentar la concentracin. Es claro
que mientras ms estrecho sea el ancho de banda menor ser el error; pero si el ancho de
banda disminuye menor energa llega al detector, lo cual exige ms amplifcacin y a mayor
amplifcacin la lectura se hace menos estable. El ancho de banda depende del tipo de
monocromador usado y se regula con la rendija de salida.
Al reducir el ancho de banda aumenta la absorbancia; en la prctica la abertura de la rendija
del monocromador se disminuye hasta que no se observe mejora en la absorbancia o hasta
que no se sacrifque mucho la estabilidad de la lectura.
5.3.6.3 desviaciones qumicas
Se consideran las desviaciones de la ley de Beer debidas a cambios en la absortividad
especfca por factores que afectan la qumica del sistema, en especial las variaciones no
controladas de la concentracin efectiva de la especie a analizar, debidas a equilibrios
asimtricos.
5.3.6.3.1 Efecto de la temperatura
En trminos generales la temperatura afecta poco la absortividad y es sufciente controlarla
dentro de un margen de 3 o 4
o
C. No obstante hay algunas excepciones, mas que todo con
especies absorbentes en forma de complejos. El efecto es variable y puede ser de aumento
o disminucin de la absortividad.
5.3.6.3.2 Efecto del solvente
Aparecen variaciones en la absortividad de una especie segn el solvente en que se
halle, debido a que las interacciones solvente-soluto dependen del carcter polar o no polar
del solvente. En muchas sustancias la posicin del mximo de absorcin se mueve (ver
desplazamientos), segn el solvente usado. Cuando en la preparacin se emplean
mezclas de solventes, se debe conservar la proporcin de estos al hacer diluciones del
soluto.
5.3.6.3.3 Efecto del tiempo
Es frecuente el cambio de la absortividad de una especie con el tiempo, bien por efecto del
oxigeno del aire, por efecto de la luz, por inestabilidad de las especies, o debido a la cintica
de la reaccin cuando para hacer un anlisis se debe generar la especie absorbente. La
figura 5.19 ilustra tres casos tpicos de la variacin de la absorbancia en el tiempo.
166
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Figura 5.19 Ilustracin de la variacin de la absorbancia de una especie absorbente
con el tiempo.
El caso 1 puede ser cuando se genera una especie absorbente que requiere un tiempo T
2
para que la reaccin sea completa. En este caso las mediciones se deben tomar despus
de que transcurra el tiempo necesario para estabilizarse la lectura. El caso 2 es cuando la
especie absorbente es estable hasta un tiempo T
3
, pero luego empieza a descomponerse.
Las lecturas deben tomarse antes que empiece a descomponerse. El caso 3 es cuando
se requiere un tiempo para que la reaccin concluya, pero la especie tiene un periodo de
estabilidad de T
1
a T
4
dentro del cual deben hacerse las mediciones.
Es importante conocer las caractersticas de estabilidad de la especie, ya que esto puede
conducir a errores graves en la determinacin.
5.3.6.3.4 Efectos de los equilibrios asimtricos
Es indispensable conocer la qumica del sistema, porque si la especie a analizar esta
involucrada en alguna reaccin de equilibrio, se deben tomar las medidas necesarias (de
acuerdo con la ley de accin de masas) par evitar cambios en la concentracin debidos a
alteraciones del equilibrio:
AB + H
+
AH + B
+
Supongamos que a determinada longitud de onda,
a
, la especia AB absorbe, pero no
absorben ni el ion H
+
, ni AH, ni el ion B
+
. Por tanto las molculas de AB que se transformen
en AH y B
+
no van a ser detectadas por el fotmetro.
A
B
S
O
R
B
A
N
C
I
A
TIEMPO
1
2
3
T1T2T3
T4
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
167
Si la concentracin de H
+
es alta, el equilibrio se desplazara hacia la derecha y la concentracin
de AB disminuir. Luego la concentracin de H
+
deber hacerse pequea (el pH deber
ser alto). Tambin servir para impedir la descomposicin de AB, aumentar la concentracin
del ion B
+
agregando otra especie que lo produzca pero que no interfera en el anlisis.
Ahora, suponiendo que una solucin de 20 g/L de AB, con un pH 10 a la cual se ha
agregado 5 g/L de RB para que produzca el ion comn B
+
, dio una absorbancia de
0.6. Despus esta solucin se diluyo con agua pura a la mitad, es decir, para que su
concentracin en AB fuera 10 g/L. Al medir la absorbancia midi 0.2 (obsrvese que
debera dar 0.3). La razn puede ser que al diluir con agua el pH disminuyo (o
sea que aumento la concentracin de H
+
) y adems la concentracin de B
+
tambin disminuyo. Estos dos hechos hicieron desplazar el equilibrio hacia la derecha. Es
decir, que adems de la dilucin la concentracin de AB disminuyo imprevistamente
por desplazamiento del equilibrio; luego la concentracin efectiva quedo inferior a 10 g/L.
En este caso no se debe diluir con agua pura, sino con una solucin que tenga pH
10 y 5 g/L de RB, para no alterar el equilibrio indebidamente.
Este ejemplo es importante porque el ion H
+
aparece con mucha frecuencia afectando el
estado de las especies a analizar, por ejemplo: el equilibrio cromato-dicromato, las especies
cidas y bsicas, muchos complejos cuya formacin depende del pH, y aun especies cuya
absortividad especifca varia con el pH o cuya banda de absorcin se mueve segn el pH.
Ejemplo 5.2: El ion Cu
2+
tiene un color verde azuloso; al adicionar amoniaco se van
formando sucesivamente cuatro complejos cuproamoniacales segn la concentracin de
amoniaco:
Cu
++
+ NH
4
OH Cu NH
3
+2
+ H
2
O
Cu NH
3
+2
+ NH
4
OH Cu(NH
3
)
2
+2
+ H
2
O
Cu(NH
3
)
2
+2
+ NH
4
OH Cu(NH
3
)
3
+2
+ H
2
O
Cu(NH
3
)
3
+2
+ NH
4
OH Cu(NH
4
)
4
+2
+ H
2
O
Estas especies color azul prpura cada vez mas intenso tienen diferente poder absorbente.
Para evitar alteracin de las proporciones de cada ion complejo, que ocasionaran desviaciones
aparentes de la ley de Beer y conduciran a errores analticos, se debe usar exceso de
amoniaco para desplazar los equilibrios hasta el ltimo grado, y las diluciones que se vayan
a ejecutar deben hacerse con una solucin de amoniaco de concentracin similar.
Ejemplo 5.3: Un mtodo para determinar hierro fotometricamente es convertirlo
en el complejo ferrocianuro FeSCN
+2
, un medio cido, el cual tiene un color rojo y absorbe a
168
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
495 nm. La reaccin de formacin es:
H
+
Fe
+3
+ SCN
-
Fe(SCN)
+2
Como la especie a analizar debe estar en la forma FeSCN
+2
, el equilibrio suele desplazarse
a la derecha agregando a 80 mL, de solucin a analizar, 100 mL, de HCl 0.4N y 10 mL de
KSCN 0.4N.
Nuevamente, si las diluciones posteriores que se hagan a los patrones o a la muestra se
hicieron con agua, la concentracin de SCN
-
se reducir y podra quedar parte del Fe sin
combinarse. Lo indicado ser emplear como solvente una solucin 0.4N en KSCN y 0.4N en
HCl.
5.4 Instrumentacin para fotometra de absorcin
11
2
5.4.1 Consideraciones generales
Los instrumentos para medir la absorcin selectiva de radiaciones se suelen denominar
fotmetros, que permiten determinar la intensidad luminosa, con mayor exactitud que por
comparacin utilizando el ojo humano como detector. En la literatura qumica antigua se les
suele llamar absorcimetros.
El termino colormetro se aplica a dispositivos visuales o fotoelctricos que operan en la
regin del visible, limitados a trabajar con determinadas longitudes de onda. Mientras que se
da la denominacin de espectrmetro al instrumento que permite examinar las diferentes
longitudes de onda presentes en un paquete de radiaciones electromagnticas.
El espectrofotmetro es una forma de espectrmetro que contiene un dispositivo
fotoelctrico para cuantifcar la potencia de radiacin, capaz de seleccionar y medir la
intensidad de las radiaciones de diferentes longitudes de onda contenidas en un espectro,
dentro del rango para el cual ha sido diseado. Generalmente permiten registrar graficas
o espectros; existen diseos para el ultravioleta, el visible, para el ultravioleta y el visible,
y para las regiones del infrarrojo cercano, el infrarrojo fundamental o medio y el infrarrojo
lejano.
La instrumentacin utilizada en fotometra de absorcin es la relacionada con los fotmetros
y espectrofotmetros, los cuales estn conformados con los componentes bsicos que
debe tener todo equipo para servir como medio de comunicacin entre la materia objeto de
11 Materiales recopilados y organizados por el profesor Federmn Castro Eusse para la asignatura anlisis instrumental I de
los programas en Qumica Industrial y Tecnologa Qumica, de la Escuela de Tecnologa Qumica de la Facultad de Tecnologas
de la UTP.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
169
estudio y el analista (ver primera unidad), es decir, la generacin de una seal, un transductor
de entrada, un procesador y un transductor de salida. En estos equipos al igual que los
estudiados en las tcnicas anteriores se encuentra un sistema ptico siendo el ms delicado
y costoso, un sistema mecnico que maneja movimientos de alta precisin, un sistema
elctrico con electrnica de alta calidad y un sistema para manejo de funciones operativas y
procesamiento de datos (procesador), como tambin una serie de accesorios para facilitar el
trabajo y la aplicacin de otras tcnicas analticas.
Con relacin a los accesorios se encuentran muestreadores automticos, dispositivos para
lavado automtico de la celda, recintos termostatizados para cintica y estudios fsicoqumicos,
dispositivos para realizar titulaciones fotomtricas y para trabajar con reflectancia,
porta celdas para diferentes espesores y volmenes, accesorios para determinaciones
turbidimtricas, nefelomtricas y de fuorescencia, sistemas para tratamiento de muestras y
estaciones para manejo de datos.
Los fotmetros se encuentran desde los ms sencillo o manuales, hasta los automatizados
y con cierta inteligencia, encontrndose tambin los semiautomticos, automticos y de
diseos especiales.
Segn como presenten y manejen la informacin se clasifcan en anlogos y digitales.
De acuerdo con su diseo ptico se encuentran de haz sencillo o un solo haz, de doble
haz y de haz dividido en los cuales se presentan ventajas y desventajas. Con relacin
a su sistema ptico tambin se clasifcan en dispersivos e interferomtricos o de
transformada de Fourier conocidos tambin como multiplex.
Segn el rango espectral hay fotmetros que cubren la regin Ultravioleta nicamente, o las
regiones ultravioleta y visible, otros cubren nicamente la regin del visible. Algunos
de rango espectral ms amplio, de 200 a 1100 nm, cubren las regiones ultravioleta,
visible e infrarrojo cercano.
Un fotmetro sencillo contiene los siguientes elementos principales:
El sistema para generar la seal analtica conformado por:
1. Una fuente de radiaciones (lmpara) que genera la seal emitiendo un espectro
continuo o de lneas segn el instrumento.
2. Un sistema selector que permite seleccionar la longitud de onda que puede ser
absorbida por la sustancia.
3. Un recipiente o celda, para colocar la sustancia a analizar.
Un dispositivo de medicin de luz especfica para valorar la intensidad de la radiacin,
170
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
en lugar del ojo humano, el cual no es muy preciso, y esta constituido por:
4. El detector.
5. El amplificador.
6. El instrumento de lectura.
Se ha tomado como referencia de estudio la regin del visible (Ver figura 5.20), pero la
metodologa es aplicable a cualquier regin del espectro (UV, IR), siempre que la fuente de
radiaciones, el sistema selector, el recipiente para la muestra y el sistema de medicin sean
los adecuados para cada regin.
Figura 5.20 Diagrama de bloques que ilustra las partes que conforman un
espectrofotmetro sencillo
5.4.2 Descripcin de las caractersticas de los elementos constitutivos de un fotmetro
y algunos detalles de su diseo con relacin a la regin del espectro en que se han de
emplear.
5.4.2.1 Fuentes de radiacin
La funcin de la fuente es emitir las radiaciones del rango espectral para el cual ha sido
diseado el instrumento.
Una buena fuente debe cumplir los siguientes requisitos para ser utilizada con este
propsito:
a. Potencia e intensidad sufciente para facilitar la deteccin y medida.
b. Estabilidad: la potencia de haz radiante debe permanecer constante durante largos
periodos de tiempo.
c. La fuente debe proporcionar radiacin continua, es decir, debe emitir todas las
radiaciones de la regin en la cual va ser usada.
d. La intensidad de la radiacin no debe variar signifcativamente con la longitud deonda,
ni fuctuar en intervalos cortos o largos de tiempo.
1 2 3 4 5 6
SEAL ANALITICA
SISTEMA PARA MEDIR LUZ ESPECIFICA
Selector de
longitud de onda
Seal analitica
Fuente de
radiaciones
generador de seal
Recipiente para la
muestra
Celda
Detector
Transductor de
entrada
Amplifcador
Procesador
Instrumento de
lectura
Transductor de salida
{{
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
171
1 2 3 4 5 6
SEAL ANALITICA
SISTEMA PARA MEDIR LUZ ESPECIFICA
Selector de
longitud de onda
Seal analitica
Fuente de
radiaciones
generador de seal
Recipiente para la
muestra
Celda
Detector
Transductor de
entrada
Amplifcador
Procesador
Instrumento de
lectura
Transductor de salida
{{
Desde el punto de vista de la variedad de radiaciones que emite una fuente podemos distinguir
en trminos generales dos clases: de espectro de lneas y de espectro continuo.
Las primeras emiten solo algunas radiaciones (denominadas lneas) asociadas con los
cambios energticos del material de la fuente, sufcientemente diferenciables por su longitud
de onda (observar figura 5.21).
Figura 5.21 espectro de emisin de lneas
Las segundas emiten un sin nmero de radiaciones que cubren cierto rango espectral
en forma tan gradual y nutrida que no es posible separar completamente unas de otras
(observar figura 5.22); el rango espectral en que se emiten se desplaza hacia longitudes
de onda mas cortas al elevar la temperatura de la fuente.
Para estudios de absorcin es deseable emplear una fuente de radiacin de espectro continuo
que cubra el mayor rango de longitudes de onda, (excepto en absorcin atmica que utiliza
lmparas de espectros de lnea).
Para la regin del visible se pueden usar las lmparas de: tungsteno, halgeno, tungsteno
halgeno o ms recientemente una lmpara de xenn. La de tungsteno emite con mayor
intensidad en la regin del rojo y del infrarrojo cercano que en la regin del azul. Por tal
motivo producen mucho calentamiento.
nm
I
N
T
E
N
S
I
D
A
D
LONGITUD DE ONDA
l
3
l
2
l
1
172
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Figura 5.22 Ilustracin del espectro de emisin continuo de dos fuentes de radiaciones:
a la izquierda el espectro de una lmpara de arco de deuterio. A la derecha el espectro
de una lmpara con filamento de tungsteno.
Si se eleva la temperatura mejora el rendimiento pero a expensas de la duracin de la
lmpara.
El flamento de la lmpara debe estar estrechamente enrollado para lograr enfocar mejor los
rayos hacia el sistema selector de longitudes de onda. La envoltura de vidrio de la lmpara
absorbe lentamente la radiacin ultravioleta.
Con frecuencia se coloca un fltro que absorba la radiacin infrarroja (generadora de calor)
y que no disminuya seriamente la radiacin del visible, ya que el calentamiento ocasiona
difcultades e inestabilidad en el funcionamiento del equipo. Por razones similares el voltaje
que alimenta la lmpara debe ser estabilizado.
Para la regin del ultravioleta, entre 180 y 350 nm, se usa la lmpara de descarga de
hidrgeno a baja presin (o la de deuterio que da mejor intensidad). La lmpara de
descarga de vapor de mercurio da mayor intensidad, pero requiere presiones muy altas
para que el rango de emisin descienda hasta los 200 nm; adems, como genera mucho
calor requiere enfriamiento o aislamiento trmico.
La envoltura de estas lmparas debe ser de cuarzo o de slice fundida que son
materiales transparentes al ultravioleta. Para la regin del infrarrojo se usan fuentes
electrotrmicas como los cuerpos incandescentes de Nernst, la fuente de globar y
alambres incandescentes como el flamento de nicromo. La primera consiste en
una barrita hueca compuesta de xidos de tierras raras, como xido de cerio, zirconio, torio
e itrio que se calienta elctricamente hasta unos 1500
0
C. Requiere enfriamiento indirecto, ya
que en fri no es conductora de la corriente elctrica (no es una fuente tan constante como la
de Globar), emite entre 0.4 y 20 micrmetros. La fuente de Globar es una barra de carburo
de silicio que se calienta a unos 1200
0
C y emite entre 1 y 40 micrmetros. El flamento de
nicromo se calienta a unos 900
0
C y emite entre 1 y 20 micrmetros. Debido al fuerte
calentamiento que producen los rayos infrarrojos, estas fuentes deben estar bien ventiladas
o refrigeradas.
200 250 300 350 400 450 500 550 600 650 700 750 800 850 900
0
I
n
t
e
n
s
i
d
a
d
d
e
r
a
d
i
a
c
i
n
o
i
r
r
a
d
i
a
n
c
i
a
,
e
s
c
a
l
a
l
i
n
e
a
l
Longitud de onda, nm
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
173
5.4.2.2 Filtros y monocromadores
Son estos los dispositivos utilizados para seleccionar la longitud de onda requerida
para un anlisis.
Los fltros son ms sencillos que los monocromadores y menos costosos, pero la efectividad
es menor y se usan principalmente para el visible. Los hay de dos clases: fltros de absorcin
y fltros de interferencia, siendo mejores los de interferencia.
Entre los fltros de absorcin fguran: los de gelatina, que consisten en una capa de gelatina
impregnada de colorantes orgnicos, puesta entre dos laminas de vidrio; actualmente son
poco usados por su tendencia a deteriorarse por efecto de la misma luz y los hongos; los
filtros de liquido, que son soluciones de componentes absorbentes apropiados; y los
filtros de vidrio, que son una lamina de vidrio coloreada por un pigmento que ha sido
disuelto o dispersado dentro del vidrio.
El principio de funcionamiento de los fltros de absorcin es el siguiente: las especies
absorbentes del fltro se escogen de tal manera que en conjunto absorban la mayor parte
de las radiaciones producidas por la fuente y dejen transmitir las que se requieren para el
anlisis.
Figura 5.23a Ilustracin del ancho de banda.
Longitud de
onda normal
Anchura
de banda
Long. de onda
h
h
2
174
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Figura 5.23b Ilustracin del ancho de banda.
La figura 5.23a muestra la grafca de transmitancia contra longitud de onda de un fltro
cuya longitud de onda nominal es 550 nm.
Este valor corresponde a la radiacin que ms transmite, pero realmente el fltro deja pasar
muchas radiaciones. El ancho de banda se toma como el rango de longitudes de
onda que se transmiten hasta con la mitad de la transmitancia mxima (observar Figura
5.23a y 5.23b). Los fltros de absorcin producen anchos de banda de 30 a 80 y hasta
250 nm. Para analizar una solucin, como norma general, sirve un fltro que tenga el color
complementario del color de la solucin.
Los filtros de interferencia permiten reducir el ancho de banda a 10 o 15 nm, y
operan de la siguiente manera: una pelcula transparente de fluoruro de magnesio,
cuyo espesor es igual a media longitud de onda de la radiacin, que se desea escoger, se
recubre con dos pelculas semitransparentes de plata. Parte de la luz incidente es refejada
repetidamente por las pelculas semitransparentes de plata y parte es transmitida cada vez.
Esto ocasiona el desfase y una interferencia destructiva entre los varios rayos que emergen
del fltro, menos para la radiacin cuya longitud de onda es dos veces la distancia entre las
pelculas de plata, o para los armnicos de ella (mltiplos de la frecuencia fundamental).
Por ejemplo, si el fltro esta calculado para que no sufra interferencia la radiacin de 550
nm, tampoco se interferan las de 275 ni las de 1100 nm.
Los armnicos se pueden eliminar fcilmente con un fltro de absorcin, ya que quedan
bastante distanciados, e inclusive en muchos casos la fuente no genera los armnicos.
5.090 5.110 6.215 6.225 6.940 6.960
0
20
40
60
80
100
%
d
e
t
r
a
n
s
m
i
t
a
n
c
i
a
Anchura
de banda
efectiva= 45
Anchura
de banda
efectiva= 45
Anchura
de banda
efectiva= 45
Anchura de
banda efectiva
1/2 de la
altura
del pico
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
175
Con un sistema monocromador se puede reducir el ancho de banda entre 1 y 5 nm o
an mucho menos para los instrumentos ms perfeccionados como los espectrofotmetros
para absorcin y emisin atmica. Los monocromadores poseen un elemento
dispersante que puede ser un prisma , una rejilla o red de difraccin. A los
equipos que poseen cualquiera de estos elementos dispersantes en su monocromador
tambin se les conoce con el nombre de instrumentos dispersivos para diferenciarlos de los
interferomtricos o de transformada de Fourier.
5.4.2.2.1 Monocromadores de prismas:
La dispersin en un prisma se debe a que las radiaciones al atravesar el prisma se refractan
a diferente grado dependiendo de su longitud de onda ver figura 5.24.
Figura 5.24 Ilustracin de la dispersin de radiaciones por un prisma.
Los materiales para prismas deben ser transparentes a la regin espectral en la que han de
servir: vidrio para el visible (tambin sirve cuarzo o slice, pero son menos efectivos para
esta regin). Para el ultravioleta cuarzo (hasta 200nm) y slice fundida (hasta 185nm).
Para el Infrarrojo se usan haluros alcalinos (NaCl de 1 a 16 m, KBr de 10 a 25 m,
CsBr de 11 a 35 m, LiF de 1 a 6 m y CaF
2
de 0, 5 a 9 m), el ms usado es el NaCl que
cubre la regin infrarroja de mayor inters.
Cuando el material del prisma es cuarzo, debido a sus propiedades anisotrpicas,
la luz al pasar se partira en dos haces observar figuras 5.25, este efecto se puede
eliminar construyendo el prisma en dos mitades, cortadas de tal manera que una sea Dextro
y la otra Levo, soldadas entre si. Este arreglo se llama prisma cornu.
Infrarrojo
Visible
Ultravioleta
Rojo
Anaranjado
A
m
arillo
V
e
rd
e
A
z
u
l
A
il
V
io
le
ta
Luz blanca
Prisma
Longitudes de onda
400 nm
760 nm
176
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Figura 5.25 Ilustracin del fenmeno de la dispersin mediante un prisma de cornu
Otra manera es emplear un prisma con su superfcie posterior aluminizada o plateada de
modo que los rayos se refejen y atraviesen dos veces el prisma, en direcciones opuestas.
Este arreglo se llama prisma Littrow, observar figuras 5.26.
Figura 5.26 Ilustracin del fenmeno de la dispersin mediante un prisma de Littrow
El poder dispersor de un material de prisma se defne como
l d
dn
, o sea, la variacin
del ndice de refraccin respecto a la longitud de onda. Este poder varia, aumentando
cuando la longitud de onda se acerca a una banda de absorcin del material. Por tanto la
separacin de las radiaciones no es uniforme; si el material del prisma es cuarzo, se presenta
un hacinamiento grave en las radiaciones del visible de ms de 600 nm. El problema en esta
regin es menor con prismas de vidrio.
El poder de resolucin de un monocromador simbolizado por R , es la
capacidad que tiene para la separacin real de dos radiaciones de diferente longitudes
Rojo
Verde
Azul
U
ltravioleta
Derecha
(+)
Infrarojo
Izquierda
(-)
Eje ptico
60
30
ngulo del pice
Superficie
posterior:e
aluminizada
Luz incidente
Luz dispersada
Rojo
Azul
qrojo
qazul
i
t
r
dn
dl
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
177
de onda, y depende del poder de dispersin del material, del ngulo apical del prisma (que
generalmente es de 60
), del ancho de base del prisma y de otros detalles del diseo total del
monocromador. Se defne como:
l
l
d
R =
Ecuacin 5.7 donde: l es el promedio de las longitudes de onda
l (s) y dl la distancia entre ellas o l l , ver figura 5.27
Ejemplo 5.4 Calcular el poder de resolucin requerido por un monocromador para que
distinga (o separe) la radiacin de 365 nm de la 368 nm.
Solucin: Aplicando la ecuacin 5.7 se tiene:
16 . 122
3
5 . 366
365 368
2
368 365
= =
+
= R
El anterior es un dato til para indicar la efectividad de un monocromador. A mayor valor de
R mejor resolucin.
Figura 5.27 Ilustracin del poder de resolucin de un monocromador.
l
dl
122.16
Potencia
Dl
l
1
l
2
90%
valle
R
178
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
5.4.2.2.2 Monocromadores de rejilla o red de difraccin
La difraccin es el fenmeno segn el cual las radiaciones al bordear un obstculo se desvan
de su trayectoria; un haz de radiaciones se difracta cuando incide sobre una pequea abertura,
el valor del ngulo de difraccin, depende de la longitud de onda de la radiacin.
Las rejillas de difraccin pueden ser: por dispersin, transmisin o refexin, las hay planas,
cncavas, de escalerilla y hologrfcas, y son utilizadas para dispersar radiaciones de las
regiones UV, VIS, IR, dirigiendo un haz policromtico procedente de una fuente de espectro
continuo a travs de una red de transmisin o hacia la superfcie de una red de reflexin
la cual es la ms usada.
La red esta constituida por una base que acta como soporte la cual se recubre de una resina
epoxica y sobre sta se deposita una pelcula que puede ser de aluminio o, a veces, de oro
o platino para producir la refexin. En la superfcie as preparada que debe ser dura, pulida
y ptimamente plana se graban mecnicamente con un instrumento de diamante o un rayo
lser, un gran nmero de surcos o estras paralelos y muy prximos entre s (observar un
CD) las cuales miradas de lado se pueden observar ver figura 5.28.
Figura 5.28 Ilustracin del corte de una red tipo escalerilla
Una red o rejilla para las regiones UV y VIS contiene, normalmente, de 300 a 2000 surcos por
milmetro, siendo las ms comunes las de 1200 a 1400 surcos/mm. Para la regin IR,
se utilizan redes desde 10 hasta 200 surcos/mm; una red de unos 100 surcos/mm se
considera adecuada para los espectrofotmetros IR diseados para cubrir el IR fundamental
de 5 a 15 m.
La red de escalerilla mostrada en figura 5.28 presenta los surcos o estras de
3
2
1
1
2
3
D C
B A
d
r
i
Normal
a la red
Haces difractados
con un ngulo
de reflexin r
Haces
monocromticos
con un ngulo
de incidencia i
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
179
forma que se observan caras bastante amplias en las que se produce la reflexin y
cara estrechas no utilizadas, geometra que proporciona una difraccin muy efciente de la
radiacin. Cada una de las caras amplias puede considerarse como un punto de origen de la
radiacin; a s pues, puede producirse una interferencia entre los haces refejados 1, 2, 3. La
interferencia es constructiva si las trayectorias diferen en un mltiplo entero n de la longitud
de onda l del haz incidente. En la figura 5.28 se observan los haces paralelos 1 y 2 de
una radiacin monocromtica que incide en la red con un ngulo i respecto a la normal
de la red. La mxima interferencia constructiva se observa que ocurre para un ngulo
refejado r. Es observable que el haz 2 recorre una distancia mayor que el haz 1 y que esta
diferencia es igual a ( ) D B B C + , aparece como un trazo ms ancho en la figura 5.28.
Para que se produzca una interferencia constructiva, esta diferencia debe ser igual a l nl .
Esto es nl ( ) D B B C n + = l , donde n un nmero entero pequeo, se denomina el orden de
difraccin. En la figura 5.28 se observa que el ngulo CAB es igual al ngulo i y que el
ngulo DAB es idntico al ngulo r , usando la relacin trigonomtrica se puede establecer
que d B C = seni , en donde d representa la distancia entre las superfcies refectantes.
Igualmente d D B = senr , por el remplazo de D C y B A se obtiene La condicin para
conseguir una interferencia constructiva, luego:nl ( ) senr seni d n + = l , ecuacin 5.8, la
cual indica que existen distintos valores de l para un determinado ngulo de difraccin
r , por lo tanto, si se encuentra una lnea de primer orden (n=1) de 1100 nm en r , las
lneas de segundo orden (550 nm) y tercer orden (366nm), tambin aparecen en ese ngulo
(observar figura 5.29). La lnea de primer orden es la de mayor intensidad por lo cual se
pueden disear redes que concentren en este orden hasta un 90% de la intensidad incidente,
las lneas de orden superior se pueden eliminar con fltros.
Figura 5.29 Ilustracin de la sobre posicin de rdenes de espectros en una rejilla
de reflexin.
800
700
600
500
400
300
200 nm
800
700
600
500
400
300
200 nm
800
700
600
500
400
300
200 nm
Orden cero
P
r
i
m
e
r
o
r
d
e
n
S
e
g
u
n
d
o
o
r
d
e
n
T
e
r
c
e
r
o
r
d
e
n
P
r
i
m
e
r
o
r
d
e
n
S
e
g
u
n
d
o
o
r
d
e
n
T
e
r
c
e
r
o
r
d
e
n
N
o
r
m
a
l
a
l
a
r
e
d
I
n
L
u
z
i
n
c
i
d
e
n
t
e
3
6
6
n
m
3
0
0
2
3
3
166
150
250
3
5
0
4
5
0
5
5
0
n
m
1
1
0
0
n
m
9
0
0
7
0
0
500
300
b
180
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
El poder de resolucin de una red de difraccin viene dado por R= nN ecuacin 5.9,
donde = n nmero de orden, = N nmero total de lneas, surcos o estras de la red.
Ejemplo 5.5 Una red de 500 lneas/cm que longitud debe tener para separar las lneas D
del Na de 589.6 y 589.3 nm en el primer orden?.
Solucin: Aplicando las ecuaciones 5.7 y 5.9
83 . 1964
3 . 0
45 . 589
3 . 589 6 . 589
2
3 . 589 6 . 589
= =
+
= R
1964.83=1XN N=1964.83 surcos, estras o
lneas en total.
Luego : cm
cm lneas
lneas
92 . 3
/ 500
83 . 1964
= 3.92 cm es la longitud.
Segn su longitud de onda, las radiaciones se refejaran y se reforzaran a diferentes
ngulos.
Para eliminar las radiaciones de rdenes indeseados se pueden emplear fltros complementarios
adecuados; en las rejillas, la resolucin esta directamente relacionada con el nmero
de surcos :a mayor nmero de surcos, mayor ser el poder de resolucin.
A diferencia de los prismas, las rejillas de difraccin producen una dispersin uniforme
respecto a la longitud de onda. Tambin en principio, una rejilla de difraccin por
reflexin puede servir para cualquier regin del espectro, eliminndose el problema de
escoger materiales diferentes para los prismas de cada regin. Esto ha sido especialmente
ventajoso para el infrarrojo, ya que los haluros alcalinos usados en prismas en los primeros
espectrofotmetros infrarrojos para esta regin, por ser Higroscpicos y frgiles se
deterioraban muy rpidamente lo cual exiga demasiados cuidados.
Las rejillas de difraccin por reflexin son costosas y el principal cuidado que
requieren es protegerlas del polvo o vapores corrosivos, ya que cualquier imperfeccin en
las estras las inutiliza. No se deben tocar con ningn material porque se rayan, ni con la
mano porque la grasa de la piel tapona las estras; conviene anotar que las rejillas, por efecto
ptico, tienen de por si una apariencia grasosa.
Redes cncavas. Las redes se pueden formar sobre una superfcie cncava o una
superfcie plana. Una red cncava permite el diseo de un monocromador sin espejos o lente
colimadores y focalizadores auxiliares, por que la superfcie cncava dispersa y focaliza la
radiacin en la rendija de salida. Esta disposicin es ms barata; a dems, la disminucin
589.45
1964.83
1964.83
589.6 + 589.3
500 lneas / cm
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
181
del nmero de superfcies pticas aumenta el rendimiento energtico del monocromador que
dispone de una red cncava.
Las redes hologrficas son el producto de la aplicacin de la tecnologa lser
en ptica para fabricar redes sobre superfcies de vidrio planas o cncavas, que producen
espectros con menos radiacin parsita debido a su mayor perfeccin en la forma y
dimensiones de las lneas; con unos costos de produccin bajos, las cuales se han venido
incorporando a los instrumentos pticos.
5.4.2.3 Sistemas monocromadores
Analizados los diferentes elementos dispersantes de las radiaciones, es conveniente estudiar
el funcionamiento de un sistema monocromador completo. La figuras 5.30, ilustra las
partes que lo integran.
Figura 5.30 Partes que integran un monocromador utilizando un prisma como
elemento dispersante.
El sistema ptico de algunos instrumentos empieza con un espejo refector el cual refeja
los rayos para aumentar el rendimiento de la lmpara y luego se encuentra una lente
condensadora que enfoca los rayos sobre la rendija de entrada donde se inicia propiamente
el monocromador el cual lo constituyen las siguientes partes:
1. rendija de entrada: en algunos modelos se puede variar el ancho de esta
rendija para regular la intensidad del rango que entra lo cual se puede hacer manual
o automticamente.
2. lente colimador: su funcin es hacer que todos los rayos incidan paralelamente
sobre el prisma.
3. prisma: dispersa los rayos, las radiaciones se refractan a diferentes ngulos segn
su longitud de onda. Se puede observar (ver figura 5.30) que las radiaciones de
una misma longitud de onda procedentes de diferentes rayos, emergen paralelas
entre si.
Plano focal
Rendija
de salida
Lente
condensadora
Prisma
Lente
colimadora
Rendija
de entrada
B
A
l
1
l
2
182
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
4. Lente colimador invertido: cada grupo de radiaciones que incidan paralelas
entre si se condensa en un punto diferente a la distancia focal de la lente.
5. Rendija de salida: All termina el sistema monocromador y esta ubicada a
la distancia focal de la lente; permite dejar salir radiaciones de determinada
longitud de onda, y obstaculizar las dems. Girando el prisma se puede escoger
la radiacin que debe salir. Variando el ancho de esta rendija se puede regular el
ancho de la radiacin emergente. Si el haz esta bien disperso se puede abrir un poco
la rendija, segn lo exijan las condiciones analticas.
Luego de la rendija de salida donde termina el sistema monocromador, se encuentra una
lente colimador: La cual hace que los rayos incidan paralelamente sobre la celda
con la sustancia a analizar, el material de las lentes debe ser transparente a la regin del
espectro en que se va a usar, cuarzo o slice para el UV y vidrio para el VIS, sales de haluros
alcalinos para el IR, ya que las radiaciones deben transmitirse a travs de ellos.
Todo el conjunto monocromador en algunos equipos se encuentra en una cmara oscura
hermtica ennegrecida internamente para aislar el sistema de radiaciones que no
provengan de la lmpara.
La distribucin de un monocromador con rejilla de difraccin por refexin es similar a la de
uno con prisma; en muchos equipos se usan espejos cncavos, parablicos e hiperblicos
en lugar de lentes; inclusive la rejilla de refexin puede adoptar una de estas curvaturas para
lograr efectos pticos complementarios a la dispersin. Los espejos tienen como ventaja sobre
las lentes, que la luz no tiene que transmitirse, lo cual es til especialmente en el infrarrojo. En
la figura 5.31 se observa la disposicin en dos formas diferentes de los componentes en
un monocromador con rejilla, el recorrido ptico es mayor en el tipo Cerney Turner que
en el tipo Ebert.
Cualquiera que sean los componentes pticos de un monocromador, deben conservarse
en perfecto estado y absolutamente limpios; la limpieza debe hacerse con todos los
cuidados pertinentes; cada componente se debe encontrar en una posicin exactamente
defnida; cualquier imperfeccin, rayadura, suciedad o desviacin de la posicin debida,
ocasiona desviaciones de la luz o aberraciones pticas que van en detrimento de la funcin
monocromadora. La cubierta formadora de la cmara oscura debe ser bien hermtica y
ennegrecida para eliminar o absorber al mximo las radiaciones extraas, o sea, las que no
han seguido el curso del monocromador.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
183
a b
Figura 5.31 Disposicin de los componentes en dos sistemas monocromadores
diferentes: a Tipo Ebert, b tipo Zcerney Turner
5.4.2.3 Cubetas o celdas
Son los nombres empleados para designar los recipientes en que se coloca la sustancia
a analizar, analito o especie absorbente. Generalmente la celda se coloca despus del
monocromador, aunque en algunos equipos la colocan antes, es decir, despus de la fuente
de radiaciones; en este caso es indispensable interponer entre la fuente y la celda un fltro
que absorba calor para evitar el calentamiento de la sustancia a analizar. En los equipos
diseados para las regiones ultravioleta y visible normalmente la celda se encuentra despus
del sistema monocromador para que todas las radiaciones de la regin no incidan sobre
la muestra y evitar que se pueda causar descomposicin de la muestra ocasionada por
fotorreacciones. En los espectrofotmetros para la regin infrarroja y para espectrofotometra
de absorcin atmica, normalmente la celda se encuentra antes del monocromador para
evitar que gran cantidad de radiaciones procedentes de la fuente y radiaciones contaminantes
del medio incidan sobre el detector y lo saturen ocasionando un mal funcionamiento.
Cuando el diseo del instrumento es de doble Haz, normalmente se encuentra un soporte
para la celda que contiene el blanco fotomtrico o referencia y otro para la celda que contiene
la muestra. Los muestreadores automticos y los lavadores automticos de la celda y los porta
celdas, son accesorios que se pueden acoplar a algunos equipos para facilitar el trabajo.
En el diseo se obtienen mejores resultados si las paredes de la celda son planas, ya que as las
radiaciones inciden perpendicularmente sobre la pared de la celda, evitndose desviaciones
de los rayos por refraccin Observar figura 5.32 a. En la regin del visible se usan
en ocasiones celdas cilndricas o tubos de ensayo como celdas, pero estos tienen
el inconveniente de que refejan parte de las radiaciones y actan indebidamente como lentes
Rejilla
Rendija de
salida
Rendija de
entrada
Distancia focal
Espejo colimador
Espejos
cncavos
Plano focal
Red de reflexin
Rendija de
entrada
Rendija de
salida
l
2
l
1
B A
184
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Observar figura 5.32 b; cuando en anlisis en serie se usan juegos de tubos, se debe
probar que sean uniformes en cuanto a espesor de la pared, trayecto ptico y transmitancia.
El material de la celda debe ser lo ms transparente posible a la regin del espectro en que
se va a utilizar (la absorbancia de la celda vaca debe ser inferior a 0.2). El
trayecto ptico o espesor til depende del poder absorbente de la especie a analizar y de la
concentracin.
En el visible se usan celdas de vidrio ordinario o de vidrio corex que es mejor y de algunos
materiales plsticos especiales como el metacrilato. Tambin sirven de cuarzo o slice. Los
materiales plsticos
a b
Figura 5.32 Celdas: a de paredes planas, b cilndricas.
son desechables, presentan como desventaja que se rayan muy fcilmente y son atacados
por algunos solventes orgnicos y no resisten alta temperatura; para su uso se requiere
adoptar las respectivas precauciones, El espesor ptico mas utilizado es de 1.00 cm para
abreviar los clculos en la ley de Beer haciendo el valor de 1 = b en la ecuacin bC A e =ebC.
Cuando en los clculos o anlisis no se reporta el espesor de la celda, se entiende
que este es 1.0 cm. Existen celdas de mayor y menor espesor para anlisis especiales
siendo las ms comunes de 0.1, 5.0 y 10.0 cm. Para el ultravioleta se requieren celdas
de cuarzo o slice fundida.
Para el infrarrojo se emplean los mismos haluros descritos para los prismas, pero en especial
el NaCl; los haluros tienen el grave inconveniente de ser Higroscpicos y solubles en
agua; para anlisis infrarrojo de soluciones acuosas se deben usar celdas de AgCl o de
algunos plsticos especiales que son transparentes a esta regin. Las celdas para la regin
infrarroja requieren diseos con soportes especiales para el ensamble de las ventanas de
Prdida por reflexin
en las interfases
Prdida por dispersin
en la solucin
Haz
emergente, P
1
Prdida por reflexin en
las interfases
Haz incidente,
P
O
H
Q
S
1
0
0
0
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
185
haluros, el espaciador y los empaques. Sus espesores varan entre 0.005 y 1.0 mm
para lquidos puros y soluciones. Para gases son de 10 cm.
La limpieza de las celdas es condicin indispensable para un buen trabajo, no se deben
rayar. Las celdas de vidrio, cuarzo o slice no se deben lavar con detergentes. Las celdas
de haluros alcalinos no se deben lavar con agua, no se debe respirar cerca de ellas, no se
deben tocar con las manos, se deben guardar en un desecador; la limpieza se debe hacer
siguiendo las instrucciones del fabricante.
5.4.2.4 Sistema de medicin
Para evaluar la intensidad de las radiaciones se requiere un dispositivo sensible a la energa
radiante y un mecanismo para traducir la informacin en trminos cuantitativos inteligibles. El
ojo humano esta limitado a la regin del visible observar figura 5.33, con una mxima
sensibilidad para la luz verde; la cuantifcacin la obtiene por comparacin de colores y de
intensidades respecto a patrones de referencia; su informacin depende de muchos factores
subjetivos y es inestable por problemas de fatiga.
Figura 5.33 Ilustracin grfica de la repuesta de una fotocelda comparada con la
respuesta del ojo normal
Los dispositivos fotoelctricos permiten trabajar en diferentes regiones del espectro, su
sensibilidad se puede regular, y son ms objetivos; la informacin la pueden presentar
en variadas formas. Normalmente constan de: un detector, un amplificador y un
sistema de lectura.
Detectores: Un detector es un transductor que convierte la radiacin electromagntica en
un fujo de electrones y, posteriormente, en una corriente o voltaje en el circuito de lectura, en
400 500 600 700 800 900
0
20
40
60
80
100
Longitud de onda en nanmetros
R
e
s
p
u
e
s
t
a
R
e
l
a
t
i
v
a
Foto celda de selenio
Ojo Normal
186
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
muchos casos la fotocorriente requiere amplifcacin, particularmente cuando se miden bajos
niveles de energa radiante, existen detectores de un solo elemento como los fotodiodos
de estado slido, los tubos fotoemisores y los tubos fotomultiplicadores,
y otros detectores de elementos mltiples como los detectores con confguracin de estado
slido. La funcin principal de un detector es convertir energa radiante en energa
elctrica y las propiedades ms importantes que debe reunir cualquier tipo de detector son:
Sensibilidad espectral, respuesta a la longitud de onda, ganancia (relacin entre el voltaje de
salida y el voltaje de entrada), tiempo de respuesta, rango de respuesta lineal, bajo nivel de
ruido y reproducibilidad.
En su mayora los detectores usados en las regiones UV y VIS se fundamentan en el
efecto fotoelctrico: Consistente en la emisin de electrones de una superfcie slida
(o lquida), cuando se irradia con radiacin electromagntica. Los electrones desprendidos
de una superfcie por el efecto fotoelctrico se denominan fotoelectrones. El efecto se
presenta en algunos materiales con radiaciones UV y en otros con radiaciones del VIS,
tambin hay materiales que presentan el efecto con radiaciones UV y VIS. Los detectores
ms utilizados son: La celda fotovoltaica, el fototubo, el fototubo multiplicador y fotodiodos.
5.4.2.4.1.1 Celdas fotovoltaicas: Los equipos ms econmicos usan celdas
fotovoltaicas, (llamadas tambin celdas de capa de Barrera), observar figura 5.34 que
dan una seal sufciente para leerse en un galvanmetro, sin necesidad de amplifcacin.
Figura 5.34 Esquema de una celda fotovoltaica
Funciona as: sobre una placa metlica se deposita una capa delgada de un semiconductor
(por ejemplo: selenio sobre hierro, (u oxido cuproso sobre cobre) y sobre esta se deposita
una pelcula transparente de plata. Cuando la luz incide sobre el semiconductor (a travs
de la pelcula transparente) los electrones se excitan y pasan a la plata, que acta como
electrodo colector; se genera as una fuerza electromotriz. Si la plata y la placa metlica
estn conectadas a un galvanmetro sensible, se originara una corriente proporcional a la
intensidad de la radiacin incidente.
La figura 5.33 ilustra la variacin de la respuesta de una celda fotovoltaica en funcin
Selenio
Hierro
Vidrio
Capa delgada de plata
Caja de
plstico
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
187
de la longitud de onda, indicando una mxima sensibilidad entre 500 y 600 nm. En lneas
discontinuas se muestra la del ojo humano. Estas celdas presentan efectos de fatiga
por exceso de iluminacin. Es recomendable acondicionar un obturador, para que solo reciba
iluminacin cuando se estn tomando lecturas. Las celdas fotovoltaicas se usan para el
visible, entre 400 y 800 nm.
Las celdas actuales de fotoconductividad (aumento de la conductividad elctrica,
en ciertos materiales, producido por radiacin electromagntica incidente), a diferencia
de las fotoelctricas operan de siguiente forma: Un trozo de material semiconductor
colocado entre dos contactos recibe un voltaje aplicado. Si no hay radiacin la corriente es
muy pequea; cuando incide sobre el material una radiacin, su resistencia disminuye y la
corriente aumenta, las celdas fotoconductoras a diferencia de las fotoelctricas,
se pueden usar en la regin del IR cercano.
5.4.2.4.1.2 Fototubos: Un fototubo (Observar figura 5.35) consta de un ctodo y
un nodo envueltos por una cubierta de vidrio al vaco o con un gas inerte a baja presin (0.2
mm Hg). La cubierta debe tener una ventana de cuarzo cuando se va a usar para radiaciones
ultravioleta.
Entre el ctodo y el nodo se aplica un voltaje de unos 90 voltios. El ctodo consiste en una
lmina recubierta de xidos de metales alcalinos y alcalino-trreos que desprenden fcilmente
electrones por efecto de la luz (efecto fotoelctrico), los cuales son recolectados por
el nodo.
Figura 5.35 Fototubo y circuito elctrico auxiliar
Si el voltaje es el sufciente para recoger los electrones con el 100% de efciencia (voltaje de
saturacin), la corriente producida es proporcional a la intensidad luminosa incidente.
Como los electrones se desprenden por efecto de la energa de los fotones, la intensidad
Fuente de alimentacin
cc de 90 V
Ctodo
Electrones
Filamento andico
Haz de fotones
Amplificador cc
y dispositivo de
lectura
188
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
de la corriente producida depende de la longitud de onda. adems, para cada material de
ctodo hay una longitud de onda por encima de la cual no se produce efecto fotoelctrico; se
denomina umbral fotoelctrico; para la plata es 261 nm, para el litio 526 nm, para el
sodio 680 nm, para el potasio 1000 nm, para el cesio 1400 nm.
La corriente del fototubo es muy pequea y requiere amplifcacin, lo cual se logra colocando
una resistencia alta (Observar figura 5.35) en el circuito del fototubo, y aplicando la
diferencia de potencial generada (IR) a la entrada de un circuito de amplifcacin. La seal
del amplifcador accionara el dispositivo de lectura.
Los fototubos se usan para el visible y para el ultravioleta, dando una buena respuesta a
radiaciones con una longitud de onda entre de 180 y 1000 nm aproximadamente.
5.4.2.1Fototubo multiplicador
El principio de funcionamiento es similar al de un fototubo, pero contiene unos electrodos
adicionales, de material fotosensible denominados dinodos, que dan una emisin
secundaria en cascada, as: visto el tubo en corte transversal (Observar figura 5.36), los
fotoelectrones liberados en el ctodo por efecto de la luz, son acelerados por una diferencia
de potencial aplicada, hacia el dinodo 1. All, al hacer contacto, cada fotoelectrn libera
varios fotoelectrones; estos a su vez son acelerados hacia un segundo dinodo, el cual
esta normalmente 90 V ms positivo que el dinodo 1. De nuevo, por cada fotoelectrn
que incide sobre la superfcie se emiten varios fotoelectrones, despus de repetirse este
proceso en los nueve dinodos, se han originado de 10
6
a 10
7
fotoelectrones por
cada fotn incidente, esta cascada se recoge al fnal en el nodo.
La corriente producida por el fotomultiplicador puede accionar el dispositivo de lectura, o
puede alimentar un amplifcador si se requiere amplifcarla ms. Como debe mantenerse una
diferencia de potencial entre cada etapa, el voltaje total requerido asciende entre unos 800 a
1000 voltios.
El voltaje debe ser estabilizado, ya que la sensibilidad vara con el voltaje. El
fotomultiplicador se usa principalmente cuando la intensidad luminosa es baja y al igual
que el fototubo responde entre 180 y 1000 nm.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
189
a
b
Figura 5.36 a Esquema de un fototubo multiplicador, b esquema de un circuito de
amplificacin
5.4.2.4.1.4 Detectores de diodo de silicio
Un detector de diodo de silicio consta de una unin pn polarizada inversamente montada
en un Chip de silicio. Observar figura 5.37, la polarizacin inversa crea una zona de
despoblacin que reduce casi a cero la conductancia de la unin, sin embargo, si se permite
que la radiacin incida sobre el chip, se forma en la zona de despoblacin huecos y electrones
que, al moverse a travs del dispositivo, dan lugar a una corriente que es proporcional a la
potencia radiante. Los diodos de silicio son ms sensibles que un fototubo de vaco,
pero menos que un fototubo multiplicador los diodos presentan un intervalo espectral
de 190 a 1100 nm aproximadamente.
1 2 3 4 5 6 7 8 9
nodo
Ctodo
Cubierta de
cuarzo
Dnodos numerados
mostrados en (a)
Al dispositivo
de lectura
R
90 V
cc de 900 V
0
Cubierta de
Cuarzo
Varios electrones por
cada electrn incidente
Numerosos eletrones
por cada fotn
Rejilla
Radiacin,h
Ctodo fotoemisor
nodo 10
7
electrones
por cada fotn
1
2
3
4
5
6
7
8
9
0
190
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
a b
Figura 5.37 a Ilustracin de un diodo de silicio, b Polarizacin inversa
5.4.2.4.1.5 Detectores para la regin infrarroja.
Los fotones de radiaciones infrarrojas no alcanzan a activar fototubos ni celdas fotovoltaicas;
por lo tanto para la regin IR, se usan los detectores fundamentados en efectos trmicos,
los piroelctricos y los fotnicos; ya que los fotones infrarrojos al ser absorbidos se
transforman en energa calorfca.
Los detectores infrarrojos no solamente deben cumplir las propiedades antes mencionadas si
no que adems deben tener un rea sensible pequea, una baja capacidad calorfca, rapidez
de respuesta, una sensibilidad trmica alta y una absortividad alta no selectiva para todas las
frecuencias de la radiacin IR.
Los ms empleados entre los electrotrmicos son la termocupla o termopar, el
bolmetro y la clula neumtica de golay, de los detectores piroelctricos es
el de sulfato de triglicina y de los fotnicos o fotoconductores el de telururo
de cadmio y mercurio (observar figura 5.38). El ms empleado de los trmicos
es el termopar que consiste en dos alambres de dos materiales semiconductores diferentes
soldados en sus extremos; cuando un extremo esta a una temperatura diferente del otro, se
genera una diferencia de potencial. Por tal razn, uno de los extremos del termopar
se mantiene protegido de la radiacin (extremo fri); el otro extremo tiene una delgada
lamina de oro ennegrecido sobre la cual inciden las radiaciones y se absorben, elevando
la temperatura (extremo caliente). Todo el conjunto se halla dentro de una cubierta al
vaco para evitar prdidas de calor y una con una ventana de KBr o de CsI transparente a
la radiacin IR.
Regin p Regin n
Unin pn
Contacto
metlico
Filamento
de plomo
Hueco
Electrn
Zona de
despoblacin
Regin p Regin n
Polarizacin inversa
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
191
a b
c
Figura 5.38 Detectores Infrarrojos: a Termopar o termocupla, b bolmetro, c clula
neumtica de Golay.
De similares caractersticas en lo que se refere al intervalo de respuesta a la seal es el
detector denominado bolmetro; es sencillamente una resistencia sensible a la temperatura.
Dos hojas delgadas de metal noble o materiales de termistor constituyen el elemento activo
de este tipo de unidad de deteccin. Estos elementos estn slidamente montados con
una de las hojas protegidas del haz incidente. Esto permite que una parte de este sistema
de dos elementos sea una resistencia de referencia o compensacin. Tales elementos
constituyen entonces las dos ramas de un puente de Wheatstone equilibrado. Cuando el
sensor absorbe la radiacin IR incidente, el circuito del puente se desequilibra; esta seal se
amplifca luego y se mide. La potencia de entrada para dicho tipo de detector puede alcanzar
el lmite mnimo de 10
-10
W, y, no obstante, detectarse a pesar del ruido inherente al sistema
del circuito electrnico acompaante.
La Clula neumtica de Golay es el sistema de deteccin IR ms elaborado y ms
sensible, con el cual pueden detectarse potencias de entrada mnimas de 5
-11
W, este sistema,
representado en la figura 5.38 C utiliza la expansin de un gas como dispositivo sensible.
Caja con
vaco
Ventana de sal
Hoja de oro ennegrecida
(placa colectora)
Transformador de equilibrado de
impedancias
Junta de metales
diferentes
Salida
Caja con
vaco
Ventana de sal
Salida
Batera excitadora
Banda metlica
oscurecida
(termistor)
Luz
Cmara
neumtica
Espejo flexible
Fotoclula
Rejilla de
lineas
Imagen de
la rejilla de lineas
Pelcula absorbente
Monocromador
y clula de
absorcin
192
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Cuando se absorbe por el gas energa radiante, se dilata en la cmara neumtica, desplazando
una membrana fexible pulimentada. Una luz enfocada sobre la superfcie pulimentada de la
membrana produce una imagen de una rejilla de lneas en el plano de dicha rejilla. Cuando la
imagen y la rejilla estn sobrepuestas, la intensidad de la luz transmitida a la fotoclula esta
en un mximo. Cuando la membrana se dilata, la imagen se desplaza y la intensidad de luz
transmitida disminuye. Pueden medirse desplazamientos muy pequeos, dando este tipo de
detector una sensibilidad muy alta.
Los equipos estn diseados para que el instrumento de medida de directamente el % T
(porcentaje de transmitancia), lo cual se logra de la siguiente forma: Si se denominando
con G la salida elctrica del detector, G es directamente proporcional a la potencia P , o
directamente proporcional a la intensidad I , luego G a P ,o G
a I , entonces
G = KP, o G = K
I
, al introducir a K como una constante de proporcionalidad, considerando
la corriente oscura o de fondo originada en el circuito de amplifcacin y denominndola K Se
tiene: K KP G + =
KP + K, o K KI G + = . Haciendo 00 . 0 = K por compensacin electrnica,
00 . 0 + = KP G KP + 0.00, o 00 . 0 + = KI G K
I
+ 0.00. De tal manera que si llamamos
0
G la seal dada para
el blanco ajustndola en el instrumento de medida a 100, se tiene que 00 . 0 100
0
+ = = KP G KP +
0.00(ecuacin 5.10 ), de igual manera si para la muestra llamamos la seal G , entonces
00 . 0
1
+ = KP G
KP
1
+ 0.00 (ecuacin 5.11 ), dividiendo la ecuacin 5.11 por la ecuacin
5.10 se tiene:
00 . 0 100
00 . 0
1
+ =
+ =
KP
KP G
luego simplifcando
P
P G
1
100
= entonces 100
1
X
P
P
G =
pero T
P
P
=
1
por consiguiente 100 TX G =TX100, T P %
1
= y 100 = P se concluye que PT P =
1
PT
y T P 100
1
= , por tanto T P %
1
= . Relacionndola con la absorbancia A,
A= - log T,
P
p
A
1
log = (ecuacin 5.12), pero 100 = P y T P %
1
= , remplazando en
la (ecuacin 5.12) queda:
100
%T
Log A =
cambiando signo
T
Log A
%
100
=
, resolviendo
la expresin logartmica
T Log Log A % 100 =
por consiguiente T Log A % 2 = .
5.4.2.4.2 Amplificadores y sistemas de lectura
Generalmente la seal del detector debe amplifcarse muchas veces para que sea posible su
medicin, el amplifcador (observar figura 5.36 b), recibe la seal del detector (seal
de entrada), y despus de una serie de operaciones electrnicas produce una seal varias
veces mayor (seal de salida), mediante el uso de amplifcadores operacionales; el diseo
del circuito electrnico de amplifcacin depende del diseo del sistema ptico en el equipo,
I
G= KP
1
+ 0.00
100= KP + 0.00
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
193
cuando en el sistema ptico hay prdidas de potencia o intensidad del haz de radiacin, la
seal dada por el detector es ms dbil y por lo tanto se requiere mayor amplifcacin.
El sistema de lectura puede ser anlogo o digital. De los instrumentos anlogos
el ms utilizado es el galvanmetro, que mide corrientes directas muy pequeas, por el
orden de microamperios, este mide la corriente elctrica del circuito de salida; tiene una
graduacin de 100 divisiones correspondiente de 0.00 100.00 A y cada micro amperio
se hace equivalente a un 1% de transmitancia, bajo la escala de % de de transmitancia
se encuentra grabada una escala en unidades de absorbancia correspondiente al logaritmo
de la transmitancia, en la cual 100.00 %T equivale a 0.00 de A y 0.00 %T a A
infinita. Observar figura 5.39.
Obstruyendo la llegada de la luz al detector, la aguja del galvanmetro debe sealar el punto
cero. Si no indica cero, esto puede deberse a que radiaciones extraas llegan al detector, o
a emisiones de fondo debidas a la temperatura o inherentes al sistema de amplifcacin; todo
esto se denomina corriente oscura. Para borrar la corriente oscura el circuito de salida
dispone de un circuito auxiliar para aplicar una seal compensadora de sentido opuesto, hasta
que el indicador marque el punto cero ( K en las ecuaciones 5.10 y 5.11). El punto
100.00 (cien por ciento de transmitancia o cero de absorbancia) se calibra permitiendo
que la luz llegue al detector despus de atravesar la solucin del blanco fotomtrico y
ajustando la seal producida hasta que indique 100.00 (
0
G ecuacin 5.10), este ajuste
se hace variando el grado de amplifcacin o el ancho de las rendijas del monocromador, o a
veces usando un atenuador adicional para bloquear parte del haz luminoso. La precisin de
las lecturas que da un galvanmetro o micro ampermetro oscila entre 0.2 y 3%.
Figura 5.39 escalas de %T y A graduadas en un galvanmetro
El potencimetro es otro instrumento anlogo, dispone de un dispositivo adicional que
permite anular en cualquier momento la seal del amplifcador por oposicin de otra seal
electrnica igual y opuesta.
2.0
1.0
o.8
0.6
0.5
0.4
0.3
0.2
0.1
0
100
90
80
70
60
50
40
30
20
10
0
% de Transmitancia
absorbancia
100 micro-amperios
oo
194
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Difiere esencialmente del galvanmetro, en que la lectura que da no es la seal directa del
amplifcador, sino la igual que se requiri para anularla. Por eso se denominan indicadores
de punto nulo. El ajuste del cero y el 100.00% se hace en forma similar a lo indicado
antes. La precisin de las lecturas es aproximadamente del 0.2%.
El potencimetro con registrador permite hacer registros de absorbancia o
transmitancia en funcin de la longitud de onda (espectros), o registros de absorbancia
en funcin del tiempo; implica un mecanismo de alta precisin consistente en una pluma
registradora que se mueve de acuerdo con la seal del amplifcador sobre la ordenada
de un papel grafico; la abscisa del papel grafco va graduada en valores de longitud
de onda y se desliza en forma sincronizada con el movimiento del prisma o de la rejilla
del monocromador. Para estudios de absorbancia en funcin del tiempo, se fja la longitud
de onda de inters y se desengrana el monocromador; en esta forma el movimiento de la
abscisa sirve para contabilizar el tiempo.
Para el uso de sistemas de lectura digitales se requiere de un dispositivo convertidor
de la seal anloga a digital, para ser manejada por un procesador el cual la puede presentar
en un display, en una pantalla LCD, o en un monitor, y ofrecer varios modos de
lectura de la seal bien sea en %T (porcentaje de transmitancia), A (absorbancia), o
C (concentracin), si el equipo ha sido calibrado con un patrn o patrones para obtener
directamente la lectura en concentracin observar figuras 5.46b y 5.47a.
5.4.3 Equipos de un solo haz, de doble haz y haz dividido.
En el equipo de un solo haz o haz sencillo (observar figura 5.40), el rayo
procedente de la fuente es dispersado en el monocromador; al girar el dispositivo dispersor
se enfoca hacia la rendija de salida la longitud de onda deseada; la radiacin atraviesa la
cubeta con el blanco fotomtrico o solucin de referencia y luego con la muestra
y llega al detector. El sistema de haz sencillo requiere voltajes, fuente, detector y dems
componentes electrnicos muy estables, para minimizar errores entre el momento de la
calibracin del equipo y el momento de tomar las lecturas de las muestras.
Figura 5.40 diagrama de un espectrofotmetro de un solo haz
Filtro o
monocromador
Obturador
Cubeta de
la referencia
Cubeta de
la muestra
Dispositivo
de lectura
0 100
Amplificador
Fotodetector
P
1
Fuente
hv
P
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
195
En los equipos de haz sencillo es necesario recalibrar nuevamente el equipo cada vez que se
cambie la longitud de onda, ya que la intensidad de emisin de la fuente, la correccin por el
blanco y la sensibilidad del detector varan con la longitud de onda.
En el equipo de doble haz, el rayo que sale del monocromador se parte en dos (observar
figura 5.41). Una parte es dirigida hacia el blanco fotomtrico o solucin de
referencia y la otra hacia la muestra a analizar (observar figura 5.41). En la
unidad de amplifcacin se comparan permanentemente las dos seales, y la seal de salida
es la correspondiente diferencia o relacin entre ellas. En los equipos de doble haz, cualquier
variacin se compensa, ya que la comparacin se hace permanentemente.
Figura 5.41 Diagrama de un espectrofotmetro de doble haz con haces divididos o
separados en el espacio
El divisor del haz mas corriente es un sector de espejo que refeja y deja pasar alternativamente
el haz por el blanco y por la muestra (doble haz, con haces separados en el
tiempo observar figura 5.42) produciendo una seal alterna modulada, la cual es
separada y comparada varias veces por segundo en el amplifcador.
En los equipos de doble haz la compensacin por los cambios ocasionados en el detector al
cambiar la longitud de onda se hacen automticamente, lo que se reporta es la diferencia
o relacin entre los haces. Esto es una facilidad fundamental cuando se trata de obtener
espectros.
Por supuesto que los equipos de doble haz son ms complejos electrnica y mecnicamente,
y son ms costosos.
Tambin existen los diseos de equipos de doble haz mediante la divisin del haz en dos
haces por transmisin y refexin. (Observar figura 5.44c)
Fuente
hv
Filtro o
monocromador
Obturador
Espejo
Fotodetector
1
Fotodetector
2
Cubeta de
la referencia
Cubeta de
la muestra
Divisor del haz
Amplificador
diferencial
Dispositivo
de lectura
0 100
P
P
1
196
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Un fotmetro es un instrumento electrnico de precisin, que requiere hbil y cuidadoso manejo.
Lo indicado antes de usarlo es conocer las instrucciones de manejo propias del equipo, o recibir
la informacin bsica pertinente. Las siguientes instrucciones presuponen el conocimiento de los
cuidados y de la forma de operar los controles.
Figura 5.42 Espectrofotmetro de doble haz, con haces separados en el tiempo
5.4.2 Instrucciones genricas de manejo y calibracin de un
espectrofotmetro.
El equipo debe instalarse en lugar limpio, seguro y no expuesto a la luz intensa, al calor o la
humedad. Debe conectarse al voltaje apropiado. Cuando se use debe tenerse cuidado especial
en el control de la amplifcacin, porque puede daarse el galvanmetro de lectura.
El ajuste de la Lmpara, Aunque slo se efecta cuando se cambia, es conveniente recibir
indicaciones de cmo hacerlo. En algunos equipos requiere procedimientos especiales, otros
lo hacen automticamente; La buena alineacin de la lmpara es un factor esencial para tener
buena respuesta en el instrumento.
Las instrucciones de manejo y calbracin pueden variar dependiendo del diseo y modelo
del espectrofotmetro por lo cual es mejor seguir las instrucciones dadas por el fabricante,
pero en general el manejo es sencillo y se deben seguir los siguientes pasos para un equipo
anlogo, si el equipo es digital pueden omitirse algunos y si el equipo tiene programada una
rutina de encendido hace algunos pasos automaticamente.
Filtro o
monocromador
0
Amplificador
Detector de
punto nulo
Vista frontal
Espejo
Transparente
Espejo
en sectores
Cubeta de
la referencia
Cubeta de
la muestra
P
1
P
Espejo
Fotodetector
Cua ptica
100-
50-
0-
Motor
Espejo
reticulado
100
Fuente
hv
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
197
5.4.3.1 Ajustes generales:
1. Ajuste del cero mecnico: Se realiza en instrumentos anlogos, con el equipo
completamente apagado, se ajusta a cero la seal de la aguja con el control dispuesto para este
fn; si no esta coincidiendo con el valor de cero.
2. conexin a la red: Generalmente 110 voltios, aunque hay instrumentos que se regulan
automticamente entre 90 y 240 V. Algunos porttiles trabajan con bateras.
3. Encendido del equipo: Colocar el control de encendido y apagado, en la posicin de
encendido ON.
4. Tiempo de calentamiento: En muchos modelos una vez encendido el equipo es
necesario darle un periodo de calentamiento (unos 5 minutos), para que la lmpara y el circuito
electrnico adquiera la temperatura ptima de funcionamiento, en algunos equipos la falta de
calentamiento se manifesta en difcultad para ajustar el 0 elctrico y 100% de T.
5. Ajuste del cero elctrico: Se ajusta Cero % de Transmitancia bloqueando con el
obturador el paso del rayo de luz para que no llegue al detector y se ajusta el sistema electrnico
hasta que la lectura del instrumento indique cero % de transmitancia.
6. Ajuste del Selector de Radiaciones: Se lleva a seleccionar la longitud de onda ()
que la sustancia absorbe.
7. Ajuste del 100% de Transmitancia (T): Se coloca una celda con el blanco
fotomtrico, se desbloquea el paso del rayo de luz moviendo el obturador y se ajusta el sistema
amplifcador hasta que el instrumento de lectura indique 100% de transmitancia.
8. Medicin del % de Transmitancia (%T): Se coloca la misma celda, u otra
celda estrictamente equivalente, con la sustancia a analizar. Se lee directamente el
porcentaje de Transmitancia, la absorbancia o la concentracin, si el equipo ha sido calibrado
con el patrn o los patrones de referencia.
5.4.3.2 Verificacin de la calibracin del sistema ptico del equipo.
La verifcacin de la calibracin del espectrofotmetro se puede realizar tomando datos sin
ninguna especie absorbente de %T variando la longitud de onda cada 20 nm, se construye
la grfca de respuesta relativa del equipo %T versus longitud de onda, se determina
el o los mximos y se compara la grfca obtenida con la dada por el fabricante. Tambin se
puede comparar la respuesta de la curva espectral dada por el instrumento para una solucin
de cloruro de cobalto 0.25 molar observar figura 5.43, la cual presenta su mximo de
absorcin a 510 nm.
198
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Figura 5.43 Curva espectral de una solucin acuosa de cloruro de cobalto 0.25 M
comparada con un blanco fotomtrico de agua destilada.
Para calibraciones ms confables se obtiene experimentalmente la curva de calibracin para el
dicromato de potasio y se comparan con la curva terica, observar figura 5.44.
Figura 5.44 Curva espectral de absorcin de una solucin de dicromato de potasio
preparada disolviendo 120 mg de K
2
Cr
2
O
7
en 1 L de H
2
SO
4
0.01 N, comparada con un
blanco fotomtrico de una solucin de H
2
SO
4
0.01 N en cubetas de 1 cm de espesor.
Cuadro 5.2 Coeficientes molares de absorcin del cromato de potasio en KOH 0.05M
350.0 700.0
-0.010
510.0
1.265
1.265
Longitud de onda, nm VIS
A
b
s
o
r
b
a
n
c
i
a
200 225 250 275 300 325 350 375
l nm
0,4
0,8
1,2
1,5
2,0
0,586+0,02
1,495+0,02
1,288+0,02
1,738
235nm
257nm
313nm
350nm
254
265
280
289
293
303
2,57
3,16
3,29
2,09
0,93
0,50
313
334
366
405
436
0,19
0,985
4,416
1,33
0,31
Longitud de
onda, nm
Longitud de
onda, nm
e . 10
-3
,
e . 10
-3
,
L
mol . cm mol . cm
L
A
b
s
o
r
b
a
n
c
i
a
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
199
Si se quiere tener una mayor confabilidad se prepara una solucin de cromato de potasio con
la cual se puede confrontar los coefcientes molares de absorcin (e) a diferentes longitudes de
onda del cromato de potasio en KOH 0.05 M observar cuadro 5.2
Figura 5.45 Curva espectral de absorcin del cristal de didimio.
La calibracin utilizando un cristal de didimio (didimio cristal formado por la mezcla de sales
de xidos de tierras raras), es la ms confable, pero es muy costosa, del cual se obtiene en el
instrumento la curva espectral de absorcin y se compara con la grafca real. observar grfca
fgura 5.45.
5.4.4. Equipos comerciales
Son muchas las casas productoras de espectrofotmetros de diferentes modelos a nivel
mundial entre las cuales sobresalen en nuestro medio la Milton Roy fabricante de los
espectrofotmetros de la serie genesys y Spectronic ; encontrndose en la dotacin de
los laboratorios los modelos Genesys 2, Genesys 5, Genesys 10, Gensys 20 y los Spectronic
20 , Spectronic 20 D, Spectronic 401, Termo Spectronic de la cual se tienen varios
espectrofotmetros: UV-VIS y AA de la lnea unicam y solaar, Mattson genesys II FTIR.
La shimadzu de la cual se cuenta en el laboratorio con un espectrofotmetro UV-VIS modelo
UV-1700, de la Perkin Elmer se tienen espectrofotmetros de absorcin atmica y UV-
VIS. Otros fabricantes reconocidos son La Varian Techtron en equipos de AA y la Beckman en
espectrofotmetros UV-VIS e IR.
400 450 500 550
l nm
10
20
30
50
T,%
0
40
60
70
80
90
403
529,5
586
200
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
5.4.4.1 Diagramas e instrucciones de manejo del espectrofotmetro
Spectronic 20D
Figura 5.46 Espectrofotmetro Espectronic: a 20 D y b diagrama ptico.
5.4.4.2 Generalidades de los Spectronic:
Caractersticas Tcnicas:
Fabricante: Milton Roy
Conexin: 110 V
Fuente: Lmpara de tungsteno.
Selector de : monocromador de red
Rango espectral: de 350 a 900 nm
Ancho de banda: 20 nm
Equipo de: Haz sencillo.
Celdas: De vidrio cilndricas de 1.0 cm de espesor y hasta 10.0 mL de capacidad.
1
2
3
4
5
6
6
7
8
9 10
a
b
Lente de campo
Rendija de entrada
Lente objetivo
Red Lampara de tungsteno
Obturador
Muestra
Leva para el control de
la longitud de onda Control de luz
Rendija de
salida
Filtro
Fototubo
de medicin
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
201
Detector: fototubos con respuesta de 350 a 600 nm y de 600 a 900 nm.
Normalmente el equipo tiene incorporado el detector de 350 a 600 nm, para trabajar entre
600 y 900 nm, es necesario cambiarlo y ubicar el fltro adicional siguiendo las instrucciones
correctamente.
Sistema de amplificacin: Por intensidad de luz
Sistema de lectura: anlogo o digital.
Instrumento de lectura: Galvanmetro o Display.
Observaciones:
Los equipos son para operar a 110 V
Las celdas son un componente de la ptica del equipo y deben tratarse y cuidarse
con toda precaucin.
No tocar la parte inferior a travs de la cual pasa la luz.
Enjuagar la celda con varias porciones pequeas de la solucin antes de efectuar
una medicin.
Secar las gotas que eventualmente queden en el exterior de la celda, o eliminar
cualquier empaado con un papel absorbente limpio.
Asegurarse que no quede pelusa por fuera ni burbujas de aire adheridas a las
paredes interiores de vidrio.
Al insertar una celda en el soporte del aparato:
a. Colocarla con la lnea ndice hacia la izquierda del aparato.
b. Cuando llegue al fondo rotarla 90 para hacer coincidir las lneas indicadoras de
la posicin exactamente.
c. Para retirar la celda proceda a la inversa (rotarla antes de levantarla para evitar
rayaduras).
Instrucciones de Operacin
1. Conecte a la red 110V el toma del equipo.
2. Encienda el equipo con el control 1 girndolo hacia la derecha, el piloto 3 debe lucir
rojo (spectronic 20). Djelo calentar y estabilizar durante unos 10 minutos
202
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
aproximadamente.
3. Con el control 1 y con el porta-celdas (2) vaco y cerrado ajuste el 0% de T o 0 de
A.
4. Con el control 4 observando la escala (6), seleccione para el anlisis.
5. Gire el control 5 hacia la izquierda hasta el tope, (para proteger el instrumento de medida
anlogo).
6. Ubique en una celda el blanco fotomtrico o lquido de referencia (son
suficientes 3 mL), colquelas en el porta-celdas y cierre el compartimiento.
7. Con el control 5 girndolo hacia la derecha ajuste el 100% de T o cero de A en el
instrumento 7 del Espectrofotmetro anlogo, en el digital, seleccione con la
tecla 8 el modo de operacin %T o A.
8. Retire la celda con el blanco e introduzca en el porta-celdas la misma celda (u otra
equivalente), con la solucin problema.
9. Lea y anote el % de T o la A de la solucin problema.
10. Retire y limpie la celda.
El Spectronic 20D digital presenta la opcin de trabajar directamente en el modo
de concentracin, eliminndose la necesidad de construir curva de calibracin,
siempre y cuando en el anlisis se trabaje en la regin lineal previamente verifcada en el
rango de concentracin de inters, con la l y el espesor de la celda adecuado.
El instrumento electrnicamente convierte el resultado de absorbancia en unidades de
concentracin multiplicando el valor de la absorbancia por el inverso de la pendiente de la
curva de calibracin (C= A x 1/b).
Para trabajar en el modo de concentracin siga los pasos de 1 a 7; luego con
la tecla 8 seleccione el modo de operacin concentracin. Con un patrn de
concentracin conocida, y pulsando las teclas 9 o 10 segn la conveniencia, ajuste el
valor de la concentracin en el display. Verifque con otro patrn de concentracin
intermedia la respuesta lineal asumida por el equipo entre 0 y la concentracin del
primer patrn. Lea la concentracin de la solucin problema.
Despus del anlisis usando el modo concentracin y para agilizar posteriores
determinaciones, o verifcar la concentracin del patrn; seleccione El modo factor,
anote el valor, cuando requiera hacer el mismo anlisis repita los pasos 1 a 7, seleccione el
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
203
modo factor con las teclas 9 y 10 fje su valor, seleccione el modo concentracin,
introduzca la celda con la muestra y lea directamente la concentracin. Igual
procedimiento se hace con el patrn si lo que se desea despus de transcurrido un periodo
de tiempo es verificar su concentracin.
5.4.4.3 Diagramas e instrucciones de manejo del espectrofotmetro
Genesys 5.
Figura 5.47 Espectrofotmetro Genesys 5: a vista frontal,b vista posterior,c diagrama
ptico.
2
1
4
5
14
15
8
6
3
9
7
16
13 12
11 10
AC
ESPEJO A
LAMPARA DE
DEUTERIO
RENDIJA DE
ENTRADA
ESPEJO
CONCAVO
RED
DISCO DE
FILTROS
RENDIJA DE
SALIDA
ESPEJO
CONCAVO
ESPEJO B
MUESTRA
LENTES
DETECTOR
LENTE
CONDENSADOR
DETECTOR DE
REFERENCIA
LAMPARA DE
TUNGSTENO
DIVISOR DEL
RAYO
8
204
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Caractersticas Tcnicas:
Fabricante: Milton Roy
Conexin a la red: 110V
Calibracin: Automtica y autodiagnstico de encendido y
funcionamiento.
Fuente: Lmpara de tungsteno hlogeno para el visible e IR cercano; deuterio
para el UV.
Selector de l : Monocromador de red.
Rango espectral: 200 a 1.100 nm. Cubre las regiones UV cercano de 200
a 350 nm, VIS de 350 a 800nm, IR cercano de 800 a 1100 nm.
Ancho de banda: 5 nm.
Equipo de: haz dividido.
Celdas: De vidrio y metacrilato para la regin del visible, paredes planas y cilindricas,
de un cm de espesor con capacidad hasta 3 mL. Cuarzo para la regin ultravioleta, son
costosas y delicadas
deben manipularse con cuidado.
Detector: Diodos de silicio.
Sistema de amplificacin: Electrnico.
Sistema de lectura: Digital.
Instrumento de lectura: Pantalla de cristal lquido (LCD) con ajuste de
contraste:
Teclado: Con el cual se puede entrar, corregir, sacar informacin y dar ordenes al
microcontrolador; el equipo puede ser operado en 5 idiomas de los cuales se ha seleccinado
el espaol.
Impresora: de papel trmico
Puertos: Serial (RS-232-C) y paralelo.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
205
Conector para red.
Accesorios: Tarjetas con software de aplicacin y grabacin. Portaceldas
para celdas especfcas y diferentes espesores.
Observaciones:
El equipo es para operar a 110 V
Las celdas son un componente de la ptica del equipo y deben tratarse y cuidarse
con toda precaucin.
No tocar la parte inferior a travs de la cual pasa la luz.
Enjuagar la celda con varias porciones pequeas de la solucin antes de efectuar
una medicin.
Secar las gotas que eventualmente queden en el exterior de la celda, o eliminar
cualquier empaado con un papel absorbente limpio.
Asegurarse que no quede pelusa por fuera ni burbujas de aire adheridas a las
paredes interiores de vidrio.
Al insertar una celda en el soporte del aparato:
a. Colocarla con la lnea ndice hacia la lente lateral derecha del porta celdas.
b. Las celdas de paredes planas de metacrilato tienen 2 posiciones en una
de las cuales da un espesor de 0.5 cm y en la otra 1 cm por lo cual deben
ubicarse convenientemente, no son resistente a la Mayora de los solventes
orgnicos y algunos compuestos inorgnicos por lo cual se deben utilizar
teniendo en cuenta esta precaucin.
c. Las siguientes instrucciones de operacin corresponden con una confguracin
sencilla para el manejo del equipo, la cual si sufre alteraciones puede
que no correspondan, en tal caso consulte el profesor o el catalogo propio
del equipo, Para sacar mayor provecho de las funciones del equipo, de la
amigabilidad del software, consulte el catalogo, en las practicas docentes
que se realizan en el curso no se alcanzan a utilizar todas las aplicaciones y
bondades del equipo.
206
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Instrucciones de operacin
1. Conecte la clavija del equipo a la red 110V.
2. Ubique el interuptor (1) en la posicin on.
3. La pantalla (3) debe lucir iluminada con la leyenda Spectronic Genesis 5,
luego aparece en la pantalla el diagnstico de encendido, fecha, hora y la
rutina de verifcacin y ajuste lo cual demora aproximadamente 1:30 minutos,
ajuste el contraste con el control (2).
4. Terminada la rutina aparece en la pantalla:
Abs/%T/C, ID: , pictogramas que monitorean el estado de las lmparas
la impresora, posicin del portaceldas ubicacin de las tarjetas de software y
grabacin.
5. Si solo va operar el equipo en A o %T :
a. Seleccione la y oprima la tecla GOTO, en la pantalla aparecer la nueva
.
b. Ubique en la primera casilla del portaceldas el blanco y alineese en la
trayectoria ptica del equipo con las teclas , oprima la tecla autocero
en la pantalla se visualiza en T 100%T o 0 en A. en la segunda ubique
la muestra, con las teclas , oprima la correspondiente a medir.
Se desplaza el portaceldas, el equipo automaticamente lee el blanco y luego
la muestra, si desea imprimir los resultados oprima la tecla print.
Para trabajar en concentracin se debe calibrar previamente el equipo
con patrones.
c. Para anlisis de muestras en serie y lectura directa de la concentracin,
se debe calibrar el equipo con patrones y seleccionar con la tecla Setup las
condiciones de operacin.
d. Para los programas barrido de exploracin, curva de calibracin
y determinacin de incognitas, no se encuentran detalladas
absolutamente todas las instrucciones, para lo cual debe observar bien los
anuncios en la pantalla y seguir las opciones que se presentan. Si
hay alguna difcultad para entrar y borrar datos, interpretar un mensaje o un
cdigo de error por favor consultar al profesor o ver el catalogo del equipo.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
207
6. Oprima la tecla correspondiente a men aparecer en la pantalla
MENU PRINCIPAL
PROGRAMAS DE APLICACIN
1. Abs/%T/C
2. Manejo de archivos
3. Manejo de programas
Si lecciona la opcin 1 operara el equipo en las condiciones
iniciales de Abs/%T/C. Si en la rendija A ubica la tarjeta
A con el software de aplicacin, cargar 4 nuevos
programas:
4. Curva estandar
5. Relaciones de absorbancia
6. Cintica simple
7. Barrido de exploracin
En la rendija B puede ubiar la tarjeta B de memoria, en la cual
podr guardar los trabajos realizados para futura observacin
en el equipo, o en un computador compatible con dicha tarjeta.
7. Si se requiere obtener una curva espectral, espectro o barrido de exploracin
de una sustancia, seleccione la opcin 7 ( barrido de exploracin), oprima
la tecla setup test, entre las condiciones para el anlisis, oprima la tecla ms
pagina siguiente para ver su contenido, termine de entrar las condiciones y oprima
la tecla Exit.
8. Ubique el blanco en la primera casilla del portaceldas y la sustancia en
la segunda, cierre la cubierta del compatimiento del porta celdas. Oprima la
tecla recorrer lnea base, espere que el equipo haga dicha rutina ( demora
1:40 minutos aproximadamente); oprima la tecla nuevo barrido. Aparecer
en la pantalla el plano con las coordenadas y comiemza a observarse el trazado
de la grfca de derecha a izquierda. Si desea imprimir la grfca oprima print,
Si requiere imprimir las condiciones, oprima la tecla setup test y luego la tecla
print.
9. Para construir una curva de calibracin seleccione la opcin 4 (curva de
calibracin), se observa en la pantalla dos opciones : 1. Construir curvas
de calibracin. 2. Determinacin de incognitas. Seleccione la opcin
1, oprima la tecla setup test, entre las condiciones para el anlisis, oprima la tecla
ms pgina siguiente cuando sea necesario. Una vez entradas las condiciones
para el anlis oprima la tecla exit. Entre las concentracines de los patrones
o estandares, oprima exit, ubique las celdas con el blanco en la primera
208
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
casilla del porta celdas y las dems con los patrones en orden ascendente
de concentracin comenzando en la casilla 2. Oprima la tecla medir un vez
terminada las lecturas oprima la tecla ver prueba y observe la grfca.
Si desea imprimirla oprima la tecla print. Si requiere imprimir las condiciones
del anlis oprima la tecla Exit y luego print. Para leer la concentracin de las
muestras ubiquelas en el porta celdas dejando el blanco en la casilla 1. Oprima
exit, seleccione la opcin 2 (determinacin de incognitas), oprima la
tecla medir si desea imprimir los resultados oprima la tecla print.
5.5.1 Lecturas: Motivacin al Anlisis Espectroscpico (fotomtrico).
Lectura 5.5.1.1
Espectroscopia (E)
123
Del latn spectrum (imagen) y del griego skopeio (observar). Es la parte de la Fsica que
estudia los espectros (v.). Aunque actualmente el concepto espectro se ha extendido a campos
muy diversos, incluso fuera de la Fsica, cuando se habla simplemente de E. se sobrentiende
que se alude al estudio del espectro electromagntico. Por tal motivo, la E. recibe
diversos califcativos, segn la regin del espectro a que se refere: E. gamma, de rayos X
(v.), ultravioleta, visible, infrarroja, de microondas, de ondas de radio. En cada uno de estos
sectores, la E. encuentra unas aplicaciones caractersticas, teniendo en cuenta los agentes
responsables de los correspondientes espectros.
Histricamente hay que remontarse a los tiempos de Newton, verdadero padre de la E.,
aunque, en realidad, slo se comprendi la importancia y posibilidades de esta disciplina
despus de los trabajos de Fraunhofer y, principalmente, de Bunsen y Kirchhoff.
Ellos construyeron el primer espectroscopio realmente til y, con su aplicacin al anlisis
de materiales diversos, demostraron todo el poder de esta tcnica.
Divisin:
Espectroscopia gamma. Esta parte de la E. estudia los espectros de radiacin
gamma (V. RADIACTIVIDAD) producidos por los cambios energticos que tienen lugar
en el interior de los ncleos (v.) atmicos. Por tanto, este tipo de E. tiene su principal
aplicacin en el estudio de la estructura y propiedades de dichos ncleos. Actualmente,
y gracias al descubrimiento del llamado efecto Mossbauer, estas aplicaciones se
han extendido al estudio del estado slido, toda vez que se ha comprobado que los
espectros, debido a este efecto, no son afectados por los tomos vecinos y permiten
estudiar propiedades generales de todos los ncleos que componen un material slido.
12 Enciclopedia GER (junio, 2006) Espectroscopia. Obtenido en 2009 htp://www.canalsocial.net/ger/busquedaav.asp/es-
pectroscopia.html
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
209
Espectroscopia de rayos X. Esta rama de la E. estudia los espectros producidos
cuando los electrones (v.) componentes de las capas internas de los tomos cambian sus
estados cunticos de energa (V. TOMO II). El estudio espectroscpico de estos cambios
permite averiguar la estructura y energa de esas capas internas de los electrones atmicos, y
tambin puede aplicarse a problemas de reconocimiento analtico de sustancias,
toda vez que el espectro de rayos X, como en general todos los espectros electromagnticos
de las sustancias, son una caracterstica muy tpica de las mismas. En este campo merece
recordarse la relacin encontrada por Moseley en 1912 entre la frecuencia de la radiacin
X absorbida por un tomo y su posicin en el Sistema peridico de los elementos qumicos
(v.), lo que permiti descubrir el llamado nmero atmico y sentar las bases para una mejor
comprensin de la estructura de la materia.
Espectroscopia visible y ultravioleta. Indudablemente esta parte de la E. es la
que ms amplia difusin y un mayor nmero de aplicaciones ha encontrado. Por una parte,
los comienzos de la E. fueron en la zona visible, por ser la nica para la que se dispona
de medios de observacin, y, en segundo lugar, porque la informacin que contienen los
espectros visibles y ultravioletas es tan grande, que no es de extraar que la E. se haya
desarrollado fundamentalmente apoyndose en estas dos regiones. Los espectros visibles
y ultravioletas se producen como consecuencia de transiciones entre distintos estados de
energa de los electrones que constituyen los tomos y las molculas, y como, al mismo
tiempo, estos electrones son los responsables de las propiedades y caractersticas qumicas
de estas sustancias, toda esta informacin es siempre de un indudable inters. Puede decirse
que, desde principios del s. xx, prcticamente todos los avances fundamentales realizados en
el campo de la Fsica atmica y molecular se han apoyado de un modo ms o menos directo
en la Espectroscopia. En el campo atmico pueden distinguirse tres fases bien defnidas
en las aplicaciones de la E. al conocimiento de la estructura de la materia. En primer lugar,
la poca de las series espectrales; ms tarde la era de los multipletes, y, por
ltimo, la de interpretacin de espectros muy complejos. Cada una de estas pocas va unida
a un nombre especialmente famoso. Niels Bohr (v.) representa el mximo exponente de la
primera poca, toda vez que, si bien las series espectrales fueron descubiertas y estudiadas
empricamente por Balmer, Paschen y otros, se debe a Bohr la gloria de haber
relacionado directamente estas series con la estructura atmica, dando su modelo del tomo
de hidrgeno en perfecto acuerdo con la estructura del correspondiente espectro observado
en forma de series. Miguel A. Cataln (v.) descubri en 1922 que los espectros de los
tomos con varios electrones de valencia, junto a las series espectrales, presentaban grupos
de lneas a las que se poda atribuir un origen comn, tenan caractersticas semejantes
y mostraban entre ellas relaciones perfectamente reconocibles. A estos grupos de lneas
los denomin multipletes, y Sommerfeld demostr que se deben a transiciones
entre estados electrnicos mltiples, producidos por la diversidad de estados cunticos que
pueden adquirir esos tomos. Este descubrimiento result equivalente al de Bohr, en cuanto
permiti estudiar y explicar con detalle la estructura de los tomos mucho ms complejos que
el del hidrgeno y el de los elementos alcalinos, que eran los nicos que la teora de Bohr
explicaba satisfactoriamente, y dio gran impulso a la E. atmica, de tal modo que ha
210
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
permitido determinar prcticamente la estructura electrnica de todos los tomos conocidos.
Por ltimo, Giulio Racah, desde el punto de vista terico, revolucion la E. a partir de
1940 al demostrar que era posible calcular tericamente, con bastante aproximacin, la
energa de los diversos estados electrnicos de cualquier tomo por complejo que fuera,
lo que a su vez permite predecir su espectro y, por tanto, ha posibilitado extender las
investigaciones espectroscpicas a tomos tales como las llamadas tierras raras y
elementos transurnidos, que, desde un punto de vista simplemente emprico, eran
inabordables en la prctica.
Paralelamente a los avances de la E. atmica, tambin la Fsica molecular ha obtenido
gran ayuda de la E. visible y ultravioleta para su desarrollo. Del mismo modo que
en el campo atmico el primer triunfo debe considerarse la interpretacin del espectro del
tomo de hidrgeno, en el molecular la molcula del mismo elemento fue el primer problema
que se resolvi con xito, gracias en primer lugar, a las ideas de Heitler y London, que
permitieron explicar tericamente el espectro de dicha molculas.
Posteriormente esta rama de la E. molecular se ha extendido a molculas ms complicadas
y puede decirse que siempre es la E. la tcnica cientfca en la que se basan las teoras
de la estructura molecular. Como en la zona visible y ultravioleta del espectro
se observan transiciones moleculares debidas a cambios de energa electrnica asociada a
cambios de energa vibracional y rotacional de las molculas, esta parte de la E. es la que,
en teora, puede proporcionar ms informacin para este tipo de estudios, pero, al mismo
tiempo, su complejidad hace que su uso se limite a las molculas ms sencillas, de dos
tomos principalmente.
Espectroscopia infrarroja y Raman. La E. en la regin infrarroja es fundamentalmente
E. molecular. Aunque las transiciones electrnicas entre estados de energa atmicos
pueden dar lugar tambin a espectros en esta regin, la informacin que suministran es
semejante a la obtenida en la regin ultravioleta y visible y, en general, tiene poca utilidad.
En cambio, la E. molecular infrarroja tiene grandes aplicaciones, porque los espectros
que se estudian son debidos nicamente a variaciones energticas causadas por las
vibraciones y rotaciones moleculares, lo que simplifca mucho su interpretacin,
al eliminar el efecto debido a los saltos electrnicos que caracterizan a los espectros visibles
y ultravioletas. Estas transiciones que se pueden estudiar por medio de la E. infrarroja, se
referen siempre al llamado estado fundamental de la molcula, es decir, al estado en que la
molcula se encuentra normalmente, y, por tanto, la informacin obtenida es siempre muy til
para conocer las propiedades y caractersticas de las molculas, precisamente en ese estado
normal. Una peculiaridad importante de los espectros infrarrojos es que las molculas
complicadas dan lugar a bandas en el espectro que son caractersticas de ciertos grupos
atmicos y, por tanto, permiten llevar a cabo determinaciones estructurales de molculas
muy grandes, basndose en los datos obtenidos a partir de molculas ms sencillas.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
211
Aunque la tcnica es distinta, la E. Raman es una rama de la E. prcticamente gemela
de la infrarroja. Tambin el espectro Raman da informacin sobre las transiciones entre
estados vibracionales y rotacionales de las molculas en su estado normal y, por tanto, los
datos obtenidos son un valioso complemento de los proporcionados por la E. infrarroja,
para interpretar estructuras y propiedades moleculares.
Espectroscopia de microondas. La E. molecular se simplifca a medida que se
desplaza a regiones de longitud de onda ms larga. Hemos visto cmo en el ultravioleta y
visible los espectros son complejos, debido al efecto conjunto de las transiciones electrnicas,
vibracionales y rotacionales. El espectro infrarrojo es ya ms sencillo porque slo lo producen
los cambios de vibracin-rotacin, y, por ltimo, en la regin de las microondas las transiciones
que dan lugar a espectro estn ligadas nicamente a cambios en la energa de
rotacin molecular. Son, por tanto, espectros ms sencillos y su interpretacin, que
constituye el tema de la E. de microondas, aporta, sobre todo, datos de inters respecto
a la distancia internuclear entre los tomos constituyentes de una molcula, as como
a su momento de inercia (v. dinmica), y, por tanto, a su masa.
Espectroscopia de ondas de radio. Continuando la gama del espectro se llega a la
regin de las ondas de radio, donde la E. propiamente dicha tiene pocas aplicaciones. Puede
incluirse en este apartado la E. radioastronmica, aunque en realidad est ms bien an
en el lmite de las microondas, pero acostumbra a denominarse radioespectroscopia.
Tiene especial inters para el estudio de la radiacin de longitud de onda relativamente
grande, emitida por objetos estelares y que, en ocasiones, ha permitido detectar objetos aun
situados a distancias inasequibles para los telescopios pticos (v. radioastronoma).
Espectroscopia instrumental. Segn la zona del espectro estudiada, los
instrumentos espectroscpicos utilizados varan considerablemente. La E.
gamma utiliza sobre todo espectrmetros, que son instrumentos provistos de un medio
dispersor de las radiaciones y de un detector para medirlas. En el campo de los rayos X y
los espectros visibles y ultravioleta, se utiliza, sobre todo, el espectrgrafo que consta
del medio dispersor y utiliza la placa fotogrfca como elemento registrador. Los espectros
infrarrojos se estudian, normalmente, con espectrofotmetros, que son aparatos
registradores provistos de detectores fotoelctricos, etc. Como ejemplos tpicos pueden
citarse los espectrgrafos de prisma y de red, que son la base de los dems instrumentos. Un
espectrgrafo de prisma consta, fundamentalmente: de una rendija, un sistema colimador, el
medio dispersivo (un prisma), que se construye de material diverso segn la zona del espectro
que se quiera estudiar, siendo los materiales ms usuales el cuarzo para el ultravioleta, el
vidrio para el visible y el cloruro sdico para el infrarrojo, y un sistema condensador que
enfoca el espectro sobre una placa fotogrfca.
Los espectrgrafos de red se construyen con redes de refexin, planas o cncavas.
La red acta al mismo tiempo como elemento dispersivo y como condensador, eliminando as
el paso de la radiacin a travs de algn material ptico, por lo que se eliminan los problemas
212
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
de absorcin y, por tanto, con una misma red se puede estudiar una regin mucho ms amplia
del espectro.
Los espectrofotmetros son aparatos mucho ms complejos en los que, junto a los
componentes propiamente espectroscpicos, existe un complicado dispositivo electrnico para
registro, desplazamiento de alguna de las partes pticas, etc. Otras aplicaciones. Al describir
las distintas ramas de la E., se han ido indicando sus aplicaciones a problemas fundamentales
de la estructura de la materia. Modernamente esta rama de la Ciencia ha invadido gran
nmero de campos afnes, extendindose considerablemente sus aplicaciones.
En primer lugar, constituye una rama prcticamente propia la llamada espectroqumica,
que utiliza los espectros de emisin de los metales para llevar a cabo anlisis qumicos. Esta
aplicacin, que constituy uno de los primeros xitos de la E. al demostrar la existencia
de elementos qumicos iguales que los terrestres primero en el Sol y, ms tarde, en otros
objetos celestes, y al descubrir elementos desconocidos apoyndose en su espectro (el gas
noble helio, p. ej.), se ha desarrollado muy considerablemente. Hoy en da todas las grandes
industrias metalrgicas poseen espectrgrafos y espectrmetros especialmente diseados
para este tipo de estudios, alguno de ellos completamente automtico (el cuantmetro) y otros
utilizando nuevas tcnicas de produccin del espectro, especialmente aptas para problemas
industriales. Entre estas tcnicas merece mencin especial la llamada E. de absorcin
atmica que, aprovechando la absorcin selectiva de radiacin por los tomos del metal
que se quiere investigar, permite llevar a cabo anlisis muy precisos de elementos qumicos,
aun en mezclas muy complejas.
En Astrofsica, no slo el anlisis de la composicin de las estrellas y otros objetos es
resultado de la tcnica espectroscpica. Tambin se determinan las temperaturas estelares,
sus distancias a la Tierra y movimiento relativo de la misma, utilizando fenmenos
espectroscpicos tales como el efecto Doppler (v.), que relaciona el corrimiento de rayas
espectrales de un tomo con la velocidad con que dicho tomo se mueve, etc. En Fsica
fundamental, el estudio de efectos especiales en los espectros, tales como el efecto de un
campo magntico (efecto Zeeman) o de un campo elctrico (efecto Stark), permite
determinar con ms detalle las propiedades de los tomos y su constitucin; y otros efectos
aparentemente secundarios, como el llamado desplazamiento Lamb de las rayas
espectrales, permiten comprobar los detalles ms fnos de las teoras fsicas, atmicas y,
en particular, la aplicacin de la electrodinmica cuntica a corregir las predicciones
de las Mecnicas ondulatorias y relativista aplicadas a la estructura atmica. Tambin en
Qumica se aprovechan las investigaciones de la E. para determinar las caractersticas de
los enlaces qumicos, mecanismo de las reacciones qumicas, formacin y existencia de
especies qumicas de vida efmera -los denominados radicales libres- y otras aplicaciones
de carcter fundamental. Y en la vida moderna las tcnicas espectroscpicas se
aplican a cuestiones tan diversas como la determinacin de la edad de un mineral, el autor de
un cuadro antiguo, o la identidad de un criminal.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
213
5.5.1.2 Balanzas? No Algo Mejor
13
4
De proponrnoslo, encontraramos seguramente en cada hogar unos cristalitos oscuros, con
la envoltura tpica de las farmacias, a los que conocemos con el nombre de permanganato. El
permanganato se emplea como desinfectante; sus disoluciones las usamos para enjuagarnos la
garganta en algunas enfermedades.
Lo que llamamos simplemente permanganato es permanganato de potasio, un compuesto que
cede con suma facilidad su oxgeno y que por ello ejerce una accin destructora sobre distintos
microorganismos infecciosos. Pero las que nos interesan ahora son otras de sus propiedades.
Tomemos un cristalito de esta sustancia y echmoslo en un vaso de agua. Al cabo de algn
tiempo sta adquirir un fuerte color violeta.
Eso ya es, de por s, un hecho interesante: a pesar del reducido tamao del cristalito, la coloracin
obtenida es tal, que ni aun poniendo el vaso delante de una lmpara se transparenta lo ms
mnimo.
Diluyamos el contenido del vaso el doble, el cudruple... La coloracin se ir debilitando, pero
no desaparecer por completo.
Tendremos que aadir muchas veces agua para que el color de la disolucin se vuelva
imperceptible.
Tomemos ahora una disolucin cuya coloracin se pueda distinguir todava a simple vista.
Qu cantidad de sustancia contiene esta disolucin, o, como dicen los qumicos, cul es la
concentracin de la misma? Esto ha sido ya establecido con gran exactitud. Doscientos mililitros
de tal disolucin, es decir, el volumen de un vaso de agua, contienen una diezmilsima de
gramo de la sustancia en cuestin. Expresando la concentracin de dicha disolucin en tanto
por ciento, obtendremos 0,0005%, esto es, cinco diezmilsimas de por ciento.
No es difcil establecer la relacin entre la cantidad de la sustancia coloreada contenida en
la disolucin y la coloracin de sta; Y despus de ello, resulta sencillsimo determinar su
concentracin: evidentemente, cuanto ms intenso sea el color de la disolucin, tanto mayor
ser la cantidad de la sustancia coloreada que lleva disuelta.
Este mtodo de anlisis fue denominado colorimtrico (de la palabra color). No cuesta
mucho convencerse de que, en lo que a la sensibilidad se refere, los mtodos colorimtricos
ofrecen grandes ventajas en comparacin con los gravimtricos, es decir, los que se basan
en la determinacin del peso.
13 FIALKOV, Yuri.El Mundo de la Qumica (la novena cifra Decimal).Editorial Cartago, Buenos Aires 1967 traducido del ruso
por Maria Luis Riera. Qumico diplomado en la Universidad de Mosc.
214
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Para averiguar la concentracin por colorimetra, pongamos por caso, de la mencionada
disolucin de permanganato potsico, slo se necesita un aparato muy simple -el colormetro,
diez mililitros de disolucin y tres minutos de tiempo.
Veamos ahora lo que pasara si nos decidiramos a emplear para el anlisis la balanza. La
concentracin de la disolucin es de 0.0005%. Esto signifca que un mililitro de la misma
contiene slo cinco millonsimas de gramo de la sustancia disuelta. Despus de evaporar a
sequedad los 10 mililitros de disolucin que nos bastaran de sobra para el anlisis colorimtrico,
no hallaramos, en resumidas cuentas, nada, ya que las balanzas analticas ordinarias no
pueden registrar cantidades tan insignifcantes como son cinco cienmilsimas de gramo.
En fn, para determinar la concentracin nos veramos obligados a evaporar a sequedad 10 litros
de la disolucin. Slo entonces hallaramos el valor de la concentracin, que se diferenciara del
verdadero, aproximadamente, en unas... cinco veces. Por qu? Pues, porque 10 litros de la
disolucin contendran una cantidad de impurezas-sustancias extraas-cinco veces mayor (y no
nos extendemos en el clculo) que los 10 mililitros de que venimos hablando.
Muchos habrn odo hablar del colorante azul de Prusia o berlins, de hermoso matiz
azul. Esta sustancia puede obtenerse aadiendo a una disolucin de cualquier sal de hierro
una disolucin de prusiato amarillo de potasio. La coloracin aparece incluso cuando
el hierro contenido en la disolucin no excede de tres centigramos por litro, o sea, de tres
cienmilsimas de gramo por mililitro. Y ese valor 0.00003g se sale ya del campo de accin
de las balanzas analticas corrientes. El prusiato amarillo de potasio es
llamado por ello reactivo de los compuestos del hierro. Y como vemos, es un
reactivo muy sensible.
Sin embargo, la sensibilidad del prusiato amarillo de potasio es poca en comparacin con
los efectos de otro indicador del hierro: la sustancia orgnica llamada fenantrolina.
Con este reactivo se puede descubrir la presencia de dos diezmillonsimas de gramo de hierro
por mililitro de disolucin (es decir 0.0000002 o bien 2 X 10
-7
). Se han encontrado reactivos
orgnicos para casi todos los elementos. Estas sustancias permiten descubrir, por la coloracin
correspondiente, de cienmilsimas a diezmillonsimas de gramo del elemento dado, en un
mililitro de disolucin. Es evidente que no hay balanza alguna que pueda equipararse, en cuanto
a sensibilidad, con las reacciones calorimtricas.
Por cierto, que para determinar el contenido de oro del mercurio en los
experimentos de Litte se emple un reactivo de largusimo y altisonante nombre:
paratetrametildiaminodifenilmetano, el cual permite descubrir la presencia de
millonsimas de gramo de oro.
Si se tiene en cuenta que un gramo de mercurio comn contiene diez veces ms oro que la
cantidad antedicha, se comprender que Litte y sus colaboradores descubrieron fcilmente en
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
215
el mercurio el que ste contena desde un principio (ms las cantidades suplementarias del oro
procedente de los lentes, gemelos, anillos y otros objetos de dicho metal).
Los reactivos orgnicos permitieron no slo la formacin de una coloracin que revelara la
presencia de tal o cual elemento en la disolucin, sino tambin que dichos elementos pasaran
a formar parte de sustancias insolubles en agua. A ttulo de ejemplo podemos citar el reactivo
orgnico denominado dimetilglioxima, descubierto por el qumico ruso L.A. Chugaiev
a comienzos de nuestro siglo. Si una disolucin contiene nquel, aunque sea en cantidad
insignifcante, al aadir a la misma dimetilglioxima se forma inmediatamente un precipitado
de color fresa. Y pesando ste, se puede calcular la cantidad de metal que contena la disolucin
analizada. Con ayuda de la dimetilglioxima se puede averiguar la cantidad de nquel
contenida en una disolucin, aunque no pase de una cienmillonsima de gramo (10
-8
) por
mililitro.
A partir de los aos 30, en la prctica de los anlisis qumicos, fueron arraigando ms y ms
los llamados mtodos fsicos. Los cientfcos buscaban tenazmente sustitutos de sus rganos
sensitivos: ojos dotados de mayor percepcin visual que los humanos; manos ms sensibles
que las nuestras; odos que permitieran captar sonidos imperceptibles.
Estos mtodos, hoy da, se emplean mucho en las investigaciones qumicas y prestan
servicios inestimables a los cientfcos.
En primer lugar, debemos citar la espectroscopia. Este es uno de los mtodos de investigacin
ms recientes, pero al mismo tiempo, quizs, el ms respetado. Cuando hace unos cien aos
descubrise que cada elemento coloreaba de diferente modo la llama del mechero Bunsen,
la noticia no caus de momento gran admiracin. A mediados del siglo XIX, cuando apareci la
espectroscopia, la Qumica viva una agitada poca de importantsimos descubrimientos.
Eran aquellos los primeros aos de existencia de la hiptesis molecular; casi cada mes aportaba
nuevos xitos, y adems, colosales en el campo de la Qumica Orgnica; se ideaban nuevos
mtodos de anlisis.
Los primeros pasos de la espectroscopia reportaron un triunfo cientfco. El bautizo
de fuego de este mtodo fue el descubrimiento de dos nuevos elementos: el rubidio y el
cesio. El descubrimiento de un nuevo elemento se haba considerado siempre un asunto de
magna importancia, y constitua un acontecimiento trascendental en las Ciencias Qumicas. De
aqu que la espectroscopia inmediatamente centrara la atencin sobre s.
El respeto a este mtodo creci ms an cuando, al cabo de un decenio poco ms o menos, se
descubrieron con su ayuda el talio, indio, germanio, galio y otros elementos. Despus
este mtodo alcanz su apoteosis con el descubrimiento del helio.
En el ao de 1868 se observ en las protuberancias del Sol una brillante lnea amarilla, que
216
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
no corresponda a ninguno de los elementos conocidos en la Tierra. El nuevo elemento fue
llamado helio en honor del Sol (en griego, helios). Pero hubieron de transcurrir decenios
antes de que el helio fuera descubierto en nuestro planeta, al principio en forma de impurezas
insignifcantes en minerales, y ms tarde, en la atmsfera.
Es de anotar el hecho de que mediante la espectroscopia se descubrieran precisamente
aquellos elementos cuya cantidad en los minerales y rocas es despreciable. De ello ya se
infere que la espectroscopia permite detectar la presencia de cantidades nfmas de los
elementos.
Convencerse por s mismo de eso no es nada difcil. Para ello no hacen falta los complicados
aparatos pticos que se emplean actualmente en los anlisis espectroscpicos. Bastar
un mechero de alcohol, o mejor todava, un mechero Bunsen. Si se introduce en su llama un
alambre de platino o de acero bien templado (por ejemplo, una cuerda de algn instrumento
musical) el color de la llama no cambiara. Ms ser sufciente haberlo frotado antes en la palma
de la mano, para que al ser introducido en la llama imprima a sta un color amarillo muy vivo.
Esta coloracin corresponde al sodio. De dnde ha salido ese elemento?, se
preguntar el lector. El caso es que los poros de nuestra piel segregan sin cesar gotitas de sudor,
que contienen cantidades apreciables de sal comn, esto es, de cloruro de sodio.
Tal es la causa de que en la llama del mechero se revele el color de dicho elemento. Ahora,
estimado lector, calcule usted cunto cloruro de sodio puede haber en la palma de la mano,
y la sensibilidad de la espectroscopia le resultar evidente.
En efecto, por medio de dispositivos muy sencillos podemos advertir la presencia de elementos
en cantidades equivalentes a cienmillonsimas de gramo. Esto signifca que, aunque el
elemento que busquemos est contenido en la materia prima (roca o mineral), en la proporcin
de un gramo por cien toneladas, lo descubriremos de todos modos si recurrimos a la
espectroscopia.
Espectroscopia y reactivos orgnicos: tal era, seguramente, todo el arsenal de que
disponan los qumicos de los aos treinta para la investigacin de pequesimas cantidades
de sustancias.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
217
5.6 Taller
Fotometra Visible
Clculos con la ley de beer y relaciones derivadas
5.6.1. Calcular las absorbancias o densidades pticas correspondientes a los siguientes
valores del % de transmitancia.
%T 100.0 95.0 88.0 71.0 65.0 50.0 27.0 17.0 10.0 8.6 1.0 0.5
A
5.6.2. A una solucin coloreada de un compuesto desconocido, para su identifcacin utilizando
la tcnica fotomtrica en la regin del visible, se le realiz un barrido espectral entre 400 y 700
nm utilizando un espectrofotmetro con una celda de paso ptico de 1.00 cm obtenindose
la siguiente tabla de datos:
Tabla No. 5. 1 % T y l ( longitud de onda) para trazar la curva espectral de un compuesto
desconocido para su identifcacin.
l
400 420 440 460 480 500 510 520 540 560 580 600 620 640 660 680 700
%T 83.0 72 48.5 28.0 20.0 19.0 13.5 15.5 33.0 64 82.0 88.0 89.0 90.0 92.0 95.0 96.0
A
1.1 Calcular el valor de la absorbancia a cada longitud de onda.
1.2 Grafcar en papel milimetrado %T Vs l .
1.3 Grafcar en papel milimetrado A Vs l .
1.4 Confrmar mediante las grfcas la l del mximo (s) de absorcin.
1.5 Comparar el mximo (s) de absorcin del espectro con espectros conocidos, escribir una
lista de posibles compuestos y determinar la identidad del compuesto.
5.6.3. Una disolucin 2.500 x 10
- 4
M se introduce en una celda de muestra cuya longitud de
paso de luz es de 2.00 cm. Cuando se mide a una longitud de onda de 425 nm, la absorbancia
de la disolucin es de 0.338 cul es la absortividad molar ( ) del analito en esta longitud de
onda (l )? Y cul es la absortividad especfca ( a) del compuesto si su peso molecular es 86
g/mol.
Respuestas 676 cm
-1
M
-1
L, 7.86 cm
-1
g
-1
L
5.6.4. La absortividad molar de un soluto particular es de 2.1 x 10
4
L mol
-1
Cm
-1
. Calcular la
transmitancia a travs de una cubeta con un trayecto de luz de 5.00 cm para una solucin de
2.00 x 10
-5
M.
218
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
5.6.5. Una disolucin de Ni (nquel) 5.00 x 10
- 4
M se coloca en una cubeta con una longitud
de paso ptico de 1.000 cm. La absorbancia a 592 nm es 0.446. Cunto vale a 592 nm? S
una disolucin de Ni de concentracin desconocida tiene una absorbancia de 0.125 a la misma
l cul es su concentracin?
Respuesta 1.40 X 10
-4
.
5.6.6. Una solucin, 10
-3
M de cierta sustancia a 350 nm y en una celda de 1 cm absorbe el 70%
de la radiacin. a) Cul ser la absorbancia cuando la concentracin sea 0.6 x 10
-3
M. b) Otra
solucin de dicha sustancia da 0.2 de absorbancia, cual ser su concentracin. c) Cul ser el %
de transmitancia de la solucin de la parte (b) en una celda de espesor tres veces mayor.
5.6.7. Una solucin que contiene 1 g por 100 mL, de cierto colorante transmite 80% de la luz
azul a 435.6 nm en una celda de vidrio de 1 cm de espesor. a) Qu porcentaje de luz ser
transmitido por una solucin que contiene 2 g por 100 mL en una celda de 1 cm de espesor?. b)
Qu concentracin se requiere para transmitir el 50% de la luz?. c) Qu porcentaje de luz ser
transmitida por una solucin de el colorante que contiene 1 g por 100 mL en una celda de 5 cm
de espesor. d) Qu espesor se requiere en la celda para que absorba el 90% de luz con una
solucin de concentracin de 1 g por 100 mL?.
5.6.8. Una cierta solucin, de un colorante azul da una absorbancia de 0.25 con una luz roja en
una celda de 1 cm de espesor. a) Cunta absorbancia dar con una celda de 2 cm de espesor
?. b) Cunto transmitir en una celda de 10 cm de espesor ? c) Qu espesor de celda en cm se
requiere para absorber solamente el 10% de la luz?.
5.6.9. Una solucin de un compuesto (0.001 M) se coloc en la cubeta de un espectrofotmetro
de 1.5 cm de espesor y su transmisin en tanto por ciento fue de 18.4 a 470 nm. Determinar el
coefciente de extincin molar ( ). Calcular el coefciente especfco de extincin ( a) si el peso
molecular del compuesto es 215 g/mol.
5.6.10. Se sabe que la absorbancia de la solucin de un material inorgnico coloreado, a
una l particular, es de 0.90, utilizando una celda de 1.00 cm y una concentracin de 0.0020
M. Para obtener una medicin ms exacta es conveniente una absorbancia de 0.39. De Qu
concentracin debe ser la solucin?.
5.6.11. Se sabe que una solucin de permanganato de potasio en una celda de 1 cm, tiene
una transmitancia de 60% a una longitud de onda dada. Si la concentracin se duplica, a) Cul
ser el porcentaje de transmitancia? b) La absorbancia? c) Qu concentracin de KMnO
4
debe
utilizarse para dar una transmitancia de 60% en una celda de 10 cm de longitud?.
5.6.12. El poder de absorcin molar (constante molar de absortividad ) de cido benzoico
en metanol, es aproximadamente 1950 a 275 nm. Cul es la concentracin mxima de cido
benzoico en g/mL que puede utilizarse en una celda de 1 cm si la absorbancia no debe exceder
de 0.8?.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
219
5.6.13. Una muestra especial de una solucin coloreada, que se sabe que obedece a la ley de
Beer, muestra un 80% de transmitancia cuando se mide en una celda de 1 cm de longitud.
a) Calcule el porcentaje de transmitancia para una solucin de concentracin dos veces mayor
en la misma celda.
b) Cul ser la longitud de la celda para dar la misma transmitancia (80%) para una solucin de
concentracin dos veces mayor que la concentracin original?
c) Calcule el porcentaje de transmitancia de la solucin original contenida en una celda de 0.5
cm de longitud.
d) Si la concentracin original era 0.0005 p/v por ciento (peso a volumen ), cul es el valor de la
absortividad a?.
5.6.14. Si el error de medicin del porcentaje transmitido es constante por centmetro transmitido,
entonces se puede demostrar que la concentracin se puede medir ms precisamente si la
concentracin es tal que el tanto por ciento transmitido es de 36.8 %.
Calcule la concentracin de una solucin de fumarato sdico requerida para dar 36.8% de
transmitancia, si se utiliza una celda de 2 cm. La absortividad molar para el fumarato sdico en
agua a 25C 1,43 x 10
2
cm
-1
mol
-1
L a 250 nm.
5.6.15. Para probar la validez de la ley de Beer en la determinacin de vitamina A, se prepararon
soluciones de concentracin conocida y se trataron por un procedimiento estndar con tricloruro
de antimonio en cloroformo para producir color azul. El porcentaje de transmitancia de la luz
incidente que ha pasado por un fltro para cada concentracin (C g/mL) en una celda dada es
el siguiente:
Tabla No. 5.2
C g/mL 1.0 2.0 3.0 4.0 5.0
%T 66.8 44.7 29.2 19.9 13.3
Grafque A Vs C y diga si se cumple o no la ley de Beer. Una solucin, cuando se trata en la forma
similar con tricloruro de antimonio, transmite el 35% de la luz incidente en la misma celda.
Cul es la concentracin de vitamina A en la solucin?.
5.6.16. Heilmeyer obtuvo Los siguientes datos para calcular la relacin de absorbancia de la
bilirrubina con la concentracin:
220
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Tabla No. 5.3
Concentracin de bilirrubina g/100 mL
2.00 5.00 7.00 10.00
Absorbancia a 450 nm
0.491 0.503 0.704 0.995
Espesor de la celda capa lquida En cm
2.56 1.05 1.05 1.05
(La bilirrubina se desec hasta pesada constante antes de disolverla en cloroformo). Determinar
la absortividad especfca para cada solucin de bilirrubina e indicar si se cumple o no
la ley de Beer.
5.6.17. Se reportaron Los siguientes datos de absorcin consignados en la tabla No. 5.4
para soluciones de oxihemoglobina en buffer pH 7 a 575 nm en una celda de 1 cm.
Tabla No. 5. 4
g/100 mL 0.03 0.05 0.10
% de Absorcin 46.5 64.9 87.7
Calcule el porcentaje transmitido por cada solucin y su respectiva absorbancia.
5.6.18. En un anlisis fotomtrico de hierro en agua se obtuvieron los siguientes datos
consignados en la tabla No. 5 para grafcar la curva de calibracin:
Tabla No. 5.5
Contenido de Fe, g/mL 0.00 0.10 0.20 0.30 0.40 0.50 X
Lectura del galvanmetro, %T 100.0 88.0 77.0 68.0 59.5 52.5 95.0
Grafque la curva de calibracin A Vs C y %T Vs C, calcule el porcentaje de hierro contenido en
el agua si la lectura en el galvanmetro fue 95 %T.
5.6.19. El cido pirvico puede determinarse colorimtricamente por conversin en su 2:4 dinitro-
fenilhidrazona seguida de la adicin de lcali. Con el fn de calibrar un colormetro fotoelctrico
la reaccin se llev a cabo en soluciones que contenan diversas cantidades de cido pirvico,
obtenindose los resultados de la tabla No.5.6.
Tabla No. 5.6
mg/L 20 40 60 100 125 150 175
A 0.130 0.259 0.390 0.628 0.750 0.855 0.940
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
221
Se analizaron por el mtodo una serie de soluciones desconocidas de cido pirvico y una
solucin patrn conteniendo 50 mg/L de cido pirvico. Las lecturas obtenidas en absorbancia
fueron: a) 0.280; b) 0.555; c) 0.690; d) 0.773; e) 0.910, para las soluciones de concentracin
desconocida y 0.325 para la solucin patrn.
Qu tanto por ciento de error se introdujo en el anlisis al emplear el mtodo proporcional de
clculo
x
x
p
p
C
A
C
A
=
(Ley de Beer) basado en el empleo del patrn de 50 mg en lugar de la curva
calibrada que se estableci previamente?. Considere el valor obtenido en la curva como el
valor real y el del mtodo proporcional como el valor experimental.
5.6.20. se desea preparar una serie de cuatro patrones de una sustancia cuya absortividad
molar es de 1500 cm
-1
mol
-1
L. a) Calcular las concentraciones de los patrones, para cubrir un
rango de 0.2 a 0.8 de A, si la celda es de 0.5 cm de espesor. b) Si una solucin problema da
1.3 de absorbancia que se debe hacer para entrarla al rango de absorbancia de los patrones?.
c) Cmo se calcula el factor de dilucin para que la lectura de absorbancia caiga cerca de 0.43
donde se obtiene el mnimo error fotomtrico?
5.6.21. Se midieron a las longitudes de onda que se dan a continuacin, los % de T de las
soluciones C y D por separado, cada una de ellas con una concentracin de 5x10
-4
moles/
litro.
Tambin se midi una muestra desconocida ( X ) que tena ambos compuestos. A partir de
los siguientes datos (tabla No. 5.7), calcule la concentracin en mg/mL de C y D, si sus
pesos moleculares son respectivamente 170 y 234 g/mol. Las mediciones se hicieron en celdas
de igual espesor b. Sugerencia: Para la solucin del ejercicio se debe tener en cuenta la
adictividad de absorbancias.
Tabla No. 5.7
Solucin C D X
%T a 530 nm 50.0 90.0 75.0
%T a 690 nm 90.0 25.0 40.0
5.6.22. Para la determinacin fotomtrica del cromo (Cr
6+
) contenido en el agua residual
de un proceso industrial de curtido de cuero, se tom un alcuota de 10.0 mL de la muestra
previamente fltrada, se le adicion 2 ml de H
2
SO
4
0.2 normal, y l mL de difenilcarbazida
para formar un complejo coloreado, se afor con agua destilada a un volumen de 100.0
mL.
Se ajust mediante el blanco fotomtrico el 0.0 de A a una longitud de onda de 540 nm, se
222
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
le determin la absorbancia a la solucin coloreada obtenindose un valor de 0.74; como se
sabe que el sistema cumple la ley de Beer en un rango experimental de 0.20 a 10.0 mg/L,
se prepar un patrn de 2.50 mg/L el cual di una absorbancia de 0.32. Se pregunta: cul es
la concentracin de Cr
6+
en la muestra? Cmo se debe preparar el blanco fotomtrico para
ajustar el 0.0 de A o 100.0% de T?
5.6.23. Para la determinacin fotomtrica del Ni (nquel) contenido en una aleacin, se
pesaron 0.0624 g de la muestra, se trataron con cido ntrico 1:3 para su disolucin,
se adicion dimetilglioxima para formar un complejo coloreado y se afor a un
volumen de 100 mL. Como se conoce que el sistema cumple la ley Beer en un
rango experimental de 0.00 a 25.00 mg/L de concentracin medida su absorbancia o %
de transmitancia a 530 nm. Se prepar un patrn de 10 mg/L el cual di un valor de
44.0% de T. Se tomaron 10 mL de la disolucin de la muestra y se diluyeron a 50 mL,
se midi la absorbancia obtenindose un valor de 0.780. Las mediciones se realizaron
en celdas de igual espesor.
Determine el % de Ni en la aleacin y explique como se deben preparar el patrn y el
blanco.
5.6.24. Para la determinacin fotomtrica del contenido de NO
2
-
(nitritos) en una muestra de un
derivado crnico (salchichas), se pesaron 10g de la muestra y despus del tratamiento para la
extraccin de los NO
2
-
(nitrititos), el fltrado se afor a 100 mL; de esta solucin se tomaron 10 mL,
se le adicionaron 2.5 mL de sulfanilamida y 2.5 mL de NEA (1 naphthyletilendiamina),
para formar la especie absorbente. Se afor con agua destilada a 25 mL, se dej en reposo durante
5 minutos y luego se determin su absorbancia en un espectrofotmetro visible a una l de 540
nm obtenindose un valor de 0.375.
Para determinar la concentracin de NO
2
-
en la solucin diluida que contiene la especie
absorbente, se prepar una curva de calibracin con los datos consignados en la tabla
5.8.
Tabla 5.8
No. Patrn Blanco 1 2 3 4
Concentracin en g/mL
0.00
0.25
0.50
0.75
1.00
% de Transmitancia 100.00 63.00 39.80 25.10 15.80
Haciendo un anlisis de la informacin consignada en el enunciado 5.6.24 responda los
siguientes planteamientos:
5.6.24.1 Si no se conociera la l analtica como se determinara?
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
223
5.6.24.2 Cmo se debe preparar el blanco fotomtrico para el anlisis y para qu debe ser
utilizado?
5.6.24.3 Cmo se deben preparar los patrones?
5.6.24.4 Cumple el sistema la ley de Beer? S____, No____, Por qu?
5.6.24.5 Cul es la sensibilidad de calibracin?
5.6.24.6 Si la mnima absorbancia que se puede diferenciar del ruido instrumental es 0.0088
cul es limite de deteccin y el lmite de cuantifcacin instrumental del anlisis?
5.6.24.7 Con qu porcentaje de error instrumental se determin la concentracin de NO
2
-
en
la muestra, considerando una incertidumbre del 1% en la medicin de la transmitancia?
5.6.24.8 Cul es la concentracin de NO
2
-
(nitrititos) en las salchichas expresada en
ppm (mg de NO
2
-
/ Kg de salchichas).
5.6.25.
5.6.25.1 Para determinar la concentracin de solucin coloreada desconocida del problema
No.2 de este taller, una vez identifcada, se prepar una solucin de 0.25 moles / Litro, se
le determin su absorbancia en la de su mximo de absorcin, en una celda de 1.00 cm
obtenindose un valor de 1.25, calcular la absortividad molar y la absortividad especfca del
compuesto, hallar la concentracin de la solucin desconocida.
5.6.25.2 A partir de los datos de concentracin y absorbancia de la solucin anterior calcular
de que concentracin se deben preparar 4 patrones de tal manera que sus absorbancias
tericas sean de 0.20, 0.40, 0.60, 0.80 y calcular cuntos mL de la solucin de 0.25 moles/Litro
se requieren para preparar 25 mL de cada patrn.
Para confrmar el cumplimiento de la Ley Beer y precisar el valor de la concentracin de
la solucin desconocida, se tomaron 10 ml y se le adicionaron 10 ml de agua. Se midi la
absorbancia real de cada patrn y de la muestra diluida. Con el blanco fotomtrico se ajusto
en el equipo el cero de A, los datos se consignaron en la tabla No. 5.8 la cual se debe
complementar con los otros datos calculados.
224
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Tabla No. 5.8
Patrn 1 2 3 4 x
Concentracin moles / litro
Volumen en mL del patrn de 0.25 moles/L
Absorbancia Terica 0.200 0.400 0.600 0.800
Absorbancia real 0.190 0.387 0.610 0.886 0.434
a) construir en papel milimetrado la curva de calibracin A
real
Vs C, extrapolar la lnea de los
puntos experimentales a cero con trazos discontinuos, analizar si se cumple la ley de
Beer, si hay desviaciones positivas, negativas, a bajas concentraciones o por ajuste del cero
de A.
b) Calcular la ecuacin, hallar la concentracin de la muestra diluida mediante interpolacin en
la grfca y con la ecuacin.
C) Calcular la concentracin de la muestra inicial y compararla con la obtenida en 5.6.25.1
anotar la conclusin. Calcular la sensibilidad, el lmite de deteccin, el lmite de cuantifcacin,
el % de error instrumental para la muestra, y el % de error total si la concentracin real de la
muestra es de 0.18 moles/litro
5.6.26. Haciendo uso de la siguiente relacin matemtica
2
1 2
2
1 2
0
) (
) (
n n
n n
I
I
r
+
=
donde:
0
I es la
intensidad del haz incidente e
r
I es la intensidad del haz refejado,
1
n y
2
n son los ndices
de refraccin de los dos medios. Calcular la prdida de intensidad porcentual causada por la
refexin para un haz perpendicular de luz amarilla seleccionada por el monocromador de un
espectrofotmetro, a medida que pasa a travs de una celda de vidrio que contiene agua.
Supngase que para la luz amarilla el ndice de refraccin del vidrio es de 1.5, el agua 1.33
y el del aire 1. Respuesta 8.8%
5.6.27. Demostrar que la absorbancia (A) medida en un espectrofotmetro es igual a
2 - Log %T o sea, que T Log A % 2 =
5.6.28. Qu refexiones y conclusiones se obtienen de las lecturas 5.5.1.1 y 5.5.1.2. ?
5.6.29. Consultar en los catalogos de equipos para instrumentacin Quimica o en
internet sobre los ltimos modelos de espectrofotmetros ultravioleta, visible y
sus aplicaciones en el control de calidad y de procesos.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
225
Bibliografa
Catlogos de los diferentes equipos
AYRES, Gilbert H. Anlisis Qumico Cuantitativo (2a. Ed.) Mxico: ED. Harla, 1972 octava
reimpresin.
CASTRO EUSSE, Federman. Manual de Practicas de Laboratorio (2da Ed). Colombia: ED.
UTP. 2003.
Catlogos de los diferentes Equipos. (Instrumentacin Qumica).
CHERIM, Stanley M. Qumica aplicada (1a Ed.) Mxico: ED. Interamericana S.A., 1974.
CONLEY, ROBERT T. Espectroscopia Infrarroja (1 Ed.) Madrid: ED. Alambra. 1979
DAVID Harvey, Qumica Analtica Moderna (1.Ed). Espaa. ED Mcgraw-Hill 2002.
EWIN, Galen W. Mtodos Instrumentales de Anlisis. (4a. ed.). Mxico: ED, Libros Mx Graw
Hill, S.A., 1978.
HARRIS, C Daniel. Anlisis qumico cuantitativo. (3a Ed.) Espaa : Editorial Reverte
S.A., c2007.
MARN VILLADA, Fabio. Conferencias Anlisis Instrumental. Material mimeografado UTP
PECSOK, Robert L., y Shields, L. Donald. Mtodos Modernos de Anlisis Qumico (1a. ed.).
Mxico: ED, Limusa, S.A., 1977.
RAO, C.N., Espectroscopia Ultravioleta y Visible (1a. ed.). Barcelona: ED, Alhambra,
S.A., 1970.
ROBINSON, James W., Principios de Anlisis Instrumental (1a. ed.). Zaragoza: ED, Acriba,
1974.
RUBINSON, Kenneth A; Rubinson Judith F. Qumica Analtica Contempornea (edicin en
espaol). Madrid: ED. Pearson Education; 2001.
RUBINSON, Kenneth A; Rubinson Judith F. Anlisis Instrumental (edicin en espaol). Madrid:
ED. Pearson Education; 2001.
226
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
SKOOG, Douglas A. WEST Donald M. HOLLER F. James. Qumica Analtica (6a. Ed).
Colombia: ED Mcgraw-Hill 1.999.
SKOOG, Douglas A. ,LEARY, James J. Anlisis Instrumental (4a. ed ) Espaa: ED, McGraw-
Hill 1.994.
SKOOG, Douglas A; Holler F James; Nieman Timothy A. Principios de Anlisis Instrumental
(5. Ed). Madrid: ED Mcgraw-Hill 2000.
SKOOG, Douglas A. WEST Donald M. HOLLER F. James. Crouch Stanley R. Qumica Analtica
(8a. ed). Mxico: ED Thomson 2005.
SKOOG, Douglas A; Holler F James; Crouch, Stanley R. Principios de Anlisis Instrumental
(6. Ed).
Mxico: ED Cengage Learning 2008.
STROBEL, Haward A. Instrumentacin Qumica (1a. ed.). Mxico: Limusa, S.A., 1988
WILLARD, Hobart H., Merritt, Lynnel., y Dean John A. Mtodos
Instrumentales de Anlisis (7a. ed ).Mxico: ED, Grupo Editorial Iberoamrica, 1.991.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
227
SEXTA
UNIDAD
228
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
229
SEXTA UNIDAD
6. Introduccin a la espectroscopia Infrarroja
14
1
6.1 Breve resea histrica y consideraciones generales.
La tcnica de espectroscopa infrarroja se inici en el ao de 1.905 en la Universidad de
Cornell en Estados Unidos con el Fsico Norteamericano William W Coblentz. Su
trabajo paso desapercibido durante 25 aos. A mediados de 1.930 los Qumicos empezaron
a jugar un papel importante en el desarrollo de la Espectroscopia Infrarroja y en el ao de
1.936 sali a la industria el primer equipo Infrarrojo.
Inicialmente se utiliz en trabajos tericos con molculas pequeas, pero durante el desarrollo
de la segunda guerra mundial, se present la necesidad de obtener nuevos materiales
resistentes y livianos, lo cual presion a los Qumicos y Espectroscopistas a
hacer aplicacin de la nueva tcnica a molculas grandes y ms complejas especialmente
en el estudio del caucho sinttico y la qumica del petrleo para la obtencin de nuevos
productos.
Los Espectrofotmetros Infrarrojos aparecieron por primera vez en el comercio en
el ao de 1.944. Se caracterizaban por ser de un solo Haz y difciles de manejar, 3 aos
despus cambio esta situacin con la introduccin de los equipos de doble Haz en 1.947,
los cuales automticamente registraban la transmitancia versus la longitud de onda.
A partir de la dcada de los aos 50 se ha venido aplicando los adelantos tecnolgicos
desarrollados en la electrnica y en el manejo de la informacin en el diseo y automatizacin
de estos equipos, los cuales han ido mejorando cada vez ms, hasta la obtencin de los ms
modernos equipos disponibles en el mercado en la primera dcada del siglo XXI.
La espectroscopa de IR es usada puede decirse, universalmente por trabajadores de
muchas disciplinas, pero el trmino tiene un signifcado diferente para cada campo.
14 Materiales recopilados y organizados por el profesor Federmn Castro Eusse para las asignaturas Anlisis Instrumental I
y Anlisis Instrumental II.
230
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Para el Qumico Analtico es: herramienta que resuelve problemas tal como la
determinacin de los ismeros del dicloro-benceno, caracterizacin de una resina, un
polmero, emulsifcantes o identifcacin del opio.
Para un Fsico puede ser til en la produccin de un mtodo de estudio de los niveles de
energa en semiconductores, determinacin de distancias interatmicas en molculas o la
medida de la temperatura de las llamas de un cohete.
Para un Qumico Orgnico es eI medio de identifcar un compuesto orgnico mediante
la seleccin de grupos funcionales, tambin puede usarla en el seguimiento del transcurso
de una reaccin.
Para un Bilogo es una tcnica que puede ser til en el estudio del transporte de materiales
bioactivos en tejidos, o dar indicios para conocer la estructura de muchos antibiticos
naturales y proveer muchas claves en el estudio de la estructura celular.
Para un Fsico-Qumico puede ser la gua para revelar el mecanismo de una reaccin
catalizada heterogneamente. En todos estos y muchos otros campos la espectroscopa
de infrarrojo es una tcnica instrumental poderosa que tiene como rasgo principal su
aplicabilidad tanto en la determinacin cualitativa corno cuantitativa de la funcionalidad
qumica de una cantidad de compuestos qumicos ya sean: gases, liquidas, slidos cristalino
o amorfos.
El espectro de infrarrojo de una sustancia es el refejo de sus vibraciones internas, luego
mediante el examen minucioso de un espectro, se puede extraer mucha informacin. Puede
hablarse entonces de la presencia de ciertos tipos de enlaces o grupos funcionales
por medio de la correlacin con una gran cantidad de informacin que la investigacin ha ido
acumulando con el pasar del tiempo. Las frecuencias e intensidades son sensibles a
la estructura, orientacin, estado fsico, conformacin, temperatura, presin y concentracin.
Todo esto combinado con el conocimiento del qumico sobre los sistemas es lo que hace la
tcnica tan til.
Sin embargo, ciertos rasgos de los espectros tienden a confundirse entre si haciendo la
interpretacin un tanto difcil para identifcacin plena de un compuesto, por lo cual se hace
necesario en muchas ocasiones, de informacin complementaria, tal como la aportada
por espectroscopia UV, la resonancia magntica nuclear, la espectrometra de masa y las
propiedades fsicas; convirtindose as en una poderosa herramienta analtica. Finalmente
podemos agregar que entre las tcnicas instrumentales que se usan en la determinacin de la
funcionalidad qumica es la ms barata y de fcil manejo. La mayora de los instrumentos
de IR registran un espectro en pocos minutos y los ms rpidos en unos pocos segundos.
Adems, su manejo es cada vez ms simplifcado.
La poca actual puede considerarse como nica para el desarrollo y aplicacin de la
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
231
espectroscopia de IR, en todos los sitios del universo existen grupos trabajando
sobre la extensin de las capacidades del IR. Siendo la tendencia ms dramtica hacia
la computarizacin de todos los aspectos de adquisicin, proceso, almacenaje de datos e
identifcacin de sustancias, habilidad que era adquirida por un espectroscopista en
muchos aos de experiencia. Afortunadamente los computadores nos han dejado parcialmente
el arte de preparar las muestras, aunque ya algunos instrumentos nos muestran buenos
espectros a partir de muestras que han sido pobremente preparadas.
La informacin espectral se ha ido en ciertos aparatos digitalizando de donde se puede
transportar y almacenar. Los espectrofotmetros de transformada de Fourier
(FT) o interferomtricos denominados tambin multiplex por transmitir gran cantidad
de informacin por un nico canal; se estn haciendo cada vez ms baratos, alcanzado los
lmites del costo de los espectrofotmetros dispersivos. Sin embargo cuando en un
laboratorio realizamos barridos cualitativos, los dos tipos de instrumentos son equivalentes.
El espectro completo de una sustancia puede adquirirse en solo cuestin de segundos. Los
espectrofotmetros antiguos estn sujetos a errores de barrido dinmico pero los ms
modernos han mejorado notoriamente gracias a la incorporacin de microprocesadores para
la manipulacin del instrumento.
Un espectrofotmetro de Fourier puede adquirir el interferograma a la velocidad
dos veces superior a la de otro tipo de espectrofotmetro, sin embargo, la velocidad de
presentacin de la informacin se ve limitada a las etapas de transformacin de datos y
su grfco. Por lo tanto se han ido utilizando procesadores de alta velocidad para acelerar
los clculos, hacindolos tiles como detectores acoplndolos a los cromatgrafos. Hoy
da los espectrofotmetros dispersivos determinan fenmenos dependientes del tiempo
de una forma ms rpida que los TF, son constantes de tiempo que varan desde unos
pocos segundos a unos minutos; sin embargo, en este aspecto es dudoso que compita con
espectrofotmetros LASER los cuales son un resultado exitoso en la determinacin de
espectros con propiedades como: muy alta sensibilidad, resolucin, pureza espectral todo
junto con una alta velocidad de barrido, todo lo que un espectrocopista necesita.
Finalmente podemos adicionar que la identifcacin de espectros con la ayuda del
computador ha ido creciendo en los ltimos aos y se han producido estaciones de datos
que almacenan, buscan y comparan con bibliotecas de espectros la informacin recibida de
un espectrofotmetro.
Las aplicaciones de la espectroscopia infrarroja son cada da ms importantes en la qumica
orgnica moderna para: la investigacin estructural y funcional, control de calidad, control
de procesos, estudios cinticos, anlisis de contaminantes ambientales, anlisis clnicos,
medicina forense, identifcacin y determinacin del grado de pureza de alcaloides en la
penalizacin por la produccin y comercializacin de estupefacientes etc.
Un curso sobre espectroscopia de infrarrojo generalmente requiere buenos
conocimientos de qumica orgnica. Por otra parte el conocimiento de estas tcnicas
232
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
espectroscpicas es de gran utilidad en los cursos de qumica orgnica moderna, pues al igual
que la potenciometria, la polarimetra, la refractometra, etc., se ha convertido en un recurso
de primer orden para la caracterizacin de las sustancias y para establecer las estructuras
moleculares. Es as como muchos textos de qumica orgnica incluyen una
discusin preliminar de espectroscopia infrarroja con el fn de lograr mayor claridad o mayor
profundidad en las disertaciones sobre qumica estructural o identificativa.
En esta unidad, mediante ejemplos y ejercicios sencillos, se suministran al estudiante los
principios bsicos y la metodologa general de la espectroscopia de infrarrojo.
Para ello se requiere solamente nociones bsicas de qumica orgnica, esencialmente en lo
relativo a los grupos funcionales. El siguiente resumen no pretende dar esta formacin previa,
sino facilitar su recordacin, e incluye apenas los aspectos mas ligados con este curso a la
espectroscopia de infrarrojo.
Esta unidad del curso de Anlisis Instrumental I, no puede considerarse sufciente para
aprovechar debidamente esta metodologa analtica; el estudiante se benefciara de el en
sus estudios de la qumica, a medida que ample sus conocimientos podr profundizar en el
estudio de la espectroscopia y en la practica continua le encontrara su verdadera
utilidad.
6.1.1 Grupos funcionales orgnicos.
La mayora de los compuestos orgnicos se pueden considerar como radicales o
residuos de hidrocarburos unidos a grupos funcionales.
Como ejemplo de radicales podemos mencionar el radical metilo -CH
3
, El radical etilo
-C
2
H
5
, el hexilo C
6
H
13
, el fenilo C
6
H
5
, el bencilo CH
2
C
6
H
5
. Como ejemplo de
grupos funcionales tendremos el grupo alcohol OH, el grupo carbonilo C=O,
carboxilo (o cido) COOH, amina NH
2
etc.
Debe recordarse que el carbono tiene una capacidad de combinacin (o valencia) de 4. El
nombre de compuesto orgnico contiene dos tipos de datos: El del grupo (o grupos)
funcional que contenga y el nombre del radical (o radicales); por ejemplo: alcohol
metilico, CH
3
OH, alcohol etlico C
2
H
5
OH, alcohol hexilico; es decir, un nombre
de familia del grupo funcional y un nombre especifco, el del radical. El grupo funcional
confiere muchas propiedades caractersticas a la molcula y es el
principal responsable de su comportamiento qumico. Aunque muchos
compuestos reciben comnmente nombres que no se ajustan a este esquema, su estructura
molecular si consta de grupos y radicales y su estudio tcnico se hace con base en
ellos; por ejemplo, la dimetilcetona, se llama comnmente acetona.
Algunos grupos contienen varias unidades funcionales: el grupo carboxilo (o cido)
COOH, contiene la unidad OH y la unidad C=O, pero su comportamiento difere en
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
233
muchos aspectos de los alcoholes y de las cetonas y por eso se considera globalmente como
un grupo funcional aparte. Sin embargo algunas caractersticas espectroscpicas
propias de las unidades aparecen en uno y otro grupo funcional.
En la representacin se usa como frmula general una R, para representar los radicales
unidos a
OH
un grupo funcional, ejemplo: R-OH representa los alcoholes primarios; R C R
representa los H
alcoholes secundarios; si se desea destacar que un radical es diferente de otro se usa R, R,
etc; ejemplo: R-C-R
indica cetonas con radicales diferentes.
O
Los radicales solo contienen carbn e hidrgeno al igual que los hidrocarburos de los cuales
se derivan; pueden ser alifticos o aromticos. Los alifticos pueden ser saturados (alcanicos)
si todos los enlaces son sencillos, o no saturados (alquenicos o alquinicos) si poseen enlaces
carbn-carbn dobles o triples. Adems, pueden ser de cadena lineal, de cadena ramifcada
o de cadena cclica.
Los radicales aromticos pueden ser bencnicos, naftalnicos, etc. Segn el nmero de
anillos aromticos que posean. Puede haber radicales que posean parte aliftica y una parte
aromtica.
Grupo molecular estructura Grupo molecular estructura
Enlaces CH
Cuadro 6.1 Principales grupos de compuestos
Metileno
Metilo
Acido
Cetona
Etilnico
Aldehdo
Eter
H
C R R
H
H
C
H
R H
H
C R C
H
H
C O
R
1
R
2
C
R
1
O
H
C
O
R
OH
C R O C R
Benceno
H
H
H
H
H
H
234
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Continuacin Cuadro 6.1 Principales grupos de compuestos
Grupo molecular estructura Grupo molecular estructura
Aldehdo
C R
O
H
Acetilnico C R CH
Enlaces de Oxgeno
Enlaces de Nitrgeno
Agua H OH
Alcohol primario
C R OH
H
H
Alcohol secundario
C
R
OH
H
R
Alcohol terciario
C OH
R
1
R
3
R
2
Fenol
OH
Nitrilos C R N
Anhdrido
R (CO)
2
R O
Amina primaria
N R
H
H
Amina secundaria
NH
R
1
R
2
Amina terciaria
N
R
1
R
3
R
2
Enlaces C C
Alcanos C R
H
H
C
H
H
R
Olefinas
RC
C
H
CH
2
CH
3
Tolueno
Enlaces C Cl
Cloroalcanos
C R R
H
Cl
Esteres
COO R R
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
235
Debe tenerse presente que algunos compuestos poseen varias funciones dentro de su
estructura.
Fuera de estas funciones existen muchas ms, pero para los ejercicios de este curso es
sufciente con las mencionadas.
6.2 Regin infrarroja del espectro electromagntico.
l
de 0.75 a 300 mm
de 13300 a 33 Cm
-1
Regin IR de 4x10
14
a 1x10
12
s
-1
E de 2.64x10
-19
a 6.62x10
-22
j
6.2.1 Subregiones: La regin IR se divide en tres subregiones.
l de 0.75 a 2,5 mm
de 13300 a 4000 Cm
-1
IR Cercano de 4x10
14
a 1.2x10
14
s
-1
(Near) E de 6.62x10
-22
a 7.94x10
-20
J
La regin de IR cercano aporta informacin sobre transiciones electrnicas y se
observan bandas de sobretonos (over tonos) de las vibraciones de estiramiento
simtrico del carbono Hidrgeno CH, OH, NH. Los espectros de reflectancia
obtenidos por penetracin profunda en las muestras de las radiaciones del IR cercano,
ha encontrado gran aplicacin en la industria de granos y alimentos para la determinacin
de protenas, grasa, humedad, azucares, aceites, nmero de yodo (instauracin) y
similares.
Estos espectros tambin se han utilizado para la determinacin de sustancias en
madera, de los componentes de los polmeros y an en la exploracin geolgica area.
Las intensidades son dbiles pero medibles y reproducibles.
{
{
Se caracteriza por ser
radiaciones calorficas
que afectan la energa
vibracional y rotacional
de las molculas.
Se caracteriza porque
las frecuencias de los
movimientos armnicos
de las molculas se
encuentran en esta
subregin.
236
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
La instrumentacin usada en esta subregin espectral es similar en su construccin
a un espectrofotmetro UV-VIS ya que muchos de estos equipos cubren gran parte del
rango del IR cercano.
l de 2,5 a 25 mm
de 4000 a 400 Cm
-1
de 1,2x10
14
a 1.2x10
13
s
-1
E de 7.94x10
-20
a 7.94x10
-21
J
La mayora de informacin relacionada con la estructura molecular y grupos funcionales se
obtiene de la subregin del IR fundamental o medio, las correlaciones tiles se han encontrado
en esta subregin (Observar cuadros 6.2 y 6.3) la cual a su vez se ha subdividido en la
regin de frecuencias de grupo de 4000 a 1300 cm
-1
y la regin de huella digital de
1300 a 650 cm
-1
. En la regin de frecuencias de grupo las bandas principales de absorcin se
asignan a unidades consistentes en vibraciones de slo dos tomos de una molcula, y no de
la estructura molecular completa. Sin embargo, hay infuencias estructurales que le provocan
desplazamientos signifcativos de un compuesto a otro. En la obtencin de la informacin
de un espectro a otro se asignan primero las bandas principales de esta regin a grupos
funcionales; en el intervalo de los 4000 a los 2500 cm
-1
. La absorcin es caracterstica de
las vibraciones de estiramiento del hidrgeno con los elementos de masa 19 o menores. Las
frecuencias de estiramiento CH son especialmente tiles para establecer el tipo de compuesto
presente; por ejemplo, tal estiramiento en el CCH se presenta aproximadamente a los 3300
cm
-1
, para los compuesto aromticos insaturados lo hace aproximadamente entre 3000 y
3100 cm
-1
, y para los compuestos alifticos ocurre a 3000 2800 cm
-1
. Cuando el CH esta
unido a masas ms pesadas, las frecuencias de estiramiento del hidrgeno se translapan a
la regin del triple enlace. Es necesario aclarar que la frecuencia
l
n
C
=
y sus unidades son
s
-1
y que el nmero de onda =
1
por lo tanto sus unidades son cm
-1
; se
observa que en algunos textos los nmeros de onda se denominan frecuencias lo
cual no es rigurosamente correcto.
El intervalo intermedio de frecuencias 2500 a 1540 cm
-1
es llamado a menudo la regin no
saturada o insaturada. Los triples enlaces y grupos similares aparecen de los 2500 a los
2000 cm
-1
; las frecuencias de los dobles enlaces caen en la regin de los 2000 a los 1500
cm
-1
. por medio de una aplicacin racional de los datos empricos acumulados es posibles
distinguir las bandas de C O, CC, CN, N O, y S O. Los factores ms relevantes en
el espectro entre los 1300 y 650 cm
-1
son las frecuencias de estiramiento de enlace sencillo y
las vibraciones de la fexin o doblez, (frecuencias de esqueleto) de sistemas poliatmicos
IR medio
(mid)
Fundamental
{
l
l exp resadaencm
1
Se caracteriza porque
las frecuencias de los
movimientos vibracionales
de las molculas se
encuentran en esta
subregin.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
237
Cuadro 6.2 Regiones sistemticas del espectro IR
que involucran movimientos de enlaces que ligan a un grupo sustituyente con el resto de la
molcula: sta es la regin de la huella digital.
La multiplicidad es tan grande como para poder asegurar la identifcacin de bandas
individuales pero, colectivamente, las bandas de absorcin ayudan a identifcar la muestra.
La instrumentacin para esta subregin del infrarrojo fundamental s difere
considerablemente en el ordenamiento de los componentes y los materiales de los mismos,
con relacin a los equipos utilizados en las regiones UV-VIS e IR cercano.
Los instrumentos usados son los espectrofotmetros dispersivos y los
interferomtricos llamados FTIR (espectrofotmetro de transformada de Fourier),
denominado tambin multiplex.
Los dispersivos son de doble Haz, tienen como elemento dispersante en su monocromador
un prisma o red de difraccin y en lugar de lentes poseen espejos; dada la complejidad de los
espectros deben poseer como mnimo un registrador. Trabajan en el dominio de la frecuencia
y fueron los primeros equipos desarrollados los cuales han sido utilizados por ms de 50
aos.
Huella
Dactilar
4500 2500
2000
1800 1650
1500
650
DEFORMACIN
TENSIN
Mayor energa
Frecuencia cm
-1
Zonas del espectro
2,5 4
5
5,5 6,1
6,6
15
l en mm
238
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Los equipos de trasformada de Fourier no poseen monocromador en su lugar tienen un
interfermetro, normalmente el de Michelson, corresponden a un desarrollo tecnolgico
ms moderno, trabajan en el dominio del tiempo produciendo un interferograma el cual
mediante la transformada de Fourir y un procesador pasan el interferograma al
dominio de la frecuencia; de tal manera que tanto los equipos dispersivos como
los interferomtricos nos presentan los espectros IR tal como los conocemos para su
interpretacin y anlisis.
6.3 cuadro resumen de las zonas espectrales
l de 25 a 300 mm
de 400 a 33 Cm
-1
de 1,2x10
13
a 1.2x10
12
s
-1
E de 7.94x10
-21
a 6.62x10
-22
J
La regin del IR lejano provee informacin a cerca de transiciones rotacionales, modos
de vibracin del esqueleto de cristales, vibraciones esquelticas de una gran cantidad
de molculas y modos de estiramiento de metal-ligando de muchos compuestos de
coordinacin.
Casi todas las molculas presentan alguna absorcin en el IR, excepto molculas mono
atmicas y homopolares tales como: Ne, He, O
2
, N
2
, H
2.
4500 2500
2000
1800 1650
1500
650
Frecuencia cm
-1
Zonas del espectro
2,5 4
5
5,5 6,1
6,6
15
l en mm
C-C
C-N
C-O
C-CI
C N
C C
C O
C C C C C
C N
X C Y
(C,O,N,S)
O-H
N-H
C-H
R lejano
(far)
{
Se caracteriza porque las
frecuencias de los movimientos
rotacionales de las molculas
se encuentran en esta
subregin.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
239
La regin de 667 a 10 cm
-1
contiene las vibraciones de flexin o de carbono,
nitrgeno, oxgeno y fuor con tomos de masa mayor a los 19 as como los movimientos
de doblez de los sistemas ciclicos o insaturados. Las vibraciones moleculares de
baja frecuencia en el IR lejano son particularmente sensibles a cambios en la estructura
global de la molcula, entonces, las bandas del IR lejano, a menudo diferen, de manera
predecible para diferentes formas isomtricas del mismo compuesto base.
Las frecuencias del infrarrojo lejano de los compuestos organometlicos frecuentemente
son sensible al ion o tomo metlico, lo que tambin puede usarse ventajosamente en el
estudio de los enlaces de coordinacin. An ms, esta regin es particularmente adecuada
para el estudio de compuestos organometlicos e inorgnicos con tomos pesados y cuyos
enlaces tienden a ser dbiles.
Algunos instrumentos dispersivos para el IR fundamental cubren parte de esta subregin
y en los diseos especfcos para ella, se requiere en los equipos fuentes de radiaciones
tales como la lmpara de arco de mercurio a alta presin y un sistema de deteccin como
la clula neumtica de Golay. La absorcin atmosfrica es un problema en el
IR lejano, y debe ser posible purgar a los espectrofotmetros con nitrgeno seco. Los
espectrofotmetros interferomtricos son particularmente valiosos en el IR
lejano, ya que a diferencia de los dispersivos dan una mejor calidad espectral.
6.3 Absorcin de radiaciones de la regin IR del espectro
electromagntico por las molculas.
Para responder al interrogante: por qu pueden absorber las molculas radiaciones de la
regin IR del espectro electromagntico?, es necesario que se cumplan las condiciones
siguientes:
6.3.1 La frecuencia natural de vibracin de la molcula ha de coincidir con la de la
radiacin incidente (longitud de onda correcta).
La frecuencia de la radiacin incidente debe ser igual a la frecuencia de vibracin de
alguno de los movimientos naturales de vibracin de la molcula, denominados modos
normales de vibracin.
Un modo normal de vibracin se defne como un modo en que el centro de gravedad
de la molcula no se mueve, y en que todos los tomos se mueven con la misma frecuencia
y en fase; cada modo normal es independiente de los otros, es decir, que cualquiera puede
presentarse sin afectar a los dems. Por tanto es posible que todas estas vibraciones se
presenten al mismo tiempo, reteniendo cada una su frecuencia caracterstica, as
l l
n
l l
n C C
C
= = =
1
240
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
un espectro IR es una representacin grfca de las transiciones vibracionales
de las molculas y las bandas aparecen cuando la absorcin de energa radiante produce
cambios en la energa de la vibracin molecular afectando la amplitud o intensidad
del movimiento pero conservando la frecuencia. En las transiciones vibracionales solo estn
permitidas ciertas energas discretas en las molculas, y la absorcin de luz corresponde a una
transicin entre dos niveles de energa. Es decir, las molculas pueden absorber fotones
cuyas energas sean exactamente iguales a la diferencia entre dos niveles de energa de
vibracin. Por esta razn los espectros de vibracin son discontinuos.
Puede esperarse un espectro de absorcin bastante complejo para la mayora de los
compuestos; el clculo aproximado de las bandas de absorcin que es de esperar se
presenten en el espectro IR de un compuesto se realiza considerando: El nmero de tomos
de la molcula, los grados de libertad y si la molcula es lineal o no lineal.
Las molculas lineales tienen 3n-5 modos normales de vibracin y las molculas no lineales
3n-6 el tres se encuentra relacionado con las tres coordenadas que se requieren para ubicar
un punto en el espacio, n es el nmero de tomos de la molcula, el 5 en las molculas lineales
es la suma de los tres grados de libertad que tienen las molculas para el movimiento de
translacin y 2 dos para los movimientos de rotacin por estar en un plano. Para las molculas
no lineales se consideran 3 grados de libertad para el movimiento rotacional, por lo cual, la
diferencia tanto en las lineales como en las no lineales corresponde a los movimientos
vibracionales, as por ejemplo la molcula lineal triatmica de CO
2
en su espectro IR sera
de esperar 3 x 3 - 5 = 4 modos normales de vibracin o movimientos de vibracin, pero solo
se observan 2 bandas, una correspondiente al movimiento de extensin asimtrico a 2330
cm
-1
y otra de los movimientos de fexin a 666 cm
-1
, la banda de extensin simtrica no
aparece por que no hay activacin del momento dipolar y las dos bandas de fexin son
degeneradas por lo cual solo se presenta una sola.
La molcula del agua es No lineal y tiene 3 x 3 - 6 = 3 movimientos vibracionales los
cuales originan las tres bandas de su espectro IR, la primera a 3756 cm
-1
correspondiente al
movimiento de extensin asimtrico, la segunda a 3662 cm
-1
del movimiento de extensin
simtrico y la tercera a 1596 cm
-1
originada por el movimiento de flexin de tijera
dentro del plano. Otro ejemplo de molcula lineal es la de HCN, y de molcula no lineal
el SO
2
. El benceno C
6
H
6
es una molcula no lineal por lo tanto es de esperar en su espectro
IR 3X12-6=30 bandas de absorcin correspondientes a los movimientos vibracionales, pero,
desde el punto de vista prctico es necesario considerar que un espectro IR esta constituido
por bandas de vibracin o modos normales de vibracin, bandas adicionales procedentes de
los armnicos, bandas procedentes de las frecuencias de combinacin y diferencias, no
es posible la observacin de todas por que al tomar el espectro de este o cualquier otro
compuesto. Se puedan presentar las situaciones siguientes:
1. Que se encuentren bandas fuera del rango espectral que cubre el instrumento las
cuales no pueden ser registradas.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
241
2. Que se presenten bandas degeneradas.
3. Que las bandas sean tan dbiles que no puedan ser detectas.
4. Que las bandas correspondan a movimientos simtricos que no activan el momento
dipolar de la molcula; como en el caso del CO
2
.
5. Que el espectro halla sido tomado en un solvente que presente bandas que solapen
o cubran bandas del compuesto.
Por el acoplamiento vibratorio, la energa de una vibracin y por consiguiente la longitud de
onda de su pico de absorcin, puede ser infuenciada por otros vibradores de las molcula.
El acoplamiento de vibraciones es un fenmeno comn, como resultado de el, la posicin de
una banda de absorcin correspondiente a un grupo funcional dado no puede especifcarse
exactamente. Por ejemplo la frecuencia del CO del metanol es 1034 cm
-1
, en el etanol
es 1053 cm
-1
y en el metilcarbinol es 1105 cm
-1
. Estas variaciones son el resultado de un
acoplamiento de la extensin CO con las vibraciones adyacentes CC o CH. Aunque
los efectos de interaccin pueden producir errores en la identidad de grupos funcionales
contenidos en un compuesto; este efecto es el que proporciona las caractersticas nicas de
un espectro de absorcin IR, tan importantes para la identifcacin positiva de un compuesto
especfco.
En el espectro pueden presentarse otras bandas de absorcin no fundamentales entre
las cuales se tienen las siguientes: Armnicos (sobretonos). Se trata de armnicos de
una frecuencia fundamental, es decir, mltiplos enteros (generalmente, el doble) de dicha
frecuencia (expresndola en cm
-1
). En algunas ocasiones los armnicos pueden presentarse
en la regin de absorcin caracterstica de otros grupos funcionales, creando una posible
fuente de error, si no se tiene cuidado en su interpretacin; pero por otra parte son muy
tiles para confrmar la presencia del grupo que la produce. Es el caso, por ejemplo el
grupo carbonilo C=O cuya banda fundamental se encuentra en los alrededores de los
1700 cm
-1
(5,88mm), y su primer armnico (3400cm
-1
; 2,94mm), se encuentra en la regin de
estiramiento del grupo OH.
Las bandas de combinacin. Son bandas relativamente dbiles que aparecen en
frecuencias iguales a la suma o a la diferencia de dos o ms frecuencias fundamentales.
Las bandas de acoplamiento, (o de conjuncin). Se presentan cuando dos bandas de
absorcin de la misma porcin de la molcula actan entre s causando un desplazamiento
en la posicin que debera esperarse para cada cromforo por separado.
La resonancia de Fermi (resonancia mecnica cuntica). Se presenta cuando
un armnico o una banda de combinacin se encuentra cerca a una banda de absorcin
242
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
fundamental, resultando en un aumento de la intensidad del armnico o de la banda de
combinacin, o un desdoblamiento de las bandas.
6.3.1.1 movimientos de vibracin de las molculas.
1. Movimientos de estiramiento, denominados tambin de elongacin, tensin,
extensin y en ingles con el termino streching. Este movimiento supone un cambio
continuo en la distancia interatmica a lo largo del eje de enlace entre dos tomos. Se
clasifcan en simtricos ( u
S
) y asimtricos ( u
AS
) observar figura 6.1.
Figura 6.1 Movimientos de estiramiento.
1. Movimientos de flexin, denominados tambin de deformacin y en ingles con
el trmino bending. Estos movimientos se caracterizan por un cambio en el ngulo
de dos enlaces. Se clasifcan dentro del plano y fuera del plano. Los movimientos
dentro del plano son los movimientos de tijera o tijereteo denominado con el termino
ingles scissoring (d) y de oscilacin o balanceo denominado con el termino
ingles Rocking (r) observar figura 6.2.
Antes de la absorcin de energa
Despus de la absorcin de energa
Movimiento de estiramiento simetrico s
Antes de la absorcin de energa
Despus de la absorcin de energa
Movimiento de estiramiento simetrico as
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
243
Figura 6.2 movimientos de flexin o deformacin dentro del plano
Los movimientos fuera del plano son los movimientos de: sacudida o vaivn,
denominado tambin aleteo, en ingles Wagging (w), y el movimiento de torsin (t)
conocido en ingles como Twisting (), observar figuras 6.3.
Figura 6.3 movimientos de flexin fuera del plano, la lnea discontinua denota el
plano.
Movimiento de oscilacin o balanceo (rocking p) dentro del plano
Movimiento de sacudida, vaiven o aleteo (wagging wg) fuera del
plano
Movimiento de torsin (twisting T) fuera del plano
Movimiento de tijera o tijereteo (scissoring) dentro del plano
244
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
y indica movimiento perpendicular hacia el plano de la pgina
Figura 6.4 Ilustracin de los modos normales de vibracin de una molcula
triatmica lineal, como la de dixido de carbono CO
2
.
Figura 6.5 Ilustracin modos normales de vibracin de la molcula de H
2
O
(1) Alargamiento
simtrico (n
s
CO)
1340 cm
-1
(7.46 mm)
(2) Alargamiento
asimtrico (n
as
CO)
2350 cm
-1
(4.26 mm)
(3) En tijera(flexin)
(d
s
C.O
2
)666 cm
-1
(15.0 mm)
(4) En tijera(flexin)
(d
s
CO
2
)666 cm
-1
(15.0 mm)
+
-
-
En tijera
(d
s
H.OH)
1596 cm
-1
(6.27 mm)
Alargamiento
asimtrico (n
as
OH)
3756 cm
-1
(2.66 mm)
Alargamiento
simtrico (n
s
OH)
3652 cm
-1
(2.74 mm)
-
+
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
245
Figura 6.6 ilustracin modos normales de vibracin del grupo metilo en el metanol,
los movimientos de tensin del CH
3
originan en el espectro las bandas a 2840 cm
-1
y 2940 cm
-1
, uno de estos movimientos es de modo simtrico y el otro asimtrico. La
vibracin por flexin se encuentra alrededor de 1400cm
-1
.
Los diversos modos de alargamiento y fexin de un grupo AX
2
que aparece como una
porcin de una molcula, por ejemplo el grupo CH
2
en una molcula de hidrocarburos,
observar figura 6.7; la regla 3n-6 no se aplica debido a que el CH
2
solo representa
una porcin de la molcula.
Movimiento Nombre del modo Abreviatura
Tensin
simtrica
Tensin
asimtrica
Flexin
C
C
C
H
H
H
H
H
H
H
H
H
n
as
n
s
246
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Figura 6.7 Ilustracin de los modos vibracionales del grupo CH
2
(+ y - indican el
movimiento perpendicular con respecto al plano de la pgina).
Es de anotar que en muchos espectros de compuestos infrarrojos, a un lado de la banda
de absorcin, aparece un smbolo con el cual se identifca que la banda es caracterstica
de determinado movimiento; as por ejemplo para el movimiento de estiramiento simtrico
el smbolo es
S
u , para el asimtrico
S A
u , para el de torsin t , por tal razn aparecen
unos smbolos entre parntesis en el desarrollo del numeral 6.2.
En tijera O flexin
en el plano
(d
s
CH
2
)
En tijera O flexin
fuera de plano
(w
CH
2
)
Torcimiento o flexin
fuera de plano
(t
CH
2
)
Oscilacin o flexin
en el plano
(p CH
2
)
Alargamiento
asimtrico
(n
as
CH
2
)
Alargamiento
simtrico
(n
s
CH
2
)
VIBRACIONES DE ALARGAMIENTO
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
247
Cuadro 6.4 Resumen de los movimientos de vibracin de las molculas.
6.3.2 La frecuencia de la vibracin debe satisfacer la ecuacin E = h
La energa de vibracin esta dada por la ecuacin
n h V E
V
|
.
|
\
|
+ =
2
1
, donde
V
E es la energa
vibracional y V es el nmero cuntico vibracional que solo puede tomar valores enteros
positivos (incluyendo el cero). As, en contraste con la mecnica ordinaria, en la que los
vibradores pueden tener cualquier energa potencial positiva, la mecnica cuntica requiere
que solo ciertas energas discretas sean asumidas por el vibrador.
Un espectro IR de una molcula es la representacin de las transiciones entre dos niveles
de energa vibracional diferentes, a temperatura ambiente, la mayora de las molculas estn
en estado fundamental,
0
0
=
V
E
, por consiguiente (V=0), as para pasar al primer estado
excitado con energa , (V=1). La diferencia de energa implicada es
, ,por tanto
n n n n n n n h h h h h h h
V E
= = = =
|
.
|
\
|
+
|
.
|
\
|
+ = 1
2
2
2
1
2
3
2
1
0
2
1
1
; de tal forma que se cumple la ecuacin E = h .
6.3.2.1 Analoga de los movimientos vibracionales de las molculas
con el movimiento mecnico del oscilador armnico simple.
Los tomos o los grupos atmicos en las molculas estn en movimiento continuo. Los
movimientos vibracionales de una molcula se parecen a los movimientos observados en
un slido o una bola con una determinada masa unida a un muelle (resorte), es decir, el
oscilador armnico simple. Al considerar la vibracin de alargamiento de un sistema de un
simple slido con una determinada masa y un muelle como se ilustra en figura 6.8,
n n n n n n n h h h h h h h
V E
= = = = |
.
|
\
|
+ |
.
|
\
|
+ = 1
2
2
2
1
2
3
2
1
0
2
1
1
1 V
E
0 1 V V EV
E E =
M
o
v
i
m
i
e
n
t
o
s
V
i
b
r
a
c
i
o
n
a
l
e
s
Flexin
Estiramiento
Simtricos
Asimetricos
Dentro del plano
Fuera del plano
Tijera
Balanceo
Vaiven
Torsin
{
{
{
{
{
248
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
la energa potencial
p
E , de la vibracin de alargamiento es una funcin de la constante
de la fuerza K , del muelle y del desplazamiento x del slido de su posicin de equilibrio
mediante la aplicacin de una fuerza a lo largo del eje del resorte, la fuerza restauradora,
segn la ley Hooke, es proporcional al desplazamiento, es decir, Kx F =
. Donde F es
la fuerza restauradora y K es la fuerza constante que depende de la rigidez del resorte. El
signo negativo indica que F es una fuerza restauradora.
Figura 6.8 Ilustracin oscilador armnico simple y diagrama de energa potencial
La energa potencial del slido y el resorte puede considerarse que es cero cuando el slido
se encuentra en reposo o posicin de equilibrio (0) el la figura 6.8. Pero, al comprimir o
extender el resorte, aumenta la energa potencial del sistema en una cantidad igual al trabajo
requerido para desplazar el slido. Por ejemplo, si el slido se mueve de cierta posicin x a
(x + dx), Posicin A en la figura 6.8, el trabajo, y por tanto el cambio en energa potencial
E es igual a la fuerza F multiplicada por la distancia dx . As, dE = - Fdx .
Combinando las ecuaciones F = -Kx y dE= -Fdx se obtiene dE= - ( - Kx)dx luego
dE = Kxdx. Integrando entre la posicin de equilibrio 0 = x y x se tiene:
=
E x
xdx K dE
0 0
dE = K xdx, resolviendo
2
2
1
Kx E = Kx
2
.
La curva de energa potencial para un oscilador armnico simple describe un movimiento
parablico, observndose que la energa potencial es un mximo cuando el resorte es
extendido o comprimido a su mxima amplitud A y disminuye parablicamente a cero en
la posicin de equilibrio Observar fgura 6.8.
Desplazamiento
E
n
e
r
g
a
p
o
t
e
n
c
i
a
l
E
0
0
A
A
A
A
0
1
1
m
y
K
x
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
249
a m
Para considerar la frecuencia vibratoria del movimiento del slido como una funcin del tiempo
t puede ser deducido de la siguiente manera: La ley de Newton expresa que F = donde
m es la masa de la bola y a la aceleracin, pero la aceleracin es la segunda derivada de
la distancia con respecto al tiempo:
2
2
dt
x d
a = sustituyendo esta expresin en la ecuacin
2
2
dt
x d
m F = , remplazando en: F = -Kx queda Kx
dt
x d
m =
2
2
- Kx una solucin pero
no la nica de esta ltima ecuacin, es
|
|
.
|
\
|
= t
m
k
Asen x donde A es la amplitud de la
vibracin, una constante que es igual al valor mximo de x. Un ciclo completo en una funcin
seno supone un cambio de 2p, por consiguiente el tiempo requerido para completar un ciclo
(el perodo t del movimiento) se da por un valor de t , tal que la cantidad t , entre parntesis
de la ltima ecuacin cambia por 2p. Luego t = t cuando
m
K
t p 2 =
. La frecuencia de la
vibracin v es el reciproco de su periodo entonces v
m
K
m
p t
n
2
1 1
= =
.
La frecuencia v
m
es la frecuencia natural del oscilador mecnico. Aunque depende
de la constante de fuerza del resorte y la masa del cuerpo unido a el, la frecuencia natural
es independiente de la fuerza impartida al sistema; los cambios introducidos en la energa
provocan un cambio en la amplitud ( A) de la vibracin. Observar figura 6.8
Las caractersticas de una vibracin atmica por extensin pueden ser asimiladas a un
modelo mecnico consistente en dos bolas (slidos esfricos) conectadas por un resorte,
en el cual las dos bolas representan los tomos y el resorte el enlace. Un trastorno de una
de estas bolas a lo largo del eje del resorte produce una vibracin llamada movimiento
armnico simple. Observar figura 6.9.
Para un oscilador armnico que consta de dos bolas con masas
1
m y
2
m conectadas por
medio de un resorte, la ecuacin de la energa potencial es una funcin de la constante de
fuerza K , y del desplazamiento total de las dos bolas con respecto a la posicin de equilibrio
( )
2 1
d d + observar figura 6.10.
2p
2p
( )
2 1
d d + t
( )
2 1
d d + t ( )
2 1
d d + t
t
250
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Figura 6.9 Modelo mecnico del oscilador con dos masas
Figura 6.10 desplazamiento de las masas con relacin a la posicin de equilibrio
La frecuencia de vibracin del sistema es una funcin de la constante de fuerza y de la masa
de cada bola.
( )
2
2 1
2
1
d d K E
p
+ =
observar figura 6.11. La energa potencial depende del
desplazamiento y de la constante de fuerza. La frecuencia depende de la constante de fuerza
y de la masa del sistema por lo cual permanece constante.
Las ecuaciones pueden modifcarse fcilmente para describir el comportamiento de un
sistema constituido por dos bolas con masas
1
m y
2
m conectadas por un resorte. Aqu solo
es necesario sustituir la masa m por la masa reducida m donde
2 1
1 1 1
m m
+ =
m
por lo tanto
2 1
2 1
1
m m
m m +
=
m
m( )
2 1 2 1
m m m m = + m luego m .
Haciendo relacin a lo anterior la frecuencia vibratoria del sistema se da por:
n
m
m p
n
k
m
2
1
= =
( )
2 1
2 1
2
1
m m
m m k +
p
remplazando en
( )
2 1
2 1
2 m m
m m k h
h E
+
= =
p
n
m
1
m
2
X = 0 X = 0
X
1 X
2
2 1
2 1
m m
m m
+
= m
m
m
2 p
2 p
m
2 p
hn
M
1
M
2
x
0
D
c
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
251
Figura 6.11 Diagrama de energa potencial
Relacionando la frecuencia con l y con nse tiene:
Para las vibraciones moleculares, ordinariamente se hace la aproximacin en la cual, el
comportamiento de una vibracin molecular es anlogo al modelo mecnico y la frecuencia
de la vibracin se calcula sustituyendo
1
m y
2
m por las masas de los dos tomos; la cantidad
k se asimila a la constante del enlace qumico. El modelo mecnico del oscilador armnico
simple es una aproximacin para explicar el comportamiento vibracional de las molculas
ya que desde el punto de vista cualitativo es una descripcin imperfecta de la vibracin
molecular; pues, cuando dos tomo se acercan entre s, la repulsin coulmbica entre los
dos ncleos produce una fuerza que acta en la misma direccin que la fuerza restauradora
del enlace y, por tanto, puede esperarse que la energa potencial se eleve ms rpidamente
que lo que predice la teora del oscilador armnico simple. Este es uno de los ejemplos que
permite evidenciar desde el punto de vista cualitativo que las curvas han de tener la forma
E
n
e
r
g
a
p
o
t
e
n
c
i
a
l
E
Distancia interatmica
0
1
2
1
2
Energa de disociacin
r
2
r
1
Nivel de energa
v
0
1
6
5
4
3
2
2 p
n
c
=
l
luego
c
l
=
n
=
( )
2 1
2 1
2
1
m m
m m k
c c
+
= =
p
n
l
1
n
1
=
l
=
( )
2 1
2 1
2
1
m m
m m k
c c
+
= =
p
n
l
1
2 p
1
c
luego
n
=
n
1
n
c
n
=
entonces n
c
n
=
=
( )
2 1
2 1
2
1
m m
m m k
c c
+
= =
p
n
l
2 p
c
252
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
no armnica que se muestra en la curva 2 de la figura 6.11. Estas curvas se apartan
del comportamiento armnico en un grado distinto, en funcin de la naturaleza del enlace y
de los tomos implicados. Debe observarse en la figura 6.11 que la curva armnica 1 y
no armnica 2 son casi iguales a energas potenciales bajas por lo cual es utilizada esta
analoga.
Pueden provocarse transiciones en los niveles de energa vibratoria por radiacin Observar
(figura 6.11 curva 2), siempre que la energa de la radiacin iguale exactamente a la
diferencia en niveles de energa E entre los estados cunticos vibracionales y estimule
cambios en el momento dipolar de la molcula. Esta diferencia de energa es idntica en
cualquier par de niveles adyacentes por que el nmero quntico vibracional puede asumir
solo valores de nmeros enteros positivos.
Los modos vibracionales posibles en una molcula poliatmica pueden verse a partir de un
modelo mecnico del sistema, como se puede observar esquemticamente en la figura
6.12. Los tomos se representan como esferas y sus pesos son iguales a los pesos de los
tomos correspondientes, y estn distribuidos conforme a la geometra espacial de la molcula;
resortes con fuerzas iguales a las de los enlaces qumicos conectan las esferas entre s y
equilibran la estructura. Si el modelo se suspendiera en el espacio y se dejara a la deriva,
parecera que las esferas sufren movimientos caticos, sin embargo, si el modelo vibracional
se observara con luz estroboscpica de frecuencia variable, se encontraran algunas
frecuencias luminosas a las que las esferas pareceran estar en reposo: esto representa las
frecuencias vibracionales especfcas de los movimientos observados.
Figura 6.12 Vibraciones y frecuencias caractersticas del acetaldehdo
C
C
H
H H
H
O
Flexin de -CH
3
1460 cm
-1
(6.85 m)
1365 cm
-1
7.33 m)
estiramiento C-C
1165 cm
-1
(
8.6 mm)
estiramiento C = O
1730 cm
-1
( 5.77 mm)
estiramiento C-H del CH
3
2960 cm
-1
( 3.38 mm)
2870 cm
-1
( 3.48 mm)
estiramiento C-H del CHO
2720 cm
-1
(3.68 mm)
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
253
6.3.3 Los cambios de vibracin deben estimular variaciones del
momento dipolar de la molcula.
Para que una molcula sea capaz de absorber radiacin IR debe tener un dipolo elctrico
variable. Una molcula posee un dipolo cuando existe una carga elctrica dbilmente positiva
y otra equivalente negativa en los tomos que la componen observar figura 6.13. Estas
cargas, que no coinciden con la del electrn o la del protn, representan, respectivamente,
un ligero defecto y exceso de electrones sobre cada superfcie, y por tanto, dos cargas
fraccionarias adyacentes y opuestas, que forman el dipolo. Para que se produzca absorcin
IR es necesario que el dipolo molecular oscile durante la transicin vibratoria.
Figura 6.13 Cargas fraccionarias sobre los tomos de carbono e hidrgeno del
formaldehdo.
En la figura 6.13 se muestran las cargas fraccionarias sobre los tomos de carbono e
hidrogeno, en el formaldehdo. (Adems, el oxgeno del formaldehdo es ligeramente negativo
respecto al del carbono). Se observa que la molcula tiene un dipolo y en consecuencia
puede absorber radiacin.
Cuando la velocidad de cambio del dipolo durante la vibracin es grande, la absorcin de
radiacin es intensa. (la fuerza del dipolo y, por tanto, su velocidad de cambio, ser tanto
mayor cuanto ms prximos se encuentren los tomos responsables del mismo). Es decir, la
carga es elevada y la vibracin rpida, la velocidad de cambio del dipolo ser
grande y la absorcin intensa, recprocamente, a una variacin lenta corresponder una
absorcin dbil. As, por ejemplo, cuando el dipolo es dbil o los tomos que vibran, aun
en la misma molcula, estn alejados entre s (como ocurre con un tomo de carbono y otro
de hidrgeno no enlazados directamente), la absorcin de radiacin ser poco intensa.
La intensidad se manifesta en las bandas de absorcin caractersticas del espectro del
compuesto; por lo cual se clasifcan como Fuertes, medias y dbiles.
+
+
_
H
H
C
O
254
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
6.3.4 La intensidad de la absorcin ha de ser proporcional al cuadrado
de la velocidad de cambio del dipolo.
6.4 Aplicaciones analticas de la espectroscopia infrarroja (IR).
Las dos aplicaciones analticas ms importantes de la espectroscopia IR son la determinacin
cualitativa y cuantitativa de compuestos orgnicos y mezclas. La frecuencia de la radiacin
absorbida
por un conjunto de tomos y enlaces qumicos, (por una molcula determinada) es siempre
constante.
Es decir, las frecuencias a las que una molcula absorbe radiacin son caractersticas de ella.
Adems, grupos funcionales tales como CH
3
, C = O, C-OH actan tambin como unidades
independientes y dan espectros de absorcin caractersticos. De esta forma, es posible la
identifcacin de grupos funcionales de gran importancia en Qumica Orgnica, y
se obtiene as mismo, la base cualitativa de la espectroscopia de absorcin IR, puesto que
molculas distintas producen espectros de absorcin diferentes, dependiendo del tamao
y forma de los tomos que las componen, es posible identifcar muestras desconocidas
comparando sus espectros de absorcin con los de distintos grupos funcionales. As mismo,
es posible obtener informacin acerca de la geometra molecular.
El grado de absorcin se controla por la velocidad de cambio de dipolo durante la
vibracin. Esta velocidad es una propiedad fsica de la molcula que no se altera en
condiciones normales.
La extensin en que se produce la absorcin puede medirse utilizando, como muestra, una
disolucin de concentracin conocida. A continuacin se determina la absorbancia de la
muestra problema y comparando ambos espectros es posible obtener la concentracin de la
misma. De esta forma, la espectroscopia IR puede utilizarse como tcnica cuantitativa.
6.4.1 Anlisis Cualitativo
Antes de tratar de interpretar un espectro IR es importante disponer de la mxima informacin
posible acerca de la muestra.
Por ejemplo, para identifcar los productos de una reaccin orgnica es muy til disponer del
mayor nmero de datos sobre las sustancias reaccionantes, as como tener una idea previa
de cules pueden ser los productos y sus posibles reacciones de degradacin. As pues,
utilizando cuanta informacin sea posible, se pueden identifcar las molculas existentes en
la muestra.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
255
La aplicacin de sta tcnica para anlisis cualitativo se basa en el comportamiento y
caractersticas estructurales de las molculas.
La frecuencia de vibracin de las distintas partes de una molcula depende de las masas
de los tomos (o grupos) que vibran y de las fuerzas de enlace puesto que la frecuencia
de absorcin es la misma que la de vibracin del grupo, la frecuencia de la radiacin IR
absorbida por grupos diferentes es caracterstica de cada grupo.
El anlisis cualitativo se lleva a cabo comparando las frecuencias absorbidas por la muestra
con las de los grupos funcionales ms importantes. Esta comparacin se realiza tanto mejor
cuando mayor sea la informacin previa de que se disponga sobre la muestra. Antes de
hacer una identifcacin positiva se deben comparar todas las bandas de absorcin tpicas
del grupo funcional.
Para la interpretacin de un espectro IR no existen reglas rgidas, sin embargo, hay
ciertos requisitos que deben satisfacerse antes de intentar su interpretacin las cuales estn
relacionadas con los siguientes criterios:
1. El espectro debe estar resuelto adecuadamente y tener una intensidad apropiada.
2. El espectro debe corresponder a un compuesto razonablemente puro.
3. El espectrofotmetro donde se obtuvo el espectro debe haber sido calibrado de modo
que las bandas se observen a las frecuencias o longitudes de onda correctas. La calibracin
adecuada puede lograrse mediante estndares confables tal como la utilizacin una
pelcula de poliestireno.
4. Debe especifcarse el mtodo de manejo de la muestra. Cuando se usa un solvente, debe
indicarse el solvente, la Concentracin y el espesor de la celda.
Un buen solvente para espectroscopia infrarroja debe reunir los siguientes requisitos:
a. Buen poder disolvente para sustancias orgnicas.
b. Buena transparencia, preferiblemente en toda la regin IR a estudiar.
c. Volatilidad moderada para facilitar la limpieza de las celdas.
d. Baja polaridad para reducir la interaccin solvente soluto que puede alterar un poco las
bandas de absorcin.
5. Debe especifcarse a qu estado fsico (slido, lquido o vapor) de la muestra
corresponde el espectro.
256
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
6. Observar en el espectro la escala en el eje de las abscisas y verifcar si es lineal en
nmero de onda o longitud de onda, observar el eje de ordenadas si esta en absorbancia o
transmitancia.
7. observar la posicin y la intensidad de cada una de las bandas anotar el nmero
de onda o la longitud de onda en la cual se presentan y confrontar esta informacin con la
aportada por la literatura qumica en las tablas y grfcas de correlacin. La identidad del
compuesto y su estructura se obtiene analizando las bandas de absorcin caractersticas de
los enlaces, grupos funcionales y radicales que acompaan la molcula.
Las grfcas de correlacin, sobre las cuales existe abundante informacin, proporcionan un
medio conciso para resumir esta informacin de modo que sea til para fnes analticos de
identifcacin.
El Qumico interesado en identifcar un compuesto orgnico mediante la tcnica IR
generalmente examina ciertas regiones del espectro en forma sistemtica como lo es la
regin de la huella dactilar, del doble, del triple enlace, de los movimientos
de deformacin o flexin y los movimientos de estiramiento o tensin.
Observar y analizar cuadros (6.1, 6.2,6.3,6.4, 6.5, 6.6), con el propsito de
obtener indicios sobre la presencia o ausencia de grupos de frecuencias. No es posible el
tratamiento preciso de las vibraciones de una molcula compleja; siendo as, el espectro
IR debe interpretarse mediante la comparacin emprica de los espectros y la
extrapolacin de estudios de molculas simples.
6.4.1.1 Frecuencias de Absorcin Caractersticas de algunos
Compuestos orgnicos:
Grupos alquilos: CH
3
, =CH
2
, CH(CH
3
)
2
, C(CH
3
)
3
.
Son hidrocarburos saturados y son compuestos que tienen una cadena saturada, presentan
una banda en la regin 2850-3000 cm.
-1
debido a las vibraciones de estiramiento del enlace
C-H. Vibraciones de fexin del enlace en las siguientes regiones dependiendo de los grupos
presentes en la molcula.
Grupo metilo (CH
3
)
Dos bandas 1375 cm.
-1
y 1450 cm.
-1
, debido a vibraciones de fexin simtrica (todos los enlaces
C-H se doblan en fase) y asimtrica (los enlaces doblan fuera de fase) respectivamente. La
banda a 1375 cm.
-1
es muy caracterstica.
Grupo metileno (CH
2
)
Una banda a 1465 cm.
-1
, debido a scissoring del grupo metileno. Esta banda se superpone
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
257
con la banda a 1450 cm.
-1
del grupo metilo. Tambin se encuentran bandas ms dbiles en la
regin 1350-1150 cm.
-1
debido a la fexin twisting y wagging y otra a 720 cm.
-1
debido
a rocking.
Grupo isopropilo CH
(CH
3
)
2
Dos bandas de igual intensidad a 1384-1380 cm.
-1
y 1370-1365 cm.
-1
.
Grupo terbutilo C(CH
3
)
3
Dos bandas a 1395-1385 cm
-1
y 1370 cm
-1
. La banda a 1370 cm
-1
es ms fuerte.
Compuestos insaturados que tienen un doble enlace:
Todos los compuestos que tienen un doble enlace presentan bandas caractersticas debido al
estiramiento del enlace C=C y debido al estiramiento y fexin del enlace C-H del sistema
C=C-H.
Para compuestos que tienen un doble enlace aislado la banda debido al estiramiento del
enlace C=C se encuentra a 1660-1640 cm
-1
y es de intensidad moderada o dbil. La
conjugacin del doble enlace con otro doble enlace, con un anillo bencnico o con un grupo
carbonilo, aumenta la intensidad de esta banda y la desplaza a 1630-1610 cm
-1
.
El estiramiento del enlace C-H olefnica de varias bandas en la regin 3020-3080. La posicin
de esta absorcin es un contraste a las de las bandas debido al estiramiento, de los enlaces
C-H saturados, las cuales se encuentran por debajo de 3000 cm.
-1
Las vibraciones de fexin del enlace C-H olefnica pueden ocurrir en el plano o fuera del
plano del doble enlace. Las vibraciones en el plano del doble enlace dan bandas dbiles en
la regin 1200-1400 cm.
-1
.
Las vibraciones fuera del plano del anillo ocasionan absorciones fuertes entre 1000-650 cm
-1
.
Las bandas obtenidas para oleofinas diferentes se resumen en seguida donde R puede
ser un grupo alquilo o un grupo carbonilo:
258
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Compuestos que tiene triple enlace:
Se encuentran dos tipos de absorcin caractersticas, la debida al estiramiento del triple
enlace y la debida al estiramiento y fexin del enlace C-H del sistema CC-H.
La banda de estiramiento de enlace CC que ocurre en la regin 2260-2100 cm.
-1
es en
general dbil y el triple enlace no esta conjugando con un carbonilo.
La banda debido al estiramiento de C-H acetilenico ocurre en la regin 3330-3260 cm
-1
y es
fuerte, y la banda debido a la fexin del enlace C-H acetilenico ocurre en la regin 700-610
cm
-1
es ancha y fuerte.
Compuestos aromticos:
En el espectro de compuestos aromticos se presentan bandas debido al estiramiento del
enlace carbono aromtico y al estiramiento y fexin del enlace C-H aromtico.
Las bandas de estiramiento del enlace carbono-aromtico se encuentran en las regiones
3100-3000 cm
-1
, es decir, a frecuencias ms altas de que los enlaces C-H alifticos.
Hay dos maneras de fexin del enlace C-H aromtico en el plano y fuera del plano
del anillo. Las bandas debido a la fexin en el plano del anillo se encuentran en la regin
1000-1200 cm
-1
. Son de moderada intensidad y su nmero y su posicin exacta
depende del tipo de sustitucin en el anillo. Las bandas debidas a la fexin fuera del plano del
anillo son en general las mas fuertes y se encuentran en la regin 900-650 cm
-1
. La posicin
exacta de ellos depende del tipo de sustitucin en el anillo y pueden usarse para determinar
la manera de sustitucin excepto en el caso de nitrobencenos cidos esteres y
aminas aromticos para tales compuestos la posicin de estas bandas es mas variable.
H
C
R
H
C
H
H
C
R
H
C
R
R
C
H
H
C
R
R
C
R
H
C
H
R
C
H
R
C
R
=
=
=
=
=
Vinilo
CIS
TRANS
VINILDEMO
TRISUSTITUIDO
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
259
De acuerdo a lo anterior se puede escribir la siguiente tabla:
Monosustituidos dos bandas 690-710 cm
-1
y 730-770 cm
-1
1.2 di sustituidos una banda 740-760 cm
-1
1.3 di sustituidos dos bandas 690-710 cm
-1
y 710-810 cm
-1
1.4 di sustituidos una banda 810-840 cm
-1
1.2.3 trisustituidos dos bandas 700-750 cm
-1
y 760-780 cm
-1
1.2.4 trisustituidos dos bandas 800-830 cm
-1
y 870-890 cm
-1
1.3.5 trisustituidos dos bandas 680-700 cm
-1
y 830-850 cm
-1
Aldehdos:
Los aldehdos alifticos saturados presentan una banda fuerte a 1720-1730 cm.
-1
debido al estiramiento del grupo carbonilo. Para aldehdos aromticos y C, B- insaturados
(R-CH-CHO) esta banda se desplaza a 1710-1685 cm
-1
(para aldehdos insaturados tambin
debe presentarse bandas debido al estiramiento del enlace C=C y C=CH fexin del enlace
C=CH). Tambin para la mayora de los aldehdos se presenta una banda a 2700-2800 cm
-1
debido al estiramiento del enlace C-H del grupo CHO. La existencia de esta banda y otra
debido al grupo carbonilo es buena evidencia de que el compuesto es un aldehdo.
La fexin del enlace C-H del grupo CHO ocurre en la regin 1000-850 cm
-1
.
Para aldehdos alifticos el estiramiento del enlace C-C del grupo CH
2
-CHO da las
bandas en la regin 1445-1375 cm
-1
.
Cetonas:
Todas las cetonas muestran una banda fuerte debido a la elongacin del grupo carbonilo,
las cetonas alifticas la muestran a 1705-1715 cm
-1
y las cetonas aromticas insaturadas
(R-CH=CH-COR) a 1650-1700 cm
-1
. Tambin las cetonas muestran bandas mltiples en
la regin 1300-1100 debido a la elongacin y deformacin del grupo C-CO-C.
Las bandas debidas a la deformacin del enlace C-H del grupo CH
3
-CO- se encuentran a
1450-1400 y 1375-1350 y las del grupo CH
2
-CO- a 1435-1405 cm
-1
.
Esteres:
Los esteres muestran dos regiones de absorcin fuerte en su espectro debido al
estiramiento del grupo C=O y la otra al estiramiento del enlace C-O. La banda del grupo
C=O ocurre a 1750-1735 para esteres alifticos saturados; 1735-1715 para los
esteres fenilo. Las bandas de estiramiento del grupo C-O son en general muy fuertes.
Los esteres del actico muestran dos bandas, una a 1240-1250 (mas fuerte) otra a
1040-1100 cm
-1
y las de los otros cidos carboxlicos saturados a 1190-1210 cm
-1
(mas fuertes) y 1040-1100 cm
-1
, los del cido benzoico a 1290 cm
-1
y 1110 cm
-1
.
260
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
A veces en los espectros de los esteres se encuentra una banda dbil cerca de 3450 cm
-1
la cual es un aromtico (sobre tono) de la absorcin del grupo carbonilo.
Alcoholes y fenoles:
Las bandas ms caractersticas del espectro de un alcohol o de un fenol son las que
resultan de los estiramientos de los enlaces O-H y C-O y de la fexin del enlace O-H.
En fases liquidas las vibraciones de estiramiento del enlace O-H tanto de los alcoholes
como de los fenoles dan una banda ancha y fuerte cerca de 3330 cm
-1
.
Esta banda es ancha debido a los puentes de hidrogeno entre las molculas del
alcohol. En la fase gaseosa o en solucin diluida en un solvente no polar esta banda es
mucho mas aguda y aparece a 3650-2584 cm
-1
.
Las bandas debido al estiramiento del enlace C-O aparecen en la regin 1200-1000cm
-1
.
y son generalmente muy fuertes. En general los alcoholes primarios absorben a
1030-1060 cm
-1
, alcoholes secundarios cerca de 1100 cm
-1
, alcoholes terciarios
cerca de 1140 cm
-1
y fenoles cerca de 1230 cm
-1
. Sin embargo estas posiciones no son
de mucha confanza y es mejor atenerse a las pruebas qumicas para distinguir entre
alcoholes primarios, secundarios y terciarios.
La fexin del enlace O-H de los alcoholes en el plano de la molcula originan una banda
en la regin 1420-1330. en alcoholes primarios y secundarios esta banda se une
con la debida a la de flexin del enlace C-H para producir dos bandas, una cerca de 1420
cm
-1
y la otra cerca de 1330 cm
-1
, para los fenoles la fexin del enlace O-H produce una
serie de bandas fuertes entre 1100-1200 cm
-1
.
Tambin los alcoholes y fenoles muestran una banda ancha en la regin 770 - 650 cm
-1
debida a la fexin del enlace O-H fuera del plano de la molcula.
cidos carboxlicos:
El espectro de un acido carboxlico es uno de los mas fciles de reconocer debido a la
absorcin caracterstica de los grupos carbonilo e hidroxilo.
El estiramiento del grupo O-H produce una banda muy fuerte y ancha en la regin de 2400-
3000
cm
-1
para cidos alifticos y a 1680-1700 cm
-1
para cidos aromticos
insaturados.
El estiramiento del enlace C-O da una banda fuerte a 1310-1250 cm
-1
. la fexin del enlace
O-H en el plano de la molcula produce una banda cerca de 1440-1400 cm
-1
y la fexin fuera
del plano produce una banda cerca de 920 cm
-1
. Esta ultima banda es ancha o de intensidad
intermedia pero tambin muy caracterstica.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
261
Amidas:
Las amidas muestran bandas muy caractersticas debido al estiramiento y fexin del enlace
N-H, el estiramiento del enlace C=O, y el estiramiento del enlace CN-.
Las dos bandas debidas al estiramiento asimtrico y simtrico del enlace NH de amidas
primarias (RCONH
2
), se encuentran en 3500 y 3400 cm
-1
respectivamente. Amidas
secundarias dan una sola banda cerca de 3500 3400 cm
-1
.
La absorcin del enlace C=O de las amidas se encuentra en la regin 1700-1630 cm
-1
, es
decir a longitudes de onda mas largas que cetonas normales.
Las amidas primarias muestran una banda de absorcin en la regin 1640-1590 cm
-1
debido a la fexin del grupo NH
2
la cual a veces aparece como doblete o multiplete. Para
amidas secundarias esta banda se encuentra en la regin 800-660 cm
-1
debido a la
fexin (wagging) del enlace.
Finalmente las amidas primarias muestran una banda cerca de 1400 cm
-1
debido al
estiramiento del enlace C-N.
Aminas:
Las aminas muestran bandas debido al estiramiento y fexin del enlace N-H y al
estiramiento del enlace C-N. La posicin y la apariencia de estas bandas dependen de la
amina empleada. Para aminas primarias o secundarias se encuentra una banda
dbil en la regin 3500-3300 cm
-1
debido al estiramiento del enlace N-H. Para aminas
primarias esta banda a veces aparece como un doblete. Las aminas terciarias por
no tener un enlace N-H no absorben en esta regin del espectro.
Las aminas primarias dan una banda a 1650-1590 cm
-1
debido a la fexin (scissoring) del
enlace N-H. Para aminas secundarias aromticas esta banda se desplaza a 1515
cm
-1
mientras que para aminas alifticas secundarias esta banda es muy dbil y en
general no se absorbe, aminas terciarias, tampoco presentan esta banda por no tener
un enlace N-H.
Las aminas primarias y secundarias tambin presentan otra banda debido a la
fexin (wagging) del enlace N-H en la regin 910-650 cm
-1
. Esta banda en general es
muy ancha.
El estiramiento del enlace C-N da una banda moderada en la regin de 1240-1020 cm
-1
para aminas primarias, secundarias y terciarias alifticas. Para las aminas
primarias, secundarias y terciarias aromticas esta banda es mucho mas fuerte
y se encuentra en la regin 1250-1350 cm
-1
. Se han asignado las siguientes posiciones a las
bandas debido al estiramiento del enlace C-H de las aminas.
262
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
primaria
1340-1250 cm
-1
secundaria
1350-1280 cm
-1
terciaria 1360-1310 cm
-1
Nitrilos:
El espectro de nitrilos se caracteriza por absorcin en la regin de 2260-2240 cm
-1
para
nitrilos alifticos y 2240-2200 cm
-1
para nitrilos aromticos debido al estiramiento
del enlace C-N.
Haluros de alquilo y de arilo:
La absorcin debida al estiramiento de los enlaces C-Cl., C-Br y C-I alifticos ocurren
en la regin 850-550, 690-575 y 600-500 cm
-1
respectivamente de tal manera que en general
es solamente posible observar la absorcin de compuestos clorinados. Una banda fuerte
debida a la flexin (wagging) del =CH
2
de los grupos CH
2
Cl y CH
2
I se observa
en las regiones 1300-1200cm
-1
, 2125-1150 cm
-1
y 1200-1100
cm
-1
respectivamente, en
compuestos policlorados aparece una banda cerca de 1300 cm
-1
, la cual es un (sobre
tono) de la banda debido al estiramiento del enlace C-Cl.
Compuestos nitro:
Los compuestos nitro aromticos muestran bandas fuertes cerca a 1550-1480 cm
-1
y
1360-1290 cm
-1
debido al estiramiento asimtrico y simtrico respectivamente del grupo NO
2
y un banda moderada cerca de 870 cm
-1
debido al estiramiento del grupo del enlace CN.
Cuadro 6.5 divisin sistemtica de la regin espectral del infrarrojo fundamental
Regin espactral
Enlace que causa la
absorcin
Longitud
de onda
Micrmetros
3750 - 3000
3300 - 2900
3000 - 2700
2400 - 2100
1900 - 1650
1675 - 1500
1475 - 1300
1000 - 650
2.7 - 3.3
3.0 - 3.4
3.3 - 3.7
4.2 - 4.9
5.3 - 6.1
5.9 - 6.2
6.8 - 7.7
10.0 - 15.4
Nmero de onda
u - cm
-1
C C - H, C = C , Ar - H, (C - H
alargamiento)
O - H, N - H, alargamiento
CH
3
-, - CH
2
-, C - H, C - H (C - H
alargamiento)
O
C C, C N, alargamiento
C = O (cidos, aldehdos, cetonas,
amidas, steres, anhdridos)
alargamiento
C = C (aliftico y aromtico)
C = N alargamiento
C - H flexin
C = C ,Ar H flexin (fuera de plano)
H
H
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
263
Frecuencia en cm
-1
Grupos y asignacin
3650 - 3600 Alcoholes, fenoles (diluidos), O - H tensin
3500 - 3300 Aminas primarias (doblete), aminas secundarias
N - H tensin
3500 - 3200 Alcoholes, fenoles (H - enlazados), O - H tensin
3500 - 3100 Amidas N - H tensin
3400 - 2400 cidos caboxlicos, O - H tensin
3300 Alquinos C - H tensin
3150 - 3050 Aromticos C - H tensin
3100 - 3000 Alkenes C - H tensin
3000 - 2850 Alquenos C - H tensin
2900 - 2700 Alcanos C - H tensin
2550 Mercaptanos S - H tensin
2270 - 1950 Alenos, quetanos, isocianatos, isotiocianatos
X = C = Y tensin
2260 - 2240 Nitrilos C N tensin
2250 - 2100 Alquinos C C tensin
1810 y 1760 Anhdridos C = O tensin
1800 Cloruros cidos C = O tensin
1750 - 1730 steres C = O tensin
1740 - 1720 Aldehdos C = O tensin
1725 - 1705 Cetones C = O tensin
1725 - 1705 cidos carboxlicos, C = O tensin
1715 - 1650 Amidas C = O tensin (banda I de amidas)
1690 - 1640 Iminas y oximas C = N tensin
1680 - 1600 Alquenos C = C tensin
1670 - 1640 Amidas C = O tensin (banda II de amidas)
1640 - 1550 Amidas primarias y aminas secundarias N - H flexin
1600 y 1475 Aromticos C = C tensin
1465 Alqueno - CH
2
- flexin
1450 y 1375 Alqueno - CH
3
flexin
1400 - 1000 Fluoruro C - F tensin
1375 - 1300, 1200 - 1140 Sulfones, cloruros de sulfonilos, sulfatos,sulfoamidas
S = O tensin
1350 - 1000 Aminas C = N tensin
1300 - 1000 Alcoholes, steres, teres, - COOH, anhdridos
C = O tensin
1150 y 1350 Nitro (R - NO2) N = O tensin
1050 Sulfxidos S = O tensin
1000 - 650 Alquenos C - H fuera del plano de flexin
900 - 690 Aromticos C - H fuera del plano de flexin
800 - 600 Cloruro C - Cl tensin
<667 Yoduro y bromo C - X tensin
Cuadro 6.6 Frecuencias de diferentes grupos atmicos en orden descendente del
nmero de onda.
264
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Tipo de vibracin Frecuencia (cm
-1
) Intensidad
*
Cuadro 6.7 tabla de correlacin simplificada de vibraciones moleculares por tipo.
* f= fuerte, m= medio, d=dbil
Los espectrofotmetro modernos para espectroscopia IR, traen acoplados una estacin
de datos con programas diseados para asistir al Espectroscopista en la identidad
de espectros IR. El programa es usado para analizar el espectro en trminos de unidades
estructurales en compuestos desconocidos.
Estos anlisis son muy rpidos y producen el tipo de informacin que una persona muy
experimentada podra dar, por referencia se obtienen instantneamente resultados que para
un Espectroscopista representaran aos de experiencia. El programa permite buscar
C - H
C - H
C - C
C = C
C - C
C = C
C - C
O - H
N - H
C - N
C = C
C = N
X = C = Y
N = O
S - H
S = O
C - X
3000 - 2850
1450 y 1375
1465
3100 - 3000
1000 - 650
3150 - 3050
900 - 690
ea. 3300
2900 - 2800
2800 - 2700
1680 -1600
1600 y 1475
no interpretable
2250 - 2100
1725 - 1705
1740 -1720
1725 - 1700
1750 - 1730
1670 - 1640
1810 y 1760
1800
1300 - 1000
3650 - 3600
3500 - 3200
3400 - 2400
3500 - 3100
1640 - 1550
1350 - 1000
1690 - 1640
2260 - 2240
2270 - 1950
1550 - 1350
2550
1050
1375 - 1300 y
1200 - 1140
1400 - 1000
800 - 600
<667
f
d
m-d
m
m
m
m
m
m
m-d
m-d
d
f
f
f
f
f
f
f
f
f
f
f
f
m
m-f
m-f
m-f
m
f
f
f
f
f
f
d-f
d
f
(flexin)
(flexin)
(tensin)
(tensin)
(tensin)
(tensin)
(fuera del plano de flexin)
(fuera del plano de flexin)
Alcanos
-CH
3
-CH
2
-
Alquenos
Aromticos
Alquino
Aldehdos
Alquenos
Alqueno
Aromticos
Alquino
Aldehdo
Cetona
cidos caboxlicos
ster
Amida
Anhdridos
Cloruro cido
Alcoholes,steres,steres cidos caboxlicos,anhdridos
Alcoholes, fenoles
Libre
enlace H
cidos caboxlicos
Aminas y amidas priamrias y secundarias
(tensin)
(tensin)
Aminas
Iminas y oximas
Nitrilos
Alenos, quetanos,isocianatos,isotiocianatos
Nitro (R-NO
2
)
Mercaptanos
Sulfones, cloruros de sulfonidos
Sulfxidos
Sulfatos, sulfoamidas
Fluoruro
Cloruro
Bromuro, ioduro
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
265
en los archivos a velocidades de 120 a 150 o ms espectros por segundo y
produce en la pantalla una lista de los espectros ms semejantes, para una confrmacin
fnal el usuario debe comparar la impresin del espectro del archivo contra el espectro de
la muestra. El espectro de la muestra debe haberse tomado en igualdad de condiciones al
espectro del archivo; para asegurar la identidad del compuesto se deben determinan algunas
propiedades fsicas o qumicas del mismo ya que el solo espectro IR en muchos
casos no es sufciente.
F, fuerte, M, medio; D, dbil; A, agudo
Cuadro 6.8 Frecuencias caractersticas de grupos inorgnicos poliatmicos
300 400 500 600 700 800 900 1000 1100 1200 1300 1400
300 400 500 600 700 800 900 1000 1100 1200 1300 1400
D
D
D
D
D
D
D
D
D
D
D
F
F
F
F
F
F
F
F
F
F
F
F
F
F
F
F F
F
F
F
F
F
F
F
F
F
F
F
F
F
F
F
F
F
F
F
F,A
F,A
F,A
F,A F,A
F A
F
F
F
M M
M
M
M M
M
M
M
M
M
M
M
M
M
M M M
MA
S
S
VS, A
2 A
2 o 3;S,A
cm
-1
BO
2
B
4
O
7
CO
3
HCO
3
SCN
SiO
3
SILICATES
NO
2
NO
3
NH
4
PO
4
HPO
4
H
2
PO
4
SO
3
SO
4
HSO
4
S
2
O
3
S
2
O
4
S
2
O
8
SeO
3
SeO
4
ClO
3
ClO
4
BrO
3
lO
3
VO
3
CrO
4
Cr
2
O
7
MOO
4
WO
4
MnO
4
Fe(CN)
6
4
_
=
=
=
_
=
_
_
+
=
=
_
=
=
_
=
=
_
=
=
_
=
_
_
_
=
_
=
=
=
_
BANDAS AGUDAS DELH
2
O
F
F
F
D
D
M
M
1600 1800 2000 2200 2400 2600 3200 3000 3400
C: HCO
3
CN
OCN
_
_
SCN
_
P: HPO
4
N:NH
4
AGUA DE
CRIST.
=
+
266
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
6.9 Coleccin de espectros analizados
A: Alargamiento C - H (Vase la figura 8).
observe el alargamiento C - H olefnico (B) a 3049 cm
-1
(3.28 mm).
C: Alargamiento C = C, 1645 cm
-1
(6.08 mm). vase la tabla III del apndice C.
D: Flexin C - H fuera de plano: 986 cm
-1
(10.14 mm)
(olefnico) 907 cm
-1
(11.03 mm).
E: Oscilacin metilnica: 720 cm
-1
(13.88 mm).
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
267
A. Alargamiento C - H, 3268 cm
-1
(3.06 mm).
B: Alargamiento C - H normal (vase la figura 8), 2857-2941 cm
-1
(3.4 - 3.5 mm).
C: Alargamiento C C, 2110 cm
-1
(4.74 mm).
D: Sobretono de flexin C - H, 1247 cm
-1
(8.02 mm)
E: Flexin fundamental C - H, <667 cm
-1
(>1.50 mm).
A. Alargamiento C - H aromtico, 3003 cm
-1
B: Alargamiento C - H metlico, 2924 cm
-1
2874 cm
-1
( 3.48 mm).
C: Bandas de sobretono o combinacin, 2000-1667 cm
-1
(5.0 - 6.0 mm) (vase la figura 14).
D: Alargamiento anular C - C, 1610, 1475 cm
-1
(6.21,6.78 mm).
E: Flexin C - H en el plano, 1038 cm
-1
(9.63 mm).
F: Flexin C - H fuera de plano, 837 cm
-1
(11.95 mm).
G: Flexin C - C anular fuera de plano, 687 cm
-1
(14.55 mm).
268
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
A. Alargamiento O - H, hidrgeno enlazado intermolecular, 3333 cm
-1
( 3.0 mm).
B: Alargamiento C - H (vase la figura 8) 2907 cm
-1
( 3.44 mm).
C: Flexin C - H (vase la figura 8), 1460, 1361 cm
-1
(6.85, 735 mm)
D: Alargamiento C - O (vase la tabla II), 1101 cm
-1
(9.08 mm).
E: Oscilacin metilnica (vase la figura 8), 757 cm
-1
(13.21 mm).
A. Alargamiento O - H: enlazamiento de hidrgeno intermolecular, 3300 cm
-1
( 3.03 mm).
B: Alargamiento C - H: aromtico, 2985 cm
-1
( 3.35 mm).
metileno, 2857 cm
-1
( 3.50 mm).
C: Bandas de sobretono o combinacin, 2000-1667 cm
-1
(5.0 - 6.0 mm) (vase la figura 14).
D: Alargamiento anular C - C, 1497, 1453 cm
-1
(6.68,6.88 mm) traslape con vibracin
en tijera CH
2
, ca. 1471 cm
-1
( cerca de 6.8 mm).
E: Flexin C - H en el plano, 1208 cm
-1
(8.28 mm).
F: Alargamiento C - O, alcohol primario, vase la tabla II, 1017 cm
-1
(9.83 mm).
G: Flexin C - H aromtico fuera de plano, 735 cm
-1
(13.60 mm).
H: Flexin C - C anular, 697 cm
-1
(14.35 mm).
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
269
A. Alargamiento O - H, hidrgeno enlazado intermolecular, amplia,3333 cm
-1
( 3.0 mm).
B: Alargamiento C - H aromtico, 3045 cm
-1
( 3.28 mm).
C: Bandas de sobretono o combinacin (vase la figura 14) 2000-1667 cm
-1
(5.0 - 6.0 mm) .
D: Alargamiento C - C anular, 1580, 1495, 1468 cm
-1
(6.33, 6.69, 6.81 mm)
E: Flexin O - H en el plano, 1359 cm
-1
(7.36 mm).
F: Alargamiento C - O, 1223 cm
-1
(8.18 mm).
G: Flexin C - H fuera de plano, 805, 745 cm
-1
(12.40, 13.43 mm).
H: Flexin C - C anular fuera de plano, 685 cm
-1
(14.60 mm).
I: Flexin O - H fuera de plano, hidrgeno enlazado (amplia), ca. 650 cm
-1
(ca.15.0 mm).
A. Alargamiento C - H aromtico, 3060, 3030, 3000 cm
-1
( 3.27, 3.30, 3.33 mm).
B: Alargamiento C - H metlico, 2950, 2835 cm
-1
( 3.39, 3.53 mm).
C: Regin de sobretono o combinacin, 2000-1650 cm
-1
(5.0 - 6.0 mm) (vase la figura 14).
D: Alargamiento anular C - C, 1590, 1480 cm
-1
(6.29, 6.76 mm).
E: Alargamiento C - O - C asimtrico, 1245 cm
-1
(8.03 mm).
F: Alargamiento C - O - C simtrico, 1030 cm
-1
(9.71 mm).
G: Flexin C - H fuera de plano, 800, 740 cm
-1
(12.6, 13.5 mm).
H: Flexin C - C anular fuera de plano, 680 cm
-1
(14.7 mm).
270
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
A. aromtico, 3077, 3040 cm
-1
( 3.25, 3.29 mm) (vase la figura 12)..
B: Aliftico, 2985 , 2941, 2874 cm
-1
( 3.35, 3.40, 3.48 mm) (vase la figura 8 y 12).
C: Alargamiento C - H aldehdico, 2825 , 2717 cm
-1
(3.54, 3.68 mm).
Doblete debido a la resonancia de Fermi con sobretono de banda a F.
D: Alargamiento C - O aldehdico normal, 1730 cm
-1
(5.78 mm). el alargamiento C = O conjugado
estara cerca de 1700 cm
-1
(5.89 mm, por ejemplo en el C
6
H
5
CHO).
E: Alargamiento C - C anular, 1600, 1497, 1453 cm
-1
(6.25, 6.68, 6.88 mm).
F: Flexin C - H aldehdica, 1389 cm
-1
(7.20 mm).
G: Flexin C - H fuera de plano, 749 cm
-1
(13.35 mm).
H: Flexin C - C fuera de plano, 699 cm
-1
(14.30 mm).
* Los incisos A a C son absorciones de alargamiento C-H.
A: n
as
, metilo,2995 cm
-1
( 3.39 mm).
B: n
as
, metileno,2930 cm
-1
( 3.41 mm).
C: n
s
, metilo,2866 cm
-1
( 3.49 mm).
D: Alargamiento C - O normal*, 1725 cm
-1
(5.80 mm) traslape con vibracin.
E: d
as,
CH
3, ca.
1430 cm
-1
(ca. 7.0 mm), vase la tabla I, apndice C.
F: d
s,
CH
2, ca.
1430 cm
-1
(ca. 7.0 mm), vase la tabla II, apndice C.
G: d
s,
CH
3
de la unidad CH
3
CO, 1370 cm
-1
(7.30 mm), vase la tabla I, apndice C.
H: Alargamiento y flexin C-CO-C, 1172 cm
-1
(8.53 mm).
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
271
A. Alargamiento O - H amplio,3300 - 2500 cm
-1
( 3.03 - 4.00 mm).
B: Alargamiento C - H (vase la figura 8), 2950, 2920, 2850 cm
-1
( 3.93, 3.43, 3.51 mm) (so-
brepuesto al alargamiento O - H).
metileno, 2857 cm
-1
( 3.50 mm).
C: Alargamiento C = O carboxlico dimrico, normal, 1715 cm
-1
( 5.83 mm).
E: Alargamiento C - O, * dmero, 1280 cm
-1
(7.81 mm).
F: Flexin O - H fuera de plano, 930 cm
-1
(10.75 mm).
* Las bandas en D y E implican la interaccin C-O-H.
A. Alargamiento C - H y N - H, 3600 - 2500 cm
-1
( 2.78 - 4.00 mm).
B: Alargamiento C (- O)
2
- del anin carboxilato asimtrico, 1600 cm
-1
( 6.25 mm).
C: Alargamiento C - C anular, 1550 cm
-1
( 6.45 mm).
D: Alargamiento C (- O)
2
- del anin carboxilato simtrico, 1385 cm
-1
( 7.22 mm).
272
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
A. Alargamiento C - H aromtico, 3070, 3040 cm
-1
( 3.26, 3.29 mm).
C = O de ster normal ( cerca de 1740 cm
-1,
5.75 mm, una frecuencia mayor que la debida al
alargamiento del
B: Alargamiento C = O, 1770 cm
-1
( 5.65 mm); esta es vase la tabla III), lo cual se origina por
la conjugacin del fenilo con el oxigeno del alcohol; la conjugacin de un grupo arilo u otra
insaturacin con el grupo carbonilo origina que este alargamiento C = O se encuentre a una
frecuencia menor que la normal (por ejemplo, los benzoatos absorben cerca de 1724 cm
-1,
5.80
mm).
C: Alargamiento C - C anular, 1593 cm
-1
(6.28 mm).
D: d
as,
CH
3,
1493 cm
-1
(6.70 mm)*.
E: d
s,
CH
3,
1360 cm
-1
(7.35 mm)*.
F: Alargamiento CC (=O)-O del acetato, 1190 cm
-1
(8.40 mm), menor que la frecuencia de los
steres de acetato normal (cerca de 1240 cm
-1,
8.07 mm) debido a la conjugacin del anillo fenilo.
* Vase la tabla I, apndice C.
A. Alargamiento C - H aromtico, 3080 cm
-1
( 3.25 mm).
B: Alargamiento C = O, 1790 cm
-1
( 5.58 mm), vase la tabla III (la posicin del alargamiento C = O
del cloruro de cido indica muy poca dependencia en cuanto a la conjugacin; los cloruros de
arolo se identifican mediante una banda tal como la C).
C: Banda de resonancia de Fermi ( alargamiento C = O y sobretono de la banda de 875 cm
-1
)
1745 cm
-1
(5.73 mm).
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
273
A. Alargamiento C - H, 2990, 2950, 2880 cm
-1
( 3.34, 3.39, 3.47 mm).
B: Alargamiento acoplado de C - O asimtrico y simtrico, respectivamente: 1825, 1758 cm
-1
(5.48, 5.69 mm), vase la tabla III, pgina 111).
C: d
s,
CH
2
(en tijera), 1465 cm
-1
(6.83 mm), vase la tabla II, apndice C.
D: Alargamiento C-CO-O-CO-C, 1040 cm
-1
( 9.62 mm).
Fuente de informacin: The Matheson Company, Inc, East Rutherford, New Jersey.
A. Alargamiento N - H, acoplado, amida primaria, enlazamiento de hidrgeno.
asimtrico, 3350 cm
-1
( 2.99 mm).
simtrico, 3170 cm
-1
( 3.15 mm).
B: Alargamiento C - H aliftico, 2960 cm
-1
(3.38 mm),
C: Traslape
D: Alargamiento N - H, 1425 cm
-1
( 7.02 mm).
E: Flexin fuera de plano N - H amplia, 700 - 600 cm
-1
(14.28 - 16.67 mm).
Alargamiento C - O, banda de amida I, 1640 cm
-1
(6.10 mm), vase la tabla III.
Flexin N - H, 1640 cm
-1
(6.10 mm), banda amida II. {
274
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
A: Alargamiento N - H, enlazamiento de hidrgeno, doblete acoplado con la amina primaria.
Asimtrico, 3365 cm
-1
( 2.97 mm).
Simtrico, 3290 cm
-1
( 3.04 mm).
Hombro cerca de 3200 cm
-1
cerca de 3.12 mm, banda de resonancia de Fermi con sobretono de
la banda en C).
B: Alargamiento C - H aliftico, 2910, 2850 cm
-1
(3.44, 3.51 mm)n
s
, CH
2
, 2817 cm
-1
( 3.55 mm), vase
la tabla II, apndice C.
C: Flexin N - H (en tijera), 1458 cm
-1
(6.17 mm).
D: d
s,
CH
2
(en tijera), 1458 cm
-1
(6.86 mm), vase la tabla II, apndice C.
E: Alargamiento C - N, 1063 cm
-1
(9.41 mm).
F: Vibracin en abanico N - H (muestra pura), 909 - 665 cm
-1
(11.00 - 15.00 mm).
A: Alargamiento N - H (NH
3
+
) amplio, 3100 - 2000 cm
-1
(3.23 - 5.00 mm), entendido por la banda
de combinacin a 2140 cm
-1
(4.67 mm) yotras bandas de combinacin - sobretono.
B: Alargamiento C - H aliftico (sobrepuesto al alargamiento N - H), 2967 cm
-1
(3.37 mm)
C: Flexin N - H asimtrica (-NH
3
+
), 1610 cm
-1
(6.21 mm).
D: Alargamiento de carboxilato (C - C)
2
, 1580 cm
-1
(6.33 mm).
E: Flexin N - H (-NH
3
+
) simtrica, 1505 cm
-1
(6.65 mm).
F: Alargamiento de carboxilato simtrico (C - O)
2
, 1405 cm
-1
(7.12 mm).
G: Oscilacin N - H (-NH
3
+
) torsional, 525 cm
-1
(19.0 mm).
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
275
A: Alargamiento C - H aromtico, 3070 cm
-1
, 3025 cm
-1
(3.26 - 3.31 mm).
B: Alargamiento C - H aliftico, 2910, 2860 cm
-1
(3.44, 3.50 mm)
C: Alargamiento C H, 2210 cm
-1
(4.53 mm) (se intensifica por la conjugacin arilo); los nitrilos
alifticos absorben a una frecuencia mayor (longitud de onda menor).
A: Alargamiento C - H aromtico, 3100, 3080 cm
-1
(3.23 - 3.25 mm).
B: Alargamiento N - O (ArNO
2
) asimtrico, 1520 cm
-1
(6.58 mm).
C: Alargamiento N - O (ArNO
2
) simtrico, 1345 cm
-1
(7.44 mm)
D: Las frecuencias bajas (longitudes de onda superiores) sonde poca utilidad para determinar
la naturaleza de la sustitucin en el anillo ya que estos modelos de absorcin se deben
a las frecuencias de flexin fuera del plano de interaccin del NO
2
y C - H.
276
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
A: Alargamiento C - H aromtico, 3085, 3060, 3030 cm
-1
(3.24, 3.27, 3.30 mm).
B: Alargamiento C- H aliftico, 2930 cm
-1
(3.41 mm).
C: Alargamiento S - H moderadamente dbil, 2565 cm
-1
(3.90 mm)
D: Modelo de banda de combinacin o sobretono indicativo de aromtico monosustituido
(Vase la figura 14), 2000 - 1667 cm
-1
(5.0, 6.0 mm).
E: Alargamiento anular C - C, 1600, 1495, 1455 cm
-1
(6.25, 6.69, 6.87 mm).
A: Alargamiento S(=O)
2
asimtrico, 1351 cm
-1
(7.40 mm).
B: largamiento S(=O)
2
simtrico, 1176 cm
-1
(8.50 mm).
C: largamiento S-O-C intenso diverso, 1000 - 769 cm
-1
(10.0 - 13.0 mm).
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
277
6.10 Espectros de referencia
A: Alargamiento C - H aromtico, 3080, 3010 cm
-1
(3.25, 3.32 mm).
B: Alargamiento anular C- C, C - N (bandas esquelticas), 1600 - 1430 cm
-1
(6.25 - 7.00 mm).
C: Flexin C - H fuera de plano, 748, 703 cm
-1
(13.37, 14.22 mm). Vase la tabla VI, apndice D,
para los modelos en la regin C de las piridinas sustituidas.
278
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
279
280
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
281
282
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
283
284
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
285
286
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
287
No. Espectro Compuesto No. Espectro Compuesto
1 Hexano 15 Metanol
2 Nujol 16 Etanol
3 Ciclohexano 17 Acetona
4 Benceno 18 2-Butanona
5 Tolueno 19 Ciclohexanona
6 m-Xileno 20 Acetato de etilo
7 Poliestireno 21 Acido ftlico, ster dietlico
8 Indeno 22 ter etlico
9 Cloroformo 23 P- Dioxano
10 Tetracloruro de carbono 24 ter de Petrleo
11 1,2 Dicloroetano 25 Disulfuro de Carbono
12 Tricloroetileno 26 Sulfxido de metilo
13 Tetracloroetileno 27 Lubricante de silicona
14 Fluorolube 28 N,N, Dimetilformamida
Cuadro 6.9 Lista de los Espectros de referencia
6.4.2 Anlisis Cuantitativo
La determinacin cuantitativa de compuestos por absorcin infrarroja se basa en la
determinacin de la concentracin de uno de los grupos funcionales del compuesto que
se investiga. Por ejemplo, si se trata de analizar una mezcla de hexano y hexanol,
la proporcin de este ltimo puede obtenerse midiendo la absorcin de la banda OH o,
mejor, la del grupo C-OH del alcohol. Con este dato puede calcularse la concentracin
de alcohol. Siempre que sea posible se utilizar la misma banda con fnes de medida, ya
que de esta forma, se reducen interferencias y se elimina el problema de superposicin de
bandas. Los clculos fnales estn basados en la ley de Beer.
P
P
T
1
= ,
I
I
T
1
=
T
Log A
1
= LogT A =
I
I
Log A
1
=
1
I
I
Log A =
y donde cia transmi T tan =
= I Intensidad de la radiacin antes de incidir sobre la muestra.
=
1
I Intensidad de la radiacin despus de atravesar la muestra.
= P Potencia de la radiacin antes de incidir sobre la muestra.
=
1
P Potencia de la radiacin despus de atravesar la muestra.
288
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
1
I
I
Log bc A = = e
,A =
bc: =
= Absortividad molar, b = Espesor de la celda en cm y
c = Concentracin de la solucin en moles por litro.
Si se utiliza siempre la misma celda, b, es constante y , que es una propiedad de la especie
molecular que se determina, puede considerarse tambin constante. Por tanto, A ser
proporcional a C.
Los equipos registran directamente A. La constante de proporcionalidad entre A y c () se
obtiene de curvas de calibracin, que se construyen con datos de absorbancia de soluciones
de concentracin conocida de la sustancia pura. Para llevar a cabo el anlisis cuantitativo, se
realizan los siguientes pasos:
1. Se selecciona un solvente adecuado.
2. Se toman los espectros del solvente y de la muestra por separado.
3. En el espectro de la muestra se selecciona un mximo de absorcin libre de
interferencias por bandas del solvente.
4. Se determina el rango de concentracin de los patrones.
5. Se mide la absorbancia de los patrones y la muestra aplicando el mtodo de la lnea
base, sino es posible ajustar con el solvente el 100% de transmitancia o el cero
de absorbancia observar
Este mtodo consiste en dibujar una lnea arbitrariamente escogida para representar
la lnea base de la banda de absorcin. Se supone que la transmitancia del solvente
es constante o por lo menos cambia linealmente entre los hombros del pico de
absorcin. La absorbancia se calcula con la expresin:
p
p
Log A
0
=
Como se ilustra
en la grfca 6.14.
A =
bc = log
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
289
Figura 6.14 ilustracin de La lnea base
6. Con los datos obtenidos se construye la curva de calibracin.
7. Mediante interpolacin se determina la concentracin de la muestra y se multiplica
por el factor de dilucin o concentracin si lo hubiere.
Los anlisis cuantitativos realizados con la tcnica de absorcin infrarroja no son tan
fciles de llevar a cabo, ni tan seguros, como los que se obtienen por absorcin ultravioleta.
Las celdas utilizadas en la regin IR son de cloruro sdico, bromuro potsico o
alguna otra sal de haluros de los elementos alcalinos. Estos materiales son muy blandos y
se deforman con facilidad; por ello, el espesor de la muestra puede variar de una medida a
otra. Adems, la superfcie se encuentra expuesta a un ataque qumico por el disolvente,
especialmente si hay trazas de agua o sustancias similares, que producen una prdida
de transparencia y hacen necesario un nuevo pulido. En consecuencia es difcil mantener
una celda constante y, por tanto, el espesor de muestra. Puesto que el anlisis cuantitativo se
fundamenta en la expresin A = bc, siendo b el espesor de la muestra (espesor interno de
la celda), cualquier error en su medida provoca un error en el clculo de c (concentracin) a
partir de A. En la prctica, estos problemas hacen difcil mantener una relacin segura entre
la curva de calibracin y la concentracin de la muestra.
Los inconvenientes y limitaciones de los mtodos cuantitativos por espectroscopia infrarroja
se manifestan en las frecuentes desviaciones de la ley de Beer y en la complejidad que
presentan los espectros lo cual aumenta la probabilidad de traslapo de los mximos de
absorcin. La estrechez de los picos y los efectos de las radiaciones extraas infuyen en la
medicin de la absorbancia lo cual hace necesario controlar el ancho de la rendija y el
ajuste de la longitud de onda.
Longitud de onda
T
r
a
n
s
m
i
t
a
n
c
i
a
,
p
o
r
c
e
n
t
a
j
e
100
50
0
A = log = log
T
T1
T
P
T1
P
1
290
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
El desarrollo de programas computarizados para el anlisis cuantitativos y el diseo de la
nueva instrumentacin han permitido corregir la mayora de inconvenientes presentados en
la aplicacin cuantitativa de esta tcnica hacindola ms fcil y confable.
Para la realizacin de anlisis cuantitativo los equipos FTIR (Espectrofotmetros Infrarrojo
con Transformada de Fourier) presentan las siguientes ventajas:
1. Espectros libres de ruido.
2. Linealizacin de la lnea base y facilidad de calibracin.
3. Mayor rango de barrido.
4. Mayor resolucin espectral.
5. Mayor exactitud fotomtrica.
6. Mayor rapidez.
7. Reproducibilidad en la posicin de la frecuencia.
8. Integracin de bandas.
9. Derivacin de espectros.
10. Software para cualifcar, cuantifcar, almacenar, enviar y presentar la informacin.
6.4.3 Limitaciones Analticas
La espectroscopia IR no puede utilizarse (excepto bajo ciertas circunstancias especiales) para
la determinacin de pesos moleculares. Tampoco es posible, en general, obtener informacin
sobre la posicin relativa de los distintos grupos funcionales de una molcula. Otra limitacin
de la tcnica IR se debe a la imposibilidad de diferenciar, con el solo espectro un compuesto
puro de una mezcla.
As por ejemplo, una mezcla de parafnas y alcoholes dar el mismo espectro que un alcohol
de peso molecular ms elevado. Sin embargo, conviene destacar que si se dispone de datos
previos sobre los componentes de la muestra y sus espectros, es posible realizar anlisis de
mezclas. En este sentido hay que indicar que diariamente se llevan a cabo gran cantidad de
anlisis cualitativos y cuantitativos, siendo esta tcnica, actualmente, uno de los mtodos
ms valiosos para la caracterizacin, no solo de sustancias puras, sino tambin de mezclas
de compuestos que aparecen en la investigacin y en la industria.
La mayora de las aplicaciones analticas estn relacionadas con la identifcacin y
determinacin de sustancias orgnicas. Su gran divulgacin se debe al hecho de que
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
291
pueden identifcarse grupos funcionales tales como cidos carboxlicos y cetonas. A partir
de esta informacin es posible obtener la composicin y estructura de compuestos nuevos y
desconocidos.
Anlisis tpicos son la deteccin o determinacin de parafnas, compuestos aromticos,
olefnas, acetilenos, alcoholes, aldehdos cetonas, cidos carboxlicos, fenoles, teres,
esteres, aminas, compuestos de azufre o haluros.
A partir del espectro IR, es posible determinar los componentes responsables del olor y
sabor de los alimentos, distinguir un polmero de otro, determinar la composicin de mezclas
de polmeros o el disolvente utilizado en pinturas. Pueden detectarse tambin los compuestos
nocivos que contaminan la atmsfera. Otra aplicacin interesante es el examen de materiales
y pinturas antiguas. As por ejemplo, a partir de la identifcacin del barniz utilizado en un
cuadro, de las telas y pigmentos de las pinturas, se pueden descubrir falsifcaciones de obras
de arte.
Con frecuencia, las pinturas y barnices y muchos otros compuestos se determinan por anlisis
de reflectancia, un proceso en el cual la muestra se irradia con luz IR y la luz refejada
se introduce en un instrumento IR. La pintura, u otra superfcie que refeje, absorbe radiacin
de la misma forma que lo hace una solucin transparente y, en consecuencia, se obtendr
su espectro IR.
Esta tcnica puede utilizarse para identifcar la pintura de herramientas o automviles que
pudieran estar implicados en accidentes siendo posible determinar caractersticas y hasta el
modelo del vehculo.
La espectroscopia IR ofrece a la industria algunas posibilidades interesantes. Puede
emplearse para determinar impurezas de materias primas, lo cual es necesario para asegurar
buenos productos. Puede utilizarse, tambin, para control de calidad (es decir, para anlisis
continuos de composicin de los productos). Esta es la forma ms barata de obtencin de
productos de garanta. Una tercera aplicacin es la identifcacin de sustancias obtenidas
en los propios laboratorios. Por ejemplo, la espectroscopia IR puede identifcar un embalaje
transparente en el que est interesado un fabricante indicando que se trata de polietileno,
poliestireno o polipropileno.
La espectroscopia IR, permite, as mismo, identifcar cera para pisos y muebles. Es
posible distinguir entre cera de abejas, cera carnauba y diferentes ceras para pisos y usos
industriales.
Adems, el fabricante puede conocer si la cera de abejas est mezclada con cera de petrleo,
que es ms barata.
En resumen, las aplicaciones de la espectroscopia IR. son muy variadas y cada vez ms
numerosas.
292
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Se han diseado instrumentos Infrarrojos para las diferentes regiones (IR cercano, IR
fundamental, IR lejano), con aplicaciones especfcas para el control de calidad, control de
procesos, control de contaminantes ambientales, anlisis clnico, medicina forense y mltiples
aplicaciones ms.
Instrumentos a los cuales se les ha aplicado los ltimos avances en tecnologa para hacer los
anlisis rpidos, seguros, confables y reproducibles; para cumplir los requisitos requeridos
por las normas nacionales e internacionales para su certifcacin.
6.4.4 Manipulacin y tratamiento de las muestras
La instrumentacin de infrarrojo ha alcanzado un notable grado de estandarizacin, tanto que
el compartimiento de la muestra de varios espectrmetros tiene que ver con esto. Sin embargo,
lo que es la manipulacin directa de la muestra presenta varios problemas en la regin del
infrarrojo. No hay un material de ventana que sea al mismo tiempo fuerte, transparente e
inerte para esta regin. Los haluros alcalinos son ampliamente utilizados, particularmente
el cloruro de sodio, que es transparente hasta una longitud de onda de 625 cm
-1
(16.00
m), las ventanas de las celdas se empaan fcilmente por su exposicin a la humedad y
requieren un pulimento constante. A veces se usa el cloruro de plata para muestras hmedas
o soluciones acuosas, pero es suave, fcilmente deformable y se oscurece bajo exposicin a
la luz visible. El tefn slo tiene bandas de absorcin C-C y C-F. Para frecuencias menores
que 600 cm
-1
es til la celda de polietileno. Materiales con alto ndice de refraccin producen
franjas de interferencia fuertes y persistentes.
6.4.4.1 Gases
En el anlisis de gases, la longitud de trayectoria usual es de 10 cm; cuando sta es demasiado
pequea para medir el espectro de los componentes minoritarios o de sustancias que se
encuentran en el anlisis de trazas, una celda de trayectoria variable proporciona longitudes
de paso en etapas de 1.5 m para celda de 20, 40 y 120 m. La trayectoria es doblada por
medio de espejeos internos de superfcie dorada y componentes metlicos de oro blanco o
de acero inoxidable; se puede aumentar la sensibilidad aumentando la presin de la muestra
gaseosa dentro de la celda hasta 10 atm, sin embargo, el ensanchamiento por presin de las
bandas de absorcin trae problemas en el trabajo cuantitativo. Celdas de gases de trayectoria
larga se han propuesto para las mediciones en el intervalo de unas cuantas partes por milln
o menos, intervalos de concentracin que se encuentran en los problemas de contaminacin
atmosfrica, muestreo del aire, instrumentacin de procesos y determinacin de pureza.
Cuando se trabaja en una regin espectral en donde hay absorcin por agua o por dixido de
carbono es deseable contar con sistema de celda dual para poder compensar.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
293
6.4.4.2 Lquidos y soluciones
Las muestras que son lquidas a temperatura ambiente generalmente se analizan en su
forma pura o en solucin. La concentracin de la muestra y la longitud de la trayectoria
se escogen para que la transmitancia caiga entre 15% y 70%. Para lquidos puros esto
representa una capa muy delgada, aproximadamente de 0.001-0.05 mm de espesor. En
el caso de soluciones, concentraciones de 10% y longitudes de celda de 0.1 mm son las
ms prcticas. Desafortunadamente no todas las sustancias son solubles a concentraciones
razonables en un solvente que no absorba en las regiones de inters. Cuando es posible,
se obtiene el espectro de una solucin al 10% en CCl
4
en una celda de 0.1 mm en la regin
de 4000-1333 cm
-1
(2.50-7.50m) y de una solucin al 10% en CS
2
en la regin de 1333-
650 cm
1
(7.50-15.38m). Las regiones transparentes de los solventes seleccionados se
muestran en grfcas elaboradas para este fn.
Para obtener el espectro de materiales polares que son insolubles en CCl
4
o en CS
2
pueden
usarse solventes tales como cloroformo, cloruro de metileno, acetonitrilo y acetona.
Se aumenta la sensibilidad yendo a longitudes de trayectoria ms larga si puede encontrarse
un solvente muy transparente.
En un espectrmetro de doble haz una celda de referencia con igual longitud de trayectoria
que la celda de la muestra se llena con solvente puro y se coloca en el haz de referencia; la
absorcin moderada del solvente, ahora comn a ambos rayos, no se observa en el espectro
registrado. Sin embargo, la transmitancia del solvente nunca debe ser menor del 10%.
La posible infuencia del solvente en el espectro de un soluto no debe ser subestimado. Debe
darse particular atencin a la seleccin del solvente para compuestos que son susceptibles
a los efectos de enlace de hidrgeno. Los puentes de hidrgeno a travs de los grupos
OH o NH alteran las frecuencias vibracionales caractersticas de esos grupos, mientras
ms fuerte es el enlace de hidrgeno la frecuencia fundamental se ve ms disminuida. Para
discriminar un enlace de hidrgeno intermolecular de uno intramolecular debe obtenerse
varios espectros a diferentes diluciones, pero con el mismo nmero de molculas absorbentes
en el rayo; si al aumentar la dilucin la banda de absorcin del enlace de hidrgeno disminuye
mientras que las bandas de absorcin de los grupos no enlazados aumentan, el enlace es
intermolecular. El enlace intramolecular no muestra un efecto de dilucin comparable.
Las celdas de infrarrojo para soluciones se construyen con ventanas selladas y separadas por
delgados empaques de tefn o de cobre o de plomo que han sido sumergidos en mercurio. El
arreglo en su conjunto es armado, asegurado y montado permanentemente en un contenedor
de acero inoxidable. Si se usan plomo o cobre y ya que el mercurio penetra estos metales, el
empaque se expande para producir un sellado frme. Las celdas tambin tienen accesorios
cnicos para aceptar las agujas de jeringas hipodrmicas y poder ser llenadas. Cada celda
se marca con su longitud de trayectoria precisa, medida por franjas de interferencia. Una
294
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
celda no ensamblada (desmontable) consta de dos ventanas y un accesorio de tefn (que
tambin permite el llenado con jeringa); el tefn forma un sello a prueba de fugas cuando la
celda se desliza dentro de una montura que se atornilla a mano.
Las celdas de fujo continuo se utilizan para el anlisis continuo de lquidos; su exactitud
cuantitativa es mayor en el muestreo repetitivo y se facilita la manipulacin de las muestras.
El acoplamiento de un instrumento de infrarrojo con un cromatgrafo por medio de una micro
celda de fujo continuo hace posible analizar el efuente de la columna en base a los grupos
funcionales.
La celda de longitud de trayecto (o trayectoria) variable consiste en una cmara cilndrica de
acero inoxidable forrada con tefn y con ventanas paralelas. La longitud de paso es ajustable
con forma continua, de 0.005 a 5 mm, y es reproducible dentro de 0.001 mm; un vernier y
una escala puesta en el cilindro permiten que el espesor de la celda pueda leerse con ms o
menos 0.0005 mm. La exactitud de los ajustes de espesor es ms o menos 0.001 mm o 1%,
cualquiera que sea mayor.
Esta celda de trayecto variable sirve para dos propsitos muy tiles en el laboratorio de
infrarrojo. El primero de ellos es la compensacin del solvente y el anlisis diferencial. Cuando
la celda se llena con un solvente y se coloca en el haz de referencia del espectrmetro, su
longitud de trayectoria puede ajustarse para compensar la absorcin indeseable del solvente
en el rayo de la muestra. En el anlisis diferencial se examinan dos lquidos que slo diferen
muy poco en la concentracin de un componente minoritario, un ajuste cuidadoso de la celda
variable aumenta el espectro del componente minoritario en la celda de trayectoria fja del haz
que atraviesa la muestra.
La segunda aplicacin usa la celda de longitud de trayectoria variable en el haz de la muestra.
Para que las bandas de absorcin dbiles de muchos lquidos, aparezcan con la intensidad
apropiada, las bandas fuertes deben ser totalmente absorbidas y su localizacin debe ser
oscurecida; en esos casos, la celda de longitud de trayectoria variable se ajusta con precisin
para proporcionar justamente la intensidad correcta para la exacta localizacin tanto de
las bandas dbiles como de las fuertes. La celda de longitud de trayecto variable elimina
la necesidad de una gran coleccin de celdas de longitud de trayectoria fja de diferentes
espesores.
La minicelda es una aproximacin econmica para obtener espectros de infrarrojo cualitativos
de lquidos. Consta de un cuerpo plstico de dos piezas con rosca y dos ventanas de disco
para celda de cloruro de plata, diseo especial. Las ventanas se ajustan en alguna parte de
la celda; la segunda parte de la celda es entonces atornillada para sellarla. Cada una de las
ventanas de AgCl de la celda presenta un espesor de 0.025 mm (Tambin se puede conseguir
ventanas con espesor de 0.100 mm). El canto de la ventana es plano y la circunferencia est
biselada para asegurar un sellado adecuado; Ya que bajo presin el AgCl fuye ligeramente,
se obtiene un sellado frme. La depresin circular en cada ventana permite que la trayectoria
de la celda pueda variarse; las ventanas pueden ser 1) colocadas espalda con espalda para
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
295
una uncin convencional, 2) arregladas de modo que la parte posterior de una ventana est
frente a la depresin circular de la otra para que una longitud de trayectoria de 0.025 mm, o
3) colocadas con las depresiones circulares frente a frente para una longitud de trayectoria
de 0.050 mm.
6.4.4.3 Pelculas
Los espectros de lquidos no solubles en un solvente adecuado se obtienen mejor de
pelculas capilares. Una gran gota de lquido puro se coloca entre dos ventanas transmisoras
de infrarrojo unidas fuertemente y montadas en el espectrmetro de un portador adecuado.
Las placas no necesitan estar muy pulidas pero deben ser planas para evitar distorsionar
el espectro. Para polmeros, resinas y slidos amorfos, la muestra se disuelve en cualquier
solvente voltil til, la solucin se esparce sobre una placa de roca de sal y el solvente
se evapora por calentamiento suave. Si el slido no es cristalino, una pelcula delgada
homognea se deposita en la placa, la cual puede ser montada y estudiada directamente. A
veces los polmeros pueden ser prensados en caliente sobre placas.
6.4.4.4 Emulsiones
Polvos o slidos reducidos a partculas pequeas pueden estudiarse como una pasta delgada
o emulsin. Una pequea cantidad de la muestra es molida por completo en un mortero limpio
hasta tener un polvo muy fno. Despus de la molienda, el agente emulsifcante se introduce
en pequea cantidad, la sufciente para capturar el polvo. La mezcla resultante se aproxima
a la consistencia de una crema dental. La mezcla se transfere entonces a las placas de
emulsin y las placas son unidades fuertemente para ajustar el espesor de la muestra; ste
se ajusta para que las bandas ms intensas den entre 60% y 80% de absorcin.
Las refexiones y refracciones mltiples de las partculas se reducen moliendo las partculas
hasta un tamao igual a un orden de magnitud menor que la longitud de onda analtica y
rodeando las partculas con un medio cuyo ndice de refraccin sea casi el mismo. Los medios
lquidos incluyen el aceite mineral o el Nujol, el hexaclorobutadieno, el perfuorokeroseno y
las grasas de clorofuorocarbono (fuorolube). Estos ltimos se usan cuando la absorcin por
un aceite mineral enmascara la presencia de las bandas de C-H. Para el anlisis cualitativo
la tcnica de emulsin es rpida y conveniente, pero los datos cuantitativos son difciles de
obtener, aun cuando se incorpore un estndar interno a la emulsin. Cambios polimrfcos,
degradacin y otros cambios pueden ocurrir durante la molienda.
6.4.4.5 Tcnica de la Pastilla
La tcnica de pastillaje implica mezclar la muestra fnamente molida (1-100g) con polvo de
bromuro de potasio y comprimir la mezcla en un dado, a sufciente presin (6000-100000
psi o lb/pulg
2
) para producir un disco transparente. El bromuro de potasio se vuelve muy
296
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
plstico a altas presiones y fuye hasta formar un disco claro. La molienda y el mezclado se
hacen convenientemente en un molino de bolas vibratorio. Otros haluros alcalinos tambin
se usan, en particular el CsI o el CsBr, para mediciones a las longitudes de onda ms largas.
Una buena dispersin de la mezcla en la matriz es un paso crtico. No debe haber humedad.
Congelar y secar la muestra es a menudo un paso preliminar necesario.
Obleas de KBr pueden formarse, sin evacuaciones, en una miniprensa. Dando vuelta a dos
tornillos muy pulidos, el uno contra el otro, dentro de un fuerte cilindro de acero inoxidable se
produce una oblea clara del KBr colocada entre ellos. La presin se aplica con llaves durante
1 min. Aproximadamente, a 75-100 mg de polvo. Algunas sustancias pueden descomponerse
o cambiar de forma bajo el calor o la presin de la formacin de la pastilla.
Por la tcnica de pastillaje y usando un estndar interno, pueden realizarse anlisis
cuantitativos con rapidez, ya que puede hacerse una medicin exacta de la relacin del peso
de la muestra al del estndar interno en cada disco u oblea.
6.4.4.6 Espesor de la Celda
Uno de los dos mtodos se usa para medir la longitud de la trayectoria de las celdas de
absorcin en el infrarrojo: el de franjas de interferencia o el del absorbedor estndar. El
mtodo de franjas de interferencias es ideal para celdas cuyas ventanas tienen un elevado
pulimento; con la celda vaca en el espectrmetro, en el lado de la muestra y sin celda en el
haz de referencia, el espectrmetro se hace operar tan cerca como sea posible de la lnea
de 100%.
Entonces se corre el espectro para producir de 20 a 50 franjas. El espesor b de la celda, en
centmetros, se calcula con la ecuacin.
B = 1/2n(m/v
1
-
2
)
en donde m es el nmero de franjas (picos o depresiones) entre dos nmeros de onda
1
y
2
y n es el ndice de refraccin del material de la muestra. Si las mediciones se hacen en
longitud de onda (micrmetros), la ecuacin es
B = 1/2n (ml
1
l
2
/ l
2
- l
1
)
en donde l
1
es la longitud de onda inicial y
2
es la longitud de onda fnal entre las que se
cuentan las franjas. El mtodo de las franjas tambin funciona bien para la medicin del
espesor de las pelculas.
El mtodo del absorbedor estndar puede usarse con una sola celda para cualesquiera
condiciones y para celdas de cavidad (miniceldas) cuyas caras internas no tiene un pulido fno,
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
297
la banda de los 1960 cm
-1
(5.10m) del benceno puede usarse para calibrar las celdas con
longitud de trayectoria menor de 0.1 mm, y la banda de los 845 cm
-1
(11.83 m) para celdas
con longitudes de trayectoria de 0.1 mm o mayores. A la primera frecuencia, el benceno tiene
una absorbancia de 0.10 por cada 0.01 mm de espesor; a los 845 cm
-1
, el benceno tiene una
absorbancia de 0.24 por cada 0.01 mm de espesor.
6.4.4.7 Reflectancia Interna
La versatilidad y el alcance de la espectrometra de infrarrojo como herramienta del anlisis
cualitativo se ha aumentado sustancialmente por la tcnica de la refectancia interna (tambin
conocida como refectancia total atenuada, ATR). Cuando un haz de radiacin entra en una
placa (o prisma) rodeada por o sumergida en una muestra, se refeja internamente si el
ngulo de incidencia en la intercara entre la muestra y la placa es mayor que el ngulo
crtico (que es una funcin del ndice de refraccin). En la refexin interna toda la energa es
refejada; sin embargo, el haz parece penetrar ligeramente ms all de la superfcie refectora
y luego regresar. La profundidad de la penetracin es de aproximadamente una longitud de
onda y est dada por
d
p
= l
1
/ 2p(Sen
2
- n
2
sp
)
1/2
en donde d
p
es la profundidad de la penetracin, en unidades de longitud de onda,
1
es
la longitud de onda de la radiacin en el prisma (i.e.,
1
= /n es el ndice de refraccin
del material del prisma), n
sp
= n
s
/n
p
, en donde n
s
es el ndice de refraccin de la muestra
y es el ngulo de incidencia del haz. El ngulo debe ser mayor que el ngulo crtico,
c
para que ocurra la refexin total, aunque debe ser fnalmente unos 0.2 grados mayor que el
ngulo crtico calculado porque el ndice de refraccin de una sustancia sufre un marcado
cambio en la vecindad de una banda de absorcin. El ngulo crtico,
c
est dado por
c
= Sen
-1
(n
2
/n
1
) en donde n
1
y n
2
son los ndices de refraccin de los materiales de
la muestra y del prisma, respectivamente.
Cuando un material se pone en contacto con una superfcie refectora, el haz pierde energa
a las longitudes de onda en que el material absorbe, ya que hay una interaccin con el
haz penetrante; esta radiacin atenuada constituye un espectro de absorcin caracterstico
del material y, cuando se mide y se grafca en funcin de la longitud de onda, es similar
al espectro de infrarrojo obtenido en el modo de transmisin normal. La refexin interna
simplifca el muestreo en el infrarrojo y abre nuevas reas de investigacin prctica. Al usar
esta tcnica los espectros de absorcin cualitativos del infrarrojo se obtienen ms fcilmente
para la mayora de los materiales slidos, sin necesidad de molerlos, disolverlos o hacer una
emulsin con ellos.
La mayora del trabajo de refectancia interna se hace mediante un accesorio que se inserta
y se retira rpidamente en el espacio de la muestra de un espectrmetro convencional del
infrarrojo. El accesorio consiste en un sistema de espejos que manda la radiacin de la
298
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
fuente hacia el accesorio y de un segundo sistema de espejos que dirigen la radiacin hacia
el monocromador. Los espejos son por una sola cara, de aluminio, y cabe en ellos el ancho
total del haz del instrumento. Los portamuestras se montan en cualquiera de tres posiciones
para cambiar el ngulo externo; las tres posiciones estndar son 30, 45 y 60. La relacin
longitud-espesor de la placa determina el nmero de refexiones, despus de que el ngulo
de incidencia ha sido seleccionado. Las dimensiones de la placa varan desde 0.25 hasta
5 mm en espesor y de 1 a 10 cm en longitud. Veinticinco refexiones internas es un valor
estndar para una placa de 2 mm. El paralelismo y la planaridad de las superfcies de la
muestra y el pulimento de la superfcie son aspectos crticos. Cuando se requiere el ptimo
de funcionamiento, es deseable haber igualado las unidades pticas en ambos haces del
monocromador; de esta forma se obtiene una curva de P
o
mucho ms plana, ya que se
cancelan absorciones como las de las placas refectoras y de los anillos 0 de tefn en las
celdas para lquidos, y hay una interferencia mnima de absorcin atmosfrica.
En la placa de un solo paso se introduce la radiacin a travs de una apertura de entrada que
consiste en un simple bisel en uno de los extremos de la placa y, despus de la propagacin-
va mltiples refexiones internas que se extienden por toda la longitud de la placa, sale por
una apertura de salida, paralelo o perpendicular a la apertura de entrada. El ngulo de bisel
determina el ngulo de incidencia interior. Este tipo de placa es til para materiales compactos,
capas delgadas y estudios de superfcie. En la placa de doble trayectoria, la radiacin entra
como en la otra, se propaga por toda la longitud de la placa, se refeja totalmente en el
extremo opuesto por una superfcie perpendicular a la longitud de la placa y regresa, para
dejar la placa por una apertura de salida que se encuentra en el mismo extremo que la
apertura de entrada. El extremo libre de la placa puede ser sumergido en lquidos o en polvos,
o puede colocarse en sistemas cerrados.
La profundidad aparente a la cual la radiacin penetra la muestra es de slo unos cuantos
micrmetros y es independiente del espesor de la muestra. Como una consecuencia,
los espectros ATR pueden obtenerse para muchas muestras que no pueden estudiarse
normalmente con los mtodos de transmisin normales.
Entre stas se hallan muestras con absorcin muy fuerte, que se resisten a la preparacin
de capas delgadas, que slo son caractersticas como capas gruesas, o que son accesibles
slo con soportes no transparentes. Las soluciones acuosas pueden manipularse sin
compensacin, con absorciones de solventes muy fuertes. Muestras que contienen materia
suspendida, tales como slidos dispersos o emulsiones que producen fondos grandes en los
espectros de transmisin, dan mejores resultados por refectancia interna mltiple. Es posible
escoger de entre una variedad de portamuestras. Algunas muestras se auto adhieren a la placa
del refector. En otros casos se necesita aplicar presin para poner la muestra en contacto con
la placa. Los lquidos se analizan usando una placa refectora de germanio que tiene tanto la
baja solubilidad requerida como una corta longitud de trayectoria. El portamuestras calentado
es un portamuestras slido modifcado equipado con dos calentadores de oblea operan a 250
grados
o
C para poder estudiar los efectos trmicos in situ, o como medio de suavizacin por
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
299
calor de varias muestras plsticas para mejorar el contacto ptico.
Tambin puede usarse una celda circle, que es un cilindro largo con bordes cnicos. Una
celda de ese tipo es muy adecuada para los instrumentos de FTIR porque se da un buen
acoplamiento entre el rayo circular del FTIR y la forma de la celda. La celda circle es
especialmente til para celdas de poco volumen o de fujo continuo.
La apariencia e intensidad del espectro de refectancia depende de la diferencia de los ndices
de refraccin entre la placa refectora y el medio enrarecido que contiene al absorbedor, y
del ngulo de incidencia interno. Entonces debe usarse una placa refectora con un ndice de
refraccin relativamente alto. El material que funciona ms satisfactoriamente para muchos
lquidos y muestras slidas es el krs-5, yoduro de bromo de talio Su ndice de refraccin
es alto, por lo que permite espectros bien defnidos de casi todos los materiales orgnicos,
aunque es soluble en soluciones bsicas. Al AgCl se recomienda para soluciones acuosas,
dada su solubilidad y su ndice de refraccin, ms bajo; tambin puede usarse el germanio,
pero es quebradizo. El seleniuro de zinc (Irtran IV) se ha utilizado pero tambin es quebradizo
y libera H
2
Se en soluciones cidas. Variando el ngulo de la radiacin incidente de 30 a
60 puede cambiarse la profundidad de penetracin de la energa dentro de la muestra.
Una unidad comercial cuenta con un montaje de tijera unido a los cuatro espejos y a las
plataformas de la muestra en un sistema de tipo pantgrafo.
Para grandes inclinaciones (cerca de 30) la profundidad de penetracin en la muestra es
considerablemente mayor (hasta en un orden de magnitud ms grande) que para pequeas
inclinaciones, cerca de los 60. Variar el ngulo de incidencia y, en consecuencia, la
profundidad de penetracin de la radiacin, es de gran inters en el estudio de superfcies.
Mucho se puede aprender sobre la superfcie de una pelcula o de un plstico en el que se
piensa que los aditivos qumicos migran hacia la superfcie, o cuando la superfcie se ha
expuesto a un intemperismo artifcial.
300
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Taller 6.5
15
2
Interpretacin de los espectros infrarrojos
El presente taller es una ayuda estructurada en instruccin programada, para iniciar
al estudiante en la adquisicin de la habilidad en la interpretacin de espectros IR.
Un conjunto de preguntas lgicas contestadas correctamente, conducirn al estudiante al
aprendizaje.
Para cada pregunta se da la respuesta correcta, de modo que las respuestas que se proponen
puedan comprobarse de inmediato. En el encontrar enunciados marcados con E que
proporcionan informacin bsica y van seguidos de una serie de preguntas marcadas con
P, respuestas graduales marcadas con R y enunciados de revisin marcados con S. El
taller ser de ayuda para el aprendizaje, si a cada pregunta se da respuesta por el estudiante
antes de verifcar la respuesta correcta.
La lectura de la pregunta y leer luego su respuesta no es conveniente. Se recomienda
hacer el ejercicio siguiendo los siguientes pasos:
1. Cubra la pgina con una hoja de papel, de modo que solamente se pueda observar un
enunciado. Lea cuidadosamente el enunciado.
2. Destape la primera pregunta. Escriba la respuesta en la hoja de papel
3. Desplace la hoja de papel hacia abajo de modo que pueda observar la respuesta correcta
de la primera pregunta. Lea la respuesta y comprela con la que usted ha dado.
4. S su respuesta es correcta, continu con la pregunta siguiente, s su respuesta no es
la correcta, estudie nuevamente el enunciado y las preguntas anteriores. Siga cuando
halla logrado contestar correctamente cada pregunta. En la interpretacin de espectros para
la obtencin de la estructura e identidad de un compuesto, se requiere de prctica y mucha
experiencia; as se utilice la ayuda de un programa computarizado u otras pruebas analticas
fsicas o qumicas confrmativas.
E-l La identifcacin de las bandas de absorcin caractersticas causadas por los diferentes
grupos funcionales constituye la base de la interpretacin de los espectros infrarrojos. As,
las frecuencias de alargamiento OH proporcionan bandas de absorcin intensas en la
regin de 3350 cm
-1
. La presencia de una banda fuerte en a regin de 3350 cm
-1
del espectro infrarrojo de un compuesto es grandemente sugestiva de que las molculas
contienen el grupo funcional OH. En la siguiente seccin se demuestra la tcnica utilizada
para la interpretacin de los espectros infrarrojos. Las ocho reas ms importantes y
15 Adaptacin del texto en instruccin programada Anlisis Espectral de compuestos orgnicos de Cliford J Creswell. Olaf
Runquist. Malcolm M. Campbell. 1ra ed. Ed. Diana 1.980 y del texto identfcacin espectromtrica de compuestos orgnicos
de Robert M. Silverstein, G. Clayton Bassler y Terence C. Morrill. 1era ed. Ed. Diana Mxico 1.980.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
301
bien defnidas en el examen preliminar de los espectros se proporcionan en el cuadro 6.5
pgina 262 de la presente unidad (6).
Regin n cm
-1
3000-2700
1900-1650
1475-1300
R-1 Alargamiento C - H de
CH3, CH2 y protn de aldehdo
Alargamiento C = O
de flexin C - H del CH3 -,CH2
P-2 En cul de las ocho regiones espectrales es de esperarse que al siguiente compuesto
sorba luz?
Regin n cm
-1
3750-3000
3000-2700
1900-1650
1475-1300
R-2
Alargamiento N - H
Alargamiento C - H
Alargamiento C = O
Flexin C - H
P-3 En cul de las ocho regiones espectrales es de esperarse que el siguiente compuesto
absorba luz? A qu tipo de vibracin se debe cada absorcin?
Regin n cm
-1
3750-3000 Alargamiento O - H
3300-3000 Alargamiento C - H de
Ar - H
3000-2700 Hidrgeno de aldehdo
1900-1650 Alargamiento C=O
1675-1500 Alargamiento C=C
(Ar)
1000-650 Flexin Ar H
(fuera de plano)
R-3
P-1 En cul de las ocho regiones espectrales infrarrojas indicadas en el cuadro 6.5 de la
pgina 262 unidad seis puede esperarse que el siguiente compuesto absorba luz?
Qu enlace da lugar a cada absorcin?
C H
HO
O
CH
3
CH
2
CH
O
N
O
H
302
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
P-5 En cul de las ocho regiones espectrales es de esperarse que el siguiente
compuesto sorba luz? A qu tipo de vibracin se debe cada absorcin?
P-4 En cul de las ocho regiones espectrales es de esperarse que el siguiente
compuesto absorba luz? A qu tipo de vibracin se debe cada una de las absorciones?
CH
3
COCH
2
C CH
O
CH
2
NHCH
3
Regin n cm
-1
3750-3000 Alargamiento N-H
3300-3000 C = C
(Alargamiento C H)
3000-2700 CH
3
y, CH
2
C H
(Alargamiento C-H)
1475-1300 Flexin C H
1675-1625 Alargamiento C = C
1000-650 Flexin C = C
R-5
H
H
Regin n cm
-1
3300-2900
Alargamiento
C C H
3000-2700 Alargamiento C H
de CH
3
y
CH
2
2400-2100 Alargamiento C C
1900-1650 Alargamiento C = O
R-4
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
303
P-7 Abajo se tiene una porcin de espectro que se sabe tiene la estructura I. Cul es la
estructura que no es consistente con el espectro? Por qu?
P-6 Abajo se tiene una porcin del espectro infrarrojo de un compuesto. Qu tipos de
grupos son posibles? Qu tipos de grupos se conoce que se encuentren ausentes?
Regin n cm
-1
3750-3000 Alargamiento NH o
OH
3300-2700 Alargamiento C H
de CH
3
,
CH
2
, C H
Ar H, C = C ,
C C H o hidrgeno de
aldehdo.
2400-2100 Alargamiento C C o
C N
1475-1300 Flexin C H
Ausentes
1900-1650 Alargamiento C=O
1675-1625 Alargamiento C=C
R-6
4000 30002500 2000 1700 1500 1300
0
100
%
T
r
a
n
s
m
i
t
a
n
c
i
a
n cm
-1
4000 30002500 2000 1700 1500 1300
0
100
%
T
r
a
n
s
m
i
t
a
n
c
i
a
n cm
-1
OH
O
I. II.
H
304
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
P-8 Abajo se incluye un espectro parcial de un compuesto que se conoce, tiene la estructura
I o II Cul estructura no es consistente con el espectro? Por qu?
R-8
La estructura II
no es consistente con el espectro debido a la falta del alargamiento
C=O (1900 1650 cm
-1
) y la presencia de absorcin en la regin de 2400 2100 cm
-1
(alargamiento CN)
P-9 Al lado izquierdo se proporciona una porcin del espectro infrarrojo de una molcula
que se conoce, tiene la estructura I o II, Cul estructura es consistente con el espectro?
Por qu?
R-9
La estructura I. La absorcin C=CH es consistente con la estructura I
pero no con la II.
4000 30002500 2000 1700 1500 1300
0
100
%
T
r
a
n
s
m
i
t
a
n
c
i
a
n cm
-1
C N
HO
CNH
2
O
3500
0
100
%
T
r
a
n
s
m
i
s
i
n
3000 2700
R-7
La estructura I no es consistente con el espectro debido a la falta de bandas en la regin
de 3750-3300 cm
-1
(alargamiento OH) y en la regin de 1675 1625 cm
-1
(alargamiento
C=C). La absorcin en la regin de 1900 1650cm
-1
(alargamiento C=O) es consistente
en la estructura II.
I
II
CH
3
OCH
2
C C CH
3
I
II
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
305
P-10 A continuacin se proporciona una porcin de espectro infrarrojo de una molcula
que se conoce, tiene la estructura I, II O IIICul es la estructura consistente con el
espectro? Por qu?
R-10
La estructura II. La presencia de la banda de 3300 cm
-1
(C CH) elimina la estructura III.
La falta del alargamiento C=O en 1900 1650 cm
-1
elimina las estructuras I Y III. Observese
la banda de alargamiento C C sumamente dbil (2200 cm
-1
) en el espectro
R-11
La estructura III. La presencia del alargamiento CH aromtico (arriba de 3000 cm
-1
) y CH
aliftico (3000-2700 cm
-1
) es consistente solo con la estructura III.
3500 3000 2500 2000 1800 1600
C
O
H
CH
3
OCH = CH C CH II
CH
3
C C C CH
3
III
O
I
%
T
r
a
n
s
m
i
t
a
n
c
i
a
n cm
-1
3.0
3000
Cl
CH
3
Cl
Cl
Cl
Cl
Cl
C (CH
3
)
3
III
II
I
3.5
2500 2000
4.0 4.5 5.0 5.5
%
T
r
a
n
s
m
i
t
a
n
c
i
a
n cm
-1
P-11 A continuacin se incluye una porcin de espectro infrarrojo de una molcula
que se conoce tiene la estructura I, II o III Cul es la esctrucutra consistente con el
espectro? Por qu?
Longitud de onda en micrmetros
306
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
P-12 Se considera que el compuesto cuyo espectro aparece abajo tiene la estructura I, II,
III O IV Cul es la estructura ms consistente con el espectro?
R-12
La estructura II. La presencia del alargamiento CH arriba de 3000 cm
-1
elimina la estructura
I. La presencia del alargamiento C=O a 1700 cm
-1
elimina las estructuras III Y IV.
7.0 6.0 5.0 4.0 3.5 3.0
100
0
3500 3000 2500
2000 1800 1600 1400 1300
%
T
r
a
n
s
m
i
t
a
n
c
i
a
n cm
-1
C C H
III
I
I
I
II
O
I
OCH=CH
2
IV
O
O
CH
2
C
O
H
II
E - 2 Existe la posibilidad de lograr distinciones de importancia en la regin de
alargamiento OH, NH del espectro (3750-3000 cm
-1
).
Las vibraciones de alargamiento OH libre (sin hidrgeno enlazado) se encuentran
en la regin de 3700-3500 cm
-1
. Las vibraciones OH de fenol libre tienden a tener
absorcin en el extremo bajo (3500) de este intervalo. Las bandas OH libre tienen
menor intensidad que las bandas OH enlazado y son evidentes solamente en soluciones
diluidas ( o en fase gas).
Una absorcin OH enlazado con hidrgeno aparece en el intervalo de 3450-3200
cm
-1
ms bien como una banda amplia e intensa.
Las aminas sin enlace manifiestan bandas en la regin de 3500-3300 cm
1
, mientras
que las aminas enlazadas tienen bandas en la regin de 3500-3100; estas bandas son
ms dbiles que las bandas de OH enlazado, pero mucho ms agudas. Las aminas
primarias muestran dos bandas, las aminas secundarias y las iminas solamente muestran
una banda y las aminas terciarias no tienen bandas. Las amidas y las lactamas tambin
manifiestan absorcin NH en la regin de 35003300.
Los cidos carboxlicos en estado solido y aun en soluciones relativamente diluidas
existen como dmeros y no manifiestan absorcin de OH en la regin esperada. En
lugar de esto, se presentan absorciones de banda amplia intensa en la regin de 3000-
2500 cm
-1
.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
307
P-13 Indicar las absorciones esperadas en el espectro del siguiente compuesto.
El espectro fue obtenido a partir de una muestra neta (es decir sin la presencia de solvente).
CH
3
CH
2
OH
R-13
Una banda intensa en la regin de alargamiento OH enlazado ( 3450-3200 cm
-1
) y bandas
de alargamiento CH (3000-2700 cm
-1
) caractersticas del CH
3
y CH
2
P-14 Indicar la absorcin esperada para el siguiente compuesto.
O H
CH
3
C N CH
2
CH
3
R-14
Una absorcin dbil pero aguda NH en la regin de 3500-3300 cm
-1
. La absorcin en la
regin de CH (3000-2700 cm
-1
) debido al alargamiento CH
3
y CH
2
y la
absorcin de C = O en la regin de carbonilo (1900-1650
cm
-1
).
P-15 Una absorcin bastante diluida del cis-ciclo-pentano-1, 2-diol en CCL
4
muestra
bandas en 3620 y 3455 cm
-1
. Proporcione una explicacin de esto.
R-15
La absorcin a 3620 cm
-1
se debe al alargamiento OH libre. La absorcin a 3485
cm
-1
se
debe al alargamiento OH enlazado. El alargamiento enlazado de una solucin diluida es
indicativo del enlazamiento de hidrgeno intramolecular; es decir,
P-16 En qu se diferencian los espectros infrarrojos de los siguientes compuestos.
C
6
H
5
CH
2
NH
2
CH
3
CN(CH
3
)
2
R-16
La bencilamina tendra dos picos en la regin de 3500-3100 cm
-1
y sin alargamiento C=O,
mientras que la N, N-dimentilacetamina no tendra alargamiento HN a 3500 - 3100
cm
-1
,
pero podra tener un alargamiento CO cerca de 1650
cm
-1
.
O
O
O
H
H
308
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
P-17En qu difieren los espectros infrarrojos de los siguientes compuestos?
(t C
4
H
9
)N
H (C
2
H
5
)
3
N
R-17
La di-t-butilamina tendra un alargamiento HN en la regin de 3500 - 3100
cm
-1
, mientras
que la trimetilamina no tendra alargamiento NH.
P-18 Cmo podran diferenciarse los espectros infrarrojos de los siguientes compuestos
(muestras netas)?
OH
CH
3
CHCH
3
(CH
3
CH
2
CH
2
CH
2
)
2
NH
R-18
El alcohol i-proplico tendra un alargamiento OH amplio intenso ( 3400-3200
cm
-1
) y banda
de alargamiento CH caractersticas del CH
3
y C H,
mientras que la
n-di-butilamina tendra una banda simple aguda y dbil en la regin de alargamiento NH
(3500- 3100
cm
-1
) y bandas caractersticas de CH
3
y CH
2
.
P-19Cmo podran diferenciarse los espectros infrarrojos de los siguientes compuestos
(muestras netas)?
CH
3
(CH
2
)
6
COOH A
(CH
3
)CCHOHCH
2
CH
3
B
(CH
3
)
3
CCH (CH
2
CH
3
)N(CH
3
)
2
C
R-19
El compuesto A no tendra absorcin OH en la regin de 3500-3100
cm
-1
, pero absorbera
en la regin 3000-2500 cm
-1
asi como en la regin de C=O (1900-1650
cm
-1
).
El compuesto B dara una banda intensa de OH en la regin de 3450-3200 cm
-1
y sin
absorcin de C=O, mientras que C no manifestara absorcin en la regin de 3400-3100
cm
-1
as como tampoco en la regin de C=O (1900-1650
cm
-1
).
P-20 En qu se diferencian los espectros infrarrojos de los siguientes compuestos
(muestras netas)?
OH OH
S
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
309
Los dos manifestaran
alargamiento OH en la regin
de 3450-3200 cm
-1
(el fenol a
los nmeros de onda inferior).
Sin embargo, el fenol mostrara
absorcin de ArH y el
ciclohexanol dara absorcin de
C H As mismo, el fenol dara
cierta flexin CH aromtica
en la regin de 1000
- 650 cm
-1
mientras que el ciclohexanol
seria lo contrario.
R-20
OH sin enlazamiento 3700-3500
cm
-1
OH enlazado 3450-3300cm
-1
NH no enlazado 3500-3300cm
-1
NH enlazado 3500-3100cm
-1
cidos carboxlicos 3000-2500cm
-1
S
Diferentes tipos de enlaces CH muestran absorcin dentro de
reas bien definidas de la regin de alargamiento CH (3300-2700 ).
Las posiciones aproximadas de las bandas CH para los diferentes
tipos de grupos se muestran a continuacin.
E - 3
Tipo H
ArH
C CH
C=CH
CH3
CH2
-CH
-C - H
O
3040
2960
2930
cm-1
3030
3300
3010
2870
2850
2890
2720
Intensidad de banda
intensidad moderada
intensidad alta
intensidad moderada
intensidad alta
intensidad alta
-
y
y
Tambin es observable que -CH3 y -CH2- originan dos
bandas
n
310
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
P-21En qu posiciones aproximadamente de la porcin de alargamiento CH del
espectro absorbera el siguiente compuesto?
CH
3
CH
2
CH
= CH
2
R-21
Una banda en la regin de 3040-3010
cm
-1
debida a los hidrgenos etilnicos.
Dos bandas en la regin de 2960-2870
cm
-1
debida al CH
3
y dos bandas en la regin de
2930-2850
cm
-1
debidas al CH
2
.
P-22 En qu posiciones aproximadamente de la regin de alargamiento CH del espectro
infrarrojo seria de esperarse que absorbiera luz el siguiente compuesto?
CH
3
CH
2
CC
CH
2
R-22
Una banda en la regin de3300
cm
-1
debida al alargamiento C C, dos bandas (2960
2870
cm
-1
) debida al CH
3
,y dos bandas (2930-2850
cm
-1
debidas al CH
2
.
O
P-23En qu posiciones aproximadamente de la porcin de alargamiento del espectro
infrarrojo seria de esperarse que absorbiera el siguiente compuesto?
R-23
Una banda dbil en la regin de 2720
cm
-1
debida al alargamiento
O
CH, dos bandas cerca de 2930 y 2850
cm
-1
debidas al CH
2
y una banda dbil cerca
de 2890
cm
-1
debida al CH
CH
O
P-24En qu posiciones aproximadamente de la porcin de alargamiento CH del espectro
infrarrojo seria de esperarse que absorbiera el siguiente compuesto?
R-24
Una banda cerca de 3030
cm
-1
debida al alargamiento CH aromtico junto con
una banda en la regin de 3040-3010 cm
-1
debida a HC=C. (Estas bandas pueden
traslaparse y uno aparecer a modo de picos separados). Una banda dbil cerca de
2720
cm
-1
debida al alargamiento CH
O
CH
O
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
311
P-25 En qu posiciones aproximadamente de la porcin de alargamiento del espectro
infrarrojo seria de esperarse que absorbiera el siguiente compuesto?
CH(CH
3
)
2
R-25
Una banda cerca de 3030
cm
-1
debida al alargamiento ArH, una banda dbil cerca
de 2890 cm
-1
debida a CH, y dos bandas cerca de 2960 y 2870
cm
-1
debida al
alargamiento CH
3
.
P-26 En qu posiciones aproximadamente de la porcin de alargamiento CH del
espectro sera de esperarse que absorbiera el siguiente compuesto?
CH
3
CH
2
CH(CH
3
)
2
R-26
Una banda dbil cerca de 2890 cm-1 debida a C H, dos bandas cerca de 2960 y 2870
cm
-1
debidas al alargamiento CH
3
-, y dos bandas cerca de 2930 y 2850 cm
-1
debidas al
alargamiento CH
2
.
P-27 En qu diferira la regin de alargamiento C H de los siguientes compuestos?
O O
A. C
6
H
5
CH B. (CH
3
)
3
C CH
R-27
El compuesto A tendra un alargamiento Ar-H cerca de 3030 cm
-1
y alargamiento
O
C H cerca de 27cm
-1
, mientras que el compuesto B no tendra alargamiento C H
arriba de 3000 cm
-1
. El compuesto B mostrara dos bandas cerca de 2960 y 2870 cm
-1
O
Debidas al CH
3
y un alargamiento C - H cerca de 2720cm
-1
.
S C C H 3300 cm
-1
Ar H 3030 cm
-1
C = C 3040 3010 cm
-1
CH
3
2960 y 2870 cm
-1
CH
2
2930 y 2850 cm
-1
CH 2890 cm
-1
O
C H 2720 cm
-1
H
312
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
E 4 La regin de alargamiento simtrico de triple enlace se resume a
continuacin.
Tipo triple enlace n cm
-1
intensidad de enlace
H C C R 2410 2100 fuerte
R C C R
1
2260 2190 intensidad variable
RC CR sin absorcin
RC N 2260 2240 fuerte
La conjugacin dar lugar a un pequeo desplazamiento de estos valores hacia
un nmero de onda menor, por ejemplo, los cianuros de arilo absorben en la
regin de 2240 2190 cm
-1
. Los acetilenos simtricos no manifestan absorcin
debido a que la vibracin simtrica no cambia de dipolo.
P-28 Qu absorciones infrarrojas son de esperarse para el siguiente compuesto?
CH
3
CH
2
C CH
R-28
Una banda cerca de 3300 cm
-1
(C C H),
dos bandas cerca de 2960 2870 cm
-1
(CH
3
),
dos bandas cerca de 2930 2850 cm
-1
(CH
2
),
una banda cerca de 2140 2100 cm
-1
(alargamiento C C simtrico) y fexin C H
aliftica en 1475 1300 cm
-1
.
P-29 Qu absorciones infrarrojas seran de esperarse para el siguiente compuesto
(muestra neta)?
HC CCH
2
OH
R-29
Una banda amplia intensa en la regin de 3450 3300 cm
-1
debida al OH, que podra cubrir
hasta la banda de 3300 cm
-1
de alargamiento C CH. Dos bandas en las regiones de 2930
2850 cm
-1
debidas al alargamiento CH2, una banda cerca de 2140 2100 cm
-1
debida
al alargamiento de C C simtrico y una fexin C H aliftica cerca de 1475 1300 cm
-1
.
P-30 Indique las absorciones infrarrojas que son de esperarse para el siguiente compuesto.
C C
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
313
R-30
Una banda cerca de 3030 cm
-1
debida al alargamiento Ar H, pero sin banda cerca de 2260
2190 cm
-1
debido a que el alargamiento C C simtrico no origina cambio en el dipolo.
El alargamiento C = C aromtico en la regin de 1675 1500 cm
-1
y la fexin Ar H en la
regin de 1000 - 650 cm
-1
.
P-31 Indique las absorciones infrarrojas que son de esperarse para el siguiente compuesto
(muestra neta).
CH
3
C CCH
2
CH
2
NH
2
R-31
Dos bandas agudas pero no demasiado intensas en la regin de 3500 3100 cm
-1
debidas
al alargamiento de N-H, dos bandas en la regin de 2960 2870 cm
-1
(CH
3
), al menos
dos bandas en la regin de 2930 2850 cm
-1
(CH
2
), una banda (probablemente de baja
intensidad) en la regin de 2260 2190 cm
-1
debida al alargamiento C y fexin de C H
aliftica en 1475 1300 cm
-1
.
P-32 Indique las absorciones infrarrojas que son de esperarse para el siguiente compuesto
(solucin saturada en CCl
4
).
R-32
Una banda (fuerte, amplia) en la regin de 3450 3300 cm
-1
debida al alargamiento de OH
(enlazado). Una banda cerca de 3030 cm
-1
debida al alargamiento Ar-H, dos bandas en la
regin de 2960 2870 cm
-1
(CH
3
), una banda (dbil) cerca de 2890 cm
-1
(C H),una banda
en la regin de 2260 - 2190 cm
-1
(aunque pudiera ser muy dbil) debida al alargamiento
C C simtrico, alargamiento C = C aromtico en la regin de 1675 1500 cm
-1
, fexin
C H aliftica en aromtica 1475 1300 cm
-1
y fexin C H en la regin de 1000 650
cm
-1
.
P-33 Indique las absorciones infrarrojas que son de esperarse para el siguiente compuesto
C C
HO
C(CH
3
)
2
CN
COOH
314
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
R-33
Una banda en la regin de 3030 cm
-1
debida al alargamiento Ar-H. Esta pudiera quedar
enmascarada por una banda difusa amplia en la regin de 3000 2500 cm
-1
debida al COOH.
El C N dara una banda en la regin de 2260 2240 cm
-1
. Se presentara el alargamiento
C = C aromtico, 1675 1500 cm
-1
, y fexin, 1000 650 cm
-1
.
S HC CR 2140 2100 cm
-1
RC CR 2260 2190 cm
-1
RC CR sin absorcin
RC N 2260 2240 cm
-1
E 5 Muchas bandas importantes aparecen en la regin de carbonilo del
espectro.
Tipo de carbonilo n cm
-1
Intensidad de la banda
O
RCH (saturado) 1740 1720 fuerte
COOH (saturado) 1705 1725 fuerte
O
R C R 1705 1725 fuerte
O
R C OR (lactosas de seis y siete
Miembros) 1750 1730 fuerte
Lactonas de cinco miembros 1780 1760 fuerte
Esteres (no cclicos) 1740 1710 fuerte
Haluros de cido 1815 1720 fuerte
Anhdridos dos bandas separadas aproximadamente
por 60 cm
-1
a
1850 1800 cm
-1
y
1780 1740 cm
-1
.
Amidas 1700 1640 cm
-1
fuerte
La conjugacin desplaza todas las bandas de absorcin hacia nmeros de onda
menores (observe que el esfuerzo en los anillos de lactona desplaza las absorciones
hacia frecuencias superiores).
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
315
P-34 En qu diferen los espectros de absorcin de los siguientes compuestos en la
regin de 4000 1650 cm
-1
?
O
CH
3
CH
2
COOH CH
3
CH
2
CH
CH
3
CCH
3
O
R-34
Todos tendran absorcin intensa en la regin de 1740 1700 cm
-1
. el cido tendra una
banda difusa amplia en la regin de 3000 2500 cm
-1
debida al OH, mientras que el aldehdo
tendra una absorcin dbil en la regin de 2720 cm
-1
debida al alargamiento CH.
P -35 En qu diferen los espectros de absorcin de los siguientes compuestos en la
regin de 4000 1650 cm
-1
?
C NH
2
O
NH
COOH
A
B
C
R-35
Los tres compuestos tendran alargamiento Ar - H en la regin de
3030 cm
-1
. El compuesto A tendra dos picos de alargamiento N H en
la regin de 3500 - 3100 cm
-1
, mientras que el compuesto B solamente
tendra un pico de alargamiento N H en tal regin, y el compuesto C no
tendra ninguno.
El compuesto A tendra un pico de alargamiento C = O en la regin de
1700 - 1640 cm
-1
mientras que B no tendra ninguno. El compuesto C
tendra alargamiento C = O aproximademente a 1700 cm
-1
. El compuesto
C tendra una banda difusa amplia en la regin de 3000 - 2500 cm
-1
debido
al OH.
316
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
P-36 En qu difieren los espectros de absorcin de los siguientes
compuestos en la regin de 4000 - 1650 cm
-1
?
R-36
Los tres compuestos tendran al menos dos bandas (regin de 2960
- 2870 cm
-1
) debidas al alargamiento CH
3
. A tendra dos bandas de
alargamiento C = O separadas por cerca de 60 cm
-1
en la regin de 1850
- 1740 cm
-1
, mientras que B tendra una banda simple C = O en la regin
de 1740 - 1710 cm
-1
y C tendra una banda simple de alargamiento
C = O en la regin de 1700 - 1640 cm
-1.
P-37 En qu difieren los espectros de absorcin de los siguientes
compuestos (soluciones concentradas) en la regin de 4000 - 1650 cm
-1
?
C NH
O
C
O
A
B
C
C NH
2
O
R-37
El compuesto A tendra un pico de alargamiento NH simple en la regin
de 3500 - 3100 cm
-1
, B tendra dos picos de alargamiento NH, y C no
tendra ninguno. A y B manifestaran absorcin en la regin de 1640 cm
-1
(baja debido a la conjugacin).
Ciertamente, la mejor forma de distinguir entre estos compuestos consiste
en la inspeccin de la regin de alargamiento NH.
CH
3
COCCH
3
A
CH
3
COCH
3
B
CH
3
CN(CH
3
)
2
C
O O
O
O
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
317
R-38
El compuesto B tendra absorcin de alargamiento OH en la regin de 3450 3300 cm
-1
,
mientras que A y C no la tendran. A tendra una absorcin de alargamiento de carbonilo en
la regin de 1740 1720 cm
-1
. C tambin tendra una absorcin dbil en 2720 cm
-1
debida al
alargamiento C H del aldehdo.
P -39 En qu diferen los espectros de absorcin de los siguientes compuestos (soluciones
concentradas) en la regin de 4000 1650 cm
-1
?
C C
C C
CH
2
CH
2
CH
O
CH
O
A
B
C
P-38 En qu difieren los espectros de absorcin de los siguientes
compuestos (soluciones concentradas) en la regin de 4000 - 1650 cm
-1
?
C
O
CCH
O
A
B
C
COH
(
(
(
(
3
3
318
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
R-39
A no tendra alargamiento de C C (no hay cambio en el dipolo) y tampoco alargamiento
C = O. B tendra absorcin dbil C C en la regin de 2260 2190 cm
-1
as como alargamiento
C = O en la regin de 1700 cm
-1
y alargamiento C - H cerca de 2720 cm
-1
.
El alargamiento C = O y alargamiento C H de aldehdo en C pudieran ser similares a los
de B, pero C no tendra alargamiento C C en la regin de 2260 2190 cm
-1
. C tendra
absorcin en la regin de 2930 2850 cm
-1
debida al CH
2
- .
S COOH (saturado) 1705 1725 cm
-1
RCOR (saturado) 1705 - 1725 cm
-1
RCHO (saturado) 1720 1740 cm
-1
Lactosas (6 y 7
Miembros) 1730 1750 cm
-1
Lactonas (5 miembros) 1760 1780 cm
-1
RCOOR 1710 1740 cm
-1
RCOX 1720 1815 cm
-1
RCOOCOR 1800 1850 cm
-1
1740 - 1780 cm
-1
RCONH
2
1680 1700cm
-1
(libre)
1640 1660 cm
-1
(enlazado)
La conjugacin desplaza las bandas hacia nmeros de onda menores.
E 6 La regin de alargamiento de doble enlace simtrico correspondiente a
1680 1600 cm-
-1
contiene bandas debidas a los siguientes grupos.
Tipo de doble enlace n cm
-1
Intensidad de la banda
C = C 1680 1620 variable
C = N 1690 - 1640 variable
N = N 1630- 1575 variable
La banda de C = C es bastante dbil para una molcula relativamente simtrica .
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
319
Los sistemas aromticos tienen una o ms bandas fuertes en la regin de 1400 1500
cm
-1
.
P-40 En qu diferen los espectros de los siguientes compuestos?
R-40
Solamente A tendra una banda en la regin de 3040 3010 cm
-1
(C = CH) y una banda
en la regin de 1680 1620 cm
-1
.
( C = C )
P-41 En qu diferen los espectros de los siguientes compuestos?
CH
3
CH = CHCH
2
CH
R-41
A tendra una banda en la regin de 3040 3010 cm
-1
(CH = C), dos bandas en la regin
2960 2870 cm
-1
(CH
3
), una banda dbil en la regin de 2720 cm
-1
(CHO) y un alargamiento
C = C en la regin de 1680 1620 cm
-1
que no estaran presentes en el espectro de B.
P-42 En qu diferen los espectros de los siguientes compuestos?
R-42
Los dos compuestos A y B manifestaran alargamiento C = CH (3040 3010 cm
-1
). A tendra
alargamiento CH
2
- (2930 2850 cm
-1
) que B no tendra. A tendra un alargamiento
C = O simple en la regin de 1725 1705 cm
-1
, mientras que B tendra dos bandas de
alargamiento C = O aproximadamente 60 cm
-1
aparte en la regin de 1850 1740 cm
-1
.
los dos compuestos A y B tendran un alargamiento C = C muy dbil en la regin de 1690
1620 cm
-1
.
CH
2
CH
3
O
O
A
B
A B
O
A
O
B
O
O
320
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
S C = C 1620 - 1680 cm
-1
C = N 1640 1690 cm
-1
N = N 1575 1630 cm
-1
E-7 la regin de fexin C H (1000 650 cm
-1
) proporciona informacin de utilidad
para la caracterizacin de las olefnas y posiciones de sustitucin en los anillos
aromticos. A continuacin se proporciona una lista de absorciones caractersticas
de utilidad:
Flexin C H etilnica:
Tipo de olefina n cm
-1
Intensidad de la banda
RCH = CH
2
990 y 910 fuerte
RCH = CRH (cis) 690 moderada a fuerte
RCH = CRH (trans) 970 moderada a fuerte
R
2
C = CH
2
890 moderada a fuerte
R
2
C = CHR 840 790 moderada a fuerte
Benceno sustituido
Tipo de sustitucin n cm
-1
Intensidad de la banda
Aromtico monosustituido (5
Hidrgenos adyacentes) 750 y 710 normalmente moderada a
fuerte
Aromtico orto (4
Hidrgenos adyacentes) 750 normalmente moderada a
fuerte
Aromtico meta (3
Hidrgenos adyacentes) 780 810 normalmente moderada a
fuerte
Aromtico para (2
Hidrgenos adyacentes) 850 - 800 normalmente moderada a
fuerte
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
321
P-43 En qu regiones del espectro infrarrojo manifestan los siguientes compuestos
absorciones distintas?
A. CH
3
CH = CHCH
3
B. CH
3
CH = CH
2
R-43
A tendra un alargamiento C = C ms dbil en la regin de 1680 1620 cm
-1
en comparacin
con B. El compuesto B tendra bandas a 910 y 990 cm
-1
caractersticas de C = CH
2
, mientras
que A tendra una banda a 970 cm
-1
(en caso de ser trans) o a 690 cm
-1
(si fuera cis).
P-44 En qu regiones del espectro infrarrojo manifestan los siguientes compuestos
absorciones caractersticas distintas?
A. (CH
3
)
2
C = CHCH
3
B. CH
3
(CH
2
)
2
CH = CH
2
R-44
Aun cuando ambos compuestos mostraran cierta absorcin en la regin de 1680 1620
cm
-1
B tendra dos bandas, 990 y 910 cm
-1
(caractersticas de RCH = CH
2
) mientras que A
tendra una banda simple en 840 790 cm
-1
.
P-45 En qu regiones del espectro infrarrojo manifestaran los siguientes compuestos
absorciones caractersticas distintas?
R-45
el m-xileno tiene tres H adyacentes y tendra una banda simple en la regin de 780 810
cm
-1
. el p-xileno solamente tiene dos H adyacentes y mostrara un pico simple en la regin
de 800 - 850 cm
-1
.
P-46 En qu regiones del espectro infrarrojo manifestan los siguientes compuestos
absorciones caractersticas distintas?
A. p-tolunitrilo
B. o-tolunitrilo
CH
3
CH
3
CH
3
CH
3
322
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
R-46
Aun cuando ambos compuestos tendran una banda de alargamiento C N en la regin de
2260 2240 cm
-1
. B tiene cuatro hidrgenos adyacentes y tendra una banda en la regin
de 750 cm
-1
. A solamente tiene dos H adyacentes y tendra una banda en la regin de 850
800 cm
-1
.
P-47 En qu regiones del espectro infrarrojo manifestaran los siguientes compuestos
absorciones caractersticas distintas?
Etilbenceno o-xileno
R-47
El etilbenceno tiene cinco H adyacentes y tendra dos bandas en la regin de 750 y 700 cm
-1
.
El o-xileno solamente tiene cuatro H adyacentes y tan solo tendra una banda cerca de 750
cm
-1
. El etilbenceno tendra dos picos en la regin de 2930 2850 cm
-1
(-CH
2
-) que no presentara el o-xileno.
P-48 En qu regiones del espectro infrarrojo manifestaran los siguientes compuestos
absorciones caractersticas distintas?
Cis-2-buteno trans-2-buteno
R-48
El compuesto cis tendra una absorcin intensa en la regin de 690 cm
-1
, mientras que el
ismero trans tendra una absorcin en la regin de 970 cm
-1
.
P-49 En qu regin del espectro infrarrojo manifestaran los siguientes compuestos
absorciones caractersticas diferentes?
R-49
El compuesto A tendra una banda simple en la regin de 840 790 cm
-1
y una banda
de alargamiento de enlace doble ms bien dbil (1680 1620 cm
-1
). B tendra dos bandas
cerca de 910 y 990 cm
-1
y una banda de alargamiento de doble enlace intensa (1680 1620
cm
-1
).
CH
3
A
B
CH
2
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
323
P-50 En qu regin del espectro infrarrojo manifestaran los siguientes compuestos
absorciones caractersticas diferentes?
C = C C = C
R-50
A tendra una banda fuerte simple en la regin de 840 790 cm
-1
, mientras que B tendra
una banda fuerte simple en la regin de 690 cm
-1
.
P-51 Abajo se incluye el espectro de un compuesto orgnico que solamente contiene C,
H y O. Indique si el compuesto es aromtico o aliftico. Indique si el compuesto corresponde
a un alcohol.
R-51
La falta de las bandas de alargamiento C H arriba de 3000 cm
-1
indicara que el
compuesto no es aromtico. El alargamiento C H a 2960 y 2930 cm
-1
indica el CH aliftico.
La falta de bandas intensas en la regin 3500 3300 cm
-1
indica que el compuesto no es
un alcohol.
P-52 Indique para el compuesto cuyo espectro corresponde al anterior si es un aldehdo,
cetona, ster, anhdrido o cido. Indique si el compuesto contiene un doble o triple enlace.
R-52
El compuesto tiene absorcin en la regin de carbonilo (1718 cm
-1
) a la frecuencia tpica
de los aldehdos, cetonas o cidos. La falta de bandas amplias y fuertes en la regin de 3000
cm
-1
debidas al OH indicara que el compuesto no es cido. La falta de alargamiento C H a
CH
3 CH
3
CH
3 H
CH
3
H
H
4000
0
100
%
T
r
a
n
s
m
i
t
a
n
c
i
a
3000 2500 2000
1800
1600 1400 1200 1000 950 900 850 800 750 700
2960
2930
1718
1378
n cm
-1
A B
324
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
2720 cm
-1
sugiere que el compuesto no es aldehdo. La falta de cualquier absorcin en las
regiones de 1650 y 2200 cm
-1
indican que, en caso de existir un doble o triple enlace, este
debe ser simtrico.
P-53 Abajo se incluye el espectro de un compuesto. Indique si el compuesto es aromtico
o aliftico.
R-53
Los picos agudos en la regin de alargamiento C H indican C = CH, C CH o hidrgeno
aromtico.
P-54 Indique si el compuesto cuyo espectro es como se muestra en P-53 contiene el
grupo C = CH o C CH.
R-54
Se tendra una banda en la regin de 2200 cm
-1
si el compuesto tuviera un grupo C CH. La
presencia del doble enlace se confrma con la banda a 1650 cm
-1
y las bandas fuertes a 910
y 990 cm
-1
indicando CH
2
= C
P-55 los grupos metilo tienen una banda caracterstica en 1375 cm
-1
. Los grupos metilo y
metileno absorben a 1450 cm
-1
. Indique si el compuesto cuyo espectro aparece en la P-53
tiene un grupo CH
3
.
R-55
No. La banda de 1375 cm
-1
se encuentra ausente, pero la banda de 1450 cm
-1
si existe.
P-56 Indique si el compuesto descrito en la P-53 contiene OH, NH o C = O.
0
100
%
T
r
a
n
s
m
i
t
a
n
c
i
a
3500 3000 2500 2000 1800 1600 1400 1200 1000 800 600
n cm
-1
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
325
R-56
No. No se tiene una banda de absorcin intensa en la regin de 3500 3300 o en la regin
de 1960 1650 cm
-1
que pudieran asociarse con el OH, NH o C = O.
P-57 Ms abajo se incluye el espectro de cierto compuesto. Cules son las indicaciones
que demuestran que el compuesto no es aromtico?
R-57
No se tiene alargamiento C H arriba de 3000 cm
-1
tampoco absorcin aromtica entre
1650 y 1450 cm
-1
y ninguna absorcin intensa en la regin de 850 700 cm
-1
.
P-58 para el compuesto descrito en la P-57, Cules son los grupos defnidos por la regin
espectral de 4000 2000 cm
-1
? Qu grupos se encuentran ausentes de acuerdo con el
rastreo en esta regin?
R-58
La banda amplia y fuerte en 3350 cm
-1
es indicativa del OH. La absorcin en la regin de
2850 - 3000 cm
-1
indica CH
2
, y/o CH
3
, y/o CH. Al menos dos de estos alargamientos
estn indicados por estas tres bandas. La banda aguda de 2970 cm
-1
es bastante sugestiva
del CH
3
. El C = CH, C CH, Ar H y C N as como los grupos C asimtricos no se
encuentran indicados.
P-59 De acuerdo con el espectro del compuesto descrito en la P-57, Cules son los
grupos indicados en la regin de 2000 1200 cm
-1
? Qu grupos se encuentran ausentes?
R-59
Las bandas en 1380 y 1470 cm
-1
son indicativas del CH
3
- y quizs del CH
2
. Los grupos
que evidentemente se encuentran ausentes son el carbonilo, C = C asimtrico y anillos
aromticos.
0
100
%
T
r
a
n
s
m
i
t
a
n
c
i
a
3500 3000 2500 2000 1800 1600 1400 1200 1000 800 600
n cm
-1
1470
1380
326
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
P-60 Abajo se incluye el espectro de cierto compuesto. Indique si el compuesto es aromtico
o aliftico.
R-60
Son varios los detalles que indican la presencia de un anillo aromtico. Toda la
absorcin de alargamiento C H se encuentra arriba de 3000 cm
-1
indicando la presencia
posible de ArH. C = C H o C C H y la ausencia CH
3
CH
2
y CH. Las bandas
intensas en 1620, 1500 y 700 cm
-1
son caractersticas de los compuestos aromticos.
P-61 Cules son los grupos funcionales indicados en el espectro considerado en la
pregunta 60 entre 4000 y 1000 cm
-1
? Qu grupos se conoce que estn ausentes?
R-61
Dos bandas agudas de intensidad madia en la regin de 3500 son sugestivas del NH
2
.
Los grupos que se conocen estn ausentes son el OH, C = O, C N y el C asimtrico.
P-62 A continuacin se incluye el espectro de un compuesto cuya formula es C
8
H
8
O.
Indique el tipo de grupo funcional al cual se encuentra asociado el oxigeno.
0
100
%
T
r
a
n
s
m
i
t
a
n
c
i
a
3500 3000 2500 2000 1800 1600 1400 1200 1000 800 600
n cm
-1
0
100
%
T
r
a
n
s
m
i
t
a
n
c
i
a
3500 3000 2500 2000 1800 1600 1400 1200 1000 800 600
n cm
-1
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
327
R-62
La falta de cualquier banda intensa en 3000 3300 cm
-1
indica la ausencia del OH. La
banda de carbonilo en 1690 es sugestiva de aldehdo, cetona o amida. Debido a que no se
tiene N en el compuesto, la amida queda eliminada. El oxigeno debe estar en la forma de
carbonilo de aldehdo o de cetona. La falta de absorcin cerca de 2720 cm
-1
(-COH) sugiere
que el compuesto es una cetona.
P-63 Indique si el compuesto descrito en la P-62 es aromtico. Existen indicaciones de
carbonos alifticos?
R-63
La absorcin en la regin de alargamiento C H arriba de 3000 cm
-1
es bastante
indicativa de un anillo aromtico. Las bandas intensas en 1600, 1580 y 680 cm
-1
tambin
son sugestivas de un anillo aromtico. Las absorciones en 2920, 2960 y 1360 cm
-1
son
indicativas del CH
3
.
P-64 Qu tipo de sustitucin aromtica tiene mayores probabilidades de existir en el
compuesto de la P-62?
R-64
Las dos bandas cerca de 700 y 750 cm
-1
son indicativas de un anillo aromtico
monosustituido.
S
P-65 El siguiente espectro es de un lquido puro de olor fragante, con un punto de ebullicin de
77C a 760 mm, densidad 0.90 g/mL a 20C, n
20
1.3719 , su frmula emprica es C
4
H
8
O
2
.
A qu compuesto corresponde?
Una lista completa de bandas de absorcin infrarrojas caractersticas se
proporciona en los cuadros 6.5 pgina 262, 6.6 pgina 263, 6.7 264 y 6.8 pgina
265 para compuestos inorgnicos.
El presente espectro a cual
compuesto corresponde,
argumente la respuesta analizando
cada una de las bandas de
absorcin que lo caracterizan.
comprelo con los espectros de
referencia
A
b
s
o
r
b
a
n
c
i
a
D
328
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
P-66 El siguiente espectro es de un compuesto aromtico, liquido con alto punto d
e ebullicin cuya frmula emprica es C
9
H
10
O A qu posible compuesto corresponde?
Argumente su respuesta.
P-67 El siguiente espectro se obtuvo de soluciones de un compuesto cristalino blanco
cuyo punto de fusin es 54C y su frmula emprica es C
12
H
11
N. El espectro fue tomado
en soluciones del compuesto en, CCl
4
y CS
2.
Identifque el compuesto. Argumente la
respuesta.
%
T
r
a
n
s
m
i
t
a
n
c
i
a
A
b
s
o
r
b
a
n
c
i
a
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
329
6.6 Trabajo practico en el laboratorio
6.6.1 Demostracin de los componentes y funcionamiento de un espectrofotmetro
infrarrojo.
6.6.2 Calibracin del equipo mediante una pelcula de poliestireno.
6.6.3 Cuidados, limpieza de las ventanas y ensamble de las celdas.
6.6.4 Determinacin del espesor de las celdas.
6.6.5 Importancia de la atenuacin en la toma de espectros en sustancias que
presentan alta absorbancia.
6.6.6 Estudio de la infuencia de la velocidad de registro en la resolucin de los
espectros.
6.6.7 Estudio de la infuencia de la amplifcacin (ganancia) en la resolucin de los
espectros.
6.6.8 Aplicaciones prcticas en las diferentes tcnicas para el manejo de
muestras.
6.6.9 Obtencin de espectros de compuestos slidos.
6.6.9.1 Tcnica de la dispersin en KBr.
6.6.9.2 Tcnica de la dispersin en Nujol
6.6.9.3 Disolucin del slido en solvente voltil y obtencin de una pelcula para toma
del espectro.
6.6.9.4 Reduccin del slido a polvo fno y obtencin de una pelcula para toma de
espectro.
6.6.9.5 Obtencin de un espectro libre de interferencias, de un compuesto slido en
diferentes solventes.
6.6.9.6 Fusin del slido y obtencin de una pelcula para tomar el espectro.
6.6.9.7 Obtencin de espectros a pelculas de diferentes materiales plsticos.
6.6.10 Obtencin de espectros de sustancias viscosas.
330
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
6.6.11 Obtencin de espectros de sustancias lquidas.
6.6.11.1 Lquidos puros.
6.6.11.2 Lquidos en solucin.
6.6.11.3 Estudio del efecto del solvente.
6.6.11.4 Obtencin de espectros libres de interferencias, de lquidos en solucin.
6.6.12 Elaboracin de curvas de calibracin para anlisis cuantitativo.
6.6.13 Obtencin de espectros de sustancias en fase de vapor.
6.6.14 Obtencin de espectros de gases.
6.6.15 Diferentes aplicaciones analticas de la Espectroscopia IR. en control de
calidad.
6.6.15.1 Diferenciacin de un aceite comestible y un aceite lubricante por espectroscopia
IR.
6.6.15.2 Identifcacin de solventes industriales.
6.6.15.3 Identifcacin de ceras por espectroscopia IR.
6.6.15.4 Determinacin del grado de insaturacin en aceites comestibles.
6.6.16 Practica
6.6.16.1 Objetivo: Aprovechar la posicin caracterstica de una banda de absorcin
del grupo funcional (C = C) para estimar el grado de insaturacin en varios aceites
alimenticios.
6.6.16.2 Teora: El doble enlace C = C presenta en el IR varias bandas de absorcin
caractersticas: entre ellas destaca la vibracin por estiramiento, comnmente situada entre
1680 - 1620 cm
-1
.
Las sustituciones, conjugaciones, etc. modifcan la forma de la banda y tambin, levemente,
su posicin; adems, de 850 a 1000 cm
-1
. El enlace C - H de los alquenos muestra picos
de absorcin por deformacin.
6.6.16.3 Procedimiento: Se seleccionan 4 tipos de aceites comestibles (se recomienda
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
331
examinar, los de maz, oliva, Girasol y soya).
Se procede al ensamble de la celda siguiendo las instrucciones del fabricante (se aconseja
comenzar con un espesor de 0.1 mm.; se coloca en la celda el primer aceite y se obtiene el
espectro de 4000 a 600 cm
-1
.
Se retira la celda y se enjuaga con cloroformo; el siguiente aceite se usa para desalojar el
cloroformo remanente en la celda y se deja llenar con el mismo. Hay que obtener tambin su
espectro.
Se procede de igual forma para cada aceite. En cada espectro, se deben examinar las bandas
mencionadas y se deduce el orden de insaturacin de los aceites proporcionados.
6.6.16.4 Entregar: Los espectros obtenidos, el orden de insaturacin de los aceites
examinados, y una pequea monografa sobre los aceites vegetales y animales.
Comparar el resultado en la tabla de nmero de I (yodo) adjunta. Qu representa el nmero
de yodo? Hay alguna relacin? Por qu?.
6.6.16.5 Nmero de yodo para algunos aceites vegetales comunes
Aceite de Nmero de i
Oliva 80 88
Maz 103 128
Soya 120 141
Crtamo 147 - 153
Girasol ___ ___
332
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Bibliografa
ALDRICHl. Librera de espectros Infrarrojo 3. Ed
CALDERN GMEZ, Carlos Eduardo. Manual para interpretacin de espectros Infrarrojos.
Publicacin Universidad Nacional de Colombia. Bogot 1.985
Catlogos y software demostrativos diferentes Equipos Infrarrojos.
CHERIM, Stanley M. Qumica Aplicada (1a Ed.) Mxico: ED. Interamericana S.A., 1974.
CLIFFORD J. Creswell, Olaf Runquist, Malcolm M. Campbell. Anlisis Espectral de Compuestos
Orgnicos, Texto programado (1a Ed.) Mxico: ED. Diana. 1.979
MUOZ M . Cuauhtmoc. Prcticas de instrumentacin analtica parte I mtodos pticos (1
Ed.) Mxico: ED. Limusa 1.981.
CONLEY, Robert T. Espectroscopia Infrarroja (1a Ed.) Madrid: ED. Alambra. 1979
HARRIS, C Daniel. Anlisis qumico cuantitativo. (3a Ed.) Espaa : Editorial Reverte S.A.,
c2007.
HARVEY,David. Qumica Analtica Moderna (1a.Ed). Espaa. ED Mcgraw-Hill 2002.
E. PREST; T. Clero; J. Seibl; W. Simon. Tablas para la Elucidacin Estructural de Compuestos
Orgnicos por Mtodos Espectroscpicos (1a. Ed espaola) Madrid: ED. Alambra. 1980
EWIN, Galen W. Mtodos Instrumentales de Anlisis. (4a. ed.). Mxico: ED, Libros Mx Graw
Hill, S.A., 1978.
HAROLD F. Wallton, Jorge Reyes. Anlisis Qumico e Instrumental Moderno. (versin espaol).
Barcelona: ED. Revert, S.A, 1.978.
MARN VILLADA, Fabio. Conferencias Anlisis Instrumental. Material mimeografado UTP.
PECSOK, Robert L., y Shields, L. Donald. Mtodos Modernos de Anlisis Qumico (1a. ed.).
Mxico: ED, Limusa, S.A., 1977.
ROBERT M. Silverstein, G. Clayton Bassler. Terence, Morrill. Identifcacin Espectromtrica
de Compuestos Orgnicos (1a Ed). Mxico: ED, Diana, 1.980.
JAMES W, Robison. Principios de Anlisis Instrumental (1a. ed.). Zaragoza: ED, Acriba,
1974.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
333
RUBINSON, Kenneth A; Rubinson Judith F. Qumica Analtica Contempornea (edicin en
espaol). Madrid: ED. Pearson Education; 2001.
RUBINSON, Kenneth A; Rubinson Judith F. Anlisis Instrumental (edicin en espaol). Madrid:
ED. Pearson Education; 2001.
SKOOG, Douglas A. WEST Donald M. HOLLER F. James. Qumica Analtica (6a. Ed).
Colombia: ED Mcgraw-Hill 1.999.
SKOOG, Douglas A. LEARY, James J. Anlisis Instrumental (4a. ed ) Espaa: ED, McGraw-Hill
1.994.
SKOOG, Douglas A; Holler F James; Nieman Timothy A. Principios de Anlisis Instrumental
(5. Ed). Madrid: ED Mcgraw-Hill 2000.
SKOOG, Douglas A; Holler F James; Crouch, Stanley R. Principios de Anlisis Instrumental
(6. Ed). Mxico: ED Cengage Learning 2008.
SKOOG, Douglas A. WEST Donald M. HOLLER F. James. Crouch Stanley R. Qumica Analtica
(8a. ed). Mxico: ED Thomson 2005.
STROBEL, Haward A. Instrumentacin Qumica (1a. ed.). Mxico: Limusa, S.A., 1988
VELSQUEZ, Omar; Zuluaga Fabio. Introduccin a la espectroscopia de Infrarrojo. Publicacin
Univalle 1.987.
WILLARD, Hobart H., Merritt, Lynnel., y Dean John A. Mtodos
Instrumentales de Anlisis (7a. ed).Mxico: ED, Grupo Editorial Iberoamrica, 1.991.
334
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
335
SEPTIMA
UNIDAD
336
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
337
SEPTIMA UNIDAD
Potenciometria
Introduccin a la electro-analtica
7. Generalidades:
La electroqumica se ocupa de las interacciones entre las especies qumicas y
los campos elctricos o electrones. Los hechos ms destacados e inherentes a la
electroqumica incluyen los cambios en las propiedades qumicas.
La electro analtica se fundamenta en las propiedades electroqumicas de las soluciones
electrolticas y comprende un grupo de mtodos electroqumicos para anlisis cuantitativos
y algunos cualitativos basados en el comportamiento de la solucin de una muestra cuando
forma parte de una celda electroqumica (pila).
Los mtodos electroqumicos se suelen agrupar de la siguiente forma:
Voltaje
Intensidad
Grupo 1 Relacionan concentracin Con: Resistencia
Capacitancia
Cantidad de electricidad
Grupo 2 Hacen uso de una medicin elctrica para establecer el punto fnal
de un anlisis Volumtrico (ejemplo titulaciones potenciomtricas).
Grupo 3 Incluye los mtodos en los cuales un componente de la muestra es
convertida por una corriente elctrica en una segunda fase que es
medida despus volumtrica o gravimetricamente.
{
338
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Para la compresin de estas tcnicas, es necesario tener muy claros los conceptos, principios
y leyes en los cuales se fundamentan y han sido objeto de estudio en los cursos de qumica
general:
Soluciones electroqumicas, actividad, reacciones de oxidacin reduccin, celdas
electroqumicas, fuerza electromotriz, ley de ohm, leyes de Faraday, culombimetra, ley de
Kohlrausch, ecuacin de Nernst, y toda la terminologa utilizada tanto desde el punto de
vista de la de la qumica (electroqumica), como de la fsica (electricidad): celdas galvnicas,
celdas electrolticas, celdas reversibles, celdas irreversibles, electrodo, electrodo estndar,
ctodo, nodo, electrolito, in, anin, catin, puente salino, diferencia de potencial, tabla de
potenciales, potencial de unin, polarizacin, despolarizador, escala de actividad, faraday,
coulomb, carga elctrica, capacitancia, potenciometra, Amperometra, intensidad, resistencia,
conductividad, conductimetra, electrogravimetra, voltmetro, ampermetro, galvanmetro,
potencimetro, seguidor de voltaje, amplifcador operacional, puente de Wheatstone, fuentes
de: corriente alterna y corriente continua.
7.1 La celda electroqumica
La celda elctrica es el corazn de la Electroqumica. Cuando un metal se sumerge en
una disolucin de sus propios iones, se crea una diferencia de potencial (voltaje) entre el metal
y la solucin. La diferencia de potencial se produce por la tendencia de los tomos de metal
a pasar a la disolucin como iones, liberando electrones en el proceso. El sistema (figura
7.1) constituye una semicelda. La lmina de metal introducida en la solucin se llama
electrodo. Un electrodo es un conductor en cuya superfcie se realiza la transferencia
de electrones hacia o desde la solucin en que esta sumergido. La reaccin entre la lmina
de metal y la solucin inica puede representarse:
M
M
+
+ e
-
(7.1)
Donde M
o
es el tomo metlico neutro, M
+
un in positivo y e
-
un electrn.
Figura 7. 1 Semicelda
Esta es una reaccin de oxidacin, ya que, en el proceso, el metal ha pasado del
estado neutro a in positivo.
Iones metlicos M+
en solucin
Metl
M
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
339
En la reaccin, iones metlicos pasan a la solucin (el metal se disuelve), que se carga
positivamente. El electrodo retiene los electrones y por tanto, se carga negativamente.
Esta es una etapa de oxidacin y el electrodo se llama nodo. Tambin puede decirse
que en el nodo se produce la oxidacin del metal segn la reaccin (7.1). Conviene
destacar que la reaccin es reversible. En la prctica, se alcanza un estado de equilibrio
entre los componentes del sistema, M
o
, M
+
y e
-
. Por otra parte, la reaccin no est
restringida a sistemas en los que slo se pone en juego un electrn. En general, la reaccin
puede ponerse en la forma:
M
o
M
n+
+ ne
-
(7.2)
Donde n es un nmero entero y la semireaccin puede representarse como M
o
/M
n+
Con algunos metales el equilibrio se alcanza en sentido opuesto y los iones metlicos tienden
a pasar a tomos neutros tomando electrones en el proceso. La reaccin ser:
M
+
+ e
-
M
o
(7.3)
Esta es una reaccin de reduccin porque los iones metlicos, cargados positivamente,
pierden su carga y se convierten en tomos neutros. En este proceso, el in metlico de
la disolucin toma un electrn del electrodo y pasa al estado de tomo neutro M
o
, que se
deposita en el electrodo.
Durante la reaccin, la disolucin pierde carga positiva y se hace ms negativa; el electrodo
pierde un electrn libre (o gana un in positivo) y queda menos negativo. Este proceso
es una reduccin del in metlico y el electrodo recibe el nombre de ctodo. En el
ctodo se produce la reduccin metlica. Al igual que en las reacciones de oxidacin, los
componentes estn en equilibrio y puede ponerse en juego ms de un electrn. La reaccin,
en su forma ms general, puede expresarse:
M
n+
+ ne
-
M
o
(7.4)
Cada uno de estos sistemas constituye una semicelda y usualmente se representa como
M
n+
/M
.
No es posible, medir directamente la diferencia de potencial entre el metal y la solucin en
ninguno de los dos casos, ya que la observacin directa de una semicelda no produce seal
alguna de interaccin. Sin embargo, cuando se unen dos semiceldas, las diferencias
de potencial generadas en cada una de ellas se combinan formando una celda con una
diferencia de potencial que se manifesta por un fujo de corriente elctrica. Este es el
fundamento de una celda o pila elctrica.
La celda de la figura 7.2 denominada celda de Daniell esta constituida por 2
340
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
semiceldas. La semicelda de la izquierda donde se produce la semirreaccin de
oxidacin conformada por el nodo que puede ser una lmina o una barra de Zn y
un electrolito que es una solucin de ZnSO
4
uno molar para obtener el potencial de la
semicelda en condiciones estndar. La semicelda de la derecha donde se produce la
semirreaccin de reduccin conformada por el ctodo que puede ser una lmina
o una barra de Cu y un electrolito que es una solucin de CuSO
4
uno molar para
obtener el potencial de la semicelda en condiciones estndar. Las 2 semiceldas
estn unidas por el puente salino, que establece la conexin elctrica, es ordinariamente
un gel en el que se disuelve un electrolito inerte. As, por ejemplo, un puente salino
puede prepararse disolviendo cloruro potsico en un gel de agar caliente. La solucin,
una vez fra, se coloca en un tubo de vidrio en forma de U, obtenindose, de esta forma, una
conexin bastante resistente que, adems, presenta la ventaja de ser elctricamente inerte.
La ventaja del puente salino gelatinoso es la de prevenir la mezcla de las dos disoluciones de
las semiceldas. El circuito se completa con los cables de conexin para unir los electrodos
andico y catdico y con un voltmetro para medir el potencial el cual se ajusta a la
ley de Ohm E = IR.
Ninguna de las dos reacciones se produce ni hay paso de corriente mientras no se cierre el
circuito elctrico. La notacin convencional para representar las celdas electroqumicas
es un diagrama de celda. Para la celda de Daniell en condiciones estndar es el
siguiente:
Zn(s) Zn
2+
(1M) Cu
2+
(1M) Cu (s) (7.5)
La lnea vertical representa el lmite de las dos fases. Por ejemplo, el electrodo de zinc es el
slido y los iones Zn
2+
(del ZnSO
4
) estn en disolucin. Para representar el lmite de las fases
se traza una lnea entre Zn y Zn
2+
. La doble lnea vertical representa el puente salino. Por
convencin, el nodo se escribe primero a la izquierda y los dems componentes aparecen
en el mismo orden en que se encontraran al moverse del nodo al ctodo. Algunas veces se
suele utilizar la representacin con la actividad (a) de la siguiente manera:
Zn(s) ZnSO
4
(a
Zn
2+
=
1,00) CuSO
4
(a
Cu
2+=1,00) Cu (s) (7.6)
En la celda tpica que se muestra en la figura 7. 2 las reacciones de las semiceldas son
las siguientes:
Zn
o
Zn
2+
+ 2e andica (7.7)
Cu
2+
+ 2e
-
Cu
o
catdica
La reaccin total es: Zn(s) + Cu
2+
(ac) Zn
2+
(ac) + Cu (s), (7.8) la s entre
parntesis signifca que es un slido y la ac que es en medio acuoso.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
341
7.1.1 El Puente salino
Si en la interfase puente salino-disolucin hay una diferencia de concentracin de iones +
y -, aparece un pequeo potencial. Cuando se usa KCl, dicho potencial es muy pequeo
porque la velocidad de difusin de los iones K
+
y Cl
-
es muy parecida. La conexin elctrica
entre las dos disoluciones debe realizarse con un puente salino inerte. Si se utilizara un
hilo metlico, l mismo constituira un par de semiceldas, una en cada extremo y esto
complicara los clculos.
Figura 7. 2 Celda completa: El puente salino (un tubo en U invertido) contiene una disolucin de
KCl (o un Gel con el electrolito) que proporciona un medio conductor elctrico entre las dos disoluciones.
Los orificios del tubo en U se taponan con algodn para evitar que la solucin de KCl fluya hacia los
recipientes, al tiempo que se permite el paso de aniones y cationes. Los electrones fluyen al exterior
desde el electrodo de Zn (nodo) hacia el electrodo de Cu (ctodo), de tal manera que se transmite la
corriente elctrica.
7.1.2 Medida de potenciales de semiceldas
Se indic, anteriormente, que no es posible medir la diferencia de potencial absoluta entre la
lmina metlica y la disolucin de sus iones. Sin embargo, es posible comparar la diferencia
entre dos semiceldas. En la prctica, se requiere de un electrodo de referencia que tenga
las siguientes caractersticas: 1) Fcil de construir. 2) Que presente un comportamiento
reversible. 3) Que de potenciales constantes y reproducibles para un conjunto de condiciones
experimentales. Por estas razones se ha aceptado, por convenio, que el sistema
hidrgeno-in hidrgeno tiene, en condiciones estndar, una diferencia de
potencial igual a cero voltios. En otras palabras, la semicelda que utiliza la reaccin
2H
+
+ 2e
-
H
2
tiene un potencial de cero voltios en las siguientes condiciones:
Voltmetro
Ctodo
de cobre
nodo
de zinc
Puente salino
Cl
-
K
+
Disolucin
de ZnSO
4
Disolucin
de CuSO
4
Tapones
de algodn
El Zn se oxida a
Zn
2+
en el nodo.
Zn (s) Zn
2+
(ac) + 2e
-
Zn (s) Cu
2+
(ac) Zn
2+
(ac) + Cu (s)
Reaccin neta
El cu
2+
se reduce a Cu
en el ctodo
2e
-
+ Cu
2+
(ac) Cu (s)
e
-
e
-
SO
4
2-
Zn
2+
SO
4
2-
Cu
2+
Zn
2+
Zn
2e
-
2e
-
Cu
2+
342
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
concentracin de iones H
+
un mol por litro | | M 1 , presin del H
2
una atmsfera, temperatura
25C (o a cualquier temperatura) y se denomina electrodo de referencia de hidrgeno
o electrodo estndar de hidrgeno, abreviado EEH (observar figura 7.3) y
puede actuar como ctodo o como nodo en una reaccin. As pues, conectando la semicelda
y midiendo la fuerza electromotriz (f.e.m.) desarrollada se obtiene directamente el potencial
relativo de la segunda semicelda. Por fuerza electromotriz se entiende cualquier fuerza
no elctrica que pone en movimiento los electrones y procede de otra forma de energa
tal como la suministrada en este caso por una reaccin qumica de oxidacin reduccin.
(observar figura 7.4).
Figura 7.3 diagrama de un electrodo estndar de hidrgeno cuya representacin es
PtH
2
(P=1 Atm)H
+
( 1.00 M)
Considerando, por ejemplo, una celda formada por las dos semiceldas.
Zn
o
Zn
2+
+ 2e
-
y 2H
+
+ 2e
-
H
2
(7.9)
El potencial de la segunda es cero por defnicin. La diferencia de potencial total, medida
en condiciones estndar, es -0,763 V, cuando en el diagrama genrico de la figura 7.4 se
remplaza M por Zn y M
n+
por Zn
2+
; como el potencial de la semicelda de hidrgeno
es cero, por defnicin, resulta que el potencial de la semicelda de Zn/Zn
2+
es -0.763
V.
Puente de sal
Conexin elctrica
Electrodo de
platino
revestido
de negro platino
Gas H
2
p = 1 a tm
a
H
+
=1
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
343
Figura 7.4 Diagrama de acoplamiento de una semicelda, con el electrodo estndar
de hidrgeno para medir su potencial representada por el diagrama
M (s) M
n+
(xM) H
+
(1 M)H
2
(P=1atm)Pt
Utilizando otras semiceldas en lugar del Zn/Zn
2+
, se podrn determinar, de forma anloga,
sus potenciales (relativos). De esta forma se obtienen para las reacciones de la celda
cobre-zinc los potenciales siguientes:
Zn
2+
+ 2e
-
Zn
o
0
E - 0.763 V (7.10)
Cu
2+
+ 2e
-
Cu
o
0
E + 0.337 V (7.11)
Los potenciales estndar de reduccin se ordenan en las tablas de potenciales para varias
reacciones de semicelda (Observar tabla 7.1) y se identifcan como ) (
0
V E , el valor
0
E no se modifca por el tamao de los electrodos o por la cantidad de disolucin. En el
apndice de los libros de Qumica analtica y de instrumentacin qumica, se encuentran
tablas ms completas que la de los potenciales resumidos en la tabla 7.1.
Medidor de voltaje
Puente salino
Electrodo
metlico
H
2
(p=1 atm)
Solucinde una
sal de M
Electrodo estndar
de Hidrgeno
M
8
H
+
=1
344
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Tabla 7.1 Potenciales estndar de electrodo a 25C
La fuerza electromotriz total desarrollada por el acoplamiento de las dos semiceldas coincide
con la diferencia de los potenciales medidos independientemente, y su valor es:
0.337 (0.763) = 1.100 V (7.12)
Que corresponde con la ecuacin E
Celda
= E
Ctodo
E
nodo
(7.13)
En la reaccin, el zinc metal se disuelve formando iones zinc y liberando electrones;
simultneamente, los iones cobre consumen un nmero igual de electrones y se depositan al
estado de cobre metal.
Zn
o
+ Cu
2+
Zn
2+
+ Cu
o
1.100V (7.14)
Electrodo Semirreaccin E
0
(V)
F
-
F
2
(g),Pt F
2
(g) +2e
-
2F
-
(ac) +2.87
H
+
,H
2
0
2
Pt H
2
O
2
(ac) + 2H
+
(ac) + 2e
-
2H
2
O +1.77
H
+
,MnO4,Mn
2+
Pt MnO
4
(ac) + 8H
+
(ac) + 5e
-
Mn
2+
(ac)+4H
2
O +1.52
Cl
-
Cl
2
(g),Pt Cl
2
(g)+ 2e
-
2Cl
-
(ac) +1.36
Cr20
2-
,Cr
3+
Pt Cr
2
O
7
(ac) + 14H
+
(ac) + 6e
-
2Cr
3+
(ac) +7H
2
O +1.33
H
+
,H
2
0 0
2
(g),Pt O
2
(g) + 4H
+
(ac) + 4e
-
2H
2
O +1.19
Br
-
Br
2
(l),Pt Br
2+
(l) + 2e
-
2 Br
-
+1.07
OCl
-
,Cl
-
Pt OCl
-
(ac) + H
2
O + 2e
-
Cl
-
(ac) + 20H
-
(ac) +0.89
Hg
2+
Hg Hg
2+
+ e
-
Hg +0.85
Ag
+
Ag Ag
+
+ e
-
Ag +0.80
Fe
3+
,Fe
2+
Pt Fe
3+
+ e
-
Fe
2+
+0.77
I
-
I
2
(s),Pt l
2
(s) + 2e
-
2l
-
+0.54
Cu
2+
Cu Cu
2+
(ac) +
2e
-
Cu(s) +0.337
Cl
-
AgCl,Ag AgCl(s)
+
e
-
Ag(s) + Cl
-
(ac) +0.22
Sn
4+
,Sn
2+
Pt Sn
4+
(ac) +
2e
-
Sn
2+
+0.15
H
+
H
2
(g),Pt H
+
(ac) +
e
-
H2(g) 0.00
Pb
2+
Pb
Pb
2+
(ac) +
2e
-
Pb(s)
-0.13
Sn
2+
Sn Sn
2+
(ac) +
2e
-
Sn(s) -0.14
Fe
2+
Fe Fe
2+
(ac) +
2e
-
Fe(s) -0.44
Zn
2+
Zn Zn
2+
(ac) +
2e
-
Zn(s) -0.76
Al
3+
Al Al
3+
(ac) +
3e
-
Al(s) -1.66
Mg
2+
Mg Mg
2+
(ac) +
2e
-
Mg(s) -2.36
Na
+
Na Na
+
(ac) +
e
-
Na(s) -2.71
Li
+
Li Li
+
(ac) +
e
-
Li(s) -3.05
7
2-
1
2
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
345
El zinc metlico se ha oxidado a iones Zn
2+
y los iones Cu
2+
son reducidos a cobre metal. La
reaccin llega a su fn cuando todos los iones cobre se han depositado o todo el zinc metlico
se ha disuelto.
El zinc es el nodo y el cobre el ctodo. El ctodo de cobre se empobrece en electrones, que
son captados por los iones cobre de la disolucin. Simultneamente, el nodo de Zn tiene
un exceso de electrones por el proceso de disolucin. El exceso de electrones fuye desde
el nodo hasta el ctodo. Este fujo electrnico constituye la corriente elctrica; el exceso
de electrones en el nodo y el defecto en el ctodo son responsables de la diferencia de
potencial que persiste hasta que la reaccin cesa. Si el proceso tiene lugar en un acumulador
elctrico, la vida de ste termina cuando acaba la reaccin.
Cuando a una celda se le aplica un voltaje, el electrodo que se carga negativamente es el
ctodo; este atrae a los iones cargados positivamente que reciben el nombre de cationes.
Los iones Na
+
, Ca
2+
y Mg
2+
son ejemplos de cationes. Asimismo, el electrodo cargado
positivamente es el nodo y atrae a los iones cargados negativamente que reciben el nombre
de aniones, tales como el Cl
-
, NO2, SO .
7.2 Tipos de semiceldas
7.2.1 Metal-in metlico.
Este tipo de semicelda consiste en un electrodo metlico en contacto
con sus propios
iones.
Como ejemplos pueden citarse la de plata (cuya representacin esquemtica es Ag/Ag
+
//) y
la de calomelanos. En la semicelda de plata, la plata metlica es el estado reducido y los iones
plata la forma oxidada. Como se indic anteriormente, entre los dos estados se establece
una diferencia de potencial que es el fundamento del semielemento elctrico. El
trazo vertical (o una coma) entre Ag y Ag
+
indica que estos son los elementos de la semicelda
y que, adems, estn en contacto. La doble barra vertical indica la terminacin de la
semicelda y el punto por donde se conectar a la segunda semicelda.
7.2.2 Electrodo inerte en contacto con iones de otros elementos en
diferentes estados de Oxidacin.
En este importante tipo de semielemento los iones de un mismo elemento se encuentran
en dos estados de oxidacin distintos. As por ejemplo, la semicelda Pt/Fe
2+
Fe
3+
//
contiene hierro en dos estados de oxidacin, siendo el Fe
2+
la forma reducida y el Fe
3+
la
forma oxidada. Un material inerte, en este caso un hilo de platino, acta como electrodo
y proporciona un soporte para el intercambio electrnico. El potencial de esta semicelda
depende de las concentraciones de Fe
2+
y Fe
3+
presentes en la disolucin y su valor se
obtiene de la ecuacin de Nernst aplicada a reacciones redox.
2-
4
-
346
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
7.2.3 Electrodo gaseoso
El electrodo de hidrgeno que se presenta Pt H
2
H
+
es un ejemplo de esta clase de
semicelda. El hilo de Pt es inerte y no reacciona con el hidrgeno gaseoso ni con los iones
hidrgeno; sin embargo, acta como soporte material para ceder o captar electrones del
sistema. El potencial elctrico se desarrolla entre el hidrgeno gas, H
2
y los iones hidrgeno,
H
+
.
7.2.4 Celdas de Concentracin
En el semielemento de hidrgeno, el gas H
2
burbujea sobre un electrodo inerte (por ejemplo,
un hilo de platino) sumergido en una disolucin cida (0bservar figura 7.3). En las
condiciones defnidas convencionalmente como estndar esto es, cuando la presin del
hidrgeno es una atmsfera y la concentracin de la disolucin cida es uno molar
(abreviadamente 1 M) y a una temperatura de 25 C, el potencial de este semielemento
es cero.
Conviene destacar que la concentracin cida es uno M, porque esta concentracin
condiciona directamente la concentracin de iones H
+
. La semirreaccin es reversible y se
puede escribir as:
2H
+
+ 2 e
-
H
2
0.000V (7.15)
O bien
H
+
+ e
-
H
2
0.000V (7.16)
Cuando se une una segunda semicelda a la de hidrgeno, el voltaje total desarrollado es la
diferencia entre los potenciales de las dos semiceldas (observar figura 7.3). El voltaje
neto desarrollado, E, es numricamente igual al potencial desarrollado por el semielemento
metlico M. Es decir:
Voltaje neto E desarrollado en la celda = E (metal M)- E (hidrgeno) (7.17)
= E (metal M) 0
= E (metal M)
De esta forma ser posible medir directamente el potencial de una semicelda metlica
midiendo el voltaje desarrollado entre el metal y la semicelda de hidrgeno.
Como se indic anteriormente, el potencial de un semielemento puede obtenerse de la
ecuacin de Nernst. Recordemos, asimismo, que, por defnicin, el potencial de
una semicelda estndar de hidrgeno (1 M en iones H
+
) es cero. De la ecuacin
de Nernst se obtiene que el potencial de una semicelda de hidrgeno 0,1 M en iones
hidrgeno es +0.0591 V. Si se unieran estas dos semiceldas el voltaje desarrollado por la
celda resultante sera la diferencia entre los potenciales de ambas:
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
347
E (total) = E(H
+
= 0.1 M) E(H
+
= 1 M) = 0.0591 0 V (7.18)
El fundamento de esta celda es la diferencia de concentracin en iones H
+
de las dos
soluciones. Este tipo de celdas se conocen como celdas de concentracin.
7.3 Convenio de Signos
El signo de las semiceldas se ha defnido de varias formas y ello ha inducido a
considerable confusin. El convenio seguido en estos apuntes es el recomendado por la
Unin Internacional de Qumica Pura y Aplicada en reunin celebrada en
Estocolmo en 1953. En este convenio, las reacciones de las semiceldas se escriben
como reducciones (observar tabla 7.1). Los elementos que tienen un poder reductor
mayor que el hidrgeno, muestran potenciales negativos y los menos reductores, positivos.
As, por ejemplo, la semicelda Zn/ Zn
2+
es negativa y Cu/Cu
2+
es positiva.
7.4 Escala de Actividad: La tendencia de un metal a disolverse o
depositarse en una semicelda determina el signo y potencial de la
misma. Esta tendencia se encuentra ntimamente relacionada con la reactividad qumica
del elemento considerado. Midiendo potenciales de semiceldas en condiciones controladas
es posible ordenar los elementos en la conocida serie de actividades.
En general, los metales situados en la parte superior de la escala son ms reactivos
qumicamente y tienden a ceder electrones ms fcilmente, segn la reaccin M
o
M
+
+
e
-
. Los situados en la parte inferior son ms nobles y no ceden fcilmente electrones; en este
sentido puede decirse que sus cationes captarn electrones de los metales situados por
encima de ellos. En este proceso, los cationes pasan al estado neutro depositndose, mientras
que el metal ms activo se disuelve. A continuacin se representan estos procesos:
348
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Metal E semicelda en V Reactividad
Sr -2.89 Estos metales desplazan el hidrgeno y se disuelven en todos
Ca -2.87 los cidos, incluso en agua.
Na -2.71
Mg -2.37 Estos metales reaccionan con los cidos y con vapor de agua.
Al -1.66
Mn -1.18
Zn -0.763
Cr -0.740
Fe -0.440
Cd -0.403
Co -0.277 Reaccionan lentamente con los cidos.
Ni -0.250
Sn -0.136
Pb -0.126
H
2
0.000
Sb +0.212 Reaccionan con cidos oxidantes.
As +0.234
Bi +0.320
Cu +0.337
Ag +0.799
Hg +0.854
Pt +1.200 Reaccionan con agua regia (HNO
3
y HCl 1:3).
Au +1.420
Cuadro 7. 1 Escala de actividad de algunos metales
Metal A (activo) in metlico A
+
+ e
-
Ion metlico B
+
(noble) + e
-
metal B
Resultado neto:
A + B
+
A
+
+ B (7.19)
En resumen, los metales ms activos desplazan a los menos activos de sus
disoluciones. As, por ejemplo, si una lmina de hierro se sumerge en una disolucin de
sulfato de cobre, algo de hierro se disuelve formando iones hierro, mientras que los iones
cobre se depositan formndose una capa de cobre metlico sobre la lmina de hierro. Este
tipo de reaccin es particularmente importante cuando los iones B
+
son iones hidrgeno
en disolucin.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
349
Segn lo expuesto anteriormente, todos los elementos situados por encima del hidrgeno
en la serie de actividades son capaces de desplazarlo de la disolucin; dicho de otra forma,
estos elementos se disuelven en una solucin cida. El metal se ioniza y pasa a la disolucin;
simultneamente, los iones H
+
del cido pasan a hidrgeno gaseoso que, normalmente, se
desprende en forma de burbujas. Por el contrario, metales nobles, tales como el platino, oro,
etc., solo se disuelven en cidos oxidantes, como el agua regia (mezcla de HCl y HNO
3,
3:1).
7.5 La ecuacin de Nernst
Una reaccin qumica genera la corriente de una pila voltaica, por lo tanto el voltaje depende
de la concentracin de las sustancias de la reaccin. Las relaciones entre la energa libre
G , la energa estndar
0
G , la constante de equilibrio K , el potencial E y el potencial
estndar
0
E consideradas para la obtencin y aplicacin de la ecuacin de Nernst se
resumen en las siguientes expresiones y diagrama: Observar figura 7.5
0
G
K
Celda E
0
Reaccin en condiciones estndar
Negativo
> 1 Positivo Espontnea
0
= 1
0
En equilibrio
Positivo
< 1 Negativo No es espontnea. La reaccin es espontnea en la direccin opuesta
Figura 7.5 Relaciones entre
0
G , K y
0
E
De la termodinmica de las reacciones qumicas se concluye que la relacin entre el cambio
350
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
de potencial qumico y la concentracin da la isoterma de la reaccin:
RTLnQ G G + =
0
(7.20)
nFE G =
0 0
nFE G = re Energalib G =
Remplazando RTLnQ nFE nFE + =
0
olar ininicam Concentrac Q = (7.21)
Se ha comprobado experimentalmente que el potencial de una semicelda es funcin de
ciertas variables tales como la temperatura, la concentracin de la disolucin y el nmero de
electrones intercambiados. La relacin matemtica entre el potencial y estas variables es la
conocida ecuacin de Nernst aplicable tanto a semicelda como a celdas.
( ) olar ininicam Concentrac Ln
nF
RT
E E + =
0
(7.22)
Donde: = E Potencial de la semicelda
=
0
E Potencial de la semicelda en condiciones estndar
= R Constante (8.314 J/grado)
= T Temperatura absoluta
= n Nmero de electrones puestos en juego en la
reaccin (coincide con el cambio de valencia del metal)
= F Faraday (96493 C) C = Coulomb
Ln = Logaritmo en base e
Introduciendo los valores de R (8.314 J/grado), T (25
o
C+ 273=298K) y F (96493C)
pasando a logaritmos decimales multiplicando por 2.3, la ecuacin toma la forma:
) (
0591 . 0
10
0
olar ininicam Concentrac Log
n
E E + = (7.23)
El parntesis que sigue al signo de logaritmo quiere decir concentracin molar de.
As por ejemplo (Fe
2+
) signifca concentracin molar de in ferroso.
El proceso M
o
M
n+
+ ne
-
puede escribirse como:
Forma reducida forma oxidada + ne
-
O bien,
Red oxd + ne
-
(7.24)
Donde n es el nmero de electrones intercambiados.
RT
nF
Ln
10
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
351
Rigurosamente, el potencial desarrollado es proporcional al Ln (actividad) del in,
ms que a su concentracin molar. La actividad es igual al producto del coeficiente de
actividad( ) f por la concentracin molar del in. La ecuacin de Nernst deber
escribirse:
( ) molar cininica fConcentra Ln
nF
RT
E E + =
0
(7.25)
7.5.1 Actividad y Coeficientes de Actividad
Cuando se disuelve un soluto en agua o en cualquier otro disolvente, la estructura cristalina
se destruye y esto va aunado a una variacin de temperatura. El soluto puede disolverse
en forma de molculas, pares inicos o iones simples o complejos. Las molculas o iones
del soluto se solvatan al interaccionar con el disolvente. Al escribir las frmulas no suele
tomarse en cuenta la solvatacin, excepto en el caso del ion hidrgeno, que tiene una energa
de solvatacin inusitadamente alta y no puede existir en solucin sin estar solvatado. Por
consiguiente, en solucin acuosa existir como H
3
O
+
, el ion hidronio, pero para mayor
comodidad se escribe como H
+
y se denomina ion hidrgeno.
Los solutos pueden clasifcarse burdamente segn la capacidad para ionizar y conducir la
corriente elctrica: no electrlitos, como el azcar y la urea, electrlitos dbiles, como los
cidos y bases dbilmente ionizados, y electrlitos fuertes, como HCl o KCl que estn muy
ionizados o tal vez completamente en solucin acuosa (se sabe que el cloruro de potasio est
completamente ionizado en estado slido).
La concentracin efectiva de los iones en solucin (determinada por el abatimiento del punto
de fusin del agua, por conductividad elctrica o por otros medios) suele ser menor que la
concentracin real de los iones presentes, excepto cuando la solucin est muy diluida.
Se emplea el trmino actividad para denotar la concentracin activa o
efectiva de un ion o molcula en solucin. Es posible relacionar la actividad con
la concentracin molar mediante el coeficiente de actividad: en la ecuacin,
i
a
=
i
f
|| i
,
i
a
es la actividad del ion,
i
f es el coeficiente de actividad del ion
e || i es la concentracin molar del ion. En soluciones muy diluidas
i
f se aproxima a la
unidad; es decir, || i a
i
. A medida que la concentracin de la especie aumenta, el
coefciente de actividad disminuye y los valores de
i
a e || i divergen cada vez ms. El
coefciente de actividad de un ion cuya carga sea mayor de uno es menor que el de un ion
cuya carga sea la unidad a cualquier concentracin dada.
RT
nF
Ln
( ) molar cininica fConcentra Ln
nF
RT
E E + =
0
*
352
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Los coefcientes de actividad de sustancias no inicas son aproximadamente iguales a uno,
excepto en soluciones muy concentradas.
Existe diferencia entre la concentracin y la actividad a consecuencia de las interacciones
inicas.
En la solucin de un electrlito tanto los iones cargados positivamente como los de carga
negativa estn en movimiento. Los iones de carga igual se repelern, pero los iones de
carga contraria se atraern. Las atracciones y repulsiones no son tan fuertes en el agua
como en disolventes que tienen constante dielctrica menor, pero s existen. La mayor parte
del tiempo, el espacio alrededor de un ion positivo tendr un exceso de carga negativa y el
espacio alrededor de un ion negativo tendr un exceso de carga positiva. As el movimiento
del ion promedio (ya sea que tenga carga positiva o negativa) estar impedido en cierto
grado y no estar tan activo como un ion completamente libre. A medida que la solucin se
diluye ms, los iones en solucin se encuentran ms distanciados y tiene efectos cada vez
menores sobre los dems iones.
En soluciones infnitamente diluidas el coefciente de actividad ( f ) toma el valor de uno.
Solamente entonces se pueden igualar la actividad y la concentracin.
El coefciente de actividad ( f en la ecuacin 7.25) se aproxima a la unidad cuando la disolucin
es muy diluida y bajo estas condiciones la ecuacin (7.24) es vlida. Sin embargo, para
concentraciones ms elevadas el coefciente de actividad disminuye y es entonces necesario
introducir correcciones por este descenso.
En la ecuacin de Nernst, el metal se encuentra en su forma reducida y los iones en
la forma oxidada. Si el proceso se considera como una reaccin redox, la expresin de la
ecuacin Nernst ser:
| |
| | d
Oxd
Ln
nF
RT
E E
Re
0
+ = (7.27) Cambiando el signo se tiene:
| |
| | Oxd
d
Ln
nF
RT
E E
Re
0
= (7.28)
Siendo:
| | d Re = concentracin de la forma reducida del in metlico.
| | Oxd = concentracin de la forma oxidada del in metlico.
RT
nF
Ln
Red
Red
RT
nF
Ln
Red
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
353
Si se sustituye T por su valor a 25
C (298
K), la constante R por 8.314 J/K y se
multiplica por 2,303 para pasar de logaritmos naturales a decimales, la ecuacin (7.28)
se transforma en:
| |
| |
| |
| | Exd
d
Log
n
C J
E
Oxd
d
Log
C nX
KX KX J
E E
Re / 0591 . 0 Re
96493
303 . 2 298 / 314 . 8
0 0
=
= ,
V
C
J
= Luego
| |
| | Oxd
d
Log
n
V
E E
Re 0591 . 0
0
= (7.29)
Estas frmulas nos proporcionan una relacin muy importante entre el potencial de una
semicelda, E , y la concentracin de las formas oxidada y reducida de los
componentes de la disolucin.
Esta relacin es el fundamento de numerosas tcnicas analticas.
7.6 Potenciales Estndar
En la ecuacin de Nernst el smbolo
0
E es el potencial de la semicelda en
condiciones estndar.
Condiciones de estado estndar son las siguientes:
Un lquido o slido puro (por ejemplo, un electrodo metlico se encuentra en estado
estndar).
Un gas a presin de 1 atm. (760 mm. Hg) y 25
o
C de temperatura.
Un slido soluble en concentracin 1 M (ms exactamente, actividad unidad).
Si se compara una disolucin 1 M con una 0.01 M, el comportamiento de la disolucin ms
concentrada es menor que 100 veces el de la ms diluida.
Se dice, entonces, que la actividad de la disolucin es menor que la unidad. La concentracin
efectiva de la disolucin no es igual a su molaridad sino a la molaridad por el coeficiente
de actividad. En la prctica, la actividad se deduce por comparacin con disoluciones
muy diluidas en las que se considera que la actividad es la unidad. A concentraciones mas
elevadas, la actividad es menor que la unidad.
Una semicelda se encuentra, tambin, en condiciones estndar cuando:
Es una disolucin saturada de un soluto ligeramente soluble (por ejemplo, AgCl), o bien
Red
Red
Red
KX KX
nX
354
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Cuando es una disolucin saturada de un gas disuelto a 25
o
C y 1 atm. de presin.
Cuando | | | | Oxd d = Re y las actividades son iguales a la unidad (se tiene el denominado
potencial formal) la ecuacin de Nernst se transforma en:
1
0591 . 0
0
Log
n
V
E E =
Pero como 0 1 = Log
0
0591 . 0
0
X
n
V
E E =
Es decir,
0
E E = V
7.7 Semiceldas de referencia
Con objeto de medir el potencial de una semicelda es necesario compararla con otra y
determinar la fuerza electromotriz (f.e.m) producida por la celda completa. La segunda
semicelda acta de referencia. Aunque la semicelda de hidrgeno es la referencia estndar
en la serie de actividades y tabla de potenciales, en la prctica, no es siempre conveniente
utilizarla y, por ello, se han desarrollado otras ms estables. En principio cualquier sistema
constituido por un metal en presencia de una disolucin de sus iones podra ser utilizado en
condiciones estndar como semicelda de referencia, denominndose electrodo de
primera clase, especie u orden. Sin embargo, en la prctica, muchos metales son
poco satisfactorios; as, por ejemplo, metales como el sodio y el potasio son muy reactivos.
Otros metales, como el hierro son difciles de obtener con un grado de pureza adecuado. Las
formas inicas de algunos metales son inestables al calor o a una exposicin al aire. Con
frecuencia, suele ser difcil controlar con seguridad la concentracin del electrolito. Por todo
ello, slo unos pocos sistemas pueden ser utilizados satisfactoriamente como semiceldas
de referencia. A continuacin se estudian algunas de las semiceldas de referencias ms
comunes:
7.7.1 Electrodo de Calomelanos
Esta semicelda consta de mercurio metlico en contacto con una disolucin saturada de
cloruro mercurioso o calomelanos, Hg
2
Cl
2
. La concentracin de la disolucin en iones
cloruro se controla poniendo el calomelanos en contacto con una disolucin de cloruro
potsico de concentracin conocida, electrodos con este principio de funcionamiento suelen
denominarse electrodos de segunda clase, especie u orden. En la figura 7.6 se
muestra el electrodo de calomelanos.
Red
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
355
Figura 7.6 Electrodo de referencia de calomel (comercial tpico)
La reaccin de semicelda es: Hg
2
Cl
2
+ 2e
-
2Hg + 2Cl
-
La forma oxidada es el Hg
2
Cl
2
, y la reducida es 2 Hg + 2 Cl
-
. Aplicando la
ecuacin de Nernst se obtiene:
| |
| | Exd
d
Log
V
E E
Re
2
0591 . 0
0
=
| | | |
| |
2 2
2
2
0
2
0591 . 0
Cl Hg
Cl Hg
Log
V
E E
=
Pero como el Hg
2
Cl
2
y el Hg se encuentran en sus estados estndar, resulta:
| | | |
| | 1
1
2
0591 . 0
2 2
0
=
Cl
Log
V
E E
Red
Hg
Hg
2
Cl
2
Cl
- 2
2
Cl
-
2
2
Enchufe para contacto con pH-metro
Agujero para agregar solucin de relleno, segn sea necesario
Alambre de platino para contacto con mercurio metlico
Pasta de mercurio metlico y calomelano
Frita porosa (Frita: mineral fnamente molido y poroso)
Solucin de relleno (saturada en KCI y Hg
2
Cl
2
)
Empalme poroso para hacer contacto con la solucin a ser medida
356
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
| |
2
0
2
0591 . 0
= Cl Log
V
E E
Cuando la concentracin de la disolucin en in cloruro es 1 M y su temperatura 25
C, la
ecuacin anterior se transforma en:
V E 2812 . 0 + =
En el cuadro 7.1 se dan las especifcaciones de los electrodos de calomel de uso ms
frecuente.
Nombre Concentracin de Potencial de reduccin (V)
Hg
2
Cl
2
KCl
Saturado Saturado saturado + 0.242 - 7.6x10
-4
(t-25)
Normal Saturado 1.0 F + 0.280 - 2.4x10
-4
(t-25)
Decinormal Saturado 0.1 F + 0.334 - 7.0x10
-5
(t-25)
Cuadro 7.2 especificaciones de los potenciales de los electrodos de calomel de
referencia.
En la prctica es conveniente seguir el sistema convencional de representacin de celdas y
semiceldas. La representacin del electrodo de calomelanos es la siguiente:
Hg(L) Hg
2
Cl
2 saturado
(KCl xM)
Y acoplado con el electrodo estndar de hidrgeno su representacin es:
Hg(L) Hg
2
Cl
2 saturado
(KCl xM) H
+
(1 M)H
2
(P=1atm)Pt
Conviene destacar que en la primera semicelda el mercurio es lquido lo cual se simboliza por
L ; en la segunda semicelda (de hidrgeno) el electrodo de platino no es la forma reducida
del metal, H
2
. Por ello se pone de manifesto en la representacin.
7.7.2 Semicelda de plata Cloruro de Plata
Una semicelda de referencia tambien muy frecuente es la de plata, cloruro de plata. Consta
de plata metlica en contacto con una disolucin de cloruro de plata.
La semirreaccin es AgCl(s) + e
-
Ag (s) + Cl
-
(ac)
Cl
-
2
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
357
Representacin Ag|AgCl
saturado
KCl
saturado
El potencial de este electrodo es de 0.199 V a 25 C
Tambin se puede utilizar una semicelda de hidrgeno, pero, al igual que la de cloruro de
plata, no es tan conveniente como el electrodo de calomelanos. La semicelda de hidrgeno
que hace uso del electrodo de vidrio es muy utilizada en medidas de pH.
7.8 Potenciometria
La potenciometria est relacionada con la medida del potencial o fuerza electromotriz de una
pila elctrica. La medida del potencial requiere que el sistema se encuentre en equilibrio, es
decir, que no pase corriente, ya que, de lo contrario, el potencial medido sera distinto.
La fuerza electromotriz de una celda puede utilizarse directamente, pero es ms importante
calcular, a partir de l, el potencial de una semicelda. Esto puede hacerse acoplando la
semicelda problema con una de referencia (estndar) para formar, as, una celda
completa.
Cuando se mide la fuerza electromotriz total de las dos semiceldas, la diferencia entre este
valor y el del semielemento de referencia es el potencial de la otra semicelda. As, pues,
potencial de la celda total (observado) = potencial de la semicelda referencia + potencial de
la semicelda problema o bien,
(7.30)
La fuerza electromotriz (f.e.m) de la celda total se mide experimentalmente y los potenciales
de los semielementos estndar se encuentran en tablas de referencia. Con estos valores
conocidos se pueden calcular el potencial del semielemento problema. Las semiceldas
estndar ms comunes son la de hidrgeno y el electrodo de calomelanos. El semielemento de
hidrgeno no es de difcil manejo, pero el de referencia de calomel es slido y reproducible,
por lo que es muy adecuado para este fn.
Una vez determinado el potencial de la semicelda problema, es posible calcular la
concentracin inica de la disolucin. La relacin entre concentracin inica y potencial del
semielemento constituye la ecuacin de Nernst, que tiene la forma de la ecuacin
7.22. o bien 7.29
Donde | | | |
+
=
n
M Oxd
en la solucin
; es la concentracin de iones metlicos en la disolucin.
Para la mayor parte de los sistemas metlicos se conocen los valores de
0
E y n ; por tanto,
midiendo E , se calcula la concentracin de metal en la disolucin.
Referencia
+
Problema
| | | |
+
=
n
M Oxd
| | | |
+
=
n
MO x d
total
= E E E
358
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
7.8.1 Instrumentos para la medida de potencial
Los dispositivos para medir el potencial deben asegurar principalmente que no se
extraiga de la celda ninguna cantidad significativa de corriente. El voltaje se mide
convenientemente con cualquiera de las dos alternativas de instrumento:
1. El potencimetro, un instrumento que utiliza un voltaje igual y opuesto para compensar
el voltaje de la celda y 2. El seguidor de voltaje, que reproduce simplemente el voltaje
de la celda por medios electrnicos. El seguidor de voltaje se ha convertido en el
dispositivo de mayor uso y el potencimetro se utiliza ocasionalmente en las mediciones
de alta precisin.
Con ambos instrumentos, se extrae de la celda una corriente diminuta, en el caso del
potencimetro esta es la corriente necesaria para activar el galvanmetro que sirve para
indicar si los dos voltajes opuestos son iguales, en el seguidor de voltaje, se requiere
corriente para hacer funcionar el circuito electrnico. En cualquiera de las dos maneras
la medicin extrae menos de 10
-9
A durante el corto tiempo requerido para hacer una
lectura.
Esto puede corresponder a 10
-9
culombios o aproximadamente 10
-14
moles de materia
oxidad o reducida. Esta cantidad es tan pequea que no se afectan las concentraciones y el
potencial obtenido, es con mucha precisin, el potencial de equilibrio deseado.
La fuerza electromotriz de una celda completa se mide con el seguidor de voltaje o un
potencimetro como el ilustrado en la figura 7.7 con el valor obtenido y la ecuacin
7.30 se calcula el potencial del semielemento problema.
Para medir el potencial de una semicelda se acopla con una de referencia, formando as
la celda completa o celda muestra. Esta celda se conecta en oposicin a una batera. Si
ambas tuvieran la misma fuerza electromotriz no habra fujo de corriente. Sin embargo, la
ordenacin se hace de forma que el voltaje producido por la batera sea mayor que el de
la celda muestra. Tambin se coloca una resistencia variable en el circuito externo de la
batera. La cada de tensin en el circuito entero es constante y en cualquier seccin del
mismo ser la razn entre la resistencia de esa seccin y la resistencia total del circuito. Por
ejemplo, si la fuerza electromotriz de la celda estndar externa es 5 voltios, este valor es
constante, cualquiera que sea la resistencia del circuito.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
359
Figura 7.7 Esquema de un potencimetro: C, hilo metlico uniforme; D, batera para
suministrar un voltaje constante; G, galvanmetro; S, semicelda y V voltmetro.
Si el circuito es un hilo uniforme de 10 cm (centmetros) de longitud y su resistencia es
5 / cm, la resistencia total ser 50. Consideremos un circuito como el de la figura 7.8
y examinemos la cada de tensin en distintas partes. La cada de tensin a lo largo de los
10 cm del hilo es 5 voltios (es decir, la fuerza electromotriz de la celda externa). Si el hilo es
uniforme, la cada de tensin ser 5/10 = 0.5 V/cm de hilo. Ms exactamente si la resistencia
elctrica del hilo es 50 la cada de tensin en los extremos es de 5V, es decir. 5/50 = 0.1
voltio/ohmio.
Figura 7. 8 Circuito elctrico que ilustra la relacin entre resistencia y cada de
potencial.
Sean los puntos A, B y C situados a 1, 3 y 6 cm, respectivamente de la celda S. La longitud
de S hasta el punto A es un cm; la resistencia es 5, luego la cada de tensin ser:
5 V x 5/50 = 0.5 V
Es decir, la diferencia de potencial entre S y A es 0.5 V. De forma anloga, la cada de
potencial entre S y B ser:
5 V x 3 x 5/50 = 1.5
Voltmetro
Galvanmetro
Bateria para suministrar
un voltaje constante
Resistencia
variable (R)
A
V
B
D
C
Hilo
metlico uniforme
Semielemento acoplado
a uno referencial
S
C
B
A
S
Celda
eltrica (5 V)
Circuito elctrico
(50 ohms. de resistencia)
G
360
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
y desde S hasta C
5 x 6 x 5/50 = 3.0 V
Podemos tambin calcular la cada de potencial entre A y B.
5 V x 2 x 5/50 = 1 V
Ya que hay 2 cm de hilo desde A hasta B y la resistencia elctrica es 10; por tanto, la
diferencia de potencial entre A y B es 10 x 0.1 V = 1 voltio.
En el potencimetro de la figura 7.7 una parte del voltaje de la batera se opone al de la
celda muestra. El voltaje en oposicin modifca la resistencia del circuito hasta que los dos
potenciales sean iguales y no pase corriente. Este es el punto cero.
La batera D proporciona un voltaje, V, estable que genera una corriente a travs del circuito
DABRD. La cada de tensin a lo largo de todo el circuito es 5 V. Se vara la resistencia
R hasta que la cada de tensin entre A y B alcanza un valor conveniente, tal como 1 2 V;
en este caso supongamos que es 1V.
El voltaje en cualquier porcin del hilo AB es proporcional a su resistencia; si el hilo es
uniforme, ser tambin proporcional a su longitud. Para cualquier posicin del cursor, C,
sobre el hilo, se cumplen las relaciones siguientes:
LongitudAB
LongitudAC
B sistenciaA
C sistenciaA
encialAB Cadadepot
encialAC Cadadepot
= =
Re
Re
(7.31)
En consecuencia,
( )
LongitudAB
LongitudAC encialAC Caidadepot
V AB
=
=1
1
(7.32)
La celda completa compuesta de la semicelda problema y la estndar se conecta como se
indica en la figura 7.7. Si el voltaje de la celda S es menor que 1 voltio, ha de existir
entre A y B una posicin del cursor C para la cual el sistema est equilibrado. En esta
posicin la diferencia de potencial entre A y C en el circuito DACBD, ser igual y opuesta a
la desarrollada por la celda S y no habr fujo de corriente a travs del circuito ACS.
La posicin de equilibrio se ha alcanzado cuando el galvanmetro no indica paso de
corriente. En ese instante la diferencia de potencial entre A y C es igual y opuesta en ambos
circuitos. Es evidente que si no hay fujo de corriente en el circuito ACS, su resistencia
puede considerarse igual a cero. As, pues, la cada de tensin entre A y C ser igual
LongitudAB
LongitudAC
B sistenciaA
C sistenciaA
encialAB Cadadepot
encialAC Cadadepot
= =
Re
ReResistencia
Resistencia
AB =1V
AB Longitud AB
AC Longitud AC
LongitudAB
LongitudAC
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
361
a la diferencia de potencial en bornes de la celda S. Aplicando la ecuacin (7.32), se
obtiene que el potencial de la celda S es igual a la cada de potencial.
Combinando esta ecuacin con la (7.30) se determina el potencial de la semicelda y
aplicando la ecuacin de Nernst, la concentracin de la disolucin. Otra posibilidad es
medir el voltaje en el equilibrio con un voltmetro.
La resistencia elctrica de este aparato es muy elevada, pero siempre fuye una pequea
cantidad de corriente que puede afectar en mayor o menor grado la medida realizada. Si
la cantidad de electricidad desarrollada por la celda es muy pequea, el error relativo de la
medida puede ser considerable.
7.9 Aplicaciones
La potenciometria se utiliza en la determinacin de concentraciones inicas de metales,
cambios de concentracin, pH y reacciones redox, se expondrn algunas de estas tcnicas
analticas, para lo cual es conveniente que el estudiante repase los aspectos fundamentales
del anlisis volumtrico clsico.
7.9.1 Medida directa de la concentracin de un metal. La concentracin
inica de un metal en una disolucin puede determinarse directamente midiendo el potencial
desarrollado por una semicelda con la disolucin problema y aplicando la ecuacin de
Nernst. Para ilustracin se desarrolla el ejercicio siguiente:
Ejercicio 7.1 A una semicelda conformada por un semielemento de cobre Cu
0
/Cu
2+
y un electrodo de referencia de calomel saturado, se le midi su voltaje con un
potencimetro obtenindose un valor de 0.442V a 25C. Calcular la concentracin de Cu
2+
en la solucin.
Desarrollo:
Utilizando la ecuacin 7.30
V E
elda Totaldelac
442 . 0 =
V E
a ereferenci Electrodod
242 . 0 = Valor tomado del cuadro 7.2
oblema
E V
Pr
242 . 0 442 . 0 + =
Despejando de la ecuacin 7.30 el valor de
problema
E se tiene:
AC V X
LongitudAB
LongitudAC
AC 1 =
oblema ferencia Total
E E E
Pr Re
+ = Problema
problema
E
+
=
2
/
0
Pr
Cu Cu
Semicelda oblema
E E
Cu
0
/ Cu
2+
Referencia
+
Problema total
= E E E
362
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Aplicando la ecuacin 7.29
| |
| | Oxd
d
Log
n
V
E E
Re 0591 . 0
0
= remplazando
V E E
Cu Cu
to Semielemen
2 . 0
2
/
0
= =
+
= 0.2V, V E 34 . 0
0
= 0.337V Tomado de la tabla de potenciales 7.1
2 = n por la semirreaccin Cu
0 2
2 Cu e Cu +
+
, | | | | 1 Re = d por ser cobre metlico
toma el valor de la unidad por estar en condiciones estndar.
| | | | ?
2
= =
+
Cu Oxd Cobre en solucin forma oxidada: Se tiene:
| |
| |
+
=
2
1
2
0591 . 0
337 . 0 2 . 0
Cu
Log V Luego:
| | | |
+
=
2
1 0295 . 0 337 . 0 2 . 0 Cu Log Log V =
| | | |
+
=
2
0 0295 . 0 337 . 0 2 . 0 Cu Log V
| | | |
+
=
2
0295 . 0 337 . 0 2 . 0 Cu Log V
| |
+
+ =
2
0295 . 0 337 . 0 2 . 0 Cu Log V , | |
+
=
2
0295 . 0
337 . 0 2 . 0
Cu Log
V
,
| |
+
=
2
0295 . 0
137 . 0
Cu Log , | |
+
=
2
644 . 4 Cu Log
| |
5 2
10 26 . 2 644 . 4
+
= = X antiLog Cu 2.26 X10
-5
o | |
5 644 . 4 2
10 26 . 2 10
+
= = X Cu
2.26 X10
-5
+
=
2
/
0
Pr
Cu Cu
Semicelda oblema
E E
Cu
0
/ Cu
2+
Referencia =
oblema ferencia Total
E E E
Pr Re
+ =
Calomel
Cu Cu
ferencia Total Semicelda
E E E
Re
2
/
0
=
+
V V V 2 . 0 242 . 0 442 . 0 = =
Red
Red
Cu
0
/ Cu
2+ Semielemento
Cu
Cu
Cu
Cu
Cu
Cu
Cu
Cu Cu
Cu
Cu
Cu
10
| | | | 1 Re = d
| | | |1R e =d
| | | | 1 Re = d
| | | |1R e =d
| | | | 1 Re = d | | | | 1 Re = d
| | | |1R e =d | | | |1R e =d
| | | |1R e =d
| | | | 1 Re = d
| | | | 1 Re = d
| | | |1R e =d
| | | |1R e =d
| | | | 1 Re = d
| | | |1R e =d
| | | | 1 Re = d
| | | |1R e =d
| | | |1R e =d
| | | | 1 Re = d
| | | | 1 Re = d
total
E
| | | | 1 Re = d
| | | |1R e =d
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
363
7.9.2 Medicin del pH
16
1
7.9.2.1 Instrumentos para la medicin del pH
El instrumento de medicin de pH tiene por objeto transformar el potencial del electrodo
en una indicacin correspondiente al pH de la solucin a medir. Para este fn es necesario
adaptar el instrumento de medicin a la curva caracterstica del respectivo electrodo de
medicin del pH utilizado. En principio no importa si la informacin es indicada en forma
analgica con un instrumento de aguja o en forma digital con indicador LED (diodo emisor
de luz) o LCD (pantalla de cristal lquido). En un caso dado, simplemente la comodidad de
lectura y la exactitud de la informacin puede ser mayor a travs de un indicador digital. Sin
embargo, s existe una diferencia signifcativa entre el procesamiento del potencial en un
instrumento de medicin analgico o digital.
7.9.2.1.1 Principio de funcionamiento del pH-metro analgico
Los instrumentos de medicin del pH analgico contienen un amplifcador de alto ohmiaje
cuyas caractersticas pueden ser adaptadas a la curva del sistema de medicin en tres
puntos: un potencimetro para el punto cero, un potencimetro para la pendiente y
un potencimetro para la compensacin de la temperatura. Con el potencimetro para
el punto cero se adapta la electrnica del amplificador al punto cero del electrodo de
medicin (observar figura 7.9). Con el potencimetro para la pendiente se modifca el
factor de amplificacin del amplifcador de tal manera que corresponda a la pendiente
del electrodo de medicin. Con el potencimetro de la temperatura se modifca el factor
de amplifcacin de acuerdo a la variacin del factor de Nernst (E) debido al cambio de la
temperatura.
Para esta compensacin de la temperatura tambin puede estar adaptada una resistencia
dependiente de la temperatura o sensor trmico (por ejemplo Pt 100 o Pt 1000), ajustada
directamente al circuito amplifcador. De esta manera la compensacin de temperatura se
puede realizar de forma totalmente automtica. Se requiere aqu que la temperatura de
solucin y el valor del pH sean medidos simultneamente.
Figura 7.9 Diagrama del principio de funcionamiento del pH-metro analgico
16 Publicacin tcnica SCHOTT GERATE Apuntes de inters sobre la medicin del pH.
Pendiente
Punto cero
Compensador de
temperatura
Electrodo
Amplif-
cador
Indicacin
364
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
7.9.2.1.2 Principio de funcionamiento del pH-metro con
Microprocesador
Los equipos modernos con microprocesadores estn construidos con electrnica digital. A
un amplifcador de entrada de alto ohmiaje le sigue un transformador A/D que convierte
el potencial de medicin analgico en valores digitales. Este potencial de medicin
digitalizado es procesado por el microprocesador con los valores de calibracin y compensacin
de temperatura, igualmente digitalizados. El resultado es trasladado entonces al Display.
Mientras que en los instrumentos de medicin del pH analgico an era necesario
manipular mucho el amplifcador, la calibracin de los pH-metros con microprocesador
tiene caractersticas totalmente diferentes en el interior del instrumento.
El microcomputador trabaja matemticamente (observar figura 7.10):
dentro de ste estn almacenados los valores del pH de los tampones de calibracin
ms comunes incluyendo su dependencia de la temperatura. Basta con oprimir la tecla
para ordenar la calibracin, el microprocesador realiza automticamente la adaptacin al
electrodo. El microprocesador calcula a partir de los potenciales del electrodo de medicin, en
los diferentes tampones de calibracin, el curso de la curva caracterstica real y la compara
matemticamente con la trayectoria de la curva ideal, la cual est almacenada en la forma de
los valores de los tampones.
Las diferencias entre la trayectoria real y la ideal en las diferentes zonas de la curva caracterstica
as determinada, tpica del electrodo utilizado, son memorizadas por el microprocesador y
utilizadas durante la medicin automticamente como valores de correccin. La adaptacin
al electrodo ya no se realiza en el pH-metro con microprocesador elctricamente sino
matemticamente. De igual manera procede el microprocesador con la compensacin
de la temperatura: ste calcula simplemente la dependencia de la temperatura del factor
de Nernst. El microprocesador hace que la calibracin y la medicin sean ms rpidas,
cmodas y seguras.
Pero no se debe olvidar, que el microcomputador solamente lleva a cabo la compensacin de
temperatura segn la dependencia de temperatura del factor de Nernst almacenada.
La variacin de las isotermas de los electrodos reales con respecto a la curva ideal, por el
contrario, tampoco la puede compensar el mejor ordenador si solo dispone de la calibracin
a una sola temperatura.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
365
Figura 7.10 Diagrama del principio de funcionamiento del pH-metro con
microprocesador.
Relaciones de resistencias en el circuito de medicin.
La mayor resistencia elctrica en el sistema de medicin la tiene la membrana de vidrio
del electrodo de medicin, con cerca de 100 a 400 M. Para mediciones exactas, el
potencial del sistema no debe recaer en el electrodo, sino que debe recaer completamente en
el instrumento de medicin. La resistencia de entrada del pH-metro debe ser por lo tanto
signifcativamente mayor que la resistencia de la membrana de vidrio. Los pH-metros
modernos tienen una resistencia de entrada de 5x10
11
(observar figura 7.11).
Como valor gua para una medicin fable del pH se considera que la resistencia de entrada
debe ser por lo menos 1000 veces superior a la de la membrana de vidrio. Teniendo una
resistencia de, por ejemplo, 100M = 0.1G en la membrana de vidrio, la resistencia de
entrada del instrumento de medicin es aproximadamente 5000 veces mayor. Los pH-
metros modernos tienen por lo tanto una buena reserva. Si se compara este requisito con
la resistencia de entrada de voltmetros modernos de aproximadamente 10M, entonces
queda claro que el conectar un electrodo de vidrio a un instrumento de medicin de este tipo
prcticamente signifca un cortocircuito.
La resistencia elctrica de la solucin a medir depende de su contenido de iones. El agua
qumicamente pura posee una resistencia extremadamente alta. El error de medicin
ocasionado por esto es, incluso en soluciones con bajo contenido de iones, menor de 0.01
unidades de pH, si no hay mucha distancia entre el diafragma y la membrana de vidrio y si
hay sufciente emanacin de KCl.
Amplif-
cador
Amplif-
cador
C
o
n
v
e
r
t
i
d
o
r
A
/
D
Correcciones
U
N
(T)
Microprocesador
Memoria:
Tablas pH (T)
de los tampones
Pantalla
Electrodo
Sensor de temperatura
366
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Figura 7.11 Relaciones de resistencia en un circuito de medicin
7.9.2.1.3 Resistencia de la membrana en dependencia de la
temperatura.
Se debe tener en cuenta que la resistencia de la membrana presenta una dependencia
relativamente alta de la temperatura. Como conductor de iones, en el vidrio la resistencia
disminuye con temperaturas mayores y aumenta con temperaturas menores. La
variacin relativa de la resistencia de la membrana con la temperatura puede ser tomada
del diagrama de resistencia / temperatura (observar figura 7.12). Para determinar la
resistencia del electrodo de vidrio utilizado a la temperatura de medicin, se debe multiplicar
su resistencia nominal por el factor determinado en el diagrama. A 0C, por ejemplo, la
resistencia de la membrana de vidrio es aproximadamente 10 veces mayor que a 25C.
Figura 7.12 Resistencia de la membrana y su dependencia de la temperatura
Resistencia de
la membrana
Resistencia
del
diafragma
Resistencia de la
solucin a medir
Resistencia de la
solucin a medir
respecto a tierra
Resistencia aislante del
aparato frente a tierra
Resistencia de entrada
del aparato de medicin
Acoplamiento
capacitivo
con la red
Acoplamiento
capacitivo
Fase
Neutro de la red
-30 -20 -10 30 20 10 0 40 120 50 60 70 80 100
10
-3
10
-2
10
-1
1
10
1
10
2
10
3
F
a
c
t
o
r
d
e
c
o
r
r
e
c
i
n
d
e
l
a
r
e
s
i
s
t
e
n
c
i
a
d
e
l
a
m
e
m
b
r
a
n
a
Temperatura C
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
367
7.9.2.1.4 Conexin a tierra
El aislamiento elctrico y la conexin a tierra estn muy relacionados con las resistencias en
el circuito de medicin. Idealmente, las resistencias del aparato de medicin y de la sustancia
a medir deben ser infnitas frente a tierra. Al medir en instalaciones industriales la sustancia
est unida a tierra normalmente mediante las tuberas.
Cuando, en un caso como ste, el aparato tambin est unido a tierra, se pueden originar
medidas errneas por desvi de tensiones a tierra. Una conexin a tierra del cable
del electrodo de medicin puede llegar a provocar cortocircuito, que ms tarde destruye
el electrodo de referencia. Si el circuito de medicin est conectado a tierra a travs de
la sustancia a medir, se tiene que separar galvnicamente el circuito de medicin del
propio aparato de medicin mediante un amplifcador de separacin.
7.9.2.1.5 Blindaje.
Por medio de acoplamiento capacitivo o inductivo de los conductores de medicin con la red o
directamente por medio de irradiacin de la muestra (por ejemplo con un agitador magntico
o una placa calefactora) pueden fuir corrientes alternas en el circuito de medicin. Estas
corrientes alternas provocan una apreciable corriente continua y una indicacin inestable.
El error de medicin ocasionado as es posiblemente del orden de algunas centsimas de
unidades de pH. En caso de duda se debe medir fuera de la red, sin agitador magntico
y sin placa calefactora, con un pH-metro alimentado por bateras o acumuladores. Para
campos electromagnticos dispersos de todo tipo, el electrodo de alto ohmiaje es como una
antena. Por lo tanto, debe estar muy bien blindado al igual que el correspondiente cable de
medicin. El blindaje no debe ser interrumpido en ningn punto por reparaciones u otros.
7.9.2.1.6 Cable y conectores
De las consideraciones anteriores se originan grandes exigencias para cables y conectores
en la medicin del pH. Los cables, en lo posible, deben ser cortos y estar muy bien
blindados. Al hacer conexiones uno mismo existe el peligro de cortocircuitos o
interrupciones en el blindaje. Se recomienda por esto utilizar siempre el cable original con
los conectores originales del fabricante. En el caso de trayectos ms largos del cable, por
ejemplo en aplicaciones industriales, el peligro de infuencias por los cables es muy grande.
Debido a la alta resistencia y a la gran capacidad de cables largos se originan tambin
tiempos muy largos en la medicin. Este efecto difcilmente se diferencia de electrodos
defectuosos. Por esta razn se debe colocar un amplifcador de medicin directamente
detrs del electrodo.
Una parte de los electrodos se suministran con cables de conexin fjos soldados. Sin
embargo, muchos disponen de un sistema de cabeza de conexin para conectar los cables.
368
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Las cabezas de conexin de los electrodos y de los cables deben ser de alta calidad
para obtener mediciones del pH fable.
Malos contactos mecnicos, resistencias de paso susceptibles de corrosin, escapes de
corriente por humedad, etc. No slo pueden ocasionar errores de medicin sino tambin
destruir el electrodo.
El sistema de cabezas de conexin original (electrodos Schott-Gerate) elimina estos
errores.
Los contactos estn baados en oro y son, por lo tanto, resistentes a la corrosin. La
unin entre cable y electrodo est asegurada mecnicamente por medio de una rosca. Esta
unin de rosca est protegida contra humedad por medio de una junta anular. El blindaje
elctrico est integrado en la cabeza de conexin. En la parte exterior, la cabeza de conexin
est aislada con plstico resistente. El aislamiento hacia el contacto interior est compuesto
por PTFE (Politetrafuoretileno), altamente hidrfobo.
7.9.2.1.7 Sensores para medicin de pH
7.9.2.1.7.1 Electrodo de vidrio para pH
La membrana de vidrio como sensor de pH: Bajo la infuencia del agua, de la
superfcie de vidrio se desprenden iones alcalinos, y los puentes de xido del esqueleto de
silicato se convierten parcialmente en grupos OH
-
por medio de la absorcin de H
2
O. De esta
manera se forma una monocapa de un grosor aproximado de 500 nanmetros. Sobre los
iones hidrgeno esta monocapa acta como un intercambiador de iones: los iones alcalinos
de la monocapa se intercambian por iones del hidrgeno del agua.
Na
+
(vidrio) + H
+
(solucin) Na
+
(solucin) + H
+
(vidrio)
Si la concentracin alcalina de la solucin acuosa es pequea en algunas clases de vidrio,
se forma un equilibrio reproducible entre la solucin y la superfcie, la cual ya solamente
depende de la concentracin de iones hidrgeno en la solucin y en la monocapa.
H
+
(monocapa) H
+
(solucin)
Si dos soluciones con actividad de iones hidrgeno a
1
(H
+
) y a
2
(H
+
) se separan por medio
de una membrana de vidrio, en ambos lados de la membrana se forma un potencial de
superfcie. Ambas superfcies de la membrana se encuentran en contacto elctrico, porque la
estructura inica del vidrio es un conductor de segundo grado. Se forma un potencial total de
la membrana, el cual se puede describir de acuerdo a la ecuacin de Nernst. Este potencial
es directamente proporcional a la diferencia de los logaritmos de las actividades de los iones
de hidrgeno en uno de los lados de la membrana, nuevamente se forma un equilibrio entre
la monocapa y la solucin, y de esta manera tambin un nuevo potencial.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
369
La formacin del nuevo equilibrio solamente dura unos pocos segundos. Sin embargo, el
tiempo total necesario para la medicin del potencial alterado no depende nicamente de la
monocapa, sino entre otras cosas de la resistencia de la solucin a medir y de la electrnica
del instrumento de medicin.
Para medir este potencial de membrana, se introduce en cada una de las soluciones un
electrodo de segundo orden, a manera de electrodo de referencia. En el momento que los
potenciales de los dos electrodos secundarios sean exactamente iguales, se compensan y el
voltaje (E) medido solamente corresponde al potencial de la membrana de vidrio.
E = E
n
log [a
1
(H
+
) /a
2
(H
+
)] = E
n
[(log a
1
(H
+
) log a
2
(H
+
)] (ecuacin 7.33)
AgAgCl (Slido), TampnVidrio
Figura 7.13 Electrodo de membrana de vidrio indicador de H
+
para la medicin del pH,
C contacto para enchufar en el pH- metro, W cable blindado, B cuerpo del electrodo,
enteramente sellado, Ag Alambre de plata recubierto con cloruro de plata, S solucin
interna de referencia, tampn de pH 7, saturado con cloruro de plata; G membrana de
vidrio, sensible a los H
+
(pH).
El electrodo de vidrio utiliza la dependencia del potencial de la membrana de vidrio de
la actividad de los iones hidrgeno. En uno de los extremos de un tubo de vidrio hay fundida
una membrana esfrica de vidrio como sensor del pH. Esta esfera se encuentra rellena
con una solucin tampn con un pH conocido. En esta solucin tampn, que adems
Ag
C
W
B
S
G
370
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
contiene un electrlito (por lo general kCl), est sumergido un electrodo referencia.
Para la medicin del pH se utiliza la diferencia de potenciales entre la superfcie interior y
la exterior de la membrana de vidrio. Este potencial del electrodo de vidrio (E) es directamente
proporcional a la diferencia del pH entre el tampn interno y la solucin a medir.
E = E
n
(pH
interior
pH
solucin a medir
) (ecuacin 7.34)
Figura 7.14 estructura bsica de un electrodo de vidrio
En la figura 7.14 hay un corte de un electrodo tpico de vidrio. En la punta del tubo interno
de vidrio, que es de vidrio qumicamente inerte y de alto ohmiaje, se encuentra una membrana
esfrica hecha de un vidrio especial sensible al pH, generalmente compuesta por: un 22%
de Na
2
0, 6% de Ca0, y 72% de SI0
2
, en algunas otras formulaciones se sustituyen los iones
sodio y calcio a diversos niveles por iones litio y bario para dar una selectividad superior a
pH elevados. El tubo interno y la esfera contienen el tampn interno, una solucin de KCl
que es 3.5 molar y est tamponada a pH 7.00, la cual, adems, hace las veces de electrlito
del sistema secundario.
7.9.2.1.7.2 Electrodo de referencia
El electrodo de referencia explicado en el numeral 7.7.1. Cuyo potencial permanece
constante y su diagrama esta representado en la figura 7.6 es un electrodo de segunda
clase en el cual estn implicadas dos interfases, como un metal recubierto con una capa de
una de sus sales poco solubles; esta constituido por un sistema que puede ser Hg/Hg
2
Cl
2
,
Ag/AgCl o Tl/TlCl (talio-cloruro de talio) en un electrlito de solucin concentrada
de KCl (3.5 mol/l). El diafragma crea un contacto elctrico con la solucin a medir. Es de baja
permeabilidad, para que el electrlito no se vierta muy rpido. Por convencin el electrodo
de vidrio es el ctodo y el de referencia el nodo.
electrodo
secundario
pH
Solucin a
medir
tampn interior
con electrlito
KCI
pH
interior
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
371
La celda que se forma para la medicin del pH conformada por los electrodos y la solucin
a medir se representa de la siguiente manera:
AgAgCl (S), TampnVidrioSolucin de pH desconocidoKCl (saturado), Hg
2
Cl
2
(s)Hg (L)
-------------------------------- ------------------------------------
Electrodo de vidrio Electrodo de referencia
7.9.2.1.7.3 Electrodos combinados
Para medir el pH se requiere un sistema compuesto por un electrodo de vidrio (electrodo
de medicin) y un electrodo de referencia. El electrodo de referencia est en contacto con la
solucin a medir por medio de un diafragma, de tal manera que el circuito elctrico se cierra
a travs de la solucin a medir.
El sistema secundario del electrodo de vidrio y del electrodo de referencia deben estar
sincronizados entre s.
Por tal razn es conveniente combinar en una sola unidad (electrodo combinado)
el electrodo de medicin y el electrodo de referencia. Algunos electros combinados traen
incorporado el sensor de temperatura. De esta manera se logra que el espacio utilizado en
una medicin sea mucho menor. Observar la figura 7.15 que representa el corte de un
electrodo combinado tpico.
El electrodo de vidrio de un electrodo combinado no requiere de un blindaje metlico, ya que
el electrlito de bajo ohmiaje del electrodo de referencia lo envuelve.
Figura 7.15 Esquema de un electrodo combinado para la medicin del pH
Conectores de
referencia
pH
Cubierta del agujero
de llenado
Agujero
de llenado
Hilo de referencia
Ag/AgCl
Hilo de Ag/AgCl
Puente salino
de frita, (Frita: mineral
fnamente molido y poroso)
Sensor de vidrio
para pH
372
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
7.9.2.1.7.4 Potencial del electrodo combinado (E): el potencial de un electrodo
combinado para medicin del pH se compone de seis potenciales diferentes:
El potencial del sistema secundario en el electrodo de vidrio (E
1
)
El potencial en la superfcie interior de la membrana (E
2
)
El potencial asimtrico de la membrana de vidrio (E
3
)
El potencial en la superfcie exterior de la membrana (E
4
)
El potencial de difusin en el diafragma (E
5
)
El potencial del electrodo de referencia (E
6
)
E = E
1
+ E
2
+ E
3
+ E
4
+ E
5
+ E
6
(ecuacin 7.35)
Para poder obtener el potencial de la membrana (E
2
+ E
4
) necesario para la determinacin
del pH, se tienen que medir forzosamente tambin los dems potenciales (E
1
,E
3
,E
5
,E
6
).
Si se logra mantener constantes estos potenciales, al hacer la medicin stos se pueden
compensar electronicamente. Pero como E
1
, E
3
, E
5
y E
6
dependen tambin de la
temperatura, de la concentracin de electrlitos y del mismo pH, en algn caso se pueden
convertir en potenciales perturbadores. En los buenos sistemas de medicin los
electrodos son construidos de tal manera que estos potenciales sean mnimos.
Por este motivo, las posibles variaciones prcticamente no alteran el resultado. Bajo la
condicin de un minucioso mantenimiento y calibracin de los electrodos de medicin, la
exactitud y reproducibilidad de la medicin del pH prcticamente no se alteran.
- Potencial de asimetra: La causa que origina el potencial de asimetra (E
3
) es la
diferencia de superfcies de las dos membranas de vidrio. Ni su rea, ni su forma, ni su
estado inicial son algunas veces idnticas. Aunque el pH en ambos lados de la membrana
sea idntico, el potencial total en la membrana nunca es igual a cero. Pero si los electrodos
provienen de una produccin que admite pocas tolerancias y si poseen una monocapa bien
desarrollada, el potencial de asimetra es de slo unos pocos mV. Esto equivale a unas
centsimas del pH lo cual se puede tener en cuenta en la calibracin del electrodo.
- Potencial de difusin: Una causa de problemas puede ser el potencial de difusin
(E
5
). Este es el resultado de diferentes velocidades de difusin de las distintas clases de
iones. Si, por ejemplo, una solucin de cido clorhdrico limita con una capa de agua pura,
los iones H
+
y los iones Cl
_
pasan al agua pura con diferentes velocidades. Los iones H
+
en este caso se difunden mucho ms rpido que los iones Cl
_
. De esta manera surge una
separacin de la carga negativa y de la positiva y se crea un potencial elctrico. Para otras
clases de iones, por ejemplo entre los iones K
+
y los iones Cl
_
, las diferencias en la velocidad
de difusin son mnimas, y slo se forma un potencial de difusin mucho menor.
Tambin en el diafragma del electrodo de referencia se encuentra un rea de separacin entre
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
373
soluciones de diferentes concentraciones de iones. Sin embargo, en general, fuye siempre
un poco de electrlito KCl a travs del diafragma a la solucin debido a la sobrepresin. Por
esta razn, los iones de la solucin a medir nicamente pueden difundir contra este fujo de
KCl. Debido a que el electrlito en el diafragma se renueva constantemente por el continuo
fujo hacia fuera, no se puede formar en l un potencial de difusin signifcativo de los iones
de la solucin a medir. En las inmediatas cercanas del diafragma se difunden los iones K
+
y
los iones Cl
_
del electrlito de referencia saliente entre los iones de la solucin a medir y en la
prctica mantienen bajo el potencial de difusin. Si por ejemplo, la solucin a medir es cido
clorhdrico, el potencial de difusin disminuye bastante por efecto del KCl saliente.
La difusin contraria de los iones K
+
cargados positivamente compensa la mucho ms veloz
difusin de los iones H
+
. Hay problemas si, por ejemplo, en un diafragma obstruido el fujo de
KCl es muy pequeo. El potencial de difusin puede crecer tanto que provoque desviaciones
de 0.1 unidades del pH y an ms.
- Potencial del sistema de electrodos bajo condiciones ideales: Si se
utilizan electrodos con sistema secundario y sistema de referencia iguales, sus potenciales E
1
y E
2
prcticamente tienen el mismo valor. Ambos potenciales se anulan, ya que tienen signo
contrario. El potencial E
3
puede, como ya se ha mencionado, ser compensado por medio
de la calibracin; E
5
se puede mantener sufcientemente pequeo para ser despreciable por
medio de un fujo sufcientemente grande de KCl. Bajo condiciones ideales el potencial del
sistema de electrodos depende nicamente de la diferencia de potenciales entre la superfcie
interna de la membrana (E
2
) y la externa (E
4
).
E = E
2
+ E
4
= E
n
(pH
interno
pH
solucin a medir
) (ecuacin 7.36)
- Curva caracterstica ideal del sistema de electrodos: La relacin entre
el pH de la solucin a medir y el potencial (E) del electrodo de medicin del pH se puede
representar en un diagrama E/pH. Bajo condiciones ideales el potencial del electrodo de
medicin del pH corresponde a una ecuacin lineal. La ecuacin ideal es entonces una
recta en el diagrama E/pH. La pendiente de la ecuacin a 25 C es de 59.16 mV/pH,
correspondiente al factor de Nernst (E
n
). El potencial medido es entonces el producto entre
E
n
y la diferencia del pH entre el tampn interno y la solucin a medir. Si el pH del tampn
interno es 7.00, entonces al medir una solucin con un pH de 7.00 a 25 C la diferencia
del pH es tambin 0.00. La ecuacin ideal atraviesa el eje de 0 mV para una solucin
a medir con un pH de 7.00 {E = 59.16 x (7.00-7.00) = 0.00}. Si por ejemplo,
una solucin a medir tiene un pH de 13.00, el potencial medido es de 354.96 mV
{E=59.16 x (7.00-13.00)}. Si la solucin a medir tiene por ejemplo un pH de 5.00 el
potencial es de 118.32 mV {E=59.16 x (7.00-5.00)}, etc.
374
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Figura 7.16 Curva caracterstica ideal del sistema de electrodos, que muestra la
ecuacin ideal del electrodo de medicin a 25C
- No-linealidad: Error cido y error alcalino.
Los electrodos de medicin cuyos puntos cero y su pendiente corresponden a la ecuacin
ideal, muestran en el rango fuertemente cido y en el rango fuertemente bsico
una desviacin del recorrido lineal. El llamado error cido para valores de pH muy
pequeos conlleva a que indiquen valores del pH demasiado altos, es decir, que el potencial
del electrodo de medicin es demasiado negativo. La causa de este error cido es la
incorporacin de molculas cidas en la monocapa, es decir, la alteracin de la actividad del
agua. Sin embargo, el error cido en los vidrios para pH modernos es tan pequeo que
en la mayora de los casos se puede obviar. El llamado error alcalino para valores de
pH muy grandes conlleva que se indiquen valores de pH demasiado bajos, es decir, el
potencial del electrodo de medicin es demasiado positivo. La razn del error alcalino es
el intercambio de iones alcalinos entre la monocapa y la solucin a medir. Este intercambio
entra a competir apreciablemente con los iones del agua para valores mayores que 11.
Ambos efectos, el error cido y el error alcalino, dependen mucho de la clase de vidrio
de la membrana. En los vidrios de las membranas modernas el error alcalino solamente
aparece si la solucin a medir con valores de pH altos contiene cantidades elevadas de iones
de sodio o de iones de litio.
Adems de los errores cidos y alcalinos, tambin las dems condiciones en los
electrodos de medicin reales no corresponden a los requisitos tericos para una validez
exacta de la ecuacin de Nernst. Ya que los potenciales E
1
, E
6
y E
3
no se pueden
ignorar totalmente, el punto cero del electrodo de medicin sin una calibracin nunca va a
corresponder al pH del tampn interno.
Tambin la pendiente de los electrodos de medicin reales nunca va a corresponder
P
o
t
e
n
c
i
a
l
d
e
l
s
i
s
t
e
m
a
E
[
m
V
]
pH de la solucin a medir
Pendiente 59.16 mV/pH
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
375
exactamente al valor terico del factor de Nernst. En los electrodos de medicin reales
el punto cero y la pendiente se separan ligeramente del recorrido ideal de la ecuacin. Los
electrodos recin fabricados y almacenados correctamente mantienen estable por un tiempo
prolongado la ubicacin del punto cero. Adems la pendiente corresponde por lo menos
al 98% de la pendiente ideal. Sin embargo, tambin se debe tener en cuenta que los
buenos electrodos envejecen, es decir, que el punto cero y la pendiente se alteran por uso y
almacenamiento.
El potencial del electrodo de medicin del pH vara con la temperatura. Esta dependencia
de la temperatura del potencial medido se basa principalmente en el factor de Nernst
(E
n
). Este vara entre 54.20 mV/pH a los 0 C y 74.04 mV/pH a los 100 C.
Esta alteracin del la pendiente del electrodo de medicin causada por el factor de
Nernst se ajusta por medio de la compensacin de temperaturas durante la calibracin y la
medicin. La amplifcacin del instrumento de medicin ajusta la pendiente para compensar
la modifcacin debida a la variacin de la temperatura.
En los electrodos de medicin reales y a la vez envejecidos no slo, como ya se mencion
anteriormente, el punto cero no corresponde exactamente al pH del tampn interno, sino
que, adems la ubicacin del punto cero depende de la temperatura. A esto se le suma que
la pendiente del electrodo de medicin no corresponde exactamente a la dependencia de la
temperatura del factor de Nernst (E
n
). Si se toman los potenciales de un electrodo de
medicin a diferentes temperaturas se obtiene para cada temperatura la curva propia. Estas
isotermas no se cortan en el eje de 0 mV con la curva ideal, sino en un punto de
corte isotrmico. El punto de corte isotrmico se aparta bastante del punto cero de
la curva ideal.
7.9.2.1.7.5 Necesidad de la calibracin.
Las diferencias entre las curvas caractersticas reales de los electrodos de medicin de pH
y las curvas ideales crean la necesidad de calibrar. Si el pH indicado por el instrumento de
medicin debe corresponder al pH real de la solucin a medir, se requiere que la electrnica
del instrumento de medicin cumpla con dos requisitos: el punto cero electrnico y
el factor de amplifcacin deben estar ajustados al punto cero, y a la pendiente de la curva
del electrodo del pH utilizado. Para calibrar la electrnica del instrumento de medicin al
electrodo del pH utilizado se utilizan tampones de calibracin con valores de
pH conocidos.
El factor 0.0591V (factor de la ecuacin de Nernst), representa la pendiente, S, de la
grfca de calibracin a 25C. No se debe confar en que la pendiente tenga precisamente
este valor ideal y para una mayor exactitud en la medicin, se debe calibrar el medidor de pH
mnimo con dos soluciones tampn a fn determinar el valor correcto de S.
376
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
2 1
1 2
Tampn Tampn
Tampn Tampn
pH pH
E E
S
=
Y validar as la escala de medicin del pH -metro
Para contrastar instrumentos de medicin del pH, y para muchos otros fnes, conviene utilizar
en la prctica soluciones tampn suministradas por las casa productoras de reactivos, las
cuales garantizan su preparacin y estn listas para el uso, Esto es rpido, seguro y cmodo,
y evita errores posibles al preparar las soluciones, por ejemplo, a causa del agua utilizada.
Cuatro soluciones tampn listas para ser utilizadas y ofrecidas comercialmente, con especial
constancia de pH por su composicin qumica y ajuste del pH de las soluciones tampn con
valores de pH referidos a 20C son las siguientes:
Solucin estndar de acetato pH 4,62 (0,2 M), solucin-tampn.
La solucin contiene 6,005 g de cido actico (CH
3
COOH) y 8,204 g de acetato sdico
(CH
3
COONa) por litro.
Fosfato en solucin pH 6,88 (0,025 M), solucin-tampn.
La solucin contiene 4,450 g de fosfato disdico (Na
2
HPO
4
2H
2
O) y 3,400 g de fosfato
monopotsico (KH
2
PO
4
. 2H
2
O) por litro.
Borato en solucin pH 9,22 (0,01 M), solucin-tampn.
La solucin contiene 3,81 g de tetraborato sdico (Na
2
B
4
O
7
. 2H
2
O) por litro.
Fosfato sodio hidrxido en solucin pH 11,00 (0.025 M), solucin tampn.
La solucin contiene 4.450 g de fosfato disdico (Na
2
HPO
4
. 2H
2
O) y 0,136 g de hidrxido
sdico (NaOH) por litro.
Las variaciones del pH a otras temperaturas se indican en la tabla 7.3
pH pH
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
377
Tabla 7.2 Correcin del pH de las soluciones tampon por efecto de la
temperatura
- Consecuencias para la exactitud en las mediciones: Si se calibra un
instrumento de medicin a cierta temperatura y luego se mide con el mismo electrodo a
temperaturas diferentes de la calibracin, la compensacin de temperatura simplemente
adapta la pendiente a la modifcacin terica el factor de Nernst. Pero en la realidad ni el
punto cero ni la pendiente se adaptan completamente, lo cual puede llevar a errores de
medicin. Para rangos de temperatura normales esto no juega un papel importante midiendo
con electrodos de buena calidad. Si se requiere una alta precisin en las mediciones con
temperaturas bastante diferentes, se debe calibrar el electrodo de medicin para cada una
de las temperaturas a medir con tampones a la misma temperatura.
Solamente as se asegura que el punto cero y la pendiente de la electrnica del instrumento
de medicin correspondan exactamente a la curva del electrodo de medicin.
7.9.2.2 Medicin del pH
La medicin del pH es fcil de llevar a cabo gracias a la fcilidad para adquirir en el comercio los
electrodos y medidores de pH de estado slido de bajo costo que confguran los instrumentos
modernos diseados para tal fn.
Bajo las consideraciones anteriores es de gran importancia que el pH se defna de tal manera
que su medicin en cualquier momento y laboratorio del mundo se realice de la misma forma.
Para satisfacer este requisito, es necesario defnir el pH en trminos operativos, solo as el
pH medido por un analista ser el mismo que el obtenido por otro.
Temperatura
(C)
15
20
25
30
35
40
45
50
55
60
70
Estandarizada de
Acetato
(pH 4,62)
+0,01
.0
-0,02
-0,01
0
+0,01
+0,02
+0,04
+0,05
+0,07
+0,09
Fosfato
(pH 6,88)
+0,02
0
-0,02
-0,03
-0,04
-0,04
-0,05
-0,05
-0,04
-0,04
-0,03
Borato
(pH 9,22)
+0,05
0
-0,04
-0,08
-0,12
-0,15
-0,18
-0,21
-0,23
-0,26
Fosfato y sodio
hidrxido
(pH 11,00)
+0,08
0
-0,10
-0,20
-0,29
-0,38
-0,47
-0,58
-0,65
-0,75
pH
Solucin tampn
D
378
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
El National Institute of Standards and Technology (NIST) y la IUPAC, recomienda una defnicin
operacional del pH que se basa en la calibracin directa de un pH-metro con amortiguadores
estndar cuidadosamente establecidos seguido de la determinacin potenciomtrica del pH de
la solucin problema.
Como ejemplo cuando el sistema de electrodos vidrio/calomel se sumergen en un
amortiguador estndar se aplica la ecuacin:
0592 . 0
K E
pH
s
s
= (ecuacin 7.37)
Donde E
s
es el potencial de la celda cuando los electrodos se sumergen en el amortiguador,
de manera similar si el potencial de la celda es E
u
, cuando los electrodos se sumergen en una
solucin de pH desconocido, se tiene:
0592 . 0
K E
pH
u
u
= (Ecuacin 7.38)
Restando la ecuacin (ecuacin 7.37) de la (ecuacin 7.38) y despejando pH
u
se
obtiene:
0592 . 0
) (
s u
s u
E E
pH pH
= (Ecuacin 7.39)
La ecuacin (ecuacin 7.39) se ha adoptado en todo el mundo como la
definicin operacional de pH.
En la defnicin del pH se tiene en cuenta la mutua accin recproca de los iones en una
solucin acuosa. Esta accin recproca lleva consigo que la concentracin efectiva sea
diferente de la nominal. Esta concentracin efectiva, la actividad, depende de la cantidad
total de iones disueltos.
Por tal razn, siempre se mide la actividad de los iones hidrgeno a
H
+
en vez de la
concentracin [H
+
]
a
H
+
= f
*
[H
+
]
El pH medido en la prctica es en realidad el logaritmo decimal negativo de la actividad de
los iones hidrgeno.
pH = -log a
H +
La concentracin de los iones hidrgeno | |
+
H en una solucin acuosa es una medida para
saber lo cida o bsica que es. Para la acidez se puede crear una escala, la cual se
pH
pH
pH pH
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
379
inicia con una concentracin inica de hidrgeno de 1 mol/l y termina con 10
-14
mol/l.
Los extremos de la escala corresponden, por una parte, a una solucin acuosa ideal de un
cido 1M 100% disociado y por otra parte, a una base 1M 100% disociada.
Sin embargo, para la medicin de la acidez no se toma la concentracin, sino un valor
logartmico, el pH. El pH es directamente proporcional al logaritmo decimal negativo de la
concentracin de iones hidrgeno. (La denominacin pH proviene del latn y es la abreviacin
de (Potentia Hydrogenii).
| |
+
=
H
Log pH
1
o bien | |
+
= H Log pH (Ecuacin 7.40)
El pH es una medida logartmica, ya que la medicin del pH potenciomtrica se basa
en las leyes logartmicas.
En la prctica esto signifca que una variacin en un factor de 10 de la concentracin de los
iones hidrgeno genera una variacin de 1.0 unidad en la escala de pH.
Es bueno recordar que el pH de soluciones en las que la concentracin de
+
H es: a. 1 x 10
-4
, b. 2 x 10
-3
, c. 5.5 x 10
-8
se calcula segn la ecuacin (ecuacin 7.40) as:
a. pH = -log (1 x 10
-4
) = -(-4.0) = 4.0
b. pH= -log (2 x 10
-3
) = -(log 2 + log 10
-3
) = -(0.3 3.0) = 2.7
c. pH = -log (5.5 x 10
8
) = -(log 5.5 + log 10
-8
) = -(0.74 8.0)=7.16
El potencial medido en la determinacin del pH para relacionarlo con la concentracin de
| |
+
H esta determinado por el siguiente clculo:
a ereferenci electrodod ndicador electrodoi celda
E E E + = ecuacin 7.30
luego
a ereferenci electrodod celda ndicador electrodoi
E E E =
a ereferenci electrodod celda
H
ndicador electrodoi
E E E E = =
+
Aplicando la ecuacin 7.29 para hallar E
lctrodo indicador
tenemos:
| |
| |
| |
| |
| | | | | |= = = =
+
+ +
+
H
n H
Log
n H
H
Log
n
H E E
H
log 1 log
059 . 0 1 059 . 0
0
059 . 0
2
2
0
| | | |
+
H Log
n
059 . 0
de donde | |
+
=
+
LogH
n
V
E
H
059 . 0
pH
pH
| | | | 1 Re = d
| | | |1R e =d
| | | | 1 Re = d
| | | |1R e =d
| |
+
=
+
LogH
n
V
E
H
059 . 0
| |
+
=
+
LogH
n
V
E
H
059 . 0
| |
+
=
+
LogH
n
V
E
H
059 . 0
| |
+
=
+
LogH
n
V
E
H
059 . 0
| | | | 1 Re = d
| | | |1R e =d
| | | | 1 Re = d
| | | |1R e =d
380
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Remplazando | |
a ereferenci electrodod celda
E E LogH
n
V
=
+
059 . 0
| |
( )
V
n E E
n
V
E E
LogH
a ereferenci electrodod celda ereferncia electrodod celda
059 . 0
059 . 0
=
=
+
| |
( )
V
n E E
LogH
a ereferenci electrodod celda
059 . 0
=
+
multiplicando a ambos lados por -1 se tiene:
| |
( )
059 . 0
n E E
LogH
erencia electroref celda
=
+
Pero | | pH LogH =
+
entonces
( )
059 . 0
n E E
pH
referencia celda
=
Segn el convenio de signos el electrodo de vidrio (indicador de iones H
+
), ser
siempre el ctodo, y el electrodo de referencia ser el nodo y el potencial de celda es
nodo ctodo celda
E E E = ecuacin (7.13) estrictamente es
j nodo ctodo celda
E E E E + =
donde
j
E es el potencial de unin.
Partiendo de la ecuacin (7.13) y haciendo el desarrollo matemtico se llega a la expresin
| |
059 . 0
n E E
pH
anodo celda
+
= donde
nodo
E es el electrodo de referencia, la diferencia
de signos en las dos ecuaciones para
celda
E tiene una consecuencia importante para la
conexin del electrodo indicador en el instrumento de medicin con relacin a la polaridad de
los terminales positivo y negativo del pH-metro.
7.9.3 Partes del potencimetro medidor de pH anlogo o digital:
Los medidores de pH de lectura directa, en su mayora bsicamente tienen mucho en comn,
aunque pueden presentar los mandos y controles dispuestos de manera diferente.
Un medidor de pH para laboratorio debe tener como mnimo independiente de su marca o
modelo, fundamentalmente los siguientes controles:
1. Conexin a la red, todos los equipos disponen de un cable de conexin a la red, para
ser alimentados con 110V con su respectiva clavija la cual dispone de tres entradas,
una para la fase, otra para el neutro y una tercera para tierra. Hay diseos porttiles
alimentados con bateras para trabajos en el campo.
pH
pH
pH
| |
a ereferenci electrodod celda
E E LogH
n
V
=
+
059 . 0
| |
a ereferenci electrodod celda
E E LogH
n
V
=
+
059 . 0
| |
a ereferenci electrodod celda
E E LogH
n
V
=
+
059 . 0
| |
a ereferenci electrodod celda
E E LogH
n
V
=
+
059 . 0
| |
a ereferenci electrodod celda
E E LogH
n
V
=
+
059 . 0
| | | | 1 Re = d
| | | |1R e =d
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
381
2. Algunos aparatos disponen de un interruptor el cual es necesario accionar para que la
corriente elctrica circule, otros modelos no disponen de interruptor y cuando se conecta la
clavija a la red, la corriente circula por l inmediatamente. Como ocurre con la mayora de
los equipos electrnicos, es bueno mantener el instrumento conectado y caliente,
a no ser que, se vaya a dejar fuera de uso durante varios das. En climas hmedos es
todava ms recomendable conservar el equipo caliente.
3. Algunos equipos, disponen de un control, el cual permite mantener la parte electrnica en
calentamiento y los electrodos desconectados del circuito. Lo cual protege el instrumento
de lectura anlogos cuando se instalan los electrodos, se cambian o se sacan de la
solucin. Es necesario entonces accionarlo cuando se va a realizar la medicin.
4. Compensador de Temperatura. Los potencimetros medidores de pH, disponen
de un mando que permite ajustar el aparato a la temperatura de la solucin problema,
con un error mximo de 1 a 2 grados. Generalmente los equipos preveen la posibilidad
de conectar un sensor automtico de temperatura (ATC compensador automtico de
temperatura) que se coloca en la solucin a ensayar o viene incorporado al electrodo,
como un termmetro que automticamente mantiene ajustado el instrumento cuando
vara la temperatura de la solucin problema.
5. Instrumento de Lectura. Puede ser un voltmetro con su escala graduada
en unidades de pH y mv, un display o pantalla para lectura digital, o un
registrador que traza la grfca. La escala de mv generalmente (+ 700 y + 1400),
se utiliza normalmente cuando el electrodo de vidrio es sustituido por un electrodo de
plata, platino o un electrodo de iones selectivo; pero no hay obligacin de hacerlo, si
se desea, se puede seguir utilizando la escala de pH, recordando que esta es tambin
una escala de mv pero en la que una divisin en unidad de pH abarca 59.16 mv (a
25C).
Otros equipos disponen de conmutadores o teclas los cuales al ser pulsados, permiten
trabajar en diferentes rangos de pH y mv, que cubren escalas ms estrechas o ms
amplias para precisar las lecturas cuando es necesario.
6. Control para Estandarizacin. Con este mando se puede desplazar la aguja del
medidor en ambos sentidos a lo largo de la escala, o la lectura digital permitiendo ajustar
la lectura al valor necesario. En las mediciones de pH ste mando se utiliza para calibrar
la escala haciendo que el medidor seale el pH correcto correspondiente a la solucin
tampn o patrn empleado.
En los pH metro que trabajan con microprocesador como el de la figura
7.17 la seleccin del parmetro a medir se hace con la tecla de funcin setup y la
estandarizacin con la tecla de funcin (std), el cual reconoce automticamente los
tampones de calibracin y hace la compensacin de temperatura, dando despus de la
calibracin un mensaje de buen electrodo (Good Electrodo) si ha sido exitosa, o
382
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
error de electrodo si esta ha fallado.
7. Control para Ajuste de la Pendiente. Los pH-metro vienen equipados con
un control para ajuste de la pendiente, el cual se usa para compensar defciencias del
electrodo mediante la utilizacin de un segundo tampn, lo cual se consigue girando la
perilla hasta la concordancia con el valor del pH correspondiente.
8. Electrodos. Generalmente dispone de dos electrodos, uno denominado de membrana
de vidrio sensible a los iones H
+
y otro de referencia, el cual comnmente es el electrodo
de Calomel o un electrodo de plata cloruro de plata. Algunos otros equipos vienen provistos
de un solo electrodo el cual contiene el electrodo de vidrio y el de referencia, denominado
electrodo combinado, vienen para cubrir diferentes rangos de pH y temperatura
como tambin con diseos especiales para mediciones de pH segn el tipo de muestra.
Los electrodos de vidrio estn cerrados hermticamente y pueden guardarse secos sin
precauciones especiales, excepto la de evitar que se raye el bulbo de vidrio sensible a
los iones H
+
. Cuando el uso es frecuente se recomienda conservarlo sumergidos en agua
destilada, para que la membrana sensible permanezca completamente hidratada, con el
propsito de obtener un buen contacto con la sustancia problema. Electrodos combinados deben
guardarse en solucin de KCl 3.5 M.
Un electrodo de vidrio seco debe sumergirse en agua destilada durante media hora como mnimo
antes de su uso.
Los electrodos de referencia (calomelanos) no estn cerrados hermticamente. Deben
guardarse llenos de solucin saturada de cloruro de potasio (3.5M). Cuando estos electrodos
se hallan en uso, el nivel de solucin en su interior debe ser ms elevado que el nivel de solucin
problema en estudio. La anilla de goma o collar de vidrio de la parte superior debe correrse
hacia arriba o hacia abajo, o girarse con el objeto de dejar abierto el orifcio de llenado, de modo
que el cloruro de potasio pueda fuir libremente hacia afuera a travs de la unin porosa o de
frita (termino utilizado para caracterizar minerales fnamente molidos). Dicho orifcio debe
mantenerse limpio. Antes de guardar un electrodo, se debe cerrar este orifcio superior y tapar
el extremo inferior de este orifcio con un capuchn de goma. No hay que dejar secar el electro-
do. Cuando la solucin de cloruro de potasio se ha secado, el electrodo queda estropeado y
es casi imposible regenerarlo. Los electrodos antes y despus de su uso deben ser lavados
sumergindolos y enjuagndolos con agua destilada o desionizada.
7.9.3.1 Manejo del pH-metro
7.9.3.1.1 Instalacin y limpieza.
Ubique el pH-metro en un sitio frme y seguro, libre de vibraciones, cercirese que en la red
de energa no existan equipos conectados que puedan producir interferencia. Retire la funda
protectora contra el polvo y limpie cuidadosamente el aparato. Lave los electrodos cuidado-
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
383
samente con abundante agua destilada, utilice para ello un Beaker y un frasco lavador.
7.9.3.1.2 Puesta en funcionamiento y calibracin.
Con la ayuda del catlogo o las instrucciones de manejo propias para el equipo, identifque
cada uno de los controles o teclas del pH-metro y su funcin. Realice los siguientes pasos:
1. Colocar el conmutador en la posicin cero y acoplar el electrodo (si se encuentra
desconectado), correspondiente a la medicin a realizar: Electrodo combinado indicador de
membrana de vidrio y referencia para la medicin del pH o el electrodo combinado indicador
de platino y referencia para medicin de mV en titulaciones Redox.
2. conectar el instrumento a la red elctrica 110 V 50/60 hz.
3. Colocar el conmutador o la funcin en la posicin pH o mV segn la medicin a
realizar.
7.9.3.1.3 Medicin de pH
4. Seleccionar la posicin pH con el conmutador o funcin, Elegir dos soluciones tampn:
Una de las soluciones tampn con el valor pH prximo al punto cero del electrodo, por
ejemplo, pH = 6.87 (segn la norma DIN 19266 y NBS) o pH = 7.00, y la segunda
solucin tampn a la distancia de unas tres unidades pH de la anterior. Por ejemplo pH
= 4.01 (segn la norma DIN 19266 y NBS) o pH = 4.00.
5. Poner en equilibrio de temperatura las soluciones tampn de calibracin y el electrodo.
Por ejemplo a 25C (+ 0.2C como valor orientativo. Cuando se desea una
reproducibilidad de aproximadamente + 0.01 unidades pH).
Si exige una reproducibilidad de pH = 0.1 unidades, puede prescindirse generalmente de
poner en equilibrio una temperatura especial.
6. Ajustar el mando C a la temperatura de la solucin tampn (s el pH-metro no
dispone de sensor de temperatura, mida la temperatura de la solucin tampn con un
termmetro).
7. Retirar el tapn del orifcio de llenado o girar, bajar o subir segn el caso la anilla de
vidrio (no es preciso en Caso de electrodos con contenido de gel); enjuagar el electrodo
con agua destilada o desionizada.
8. Sumergir el electrodo, hasta cubrir la membrana del bulbo y el poro de contacto
como mnimo, en la solucin tampn con el valor de pH prximo al punto cero (pH =
6.87 pH = 7.00). Ajustar mediante el mando pH la indicacin digital al valor de la
384
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
solucin tampn observar figura 7.18
9. Retirar el electrodo enjuagarlo bien con agua destilada y Sumergirlo en la segunda
solucin tampn (pH = 4.01 pH = 4.00).
10. Ajustar mediante el mando mV/pH, la indicacin digital al Valor pH de la segunda
solucin tampn. Con ello queda adaptado el instrumento a la funcin del electrodo
(calibrado), algunas veces es necesario verifcar la calibracin repitiendo los
pasos 8-9 y 10. Enjuagar bien nuevamente el electrodo.
11. Dejar el conmutador en posicin pH.
12. Ajustar el mando C a la temperatura de la solucin a medir (S el pH-metro no
dispone de sensor de temperatura, mida la temperatura de la solucin tampn con
un termmetro).
13. Para medir el valor del pH, el electrodo se sumerge en la solucin a medir hasta cubrir
el bulbo de la membrana y el poro de contacto como mnimo. Se lee el valor
del pH en el display de indicacin, despus de un perodo de tiempo razonable (30
segundos) de equilibrio de la temperatura y las soluciones del electrodo y problema.
Figura 7.17 instrucciones de manejo pH-metro Fisher AB15
Presione modo para seleccionar pH
Presione setup dos veces y luego enter
para eliminar los bufer de la estandarizacin
anterior
Presione std para entrar estandarizacin en la
pantalla. Lave bien el electrodo y abra el orifcio
de llenado. Sumrjalo en el bufer seleccionado
del grupo escogido
Presione std de nuevo para iniciar la estan-
darizacin. Cuando la lectura se estabilice la
pantalla regresar a la posicin de medida.
Repita los pasos 3-4 con el sgundo bufer.
Sumerja el electrodo en la muestra.
Lea el pH y la temperatura
1
2
3
4
5
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
385
Figura 7.18 Medidor de pH SCHOTT CG 824
7.9.3.1.4 Manejo y cuidado de los electrodos
7.9.3.1.4.1 Almacenaje
Para almacenar los electrodos de vidrio, se coloca una caperuza protectora sobre la
membrana de vidrio llena de agua destilada. Por medio de esta funda de agua se evita
que la superfcie de la monocapa se seque y el electrodo este apto de inmediato para efectuar
mediciones. En el caso de electrodos de referencia se cierra la abertura para el rellenado
y se coloca la caperuza protectora sobre el diafragma. De esta manera se evita el vertido
del electrlito. En el caso de los electrodos combinados se emplea una caperuza llena de
un electrlito (por ejemplo KCl 3.5 M). El agua destilada es menos recomendable,
porque podra diluir el electrlito del electrodo de referencia. Si se almacenan en seco los
electrodos de vidrio, entonces el electrodo debe ser colocado por lo menos 24 horas en
agua destilada o solucin KCl 3.5 M para que se forme nuevamente la superfcie de la
monocapa. Si durante el almacenamiento se perdi electrlito del electrodo de referencia,
se debe remplazar con electrlito fresco a travs de la abertura para el llenado. La mejor
temperatura de almacenamiento est entre 15-25
o
C. A temperaturas ms altas envejecen
ms rpido los electrodos
1 2
3 4 5 6
1. Piloto de encendido
2. Pantalla de lectura digital
Display
3. Selector de temperatura
4. Selector de cero
(punto neutro)
5. Control para ajuste de la
pendiente
6. Selector de funcin
cero, pH, mV
386
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
7.9.3.1.4.2 Envejecimiento y duracin
A temperaturas ambiente, los sistemas secundarios del electrodo de vidrio y del electrodo de
referencia se gastan poco, inclusive bajo uso constante, la vida del electrodo de medicin puede
llegar a ser de varios aos sin problema. Procesos de envejecimiento irreversibles, causados
por altas temperaturas de almacenamiento y de medicin, por polarizacin y cortocircuito o
por infuencias qumicas de las sustancias a medir pueden acortar signifcativamente la vida
de los electrodos. El envejecimiento de los electrodos se manifesta por medio de tiempos
de respuesta signifcativamente ms prolongados, aumento de la resistencia elctrica y
disminucin de la pendiente.
7.9.3.1.4.3 Regeneracin
La disminucin de la pendiente y tiempos mayores de respuesta que tienen su origen en
cambios en la membrana de vidrio pueden ser remediados a veces. Muchas veces un buen
enjuague es til: en casos ms difciles es posible eliminar la superfcie de la monocapa
inservible con cido fuorhdrico diluido en pocos minutos. Luego slo se enjuaga y se deja
en agua destilada durante 24 horas para que se forme una nueva monocapa. Tambin es
posible corregir cambios en el punto cero debido a una variacin de la concentracin del
electrlito de referencia. El electrlito viejo es succionado con una trompa de agua, una pera
de bombeo o jeringa, por el orifcio de llenado y se llena luego con electrlito fresco. KCl
cristalizado en el electrodo de referencia puede ser eliminado calentando todo el electrodo
al bao mara, En el caso de electrodos con electrlito slido se reduce la concentracin de
KCl en mediciones prolongadas por disolucin en la sustancia a medir; aqu tambin se
logra una cierta regeneracin, dejndolo algunos das en una solucin KC 3.5 M.
7.9.3.1.4.4 Limpieza
Los diafragmas obstruidos se limpian por medio de succin con la trompa de agua o aplicando
presin al electrlito. Si la obstruccin se debe a protenas (en leche, sangre, etc.), es posible
a veces limpiar el diafragma con una solucin de pepsina/HCl. La aparicin de manchas
negras de sulfuro de plata en el diafragma cuando se tienen electrodos de referencia con un
sistema Ag/AgCl, puede ser eliminada eventualmente con una solucin de tiourea/HCl.
7.9.3.1.5 Medicin del pH bajo condiciones especiales
7.9.3.1.5.1 Soluciones muy cidas
Al efectuar mediciones en soluciones cuyo pH es menor que la unidad, aparece el error
cido, esto es, los valores del pH medido son demasiado altos. Adems existe en el
campo cido el peligro de corrosin de la membrana de vidrio por iones fuoruro e iones
fosfato, sobre todo a altas temperaturas. Con el fn de mantener estos errores en el mnimo,
se utilizan electrodos cuya membrana de vidrio est optimizada al campo cido. Una eventual
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
387
modifcacin de la membrana debido a mediciones muy prolongadas en campo muy cido,
puede ser restaurada colocando el electrodo durante largo tiempo en agua destilada.
7.9.3.1.5.2 Soluciones muy bsicas
En el campo muy bsico, por encima de pH once, se modifca o incluso se destruye la
monocapa muy rpidamente, en especial a temperaturas elevadas. Por ello surgen grandes
potenciales de asimetra y tiempos prolongados de ajuste. Si las soluciones bsicas contienen
iones de sodio o de litio se presenta adems el error alcalino, esto es, el resultado se
falsifca hacia pH menores.
Con el fn de mantener estos errores en el mnimo, se utilizan electrodos cuya membrana de
vidrio est optimizada al campo de las bases (por ejemplo los de tipo H, o para soluciones
bsicas calientes tipo S).
7.9.3.1.5.3 Altas temperaturas
Con temperaturas superiores aproximadamente 50
o
C, se debe comprobar que los electrodos
tengan buenos sistemas secundarios (el ms adecuado es el sistema Thalamid). Con
temperaturas superiores a los 100
o
C el electrlito puede hervir. Aplicando ciertos aditivos
que elevan el punto de ebullicin del electrlito, se pueden utilizar ciertos electrodos de vidrio,
electrodos de referencia y electrodos combinados hasta 110
o
C. La aplicacin de electrodos
de plata/cloruro de plata y Thalamid con sobrepresin permite, en principio, temperaturas de
hasta 135
o
C. Sin embargo se debe tener en cuenta que la utilizacin a altas temperaturas
acorta la vida til de los electrodos.
7.9.3.1.5.4 Bajas temperaturas
La mayora de los electrodos no son aptos para aplicaciones a temperaturas inferiores a 10
o
C. A bajas temperaturas cristaliza el KCl en el electrodo de referencia. Adicionalmente
aumenta la resistencia de la membrana de vidrio de manera que puede originar tambin
posibles errores. Los electrodos normales de vidrio slo deben utilizarse hasta temperaturas
de 5
o
C. Para temperaturas inferiores se requieren electrodos de vidrios especiales.
Es posible adaptar los electrodos de referencia para su utilizacin a bajas temperaturas
cambiando el electrlito (solucin 2.0 M KCl de 20
o
C hasta 5
o
C; 1.5 M KCl con 50%
glicerina hasta 30
o
C).
7.9.3.1.5.5 Concentraciones extremas de iones
En soluciones con una alta concentracin de iones se pueden presentar fcilmente potenciales
de difusin perturbadores en el diafragma. En soluciones muy pobres en iones, la resistencia
de la sustancia a medir es relativamente alta. Por lo tanto, es conveniente utilizar diafragmas
388
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
con una velocidad de vertido alta, por ejemplo un diafragma esmerilado.
7.9.3.1.5.6 Soluciones qumicamente reactivas
Soluciones muy bsicas y soluciones que contienen cido fuorhdrico o cido fosfrico atacan
la membrana de vidrio, especialmente a altas temperaturas. En cierta medida es posible
regenerar los electrodos. Tambin las soluciones fuertemente oxidantes (por ejemplo, cloro,
bromo, yodo, cromatos, etc.) pueden ser un problema: en ellas se prohbe el empleo de
diafragmas de platino.
Pero tambin se pueden destruir los sistemas de medicin. En estos casos es necesario
proteger el electrodo de referencia con un puente salino o se debe utilizar directamente un
electrodo de doble electrlito. En soluciones que contienen sulfuro son poco recomendables
los electrodos de referencia con sistema Ag/AgCl. Formadores de complejos envenenan
tanto sistemas Ag/AgCl como Hg/Hg
2
Cl
2
. En este caso es til el empleo de un electrodo de
referencia con diafragma de platino y sistema de Thalamid o un puente salino.
7.9.3.1.5.7 Suspensiones y emulsiones
Es lgico que el diafragma se obstruya fcilmente en soluciones con sustancias slidas
fnamente divididas o con sustancias de alta viscosidad. Esto se puede evitar utilizando
diafragmas menos sensibles como el diafragma de platino o el diafragma de frita (termino
utilizado para caracterizar minerales fnamente molidos) de vidrio con una alta velocidad de
vertido. Despus de efectuar mediciones en soluciones con un contenido protenico (leche,
sangre, etc.), se debe limpiar el diafragma con solucin de pepsina. Otra posibilidad es la
utilizacin de diafragmas esmerilados, que permiten una fcil limpieza.
7.9.3.1.5.8 Sustancias abrasivas
Sustancias mviles con partculas fotantes slidas, duras, pueden daar la superfcie
del electrodo de vidrio. Esto generalmente se evidencia mediante tiempos de calibracin
mayores. Se puede compensar hasta cierto punto mediante una frecuente regeneracin de
la membrana de vidrio y una nueva calibracin.
7.9.3.1.5.9 Sustancias slidas
Sustancias slidas como, por ejemplo, masas de panadera o muestras de suelo, no son
aptas directamente para la determinacin del pH. Aqu es importante el seguimiento
exacto de instrucciones especfcas de medicin para que los resultados de la misma sean
comparables.
Muestras de suelo, por ejemplo, son suspendidas en una determinada cantidad de agua,
la cual debe estar en una relacin exactamente determinada con la masa de la sustancia
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
389
a medir. A esto se agrega un aditivo para favorecer la suspensin (por ejemplo, solucin
CaCl
2
). El pH se mide despus de un determinado tiempo de sedimentacin. En estos
casos se deben tener en cuenta exactamente las instrucciones de las normas por ejemplo
las normas DIN 19684 para muestras de suelos.
7.9.3.1.5.10 Medidas en medios no acuosos
El concepto de pH solamente es vlido en soluciones acuosas. En medios no acuosos
como por ejemplo alcohol, rigen otras leyes. En principio, tambin es posible medir un pH
en ellas.
Sin embargo, debido a que el pH est defnido por medio del equilibrio de disociacin del
agua, las mediciones en otros disolventes no indican pH reales. Es necesario defnir para
cada uno de ellos una escala del pH propia. De la misma manera los electrlitos de referencia
no son aptos para mediciones en soluciones anhidras y deben ser cambiados.
.Pueden distinguirse los disolventes prticos y los aprticos. Los disolventes prticos, como
el agua, presentan una disociacin neta. Ejemplo:
2 H
2
O H
3
O
+
+ OH
-
2 CH
3
OH CH
3
OH
2
+
+ CH
3
O
-
2 CH
3
COOH CH
3
COOH
2
+
+ CH
3
COO
-
Los puntos neutros de estos disolventes no son ya pH=7 En los disolventes aprticos no
se constata disociacin neta alguna o como mximo, muy dbil (benceno, ter, cloroformo,
etc.) Adems presentan una conductividad muy baja, lo cual difculta notablemente la medida,
as como la presencia de cargas electrosttica (y su descarga) en el electrodo de medida.
En tales casos es preferible medir la acidez o basicidad por titulacin no acuosa. Para ello,
o eventualmente para medidas comparativas, se recomienda la siguiente combinacin de
electrodos:
Electrodo de pH separado con electrodo de referencia Ag/AgCl con LiCl saturado. En
etanol como electrolito interior y exterior.
7.9.3.1.5.11 Medidas en muestras de agua
En este caso es precisamente donde los cambios de tensin de difusin en el diafragma
juegan un papel decisivo. Dichos cambios provocan falsas lecturas y una estabilizacin lenta
del valor medido.
Deben usarse electrodos con una superfcie de diafragma grande. Es tambin til aadir una
sal neutra (1 mL NaCl o KCl sat./50 mL de muestra). Los electrodos ms adecuados son:
390
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
- Electrodo de vidrio combinado, con diafragma esmerilado.
- Electrodo de pH separado con electrodo de referencia Ag/AgCl con diafragma
esmerilado.
7.9.3.1.5.12 Medidas en carne, queso, frutas, etc.
En estos casos se utilizan electrodos de penetracin (o aguja). La muestra puede ser punzada
previamente o bien hacerlo directamente con el electrodo mediante un ligero movimiento
rotatorio.
El electrodo se debe limpiar cuidadosamente despus de cada medida. Debe tenerse la
precaucin de mantener la membrana y el diafragma en contacto con la muestra durante la
medida.
Electrodos apropiados.
- Microelectrodo de pH combinado, con membrana de vidrio cilndrica.
- Electrodo de pH de aguja combinado.
7.9.3.1.5.13 Medidas de Superficie
Las medidas sobre piel, cuero, cartn de pintura, etc. Se efectan con electrodos de
membrana plana. Mojar la superfcie de lo que se quiera medir con una o dos gotas de agua
destilada o de solucin de KCl, aplicar el electrodo verticalmente sobre la parte mojada de la
superfcie, efectuar algunos movimientos rotatorios y seguidamente medir el pH (calibrado
en soluciones tampn).
Despus del calibrado, y entre cada una de las medidas, limpiar a fondo el electrodo con agua
destilada y secarlo (peligro de arrastre a causa de la medida en volmenes tan pequeos).
- El electrodo de pH combinado de membrana plana es el indicado.
7.9.3.1.5.14 Medidas de muestras de volumen muy pequeo
Para tal necesidad se han construido microelectrodos especiales. Tambin en este caso es
importante limpiar a fondo y secar con un papel suave el electrodo despus de cada medida
(riesgo de arrastre). Electrodos adecuados:
- Microelectrodo de pH combinado, con esmerilado normalizado y cable fjo.
- Microelectrodo de pH combinado.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
391
- Microelectrodo de pH combinado, y esmerilado normalizado (membrana de vidrio
esfrica).
- Microelectrodo de pH combinado, y esmerilado normalizado (membrana de vidrio
cilndrica).
7.9.3.1.5.15 Medidas en ungentos, cremas y pastas. (productos
cosmticos, farmacuticos y artculos alimenticios)
En estos casos el diafragma suele quedar recubierto por las muestras y por ello deber ser
fcilmente limpiable. Solamente son aptos aquellos electrodos con diafragmas fciles de
limpiar o con una capa de difusin fcilmente reemplazable. Despus de la medida se limpian
con etanol y se lavan con agua. Finalmente, tras quitar el esmerilado, se lava el diafragma
con electrolito.
Electrodos:
- Electrodo de pH combinado, con diafragma esmerilado.
- Electrodo de pH separado con electrodo de referencia con diafragma esmerilado.
7.9.3.1.5.16 Medidas en melazas, confitura, miel, etc.
Normalmente estas muestras ensucian el diafragma y, por lo tanto, ste debe ser fcilmente
limpiable. Debido al elevado contenido de azcar de estas sustancias debe evitarse el
contacto prolongado con el electrodo (deshidratacin de la capa de gel). Lavar bien los
electrodos y proceder si es necesario a lavados intermedios: El electrodo de pH combinado,
con diafragma esmerilado es el indicado.
7.9.3.1.5.17 Medidas en suero sanguneo, leche, yogur, comidas
preparadas, etc.
En principio, puede emplearse cualquier tipo de electrodos, incluidos los microelectrodos.
Es necesario sumergirlos de vez en cuando en la solucin pepsina/cido clorhdrico para
liberarlos de materia protenica adherida. Seguidamente lavarlos bien con agua.
7.9.3.1.5.18 Medidas en lacas, pinturas, suspensiones
En este caso, es preferible el electrodo de vidrio combinado, con diafragma esmerilado, ya
que se encuentra cerca de la membrana de vidrio (conductividad de la solucin) y es, por
aadidura, fcil de limpiar. Limpiar el electrodo despus de cada uso con un disolvente
392
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
apropiado y despus enjuagarlo con agua destilada. Evitar el contacto prolongado con el
medio. Electrodo:
Electrodo de pH combinado, con diafragma esmerilado.
7.9.3.1.5.19 Medidas generales
Casas productoras de electrodos ofrecen ms de medio centenar de electrodos distintos para
la medida del pH. Dichos electrodos se diferencian entre si por su longitud, la composicin
del vidrio de la membrana de medida y el tipo de diafragma. Se podr encontrar explicaciones
ms precisas sobre el electrodo que mejor se adapta a cada problemtica, en las publicaciones
tcnicas catlogos.
7.9.3.1.6 Tratamiento de los electrodos despus de la medida
- Lavar bien los electrodos y secarlos ligeramente con papel suave. No secarlos nunca
totalmente.
- Conservar los electrodos combinados en KCl 3.5 mol/L.
- Despus de su utilizacin en muestras grasas, limpiar los electrodos con una mezcla
etanol/ ter; fnalmente lavarlos con agua destilada.
- Despus de su utilizacin en tensoactivos, lavar abundantemente con agua.
- Cuando se utilizan en soluciones protenicas, sumergirlos de vez en cuando en una
mezclapepsina/HCl (5% pepsina en HCl 0.1mol/L.) durante dos horas y despus lavarlos
bien con agua.
- No usar jams el bao de ultrasonidos para limpiar los electrodos (provoca la destruccin
del contacto interno y eventualmente tambin del sistema de referencia).
7.9.3.1.4 Medicin de potenciales redox (mV)
7.9.3.1.4.1 Electrodo combinado Para la medicin de potenciales redox
Un electrodo inerte como oro o platino, que sirve como suministrador o aceptor de electrones
en una semirreaccin redox; al ser sumergido en una solucin que contiene los estados
oxidado y reducido de un sistema redox homogneo y reversible, es capaz de seguir los dos
estados de oxidacin. Al ser acoplado con un electrodo de referencia (calomel o plata cloruro
de plata) se constituye en un electrodo combinado til para el seguimiento de los
potenciales en las titulaciones de oxidacin reduccin, Observar fgura 7.19
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
393
Figura 7.19 Electro combinado de platino para medicin de potenciales redox. A
electrodo de alambre de platino, B electrodo de referencia.
7.9.3.1.4.2 Medicin de mV
Puesta en marcha del instrumento de acuerdo con lo que se describe en los pasos 1 y 2.
Instruccin 7.9.3.1.2
Colocar el conmutador o la funcin en la posicin mV.
Verifcar la respuesta en mV del electrodo combinado indicador de platino y referencia para
medicin de mV de la siguiente manera:
Lave y enjuague bien el electrodo con agua destilada.
Sumrjalo hasta cubrir la parte sensible del electrodo (metlica de platino) en una solucin
buffer pH 7 saturada con cristales de quinhidrona recin preparada. El potencial
debe estar entre 10 mV de acuerdo a los siguientes valores:
B
A
394
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Temperatura en C 20 25 30
Potencial en mV +92 +86 +79
Remueva el electro enjuguelo nuevamente muy bien con agua destilada. Sumrjalo en una
solucin buffer pH 4 saturada con cristales de quinhidrona recin preparada.
El electrodo debe responder rpidamente a los siguientes potenciales dependiendo de la
temperatura:
Temperatura en C 20 25 30
Potencial en mV +268 +263 +258
Remueva el electro enjuguelo nuevamente muy bien con agua destilada. Sumrjalo hasta
cubrir la parte sensible del electrodo (metlica de platino) en la solucin a medir. Se lee el
valor del potencial mV en el display de indicacin, despus de un perodo de tiempo
razonable (30 segundos) de equilibrio de la temperatura y las soluciones del electrodo y
problema.
7.9.3.1.4.2 Electrodo de membrana
En este tipo de electrodos el potencial se desarrolla a travs de una membrana que separa
una solucin interna de la solucin que interesa. El electrodo de vidrio y otros electrodos
de iones selectivos se encuentran en esta categora. Son electrodos cuyo potencial de
membrana es funcin de la concentracin de un in dado en la disolucin.
Finalmente en un grupo bastante impreciso se incluyen transistores sensibles a los efectos
del campo y que poseen iones selectivos (ISFETs) utilizados como sensores qumicos. Por
lo general se considera que estos forman una subclase de electrodos de iones selectivos.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
395
7.9.3.1.4.2.1 Electrodos selectivos de iones y sus aplicaciones
Tabla 7.3 Electrodos selectivos y sus aplicaciones
Amoniaco, amonio
NH
3
, NH
4
+
Bromuro
Br
-
Cadmio
Cd2+
Calcio
Ca
2+
Anhdrido carbnico
CO
2
Cloruro
Cl
-
Cobre
Cu
2+
Cianamidas
CN
-
Fluoruro
F
-
Tetrafuorborato
BF
4
-
Hidrogeno
H
+
Ioduro
I
-
Plomo
Pb
2+
Nitrato
NO
3
-
xido de nitrgeno
NO
x
Perclorato
ClO
4
-
Potasio
K
+
Plata/sulfuro
Ag
+
, S
2-
Sodio
Na+
Tiocinato
SCN
-
Ion para el cual el
electrodo es selectivo
Intervalo til de
concentracin (M y ppm)
Aplicaciones
10
-6
-0,1 M
0,02 2000 ppm
10
-6
-0,1 M
0,08 8000 ppm
10
-7
-0,1 M
0,01 11,000 ppm
10
-5
-1 M
0,4 40000 ppm
5 x 10
-5
- 0,01 M
2 400 ppm
3 x 10
-5
0,1 M
1,0 3500 ppm
10
-6
- 0,1 M
0,06 - 6000 ppm
10
-6
10
-3
M
0,03 250 ppm
10
-6
0,1 M
0,02 2000 ppm
3 x 10
-6
-0,1 M
0,3 9000 ppm
0 14 pH
10
-7
-0,1
0,01 10000 ppm
10
-6
-0,1 M
0,2 20000 ppm
6 x 10
-6
-1 M
0,4 60000 ppm
4 x 10
-6
5 x 10
-3
M
0,2 200 ppm
3 x 10
-6
-0.1 M
0,3 10000 ppm
10
-5
1 M
0,4 40000 ppm
10
-7
-0,1 M Ag
+
0,01 10.000 ppm
10
-5
0,1 M
0,2 2000 ppm
5 x 10
-6
-1 M
0,3 60000 ppm
El electrodo mide el amonaco disuelto, y tambin puede medir otras
sustancias por medio de pretratamientos qumicos, incluyendo el nitrato de
amonio. El amonaco se mide normalmente en alimentos, aguas residuales,
suelos y sistemas biolgicos.
Anlisis de aguas contaminadas. Procesos fotogrfcos.
El Cd
2+
puede valorarse directamente por neutralizacin con AEDT. Se
utiliza en anlisis de baos electrolticos y como detector de punto fnal en
valoraciones de sulfto en los licores de la pulpa de la madera.
Valoraciones directas de Ca
2+
en fuidos biolgicos y de calcio total con
AEDT. Tambin en suelos, alimentos y agua.
El CO
2
disuelto y los carbonatos pueden medirse directamente. Entre
otras muestras se analizan suero, vino, agua y refrescos.
La presencia de cloruros es crtica en el procesado de alimentos, resinas e
insecticidas. Tambin se usa como material biolgico y en la investigacin
mdica de la fbrosis cstica.
Baos electrolticos y baos de decapado cido, suelos, lodos, productos
farmacuticos, alimentacin y bebidas.
Anlisis de baos electrolticos, extraccin de minerales y aguas residuales.
Muy usado en el anlisis del suministro de agua fuorada, pasta de dientes,
hueso, baos electrolticos, vertido de aguas y metabolismo de fuorboratos.
Cuantifcacin del acido fuobrico en los baos electrolticos, anlisis de
boro en el suelo, tejido vegetal, y vidrio en la formacin de fuorboratos.
Medidas de pH.
Comnmente usado en los anlisis de disoluciones salinas de desechos
industriales y en investigaciones farmacuticas.
Principalmente se usa en baos electrolticos y para detectar SO
4
2
-
, de
forma indirecta mediante valoracin con plomo.
Principalmente en los anlisis de suelos y de fertilizantes, tratamiento
biolgico de aguas, en procesos de fabricacin farmacuticos y
fotogrfcos.
Un electrodo detector de gases que se utiliza principalmente para la
deteccin de nitritos, NO
2
-
, en alimentacin, aguas subterrneas, baos
electrolticos y medicin del NO
x
atmosfrico.
Principalmente utilizado en explosivos y en la industria de propulsores
slidos.
Anlisis de suelos, fertilizantes, fuidos biolgicos y vinos.
Aplicaciones de papeleras y de pulpa de papel. Recuperacin de plata de
los procesos fotogrfcos.
Anlisis de sodio en alimentos dietticos, manantiales de agua de gran
pureza, tejidos, vidrio, licor de pulpa y productos biolgicos.
Muy comnmente usado en la industria de baos electrolticos.
Referencia principal: The Beckman Handbook of Applied Electrochemistry. 1980. Fullerton,CA: Beckman Instruments, Inc.
AEDT (cido etilendiaminotetraactico). Se utilizan tambin las siglas inglesas EDTA.
396
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
7.9.3.1.4.3 Electrodos con puente salino
Para hacer mediciones en soluciones que atacan el sistema de los electrodos de referencia
o lo puedan envenenar, se lleva a cabo la medicin con un puente salino. Esto signifca que
el electrodo de referencia no se sumerge en la solucin a medir, sino en un recipiente que
contiene una solucin electroltica, la cual est en contacto con la solucin a medir a travs
de otro diafragma. Si se remplaza con cierta frecuencia el electrolito en el puente salino, no
se deben temer fallos en el electrodo de referencia. Para algunos casos especiales, existen
electrodos de referencia con puente salino integrado, los llamados electrodos de doble
electrlito.
7.9.4 Aplicaciones analticas de la potenciometra.
7.9.4.1 Determinacin del pH: La determinacin del pH es una de las mediciones
qumicas ms frecuentes en todos los laboratorios: Qumicos, Biolgicos, Geolgicos, de
suelos, de aguas, de biotecnologa, de farmacologa, Clnicos, Plantas de Tratamiento de aguas,
de control de calidad, de contaminacin ambiental, productos alimenticios, medicamentos entre
muchos otros.
Presenta este parmetro como medida de acidez y alcalinidad en medio acuoso una base
til al qumico siempre y cuando se interprete correctamente para obtener del pH valiosa
informacin en el anlisis qumico ya que de un pH cido o bsico se puede derivar informacin
sobre la presencia o ausencia de ciertos compuestos, aniones o cationes en una muestra.
7.9.4.2 Titulaciones potenciomtricas: Las aplicaciones de la potenciometra
en la tcnica de las titulaciones, presenta las siguientes ventajas con respecto al uso de
indicadores visuales:
- Si la muestra es de naturaleza desconocida, no es posible elegir un indicador, porque no se
puede pronosticar el pH del punto fnal de equivalencia.
- La muestra puede exhibir ms de un punto fnal (punto de infexin), lo que se puede
observar, cuando los datos se transferen a un grfco (pH Vs volumen de titulante
agregado).
- Cuando los puntos fnales no son ntidos, generalmente no hay indicadores satisfactorios,
porque cambian de color muy gradualmente. Los datos potenciomtricos se pueden pasar a
un grfco para determinar con bastante exactitud el punto de infexin. Hay varios caminos
para determinar grfcamente el punto de equivalencia. El primero es el ms simple y se
aplica principalmente a las valoraciones en que se trata de cidos y bases fuertes, donde hay
cambios muy fuertes de pH en el punto fnal. Se traza la grfca de pH en funcin de los
mililitros de solucin titulante como se muestra en figura 7.20. Se escoge el punto medio
en el pH como punto de equivalencia y fnalmente se baja una lnea perpendicular a la lnea
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
397
base. El punto de interseccin con sta es el volumen de valorante gastado.
Figura 7.20 Mtodo de la semialtura para la determinacin del punto final en una
valoracin potenciomtrica.
El segundo mtodo es ms preciso y es aplicable en todos los casos de neutralizacin. Se
traza la grfca de los valores de
mL
pH
en funcin de los mL de solucin valorante, se
obtendr una curva como la que se muestra en la figura 7.21.
Figura 7.21 Mtodo de la primera derivad para la determinacin del punto final en una
valoracin potenciomtrica.
pH
H
H
1
2
v mL de solucin valorante
v mL de solucin valorante
pH
pH
mL
mL
pH
mL
pH
v
398
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Un tercer mtodo consiste en trazar la grfca de los valores de
2
2
mL
pH
en funcin de los
mL de titulante como se observa en la figura 7.22.
Figura 7.22 Mtodo de la segunda derivada para la determinacin del punto final en una
valoracin potenciomtrica.
Los grfcos ms frecuentes, utilizados en las valoraciones potenciomtricas para hallar el punto
de equivalencia dependiendo del tipo de titulacin, son: pH vs mililitros de titulante;
pH/v Vs mililitros de titulante;
2
pH/v
2
vs mililitros de titulante.
Un cuarto mtodo implica la construccin de un rectngulo alrededor del punto de equivalencia
y es mucho ms rpido que el segundo mtodo. Simplemente se trazan las lneas en el orden
indicado. Se encontrar a veces que es necesario expandir el eje de los mL de valorante para
aplicarlo en el caso de valoraciones cido fuerte- base fuerte. Observar figura 7.23
pH
v
2
v mL de solucin valorante
pH
2
mL
pH
mL
pH
v
2
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
399
Figura 7.23 Mtodo de construccin geomtrica para la determinacin del punto final en
una valoracin potenciomtrica.
Procedimiento:
- Se traza una lnea que pase por la porcin recta ascendente del pH.
- Se prolonga la lnea 2 desde la porcin fnal de la curva para cortar la lnea 1, creando el
punto A.
- De igual manera, se obtiene el punto B, pero con la porcin fnal de la curva.
- A travs de A, se traza una lnea paralela al eje de pH.
- A travs de B se traza una lnea paralela al eje de pH.
- A travs de B se traza una lnea paralela al eje de mL, lo cual crea el punto C.
- A travs de A se traza una lnea paralela al eje de mL, lo cual crea el punto D.
- Se unen los puntos D y C con una lnea recta. La interseccin con la lnea 1 es el centro de
un rectngulo que se ha construido alrededor del punto de equivalencia.
- El presente mtodo es aplicable en las curvas de valoracin que no presentan simetra.
Algunos otros analistas recomiendan trazar crculos tangentes a las curvas de la grfca y unir
sus centros a travs de una lnea que corta la porcin recta ascendente de pH y luego a partir
de dicho punto trazar una lnea paralela al eje de pH hasta cortar al eje de v.
De estas formas se determina el volumen titulante consumido para la valoracin.
En valoraciones de oxidoreduccin se construyen las grficas de igual
manera pero teniendo en cuenta que en el eje (Y) el parmetro es dado en
mV (milivoltios). Las grafcas sern entonces mV Vs mL de titulante, mV/v
Vs mililitros de titulante (primera derivada) y
2
mV/v
2
Vs. mililitro de titulante
(segunda derivada).
Para obtener simetra en las grfcas de la primera y segunda derivada, se grafca el parmetro
pH
v mL de solucin valorante
D
1
5
8
7
2
A
B
C
3
6
4
400
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
mL
pH
, o
2
2
mL
pH
contra el promedio del volumen de los volmenes de titulante
considerados para calcular el mL o el
2
mL segn la grfca a construir.
- Al obtener por el mtodo potenciomtrico datos de pH en las regiones amortiguadas de la
curva de titulacin, es posible calcular el (los) valor (es) del pK de la sustancia titulada.
Un equipo tpico utilizado para la realizacin de las titulaciones potenciomtricas se describe
en la figura 7.25 b. Es conveniente aclarar que en el comercio se encuentran equipos
completamente automticos, que trabajan bajo el principio de la segunda derivada, para realizar
simultneamente varias titulaciones previamente programadas.
7.9.4.2.1 Potenciomtricamente se puede realizar los siguientes tipos de
titulaciones: cido Base, oxido-reduccin, precipitacin y complexomtricas.
7.9.4.3 Determinaciones con electrodos selectivos.
Los electrodos selectivos pueden utilizarse, indistintamente, en soluciones acuosas y no
acuosas, y sus aplicaciones se han desarrollado considerablemente en los campos de la qumica
orgnica, bioqumica y medicina. Adems, no es necesario, en general, realizar una preparacin
previa de la muestra. En defnitiva, el aspecto ms interesante de los electrodos especfcos es la
obtencin de resultados con rapidez y sin prdida de muestra. Estos electrodos son adecuados
para el anlisis continuo de aguas y plantas industriales, simplemente, colocando el electrodo
(tal como en un ro o una planta) y midiendo el voltaje desarrollado. Este voltaje puede calibrarse
en trminos de concentracin del in por ejemplo sodio, si se trata de un electrodo especfco
de sodio; de este modo sobre la escala display o pantalla se lee directamente la concentracin
de sodio.
La concentracin de otros iones puede determinarse de forma anloga, haciendo uso de
los electrodos especfcos correspondientes. Algunos de los anlisis especfcos incluyen la
determinacin de sodio y potasio en bilis, nervios y tejidos musculares, rin, plasma sanguneo,
orina y otros cuerpos fuidos.
Tambin se ha utilizado en el anlisis de agua de mar, barros marinos, agua de ros y aguas
industriales (como calderas) as como en la determinacin de Na
+
, K
+
, Li
+
, Mg
2+
, Ca
2+
, Ag
+
, Cr
2+
,
Rb
+
, NH
4
+
,I
-
, F
-
, Cl
-
, Cd
+
, Pb
2+
, y SCN
-
, en lquidos orgnicos.
En muestras acuosas se han determinado concentraciones muy bajas de iones Br
--
, Cd
2+
, Ca
2+
,
Cl
-
, CN
-
, Cu
2+
, I
-
, F
-
, Pb
2+
, NO
3
-
, ClO
4
-
, Na
+
, SCN
-
, S
3-
, Ag
+
. Debe recordarse que la ecuacin de
Nernst relaciona el potencial con la concentracin lo cual permite hacer directamente
estas aplicaciones.
pH
v
pH
v
2
v v
2
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
401
7.9.4.3.1 Curvas de calibracin mV vs C con electrodos para iones
selectivos.
Para determinaciones con mayor sensibilidad, limites de deteccin y cuantifcacin como
tambin mejorar la precisin y exactitud en las determinaciones con electrodos selectivos, se
construyen curvas de calibracin (mV Vs C) de milivoltios versus cualquier parmetro de
concentracin buscando una relacin lineal (observar figura 7.24), de tal manera que
el potencial medido sea directamente proporcional a la concentracin; en la cual se puede
interpolar el voltaje medido a una solucin desconocida para hallar su concentracin, o se
puede encontrar la pendiente y el intercepto de la ecuacin b mX Y + = donde: mV Y =
e lapendient m = , in concentrac X = y ercepto b int =intercepto
y mediante su aplicacin
encontrar la concentracin de la muestra desconocida.
Figura 7.24 Grfica tpica de calibracin para la determinacin de aniones o cationes
con electrodos selectivos
m mV,
Concentracin en mg/L
0,0
0,0
5,0
25,0
20,0
15,0
10,0
2,0 4,0 6,0 8,0 10,0
m
V
e lapendient m =
in concentrac X =
402
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
7.9.5 Equipos para medicin del pH y titulaciones potenciomtricas
a
b
Figura 7.25 a diferente modelos de medidores de pH existentes en los laboratorios de
qumica, b equipo para titulaciones potenciomtricas integrado por un potencimetro
medidor de pH y mV al cual se puede acoplar un electrodo combinado para medidas de
pH con su respectivo sensor de temperatura o un electrodo combinado de platino para
medir mV en valoraciones de oxido reduccin, una placa con agitacin magntica,
una barra de agitacin magntica, una bureta, un soporte para la bureta.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
403
7.10 Taller
17
2
7.10.1 Defna los siguientes conceptos:
Soluciones electroqumicas, actividad, reacciones de oxidacin reduccin, semicelda
electroqumica, celda electroqumica, fuerza electromotriz, ley de ohm, leyes de Faraday,
ley de Kohlrausch, ecuacin de Nernst, celdas galvnicas, celdas electrolticas, celdas
reversibles, celdas irreversibles, electrodo, electrodo estndar, ctodo, nodo, electrolito,
in, anin, catin, puente salino, diferencia de potencial, tabla de potenciales, potencial de
unin, , escala de actividad, faraday, carga elctrica, potenciometra, intensidad, resistencia,
voltmetro, ampermetro, galvanmetro, potencimetro, seguidor de voltaje, amplifcador
operacional, fuentes de: corriente alterna y corriente continua.
7.10.2. Se construy una celda a 25C utilizando los siguientes elementos: Electrodo de
Ag(s), solucin problema Ag
+
, puente salino de KCl, solucin saturada de KCl y Hg
2
Cl
2
y
electrodo de Hg (L). Se pide:
a. Identifcar el electrodo de referencia y su Potencial. Escribir el diagrama con el cual
se representa esta semicelda.
b. Especifcar si cumple las caractersticas para Ser usado como referencia.
c. Explique la funcin del puente salino y las Propiedades del KCl como electrolito.
d. Identifcar el ctodo y el nodo.
e. Escribir las semirre-acciones andica y catdica con sus potenciales estndar.
f. Escriba la reaccin completa y el potencial de la Celda si el semielemento de Ag esta
en Condiciones estndar.
g. Escribir la notacin de la pila en condiciones Estndar.
h. Determinar si es galvnica o electroltica, Reversible o irreversible.
i. Si el potencial observado para la celda es 0.4 V Calcular la concentracin de [Ag
+
]. Escribir
la notacin de la pila en estas condiciones.
j. Calcular el Kps para el AgCl con el valor de la concentracin de [Ag
+
] hallado en estas
condiciones y calcular el % de Error con relacin al valor del kps bibliogrfco.
7.10.3. Utilizando los potenciales de electrodo estndar adecuados, y aplicando la ecuacin
de Nernst, calcular el Kps del AgI. Considere la semirreaccin AgI + e
_
Ag
0
+ I
_
E
0
= -0.151 V
17 Ejercicios recopilados y elaborados por el profesor Federmn Castro Eusse para la asignatura anlisis Instrumental I
404
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
7.10.4. Verifcar mediante la aplicacin de la ecuacin de Nernst, que el potencial del
electrodo de plata cloruro de plata saturado tiene un potencial de 0.199 V a 25C.
7.10.5 Consultar qu se entiende por la defnicin operacional del pH y cul es su
importancia.
7.10.6 La celda ECS ( ) x a H =
+
elctrodo de vidrio, tiene un potencial 0.2094V cuando
la disolucin del compartimento derecho es un tampn de pH 4.006. Si se sustituye por
muestras de pH desconocido se obtienen los siguientes potenciales: a. -0,3011V y b. +0.1163V
Calcular el pH y la actividad del in hidrgeno de cada solucin problema. C. Suponiendo
una imprecisin de 0.002V en el potencial de unin, cul es el intervalo de actividades de
in hidrgeno en el que se puede esperar encontrar el valor verdadero?
7.10.7. Consultar sobre el tipo de grfcas que son utilizadas para determinar el volumen de
titulante en las valoraciones potenciomtricas y que utilidad tienen.
7.10.7.1 Con los datos de la tabla 7.4 construya las grfcas explicadas en el numeral
7.9.4.2, determine en cada una de ellas el volumen de titulante para hallar el punto de
equivalencia. Con el volumen de titulante hallado con la grfca que considere ms confable
calcule la normalidad del cido. Los datos corresponden a una valoracin de 25 mL de
HCl con NaOH 0.1 N.
Tabla 7.4
Continuacin tabla 7.4
7.10.8 Consultar las ventajas que presentan las titulaciones potenciomtricas sobre las
titulaciones de neutralizacin cido base y xido-reduccin realizadas mediante el uso de
indicadores.
7.10.9 Consultar en los catalogos de equipos para instrumentacin Quimica o en
internet sobre los ltimos modelos de medidores de pH y sus aplicaciones en el control
de calidad y de procesos.
Volumen de NaOH 0.1 N en mL 0.0 10.0 15.0 17.0 18.0 19.0 20.0 21.0 21.5 22.0 22.5 23.0 23.5
1.65 1.95 2.03 2.11 2.21 2.31 2.48 2.57 2.71 2.86 3.19 3.33 1.31
pH
Volumen de NaOH 0.1 N en mL 23.4 23.5 23.6 23.7 23.9 24.2 24.5 25.0 25.5 26
4.12 5.22 9.93 10.32 10.56 10.86 11.02 11.3 11.5 3.67
pH
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
405
Bibliografa
ALMAGRO, Huertas V. Teora y Practica Electroanlisis. (S. ed). ED Alambra, 1.969.
ALUN, Evans. Potentiometry and Ion Selectivo Electrode (Analitycal Chemistry By Open
Learning).
AYRES, Gilbert H. Anlisis Qumico Cuantitativo (2a. Ed.) Mxico: ED. Harla, 1972 octava
reimpresin...
HARRIS, C Daniel. Anlisis qumico cuantitativo. (3a Ed.) Espaa : Editorial Reverte S.A.,
c2007.
HAEVEY, David. Qumica Analtica Moderna (1. ed). Madrid: ED, Mc Graw Hill. 2002
MELOAN, Clifton E., y KISER, Robert M. Problemas y Experimentos en anlisis Instrumental.
(1a. ed.). Mxico: ED, Revert, S.A., 1973.
ROBINSON, James W., Principios de Anlisis Instrumental (1a. ed.). Zaragoza: ED, Acriba,
1974.
RUBINSON, Kenneth A; Rubinson Judith F. Qumica Analtica Contempornea (edicin en
espaol). Madrid: ED. Pearson Education; 2001.
RUBINSON, Kenneth A; Rubinson Judith F. Anlisis Instrumental (edicin en espaol). Madrid:
ED. Pearson Education; 2001.
SKOOG, Douglas A., West, Donald N. Anlisis Instrumental (1a. ed.). Mxico: ED,
Interamericana, 1975.
SKOOG, Douglas A., West, Donald N. Fundamentos de Qumica Analtica, Barcelona: ED,
Revert, S.A., 1979.
SKOOG, Douglas A. WEST Donald M. HOLLER F. James. Qumica Analtica (6a. Ed).
Colombia: ED Mcgraw-Hill 1.999.
SKOOG, Douglas A. LEARY, James J. Anlisis Instrumental (4a. ed) Espaa: ED, McGraw-Hill
1.994.
406
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
SKOOG, Douglas A; Holler F James; Nieman Timothy A. Principios de Anlisis Instrumental
(5. Ed). Madrid: ED Mcgraw-Hill 2000.
SKOOG, Douglas A. WEST Donald M. HOLLER F. James. Crouch Stanley R. Qumica Analtica
(8a. ed). Mxico: ED Thomson 2005.
SKOOG, Douglas A; Holler F James; Crouch, Stanley R. Principios de Anlisis Instrumental (6.
Ed). Mxico: ED Cengage Learning 2008.
STROBEL, Haward A. Instrumentacin Qumica (1a. ed.). Mxico: Limusa, S.A., 1988
VASSOS, Bsil H. EWIN, Galen W. Electroqumica (1. Ed) Mxico: ED, Limusa, 1.987.
WILLARD, Hobart H., Merritt, Lynnel., y Dean John A. Mtodos Instrumentales de Anlisis
(7a. ed). Mxico: ED, Grupo Editorial Iberoamrica, 1.991.
Catlogos de los diferentes Equipos medidores de pH existente en los laboratorios de la
Escuela de Qumica de la UTP.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
407
OCTAVA
UNIDAD
408
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
409
OCTAVA UNIDAD
Electrogravimetra y Culombimetra
8 Generalidades
18
1
8.1 Electrolisis y depsito electroltico.
Cuando se construye una celda electroqumica completa, por ejemplo, con una semicelda
de
+ 2
/ Zn Zn y otra de
+ 2
/ Cu Cu , el Zn se disuelve y los iones
+ 2
Cu se depositan al
estado de cobre metlico desarrollndose un potencial de 1.1 V. si se aplica un voltaje superior
a este en oposicin, la reaccin se invierte. El cobre se disuelve como in
+ 2
Cu y
los iones
+ 2
Zn se depositan. Este proceso se conoce con el nombre de electrolisis.
Cuando los electrodos se cargan elctricamente, como se indica en al figura 8.1, los
aniones, cargados negativamente, y los cationes, con carga positiva, son atrados por
los electrodos de signo opuesto. El movimiento se indica en la figura 8.1.
El voltaje que es necesario aplicar para invertir el fujo de corriente en una celda electroltica
viene dado por la ecuacin
je Sobrevolta Anodo Ctodo Celda
E IR E E E = . Ecuacin 8.1,
donde:
Ctodo
E = Potencial catdico
Anodo
E = potencial andico
IR = Cada de potencial en la celda (solucin del electrolito)
je Sobrevolta
E = sobre voltaje ocasionado por la superfcie y material del electrodo como tambin
por el desprendimiento de gases.
versible Anodo Catodo
E E E
Re
= = a la fuerza electromotriz desarrollada por la celda.
En la prctica, es necesario aplicar un voltaje ligeramente superior al calculado
tericamente para provocar el fujo de corriente. La diferencia entre el voltaje terico y el
prctico corresponde al sobre voltaje, denominado tambin sobre tensin.
En el proceso de electrodepsito que se ilustra en la figura 8.1 el voltaje necesario para
depositar cobre de la solucin se obtiene de la ecuacin 8.1.
Catodo
E para la concentracin
del
+ 2
Cu en la solucin y
Anodo
E ,se calculan mediante la aplicacin de la ecuacin de
Nernst.
18 Materiales recopilados y organizados por el profesor Federmn Castro Eusse para las asignaturas anlisis Instrumental I
y laboratorio de Anlisis Instrumental I.
Zn Zn Zn Cu Cu
Zn
Cu
Cu
Cu
IR
reversible
410
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Bajo la infuencia del voltaje aplicado, los iones
+ 2
Cu y
+
H de la solucin son atrados
por el electro negativo (ctodo); los iones
2
4
SO (aportados por la sal CuSO
4
) y
OH
por el electrodo positivo (nodo). En el ctodo, los cationes metlicos captan electrones
y se depositan tomos metlicos. Un nmero igual de electrones son liberados en el nodo
por los aniones, completndose as el circuito.
Para ilustrar las relaciones entre corriente y el voltaje durante una electrlisis a potencial fjo,
consideremos una pila de dos electrodos de platino, cada uno de ellos con una superfcie
de 100 cm
2
, sumergidos en una solucin 1.00 M respecto al ion Cu
2+
Y 1.00 M
respecto al ion H
+
y con una resistencia de de celda de 0.50 ohmio. Cuando
pasa corriente por la celda, se electrodeposita cobre sobre el ctodo y se desprende
oxigeno a una presin parcial de 1 atm en el nodo.
8.1.1 Potencial de descomposicin.
De datos de potencial estndares para las medias reacciones Se obtiene el valor de -0.89 V
para el potencial de descomposicin terico en condiciones estndar.
Semirreaccin catdica
+
+ Cu e Cu 2
2
V E 337 . 0 =
E
ctodo
Semirreaccin andica
(
+ +
+
O H e H O
2 2
2 2
2
1
V E 23 . 1 =
E
nodo
______________________________
Reaccin total
+ +
+ + + H O Cu O H Cu 2
2
1
2 2
2
V E 89 . 0 =
,
E
ctodo
- E
nodo
La reaccin general de la celda se expresa as:
+ +
+ + + H O Cu O H Cu 2
2
1
2 2
2
Cuando las condiciones no son las consideradas estndar, se aplica la ecuacin de
Nernst para calcular tericamente el potencial de descomposicin.
Ejemplo: Calcular a 25C el potencial necesario para iniciar la electrodeposicin
de cobre en una solucin que es M x
3
10 1
en
+ 2
Cu preparada a partir de CuSO
4
en
cido sulfrico 1.0
M. Utilizando electrodos de platino lisos con un rea de 100 cm
2
, una
densidad de corriente de 0.01 A/cm
2
y considerando despreciable la cada de potencial IR
en la solucin del electrolito.
En el presente ejemplo, mediante la reaccin catdica se electrodeposita el cobre en
el ctodo.
Cu
SO
OH
Cu Cu
1.23
0.89
Cu Cu
Cu Cu
Cu 10
0
0
0
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
411
Puesto que no hay presentes substancias fcilmente oxidables. La reaccin andica
consistir en la oxidacin de H
2
O para dar O
2
(observar figura 8.1). Del cuadro de
potenciales estndares hallamos el potencial para el cobre y para el agua:
+
+ Cu e Cu 2
2
Semirreaccin catdica V E 337 . 0 =
O H e H O
2 2
2 2
2
1
+ +
+
Semirreaccin andica V E 23 . 1 =
Aplicando la ecuacin de Nernst hallamos los potenciales catdico y andico.
Para el catdico se considera la concentracin del
+ 2
Cu M x
3
10 1
.
V
x
Log V E 248 . 0
10 1
1
2
059 . 0
337 . 0
3
= =
Y para el electrodo del oxigeno, suponiendo que se desprende O
2
a una presin de una
atmsfera,
( ) ( )
23 . 1
0 . 1 0 . 1
1
2
059 . 0
23 . 1
2
1
2
= = Log V E
El potencial de la celda es entonces
V V V E
Celda
981 . 0 23 . 1 2485 . 0 = =
Este es el voltaje mnimo necesario, tambin llamado potencial de descomposicin
reversible.
As, la iniciacin de la reaccin:
+ +
+ + + H O Cu O H Cu 2
2
1
2 2
2
Requerira la aplicacin de un potencial reversible superior a -0.981 V.
Cu Cu
Cu
Cu Cu
1.23
10
10
1.23
1.23
1.23
412
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Figura 8.1 Electrodeposicin de Cu de una solucin 0.001 molar en Ion Cu
2+
preparada
a partir de CuSO
4
en cido sulfrico 1.0 M utilizando Electrodos de platino, aplicando
con una fuente de corriente continua el potencial necesario. En el ctodo se deposita
Cu
y en el nodo se desprende O
2
.
Sin embargo, en la prctica, el potencial ha de ser mayor que el reversible.
El voltaje extra es debido a efectos de polarizacin y sobretensin. El potencial
necesario es la suma del potencial reversible, polarizacin y sobretensin, y
recibe el nombre de potencial de descomposicin.
Aunque no se conoce el mecanismo exacto de la sobretensin, pueden citarse algunos
factores que infuyen en su valor fnal:
a) Material electrdico. Por ejemplo, la sobretensin de hidrogeno sobre mercurio es
elevada, pero sobre electrodos de platino es casi cero.
b) Estado fsico superfcial del electrodo. Las superfcies rugosas presentan
sobretensiones ms bajas.
c) Material liberado en el electrodo. Los metales tienen un efecto despreciable en la
sobre tensin; sin embargo, el efecto de los gases puede ser considerable.
d) Naturaleza del electrolito. Las bases producen una sobretensin mayor que los
cidos.
e) La sobretensin disminuye con la agitacin y con el incremento de la temperatura
debido a que estos factores tienden a desprender productos de reaccin de la
superfcie del electrodo.
Desprendimiento
de O
2
Ctodo nodo
SO4
Pt
Pt
H
+
Cu
++
Cu
Solucin de CUSO4
V
Sistema de calentamiento y agitacin
magntica
Agitador magntico
On Off
Calentamiento
Agitacin
1 2 3 4
1 2 3 4 5
OH
-
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
413
En el ejemplo anterior, la sobretensin de O
2
sobre electrodos de platino
segn el cuadro 8.1 es de 0.85 V. La tensin de descomposicin del Cu
2+
( M x
3
10 1
) es -0.981 V + (-0.85 V) =-1.831V, es decir, potencial reversible ms
sobretensin.
Las lneas discontinuas de la figura 8.1 ilustran el comportamiento terico de corriente
y voltaje de la celda; se ve que el potencial de descomposicin es la interseccin de dos
lneas rectas. En realidad, la relacin de corriente-voltaje para este sistema se parecer ms
a la curva de lnea continua de la figura 8.1 En este caso, el supervoltaje de oxgeno en
el nodo produce el efecto de desplazar la curva hacia la derecha. Adems, comienza a
pasar una pequea corriente tan pronto como se aplica el potencial. Este fujo obedece a dos
causas. Primera. Muchas soluciones contienen pequeas concentraciones de impurezas
fcilmente producidas que pueden difundirse a la superfcie del ctodo; oxgeno y hierro
disuelto (III) son dos ejemplos comunes. Adems, parte de este fujo de corriente inicial
se debe a la reduccin de Cu
2+
de la misma. Esta aparente anomala es resultado del
supuesto de actividad unitaria para el cobre en el clculo del potencial de descomposicin
terico. Este supuesto es correcto tan pronto como el electrodo ha adquirido una capa
uniforme de cobre. Pero, al comienzo de la electrlisis, el ctodo es inicialmente platino y no
se convierte en un electrodo de cobre hasta que se produce electrodeposicin. Segunda.
Los experimentos han demostrado que la actividad de un metal en un electrodepsito que
solo cubre parcialmente una superfcie de platino es menor que uno.
Inicialmente el numerador del trmino logartmico de la ecuacin de Nernst para la
reduccin del Cu
2+
es infnitamente pequeo y se aproxima a un valor de uno solo
despus de haberse formado sobre la superfcie de platino una pelcula continua de cobre.
Como consecuencia, en realidad se produce electrodeposicin en potenciales ms positivos
que el basado en el supuesto de actividad unitaria para el cobre. Con mucha frecuencia,
la electrodeposicin de un metal sobre una superfcie de platino no comienza
repentinamente cuando se alcanza el potencial de descomposicin; aumenta gradualmente,
siendo mucho ms rpida en la regin de este potencial y ms all de ella.
Cuadro 8.1 Supervoltaje para formacin de hidrgeno en varios electrodos a 25 C
10
Pt liso
Pt platino
Au
Cu
Ni
Hg
Zn
Sn
Pb
Bi
Composicin
del electrodo
0.024
0.015
0.241
0.479
0.563
0.9
b
0.716
0.856
0.52
0.78
Supervoltaje (V),
(densidad de corriente
0.001 A/cm
2
)
H
2
O
2
0.721
0.348
0.673
0.422
0.353
0.068
0.030
0.391
0.584
0.747
1.1
c
0.746
1.077
1.090
1.05
0.85
0.521
0.963
0.580
0.519
0.676
0.048
0.798
1.269
1.241
1.1
d
1.229
1.231
1.262
1.23
1.49
0.76
1.63
0.793
0.853
Supervoltaje (V),
(densidad de corriente
0.01 A/cm
2
)
Supervoltaje (V),
(densidad de corriente
1 A/cm
2
)
H
2
O
2
H
2
O
2
414
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
La grafica 8.1 ilustra aproximadamente la diferencia que se presenta entre el voltaje
terico calculado y el voltaje experimental.
Para que se produzca la reaccin de la celda a una velocidad apreciable, es necesario
imprimir un potencial considerablemente en exceso del valor terico calculado de -1.831
V. Por ejemplo, la operacin a un nivel de corriente de 0.5 A requiere la aplicacin
de un voltaje adicional para vencer la resistencia de la celda no considerada en los
clculos tericos, experimentalmente, la resistencia de la solucin del electrolito se puede
determinar midiendo su conductividad y hallando el valor inverso ya que la resistencia es el
inverso de la conductividad. Considerando un sobrevoltaje aproximado de 0.5 V para
vencer la resistencia de la celda, dara como estimacin razonable del potencial requerido
para la operacin de la celda electroltica -2.33 V segn el clculo siguiente:
je Supervolta
nodo
Catodo Celda
E IR E E E =
V V V E
Celda
85 . 0 5 . 0 981 . 0 =
V E
Celda
33 . 2 =
Grafica 8.1, Ilustra la diferencia entre el voltaje calculado tericamente y el valor
experimental.
Sin embargo desde el punto de vista experimental realizando la elctrodeposicin mediante
el montaje ilustrado en la figura 8.3 y considerando la ley de Ohm, para mantener
constante la intensidad de 0.5 A durante la electrolisis hasta la electrodeposicin
completa del Cu
2+ ,
es necesaria la aplicacin de un mayor voltaje aproximadamente 4V
por la infuencia de otras variables no consideradas como son: La temperatura, el sistema
de agitacin utilizado, la forma geomtrica de los electrodos, el estativo para los electrodos,
la distancia de los electrodos, los cables conductores, la fuente de corriente continua usada,
la forma de la cuba electroltica o recipiente utilizado, la densidad del electrolito, y el uso de
sustancias despolarizantes.
0.85
33
C
o
r
r
i
e
n
t
e
e
n
a
m
p
e
r
i
o
s
0
0.1
0.2
0.3
0.4
0.5
-
-
-
-
-
Potencial aplicado, voltios
1.0 2.0 3.0
Curva
calculada
Curva
experimental
Potencial de
descomposicin
Potencial de
descomposicin
IR
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
415
La electrolisis se puede realizar experimentalmente mediante 3 modalidades:
1.) Electrlisis a intensidad constante como la analizada en el ejemplo anterior,
2.) Electrolisis a potencial constante y 3.) Electrlisis a potencial de ctodo controlado. Cada
modalidad presenta ventajas y desventajas sobre las dems.
8.1.2 Electrlisis con corriente constante
Puede realizarse electrodeposicin analtica manteniendo la corriente, en lugar del potencial
aplicado, en un nivel ms o menos constante. Este procedimiento requiere aumentos
peridicos de la fuerza electromotriz aplicada al avanzar la electrlisis por los cambios
presentados en la resistencia de la celda electroltica segn la ley de Ohm, considerada
anteriormente.
La polarizacin por concentracin va acompaada de una reduccin de la corriente. Para
contrarrestar este efecto, el potencial aplicado puede hacerse ms negativo; el aumento
resultante de la atraccin electroesttica hace que los iones de Cu
2+
emigren a la superfcie
del ctodo a una velocidad sufciente para mantener el fujo de corriente deseado. Pero se
produce rpidamente una situacin en la que la solucin se ha agotado tanto de ion Cu
2+
que la reduccin de esta especie por si misma es inadecuada para mantener una corriente
constante. Mayores aumentos en el voltaje aplicado provocan entonces un rpido cambio
en el potencial del ctodo hasta un punto que se produce electrodeposicin conjunta de
hidrgeno.
Entonces, el potencial del ctodo es estabilizado en un nivel fjo por el potencial estndar
y por el sobrevoltaje de la nueva reaccin del electrodo; ya no sern necesarios otros
grandes aumentos en el potencial de la celda para mantener la corriente constante. Continua
electrodepositndose cobre cuando los iones Cu
2+
llegan a la superfcie del electrodo; pero
la contribucin de este proceso del electrodo a la corriente total se hace cada vez menor a
medida que la electrodeposicin se aproxima a su fn. Pronto predomina desprendimiento de
hidrogeno.
En el trabajo electroanaltico, el vigoroso desprendimiento de gas origina depsitos
con malas cualidades fsicas. Por esta razn, la electrodeposicin a corriente constante se
emplea pocas veces o ninguna. En su lugar se permite que la corriente baje, con preferencia
a la formacin de gas.
Alternativamente, la electrolisis se realiza en presencia de una sustancia que se reduce
ms fcilmente que el hidrogeno y cuya reduccin concurrente no daa el electrodepsito
analtico. En el anlisis de Cu
2+
, por ejemplo, el ion nitrato acta de este modo, y su
reduccin a un ion amonio ocurre ms fcilmente que el desprendimiento de hidrogeno,
actuando el in
3
NO como un despolarizador segn la reaccin: NO
NO
3
+ 10 H
+
+ 8e
-
NH
4
+ 3H
2
O
+
-
416
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
8.1.3 Electrolisis con potencial de ctodo constante
De la ecuacin de Nernst se ve que una disminucin de diez veces en la concentracin de
un ion que se deposita requiere un cambio negativo de potencial de solo 0.059 /n V. as,
un ion puede ser eliminado cuantitativamente de la solucin con un cambio relativamente
pequeo en el potencial del ctodo. Como consecuencia, los mtodos electrogravimtricos
son potencialmente muy selectivos.
En el presente ejemplo, la concentracin de cobre se reduce de 0.001 M a 10
-6
M cuando el
potencial del ctodo cambia de un valor inicial de +0.248 a + 0.1597 aproximadamente 0.16
V. En teora, debe ser factible separar cobre de cualquier elemento que no se deposita dentro
de esta gama de potencial de 0.15 V; las especies que precipitan a potenciales mas positivos
que +0.248 V podran ser eliminadas por deposicin preliminar, mientras que los iones que se
electrodepositan a potenciales menores de +0.16 V no serian reducidos hasta que no termina
la electrodeposicin de cobre.
Para resumir, si se deseara aceptar una reduccin de concentracin de 1000 veces como
una separacin cuantitativa, se deduce que iones univalentes que diferen en potenciales
estndares en 0.3 V o mayores pueden ser, en teora, separados cuantitativamente por
electrodeposicin si sus concentraciones iniciales son iguales. Correspondientemente, se
requieren diferencias de 0.15 y 0.1 V para iones divalentes y trivalentes.
Una aproximacin a estos valores de separacin tericos, en un periodo de electrolisis
razonables, requieren una tcnica ms refnada que la analizada hasta ahora, porque el
comienzo de la polarizacin por concentraciones en el ctodo, si no se detiene, impedir
todas las separaciones menos las ms poco fnas. El cambio en el potencial del ctodo se
rige por la reduccin en la cada IR. As, cuando al principio pasan corrientes relativamente
grandes, puede esperarse que el cambio en el potencial del ctodo sea grande. Por el
contrario, si la celda es operada a niveles de baja corriente, el tiempo requerido para terminar
la electrodeposicin puede ser prohibitivamente largo.
Una respuesta a esta situacin es iniciar la electrlisis con un potencial de celda aplicado que
sea sufcientemente alto para asegurar un fujo razonable de corriente; al establecerse la
polarizacin por concentracin, el potencial aplicado se reduce continuamente para mantener
el potencial del ctodo en el nivel necesario para lograr la separacin deseada.
Desafortunadamente, no es factible elaborar programas de cambios aplicado sobre una base
terica, debido a los errores en las variables que afectan a la electrodeposicin, como efectos
de supervoltaje y cambios de conductividad. Ni tampoco til medir el potencial a travs de los
electrodos de trabajo, porque esto solo mide el potencial general de la pila. La alternativa es
medir el potencial del ctodo comparndolo con un tercer electrodo cuyo potencial en
la solucin es conocido y constante, es decir, un electrodo de referencia. El potencial
impreso a travs de los electrodos de trabajo puede ajustarse al nivel que impartir el potencial
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
417
deseado al ctodo respecto al electrodo de referencia.
Esta tcnica se denomina electrolisis de ctodo controlado. La diferencia de
potencial entre el electrodo de referencia y el ctodo se mide con un potencimetro, el
potencial aplicado entre los electrodos de trabajo se controla con un divisor de voltaje, de
modo que el potencial del ctodo se mantiene a un nivel apropiado para la separacin.
8.2 Efectos de variables experimentales
Para la obtencin de buenos electrodepsitos bien sea con fnes analticos o industriales es
necesario controlar una serie de variables fsicas y qumicas que afectan el proceso
electroqumico en su realizacin prctica. Entre las variables fsicas que es de importancia
controlar se encuentran: 1) La temperatura, 2) El voltaje aplicado, 3) la intensidad, 4) La
densidad de corriente (ordinariamente, se expresa en amperios/dm
2
), 5) La agitacin, 6) El
desprendimiento de gases y 7) el tiempo. De las variables qumicas deben controlarse: 1)
La concentracin de electrolito, 2) el pH, 3) El solvente, 4) La densidad de la solucin, y 5)
Los aditivos qumicos. Las condiciones correctas han sido determinadas experimentalmente
para cientos de sistemas.
Operando en condiciones adecuadas se obtienen depsitos brillantes y adherentes y no son
necesarias precauciones especiales en la manipulacin (lavado, secado, pesado, etc.),
del electrodo. En los electrodepsitos con fnes industriales y comerciales se aaden
sustancias qumicas tales como cola, gelatina y otros coloides hidrflos que actan como
abrillantadores y proporcionan una buena adherencia.
Los aditivos qumicos rara vez se utilizan en los electrodepsitos con fnes analticos ya que el
peso del electrodepsito puede ser afectado provocando una interferencia en el mtodo.
Adems del potencial y la corriente, el control de otras variables experimentales citadas
anteriormente es importante en el anlisis electrogravimtrico.
Para fnes gravimtricos, un deposito electroltico debe ser fuertemente adherente,
denso y liso, para que los procesos de lavado, secado y pesado (del electrodo
usado como ctodo) puedan ser efectuados sin perdida mecnica o sin reaccin con la
atmsfera. Los buenos depsitos metlicos son de grano fino y tienen un lustre
metlico; los precipitados esponjosos, pulverulentos o escamosos es probable que sean
menos puros y menos adherentes.
8.2.1 Desprendimiento de gas. Si se forma un gas durante una electrodeposicin,
suele obtenerse un depsito esponjoso e irregular. En las reacciones catdicas el que
ocasiona mayor interferencia usualmente es el hidrogeno, y debe tenerse siempre
cuidado de prevenir su formacin por el control de potencial del ctodo o por la adicin de un
despolarizador. Se ha indicado que el ion nitrato acta como despolarizador
en el anlisis de cobre.
418
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
8.2.2 Densidad de corriente. Los precipitados electrolticos se parecen a los
precipitados qumicos en que el tamao de sus cristales disminuye al aumentar su velocidad
de formacin, es decir, al aumentar la densidad de la corriente. Pero, en este caso, el pequeo
tamao del cristal es una caracterstica deseable, los depsitos metlicos lisos, fuertes y
adherentes contienen cristales muy fnos.
Aunque densidades de corriente moderadamente altas generalmente dan electrodepsitos
ms satisfactorios, deben evitarse los extremos; densidades de corriente muy
altas conducen a menudo a precipitados irregulares con poca resistencia fsica, que surgen
con estructuras ramifcadas de algunos puntos del electrodo. Adems, corrientes muy altas
tambin provocan polarizacin por concentracin y la concomitante formacin de gas. De
ordinario, una densidad de corriente de 0.01 y 0.1 A por cm
2
es apropiada para trabajo
electroanaltico.
8.2.3. Agitacin. La agitacin tiende a reducir la polarizacin por concentracin,
y generalmente es conveniente en una electrolisis.
8.2.4 Temperatura. Aunque la temperatura puede desempear un importante papel en
determinar las caractersticas en un electrodepsito, la prediccin de su efecto pocas veces
es posible. En el lado positivo, las temperaturas ms altas tienden a inhibir la polarizacin
por concentracin aumentando la movilidad de los iones y reduciendo la viscosidad del
disolvente.
Al mismo tiempo, las temperaturas elevadas tambin tienden a reducir al mnimo los efectos
del supervoltaje; en estas circunstancias, puede observarse aumento de la formacin de
gas.
As, la temperatura ms apropiada para una electrolisis dada solo puede determinarse
experimentalmente.
8.2.5 Variables qumicas
El xito o el fracaso de una determinacin electroltica es infuido a menudo por el medio
ambiente qumico en que se produce la electrodeposicin. El pH del medio y la presencia de
agentes complejos merecen particular atencin.
8.2.5.1 Efecto de pH. Que un metal dado pueda ser depositado completamente
o no depende frecuentemente del pH de la solucin. No se encuentra ningn problema
con especies fcilmente reducidas como el ion Cu
2+
o ion Ag
+
; estas pueden ser eliminadas
cuantitativamente por medios muy cidos sin interferencia. Por el contrario, elementos menos
fcilmente reducidos no pueden ser depositados en solucin cida, debido al desprendimiento
simultaneo de hidrogeno, as, por ejemplo, se necesitan medios neutros o alcalinos para
deposicin electroltica de Ni
2+
y Cd
2+
.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
419
El control apropiado del pH en ocasiones hace factible la separacin cuantitativa de
cationes.
Por ejemplo, el cobre se separa fcilmente por electrolisis de nquel, cadmio o cinc en
soluciones acidas. Aun si se produce concentracin extrema durante la electrodeposicin de
cobre, el cambio resultante en el potencial del ctodo no puede llegar a ser sufcientemente
grande para causar electrodeposicin simultnea de los otros metales. Al principio se produce
desprendimiento de hidrogeno; en este proceso se estabiliza el potencial del ctodo en un
valor menos negativo que el requerido para iniciar la electrodeposicin de estos metales.
8.2.5.2 Efecto de agentes formadores de complejos. Se halla empricamente
que muchos metales forman pelculas muy lisas y ms adherentes cuando son depositados
en soluciones en las que sus iones existen principalmente como complejos. Las mejores
superfcies metlicas son producidas frecuentemente de soluciones que contienen grandes
cantidades de cianuro (La tendencia actual es a no utilizar el cianuro) o amoniaco. Las
razones de este efecto no son evidentes.
La electrodeposicin de un metal de una solucin en la que su ion existe como un complejo
requiere un potencial aplicado ms alto que en la ausencia del reactivo complejo.
La magnitud de este cambio de potencial se calcula fcilmente, con tal que se conozca la
constante de formacin del ion complejo.
Ocasionalmente, la separacin electroltica de iones que ordinariamente se depositaran
juntos puede lograrse por formacin selectiva de complejos. Por ejemplo, el cobre en una
muestra de acero puede ser depositado electrolticamente de una solucin que contenga
iones fosfato o fuoruro. Aunque est presente una gran cantidad de hierro, la reduccin de
hierro (III) no se produce debido a la gran estabilidad de sus complejos con estos aniones.
8.3 Reacciones electrdicas
8.3.1 Reacciones andicas. Si se electroliza una disolucin acuosa de cloruro y
yoduro, son posibles las siguientes reacciones andicas:
Potencial reversible
1.
2.
3.
Si se aplica un potencial andico de +0.6 V, en ausencia de sobretensin, se produce la
reaccin (3) liberndose yodo en el nodo. Si es de 1.3 V, transcurren, simultneamente, los
procesos (2) y (3) y se desprenden oxigeno y yodo. Por ltimo, si el potencial andico es +
4OH
O
2
+ 2H
2
O + 4e + 1.23V
-
-
2Cl
Cl
2
+ 2e + 1.35V
-
-
2I I
2
+ 2e + 0.54V
-
-
420
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
1.4 V, se producen (2) y (3), pero la (1) queda inhibida por el gran exceso de agua presente.
El agua que rodea a los electrodos previene la reaccin andica de ion cloruro.
Esta es caracterstica importante de las reacciones electrolticas. A potenciales andicos
bajos se oxidan nicamente los aniones fcilmente oxidables. Sin embargo, si el potencial se
eleva sufcientemente, se oxidaran los iones OH
-
del agua de la disolucin. Los aniones OH
-
se
encuentran en proporcin muy superior a cualquier otro tipo de aniones, de forma que cuando
el potencial aplicado es bastante elevado, son ellos los que suministran prcticamente todos
los electrones requeridos por el nodo. De esta forma, los OH
-
provienen de la oxidacin de
otros aniones, aun cuando se encuentren a un potencial adecuado para su oxidacin.
8.3.2 Reacciones catdicas. Una solucin que contenga Zn
2+
y Cu
2+
puede dar lugar
a las siguientes reacciones:
Potencial reversible
1.
2.
3.
A un potencial catdico de + 0.4 V, el Cu se deposita. A -0.80 V, se producen las reacciones
(2) y (3), pero no la (1), que se encuentra prevenida por la descomposicin del agua. Como
en el caso anterior, se ha prescindido de los efectos de sobretensin. Asimismo, el hidrogeno
formado por reduccin de H
+
se desaprende del ctodo en forma gaseosa. La gran proporcin
de H
+
previene la descarga de los iones Zn
2+
, aun cuando el potencial sea sufciente para su
reduccin.
8.3.3 Efectos del pH en las reacciones andicas y catdicas. En soluciones
acuosas hay siempre pequeas cantidades de iones hidrogeno, H
+
, y iones oxhidrilo, OH
-
. Su
concentracin en una solucin acuosa se ajusta siempre la ecuacin:[H
+
][OH
-
]=10
-14
En
una solucin neutra, las concentraciones de hidrogeno y iones oxhidrilo son iguales; por lo
tanto, [H
+
]=[OH
-
]=10
-7
.
En soluciones acidas, la concentracin de ion hidrogeno es mayor que en solucin neutra (por
ejemplo, 10
-5
). En esta solucin, la concentracin [OH
-
] ser 10
-9
. Asimismo, las soluciones
bsicas, la concentracin [OH
-
] es mayor que en las soluciones neutras (por ejemplo, 10
-4
)
y, por tanto, la [H
+
]
ser 10
-10.
En consecuencia, las concentraciones [OH
+
] y [OH
-
] estn
directamente relacionadas con el pH de la solucin.
Las reacciones andicas se encuentran afectadas por la concentracin [OH
-
]; si es elevada,
los iones oxhidrilo se oxidan y previenen la oxidacin de otros iones, como el Cl
-
.
Pero si
[OH
-
]es baja, como sucede en una solucin cida, el potencial necesario para oxidar los
OH
-
aumenta (segn la ecuacin de Nernst) hasta tal punto que pueden llegar a oxidarse los
Cl
-
y no los
OH
-
.
Zn
Zn
2+
+ 2 e
-
- 0.763 V
H
2
2H
+
+ 2 e
-
0.000 V
Cu
Cu
2+
+ 2 e
-
+ 0.337V
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
421
Un efecto similar se observa en el ctodo. Una concentracin elevada de H
+
prevendr el
depsito de los iones nquel. Qumicamente esto es equivalente a decir que el nquel metal se
disuelve en soluciones acidas. Sin embargo, reduciendo la concentracin de H
+
(haciendo la
solucin bsica) aumenta el potencial necesario para el desprendimiento de hidrogeno.
Si la [H
+
] se reduce lo sufciente, llegar a electrodepositarse nquel sin liberacin de
hidrogeno.
8.4 Instrumentacin para realizar electrodepsitos con fines
analticos.
Se encuentran en el comercio una gran variedad de equipos para hacer electroanlisis los
cuales estn constituidos generalmente por una fuente de corriente continua (la cual puede
ser una pila, una batera, o un converti dor), una resistencia variable, cables
conductores con sus respectivos conectores, electrodos, estativo para los electrodos,
una celda para electrlisis o cuba electroltica, algn medio para la agitacin (magntico
o mecnico) y calentamiento de la solucin, e instrumentos de medida apropia-
dos tales como: Sensor de temperatura o termmetro, cronmetro, voltmetro y
ampermetro. Adems se requiere de una balanza de precisin analtica.
La figura 8.2 ilustra el diagrama de un equipo para la realizacin de electrodepsitos con
fnes analticos. Los equipos para electrodepsitos con fnes industriales son de mayor capacidad
por el tamao de los objetos a recubrir lo cual exige diseos especiales.
Figura 8.2 diagrama de un equipo simplificado para electrodepsitos con fines
analticos
8.4.1 Electrodos: Son construidos usualmente en platino, aunque pueden ser usados con
las debidas precauciones electrodos de cobre, latn, tntalo, acero inoxidable,
grafito y otros metales. Los electrodos de platinos tienen la ventaja de ser relativamente
no reactivos y pueden ser calcinados para separar cualquier grasa, materia orgnica, o gases
Ampermetro
Voltmetro
Beaker
forma alta
Ctodo de
gasa de Pt
Anodo de Pt
Motor
A
V
6 a 12 voltios cd
Resistencia
Variable
422
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
que tendran efectos perjudiciales sobre las propiedades fsicas del electrodepsito. Ciertos
metales, como bismuto, zinc y galio, no pueden ser electrodepositados directamente
sobre platino ya que causan deterioro permanente del electrodo. El platino debe ser protegido
siempre con una capa de cobre electrodepositada antes de emprender la electrlisis de
estos materiales. Igualmente el platino no debe ser usado como nodo en soluciones
que contengan altas concentraciones de in cloruro, puede desprenderse cloro en lugar
de oxgeno y producirse la oxidacin del electrodo. Para usar un nodo de platino en estas
condiciones debe ser protegido del ataque mediante la utilizacin de un despolarizador.
Figura 8.3 Ilustracin del montaje de un equipo para anlisis electroqumico
1) Fuente de corriente contina. 2.) conexin andica polo + (color rojo), 3) conexin
catdica polo negativo (color negro), 4) Conexin a tierra (color verde), 5) Instrumentos
de medida (Tablero de lectura), 6) Interruptor de la fuente, 7) voltmetro, 8) Ampermetro,
9) Controles para ajuste del voltaje, 10) Controles para ajuste de la intensidad, 11) Pilotos
indicadores de intensidad y voltaje, 12) Cables conectores de los electrodos, 13) Sistema
de calentamiento y agitacin, 14) Placa de calentamiento, 15) Control para el ajuste de
la velocidad de agitacin, 16) Control para el ajuste de la temperatura y calentamiento,
17) interruptor del sistema de calentamiento y agitacin, 18) Barra para agitacin
magntica, 19) Estativo para los electrodos, 20) Pinza para sujetar el termmetro, 21)
Termmetro, 22) pinza para sujetar el nodo, 23) Pinza para sujetar el ctodo, 24) Lmina
de platino nodo, 25) Lmina de platino ctodo, 26) Beaker que contiene el electrolito,
27) Cronmetro.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
423
Los ctodos estn formados comnmente por cilindros en malla, de 2 a 3 cm de
dimetro y unos 6 cm de altura. Esta construccin reduce al mnimo los efectos de
polarizacin, suministrando una gran rea superfcial en la cual la disolucin puede circular
libremente. Los nodos pueden ser en forma de serpentn o lmina, o un segundo electrodo
de tela metlica con dimetro menor al del ctodo, construidos en platino; los cuales pueden ser
accionados por un motor para producir una agitacin efectiva del electrolito observar figura
8.2. Si no se dispone de esta condicin ideal, el ctodo y el nodo pueden sustituirse por
pequeas lminas preferiblemente de platino.
El recipiente para la solucin del electrolito es con frecuencia una cuba electroltica de vidrio
de paredes planas o un vaso de vidrio (Beaker) de forma alta cubierto por un vidrio de reloj,
dividido que permite el acceso de los electrodos, para excluir la suciedad y minimizar la prdida
de solucin durante la electrlisis. La figura 8.3 muestra el montaje del sistema utilizado en
nuestras prcticas para hacer los electrodepsitos con fnes analticos.
8.4.2 Manejo del equipo electrolizador
8.4.2.1 Instalacin y limpieza.
Se hace el montaje del equipo indicado en la figura 8.3 en un sitio frme y seguro, libre de
vibraciones, cerciorndose que en la red de energa no existan equipos conectados que puedan
producir interferencias.
Se limpian los electrodos de platino (pequeas lminas) por inmersin en cido ntrico 6 M,
calentando la solucin cida con los electrodos durante 2 minutos (evitando el desprendi-
miento de vapores). As se remueve cualquier suciedad depositada sobre ellos, se enjuagan
con abundante agua del acueducto y destilada. Los electrodos deben ser Manejados
con una pinza (en caso de ser necesario cogerlos con las manos, debe tomarlos de la parte
que no va a quedar en contacto con la solucin, especialmente el que va a ser utilizado como
ctodo por que la grasa de las manos impide la fjacin del elemento.
El electrodo que acta como ctodo se debe secar y pesar. Se instalan los electros en el
estativo y Se adiciona a la cuba un volumen conocido de la solucin a electrodepositar y se
sumergen los electrodos hasta cubrir el ctodo y el nodo, dejando por fuera de la solucin
aproximadamente un cm de cada electrodo. Es conveniente aclarar que el circuito se cierra
cuando se sumergen los electrodos, pues, cuando estan por fuera de la solucin electroltica
el circuito esta abierto. Se ajusta la temperatura al valor requerido y una vez el termmetro
seale la temperatura programada, se ajusta la velocidad de agitacin y la intensidad requerida
regulando el voltaje, si lo que se desea es hacer un electrodepsito a intensidad
constante. Se pone en funcionamiento el cronmetro y se monitorea que permanezca
constante la intensidad, regulando el voltaje hasta el fnal de de electrodeposicn del
424
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
elemento, lo cual debe ser evidenciado mediante una prueba cualitativa que permita determinar
la ausencia del elemento en la solucin. Una vez terminada la electrodeposicin se deben retirar
los electrodos de la solucin sin suspender el voltaje. El electrodo usado como ctodo, sobre el
cual se encuentra el deposito del metal, debe ser secado y pesado.
8.5 Aplicaciones analticas
La precipitacin electroltica se ha usado a travs del tiempo como una tcnica analtica
para la determinacin electrogravimtrica de metales. El metal que se va a determinar es
electrodepositado sobre un ctodo de platino previamente pesado. La ganancia
en peso del ctodo obtenida por diferencia de peso, una vez realizado el proceso, determina
la cantidad del metal depositado; el cual por simple clculo estequiomtrico puede
relacionarse con la concentracin de este en la solucin o el porcentaje en la muestra problema
si se trata de un slido. La principal aplicacin de la Electrogravimetra est representada en el
macroanlisis. Permite separar en estado puro y cuantifcar el o los elementos de inters en
una muestra metlica. Por pesada del electrodo antes y despus del electrodepsito, se puede
determinar los constituyentes ms importantes, siempre que la diferencia entre los potenciales
necesarios sea sufciente para evitar la formacin de otros electrodepsitos. El mtodo es el
ms utilizado en la determinacin de metales de transicin, cobre y metales nobles.
El aspecto analtico de los mtodos basados en la formacin de electrodepsitos es la
separacin y pesada de los componentes seleccionados de la muestra. As, por ejemplo, una
muestra metlica puede contener nquel y cadmio. Se disuelve dicha muestra y la solucin
se electroliza para depositar selectivamente nquel en el ctodo. La cantidad de nquel se
obtiene por pesada del ctodo antes y despus de la formacin del electrodepsito. Durante
la electrolisis, el potencial catdico va aumentando al disminuir la concentracin de nquel.
Si este aumento es sufciente para provocar el electrodepsito de cadmio se producira un
error analtico.
El mtodo a seguir consiste en electrodepositar el nquel hasta que el potencial catdico
alcance un valor determinado e insufciente para electrodepositar el cadmio. Para ello,
es necesario mantener un control de potencial, por lo que el mtodo se conoce como
electrolisis de potencial controlado, siendo el mtodo ms frecuente de formacin
de electrodepsitos con fnes analticos. Actualmente se dispone de equipos comerciales que
requieren un mnimo de atencin.
La medida de potencial catdico (o andico) se lleva a cabo con un electrodo de referencia
(por ejemplo, calomelanos) procurando situarlo lo ms prximo posible a la superfcie del
electrodo, tal como se muestra en la figura 8.4. durante la electrolisis, la concentracin
inica en las inmediaciones del electrodo disminuye y es necesario un potencial ms elevado
para que contine la formacin del depsito. Cuando el voltaje alcanza un valor preestablecido,
se desconecta el circuito y cesa la electrolisis. De esta forma se previene el depsito de un
segundo metal sobre el electrodo.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
425
Figura 8.4 Ilustracin de la electrodeposicin a potencial controlado
Es evidente que siempre existe un pequeo error por el metal no depositado. Sin embargo, la
concentracin de metal no depositado puede calcularse mediante la ecuacin de Nernst.
Si el volumen de la solucin es conocido, puede calcularse la cantidad total de metal que
permanece en solucin y hacer la correccin correspondiente.
Uno de los problemas de estos depsitos electrolticos es que los electrodos deben
manejarse con sumo cuidado para evitar perdidas del metal depositado. Por otra parte, como
los electrodos deben pesarse, hay que lavarlos y secarlos cuidadosamente. Asimismo, el
depsito debe protegerse de cualquier ataque qumico, tal como la oxidacin por el aire;
cualquiera de estos factores podra implicar un error analtico.
Entre las aplicaciones de mayor inters en la electrolisis cabe citar la formacin de
electrodepsitos, que permite separar y obtener en estado puro los componentes ms
importantes de una muestra metlica. Tambin es importante su aplicacin a cargas de
bateras, estudio de reacciones electrdicas, obtencin de metales puros de sus soluciones y
eliminacin de impurezas metlicas de soluciones. Por pesada del electrodo antes y despus
del electrodepsito, se pueden determinar los constituyentes ms importantes, siempre que
la diferencia entre los potenciales necesarios sea sufciente para evitar la formacin de otros
depsitos. Este mtodo es el ms utilizado en la determinacin de metales de transicin,
cobre y metales nobles.
Bajo cuidadosas condiciones bien controladas, la tcnica se extiende a la separacin de iones
de un metal en presencia de iones de otros metales.
En condiciones adecuadas, como excepcin a este procedimiento, pueden depositarse en el
nodo PbO
2
, MnO
2
y el Tl
2
O
3
y, por lo tanto, separarse de casi todos los otros iones
metlicos. Los iones de haluros pueden electrodepositarse en un nodo de plata, selecti-
vamente, si el nodo es controlado, ya que el comportamiento del nodo es en general, anlogo
al de un ctodo.
Electrodo referencial
Cuba electroltica
Ctodo
Anodo
x x
426
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Adems de la aplicacin de esta tcnica con fnes analticos, presenta un mtodo muy
utilizado en la industria qumica para la produccin de gases, sales de diferentes elementos,
obtencin de metales puros y en los recubrimientos electroqumicos: cobrizado, niquelado,
cromado, plateado, zincado, aureado, latonado etc, que permiten proteger y dar mejor
presentacin con fnes decorativos a una variedad de artculos elaborados con materiales que
expuestos al medio ambiente se oxidan con facilidad.
8.6 Culombimetra
El mtodo analtico indicado anteriormente est basados en el peso del electrodo usado
como ctodo antes y despus del electrodepsito del elemento problema. Otra posibilidad es
medir la cantidad de electricidad necesaria para electrodepositar el metal, y a partir
de ella, calcular la cantidad de iones reducidos u oxidados. El fundamento del clculo son las
leyes de Faraday, que establecen:
1. La cantidad de una sustancia dada, que se libera en un electrodo, es proporcional a la
cantidad de electricidad que pasa a travs del sistema.
2. Las cantidades de diferentes sustancias que se depositan por la misma cantidad de
electricidad, son proporcionales a los pesos qumicos equivalentes de estas sustancias.
Estas defniciones son verdaderas nicamente si la efciencia de la corriente no vara y sea el
100% para la sustancia que est siendo medida.
En los clculos cuantitativos la cantidad de elemento determinada por diferencia de peso del
electrodo, debe ser igual a la calculada mediante las leyes de Faraday si se controlan bien
las variables intensidad y tiempo durante la electrlisis.
De los conceptos bsicos de electroqumica tratados en la qumica general se recuerda la
expresin matemtica relacionada con las leyes de Faraday IT Q = donde: a c Q arg =
en Culombs
, Intensidad I = en amperios ( ) A , Tiempo T = en segundos
( ) s . El Amperio ( ) A es la unidad de corriente,
s
C
A
1
1 = . El Culomb ( ) C es la unidad
de carga elctrica del sistema internacional (SI), igual a la carga transportada por una corriente
elctrica de un amperio que fuye un segundo.
1C= 1 As. Es la cantidad de electricidad que causar la electrodeposicin o remocin de
0.001118 g de plata en un electrodo. C 96487 son iguales a un Faraday. El Faraday
se simboliza por F . C F 96487 1 = ; es la cantidad de electricidad equivalente al nmero de
Avogadro de electrones transferidos en procesos de oxidacin reduccin.
IT
( ) C
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
427
Para reducir o electrodepositar 1 equivalente-gramo ( ) g Eq de cualquier elemento
o sustancia se necesita 1 faraday de electricidad; un equivalente gramo ( ) g Eq de
un elemento es igual al peso atmico del elemento ( ) Pae dividido por el cambio de valencia
( ) n durante la electrlisis.
( ) g Eq =
( )
( ) n
Pae
La aplicacin de la ley de Faraday se basa en el hecho de que para reducir un equivalente
gramo ( ) g Eq de cualquier sustancia se necesita la misma cantidad de electricidad. As,
por ejemplo, el equivalente-gramo de plata es: g Eg = Ag g
n
g
n
PaAg 87 . 107
=
|
.
|
\
|
Por tanto, se necesita 1 faraday C 96487 para reducir 107.87 g. de iones plata a plata
metlica.
La ley se aplica tambin a la reduccin inica simple, sin formacin de depsito. As, por
ejemplo, el ion frrico puede reducirse a ion ferroso de acuerdo con el equilibrio:
La cantidad de energa necesaria para reducir 1 equivalente-gramo de hierro ser:
Se necesita, pues, 1 faraday para reducir 55.85 g. de ion frrico a ion ferroso. Si los iones
frricos se reducen al estado metlico la cantidad de electricidad necesaria estar de acuerdo
con la reaccin:
En este caso, el cambio de valencia es tres, es decir, 1 faraday reducir 55.85/3 g. de hierro,
o bien, sern necesarios 3 faraday para reducir 55.85 g. de hierro. As, pues, la formulacin
matemtica de esta ley ser:
Peso depositado o reducido en g
( ) ( )
C
gdemetal Eq s T A I
96487
=
Eq
Eq
Eq
Eg Ag
87
Peso atomico del hierro
cambio de valencia durante la electrolisis
g =
55.85
1
g
[
[
Ag + e Ag
+
-
0
Fe + e Fe
3+
-
2+
Fe + 3e Fe
0
3+
-
Eq
Eq
( ) ( )
C
gdemetal Eq s T A I
96487
=
( ) ( )
C
gdemetal Eq s T A I
96487
=
T
g
428
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
8.6.1 Aplicaciones analticas de la Culombimetra
Entre las aplicaciones industriales ms importantes pueden citarse:
1) El control contino de la concentracin de mercaptn
2
en los materiales utilizados en la
manufactura de la goma. La muestra reacciona continuamente con bromo que se produce
culombimetricamente. El bromo reacciona con mercaptn y se reduce a bromuro. Un tercer
electrodo mide el potencial de Br
2
frente al Br
-
y, segn la medida, regula automticamente la
produccin culombimtrica de bromo.
2) En el anlisis continuo y el control en la produccin de hidrocarburos clorados. Los
hidrocarburos clorados se hacen pasar a travs de un horno caliente que los transforma en
HCl.
Este se disuelve en agua y el Cl
-
se valora con Ag
+
. Los Ag
+
se generan
Culombimetricamente.
Es necesario que la velocidad de fujo de la muestra sea constante en todo instante. La
corriente columbimtrica es proporcional a la concentracin de Cl
-
, que activa la semi-clula
Ag/AgCl durante el proceso.
3) Otro aspecto interesante es la posibilidad de obtener un reactivo en solucin. Reactivos
tales como cidos, bases, agentes reductores y oxidantes pueden obtenerse en solucin
para reaccionar de igual forma que en el anlisis volumtrico. As pues, las valoraciones
volumtrica se pueden realizar generando elctricamente el agente valorante. La cantidad
de valorante consumido se obtiene directamente de la cantidad de electricidad gastada en
producirlo. Normalmente, esta medida es mucho ms exacta que el valor obtenido por pesada
de reactivo, donde estn incluidas trazas de impurezas que pueden existir. De esta forma se
consiguen resultados ms seguros que los obtenidos con los reactivos ms puros. El lmite
de seguridad de este mtodo depende del valor del Faraday. En consecuencia, puede
considerarse como la tcnica adecuada para la preparacin de patrones primarios en anlisis
volumtrico.
8.7 Aplicaciones de los electrodepsitos y la columbimetra en el
anlisis qumico.
El siguiente ejemplo ilustra aplicaciones tpicas de los electrodepsitos y la culombimetra en
el anlisis electroqumico:
8.7.1 Para la determinacin del contenido de cobre en un mineral, despus de triturar
y tamizar la muestra, se tomaron 25 g y se le realiz el tratamiento requerido (disolucin
en cido, fltracin), el volumen del fltrado se aforo con agua destilada a 100 mL y
luego se electrolizaron hasta la completa electrodeposicin del cobre segn la
27 Modifcador de la polimerizacin del caucho (Marca registrada)
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
429
reaccin
con una intensidad constante de 0.25 A durante
10 minutos y 21 segundos. El electrodo usado como ctodo peso 1.23 g antes de la
electrodeposicin y 1,28 g despus de electrodepositado el cobre.
Calcular el %CU en el mineral obtenido electrogravimetricamente y culombimetricamente.
Desarrollo:
Con los datos de la electrogravimetra:
% de Cu en el 100
min
min X
eral gde
gCu
eral =
gCu = Peso del electrodo despus de la electrodeposicin - Peso del
electrodo antes de la electrodeposicin= 1.28g - 1.25g = 0.05g.
% de Cu en el % 2 . 0 100
min 25
05 . 0
min = = X
eral gde
gCu
eral
Con los datos de culombimetra:
IT Q = Amperios 25 . 0 = X Culombios segundos
uto
segundos
utosX 25 . 155 21
min
60
min 10 = +
% 2 . 0 100
min 25
96487
25 . 155 5 . 31
100
min 25
1
% =
= X
eral gde X
gCu Eq
C
C X
gCu Eq
gCu
X
eral gde X
gCu Eq
F
gCuXQ Eq
Cu
0.05
25
IT
25
10
60
21
25
25
25
25
Eq
Cu
Eq
Eq
Eq
31.5
Cu
2+
+ 2 e Cu ,
0
Peso equivalente del cobre
=
63g
=
31.5g segn la reaccin
2
Cu
2+
+ 2 e Cu
0
430
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Taller 8.1
8.1.1 Una muestra de cloruro estnnico fue reducida a cloruro estnnoso segn la reaccin:
La corriente aplicada fue de 9.65 A y el tiempo empleado en la reduccin, 16 minutos 40
segundos.
Se pide determinar:
8.1.1.1 El peso de ion estnnico que haba inicialmente en la muestra.
8.1.1.2 La molaridad de la solucin si se electrolizo un volumen de 250 mL de la
solucin.
8.1.2 Para determinar el % de pureza de un nitrato de nquel Ni(NO
3
)
2
calidad industrial, se
pesaron 4.00 g de la sal y despus de solubilizarlos se llevaron a un volumen de 250 mL. Se tom
un alcuota de 100 mL y se electrolizaron hasta la completa electrodeposicin del nquel segn la
reaccin Ni
2+
+ 2 e
-
Ni, En el proceso de electrlisis la intensidad permaneci constante en
0.75 A durante 25 minutos.
Se pide determinar:
8.1.2.1 El % de pureza de la sal.
8.1.2.2 La diferencia de peso esperada para el ctodo Si la determinacin de Ni en los 100mL
de solucin se hubiera realizado electrogravimetricamnte con la misma intensidad y en el mismo
tiempo.
8.1.2.3 Consultar en los catalogos de equipos para instrumentacin Quimica o en
internet sobre los ltimos modelos de equipos electrolizadores y sus aplicaciones
en el control de calidad y de procesos.
Sn + 2e Sn
2+
4+
-
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
431
Bibliografa
HARRIS, C Daniel. Anlisis qumico cuantitativo. (3a Ed.) Espaa : Editorial Reverte S.A.,
c2007.
ROBINSON, James W., Principios de Anlisis Instrumental (1a. ed.). Zaragoza: ED, Acriba,
1974.
SKOOG, Douglas A., West, Donald N. Anlisis Instrumental (1a. ed.). Mxico: ED,
Interamericana, 1975.
SKOOG, Douglas A., West, Donald N. Fundamentos de Qumica Analtica, Barcelona: ED,
Revert, S.A., 1979.
SKOOG, Douglas A. LEARY, James J. Anlisis Instrumental (4a. ed) Espaa: ED, McGraw-Hill
1.994.
STROBEL, Haward A. Instrumentacin Qumica (1a. ed.). Mxico: Limusa, S.A., 1988
VASSOS, Bsil H. EWIN, Galen W. Electroqumica (1. Ed) Mxico: ED, Limusa, 1.987.
WILLARD, Hobart H., Merritt, Lynnel., y Dean John A. Mtodos Instrumentales de Anlisis
(7a. ed). Mxico: ED, Grupo Editorial Iberoamrica, 1.991.
Catlogos de las diferentes fuentes electrolizadoras.
.
432
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
433
NOVENA
UNIDAD
434
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
435
Novena unidad
Conductimetra
9. Generalidades
19
1
9.1 Conductividad
Las soluciones electrolticas tienen la propiedad de conducir la corriente elctrica al igual
que un cable o alambre de un elemento o material conductor, siendo as lo inverso a la
resistencia, de tal manera que la solucin de un electrlito obedece la ley de Ohm
( .
Bajo la aplicacin de un campo elctrico La conduccin de una corriente elctrica a travs
de una solucin de electrolito supone migracin de especies cargadas positivamente hacia
el ctodo y cargadas negativamente hacia el nodo. La conduccin de la corriente elctrica
a travs de una disolucin inica se realiza por medio del movimiento de los iones en la
disolucin. La conductividad de una disolucin es una medida de su facilidad para transportar
corriente, los electrones son transportados por los iones. Los positivos, como el M
+
migran a
travs de la disolucin, hacia el ctodo, los aniones A
-
se dirigen hacia el nodo dando como
resultado un fujo de electrones, es decir, la disolucin conduce la electricidad.
La conductividad de la disolucin depende de dos factores: primero, el nmero de
electrones que cada in puede desplazar (as A
2-
transporta doble nmero de electrones que
A
-
), segundo la velocidad del in a travs de la disolucin.
A su vez la movilidad de un ion depende: primero, del disolvente en el cual se encuentre,
por ejemplo, agua o un solvente orgnico. Segundo, del voltaje aplicado. Tercero, del
tamao del ion, (el ms grande es menos veloz). Cuarto, la naturaleza del ion (si esta
hidratado el tamao efectivo aumenta). Quinto, viscosidad y temperatura del disolvente. En
condiciones estndar, la movilidad es una propiedad fsica caracterstica del ion. A dilucin
infnita, es el factor principal en la conductividad equivalente. A concentraciones ms
elevadas, los iones pueden formar molculas no ionizadas y la conductividad disminuye.
9.1.1 Conductancia equivalente en dilucin infinita.
La movilidad de un ion en solucin se debe a cuatro fuerzas. Una fuerza elctrica,
igual al producto del potencial del electrodo y la carga de ion, tiende a desplazar la partcula
hacia uno de los electrodos. Este efecto es parcialmente contrarrestado por una fuerza
friccional, que es una propiedad caracterstica de cada ion. En soluciones diluidas solo
estos dos efectos desempean un papel importante en la determinacin de la conductividad;
19 Materiales recopilados y organizados por el profesor Federmn Castro Eusse para las asignaturas anlisis Instrumental I
y el laboratorio de Anlisis Instrumental I.
436
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
as, en estas circunstancias, la conductancia equivalente de una sal es independiente de su
concentracin.
A concentraciones fnitas, otros dos factores, el efecto electrofortico y el efecto
de relajacin, adquieren importancia y hacen que la conductancia equivalente de una
solucin disminuya con los aumentos de concentracin.
El efecto electrofortico se debe al movimiento de los iones de carga opuesta que
rodean al ion que interesa. Estos iones arrastran molculas de disolvente; el movimiento de
la partcula primaria es retardado as por el fujo de disolvente en sentido opuesto. El efecto
de relajacin tambin debe su origen a movimiento de la atmsfera inica que rodea a
una partcula determinada. Pero, en este caso, el movimiento del ion es retardado por la
carga de signo opuesto que se acumula detrs de la partcula en movimiento.
Para electrolitos fuertes existe una relacin lineal entre la conductancia equivalente y la
raz cuadrada de la concentracin. La extrapolacin de esta relacin de lnea recta a cero
concentraciones da un valor para la conductancia equivalente en dilucin infinita
0
.
Una presentacin grafca similar de un electrolito dbil, es no lineal, y la evaluacin directa
de
0
es difcil
.
A dilucin infnita, las atracciones entre los iones se anulan; la conductancia general de
la disolucin consiste entonces en la suma de las conductancias inicas equivalentes
individuales. l + l
Donde l y l son las conductancias inicas equivalentes del catin y el anin de la sal a
dilucin infnita. Pueden determinarse conductancias inicas individuales de otras mediciones
de electrolitos; en el cuadro 9.1 aparecen valores de algunos iones comunes. Obsrvese que
se usan smbolos como , , , para destacar que las unidades
de concentracin son en equivalentes por litro. Las diferencias que existen entre la
conductancia inica equivalente de varias especies se deben principalmente a diferencias
en su tamao y en el grado de hidratacin.
La conductancia inica equivalente () es una medida de la movilidad de un ion bajo la
infuencia de un campo de fuerzas elctricas, siendo as una medida de su capacidad de
transporte de corriente.
Por ejemplo, la conductancia inica de un ion potasio es casi igual que la de un ion cloruro;
por lo tanto, una corriente que atraviesa una solucin de cloruro de potasio es transportada
casi igualmente por las dos especies. La situacin es muy diferente con el cido clorhdrico,
debido a la mayor movilidad del ion hidronio, dicha especie transporta una fraccin mayor
de la corriente [350/(350 +76)] en una electrolisis. Todos los iones contribuyen al proceso de
conduccin, pero la fraccin de corriente transporta por una especie dada es determinada
+
-
+
-
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
437
por su concentracin relativa y su movilidad inherente en el medio. La conductividad de la
corriente por la solucin resulta de la aplicacin de la fuerza elctrica y depende directamente
del nmero de partculas cargadas existentes en la misma.
Catin Anin
349.8 199.0
38.7 76.3
50.1 78.1
73.5 76.8
73.4 71.4
61.9 67.3
53.1 40.9
59.5 80.0
63.6 69.3
69.5 74.2
68.0 110.5
69.6 ----- -----
Cuadro 9.1 Conductancias inicas equivalentes a 25C
9.2 Medicin de la conductividad
Una forma de conocer la capacidad de conduccin de una disolucin electroltica es midiendo
su resistencia y hallando su valor inverso ya que la conductividad es lo inverso a la
resistencia. Pues mientras la primera denota la facilidad para conducir la corriente elctrica
y se simboliza por la letra mayscula L, la segunda manifesta la oposicin al paso de la
electricidad y se caracteriza con la letra mayscula R. La unidad de resistencia en el sistema
internacional es el Ohm (Ohmio), representado por la letra griega mayscula (omega),
igual a una resistencia que deja pasar una corriente de un amperio cuando hay una diferencia
de potencial de un voltio a travs de ella:
-1
, la unidad de conductividad es el
inverso de la unidad de resistencia el mho o simplemente el ohm a la menos uno (
-1
).
En el sistema internacional la unidad de conductividad es el siemen simbolizado por la letra
mayscula S.
-1
.
1
- 1
=1000 m
-1
(mil miliohm a la menos uno), 1
- 1
=1000000
- 1
(un milln de
micro ohm a la menos uno), igualmente son las unidades en milisiemen (mS) y en
microsiemen (S).
438
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Denominacin Nombre de unidades Smbolo de unidades
Resistencia (R) ohmio
Conductividad ohmio
-1
=mho=siemens*
-1
=
-1
= S
Resistividad () ohmio cm , ohmio metro cm , ohmio m
Conductividad especfca (k) mho cm
-1
= siemens cm
-1
-1
cm
-1
= S cm
-1
Conductividad equivalente
-1
cm
2
equiv
-1
o
S cm
2
equiv
-1
Cuadro 9.2 Unidades utilizadas en conductimetra
*siemens es una unidad del sistema internacional.
Para determinar la conductividad de una solucin se requiere sumergir los electrodos
apropiados en la solucin y por medio de un dispositivo elctrico medir su resistencia y
luego calcular el valor inverso del dato obtenido, los equipos modernos hacen este clculo
matemtico por medio de un circuito electrnico.
9.2.1 La conductividad y su medicin depende de los siguientes
Factores:
a) Del area de los electrodos.
b) De la forma geomtrica de los electrodos.
c) De la distancia de los electrodos.
d) Del material de los electrodos.
e) De la disposicin de los electrodos entre s en la disolucin.
f) Del tipo de especies inicas en la disolucin. (ion, tamao y carga del ion)
g) De la concentracin de las especies inicas.
h) Del solvente.
i) De la viscosidad de la solucin.
j) De la temperatura de la solucin.
k) Del voltaje aplicado
Como puede verse en esta lista, la medida de la resistencia no depende solamente de las
propiedades de la disolucin, sino tambin de la geometra de los instrumentos, esto es, de
los puntos a, b, c y d en la lista.
Las unidades usadas para las medidas analticas tienen en cuenta las diferencias de la
geometra y del rea de los electrodos. La resistencia se convierte en unidades como si
la medida se hubiera llevado a cabo en una celda de 1 cm
3
de volumen, entre dos placas
de electrodos, cada una de 1 cm
2
,
que estn paralelas y a 1 cm de separacin. La medida
de la resistencia en una geometra especfca se llama resistividad, sus unidades
correspondientes son, por ejemplo: ohm-cm, [(1 ohm-cm) * (1cm de longitud)
-1
* 1 cm
2
de
{
Siemens, cm
2
,equivalentes
-1
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
439
rea)= 1 ohm-cm] y se simboliza por la letra griega minscula (rho) La inversa de la
resistividad se llama conductividad especfica o conductancia especifica y
representa con la letra K y sus unidades son
-1
cm
-1
o S cm
-1
.
En un solo laboratorio y con los mismos electrodos, esta medida puede ser til para el anlisis.
Pero la informacin no sera directamente comparable entre distintos laboratorios.
Como consecuencia, la resistencia aparente, o su inversa, la conductividad, no se realiza
para describir las propiedades de las disoluciones inicas.
9.2.2 Conceptos y relaciones matemticas conductimtricas
9.2.2.1 Conductancia L. la conductancia de una solucin es el reciproco de la resistencia
elctrica y tiene unidades de ohmio
-1.
Es decir.
Donde R es la resistencia en ohmios.
9.2.2.3 Conductancia especifica k. La conductancia es directamente proporcional
al rea de la seccin transversal A e inversamente proporcional a la longitud ,
de un conductor uniforme, as, entonces:
Donde k es una constante de proporcionalidad llamada conductancia especifica.
Sin duda, es la conductancia cuando A y son numricamente iguales:
lo cual da como unidades
-1
cm
-1
, Si estos parmetros se basan en el centmetro K es
la conductancia de un cubo de lquido de un centmetro de arista. Las dimensiones de la
conductancia especfca son entonces ohmio
-1
cm
-1
.
Las conductividades especfcas de las soluciones estndar de KCl de diferentes
concentraciones molares y a distintas temperaturas son de uso frecuente como referencia
para la calibracin de los medidores de conductividad, por su utilidad en el laboratorio se
presentan sus valores para algunas de ellas en la siguiente tabla:
440
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
TEMPERATURA
CONCENTRACION DE KCl EN Mol/L
0,001 0,01 0,1 1
C mS/cm
18 0,127 1,225 11,19 98,24
19 0,130 1,251 11,43 100,16
20 0,133 1,278 11,67 102,09
21 0,136 1,305 11,91 104,02
22 0,138 1,332 12,15 105,94
23 0,141 1,359 12,39 107,89
24 0,144 1,386 12,64 109,84
25 0,147 1,413 12,89 111,80
Tabla 9.1 Valores de conductividad especifica a diferentes temperaturas
y concentraciones de KCl
Tomado de Schott Gerate informacin de celdas de conductividad
9.2.2.4 Conductancia equivalente, . La conductancia equivalente se defne como
la conductancia del equivalente gramo de un soluto contenido entre electrodos separados
1 cm. No se especifcan el volumen de la solucin y el rea de los electrodos, estos
varan para satisfacer las condiciones de la defnicin. Por ejemplo, una solucin de 1.0 N
(1 equivalente gramo por litro) requerira electrodos con reas individuales de 1000 cm
2
,
una solucin 0.1 N necesitara electrodos de 10 000 cm
2
.
Por ello, raras veces, o nunca,
se emprende la medicin directa de conductancia equivalente, a causa de la incomodidad
experimental asociada con tales electrodos relativamente grandes. En su lugar, esta cantidad
es determinada indirectamente de datos de conductancia especfca. Por defnicin, ser
igual a L cuando un equivalente gramo de soluto esta contenido entre electrodos separados
1 cm. El volumen V de la solucin (cm
3
) que contendr un equivalente gramo de soluto se
da por:
Donde C es la concentracin en equivalentes por litro (normalidad, N). Este volumen tambin
puede expresarse por las dimensiones de la pila donde es la distancia entre los
electrodos en cm y A el rea en cm
2
. Con fjado por defnicin en un centmetro,
Sustituyendo A en la ecuacin por se tiene: , pero, y
Entonces:
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
441
Las unidades de K son
-1
cm
-1
y de C equivalentes/Litro, expresando el volumen en cm
3
, las
unidades de quedan como
-1
cm
2
equiv
-1
o S cm
2
equiv
-1
.
Electrolito
Limite 0
Concentracin (equiv L
-1
)
0.001 0.01 0.1
KCl 149.86 146.95 141.27 128.96
NaCl 126.45 123.74 118.51 106.74
HCl 426.16 421.36 412.00 391.32
AgNO
3
133.36 130.51 124.76 109.14
KNO
3
144.96 141.84 132.82 120.40
NH
4
Cl 149.7 ----- 141.28 128.75
LiCl 115.03 112.40 107.32 95.86
KOH 271.5 234 228 213
NaOH 247.7 244.6 239.9 -----
Tabla 9.3 Conductividades equivalentes de diferentes sales en solucin acuosa a
25C (unidades S cm
2
equiv
-1
)*
9.2.2.5 Conductividad y concentracin inica
Como puede verse en la tabla 9.3, la conductividad de las disoluciones depende de
los tipos de iones presentes y de sus concentraciones. Todos los iones presentes en la
disolucin participan en el proceso de conduccin. Para clasifcar estas contribuciones, sirve
de ayuda tener en cuenta la conductividad por cada ion equivalente (por cada carga inica),
y se denominan conductividades equivalente, designadas por la letra griega ver
numeral 9.2.2.4. La conductividad equivalente atribuible a un ion especfco se escribe l
i.
Siempre se puede afrmar que
Las conductividades equivalentes a dilucin infnita son aditivas y algunas veces se denominan
movilidades inicas limitante, (Limitante aqu signifca en el lmite de la dilucin infnita.)
Ecuacin 9.1
*Las unidades son (S cm
2
equiv
-1
) dada la concentracin en equiv /cm
3
=
Sobre la expresin V= es necesario las siguientes aclaraciones: C se da en unidades
de concentracin de equivalentes por litro que es la normalidad (N), V es el volumen, por tanto,
NXV=al nmero de equivalentes. Luego V=
ya que N es igual a C.
1000
c
Nmero de equivalentes
N
1 equivalente
N
equivalente
litro
=
1
N litros
-1
=
1 litro
1000 mL
N N
=
1000
C
=
l
i
442
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Donde l
es la conductividad equivalente a dilucin infnita, ( es la sumatoria de la
contribucin de todos los iones con carga positiva (cationes), ( es la sumatoria de la
contribucin de todos los iones con carga negativa (aniones).
Los electrolitos fuertes son capaces de disociarse completamente en solucin. La
conductividad de una solucin de un electrolito fuerte a baja concentracin sigue la ley de
Kohlrausch la cual expresa que la conductividad equivalente es directamente proporcional
a la raz cuadrada de la concentracin siguiendo una relacin casi lineal donde la
concentracin C se expresa en equivalentes por litro (unidades de normalidad). Entonces
ser igual a la multiplicada por un valor constante m emprico que depende la naturaleza
del disolvente y la temperatura.
Ecuacin 9.2
Por otra parte, Kohlrausch tambin encontr que la conductividad limitante de aniones
y cationes son aditivas: la conductividad de una solucin de sal es igual a la suma de las
contribuciones a la conductividad de los cationes y los aniones.
La ecuacin 9.1 defne cuantitativamente que la conductividad total se compone de
las contribuciones de todos los iones presentes. En la tabla 9.1 se muestran valores
representativos de las conductividades especifcas de soluciones de una sola sal, las cuales
dependen de la concentracin. Esto se debe a las interacciones entre los iones.
Las mayores conductividades de las disoluciones de KOH, NaOH y HCl en la tabla 9.3
pueden explicarse al observar que el H
+
es unas cinco veces mejor conductor de carga en el
agua que los otros cationes, y, por otro lado, que el OH
-
es unas tres veces ms efectivo que
otros aniones. Lo que en defnitiva signifca que haciendo un experimento de conductimetra
con agua, la sensibilidad a los cambios en la concentracin de protones es unas cinco veces
mayor que otros cationes. Anlogamente, con los hidrxidos la sensibilidad seria tres veces
mayor
9.3 Instrumentos para medir la conductividad
Para medir la conductividad absoluta o la conductividad especfca, se requiere de un
instrumento denominado conductmetro, de los cuales existen anlogos y digitales,
para sobre poner en mesa, porttiles y diseos especiales para medir la conductividad en
titulaciones, procesos industriales y actuar como detectores en cromatografa de intercambio
inico. Segn su utilizacin presentan diferentes confguraciones.
Generalmente estn constituidos por:
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
443
9.3.1 Una fuente de energa
La fuente suministra corriente alterna para evitar la polarizacin electrdica por las
corrientes fardicas, de esta forma, se produce un cambio en el sentido del movimiento de
los iones cuando cambia la corriente, desapareciendo as la polarizacin y otros problemas
electrdicos.
La comodidad y disponibilidad de corriente alterna de 60 ciclos, reducida gradualmente
de 110 a voltajes entre 6 y 10 voltios es til para el instrumento, pero las mediciones con
frecuencias de 1000 Hz son ms adecuadas. Lo cual justifca su uso para muchos fnes.
9.3.2 Un recipiente (celda, cuba o cubeta), para contener la solucin del electrolito, de
los cuales existen diferentes modelos, ver figura 9.1, dependiendo del anlisis a realizar.
Se encuentran celdas adecuadas para mediciones de la conductividad de las soluciones y para
titulaciones conductimetricas.
Generalmente las celdas son construidas en vidrio o plsticos resistentes a las soluciones, son
de diferentes volmenes y disposicin de los electrodos segn los propsitos con los cuales
sea utilizada (medicin de conductividad o para titulaciones). Las celdas para titulaciones
conductimtricas, en su mayora disponen de una tabuladora lateral a la cual se acopla una
manguera y una pinza que sirve para interrumpir el paso de las soluciones facilitando el drenaje
y el lavado (observar figura 9.1 g). En otros diseos como las celdas de inmersin tienen
los electrodos en forma de anillos o placas paralelas (observar figura 9.1 a, h) y vienen
para ser sumergidas en la solucin siendo muy tiles para ambos propsitos
9.3.2.1 Electrodos
Deben ser preferiblemente de platino recubiertos con negro de platino o platinizados para
aumentar su superfcie efectiva de contacto y, por tanto, sus capacitancias para obtener
como resultado la disminucin al mnimo de las corrientes fardicas, deben estar frmemente
situados en una geometra constante de uno con relacin al otro, pueden estar dispuestos
en forma de lminas rectangulares paralelas (observar figura 9.1 a, c, e, f, g, h)
o anillos (observar figura9.1 b, d). Los electrodos pueden estar formando parte del
mismo recipiente o constituyendo una celda independiente (observar figura 9.1 b, h).
444
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Figura 9.1. Diferentes modelos de celdas para medir la conductividad: a, c, e diseos
tpicos para determinacin de conductividades, b, f, h diseos para inmersin en
la solucin; c, g diseos para titulaciones., d diseo para detector conductimtrico
en cromatografa de intercambio inico y medicin de la conductividad en fluidos
lquidos para el control de procesos.
En la ecuacin la relacin de la distancia ( en cm) de los electrodos,
con el rea de los mismos en centmetros cuadrados ( ), que constituye el cociente
Salida
Flujo
Celda sencilla
Celda de
inmersin
Celda para
conductmetro
KM2
a
b
c
d
e
f
g
h
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
445
se denomina constante de celda y usualmente se designa como por lo tanto
y sus unidades son .
Cuando el valor de es igual a la unidad;
por lo tanto quedando las unidades de , cuando los valores de la
distancia entre los electrodos y sus reas son diferentes de la unidad es necesario calcular
experimentalmente el valor de la constante . Para hacer correctamente la medicin, se
mide en el instrumento la conductividad y se multiplica por la constante de la celda para
determinar la conductividad especfca
Para estos casos el valor de la constante se , se determina midiendo la conductividad de
una solucin cuya conductividad especfca es conocida a una determinada temperatura y
de la ecuacin se obtiene que , cancelando unidades queda en
.
9.3.3 Control de temperatura
Su funcin es mantener una temperatura constante durante la medicin, un sistema peltier
o termostatizado equipado preferiblemente con su respectivo sensor de temperatura,
incorporado a la celda de conductividad y con lector de temperatura, puede garantizar
esta condicin. El coefciente de temperatura para mediciones de conductancia es en valor
promedio aproximadamente del 2% por C, como consecuencia se requiere de algn control
de temperatura durante la medicin, pero, para muchos fnes es sufciente su determinacin a
temperatura ambiente.
9.3.4 Sistema para titulaciones
Para medir la conductividad en las titulaciones conductimtricas el equipo se debe
complementar con un sistema de agitacin, una bureta de precisin, un soporte para la
bureta. El sistema de agitacin no debe ser magntico ni mecnico porque genera calor,
puede estropear los electrodos y alterar la medicin distorsionando la forma de la grfca a
medida que avanza la titulacin, por efectos de cambios en la temperatura o ubicacin de los
electrodos, para lo cual puede ser til una agitacin por turbulencia con aire.
9.3.5 Un dispositivo electrnico para medir la resistencia.
Puede ser un circuito constituido por un puente de Wheatstone o un amplificador
operacional.
446
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
9.3.5.1 Puente de Wheatstone
Uno de los equipos anlogos para medir la conductancia se fundamenta en el puente de
Wheatstone.
El circuito del puente de Wheatstone es muy sencillo ver figura 9.2 y facilita en forma
directa una comparacin entre una resistencia desconocida con resistencias normalizadas.
Figura 9.2 Circuito de un puente de Wheatstone
Los dos brazos de la resistencia del puente dividen la corriente disponible de una fuente, para que
la corriente i
1
, pase a travs de la parte superior del circuito, e i
2
a travs de la inferior.
Entre los brazos se encuentra una derivacin CD en la que se localiza un detector en cero N
que puede estar constituido por un galvanmetro, una seal visual (luz) o auditiva (sonido). El
equilibrio consiste en variar la resistencia de un brazo hasta que no cruce ninguna corriente
el puente CD.
Cuando estn en equilibrio, el potencial de los puntos C y D debe ser igual. Este resultado
se obtiene solo cuando la cada de tensin en R
1
es igual a la de R
3
y la de R
2
sea idntica a la
de R
4
. El voltaje que atraviesa cada resistencia en trminos de corriente y resistencia segn la
ley de Ohm (V=IR), deben expresarse como:
I
1
R
1
= I
2
R
3
e I
1
R
2
= I
2
R
4
. Si dividimos una igualdad por la otra, las corrientes se anulan y se
obtiene la expresin R
1
/R
2
= R
3
/R
4
, R
3
puede tomarse como la resistencia desconocida igual
a R
1
/R
2
x R
4
; y est representada en el equipo por la celda donde se deposita la sustancia a
la cual se quiere medir su conductividad o conductancia especfca.
El puente descrito anteriormente es tpico para el uso de corriente continua o alterna; para
energizarlo con corriente alterna, debe hacerse otras consideraciones introduciendo en las
resistencias que conforman los brazos del puente un condensador o capacitor que compensa
C
B
D
A
C
3
R
3
R
2 R
1
R
4
C
4
i
1
i
2
Celda
{
N
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
447
ciertas prdidas caractersticas de una corriente alterna al paso por una resistencia, evitando
fuentes de error comunes con el uso de corriente alterna; la utilizacin de este tipo de corriente
trae como ventaja el evitar la polarizacin. Adems se previene la descomposicin qumica de la
solucin que ocurrira si usramos corriente continua.
9.3.5.2 Amplificador operacional
El circuito amplificador operacional es el componente bsico de la mayora de
los modifcadores de seal analgicos. Es un amplifcador de alta ganancia que, cuando
se conecta a otros componente elctricos, puede realizar gran variedad de operaciones
matemticas sobre seales analgicas.
Figura 9.3 Amplificador operacional utilizado para mediciones de resistencia y
conductancia.
El puente de Wheatstone se puede remplazar por el amplificador operacional
como se muestra en la figura 9.3, si la celda se conecta en lugar de R
1
, resulta una corriente
1 1
ES R E I = = , que es proporcional a la conductancia de la celda. Para la medicin de
resistencias, se usa una resistencia fja R
1
a la entrada del circuito generador de corriente
y se conecta la celda en vez de R
2,
debido a que esta misma corriente pasa por la celda y
el amplifcador operacional mantiene el punto S en el potencial comn, el voltaje de salida
es igual a
celda
IR esto da por resultado una salida de voltaje directamente proporcional a la
resistencia de la celda. Si el resistor de retroalimentacin R
1
se reemplaza por un termistor
semiconductor, los cambios de temperatura de la solucin en la celda pueden ser corregidos
por el circuito. Una fuente de voltaje de pulsos elimina el calentamiento elctrico indeseable
en el termistor y sus alrededores.
9.4 Aplicaciones analticas de las mediciones conductimtricas
La conductancia es una propiedad de las soluciones electrolticas, la cual puede medirse
fcilmente, teniendo muy poca aplicacin en la identifcacin de sustancias ya que existen pocos
R
2
i
R
1
i
S
E
in
E
0
+
-
+
-
ES
IR
448
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
datos seguros sobre las conductancias especfcas de las sustancias puras. En los lquidos,
la conductancia casi siempre decrece con forme mejora la pureza, por lo tanto, cuando se
da la conductancia de un lquido, se tiene el objeto de dar el ndice de pureza ms que una
constante caracterstica. Como ejemplo el agua pura presenta una conductancia
especfica de 5 x 10
-8
ohmios
-1
cm
-1
, (una resistencia de 20 ) lo cual ha sido
utilizado como un importante mtodo para estudiar la pureza del agua destilada o desmineraliza-
da, ya que vestigios de una impureza inica aumentarn su conductancia.
Las soluciones electrolticas simples en solventes polares se adaptan en una forma
muy especial a anlisis cuantitativos por medio de tcnicas conductimtricas
basadas en curvas de calibracin las cuales se extienden desde pequeas conductancias y
concentraciones inicas muy reducidas hasta altas conductancias y grandes concentraciones.
Las mediciones de conductancia tambin son tiles para ciertos tipos de anlisis elemental. Por
ejemplo, puede analizarse hidrocarburos para determinar su contenido de azufre por combus-
tin de la muestra seguida de absorcin del bixido de azufre en perxido de hidrgeno; el
aumento de conductancia resultante del cido sulfrico puede relacionarse con la
concentracin de azufre.
Anlogamente pequeas cantidades de nitrgeno de materiales biolgicos. Pueden
determinarse por una digestin Kjeldahl ordinaria con cido sulfrico seguida de destilacin
de amonaco en una solucin de cido brico. La conductancia de la solucin del borato
de amonio resultante puede relacionarse entonces con el porcentaje de nitrgeno en la
muestra.
Las mediciones de conductancia se emplean tambin ampliamente para medir la salinidad
del agua del mar y en cromatografa de intercambio inico en la cual el sistema
de deteccin en los cromatografos de intercambio inico se fundamenta en la
conductividad medida a una determinada temperatura y con una celda especial. Finalmente las
mediciones de conductancia proporcionan mucha informacin sobre equilibrios de asociacin
y disociacin en soluciones acuosas siempre que, por supuesto, una o ms de las especies
reaccionantes sea inica.
La aplicacin de las mediciones de conductividades directas en el anlisis es limitada a
causa de la naturaleza no selectiva de esta propiedad. Los principales usos de las mediciones
directas se han reducido al anlisis de mezclas binarias agua-electrolito y a la determinacin
de concentracin total de electrlitos, por lo cual tambin existe una relacin con los slidos
totales disueltos en una solucin electroltica. Esta ltima medicin es particularmente til
como un criterio de pureza para el agua bien sea: destilada, agua desionizada, agua para
consumo humano utilizada en la industria de las bebidas refrescantes y alcohlicas, aguas
para calderas, y evaluar el porcentaje de slidos de carcter inico disueltos en aguas para
irrigar cultivos, aguas para hidropona, aguas termanales, aguas para recreacin, aguas
lluvia, aguas de escorrenta, secreciones orgnicas como la orina, el sudor etc.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
449
9.4.1 Las tcnicas conductimetricas son usadas en procesos para
controlar:
Las concentraciones inicas en arroyos y ros.
Los contenidos salinos en calderas.
La concentracin de iones a la salida de una columna de cromatografa liquida.
La concentracin de disoluciones acidas utilizadas en procesos industriales.
La concentracin de fertilizante liquido a medida que un fertilizante es aplicado.
El punto fnal de valoraciones donde la concentracin del reactivo o del valorante cambia
(por ejemplo, en valoraciones de acido- base utilizando valorante o .
Con estndares apropiados y un buen control en la temperatura podemos obtener una alta
precisin y exactitud del orden del 0.1 %. Sin embargo, estos anlisis no suelen realizarse
debido a la gran infuencia de la temperatura sobre la conductividad. Como podemos ver
en la tabla 9.1. La conductancia inica normalmente cambia un 2% por cada C. Si la
resistencia entre los electrodos es del orden de 1000 ohmios y la temperatura ambiente se
regula termostticamente a 0.1 C, entonces podemos esperar unos valores cuantitativos
entre 1-2%.
9.4.2 Titulaciones conductimtricas.
Las titulaciones conductimtricas, en las que se usan mediciones de conductancia para el
punto fnal, pueden aplicarse a la determinacin de numerosas sustancias.
La principal ventaja del punto fnal conductimtrico es su aplicacin a la titulacin de soluciones
muy diluidas y a sistemas en los que la reaccin es relativamente incompleta.
As, por ejemplo, la titulacin conductimtrica de una solucin acuosa de fenol (K
a
10
-10
) es
factible aunque el cambio en el pH en el punto de equivalencia es insufciente para un punto
fnal potenciomtrico o un punto fnal indicador.
El anlisis conductimtrico puede utilizarse en la mayor parte de las valoraciones que
implique soluciones inicas, aunque es bastante seguro, presenta la desventaja de que, a
veces, requiere una preparacin de la muestra (disolucin y dilucin) pudiendo llegar a
ser necesario muestras de tamao o volumen signifcativo (varios mL).
Cuando los iones de una solucin se sustituyen por iones de otro elemento, se produce un
cambio en la conductividad, lo cual permite un medio cmodo para determinar puntos fnales en
titulaciones, establecidos mediante mediciones sufcientes para defnir la curva de titulacin.
Los datos de conductancia se grafcan como una funcin del volumen de titulante, las dos
porciones lineales se extrapolan tomndose su interseccin como punto de
equivalencia. Aunque es necesaria una temperatura constante, no se requiere un
450
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
control estricto de esta para la realizacin de una titulacin conductimtrica correcta.
Las lneas suelen resultar ligeramente curvadas debido a:
a. Variaciones en la temperatura originadas en parte por el calor de neutralizacin.
b. Aumentos constantes en el volumen de la solucin provocados al aadir el
reactivo, por lo tanto, se hace necesario corregir la conductancia especfica por este
efecto, lo cual puede hacerse multiplicando la conductancia especfca (K) observada por un
factor de correccin (F
c
).
F
c
= (V + v)/V. Donde V es el volumen inicial de la solucin a valorar y v el volumen
de titulante agregado; la correccin presupone que la conductividad es una funcin
lineal de la dilucin; K
r
=KxF
c
, siendo K
r
la conductancia real.
Con un titulante 10 veces ms concentrado que la sustancia a valorar, se obtiene la ventaja
de tener un incremento de v ms pequeo hacindose menor el factor de correccin llegando a
veces a no ser necesario.
c. Efectos Interinicos: Los iones ajenos a la solucin pueden perturbar ligeramente la
curva, aunque en general, aumentan la conductancia en una cantidad constante.
A pesar de esto, la inflexin es pronunciada y normalmente es sufciente efectuar 3 4
lecturas a cada lado del punto de equivalencia para defnir el punto de interseccin y a partir
de este conocer el volumen de titulante gastado en la valoracin para realizar los clculos
estequiomtricos necesarios y conocer la concentracin de la solucin problema.
El mtodo conductimtrico presenta ventajas sobre los mtodos potenciomtricos e
indicadores, en las valoraciones de cidos muy dbiles, mezclas de cidos fuertes y dbiles,
soluciones muy diluidas y titulaciones basadas en equilibrio desfavorables e igualmente en
valoraciones con indicadores cuyos colores caractersticos son interferidos por la
formacin de precipitados u otros compuestos.
Aunque el mtodo es potencialmente adaptable a todos los tipos de reacciones
volumtricas, el nmero de aplicaciones tiles al sistema Redox, es limitado ya que el
exceso del In H
+
necesario para tales reacciones, por su gran movilidad tiende a enmascarar
los cambios de la conductividad asociados con la reaccin volumtrica.
Son pocas las valoraciones en las que interviene la formacin de iones complejos a las
que se puede aplicar este mtodo. En resumen pueden valorarse por conductimetra:
cidos o bases fuertes, cidos o bases dbiles, mezclas de cidos fuertes y dbiles, sustan-
cias con cuyo valorante forman precipitado (muy limitado y para lo cual es necesario
predecir el curso de la titulacin resultante antes de realizarla, con base en las
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
451
conductancias inicas equivalentes que presentan los iones constitutivos de
las soluciones.
9.4.2.1 Titulaciones de neutralizacin cido- base
Las titulaciones de neutralizacin estn particularmente bien adaptadas al punto fnal
conductimtrico, debido a la conductancia muy alta de los iones hidronio e hidroxilo comparada
con la conductancia de los productos de la reaccin.
9.4.2.1.1 Titulacin de cidos o bases fuertes.
La lnea continua de la figura 9.4 representa una curva (corregida por el cambio de
volumen) obtenida cuando se titula acido clorhdrico con hidrxido de sodio de sodio. Se
representan tambin las contribuciones calculadas de los iones individuales a la conductancia
de la solucin segn los datos de conductividad equivalente a dilucin infnita del cuadro
de datos 9.1.
La reaccin inica implicada con sus valores de conductividades equivalentes inicas a
dilucin infnita es la siguiente: Durante
la neutralizacin, los iones de hidrgeno (Hidronio son sustituidos por un nmero
equivalente de iones de sodio menos mviles, y la conductancia cambia a valores inferiores
como resultado de esta sustitucin. En el punto de equivalencia, las concentraciones de
iones hidronio e hidrxido se encuentran en un mnimo y la solucin exhibe su conductancia
ms baja pasando en conductancia equivalente a dilucin infnita de (349.8 + 76.3 = 426.1)
a (50.1 + 76.3 = 126.4). Se produce una inversin de la pendiente ms all del punto fnal
al elevarse las concentraciones de ion sodio y ion hidrxido por la adicin en exceso del
agente valorante (50.1 + 199 = 249.1). Con excepcin de la regin inmediata al punto de
equivalencia, hay una excelente linealidad entre conductancia y el volumen de base agregado,
como resultado, solo se necesitan para un anlisis dos o tres observaciones a cada lado del
punto de equivalencia.
El punto de equivalencia se halla grfcamente, extrapolando las lneas rectas con su misma
pendiente hasta su punto de corte y bajando desde all una recta, en forma perpendicular
hasta el corte con el eje del volumen, se determina el volumen de titulante consumido
para la neutralizacin. Matemticamente, se pueden determinar las dos ecuaciones de
cada segmento de las rectas,( , luego, se igualan las
ecuaciones y despejando el valor de x se encuentra el volumen
de titulante consumido para la valoracin. Este mtodo permite, cuando los puntos no caen
sobre los segmentos de la rectas en algunas titulaciones, aumentar la precisin del anlisis
haciendo un ajuste de cada segmento de recta por mnimos cuadrados.
452
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Figura 9.4 Titulacin conductimtrica de un cido fuerte HCl Con una base fuerte NaOH.
La lnea continua representa la curva de titulacin, corregida por un cambio de volumen.
Las lneas discontinuas indican la contribucin de las especies individuales, corregidas
tambin por cambio de volumen, a la conductancia de la solucin.
9.4.2.1.1.2 Titulacin de cidos o bases dbiles.
La figura 9.5a, ilustra la aplicacin del punto fnal conductimtrico a la titulacin de acido
brico (K
a
= 6 x 10
-10
) con base fuerte. Esta reaccin es tan incompleta que un punto fnal
potenciomtrico o un punto fnal indicador sera muy insatisfactorio. En las primeras etapas
de la titulacin se establece rpidamente un amortiguador que imparte a la solucin una
concentracin muy pequea y casi constante. Los iones hidrxido agregados son consumidos
por este amortiguador y no contribuyen directamente a la conductividad. Pero resulta un
aumento gradual de la conductancia, debido a la elevacin de la concentracin de iones sodio
y borato. Al alcanzar el punto de equivalencia, no se produce ms borato; mas adiciones de
base provocan un aumento ms rpido de la conductancia, debido a la mayor concentracin
del ion hidrxido mvil.
La figura 9.5 b, ilustra la titulacin de un acido moderadamente dbil, como cido actico
(K
a
10
-5
), con hidrxido de sodio. La no linealidad en las primeras porciones de la curva de
titulacin crea problemas para establecer el punto fnal; pero, con soluciones concentradas,
es factible la titulacin.
C
o
n
d
u
c
t
a
n
c
i
a
Volumen de NaOH adicionado
H
3
O
+
Cl
-
Na
+
Y
1
=m
1
x + b
1
Y
2
=m
2
x + b
2
OH
-
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
453
Figura 9.5 Curvas tpicas de titulaciones conductimtricas: a titulacin de un cido
muy dbil con hidrxido de sodio, b un cido dbil con hidrxido de sodio.
Como antes, podemos interpretar esta curva a la luz de los cambios en la composicin
que se produce. Aqu la solucin tiene inicialmente una concentracin moderada de iones
hidronio (10
-3
M). La adicin de base establece un sistema amortiguador y la consiguiente
disminucin de la concentracin de iones hidronio. Concurre con esta reduccin el incremento
de la concentracin del ion sodio y la base conjugada del cido. Estos dos factores actan
oponindose uno al otro. Al principio, predomina la disminucin de la concentracin de iones
hidronio y se observa una reduccin de la conductancia. Al progresar la titulacin, el pH se
estabiliza (en la regin amortiguadora); el aumento del contenido de la sal se convierte entonces
en el factor ms importante, y resulta fnalmente un aumento lineal de la conductancia. Ms
all del punto de equivalencia la curva adquiere pendiente ms pronunciada, debido a la
mayor conductancia inica del ion hidrxido.
En principio, todas las curvas de titulacin para cidos o bases dbiles contienen las
caractersticas generales de la figura 9.5 b. pero la ionizacin de especies muy dbiles es
tan ligera que con el establecimiento de la regin amortiguadora se produce poca o ninguna
curvatura, observar figura 9.5 a. Al aumentar la concentracin de acido (o base), aumenta
tambin el grado de curvatura en las primeras porciones de la curva de titulacin. Para
cidos o bases dbiles con constantes de disociacin mayores a 10
-5
, la curvatura se vuelve
C
o
n
d
u
c
t
a
n
c
i
a
Volumen de NaOH
C
o
n
d
u
c
t
a
n
c
i
a
Volumen de NaOH
0.1 N
0.1 N
b
a
454
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
tan pronunciada que no puede distinguirse un punto fnal.
En la figura 9.6 c, se ilustra la titulacin del mismo acido dbil que en la figura 9.5b, pero
con hidrxido de amonio en lugar de hidrxido de sodio. En este caso, como el titulante es un
electrolito dbil, la curva es esencialmente horizontal mas a halla del punto de equivalencia. El
uso del hidrxido de amonio como titulante proporciona realmente una curva que se extrapola
con menos error que la curva correspondiente basada en titulacin con hidrxido de sodio.
Figura 9.6 Curvas tpicas de titulaciones conductimtricas: c un cido dbil (K
a
10
-5
)
con hidrxido de amonio, d la sal de un cido dbil.
9.4.2.1.1.3 Titulacin de sales de cidos o bases dbiles. La figura 9.6
d, representa la curva de titulacin de una base dbil, como ion acetato, con una disolucin
estndar de acido clorhdrico.
La adicin de acido fuerte provoca la formacin de cloruro de sodio y cido actico no disociado.
El efecto neto es una ligera elevacin de la conductancia a causa de la mayor movilidad del
ion cloruro comparada con la del ion acetato al que substituye. Pasado el punto fnal, una
brusca elevacin de la conductancia sigue a la adicin de iones hidronio en exceso.
El mtodo conductimtrico es conveniente para la titulacin de sales cuyo carcter acido o
bsico es demasiado dbil para dar puntos fnales satisfactorios con indicadores.
La figura 9.7e, es tpica de la titulacin de una mezcla de dos cidos que diferen en grado
de disociacin. La titulacin conductimtrica de tales mezclas es frecuentemente ms precisa
que un mtodo potenciomtrico.
C
o
n
d
u
c
t
a
n
c
i
a
Volumen de HCI
C
o
n
d
u
c
t
a
n
c
i
a
Volumen de NH
3
c
d
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
455
Figura 9.7 e, grfica de una titulacin de una mezcla HCl y CH
3
COOH Con NaOH. f
ion cloruro con nitrato de plata.
9.4.2.1.1.4 Precipitacin y titulaciones de formacin de complejos.
La figura 9.7 f, es bastante tpica de una titulacin de precipitacin. La pendiente de la
porcin inicial de la curva puede ser hacia abajo o hacia arriba, segn la conductancia relativa
del ion que se determina y del ion de carga anloga del reactivo que lo sustituye. Una lnea de
pendiente descendente produce una curva de titulacin en forma de V que proporciona una
defnicin ms precisa del punto fnal. Por tanto, es preferible, cuando sea posible, escoger
un reactivo en que la conductancia inica del ion no reactivo sea menor a la del ion que se
titula. Entonces, segn los datos del cuadro, podemos predecir que el cloruro de litio sera
preferible al cloruro de potasio como agente precipitador para el ion plata.
Los mtodos conductimtricos basados en la precipitacin o reacciones de formacin
de complejos no son tan tiles como los mtodos en los que participan procesos de
neutralizacin.
Los cambios en la conductancia durante estas titulaciones rara veces son tan grandes
como los observados con reacciones acido-bsicas, porque ningn otro ion se aproxima
C
o
n
d
u
c
t
a
n
c
i
a
Volumen de NaOH
Punto fnal
HCI
Punto fnal
cido actico
e
C
o
n
d
u
c
t
a
n
c
i
a
Volumen de AgNO
3
f
456
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
a la conductancia del ion hidronio o el ion hidroxilo. Factores como lentitud de la reaccin y
coprecipitacin representan otras fuentes de difcultad con reacciones de precipitacin.
9.4.3 Curvas de calibracin.
Conductimetricamente, se pueden construir grfcas de calibracin de conductancia versus
concentracin, buscando experimentalmente un rango de concentracin donde se presente
un comportamiento lineal entre la conductancia y cualquier parmetro de concentracin
para al interpolar en ella la conductancia de una solucin de concentracin desconocida,
se pueda determinar su concentracin, o para obtener la ecuacin donde:
es la conductancia es la pendiente, la concentracin y la interseccin con el eje
de conductividad y mediante ella calcular la concentracin desconocida de la solucin del
electrolito.
9.5 Instrumentos comerciales para medir la conductividad
Figura 9.8 Conductmetro digital CG 857 y CG 858
9.5.1 Caractersticas Tcnicas.
Puesta en marcha
a) Antes de poner en marcha el instrumento por vez primera abrir la caja de pilas en el lado
Pantalla digital
Indicador de Bateria
Conexin celda
Control para prendido, apagado,
medicin y calibracin
Selector de medicin
Medidor constante de celda
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
457
inferior del instrumento y encajar la pila adjunta (9 V, IEC 6 F 22). El tornillo de fjacin
podr ser afojado mediante una moneda. En caso de recambio, nicamente deben usarse
pilas absolutamente resistentes a la oxidacin.
b) Podrn emplearse celdas medidoras con constantes de K= 0,75 a 1,25 cm
-1
c) Control de pilas: Est provisto el instrumento de un sistema automtico de control de pilas.
Los voltajes inferiores se sealizarn en la pantalla.
d) Para la medicin de la conductividad elctrica de una solucin electroltica
los conductmetros CG 857 y 858 cuentan con tres gamas de medicin:
Posicin del conmutador selector
de gama de medicin Gama de medicin
200 S 0.1199.9 S cm
-1
2000 S 11999 S cm
-1
200 mS 0.0119.99 mS cm
-1
e) la constante de la celda medidora de conductividad podr ajustarse de forma continua de
0,75... 1,25 cm
-1
.
f) Despus de sumergir la celda medidora de conductividad en la solucin, podr leerse el
valor directamente en la pantalla.
9.5.2 Medicin de resistencias hmicas
g) Se deber conectar la resistencia a medir a las entradas de 4mm del instrumento.
H) Ajustar a 1.00 cm
-1
la constante de celda medidora en el instrumento.
i) Se leer la Conductividad en la pantalla tras girar el Conmutador selector de gama de
medicin a la gama ms propicia. La resistencia hmica se calcular segn la relacin
siguiente:
Resistencia hmica = R[]= 1/L [
-1
]
9.5.3 Indicaciones y aclaraciones importantes respecto a la medicin
de la conductividad elctrica
J) Las superfcies metlicas de la celda medidora debern estar sumergidas por completo
en la solucin a medir. Por consiguiente, deber prestarse atencin a una profundidad
sufciente de inmersin. Las burbujas alteran el resultado, particularmente en el caso de
mediciones de caudales.
458
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
K) En todos los casos en que se mida con celdas medidoras de inmersin deber esperarse
hasta que queden constantes los valores medidos (aprox. 3s).
l) Los electrodos platinados no se debern limpiar empleando medios mecnicos. En caso
de que con agua no se logre el objetivo, es recomendable, segn el tipo de impureza,
la inmersin en cido ntrico al 1%, hidrxido sdico al 1%, o bien en disolventes
orgnicos.
Celdas medidoras de plstico con electrodos de nquel platinados debern limpiarse con
cido nicamente por un tiempo muy corto, o de ninguna manera, ya que existe el peligro
de disolucin.
m) Smbolos y frmulas utilizados en la medicin de la conductividad:
K: Conductividad especfca de una solucin electroltica indicada en
[
-1
cm
-1
] [S cm
-1
]
C: Constante de la celda medidora (factor celda) indicada en [cm
-1
].
n) El modelo CG 858 se diferencia del CG 857 en que posee un selector manual
de temperatura, un sistema de medicin automtico de temperatura mediante un sensor
incorporado en la celda y la posicin auto para calibrado.
9.5.3 Instrucciones de manejo.
a) Se lava la celda con abundante agua del acueducto, se introduce en cido ntrico
al 1% un poco caliente (precaucin: Evitar desprendimiento de
vapores), se enjuaga nuevamente con abundante agua del acueducto y luego en
agua destilada.
b) Se conecta la celda en el equipo.
c) Se ubica el control para prendido en la posicin man y luego en abs, y el control de
medicin en C.
d) Calibracin: Se introduce la celda en una solucin de KCl 0.1 M, se espera
unos 45 s y se lee la temperatura en la pantalla. Si es diferente de 25C, se tiene en
cuenta un coefciente de temperatura del 2% por C y se hacen los clculos para la
correccin respectiva a la temperatura observada. Se debe tener en cuenta que una
solucin de KCl 0.1 M a 25 C, tiene una conductividad especfca de 0.01289 S
cm
-1
equivalente a 12,89 mS cm
-1
o 12.890 S cm
-1
.
e) Se ubica el control de prendido en la posicin auto y el selector de medicin en la
posicin 20 mS cm
-1
. Se gira el medidor de constante de celda hasta que en la
pantalla se observe la conductividad especfca calculada y se deja en dicha posicin.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
459
f) Se retira la celda de la solucin, se enjuaga con abundante agua del acueducto y
luego con agua destilada, se introduce en la solucin a la cual se requiere medir la
conductividad especfca. Se ubica el control de prendido en la posicin abs, se
selecciona la escala de medicin ms adecuada para obtener la mayor exactitud en la
medida.
Figura 9.9 Conductmetro Fisher Scientific accumet AB 30
Caractersticas tcnicas
ptimo para mediciones de conductividad, resistividad y slidos totales disueltos (TDS).
Fcil estandarizacin con dos teclas tctiles.
Replatinizado de los electrodos de celda de conductividad.
Compensacin automtica de temperatura (ATC).
Chequeo automtico de la celda de conductividad mediante un mensaje en la parte baja de
la pantalla de buen electrodo o error de electrodo.
Soporte para celda.
Fuente de alimentacin de corriente continua (DC).
Completamente automtico en la seleccin rpida de las condiciones para una operacin
intuitiva.
Se puede operar con constantes de celdas de 0.1, en el rango de valores de 0.5 a 200.0 S
cm
-1
,1.0 en el rango de valores de 0.01 a 2.0 mS cm
-1
y 10.0 cm
-1
, en el rango de valores
de 1 a 200 mS cm
-1
460
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
9.6 Taller
9.6.1 Calcular las conductividades equivalente y molar del sulfato frrico Fe
2
(SO4)
3
en
solucin a dilucin infnita a 25C.
9.6.2 Calcular la fraccin de corriente transportada por el in Fe
3+
en el Fe
2
(SO
4
)
3
en
solucin a dilucin infnita a 25C.
9.6.3 A una solucin 0.1 Molar de KCl a 25C se le determino la conductividad L obtenindose
un valor de 0.0112
-1
cm
-1
, calcular la constante de la celda en la cual se realiz la
determinacin si la conductividad especfca K del KCl a 25C es 0.01289
-1
cm
-1
.
9.6.4 Una solucin de H
2
SO
4
0.02 Molar tiene una conductancia especfca (K) de
0.0164
-1
cm
-1
a 25 C. Calcular:
9.6.4.1 Su resistencia medida en una celda cuya constante de celda (C) es de 2.5 cm
-1
.
9.6.4.2.Calcular la conductancia equivalente de la solucin.
9.6.5 A 25C la conductividad equivalente de una solucin 0.005N de Hidrxido de sodio
(NaOH) es de 240 Equi
-1
-1
cm
2
. Cul es su conductividad especfca y su resistencia si
los electrodos estn separados 1 cm y cada uno tiene una superfcie de 1 cm
2
?
9.6.6 La conductancia equivalente de una solucin de cido actico 0.002414 N a 25C es
32.32 Equi
-1
-1
cm
2
. Se pide Calcular la conductancia especfca de la solucin.
9.6.7 A una solucin saturada de AgCl se le determino la conductividad especfca K a
25C obtenindose un valor de 2,3 S cm
-1
, calcular el KPS (producto de solubilidad),
compararlo con el dato bibliogrfco y calcular el porcentaje de error con el cual se obtuvo
dicho valor.
9.6.8 La conductancia especfca a 25C de una solucin saturada de sulfato de bario
(BaSO
4
) es de 4.58 X10
-6
-1
cm
-1
, y la del agua destilada es de 1.52X10
-6
-1
cm
-1
.
Cul es la solubilidad del sulfato de bario (BaSO
4
) a 25C en moles por litro y en gramos
por litro?. Calcule la constante del producto de solubilidad de esta sal, comprelo con el dato
bibliogrfco y calcule el porcentaje de error con el cual fue determinado.
9.6.9 Para determinar conductimetricamente la concentracin de un cido fuerte
(HCL) mediante una titulacin, se tomaron 25 mL del cido y se valoraron con una
base fuerte (NaOH) de concentracin 0.1 N obtenindose los resultados consignados en
la tabla de datos 9.6.9.1.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
461
Tabla de datos 9.6.9.1
mL titulante 0.00 0.50 1.00 1.50 2.00 2.50 3.00 3.50 4.0 4.5 5.00
K
-1
cm
-1
2995 2820 2530 1755 1315 910 1100 1450 1700 2030 2260
9.6.9.1 Escribir la reaccin en su forma inica.
9.6.9.2 Consultar en las tablas las conductancias inicas equivalentes a dilucin infnita
(l ) para cada uno de los iones que intervienen en la valoracin.
9.6.9.3 Con base en las conductividades equivalentes a dilucin infnita predeterminar la
forma de la grafca esperada para la titulacin.
9.6.10 Usando los valores de conductancias equivalentes a dilucin infnita, describa la
forma general de la curva de titulacin esperada en cada uno de los casos siguientes:
9.6.10.1 Valoracin Conductimtrica de una mezcla de un cido fuerte (HCl) y un cido
dbil (CH
3
COOH) con una base fuerte (NaOH).
9.6.10.2 Valoracin de BaOH
2
con HCl.
9.6.10.3 Valoracin de NH
4
Cl con NaOH.
9.6.10.4 Valoracin de nitrato de plata con cloruro de potasio.
9.6.10.5 Valoracin de acetato de plata con cloruro de litio.
9.1.11.6 Valoracin de acetato de plomo con cromato de potasio.
9.6.10.7 Valoracin de una solucin de vainillina con una solucin de hidrxido de sodio.
9.6.11 En la valoracin Conductimtrica de 25 mL de una mezcla de un cido fuerte
(HCl) y un cido dbil (CH
3
COOH) con una base fuerte (NaOH) 0.10 N. Se obtuvieron
los valores consignados en la tabla 9.6.9.2
Tabla de datos 9.6.9.2
9.6.11.1 Calcular el volumen total de titulante consumido para la valoracin de los dos
cidos.
mL titulante 0.50 1.00 1.50 2.00 2.50 3.00 3.50 4.00 4.50 5.00 5.50 6.00 6.50
1906 1587 1250 750 930 1180 1320 1510 1740 2080 2230 2420 2348
K
-1
cm
-1
0.00
7.00 7.50
3181 2540 2675
462
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
9.6.11.2 Calcular el volumen de titulante consumido para la valoracin del HCl.
9.6.11.3 Calcular el volumen de titulante consumido para la valoracin del CH
3
COOH.
9.6.11.4 Calcular la normalidad del HCl
9.1.11.5 Calcular la normalidad del CH
3
COOH.
9.6.11.6 Calcular el porcentaje de error con el cual se determino la concentracin de cada
cido si la concentracin real de cada cido en la mezcla es 0.01N.
9.6.12 Para un puente de conductancia diseado para la escala de 1% a 18% de HCl,
se recomienda una constante de celda de 20.0 cm
-1
. Las conductancias correspondientes
varan entre 0.0630 hasta aproximadamente 0.750
-1
. Cul es el intervalo de resistencias
que est implicado.
9.6.13 Consultar en los catalogos de equipos para instrumentacin Quimica o en
internet sobre los ltimos modelos de conductimetros y sus aplicaciones en el control
de calidad y de procesos.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
463
Bibliografa
HARRIS, C Daniel. Anlisis qumico cuantitativo. (3a Ed.) Espaa : Editorial Reverte S.A.,
c2007.
ROBINSON, James W., Principios de Anlisis Instrumental (1a. ed.). Zaragoza: ED, Acriba,
1974.
RUBINSON, Kenneth A; Rubinson Judith F. Qumica Analtica Contempornea (edicin en
espaol). Madrid: ED. Pearson Education; 2001.
RUBINSON,, Kenneth A; Rubinson Judith F. Anlisis Instrumental (edicin en espaol). Madrid:
ED. Pearson Education; 2001.
SKOOG, Douglas A., West, Donald N. Anlisis Instrumental (1a. ed.). Mxico: ED,
Interamericana, 1975.
SKOOG, Douglas A., West, Donald N. Fundamentos de Qumica Analtica, Barcelona: ED,
Revert, S.A., 1979.
SKOOG, Douglas A. LEARY, James J. Anlisis Instrumental (4a. ed) Espaa: ED, McGraw-Hill
1.994.
STROBEL, Haward A. Instrumentacin Qumica (1a. ed.). Mxico: Limusa, S.A., 1988
VASSOS, Bsil H. EWIN, Galen W. Electroqumica (1. Ed) Mxico: ED, Limusa, 1.987.
WILLARD, Hobart H., Merritt, Lynnel., y Dean John A. Mtodos Instrumentales de Anlisis
(7a. ed). Mxico: ED, Grupo Editorial Iberoamrica, 1.991.
Catlogos de las diferentes conductmetros.
.
464
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Formato gua para el seguimiento de las demostraciones
Objetivos:
Que el estudiante:
Reconozca los sistemas y partes que conforman el instrumento o equipo.
Conozca el cuidado que se debe tener con el equipo y las partes que lo confguran: ensamble, limpieza,
almacenamiento. Adems como se introduccin las muestras y el uso de los accesorios.
Observe como se llevan a la prctica las instrucciones, normas de seguridad y precauciones en el manejo
del equipo.
Confirme la calibracin del equipo, como tambin el manejo del software para la obtencin de datos en la
cualifcacin y cuantifcacin de compuestos.
Analice los datos y parmetros estadsticos calculados o dados por el equipo.
Observe las aplicaciones de la tcnica en el anlisis qumico cualitativo y cuantitativo en el control de calidad
de productos y procesos qumicos industriales.
Desarrollo:
1. Instrumento o equipo __________________________________
Anlogo_______, Digital _______
1.1 Marca _____________________
1.2 Modelo ________________________
1.3 Sistemas identifcados: ptico ______, Mecnico______, Elctrico ---------, Neumtico_____
Trmico _______, microprocesador ______
1.4 rango de lectura_____________________ Unidades _________ Precisin _________
1.5 Accesorios: ___________________________________________________________
1.6 Partes delicadas _______________________________________________________
1.7 Calibracin:
Sustancia de referencia _______________________ Dato de la lectura ____________
1.8 Datos obtenidos para la muestra: ________________ ______________
Identidad de la muestra __________________________ Concentracin ____________
Anexos
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
465
UNIVERSIDAD TECNOLOGICA DE PEREIRA
FACULTAD DE TECNOLOGIA
Programas en Tecnologa Qumica y Qumica Industrial
08-08-11
ASIGNATURA: ANALISIS INSTRUMENTAL I
CODIGO: QI 543 HORAS CREDITO: 3
INTENSIDAD SEMANAL: T = 3 Horas.
P = 1 Horas. TOTAL: 4
OBJETIVO: Aprobado el curso, el estudiante estar en capacidad de:
Diferenciar los conceptos, principios y leyes en los cuales se fundamentan los diversos mtodos
analticos instrumentales como tambin la confguracin y funcionamiento de los equipos.
Describir la confguracin y la funcin de las partes de la instrumentacin o equipos y explicar su
importancia en el anlisis qumico.
Determinar las condiciones operativas y el valor o el rango de los parmetros fsicos o fsicoqumicos
apropiados para un anlisis.
Aplicar las leyes en las cuales se fundamentan las tcnicas a la solucin de problemas analticos en
investigacin, control de calidad y control de procesos.
Reconocer las aplicaciones y limitaciones de las tcnicas analticas estudiadas.
Lo anterior con base en el estudio de los fenmenos originados en la interaccin de las radiaciones
electromagnticas con la materia y en las propiedades electroqumicas de las soluciones.
Esta asignatura complementa sus conocimientos de Qumica Analtica con propsitos investigativos
o de control de calidad.
CONTENIDO TEORIA:
1. Introduccin: Contextualizacin de la asignatura en el campo de la qumica analtica y
los programas acadmicos en Tecnologa Qumica y Qumica Industrial.
1.1 Generalidades de la Instrumentacin Qumica.
1.2 Clasifcacin de las tcnicas instrumentales.
1.3 Confguracin de los instrumentos o equipos.
1.4 Criterios de calidad analtica.
466
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
2. Radiaciones electromagnticas: Conceptos de: onda, longitud de onda, velocidad,
frecuencia, nmero de onda, refraccin, energa cuntica, emisin, absorcin, espectro
electromagntico. Desfase e interferencia de radiaciones, interacciones de las radiaciones
electromagnticas con la materia. Ejercicios de aplicacin.
3. Refractometra: Fenmeno de refraccin. Ley de Snell. Refraccin lmite. Refexin
total. Propiedades dispersivas de las sustancias. Instrumentacin. Medicin del ndice de
refraccin. Variacin del ndice de refraccin. Aplicaciones cualitativas y cuantitativas, error
instrumental. Ejercicios de aplicacin.
3.1 Demostracin: Partes del refractmetro, funcin de ellas, medicin del ndice de
refraccin y grados brix.
4. Polarimetra: Obtencin de la luz polarizada. Origen de la actividad ptica. Ecuacin
bsica de la polarimetra. Instrumentacin. Medicin del ngulo de giro. Variacin de la
actividad ptica. Aplicaciones cualitativas y cuantitativas, error instrumental. Ejercicios de
aplicacin.
4.1 Demostracin: Partes del polarmetro, funcin de ellas, medicin del ngulo de giro.
Ejercicios de aplicacin.
5. Fotometra de Absorcin - Principios Generales: Absorcin de las
radiaciones electromagnticas por la materia. Fenmeno del color. La ley de
Beer: signifcado de trminos y derivacin, Formas simplifcadas de la ley de Beer, estudio
grfco de la ley de Beer. Instrumentacin. Medicin de la transmitancia y la Absorbancia.
Error fotomtrico. Curvas espectrales y de calibracin. Ejercicios de aplicacin.
5.1 Fotometra de Absorcin - Instrumentacin: Fuentes de radiaciones segn
regin espectral y caractersticas tcnicas. Selectores de longitud de onda: Filtros,
monocromadores dispersivos de prismas y rejilla, funcionamiento. Celdas: Caractersticas
de los materiales y cuidados. Detectores. Sistemas de amplifcacin y lectura. Sistema de
doble haz, funcionamiento y utilidad.
5.2 Fotometra de Absorcin. Desviaciones de la Ley de Beer: Desviaciones
por no monocromaticidad, seleccin de mximos de absorcin. Desviaciones qumicas y de
equilibrio asimtrico. Efectos de temperatura, pH y tiempo sobre la absortividad.
5.3 Demostracin: Partes del fotmetro y su funcin. Los colores y su rango de longitud de
onda, curvas: Espectrales de absorcin y de calibracin.
6. Introduccin a la Espectroscopa Infrarroja: Fundamentos, principales formas de
vibracin de las molculas. Relacin de las bandas de absorcin con las funciones orgnicas
y la estructura molecular. Ejercicios de anlisis espectral IR.
7. Potenciometra: Celdas Electroqumica: escritura de celdas, potencial de electrodo,
potencial normal de electrodo, ecuacin de Nernst. Electrodos de referencia: Calomel y
plata - cloruro de plata. Electrodos indicadores: Metlicos y de membrana. Instrumentacin.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
467
Medicin del pH. Medicin directa de concentracin inica. Titulaciones potenciomtricas De:
neutralizacin, oxido-reduccin, precipitacin. Ejercicios. Aplicaciones.
7.1 Demostracin: Mediciones potenciomtricas, precauciones generales. Medicin directa
de pH. Titulacin potenciomtrica.
8. Electrogravimetra: Leyes de Faraday - Culombimetra. Relaciones voltaje intensidad
durante la electrlisis. Polarizacin. Sobrevoltaje y cada ohmica. Electrodeposiciones a:
voltaje constante, intensidad constante, con potencial controlado del ctodo. Efecto de
las variables experimentales (fsicas y qumicas) en los electrodepsitos. Instrumentacin.
Aplicaciones.
8.1 Demostracin: Obtencin de electrodepsitos.
9.0 Conductimetra: Conductividad, conductividad especfca. Conductancia inica
equivalente. Movilidades inicas. Factores que la afectan. Instrumentacin, Celda de
conductividad. Medicin de la conductividad. Aplicaciones. Titulaciones conductimtricas.
9.1 Demostracin: Manejo del equipo y mediciones conductimtricas.
METODOLOGA:
Clases Tericas: Desarrollo y explicacin en clase de los temas de cada unidad; tomando como
base los apuntes, esquemas, tablas y grfcas dados previamente por parte del profesor y con la
participacin activa de los estudiantes.
Demostraciones: Demostraciones prcticas sobre: componentes, instrucciones de manejo y
medicin en los instrumentos.
Talleres y trabajos: Ejercicios de aplicacin en los temas de las diferentes unidades.
Consultas: Realizacin de asesoras y atencin a consultas extraclase a solicitud de los
estudiantes.
468
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
Tabla No.1 programacin por unidades semanas y referencia bibliogrfica
por unidades.
Semana Unidad Horas Bibliografa recomendada por unidades
1-2 1 5 6-11-12-14-15-17-22- 23
2-3 2 4 3-11-14-15-17-18-19-20-21-22- 23
3-4 3 7 3-11-18-20-21- 23
5-6 4 6 3-6-11-15-18-20-21-23
6 1Parcial 2
7-8-9-10 5 14 1-3-6-10-11-12-14-15-17-18-20-21-22-23
10-11 6 6 10-11-13-14-15-17-18-19-20-21-22-23
12 2Parcial 2
12-13-14 7 10 1-3-10-11-12-13-14-15-17-20-21-22-24
15 8 4 1-3-10-11-12-13-14-15-20-21-24
16 9 4 11-18-19-20-21-24
18 o 19 3Parcial 2 En periodo de exmenes finales
Nota: Los nmeros de la bibliografa recomendada por unidades, corresponden a la numeracin de
los libros incluidos en la bibliografa del curso, en los cuales se trata de manera ms amplia los temas
correspondientes.
EVALUACION: Examenes escritos, desarrollo de los talleres, trabajos,
exposiciones, participacin en las demostraciones, consultas.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
469
BIBLIOGRAFIA:
1. AYRES, Gilbert H. Anlisis Qumico Cuantitativo (2a. Ed.) Mxico: ED. Harla, 1970 octava
reimpresin.
Catlogos, Software demostrativos y videos sobre los equipo
2. DAY, R.A. J.R. UNDERWOOD A.L. Qumica Analtica Cuantitativa (5a. Ed). Mxico ED,
Prentice-Hall Hispano Americana S.A., 1.989.
3. EWING, Galen W. Mtodos Instrumentales de Anlisis. (4a. ed.). Mxico: ED, Libros Mc Graw
Hill, S.A., 1978.
4. FRITZ, James S., Schenk, George H. Qumica Analtica Cuantitativa (3a. ed.). Mxico: ED,
Limusa, S.A., 1979.
5. HALLIDAY, David. RESNICK, Robert. Fsica (3a. ed). Mxico: ED, Compaa Editorial Continental.
1.982.
6. HARVEY, David. Qumica Analtica Moderna (1. ed). Madrid: ED, Mc Graw Hill. 2002
7. KENNETH, A Rubinson; Judith F. Rubinson. Anlisis Instrumental (edicin en espaol). Madrid:
Pearson Education; 2001.
8. KENNETH, A Rubinson; Judith F. Rubinson. Qumica Analtica (edicin en espaol). Madrid:
Pearson Education; 2001.
9. MUOZ, Cuauhtmoc. Prcticas de Instrumentacin Analtica Mtodos Elctricos. (1a. Ed.)
Mxico: ED. Limusa, S.A., 1981.
10. MUOZ, Cuauhtmoc Prcticas de Instrumentacin Analtica Mtodos pticos (1a. Ed). Mxico:
ED, Limusa, S.A., 1981.
11. PECSOK, Robert L., y Shields, L. Donald. Mtodos Modernos de Anlisis Qumico
(1a. ed.). Mxico: ED, Limusa, S.A., 1977.
12. SKOOG, Douglas A., West, Donald N. Anlisis Instrumental (2a. ed.). Mxico:
ED, Interamericana,1986.
13. SKOOG, Douglas A., West, Donald N. Fundamentos de Qumica Analtica, Barcelona: ED,
Revert, S.A., 1979.
14. SKOOG, Douglas A. WEST Donald M. HOLLER F. James. Qumica Analtica (6a. Ed). Colombia:
ED Mcgraw-Hill 1.999.
15. SKOOG, Douglas A. WEST Donald M. HOLLER F. James. Crouch Stanley R. Qumica Analtica
470
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
(8a. ed). Mxico: ED Thomson 2005.
16. SKOOG, Douglas A. LEARY, James J. Anlisis Instrumental (4a. ed ) Espaa: ED, McGraw-Hill
1.994.
17. SKOOG, Douglas A; Holler F James; Nieman Timothy A. Principios de Anlisis Instrumental
(5. Ed). Madrid: ED Mcgraw-Hill 2000.
Revistas:
18. Analytical Chemistry.
19. Journal of Chemical Education.
20. STROBEL, Howard A. Instrumentacin Qumica (1a. ed.). Mxico: Limusa, S.A., 1982.
21. WILLARD, Hobart H., Merritt, Lynnel., y Dean John A. Mtodos
Instrumentales de Anlisis (7a. ed ).Mxico: ED, Grupo Editorial Iberoamrica, 1.991.
22. SKOOG, Douglas A; Holler F James;Crouch Stanley R. Principios de Anlisis Instrumental (6.
Ed). Mxico: ED Cengage Learning 2007.
23. CASTRO E, Federmn. Algunos mtodos Fotomtricos y electromtricos Apuntes de Clase.
ANALISIS INSTRUMENTAL
ALGUNOS MTODOS FOTOMTRICOS Y ELECTROMTRICOS APUNTES DE CLASE
471
Вам также может понравиться
- Análisis Instrumental Algunos Métodos Fotométricos y Electrométricos Apuntes de ClaseДокумент471 страницаAnálisis Instrumental Algunos Métodos Fotométricos y Electrométricos Apuntes de ClaseFreddy CH100% (3)
- Calibración QuímicaДокумент139 страницCalibración Químicamaraperezlindo60% (5)
- Curso Experimental en Quimica Analitica 1nodrm PDFДокумент272 страницыCurso Experimental en Quimica Analitica 1nodrm PDFKosteño YourLove100% (4)
- Curso Quimica Analitica Analisis CuantitativoДокумент338 страницCurso Quimica Analitica Analisis Cuantitativolinomigueles100% (7)
- Análisis InstrumentalДокумент1 022 страницыAnálisis InstrumentalLuciano Tooper100% (2)
- Análisis Instrumental FarmaciaДокумент100 страницAnálisis Instrumental Farmaciaalejandro hernandez100% (2)
- Bio PDFДокумент30 страницBio PDFJunta Asobionor50% (2)
- Química Analítica Teoría y PrácticaДокумент576 страницQuímica Analítica Teoría y PrácticaDiana Abigail Quiroz Segoviano71% (45)
- Quimica Inorganica Vol I Gabino A. CarriedoДокумент305 страницQuimica Inorganica Vol I Gabino A. CarriedoCarlos de Jesus Limon Gutierrez100% (3)
- Química de Prod. Naturales PDFДокумент280 страницQuímica de Prod. Naturales PDFHuerto Farias100% (2)
- Guia .Quimica Analitica Cualit.Документ44 страницыGuia .Quimica Analitica Cualit.LIZBETH ELIANA AGUILAR ARTEAGAОценок пока нет
- Introducción A La Síntesis de Fármacos PDFДокумент451 страницаIntroducción A La Síntesis de Fármacos PDFsahel quezada100% (1)
- Manual Quimica AnaliticaДокумент131 страницаManual Quimica AnaliticaSalvador RochaОценок пока нет
- Ensayos FisicoquímicosДокумент23 страницыEnsayos FisicoquímicosLorena0% (2)
- Ensayos BiotecnologicosДокумент208 страницEnsayos BiotecnologicosVanesa Gacio100% (1)
- Conceptos Basicos de Quimiometria y Control de Calidad en Quimica AnaliticaДокумент139 страницConceptos Basicos de Quimiometria y Control de Calidad en Quimica AnaliticaJose Santos100% (2)
- Analisis Quimico PujolДокумент452 страницыAnalisis Quimico PujolDecanato FIQIA UNPRG100% (4)
- IPP-Gómez Torres - Análisis Instrumental. Manual de Laboratorio PDFДокумент15 страницIPP-Gómez Torres - Análisis Instrumental. Manual de Laboratorio PDFHanz Pichilingue Cruz100% (2)
- Curso de Quimica Analitica General 2ed Tomo2 CharlotДокумент198 страницCurso de Quimica Analitica General 2ed Tomo2 CharlotFelipe Saucedo100% (1)
- Manual de Practicas de Quimica AnaliticaДокумент114 страницManual de Practicas de Quimica AnaliticaHugo Montaño100% (6)
- Laboratorio de Técnicas Analíticas InstrumentalesДокумент18 страницLaboratorio de Técnicas Analíticas Instrumentalesmfernandez002100% (1)
- Manual QA 1. Clve. 1402Документ87 страницManual QA 1. Clve. 1402samo4567% (3)
- Colección de Problemas y Ejercicios de Química AnalíticaДокумент260 страницColección de Problemas y Ejercicios de Química Analíticarasl1996100% (15)
- Reactores Bioquímicos PDFДокумент314 страницReactores Bioquímicos PDFJesús Lozano Parejo100% (2)
- Introducción A La Experimentación en Química Analítica PDFДокумент264 страницыIntroducción A La Experimentación en Química Analítica PDFtbautistadiegoОценок пока нет
- Quimica Fisica - 3Документ483 страницыQuimica Fisica - 3William Curie75% (4)
- Fundamentos Espectroscopía AtómicaДокумент40 страницFundamentos Espectroscopía AtómicaMartin Fernandez100% (2)
- LIBRO Fundamentos de La Espectroscopia UV-VisДокумент150 страницLIBRO Fundamentos de La Espectroscopia UV-VisRicardo Vladimir León Francisco80% (5)
- Química Analítica Instrumental Gallardo F PDFДокумент235 страницQuímica Analítica Instrumental Gallardo F PDFDario Alonso López Adanaqué100% (2)
- Métodos Experimentales en Química Orgánica - OmarambiДокумент125 страницMétodos Experimentales en Química Orgánica - OmarambiOscar G. Marambio100% (13)
- Química: Prácticas de LaboratorioДокумент185 страницQuímica: Prácticas de LaboratorioAlfredo Herrera FigueroaОценок пока нет
- Análisis inorgánico cualitativo sistemáticoОт EverandAnálisis inorgánico cualitativo sistemáticoРейтинг: 4.5 из 5 звезд4.5/5 (2)
- Problemas resueltos de Química Analítica CuantitativaОт EverandProblemas resueltos de Química Analítica CuantitativaРейтинг: 5 из 5 звезд5/5 (3)
- Técnicas y medidas básicas en el laboratorio de químicaОт EverandTécnicas y medidas básicas en el laboratorio de químicaРейтинг: 4.5 из 5 звезд4.5/5 (6)
- Directrices ElectrotecniaДокумент6 страницDirectrices ElectrotecniaCezanne1Оценок пока нет
- 1984 - George Orwell en EspañolДокумент5 страниц1984 - George Orwell en EspañolJESUS ARBEY MUNOZ CABRERAОценок пока нет
- Practica 1 Electro Qui MicaДокумент8 страницPractica 1 Electro Qui MicaRonmel AlejandroОценок пока нет
- Introducción a la electroquimica y métodos analíticosДокумент218 страницIntroducción a la electroquimica y métodos analíticosLucho LópezОценок пока нет
- Análisis de Circuitos Eléctricos IIДокумент14 страницAnálisis de Circuitos Eléctricos IIAlan Yair Ceballos CruzОценок пока нет
- Informe Final 3 Circuitos Electricos IiДокумент26 страницInforme Final 3 Circuitos Electricos Iiheny ruth0% (1)
- CLASE1Документ30 страницCLASE1Eliana Isabel Osorio BedoyaОценок пока нет
- 2 - TALLER - Teoría Atómica y Tabla PeriódicaДокумент3 страницы2 - TALLER - Teoría Atómica y Tabla Periódicalufer94Оценок пока нет
- Medicion y Analisis de ComponentesДокумент118 страницMedicion y Analisis de Componentesjuan invernozОценок пока нет
- Componente Práctico - Fisica Electronica - MarlioДокумент20 страницComponente Práctico - Fisica Electronica - MarlioMarlio MontealegreОценок пока нет
- Ondas estacionarias en una cuerda: Análisis de resonanciaДокумент7 страницOndas estacionarias en una cuerda: Análisis de resonanciaFabian MaloОценок пока нет
- F2 Laboratorio Circuitos - Ley de OhmДокумент7 страницF2 Laboratorio Circuitos - Ley de OhmKAREN VALERIA PEREZ JIMENEZОценок пока нет
- Trabajo de InstrumentalДокумент41 страницаTrabajo de InstrumentalBranco Figueroa Ayala79% (24)
- Guia 6 OndasEstacionarias-CorregidaДокумент6 страницGuia 6 OndasEstacionarias-CorregidaDiana AlexaОценок пока нет
- Practica5-Ondas Estacionarias VirtuallДокумент10 страницPractica5-Ondas Estacionarias VirtuallFa AnibalОценок пока нет
- Análisis de Señales AleatoriasДокумент35 страницAnálisis de Señales AleatoriasMauricio MillánОценок пока нет
- 100000I73N AnalisisDeCircuitosElectricos PDFДокумент2 страницы100000I73N AnalisisDeCircuitosElectricos PDFaderОценок пока нет
- Fis Exp PDFДокумент7 страницFis Exp PDFAugusto AbuabaraОценок пока нет
- Loyola Reyes Maximiliano 1IM15 Práctica 5. Ley de OhmДокумент25 страницLoyola Reyes Maximiliano 1IM15 Práctica 5. Ley de OhmMaximilianoОценок пока нет
- Electrotecnia y Electricidad PDFДокумент5 страницElectrotecnia y Electricidad PDFMiguel Agustin GerezОценок пока нет
- Silabo Sistemas ElectricosДокумент3 страницыSilabo Sistemas ElectricosleslyОценок пока нет
- A7-6 Analisis Cuantitativo de AguasДокумент54 страницыA7-6 Analisis Cuantitativo de Aguassmcortes8762Оценок пока нет
- Manual de Analisis de Agua: Segunda Edición en EspañolДокумент220 страницManual de Analisis de Agua: Segunda Edición en EspañolLaura Isabel Tolosa100% (1)
- Estandarizacion de Prueba de DboДокумент103 страницыEstandarizacion de Prueba de DboYurly MoralesОценок пока нет
- Manual de Laboratorio de Quimica AnaliticaДокумент25 страницManual de Laboratorio de Quimica AnaliticalilipuОценок пока нет
- Solucion Hoja 2.1Документ3 страницыSolucion Hoja 2.1lilipuОценок пока нет
- Manual de Metodos de Analisis Del Agua PotableДокумент269 страницManual de Metodos de Analisis Del Agua PotablePinkerton JD IC100% (1)
- Tratamiento de Agua v1 1Документ27 страницTratamiento de Agua v1 1lilipuОценок пока нет
- Titulaciones ConductimetricasДокумент17 страницTitulaciones ConductimetricasAlexis Sánchez100% (1)
- Miller J C Estadistica para Quimica Analitica PDFДокумент113 страницMiller J C Estadistica para Quimica Analitica PDFmauricioОценок пока нет
- Adición de Ácido Cítrico en La Solución Nutritiva para Tomate en Un Suelo Calcáreo 32-3-251-255Документ5 страницAdición de Ácido Cítrico en La Solución Nutritiva para Tomate en Un Suelo Calcáreo 32-3-251-255lilipuОценок пока нет
- Ticqui PDFДокумент213 страницTicqui PDFlilipuОценок пока нет
- Apunte Complementario TP 11 EFS PDFДокумент8 страницApunte Complementario TP 11 EFS PDFlilipuОценок пока нет
- Espectroscopia de Absorción Atómica: Facultad de Ciencias Químicas UACH MC Edmundo Rocha DRДокумент27 страницEspectroscopia de Absorción Atómica: Facultad de Ciencias Químicas UACH MC Edmundo Rocha DRlilipuОценок пока нет
- Análisis Instrumental Algunos Métodos Fotométricos y Electrométricos Apuntes de Clase1Документ471 страницаAnálisis Instrumental Algunos Métodos Fotométricos y Electrométricos Apuntes de Clase1lilipu100% (10)
- Ejemplo S Calculo PotДокумент4 страницыEjemplo S Calculo PotlilipuОценок пока нет
- Libro ArsénicoДокумент242 страницыLibro ArsénicoLUCHY43100% (2)
- Pto de Equivalencia, Determinacion GraficaДокумент3 страницыPto de Equivalencia, Determinacion Graficamanolete4321Оценок пока нет
- El Cuaderno Del LaboratorioДокумент7 страницEl Cuaderno Del LaboratoriolilipuОценок пока нет
- Guia de ElectroquimicaДокумент3 страницыGuia de ElectroquimicalilipuОценок пока нет
- Colección de Problemas y Ejercicios de Química AnalíticaДокумент260 страницColección de Problemas y Ejercicios de Química Analíticarasl1996100% (15)
- Problemas ResueltosДокумент7 страницProblemas Resueltoslilipu33% (6)
- Publicación en El BOE de 7 Nuevos Títulos de FP BásicaДокумент507 страницPublicación en El BOE de 7 Nuevos Títulos de FP BásicaFETE-UGT ExtremaduraОценок пока нет
- Presentacion IДокумент26 страницPresentacion IlilipuОценок пока нет
- Acido Base-AP y Ejerc IДокумент9 страницAcido Base-AP y Ejerc IlilipuОценок пока нет
- Quimica Analitica 2 - Electroanalisis Clase 2010Документ14 страницQuimica Analitica 2 - Electroanalisis Clase 2010lilipuОценок пока нет
- Material de LaboratorioДокумент1 страницаMaterial de LaboratoriolilipuОценок пока нет
- Selectividad - Reacciones de Transferencia de ElectronesДокумент4 страницыSelectividad - Reacciones de Transferencia de ElectroneslilipuОценок пока нет
- Manual de Quimica Ambiental I PDFДокумент65 страницManual de Quimica Ambiental I PDFMilton OlivellaОценок пока нет
- RuidoДокумент21 страницаRuidoanairaeneriОценок пока нет
- Resumen IRДокумент2 страницыResumen IRCésar ZamudioОценок пока нет
- Diagrama 8Документ4 страницыDiagrama 8Dani CrОценок пока нет
- Reporte 3 ATEMДокумент14 страницReporte 3 ATEMMAURICIO ALANIS SANTOYOОценок пока нет
- Curso Espectroscopia 2022 IRДокумент55 страницCurso Espectroscopia 2022 IRCarlos SepulvedaОценок пока нет
- Espectroscopía IRДокумент6 страницEspectroscopía IRFioreОценок пока нет
- Aplicaciones de La Espectroscopia Infrarroja I 14Документ42 страницыAplicaciones de La Espectroscopia Infrarroja I 14FelipeSalinas100% (1)
- Análisis de Pintura Automotriz Mediante Espectroscopía Raman.Документ17 страницAnálisis de Pintura Automotriz Mediante Espectroscopía Raman.DENIS JOEL CIFUENTES CANOОценок пока нет
- DCA-741 Métodos Espectroscópicos para Análisis de AlimentosДокумент13 страницDCA-741 Métodos Espectroscópicos para Análisis de AlimentosPosgrado en Ciencia y Tecnología Agroalimentaria100% (1)
- Práctica 09 - Espectroscopía IRДокумент14 страницPráctica 09 - Espectroscopía IRWENDY SERNAQUE VELASQUEZОценок пока нет
- Espectroscopia InfrarrojaДокумент17 страницEspectroscopia InfrarrojaCitlali Carrera LopezОценок пока нет
- L4 - Espectroscopía Infrarroja y Ultravioleta-VisibleДокумент15 страницL4 - Espectroscopía Infrarroja y Ultravioleta-VisibleJan Paul MontesОценок пока нет
- Informe Final NaftalenoДокумент6 страницInforme Final NaftalenoLaura ToroОценок пока нет
- Manual de Uso - HGIR-Force 200Документ20 страницManual de Uso - HGIR-Force 200DanielОценок пока нет
- Informe - Instrumental - IrДокумент8 страницInforme - Instrumental - IrAdriana Cangrejo YantenОценок пока нет
- Uso Del Analisis Espectroscopico en La Industrial TextilДокумент18 страницUso Del Analisis Espectroscopico en La Industrial TextilRosalía MirandaОценок пока нет
- Determinación de Grupos Funcionales Mediante Espectroscopia IRДокумент7 страницDeterminación de Grupos Funcionales Mediante Espectroscopia IRKarina OvalleОценок пока нет
- Espectroscopia de InfrarrojoДокумент53 страницыEspectroscopia de InfrarrojoOscar Arias100% (1)
- Cromatografia en Columna Extractos Vegetales PDFДокумент16 страницCromatografia en Columna Extractos Vegetales PDFHéctor Balmori0% (1)
- Quimica Espectros InfrarrojosДокумент13 страницQuimica Espectros InfrarrojosJorge Luis Martínez ChaupeОценок пока нет
- Expo MaterialesДокумент4 страницыExpo MaterialesAndrés Felipe LópezОценок пока нет
- Informe Farmaco AlcaloidesДокумент10 страницInforme Farmaco AlcaloidesDenilson David Loayza CallisayaОценок пока нет
- Determinacion de Grupos Funcionales MediДокумент5 страницDeterminacion de Grupos Funcionales MediANDRES MAURICIO CHAMORRO MUNOZОценок пока нет
- Caracterización Química y Física de Una Arcilla de Alta AlúminaДокумент15 страницCaracterización Química y Física de Una Arcilla de Alta AlúminaDaro Torrico OrellanaОценок пока нет
- Instrumental IR IbuprofenoДокумент22 страницыInstrumental IR Ibuprofenoart95Оценок пока нет
- Segunda Serie IRДокумент8 страницSegunda Serie IRfercho_rulesОценок пока нет
- ANGIE RODELO EspectrosДокумент3 страницыANGIE RODELO EspectrosANGIE PAOLA RODELO PANZAОценок пока нет
- Principios y Aplicaciones de La Espectroscopia de InfrarrojoДокумент6 страницPrincipios y Aplicaciones de La Espectroscopia de InfrarrojoPerorina ellieОценок пока нет
- Actividad02 Caracterizacion de MaterialesДокумент8 страницActividad02 Caracterizacion de MaterialesDiego RodriguezОценок пока нет
- Espectrofotómetros InfrarrojoДокумент7 страницEspectrofotómetros InfrarrojoLizbethОценок пока нет
- Sintesis Del Ligando KetoprofenoДокумент2 страницыSintesis Del Ligando KetoprofenoRusbel RiosОценок пока нет