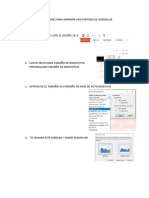
Академический Документы
Профессиональный Документы
Культура Документы
Propiedades de Los Compuestos Iónicos
Загружено:
Angélica Ushiña ReinosoАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Propiedades de Los Compuestos Iónicos
Загружено:
Angélica Ushiña ReinosoАвторское право:
Доступные форматы
PROPIEDADES DE LOS COMPUESTOS INICOS
Compuesto inico:
Es la unin que resulta de la presencia de fuerzas de atraccin electrostticaentre los
iones de distinto signo. Se da cuando uno de los tomos capta electrones del otro.
El metal dona uno o ms electrones formando iones con carga positiva o cationes con
una configuracinelectrnica estable. Estos electrones luego ingresan en el no metal,
originando un ion cargado negativamente o anin, que tambin tiene configuracin
electrnica estable. La atraccin electrosttica entrelos iones de carga opuesta causa
que se unan y formen un enlace.
Los compuestos inicos forman redes cristalinas constituidas por iones de carga
opuesta unidos por fuerzas electrostticas. Este tipo deatraccin determina las
propiedades observadas. Si la atraccin electrosttica es fuerte, se forman slidos
cristalinos de elevado punto de fusin e insolubles en agua; si la atraccin es menor,
comoen el caso del NaCl, el punto de fusin tambin es menor y, en general, son
solubles en agua e insolubles en lquidos no polares como el benceno.
PROPIEDADES DE LOS COMPUESTOS IONICOS
Cuando hablamos de propiedades de un compuesto, principalmente nos referimos a:
estado de agregacin a temperatura ambiente (puntos de fusin y de ebullicin),
conductividad elctrica, dureza y solubilidad en disolventes polares y apolares. Varias
de estas propiedades dependen de la fuerza del enlace qumico implicado. En el caso
del enlace inico, los iones se hallan unidos fuertemente entre s, porque las
atracciones electrostticas entre iones de signo opuesto, son intensas. As, para fundir
o evaporar un compuesto inico, habr que aportar una gran cantidad de energa,
porque ser necesario romper las interacciones catin-anin. Esto hace que se
requieran temperaturas elevadas.
De forma general, las propiedades de los compuestos inicos son:
Slidos a temperatura ambiente. Las fuerzas que mantienen unidos los iones
son fuertes, y por este motivo a temperatura ambiente el compuesto se halla en
estado slido.
Forman redes cristalinas altamente ordenadas. Los aniones y cationes
tienen posiciones definidas en el espacio, en funcin del tipo de red cristalina.
Puntos de fusin y ebullicin elevados. Debido a que, como hemos dicho,
las fuerzas electrostticas que mantienen unidos los iones son fuertes, es
costoso separarlos. Por este motivo, hay que aportar elevadas temperaturas
para fundirlos y para evaporarlos.
Elevada dureza. Tambin se debe a la fortaleza del enlace, ya que para rayar
la superficie del compuesto hay que romper enlaces de los iones superficiales.
Sin embargo, podrn ser rayados por compuestos de mayor dureza, como por
ejemplo el diamante (el compuesto de mayor dureza, con un 10 en la escala de
Mohs).
Fragilidad. A pesar de su dureza, son frgiles frente a los golpes. Por qu?
Porque un impacto puede hacer resbalar unas capas sobre otras y que, de
pronto, se vean enfrentados entre s iones del mismo signo. La repulsin
electrosttica entre iones del mismo signo fragmenta el cristal.
No conductores de la corriente en estado slido. En estado slido los iones
estn colocados en posiciones fijas de la red y no presentan movilidad alguna.
La falta de movilidad elctrica hace que no sean conductores.
Conductores de la corriente elctrica en estado fundido o disuelto. Puesto
que en estado fundido o disuelto los iones ya s presentan movilidad, a
diferencia de lo que ocurre en estado slido, en estos estados pueden conducir
la corriente.
Insolubles en disolventes apolares.
Solubles en disolventes polares. Son solubles en disolventes polares como
el amonaco lquido o el agua, pues las molculas de agua son capaces de
rodear los iones y atraerlos electrostticamente hasta separarlos de la red
inica, fenmeno que se conoce como solvatacin. Recordemos que la
molcula de agua es un dipolo. Cuanto ms estable sea la red, es decir, mayor
sea su energa reticular, ms difcil ser disolverlo porque ser requerir mayor
energa. Por ello, aunque en general digamos que los compuestos inicos son
solubles en agua, algunos de ellos no lo son (por ejemplo, el yoduro de plomo
Вам также может понравиться
- Guia de Estudio Piense II 2011 PDFДокумент32 страницыGuia de Estudio Piense II 2011 PDFAlbertoGutiérrezОценок пока нет
- Agenda Mascota 1Документ13 страницAgenda Mascota 1Angélica Ushiña ReinosoОценок пока нет
- DOG Celeste A5Документ12 страницDOG Celeste A5Angélica Ushiña ReinosoОценок пока нет
- Instrucciones paraДокумент3 страницыInstrucciones paraAngélica Ushiña ReinosoОценок пока нет
- Promo SanValentuenti 2021Документ4 страницыPromo SanValentuenti 2021Angélica Ushiña ReinosoОценок пока нет
- PortadasДокумент4 страницыPortadasAngélica Ushiña ReinosoОценок пока нет
- DOG CelesteДокумент12 страницDOG CelesteAngélica Ushiña ReinosoОценок пока нет
- Catalogo Marroquineria TextilДокумент34 страницыCatalogo Marroquineria TextilAngélica Ushiña ReinosoОценок пока нет
- Gram Schmidt 1Документ31 страницаGram Schmidt 1Angélica Ushiña ReinosoОценок пока нет
- PauMagazineMarzo PDFДокумент42 страницыPauMagazineMarzo PDFMaggi SanabriaОценок пока нет
- Instrucciones paraДокумент3 страницыInstrucciones paraAngélica Ushiña ReinosoОценок пока нет
- Documento Sin QueДокумент4 страницыDocumento Sin QueAngélica Ushiña ReinosoОценок пока нет
- Catalogo Marroquineria TextilДокумент34 страницыCatalogo Marroquineria TextilAngélica Ushiña ReinosoОценок пока нет
- Gram Schmidt 1Документ31 страницаGram Schmidt 1Angélica Ushiña ReinosoОценок пока нет
- Portafolio Manuarte Ecuador 2020Документ11 страницPortafolio Manuarte Ecuador 2020Angélica Ushiña ReinosoОценок пока нет
- Movimientos Básicos: Filigrarte Filigr - ArteДокумент1 страницаMovimientos Básicos: Filigrarte Filigr - ArteAngélica Ushiña ReinosoОценок пока нет
- Análisis Combinatorio y Teoría de ProbabilidadesДокумент64 страницыAnálisis Combinatorio y Teoría de ProbabilidadesAngélica Ushiña ReinosoОценок пока нет
- Fotografía 3Документ13 страницFotografía 3Angélica Ushiña ReinosoОценок пока нет
- PresentaciónДокумент15 страницPresentaciónAngélica Ushiña ReinosoОценок пока нет
- 1era ClaseДокумент30 страниц1era ClaseAngélica Ushiña ReinosoОценок пока нет
- Exposición BiologíaДокумент8 страницExposición BiologíaAngélica Ushiña ReinosoОценок пока нет
- Tema 0 Repaso 1º Bachillerato Unidad 0Документ27 страницTema 0 Repaso 1º Bachillerato Unidad 0urrexolaОценок пока нет
- Documento Sin QueДокумент4 страницыDocumento Sin QueAngélica Ushiña ReinosoОценок пока нет
- Caja - Dia de La Madre - PPTX Versión 1Документ11 страницCaja - Dia de La Madre - PPTX Versión 1Angélica Ushiña ReinosoОценок пока нет
- Fundas Impresas y Normales para El 2020Документ5 страницFundas Impresas y Normales para El 2020Angélica Ushiña ReinosoОценок пока нет
- Signos de PuntuaciónДокумент9 страницSignos de PuntuaciónAngélica Ushiña ReinosoОценок пока нет
- Concordancia VerbalДокумент3 страницыConcordancia VerbalAngélica Ushiña ReinosoОценок пока нет
- Ondas en Tres DimencionesДокумент4 страницыOndas en Tres DimencionesAngélica Ushiña ReinosoОценок пока нет
- Consultar en Wikipedia Sería Un Arma de Doble Filo Si Es Que No Existieran Los Expertos Que Colaboran Con La EnciclopediaДокумент1 страницаConsultar en Wikipedia Sería Un Arma de Doble Filo Si Es Que No Existieran Los Expertos Que Colaboran Con La EnciclopediaAngélica Ushiña ReinosoОценок пока нет
- Doc1.pNERVIOSOДокумент3 страницыDoc1.pNERVIOSOElias Castillo FloresОценок пока нет
- Inspeccion Higienico Sanitaria de La Empresa Congga Trabajonuevo ImprimirДокумент20 страницInspeccion Higienico Sanitaria de La Empresa Congga Trabajonuevo ImprimirYnohtnaAipatОценок пока нет
- Practica Dirigida 4Документ3 страницыPractica Dirigida 4Fernando Valdez CarpioОценок пока нет
- Jhara Cortez Tesis Final SustentacionДокумент119 страницJhara Cortez Tesis Final SustentacionFrankChumaceroVelasquezОценок пока нет
- TP4 - Resolucion - Metodo de Los DesplazamientosДокумент74 страницыTP4 - Resolucion - Metodo de Los DesplazamientosCristian SosaОценок пока нет
- Valoracion de Proyectos de Inversion de CapitalДокумент39 страницValoracion de Proyectos de Inversion de CapitalDaniel Tercero Hernández75% (4)
- Semana 10 Dia 1Документ8 страницSemana 10 Dia 1Alvaro J CesarОценок пока нет
- Canción de Cruzada de Teobaldo de NavarraДокумент17 страницCanción de Cruzada de Teobaldo de NavarraConsuelo Prats RedondoОценок пока нет
- Gille, Bertrand - Introduccion A La Historia de Las Tecnicas-1Документ103 страницыGille, Bertrand - Introduccion A La Historia de Las Tecnicas-1perebausa100% (1)
- Fundamentos de FisicaДокумент82 страницыFundamentos de FisicaFernanda Montiel TorrucoОценок пока нет
- Nomenclatura DinДокумент1 страницаNomenclatura DinManuel MartinezОценок пока нет
- Rodete Glenoideo Localizado en El Reborde Glenoideo, Recubre La EscotaduraДокумент22 страницыRodete Glenoideo Localizado en El Reborde Glenoideo, Recubre La EscotaduraKike BenitezОценок пока нет
- Edad MediaДокумент1 страницаEdad MediaKaneki DragОценок пока нет
- Planes PermanentesДокумент5 страницPlanes PermanentesBetsaida BlancoОценок пока нет
- Plantilla de Product BacklogДокумент4 страницыPlantilla de Product BacklogAlexandra STОценок пока нет
- Deformacion PlasticaДокумент11 страницDeformacion PlasticarichardОценок пока нет
- CLASE 2 Roxana Levinsky Capítulo Noveduc FinalДокумент12 страницCLASE 2 Roxana Levinsky Capítulo Noveduc FinalsilvanaiОценок пока нет
- MBA Especializado en Medio AmbienteДокумент24 страницыMBA Especializado en Medio AmbienteErickWernerОценок пока нет
- Diapositiva de SustentacionДокумент44 страницыDiapositiva de SustentacionMichael Castañeda PiscoyaОценок пока нет
- Seguridad VialДокумент20 страницSeguridad VialdinamayeОценок пока нет
- Manual Instalacion JenkinsДокумент7 страницManual Instalacion JenkinsfredyОценок пока нет
- XVI XVI: Xiii Concurso de Comprensión Lectora Xiii Concurso de Comprensión Lectora Xiii Concurso de Comprensión LectoraДокумент2 страницыXVI XVI: Xiii Concurso de Comprensión Lectora Xiii Concurso de Comprensión Lectora Xiii Concurso de Comprensión LectoraEdwin Mateo Barja FloresОценок пока нет
- Anexo 1 Ejercicios Tarea 2 16-01 2022Документ13 страницAnexo 1 Ejercicios Tarea 2 16-01 2022Fabian GarciaОценок пока нет
- Eportfolio - Mahara Desde La ExperienciaДокумент240 страницEportfolio - Mahara Desde La ExperienciaNagore Ipiña LarrañagaОценок пока нет
- Lengua Castellana y LiteraturaДокумент4 страницыLengua Castellana y Literaturasuper-woman100% (3)
- Cuidado de AparatosДокумент2 страницыCuidado de AparatosLucia sales estevezОценок пока нет
- Quién Soy YoДокумент3 страницыQuién Soy YoMateoBarrosFОценок пока нет
- Presentación Dasometría y Medición de Sombra 2019Документ49 страницPresentación Dasometría y Medición de Sombra 2019fred liОценок пока нет
- Check List AmoladoraДокумент2 страницыCheck List AmoladoraGERMAN MIRANDAОценок пока нет
- Examen FInal 19-02 Contabilidad General FC RESUELTOДокумент6 страницExamen FInal 19-02 Contabilidad General FC RESUELTOHaily BailonОценок пока нет
- Neoformaciones Frecuentes de La ConjuntivaДокумент10 страницNeoformaciones Frecuentes de La ConjuntivaDaniela Ruiz MartinezОценок пока нет