Академический Документы
Профессиональный Документы
Культура Документы
Cours S4 Chapitre 5 Reaction Chimique
Загружено:
Anass AnassАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Cours S4 Chapitre 5 Reaction Chimique
Загружено:
Anass AnassАвторское право:
Доступные форматы
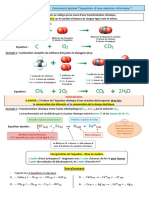
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
I) Loi de conservation de la matire :
1) A lchelle molculaire :
On considre la raction vive qui a lieu entre le fer (Fe (s)) et le soufre (S (s))
et qui donne le sulfure de fer (FeS (s)) :
Fe (s) + S (s) FeS (s)
La stchiomtrie d'une raction chimique repose sur deux principes :
- au cours de la raction, il n'y a ni cration ni disparition de matire.
- la nature des atomes reste inchange. Seuls les changes d'lectrons
sont possibles.
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
I) Loi de conservation de la matire :
2) A lchelle macroscopique :
Partant du principe de conservation de la matire, on en conclut qu'au cours
de la raction, il y a conservation de la masse :
La masse des ractifs qui ragissent doit tre gale la masse des produits
qui se forment.
On prlve plusieurs exemplaires dune masse mFe = 5,58 g de fer et dune
masse mS = 3,22 g de soufre avec une balance lectronique.
Les masses mesures correspondent un 1/10me de la masse molaire
atomique de llment, indique dans le tableau priodique !
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
I) Loi de conservation de la matire :
2) A lchelle macroscopique :
a) Mlange stchiomtrique :
A laide dun pilon, dans un mortier, on
mlange une masse 3.mFe 16,74 g et
une masse 3.mS 9,66 g :
On dpose le mlange sur une brique
rfractaire et on l'enflamme l'aide du
bec Bunsen :
Une forte odeur nausabonde se dgage au cours de la combustion.
Le produit form est du sulfure de fer (FeS) solide gris et poreux.
La mesure de la masse du sulfure de fer donne mFeS 26,30 g.
Aux erreurs exprimentales prs, la masse de sulfure de fer est gale la
somme des masses des ractifs de dpart.
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
I) Loi de conservation de la matire :
2) A lchelle macroscopique :
b) Ractif en excs :
Dans un mortier, on mlange intimement une masse 3.mFe 16,74 g et une
masse 5.mS 16,10 g.
On dpose le mlange sur une brique rfractaire et on l'enflamme l'aide
du bec Bunsen.
En plus de la forte odeur nausabonde du sulfure de fer (FeS), on sent une
odeur piquante et des fumes blanches, correspondant un dgagement
d'oxydes de soufre.
La mesure de la masse du sulfure de fer donne mFeS 26,35 g.
Aux erreurs exprimentales prs, la masse de sulfure de fer est gale celle
de la premire exprience.
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
I) Loi de conservation de la matire :
2) A lchelle macroscopique :
c) Conclusion :
Pour obtenir une raction complte, il ne sert rien de mettre l'un des
ractifs en excs.
Les proprits physiques et chimiques des ractifs de dpart n'ont rien
voir avec les proprits physiques et chimiques des produits de la raction.
Lorsque les ractifs sont pris dans des proportions correctes (mFe et mS, ou
3.mFe et 3.mS, ...) qu'on appelle proportions stchiomtriques, la raction
peut tre totale.
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
II) Relation entre lchelle atomique et lchelle macroscopique :
1) Interprtation dune transformation chimique :
Au cours du XIXe sicle, les chimistes ont dduit l'existence d'entits
lmentaires : les molcules, formes datomes. Lors des ractions
chimiques il se produit de nombreux chocs entre les molcules des ractifs.
Au cours d'une transformation chimique, les atomes des molcules des
ractifs se recombinent lors des chocs pour donner les molcules des
produits.
On traduit la transformation chimique par une criture symbolique :
Lquation-bilan, dans laquelle on reprsente les atomes par le symbole de
leur lment, on peut indiquer ltat des diffrentes espces :
Fe (s) + S (s) FeS (s)
Les coefficients stchiomtriques doivent tre choisis entiers, les plus
petits possible.
Lquation bilan symbolise ce qui se produit lchelle atomique :
Fe (s) + S (s) FeS (s)
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
II) Relation entre lchelle atomique et lchelle macroscopique :
2) Unit de quantit de matire :
Si l'on veut vrifier la conservation de la matire (et de la charge lectrique)
lors dune raction, il faut utiliser les ractifs en quantits mesurables
notre chelle (chelle macroscopique).
La masse d'un atome tant trs faible il faut prendre un trs grand nombre
de molcules pour en avoir une quantit macroscopique.
L'unit de quantit de matire dfinit donc le nombre d'entits (atomes,
molcules, ions, lectrons ou particules) contenue dans l'unit de quantit
de matire de cette entit.
L'unit de quantit de matire s'appelle la mole (symbole mol).
Une mole est la quantit de matire d'un systme contenant autant d'entits
(atomes, molcules, ions, lectrons ou particules) qu'il y a d'atomes dans
12 g de 126C.
Dans 12 g de "carbone 12" il y a 6,02.1023 atomes 126C.
Le nombre d'Avogadro est le nombre NA = 6,02.1023 d'entits contenues
dans une mole.
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
II) Relation entre lchelle atomique et lchelle macroscopique :
3) Exemples dapplications :
Dsormais, la raction du fer avec le soufre peut s'interprter l'chelle
macroscopique en disant qu'une mole de fer ragit avec une mole de soufre
pour donner une mole de sulfure de fer.
On traduit cette raction l'chelle macroscopique par une quation-bilan :
Fe (s) + S (s) FeS (s)
Les modles molculaires nous permettent de comprendre la "mcanique"
d'une raction chimique.
Exemple : synthse de l'eau :
2 H2 + O2 2 H2O
- lchelle molculaire :
- lchelle macroscopique :
2 moles de dihydrogne (2xNA molcules de H2) ragit avec 1
mole de dioxygne (NA molcules de O2) pour donner 2 moles
deau (2xNA molcules de H2O).
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
II) Relation entre lchelle atomique et lchelle macroscopique :
4) Autres exemples :
a) Combustion du carbone :
C + O2 CO2
- lchelle molculaire :
- lchelle macroscopique :
1 mole de carbone (NA atomes de C) ragit avec 1 mole de dioxygne
(NA molcules de O2) pour donner 1 mole de dioxyde de carbone (NA
molcules de CO2).
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
II) Relation entre lchelle atomique et lchelle macroscopique :
4) Autres exemples :
b) Combustion du mthane :
CH4 + 2 O2 CO2 + 2 H2O
- lchelle molculaire :
- lchelle macroscopique :
1 mole de mthane (NA molcules de CH4) ragit avec 2 moles de
dioxygne (2xNA molcules de O2) pour donner 1 mole de dioxyde de
carbone (NA molcules de CO2) et 2 moles deau (2xNA molcules de
H2O).
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
II) Relation entre lchelle atomique et lchelle macroscopique :
5) Dtermination des coefficients stchiomtriques :
Les coefficients stchiomtriques nous donnent les proportions entre les
quantits de matire des diffrentes espces chimiques.
Les coefficients stchiomtriques doivent traduire les lois de conservation
de la matire et de la charge lectrique.
Les coefficients stchiomtriques doivent tre des nombres entiers les
plus petits possible.
A partir de ces deux rgles, on dtermine les coefficients stchiomtriques
par une mthode intuitive ou par une technique mathmatique.
Exemple : Equilibrer les quations des ractions suivantes :
H2 + O2 H2O
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
II) Relation entre lchelle atomique et lchelle macroscopique :
5) Dtermination des coefficients stchiomtriques :
Les coefficients stchiomtriques nous donnent les proportions entre les
quantits de matire des diffrentes espces chimiques.
Les coefficients stchiomtriques doivent traduire les lois de conservation
de la matire et de la charge lectrique.
Les coefficients stchiomtriques doivent tre des nombres entiers les
plus petits possible.
A partir de ces deux rgles, on dtermine les coefficients stchiomtriques
par une mthode intuitive ou par une technique mathmatique.
Exemple : Equilibrer les quations des ractions suivantes :
2 H2 + O2 2 H2O
H2 + N2 NH3
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
II) Relation entre lchelle atomique et lchelle macroscopique :
5) Dtermination des coefficients stchiomtriques :
Les coefficients stchiomtriques nous donnent les proportions entre les
quantits de matire des diffrentes espces chimiques.
Les coefficients stchiomtriques doivent traduire les lois de conservation
de la matire et de la charge lectrique.
Les coefficients stchiomtriques doivent tre des nombres entiers les
plus petits possible.
A partir de ces deux rgles, on dtermine les coefficients stchiomtriques
par une mthode intuitive ou par une technique mathmatique.
Exemple : Equilibrer les quations des ractions suivantes :
2 H2 + O2 2 H2O
3 H2 + N2 2 NH3
O2 + NH3 NO + H2O
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
II) Relation entre lchelle atomique et lchelle macroscopique :
5) Dtermination des coefficients stchiomtriques :
Les coefficients stchiomtriques nous donnent les proportions entre les
quantits de matire des diffrentes espces chimiques.
Les coefficients stchiomtriques doivent traduire les lois de conservation
de la matire et de la charge lectrique.
Les coefficients stchiomtriques doivent tre des nombres entiers les
plus petits possible.
A partir de ces deux rgles, on dtermine les coefficients stchiomtriques
par une mthode intuitive ou par une technique mathmatique.
Exemple : Equilibrer les quations des ractions suivantes :
2 H2 + O2 2 H2O
3 H2 + N2 2 NH3
5 O2 + 4 NH3 4 NO + 6 H2O
NO + O2 NO2
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
II) Relation entre lchelle atomique et lchelle macroscopique :
5) Dtermination des coefficients stchiomtriques :
Les coefficients stchiomtriques nous donnent les proportions entre les
quantits de matire des diffrentes espces chimiques.
Les coefficients stchiomtriques doivent traduire les lois de conservation
de la matire et de la charge lectrique.
Les coefficients stchiomtriques doivent tre des nombres entiers les
plus petits possible.
A partir de ces deux rgles, on dtermine les coefficients stchiomtriques
par une mthode intuitive ou par une technique mathmatique.
Exemple : Equilibrer les quations des ractions suivantes :
2 H2 + O2 2 H2O
3 H2 + N2 2 NH3
5 O2 + 4 NH3 4 NO + 6 H2O
2 NO + O2 2 NO2
Fe + H3O+ Fe2+ + H2 + H2O
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
II) Relation entre lchelle atomique et lchelle macroscopique :
5) Dtermination des coefficients stchiomtriques :
Les coefficients stchiomtriques nous donnent les proportions entre les
quantits de matire des diffrentes espces chimiques.
Les coefficients stchiomtriques doivent traduire les lois de conservation
de la matire et de la charge lectrique.
Les coefficients stchiomtriques doivent tre des nombres entiers les
plus petits possible.
A partir de ces deux rgles, on dtermine les coefficients stchiomtriques
par une mthode intuitive ou par une technique mathmatique.
Exemple : Equilibrer les quations des ractions suivantes :
2 H2 + O2 2 H2O
3 H2 + N2 2 NH3
5 O2 + 4 NH3 4 NO + 6 H2O
2 NO + O2 2 NO2
Fe + 2 H3O+ Fe2+ + H2 + 2 H2O
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
II) Relation entre lchelle atomique et lchelle macroscopique :
6) Coefficients stchiomtriques et quantit de matire :
a) Exemple de la synthse de leau :
Lquation bilan scrit : 2 H2 + O2 2 H2O
A lchelle molculaire : 2 molcules de dihydrogne H2 doivent ragir avec
1 molcule de dioxygne O2 pour donner 2 molcules deau H2O.
A lchelle macroscopique : 2 moles de dihydrogne H2 doivent ragir avec
1 mole de dioxygne O2 pour donner 2 moles deau H2O.
On pourrait dire galement que nH2 = 1254 moles de dihydrogne H2 doivent
ragir avec nO2 = 627 moles de dioxygne O2 pour donner nH2O = 1254
moles deau H2O.
On remarque quil existe des relations simples entre ces quantits de
matire et les coefficients stchiomtriques de lquation bilan.
En effet, on peut crire :
nH2 1254 nO2 627 nH2O 1254
=
=
=
=
=
2
2
1
1
2
2
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
II) Relation entre lchelle atomique et lchelle macroscopique :
6) Coefficients stchiomtriques et quantit de matire :
b) Gnralisation :
On considre une raction fictive dont lquation bilan scrit :
A + B C + D
A et B sont des ractifs et C et D sont des produits.
, , et sont les coefficients stchiomtriques.
Soit nA et nB les quantits de matire des ractifs A et B qui ragissent
effectivement au cours de la raction.
Soit nC et nD les quantits de matires des produits C et D qui se forment.
Entre les diffrentes quantits de matire existent les relations :
n A = nB = nC = nD
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
III) Masse molaire :
1) Masse molaire atomique :
La masse molaire atomique d'un lment est la masse d'une mole d'atomes
de cet lment.
La masse molaire atomique sexprime en gramme par mole (g.mol-1).
La masse molaire atomique tient compte de la composition isotopique de
l'lment dans la nature.
Exemple : Calculer la masse molaire atomique du bore, sachant que le bore
est compos de deux isotopes : 19,64 % de B (de masse molaire
atomique M10 = 10,0129 g.mol1) et 80,36 % de B (de masse
molaire atomique M11 = 11,0093 g.mol1).
On trouve
MB = 10,8 g.mol1.
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
III) Masse molaire :
2) Masse molaire molculaire :
La masse molaire molculaire est la masse d'une mole de molcules.
La masse molaire molculaire est gale la somme des masses molaires
atomiques des atomes qui la constituent.
La masse molaire molculaire sexprime en gramme par mole (g.mol-1).
Exemple : La masse molaire molculaire du dihydrogne H2 est :
MH2 = 2xMH = 2x1,0 = 2,0 g.mol1
La masse molaire molculaire de leau H2O est :
MH2O = 2xMH + MO = 2x1,0 + 16,0 = 18,0 g.mol1
La masse molaire molculaire du dioxyde de carbone CO2 est :
MCO2 = MC + 2xMO = 12,0 + 2x16,0 = 44,0 g.mol1
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
III) Masse molaire :
3) Masse, masse molaire et quantit de matire :
La masse effective mX (en g) dune espce chimique X est gale au produit
de sa masse molaire molculaire MX (en g.mol1), par sa quantit de matire
nX (en mol) :
mX = MX. nX
Exercice : Quelle quantit de matire nNa2SO4 de sulfate de sodium
reprsente une masse mNa2SO4 = 14,21 g ?
On donne les masses molaire atomiques :
MNa = 23,0 g.mol1, MO = 16,0 g.mol1, MS = 32,1 g.mol1
La masse molaire molculaire du sulfate de sodium est :
MNa2SO4 = 2xMNa + MS + 4xMO = 142,1 g.mol1
Do
nNa2SO 4 =
mNa2SO 4 14,21
=
= 0,1 mol
MNa2SO 4 142,1
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
IV) Volume molaire :
1) Loi dAvogadro :
Dans les mmes conditions de pressions et de temprature tous les gaz
occupent le mme volume.
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
IV) Volume molaire :
2) Dfinitions :
Dans chaque cas, il faut prciser les conditions de pression et de
temprature dans lesquelles les volumes sont mesurs.
On dfinit plus particulirement les :
conditions normales de pression et temprature (C.N.P.T.) :
P = 1 atm. = 1013,25 hPa et T = 0 C = 273 K.
conditions standards de pression et temprature (C.S.P.T.) :
P = 1 atm. = 1013,25 hPa et T = 25 C = 298 K.
Le volume molaire Vm d'un gaz est le volume qu'occupe une mole de ce gaz
pris dans des conditions donnes de pression et de temprature.
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
V) Concentration molaire volumique et molarit :
1) Dfinition :
La concentration molaire volumique ou molarit d'un corps en solution est
gale la quantit de matire de ce corps par litre de solution.
La concentration molaire volumique sexprime en mole par litre (mol.L-1).
Remarque : Une solution tant constitue dun solvant, en grande quantit,
dans lequel on dissout un solut, en faible quantit, on nglige
toujours la variation de volume de la solution occasionne lors
de lintroduction du solut dans le solvant.
Chapitre 5 :
REACTION CHIMIQUE ET LOIS DE CONSERVATION
S4F
V) Concentration molaire volumique et molarit :
2) Symbolique :
Dans la suite nous distinguerons deux types de concentrations molaires :
- La concentration molaire volumique ou molarit en produit Y introduit,
note CY, est gale au rapport de la quantit de matire nY de produit Y, au
volume V deau dans lequel on le dissout :
nY
CY =
V
- La concentration molaire volumique en espce chimique X effectivement
prsente, note [X], est gale au rapport de la quantit de matire nX de
lespce X, au volume V de solution :
nX
[X] = V
Exercice : On dissout une masse mNa2SO4 = 14,21 g de sulfate de sodium, de
masse molaire molculaire MNa2SO4 = 142,1 g.mol1, dans un
volume V = 10 L deau :
- Ecrire lquation bilan de la dissolution du sulfate de sodium.
- Calculer la molarit CNa2SO4 de la solution de sulfate de sodium.
- Calculer les concentrations molaires volumiques [Na+], [SO42].
Вам также может понравиться
- TD 07-08Документ43 страницыTD 07-08Oumarou KontaОценок пока нет
- CHM 100 Atomes Et MoleculesДокумент32 страницыCHM 100 Atomes Et MoleculesOzias100% (1)
- Chapitre 2: Molécules Et Solvants Exercices: Exercice N°1: Représentations de Lewis de MoléculesДокумент4 страницыChapitre 2: Molécules Et Solvants Exercices: Exercice N°1: Représentations de Lewis de MoléculesBarthОценок пока нет
- Olympiade-Chimie Maroc 2016Документ2 страницыOlympiade-Chimie Maroc 2016Ahmed ZagourОценок пока нет
- DS4 CorrigeДокумент16 страницDS4 CorrigeNadia Ait AhmedОценок пока нет
- PC ChimieДокумент5 страницPC Chimiebotipex422Оценок пока нет
- TD Eq5Документ10 страницTD Eq5hala shooowОценок пока нет
- MP CHIMIE CCP 1 2005.extrait PDFДокумент4 страницыMP CHIMIE CCP 1 2005.extrait PDFkmeriemОценок пока нет
- Cours ChimieДокумент134 страницыCours ChimieMehdi Hajji100% (2)
- Fascicule de Révision Chimie PDFДокумент26 страницFascicule de Révision Chimie PDFmoane8Оценок пока нет
- Spectrometrie de MasseДокумент8 страницSpectrometrie de MassesafemindОценок пока нет
- CPD Physique Chimie Seconde Semaine Du 17 Mai 2021Документ5 страницCPD Physique Chimie Seconde Semaine Du 17 Mai 2021Andrew RolfОценок пока нет
- T Science DevoirdДокумент2 страницыT Science DevoirdOumar TraoréОценок пока нет
- SMPC2 - M10Liaisons Chimiques - TD Série 1 - PR LaghzizelДокумент2 страницыSMPC2 - M10Liaisons Chimiques - TD Série 1 - PR Laghzizel마리아 정Оценок пока нет
- Chimie OrganiqueДокумент8 страницChimie OrganiqueTarik ZaidОценок пока нет
- Travaux Dirigés de Chimie N° 3: Exercice 1: Quelques Représentations de Lewis D'espèces CarbonéesДокумент2 страницыTravaux Dirigés de Chimie N° 3: Exercice 1: Quelques Représentations de Lewis D'espèces CarbonéesAbderrahman IGHNIHОценок пока нет
- TD Orbitalaire L3 2019-1Документ31 страницаTD Orbitalaire L3 2019-1dhoubzainabОценок пока нет
- T Science DevoirdДокумент2 страницыT Science DevoirdOumar TraoréОценок пока нет
- DS1 2022-2023 Sujet Corrige BaremeДокумент10 страницDS1 2022-2023 Sujet Corrige Baremearnaud.bedouinОценок пока нет
- Chimie 3apt1Документ12 страницChimie 3apt1aliabdalghafourОценок пока нет
- Fiche LASS 2 Chimie FACДокумент9 страницFiche LASS 2 Chimie FACadelainОценок пока нет
- Exercices Chimie Des MatériauxДокумент14 страницExercices Chimie Des Matériaux7box.beОценок пока нет
- Chimie Premiere CdeДокумент30 страницChimie Premiere CdeHans René Nkwinga NgokoОценок пока нет
- Examen Finaux Et Corrigé - 230516 - 232706Документ37 страницExamen Finaux Et Corrigé - 230516 - 232706bensalimyoussef94Оценок пока нет
- Acfrogbdynprbbpxk7mr6jpv El20b6poabnus3ss-Nt5f4-Nzclm90uj5fjx6tcenkdomdxgjg-Msjnqnrczmpmmg5ldtvksab5weedks0t1xz6 Jhrtj0b4cvv1 N4kanxpmvtydjhon1 Stt7Документ1 страницаAcfrogbdynprbbpxk7mr6jpv El20b6poabnus3ss-Nt5f4-Nzclm90uj5fjx6tcenkdomdxgjg-Msjnqnrczmpmmg5ldtvksab5weedks0t1xz6 Jhrtj0b4cvv1 N4kanxpmvtydjhon1 Stt7ichouten techОценок пока нет
- Cours de 2eme BiofДокумент3 страницыCours de 2eme BiofYassine MОценок пока нет
- 6128ed3519f3cequation Bilan D Une Reaction Chimique Cours de PHДокумент4 страницы6128ed3519f3cequation Bilan D Une Reaction Chimique Cours de PHEric KonanОценок пока нет
- Olympiade-Chimie Maroc 2016 Serie 4Документ4 страницыOlympiade-Chimie Maroc 2016 Serie 4mrОценок пока нет
- TD4 22-23Документ3 страницыTD4 22-23Anis ChaibiОценок пока нет
- Cours2 Chimi PDFДокумент18 страницCours2 Chimi PDFhadjeb_abdessalamОценок пока нет
- TheorieGroupes TD3 SujetДокумент4 страницыTheorieGroupes TD3 SujetAdel KridОценок пока нет
- Chimie L1 MPCIДокумент97 страницChimie L1 MPCIAhmad CisséОценок пока нет
- Chimie Organique - Cours EpoДокумент236 страницChimie Organique - Cours EpoMohamed Salim CompaoreОценок пока нет
- C5 Réactions Chimiques-Equation BilanДокумент6 страницC5 Réactions Chimiques-Equation Bilanndeye yarame diopОценок пока нет
- Fiche Méthode Ajuster Équation ChimiqueДокумент1 страницаFiche Méthode Ajuster Équation Chimiqueaxel artusОценок пока нет
- Les Rc3a9actions ChimiquesДокумент15 страницLes Rc3a9actions ChimiquesJean SangaréОценок пока нет
- Cours CHM 144 P38 - P43Документ8 страницCours CHM 144 P38 - P43Bejen BEJENОценок пока нет
- Série D'exercices N°1 - Chimie - Notion D'avancement D'une Réaction Chimique - Bac M SC Exp (2009-2010) MR Soudani ElyesДокумент2 страницыSérie D'exercices N°1 - Chimie - Notion D'avancement D'une Réaction Chimique - Bac M SC Exp (2009-2010) MR Soudani Elyesأبوأحمد الجزيري78% (9)
- Etude Quantitative D'une Réaction Chimique I) Conservation de La MasseДокумент2 страницыEtude Quantitative D'une Réaction Chimique I) Conservation de La MasseMouhibi AbdellahОценок пока нет
- Conservation de La Masse Lors D'une Tranformation Chimique - 4eДокумент3 страницыConservation de La Masse Lors D'une Tranformation Chimique - 4eAbđė Ěł ŁğđОценок пока нет
- TD 07-08Документ43 страницыTD 07-08Farid Kikani100% (1)
- Exercice 1 (7 Points) Polymères Et EnvironnementДокумент4 страницыExercice 1 (7 Points) Polymères Et EnvironnementkamdemОценок пока нет
- 1S.chim1.Cours - Quantite de Matiere Et Bilan de Matiere 06-07Документ5 страниц1S.chim1.Cours - Quantite de Matiere Et Bilan de Matiere 06-07Mohammed Ben AliОценок пока нет
- SÃrie 3 MP1 2021 2022Документ2 страницыSÃrie 3 MP1 2021 2022Hedil SouafОценок пока нет
- Cours Chimie Organique M15Документ42 страницыCours Chimie Organique M15MOHAMED MAZOUARIОценок пока нет
- 4e CHIMIE La StœchiométrieДокумент4 страницы4e CHIMIE La Stœchiométrie2mgrx9km8fОценок пока нет
- ch7 Transformations ChimiquesДокумент3 страницыch7 Transformations ChimiquesJanna Hassan Mostafa Abdallah Abdel MawlaОценок пока нет
- Cours 11 - Les Lois de La Réaction ChimiqueДокумент3 страницыCours 11 - Les Lois de La Réaction ChimiqueadnanОценок пока нет
- Td4 Corrige Complet 1Документ8 страницTd4 Corrige Complet 1Fedoua Benamer0% (1)
- COURS MAGISTRAL Def 05Документ31 страницаCOURS MAGISTRAL Def 05abdelnjifendjouОценок пока нет
- Cours RedoxДокумент14 страницCours Redoxass mohОценок пока нет
- Chimie en PremièreДокумент71 страницаChimie en PremièreCecile Spykiline100% (4)
- Relativité restreinte, mécanique quantique et relativité générale: Base physique et mathématique de la relativité restreinte et générale et de la mécanique quantiqueОт EverandRelativité restreinte, mécanique quantique et relativité générale: Base physique et mathématique de la relativité restreinte et générale et de la mécanique quantiqueОценок пока нет
- Cimenterieaumaroc2013 130407031853 Phpapp01 PDFДокумент6 страницCimenterieaumaroc2013 130407031853 Phpapp01 PDFAnass AnassОценок пока нет
- Cour D'atomistiqueДокумент19 страницCour D'atomistiqueIhsan Mokhlisse89% (9)
- Genie Des ProcédésДокумент33 страницыGenie Des ProcédésAnass Anass88% (8)
- Rapport de StageДокумент39 страницRapport de StageImado Eco Tarmount100% (1)
- Chapitre 3 Les Techniques Physiquo Chimique Danalyse Et de CaractrisationДокумент5 страницChapitre 3 Les Techniques Physiquo Chimique Danalyse Et de CaractrisationAnass Anass100% (1)
- Mecanique Des FluidesДокумент14 страницMecanique Des FluidesAnass Anass100% (1)
- Sechage SolideДокумент17 страницSechage SolideXavi MxaviОценок пока нет
- CprofДокумент14 страницCprofAnass Anass100% (1)
- CombustionДокумент11 страницCombustionMouhamed AbdarrahmaneОценок пока нет
- Chap-8 Bilans ThermiquesДокумент28 страницChap-8 Bilans Thermiquescherif003Оценок пока нет
- Cinematique - Mécanique Des FluidesДокумент13 страницCinematique - Mécanique Des FluidesSalma BrbОценок пока нет
- Rapport de Stage Menara PrefaДокумент27 страницRapport de Stage Menara PrefaMohamed Lamrabet88% (26)
- Rapport Complet 1Документ34 страницыRapport Complet 1Anass Anass80% (10)
- Chimie - Le Minimum À SavoirДокумент186 страницChimie - Le Minimum À SavoirBabacar Kane100% (1)
- Bilan ThermiqueДокумент10 страницBilan ThermiqueAmix Tpv100% (2)
- PfesoulaimanehassaniДокумент121 страницаPfesoulaimanehassaniAnass Anass100% (1)
- Transfert ThermiqueДокумент161 страницаTransfert ThermiqueMehdi Hababa100% (1)
- Espci Meca Flu Chap4Документ10 страницEspci Meca Flu Chap4Anass Anass100% (1)
- Rapport PFE OCP - NAHIDI HassanДокумент92 страницыRapport PFE OCP - NAHIDI HassanNahidi100% (1)
- Organisation Des Métiers de La ProductionДокумент171 страницаOrganisation Des Métiers de La ProductionLotfi AbdallahОценок пока нет
- Coef de PartageДокумент13 страницCoef de PartageKhadija Moustaid50% (2)
- Relations Entre Quantites de Matieres Lors Dune RactionДокумент2 страницыRelations Entre Quantites de Matieres Lors Dune RactionAnass Anass100% (1)
- Brochure Logy PlanДокумент33 страницыBrochure Logy PlanAnass AnassОценок пока нет
- React EursДокумент17 страницReact EursAnass Anass100% (1)
- Syllabus 0Документ13 страницSyllabus 0Anass AnassОценок пока нет
- Fares Nessim Abou El Fattah YazidДокумент25 страницFares Nessim Abou El Fattah YazidAnass AnassОценок пока нет
- Cours AvancementДокумент9 страницCours AvancementAnass Anass100% (1)
- Calcul de Réacteurs ChimiquesДокумент39 страницCalcul de Réacteurs ChimiquesجعدبندرهمОценок пока нет
- Cinetique IДокумент2 страницыCinetique INajimou Alade TidjaniОценок пока нет
- Equation CERPДокумент19 страницEquation CERPZakari YaeОценок пока нет
- Chapitre 2 Bilans Matiere Regime PermanentДокумент10 страницChapitre 2 Bilans Matiere Regime Permanentجعدبندرهم75% (4)
- Série Des Exercices - Chimie 1er Bac SM BiofДокумент54 страницыSérie Des Exercices - Chimie 1er Bac SM BiofJarch163% (8)
- Exercices - CHIM-S-101 - 2023-2024 - 02Документ3 страницыExercices - CHIM-S-101 - 2023-2024 - 02cotam58578Оценок пока нет
- TD6 Stoechio 1516Документ12 страницTD6 Stoechio 1516Mello GraceОценок пока нет
- CIEP Conceptions Et Vidéo Jeu AmpèremètreДокумент31 страницаCIEP Conceptions Et Vidéo Jeu AmpèremètreDaniela DinicaОценок пока нет
- Modélisation BilanДокумент32 страницыModélisation Bilanجعدبندرهم100% (1)
- Chimie Des SolutionsДокумент24 страницыChimie Des SolutionsEl Hadi100% (1)
- dK0sSvoWop4xuiwiHRXXz mGHps PDFДокумент20 страницdK0sSvoWop4xuiwiHRXXz mGHps PDFMOSTAFAОценок пока нет
- La Réaction ChimiqueДокумент9 страницLa Réaction ChimiqueOumar TraoréОценок пока нет
- Cinétique Chimique TD Corrigé 05Документ8 страницCinétique Chimique TD Corrigé 05elie mij kisaleОценок пока нет
- Cours Réacteurs Homogènes 1ère Partie-1Документ11 страницCours Réacteurs Homogènes 1ère Partie-1Faiza RahmouniОценок пока нет
- PDF - 2023 XCHI564 EMINES 2 Réacteurs Homogènes Hydro Idéale Bilans MATIERE Optim Techn EcoДокумент74 страницыPDF - 2023 XCHI564 EMINES 2 Réacteurs Homogènes Hydro Idéale Bilans MATIERE Optim Techn EcoMouncef AsryОценок пока нет
- Cours Changement de Couleur Et Reaction ChimiqueДокумент7 страницCours Changement de Couleur Et Reaction Chimiqueezzeddine1975Оценок пока нет
- Modelisation Des Transformations Chimiques Bilan de La Matiere Resume de Cours 2Документ2 страницыModelisation Des Transformations Chimiques Bilan de La Matiere Resume de Cours 2Lazreg ImedОценок пока нет
- 05 06 Rapport de LaboratoireДокумент4 страницы05 06 Rapport de LaboratoireScribdTranslationsОценок пока нет
- Cours Réacteurs HomogénesДокумент15 страницCours Réacteurs HomogénesAYA KAIDIОценок пока нет
- Aurore-Chimie 2nde SДокумент25 страницAurore-Chimie 2nde SghislainhinkponОценок пока нет
- Saponificat BeurreДокумент3 страницыSaponificat Beurre84vtmy8r44Оценок пока нет
- Equilibres Chimiques Et Électrochimiques en Solution Aqueuse (PDFDrive)Документ163 страницыEquilibres Chimiques Et Électrochimiques en Solution Aqueuse (PDFDrive)Samah Soltane0% (1)