Академический Документы
Профессиональный Документы
Культура Документы
Cinetica Quimica
Загружено:
Kaziel Campbell0 оценок0% нашли этот документ полезным (0 голосов)
27 просмотров4 страницыcinética
Оригинальное название
CINETICA-QUIMICA
Авторское право
© © All Rights Reserved
Доступные форматы
DOCX, PDF, TXT или читайте онлайн в Scribd
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документcinética
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOCX, PDF, TXT или читайте онлайн в Scribd
0 оценок0% нашли этот документ полезным (0 голосов)
27 просмотров4 страницыCinetica Quimica
Загружено:
Kaziel Campbellcinética
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOCX, PDF, TXT или читайте онлайн в Scribd
Вы находитесь на странице: 1из 4
CINETICA QUIMICA
Este campo estudia la velocidad de reaccin de los procesos qumicos en
funcin de la concentracin de las especies que reaccionan, de los productos de
reaccin, de los catalizadores e inhibidores, de los diferentes medios disolventes,
de la temperatura, y de todas las dems variables que pueden afectar a la
velocidad de una reaccin.
Cuando algunas sustancias reaccionan lo hacen en forma lenta, por ejemplo el
hierro en presencia de aire; otras reaccionan rpidamente,como por ejemplo el
sodio tambin en presencia de aire; y hay sustancias como el papel en presencia
de aire que no reaccionaran jamas sin el auxilio del fuego, pero una vez
comenzada la reaccin sta se desarrolla rpidamente.
Entonces, tanto para que una reaccin ocurra, como para modificar su velocidad,
se debern tener en cuenta varios factores.
Velocidad de reaccin
La cintica qumica busca la relacin entre la forma precisa en que vara la
velocidad de reaccin con el tiempo, y la naturaleza de las colisiones
intermoleculares (que controlan la velocidad) implicadas en la generacin de los
productos de reaccin.
La velocidad de reaccin se expresa de la siguiente forma:
Velocidad
=
Velocidad
=
moles o gramos de sustancias que
reaccionan por litro
(1)
tiempo en segundos
moles o gramos de sustancias obtenidas por
litro
(2)
tiempo en segundos
Naturaleza de los reactantes
La naturaleza de los reactantes involucrados en
una reaccin determina el tipo de reaccin que
se efecta. Las reacciones en las cuales se
redistribuyen enlaces o se transfieren electrones
pueden
ser ms lentas que las que no involucran estos
cambios.
Las reacciones inicas se efectan
inmediatamente, esto se debe a las frecuentes
colisiones entre iones con cargas opuestas.
En una reaccin inica no hay transferencia de
electrones. Las reacciones entre molculas
neutras pueden ser ms lentas que las inicas a causa de la transferencia
electrnica y redistribucin de enlaces. La mayor parte de las colisiones
moleculares son elsticas, por lo tanto,las molculas simplemente rebotan y se
apartan sin cambios. Sin embargo, algunas colisiones tienen la suficiente energa
para ocasionar cambios en las nubes electrnicas de las molculas que chocan.
Cuando ocurre el cambio, las molculas que chocan pueden formar el complejo
activado. La energa requerida para formar este se conoce como energa de
activacin. Si esta es pequea pocas de las colisiones tienen la suficiente energa
para formar el complejo activado. Por lo tanto, la reaccin puede ser tan lenta que
no es detectable.
Factores que modifican la velocidad de las reacciones
Para que dos sustancia reaccionen, sus molculas, tomos o iones deben chocar.
Estos choques producen un nuevo ordenamiento electrnico y, por consiguiente
un nuevo ordenamiento entre sus enlaces qumicos, originando nuevas
sustancias.
1. Temperatura
Segn la Teora Cintica, la temperatura aumenta la energa cintica de las
molculas o iones y por consiguiente el movimiento de estos, con lo cual,
aumenta la posibilidad de choques entre las molculas o iones de los reactivos,
aumentando la posibilidad de que ocurra la reaccin o acelerando una reaccin
en desarrollo.
Sin embargo, el incremento de la velocidad de la reaccin no depende tanto del
incremento del nmero de colisiones, cmo del nmero de molculas que han
alcanzado la energa de activacin.
La velocidad de una reaccin crece, en general, con la temperatura, y se
duplica, aproximadamente, por cada 10 C que aumenta la temperatura.
5. Concentracin
La velocidad de una reaccin qumica es proporcional a la concentracin en
moles por litro (moles/litro), de las sustancias reaccionantes.
Si dos sustancias homogneas A y B (gases o soluciones) reaccionan:
A + B C + D (6)
La velocidad de la reaccin es:
V = [A].[B] (7)
En la que los corchetes sealan concentraciones en moles por litro. Observemos
que si duplicamos la concentracin, por ejemplo, de la sustancia A, la velocidad
de la reaccin se duplica:
V* =2.[A].[B] (8)
Si las sustancias que reaccionan son gaseosas, la concentracin de las mismas
aumenta disminuyendo el volumen, lo que se logra aumentando la presin.
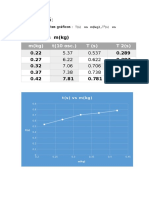
En la figura anterior se observa, que aumentando la presin las molculas de las
sustancias reaccionantes se aproximan entre s, acrecentando la posibilidad de
choque entre sus molculas, y por consiguiente se acelera la reaccin.
6. Catalizadores
Se llaman catalizadores a las sustancias que intervienen en las reacciones,
acelerndolas o retardndolas y que siguen presentes al finalizar la reaccin, es
decir que no se consumen en esta, no son parte de los productos reaccionantes.
Las sustancias que retardan la velocidad de reaccin se denominan inhibidores.
i. Catalizadores de contacto o heterogneos:
No reaccionan qumicamente con las sustancias del sistema: adsorben en su
superficie, las molculas de esas sustancias reaccionantes, aumentan, por
consiguiente, el nmero de choques entre ellas y aceleran la reaccin.
Una reaccin en la cual los reactantes y el catalizador no estn en la misma fase
(estado) es una reaccin heterognea. Este tipo de catalizadores generalmente
producen una superficie donde las sustancias pueden reaccionar, estos
catalizadores funcionan adsorbiendo alguno de los reactantes, debilitando el
enlace en cuestin hasta el punto en que el otro reactante rompe dicho enlace. La
adsorcin es la adherencia de una sustancia a la superficie de otra.
Algunos metales (finamente divididos para aumentar la superficie de contacto)
actan como catalizadores de contacto: platino, nquel, xido frrico (Fe 2O3),
pentxido de vanadio (V2O5), entre otros. El dixido de azufre (SO2) reacciona
lentamente con el oxgeno:
2.SO2 + O2 2.SO3 (lenta)
Pero, en presencia de platino y de calor, la reaccin es inmediata:
2.SO2 + O2 (amianto platinado + calor) 2.SO3 (rpida)
ii. Catalizadores de transporte u homogneos:
Estos catalizadores actan interviniendo en la reaccin y luego se regeneran al
finalizar la misma. Un catalizador homogneo se encuentra en la misma fase
(estado) que los reactantes
Son caractersticas de los catalizadores:
a) Gran desproporcin entre la masa de las sustancias que reaccionan y la
pequea masa del catalizador.
b) El catalizador se halla igual al final del proceso, que al comienzo de l.
c) Un catalizador no produce una reaccin que sin l no se realiza, solo modifica
la velocidad de la misma.
d) Los catalizadores son especficos de cada reaccin o de un cierto grupo de
reacciones.
La absorcin de las impurezas que acompaan a las sustancias reaccionantes,
pueden disminuir o detener la accin del catalizador. Estas sustancias que
retardan la accin de los catalizadores se denominan venenos del catalizador.
Resumiendo: para aumentar la velocidad de una reaccin, se debe aumentar la
posibilidad de choque entre las molculas, iones o tomos de las sustancias
reaccionantes, modificando las variables enumeradas que el proceso permita.
Вам также может понравиться
- Falta InoДокумент17 страницFalta InoKaziel CampbellОценок пока нет
- Ejercicios Resueltos IДокумент10 страницEjercicios Resueltos INatalia Bohorquez Toledo100% (2)
- Seguridad en Soldadura 1Документ42 страницыSeguridad en Soldadura 1Kaziel CampbellОценок пока нет
- Ejercicios Resueltos IДокумент15 страницEjercicios Resueltos IKaziel Campbell0% (1)
- Soldadura (P A W)Документ7 страницSoldadura (P A W)Kaziel CampbellОценок пока нет
- Lab1 - MicroelectronicaДокумент13 страницLab1 - MicroelectronicaKaziel CampbellОценок пока нет
- Aplicación de La Energía Hidraulica en La RegiónДокумент23 страницыAplicación de La Energía Hidraulica en La RegiónKarina MamaniОценок пока нет
- EstequiometriaДокумент29 страницEstequiometriawemildrethОценок пока нет
- Proceso de Obtencion y Exportacion de La Quinua (2) .PptxuuДокумент24 страницыProceso de Obtencion y Exportacion de La Quinua (2) .PptxuuKaziel Campbell100% (2)
- Soldadura OxiacetilenicaДокумент62 страницыSoldadura OxiacetilenicaElias Alva NavarroОценок пока нет
- Hoy No Voy A LlorarДокумент8 страницHoy No Voy A LlorarKarina MamaniОценок пока нет
- AgroexportacionДокумент19 страницAgroexportacionCarlos GonzalesОценок пока нет
- Refineria de Iquitoyys (13yy)Документ14 страницRefineria de Iquitoyys (13yy)Kaziel CampbellОценок пока нет
- Visual Basic UPV Quimica 2007Документ37 страницVisual Basic UPV Quimica 2007Josmar RamosОценок пока нет
- Tema 2. Amplificadores de Varias Etapas y Amplificador DiferencialДокумент16 страницTema 2. Amplificadores de Varias Etapas y Amplificador DiferencialXavier GualánОценок пока нет
- Informe Nº7 Labo de Q.organica 1 (Acid. Carboxilicos)Документ31 страницаInforme Nº7 Labo de Q.organica 1 (Acid. Carboxilicos)AldoCabreraFernandez100% (1)
- 70 y 72Документ6 страниц70 y 72Kaziel CampbellОценок пока нет
- Superficies CuadraticasДокумент6 страницSuperficies CuadraticasKaziel CampbellОценок пока нет
- Taller 6Документ1 страницаTaller 6Kaziel CampbellОценок пока нет
- Diapositivas - Psicología en La IngenieríaДокумент36 страницDiapositivas - Psicología en La IngenieríaKaziel CampbellОценок пока нет
- Diseño de Cartas ASMДокумент26 страницDiseño de Cartas ASMMilton Octavio GarcíaОценок пока нет
- Labo 3 (Yuliet)Документ4 страницыLabo 3 (Yuliet)Kaziel CampbellОценок пока нет
- LaboДокумент19 страницLaboKaziel CampbellОценок пока нет
- Lectura 5Документ3 страницыLectura 5Kaziel CampbellОценок пока нет
- Animales en ExtincionДокумент14 страницAnimales en ExtincionKaziel CampbellОценок пока нет
- Transpuesta de Una MДокумент1 страницаTranspuesta de Una MKaziel CampbellОценок пока нет
- Transpuesta FortranДокумент1 страницаTranspuesta FortranKaziel CampbellОценок пока нет
- LaboДокумент19 страницLaboKaziel CampbellОценок пока нет
- Resume NДокумент5 страницResume NKaziel CampbellОценок пока нет
- Promedio FinalДокумент1 страницаPromedio FinalKaziel CampbellОценок пока нет
- Análisis variables altura carga velocidadДокумент1 страницаAnálisis variables altura carga velocidadJhean TurpoОценок пока нет
- Partes Del ChillerДокумент6 страницPartes Del ChillerPablo Joaquin100% (1)
- Diapositivas Interes SimpleДокумент50 страницDiapositivas Interes SimpleAldana Orellana JazminОценок пока нет
- TP1 PrecipitacionДокумент11 страницTP1 PrecipitacionPedro Dante RuizОценок пока нет
- Cartilla ClimaticaДокумент89 страницCartilla ClimaticaJessica Flores ChicanaОценок пока нет
- ACOTAMIENTOДокумент13 страницACOTAMIENTOjohnny humberto alvarez paezОценок пока нет
- Especificaciones RompeДокумент21 страницаEspecificaciones RompeWilson Vasquez MariscalОценок пока нет
- Centro Sismológico Nacional CensisДокумент3 страницыCentro Sismológico Nacional CensisLucia Alexandra Rimac RamirezОценок пока нет
- Diseño de Teoria de ColasДокумент5 страницDiseño de Teoria de ColasJessica Mendez SalcedoОценок пока нет
- Mecánica de Sólidos LaboratorioДокумент5 страницMecánica de Sólidos LaboratorioSergio Alberto Escobedo RodriguezОценок пока нет
- Asp PDFДокумент182 страницыAsp PDFA-k AmandaОценок пока нет
- RESUMEN Clase 3 - Todo de PeirceДокумент18 страницRESUMEN Clase 3 - Todo de PeirceNefcColomboОценок пока нет
- Introducción A Las Mediciones EléctricasДокумент11 страницIntroducción A Las Mediciones EléctricasLaura MarcelaОценок пока нет
- Lab 2 Qui-331 Propiedades Coligativas, Hecho Por Adrian MVR 100573987Документ9 страницLab 2 Qui-331 Propiedades Coligativas, Hecho Por Adrian MVR 100573987Adrian Miguel Valerio RosarioОценок пока нет
- Corrosión y oxidación: procesos de deterioroДокумент23 страницыCorrosión y oxidación: procesos de deterioroSARAH VASQUEZ SHANKSОценок пока нет
- Clasificación de Reservas de PetroleoДокумент21 страницаClasificación de Reservas de PetroleoNicolás ValdiviezoОценок пока нет
- GlosarioДокумент5 страницGlosarioALYSON DARIANA ZARAZUA MERINOОценок пока нет
- Geometria SagradaДокумент6 страницGeometria SagradaJairo MorenoОценок пока нет
- Guia No.2Документ3 страницыGuia No.2Cristian E.MОценок пока нет
- Enfriamiento Con Deshumidificación 2Документ8 страницEnfriamiento Con Deshumidificación 2Gal JhonОценок пока нет
- Notas Cuarto Taller Econometria I 2019 2Документ54 страницыNotas Cuarto Taller Econometria I 2019 2VrtoОценок пока нет
- Metodología de La Investigación (Variables)Документ11 страницMetodología de La Investigación (Variables)Rodoleivis RuizОценок пока нет
- Excel para Ingenieros PDFДокумент135 страницExcel para Ingenieros PDFmibasbeОценок пока нет
- Riesgo y RendimientoДокумент21 страницаRiesgo y RendimientoDelia Mercedes Mendoza GonzalesОценок пока нет
- Plan de Estudios Laboratorio de Física Básica IДокумент3 страницыPlan de Estudios Laboratorio de Física Básica ILaura AОценок пока нет
- NCh00146 2 2000 PDFДокумент15 страницNCh00146 2 2000 PDFrenzoesОценок пока нет
- Trabajo de Investigacion F.PДокумент12 страницTrabajo de Investigacion F.PEros Matias DavilaОценок пока нет
- G05 Motores DC 2021-2Документ11 страницG05 Motores DC 2021-2edison barrionuevoОценок пока нет
- Quimica y Estructura CeramicaДокумент66 страницQuimica y Estructura CeramicaBerenice Acevedo HerreraОценок пока нет
- 50 Comandos de AutoCAD Que Debes ConocerДокумент6 страниц50 Comandos de AutoCAD Que Debes ConocerJorge Luis Cruz LaverdeОценок пока нет