Академический Документы
Профессиональный Документы
Культура Документы
Bioquimica Informe 3 Upsjb
Загружено:
Jesus Flores CamposИсходное описание:
Оригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Bioquimica Informe 3 Upsjb
Загружено:
Jesus Flores CamposАвторское право:
Доступные форматы
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
INTRODUCCION:
Las enzimas son protenas que catalizan las reacciones orgnicas;
entre sus caractersticas tenemos que son especficas, son
protenas y son biolgicas. Las enzimas tienen un centro activo
donde entra el sustrato que va a hacer modificado, pueden ser
especficas en cuanto a forma del sustrato, tipo de sustrato, grupo,
reaccin.
Las enzimas se nombran usando como prefijo el nombre del
sustrato o de la reaccin junto con el sufijo asa.
La actividad enzimtica esta afectada por el pH, la temperatura,
concentracin de sustrato, concentracin de la enzima, tamao del
sustrato, presencias de moduladores o inhibidores y la presencia de
cofactores.
En las vas metablicas se encuentran enzimas que regulan ciertas
necesidades del cuerpo. Las enzimas Covalentemente moduladas
se encuentran inactivas y solo se activan en la presencia de otra
enzima. Las enzimas Isoenzimas son la misma enzima misma
funcin y se halla en varios puntos del metabolismo y las enzimas
BIOQUIMICA Y NUTRICION
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
OBJETIVOS:
Conocer la importancia del Km.
Identificar los efectos que produce las altas temperaturas en
las enzimas.
Conocer la clasificacin de las enzimas.
Identificar que es un cofactor.
BIOQUIMICA Y NUTRICION
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
Marco Terico:
ENZIMAS
BIOQUIMICA Y NUTRICION
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
Debido a la naturaleza proteica, las enzimas se ven afectadas en su
actividad y estructura por los mismos factores que afectan a las
dems protenas, entre los que cabe destacar:
pH: el pH es el grado de acidez de
una solucin. De acuerdo con el sitio
donde acta la enzima, tiene un pH
ptimo; por ejemplo, la pepsina que
se halla en el jugo gstrico tiene un
pH ptimo cido; por encima de este
valor la velocidad de la reaccin
disminuye porque la estructura de la enzima se ve afectada. El pH
del medio es el responsable de que los grupos funcionales de las
enzimas (-COOH, -NH2, -OH, -SH) pueden estar cargados positiva,
y negativamente, o posean carga neutra. Recordar que las
variaciones del pH pueden ocasionar un cambio en la estructura
tridimensional de las enzimas, que pueden afectar en su actividad.
Existe un pH ptimo en que la concentracin de H+ es la idnea
para que se produzca la actividad cataltica. Tambin existe una
banda, que oscila entre un valor del pH mnimo y otro mximo,
donde la enzima puede actuar. Para valores situados fuera de esta
zona no existe actividad enzimtica, dado que las cadenas
polipeptdicas se pueden desnaturalizar. La mayor parte de las
enzimas poseen un pH prximo al del estado neutro.
BIOQUIMICA Y NUTRICION
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
Temperatura: como toda protena, la enzima se ve afectada por las
temperaturas muy altas, pues su estructura globular se rompe y
pierde funcionalidad, se desnaturaliza. El calor implica movimiento,
as que por debajo de cierta temperatura las enzimas comienzan a
perder
movilidad y la velocidad de reaccin disminuye. Las temperaturas
no adecuadas para que una enzima (que son protenas) realice sus
funciones tienden a desnaturalizarla y esto causa, deficiencia en las
funciones que realiza la enzima y a temperaturas extremas a daar
la enzima completamente.
Las reacciones catalizadas por enzimas siguen, por regla general,
la ley de Van tHoff que establece que cada diez grados de aumento
de la temperatura se produce un aumento de velocidad de la
reaccin de dos a cuatro veces. Esta regla se cumple dentro de
unos limites, ya que las enzimas, debido a su naturaleza proteica,
son termolbiles, siendo afectadas por las variaciones de la
temperatura e inactivndose al desnaturalizarse.
ENZIMAS REGULADORAS DEL
METABOLISMO
BIOQUIMICA Y NUTRICION
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
En las vas metablicas encontraremos enzimas que regulan ciertos
pasos muy importantes, en las cuales las reacciones subsecuentes
se veran favorecidas o reprimidas, dependiendo de las
necesidades del cuerpo. Son catalizadores biolgicos, que adems
de las propiedades que caracterizan a las enzimas, presentan
caractersticas que le confieren papeles reguladores del
metabolismo.
Enzimas Covalentemente Moduladas
Los enzimas modulados covalentemente tambin presentan dos
formas, una activa y otra inactiva, que son interconvertibles por
modificacin covalente de sus estructuras catalizada por otros
enzimas, denominados enzimas moduladores. Tal modificacin
suele consistir en la adicin o eliminacin de un grupo qumico
esencial para la catlisis (generalmente un grupo fosfato, metilo,
adenilato u otros) de manera que el enzima modulado se activa
cuando est unido a dicho grupo y se inactiva cuando ste se
elimina. En la mayor parte de los casos son necesarios dos enzimas
moduladores diferentes, uno que activa el enzima modulado y otro
que lo inactiva. Se encuentran en forma inactiva y solo se activan
en la presencia de otra enzima. Por ejemplo: el tripsinogeno es la
forma precursora de la tripsina (enzima pancretica que degrada
protenas) cuando es segmentada por otra enzima se activa.
Enzimas Isoenzimas
BIOQUIMICA Y NUTRICION
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
Son la misma enzima, es decir, tienen, por ejemplo, la misma
funcin, y se hallan en varios puntos del metabolismo. La
glucoquinasa y hexoquinasa son enzimas que fosforilan la glucosa;
La glucoquinasa se encuentra en las clulas del hgado, fosforilando
la glucosa que entra a el. En el musculo de la hexoquinasa la que
esta presente y realiza la misma funcin.
Enzimas Alostricas
Son enzimas que tienen cuatro cadenas peptdicas. Entre ellas se
encuentra la fosfofructoquinasa, la cual tiene como funcin fosforilar
la fructosa 6 fosfato. La mayora de las enzimas Alostricas son
protenas con varias subunidades. La unin del sustrato a un
protmero en una enzima Alostricas afecta a las propiedades de
unin de los protmeros adyacentes. La actividad de las enzimas
Alostricas se ve afectada por molculas efectoras que se unen a
otros lugares denominados lugares alostricos o reguladores. Las
enzimas Alostricas generalmente catalizan pasos reguladores
clave de las rutas bioqumicas.
FUNCIONES DE LAS ENZIMAS
En su estructura globular, se entrelazan y se pliegan una o ms
cadenas polipeptdicas, que aportan un pequeo grupo de
BIOQUIMICA Y NUTRICION
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
aminocidos para formar el sitio activo, o lugar donde se adhiere el
sustrato, y donde se realiza la reaccin.
Una enzima y un sustrato no llegan a adherirse si sus formas no
encajan con exactitud. Este hecho asegura que la enzima no
participa en reacciones equivocadas.
La enzima misma no se ve afectada por la reaccin. Cuando los
productos se liberan, la enzima vuelve a unirse con un nuevo
sustrato.
INHIBIDORES ENZIMATICO
Compuestos o agentes que se combinan con una enzima de
manera tal que evitala combinacin sustrato-enzima normal y la
reaccin cataltica. La unin de un inhibidor puede impedir la
entrada del sustrato al sitio activo de la enzima y/u obstaculizar que
la enzima catalice su reaccin correspondiente. La unin del
inhibidor puede ser reversible o irreversible. Normalmente, los
inhibidores irreversibles reaccionan con la enzima de forma
covalente y modifican su estructura qumica a nivel de residuos
esenciales de los aminocidos necesarios para la actividad
enzimtica. En cambio, los inhibidores reversibles suenen a la
enzima de forma no covalente, dando lugar a diferentes tipos de
inhibiciones, dependiendo de si el inhibidor se une a la enzima, al
complejo enzima-sustrato o a ambos.
CLASIFICACIN DE LAS ENZIMAS
BIOQUIMICA Y NUTRICION
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
xido-reductasas
(Reacciones
de
xidoreduccin).
Transferasas
(Transferencia
de
grupos
funcionales)
Hidrolasas (Reacciones de hidrlisis)
Liasas (Adicin a los dobles enlaces)
Isomerasas (Reacciones de isomerizacin)
Ligasas (Formacin de enlaces, con aporte de
ATP)
FACORES QUE AFECTAN LA
ACTIVIDAD ENZIMATICA
BIOQUIMICA Y NUTRICION
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
Los biocatalizadores especficos sintetizados por el organismo,
llamados enzimas son protenas que intervienen en las reacciones
biolgicas, acelerando la velocidad de reaccin hasta alcanzar su
punto de equilibrio. Las enzimas son sumamente especficas en las
reacciones que catalizan y en los compuestos (llamados sustratos)
sobre los que actan.
La cintica enzimtica es el estudio del comportamiento de la
velocidad en reacciones catalizadas por enzimas. Las mediciones
de la cintica proporcionan una herramienta bioqumica muy til
para calcular la concentracin de una enzima en una muestra
biolgica y comparar su actividad cataltica con la de otras enzimas.
Adems, las mediciones cinticas permiten describir de manera
cuantitativa el efecto de un veneno o medicamento sobre la
actividad de una enzima.
La velocidad a la que procede una reaccin enzimtica est
controlada en parte por las concentraciones de la enzima y el
sustrato. A medida que progresa la reaccin, aumenta la
concentracin de los productos a expensas de la desaparicin de
los correspondientes sustratos, en tanto que la concentracin de la
enzima no se altere.
La actividad enzimtica puede expresarse:
BIOQUIMICA Y NUTRICION
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
a) Por la desaparicin del sustrato (S).
b) Por la aparicin de productos (P).
c) Por modificacin de cofactores (C).
Diversos factores modifican la actividad enzimtica, tales como:
1) Concentracin de sustrato [S]
2) Concentracin de la enzima [E]
3) pH del medio
4) Influencia de la temperatura
5) Efecto de inhibidores y activadores
En la presente prctica estudiaremos el efecto de estos factores
sobre la actividad enzimtica de la amilasa salival sobre el almidn.
La amilasa es una enzima que degrada molculas hidrocarbonadas
complejas en componentes ms pequeos, tiene un PM de 40,000
a 50,000 daltons. Es producida por el pncreas exocrino y las
glndulas salivales para ayudar a digerir el almidn.
EXPERIMENTO A
BIOQUIMICA Y NUTRICION
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
EFECTO DE LA CONCENTRACIN DE LA
ENZIMA, DE LA TEMPERATURA Y DEL ION
CLORO SOBRE LA ACTIVIDAD DE LA AMILASA
SALIVAL
1) Preparar los siguientes tubos:
Tubos No.
Solucin almidn 1%
Buffer phosphate pH 6.6
Solucin salina (NaCl 1%)
Agua destilada
I
1 ml
5 ml
2.8 ml
II
1 ml
5 ml
2.6 ml
III
1 ml
5 ml
2.4 ml
IV
1 ml
5 ml
2.2 ml
---
---
---
---
V
1 ml
5 ml
--2.2
ml
VI
1 ml
5 ml
2.2
ml
---
VII-C
1 ml
5 ml
2.2 ml
---
2) Colocar los tubos I al V en un bao de agua a 37C, durante 5
minutos. El tubo VI servir de comparacin para ver el efecto
de la temperatura sobre la accin enzimtica por lo que se
deja a temperatura ambiente.
3) Agregar la solucin de enzima:
Tubos No.
Solucin amilasa
I
0.4 ml
II
0.8 ml
III
1.2 ml
IV
1.6
ml
V
1.6
ml
VI
1.6
ml
VII-C
---
4) Colocar nuevamente los tubos I al V en bao de agua a 37C
durante 20 minutos, el tubo VI se mantiene a temperatura
ambiente.
BIOQUIMICA Y NUTRICION
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
5) Luego hacer el control final de la reaccin con el reactivo de
yodo, de la siguiente manera:
Tubos No.
HCl 0.05 N
de los tubos de reaccin
correspondientes agregar
Solucin yodada
I
5 ml
0.5 ml
II
5 ml
0.5 ml
III
5 ml
0.5 ml
0.5 ml
0.5 ml
0.5 ml
IV
5 ml
0.5
ml
0.5
ml
V
5 ml
0.5
ml
0.5
ml
VI
5 ml
0.5
ml
0.5
ml
VII-C
5 ml
0.5 ml
0.5 ml
6) Mezclar y dejar en reposo por 10 minutos.
7) Leer las absorbancia al espectrofotmetro a 650 nm.
8) La diferencia de las absorbancia entre los tubos nos indicar la
actividad enzimtica para cada tubo.
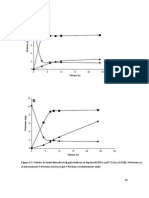
9) Graficar en papel milimetrado: Actividad enzimtica en el eje Y
vs concentracin de la enzima [E] en el eje X.
EXPERIMENTO C
BIOQUIMICA Y NUTRICION
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
EFECTO DEL PH SOBRE LA ACTIVIDAD DE LA AMILASA SALIVAL
1)Preparar los siguientes tubos:
Tubos No.
Solucin de almidn 1%
Solucin salina (NaCl 1%)
Buffer phosphate pH 6.6
Buffer phosphate pH 3.7
Buffer phosphate pH 8.0
I
5 ml
2 ml
2 ml
-----
II
5 ml
2 ml
--2 ml
---
III
5 ml
2 ml
----2 ml
2)Mezclar y colocar los tubos en bao de agua a 37C por 5 minutos.
3)Aadir a cada tubo 2 ml de solucin de enzima (amilasa).
4)Colocar nuevamente los tubos a 37C por 20 minutos.
5)Extraer los tubos del bao y realizar el control mediante la solucin yodada,
como en el experimento anterior.
6)Realizar el estudio crtico comparativo de ellos. Sacar conclusiones.
7)Graficar en papel milimetrado una curva de actividad enzimtica vs pH.
CONCLUSIONES
BIOQUIMICA Y NUTRICION
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
Se puede concluir que una enzima en grandes
cantidades reacciona con facilidad con el perxido
de hidrogeno.
La velocidad de la reaccin puede variar por
diferentes motivos ya sea por la cantidad del
sustrato por la temperatura, Etc.
Los catalizadores biolgicos actan sobre un
sustrato en especial no acta sobre grandes
cantidades.
El nivel en pH nos marcara tambin q tipo de
reaccin es y cunto ser su velocidad.
CUESTIONARIO
BIOQUIMICA Y NUTRICION
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
1.- CUL ES LA IMPORTANCIA DEL KM.
El km es una constante para cada enzima, y su importancia radica
en que es un ndice muy aproximado de la afinidad de la enzima
respecto a su sustrato. En efecto puede verse a la figura 7.10 que si
el Km es muy pequeo, quiere decir que a baja (s) se alcanzara la
velocidad mxima. En otras entradas, el Km puede ser
inversamente proporcional a la afinidad de la enzima por el
sustrato.
En virtud de la importancia el significado de los conceptos
anteriores, no debe sorprender que la determinacin del Km y la
Vmax de las enzimas sea objeto de la experimentacin de
numerosos laboratorios de investigacin bioqumica
2.- QU EFECTOS PRODUCE LAS ALTAS TEMPERATURAS
SOBRE LAS ENZIMAS.
Las enzimas son siempre protenas y stas soportan temperaturas
relativamente altas. Pero superada esa temperatura, las protenas
se desnaturalizan y por tanto tambin las enzimas.
Se estima que la temperatura aproximada de desnaturalizacin in
vitro en de 45 C. In vivo pueden soportar temperaturas
ambientales ms altas pero es porque el cuerpo utiliza todos sus
sistemas de refrigeracin. Se puede vivir a temperaturas de hasta
unos 50 C
3.- COMO SE CLASIFICAN LAS ENZIMAS?
Clasificacin de las Enzimas
BIOQUIMICA Y NUTRICION
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
Las enzimas, se clasifican por tipos de reaccin y mecanismo. Con el
descubrimiento de ms y ms enzimas surgieron ambigedades inevitables y
con frecuencia no estaba claro de que enzima se estaba hablando, para
remediar esta deficiencia la Unin Internacional de Bioqumica (IUB, en ingles
internacional Union Of Biochemistry) adopto un sistema complejo pero
inequvoco, de la nomenclatura enzimtica y las clasifico:
Oxidoreductasas:
Estas enzimas catalizan la transferencia de electrones desde una molcula que
va a ser el agente reductor hasta otra molcula receptora y esta ser el agente
oxidante.
Las enzimas Oxidoreductasas reaccionan de la siguiente manera:
AH2 + O2 A + H2O
Se clasifican en:
Deshidrogenadas.
Oxidasas.
Peroxidasas.
BIOQUIMICA Y NUTRICION
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
Oxigenasas.
Hidroxilasas.
Reductasas
Transferasas:
Estas enzimas catalizan la transferencia de un grupo funcional de
una molcula donante a una molcula receptora.
Las
enzimas
Transferasas
de la siguiente
AB + C A+
reaccionan
manera:
CB
Se clasifican en:
Grupos Monocarbonados.
Grupos Aldehdo o Ceto.
Acil Transferasas.
Glicosiltransferasas.
BIOQUIMICA Y NUTRICION
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
Alquil o Ariltranferasas.
Grupos Nitrogenados.
Grupos Fosfato.
Grupos Sulfato.
Hidrolasas:
Estas enzimas son capaces de hidrolizar sea descomponer
qumicos por su reaccin con el agua.
Las
enzimas
reaccionan de
manera:
Hidrolasas
la siguiente
AB + H2O AH + BOH
Se clasifican en:
Esterasas.
Glucosidasas.
Eter Hidrolasa.
Peptidasas.
Acil anhidro Hidrolasas.
BIOQUIMICA Y NUTRICION
enlaces
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
Helicasas.
Etc.
Liasas:
Estas enzimas son las encargadas de catalizar la ruptura de enlaces qumicos
en compuestos orgnicos por un mecanismo distinto a la hidrlisis y a la
oxidacin. Como resultado del proceso de la ruptura de los enlaces se forman
frecuentemente nuevos dobles enlaces o nuevas estructuras en anillos.
Las enzimas Liasas reaccionan de la siguiente manera:
AB A + B
Se
clasifican en:
Actan sobre enlaces C-C.
Actan sobre enlaces C-O.
Actan sobre enlaces C-N.
Actan sobre enlaces C-S.
BIOQUIMICA Y NUTRICION
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
Actan sobre enlaces C- Haluro.
Actan sobre enlaces P-O.
Etc.
Isomerasas:
Estas enzimas son las encargadas de transformar un isomero de un compuesto
qumico en otro
Las enzimas Isomerasas reaccionan de la siguiente manera:
ABC ACB
Se clasifican en:
Rasemasas y Epimerasas.
Cis-Trans- Isomerasas.
Oxidoreductasas Intramoleculares.
Transferasas Intramoleculares.
BIOQUIMICA Y NUTRICION
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
Liasas Intramoleculares.
Ligasas:
Son las enzimas capaces que catalizar la unin entre dos molculas de gran
tamao, para dar lugar a un nuevo enlace qumico.
Las enzimas Ligasas reaccionan de la siguiente manera:
A + B + XTP AB + XDP + Pi
Se clasifican en:
Forman enlaces C-O.
Forman enlaces C-S.
Forman enlaces C-N.
Forman enlaces C-C.
Forman enlaces esters fosforicos.
Actan sobre enlaces N-metal.
BIOQUIMICA Y NUTRICION
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
4.- A QUE SE LLAMAN ZIMGENOS E ISOENZIMAS.
ISOENZIMA :
Las isoenzimas o isozimas son enzimas que difieren en la secuencia
de aminocidos, pero que catalizan la misma reaccin qumica. Estas
enzimas suelen mostrar diferentes parmetros cinticos (i.e. diferentes
valores de KM), o propiedades de regulacin diferentes. La existencia
de las isoenzimas permite el ajuste del metabolismo para satisfacer las
necesidades particulares de un determinado tejido o etapa del
desarrollo.
ZIMOGENOS:
Es un precursor enzimtico inactivo, es decir, no cataliza ninguna
reaccin como hacen las enzimas. Para activarse, necesita de un cambio
bioqumico en su estructura que le lleve a conformar un centro activo
donde pueda realizar la catlisis. En ese momento, el zimgeno pasa a
ser una enzima activa. El cambio bioqumico suele ocurrir en un lisosoma,
donde una parte especfica de la enzima precursora se escinde del resto
para activarla. La cadena de aminocidos que se libera por la activacin
se llama pptida de activacin.
5.- QUE SON COFACTORES Y MENCIONE EJEMPLOS.
Un cofactor es un componente no proteico, termoestable y de baja
masa molecular, necesario para la accin de una enzima. El cofactor se
BIOQUIMICA Y NUTRICION
UNIVERSIDAD PRIVADA SAN JUAN BAUTISTA
FACULTAD DE CIENCIAS DE LA SALUD
ESCUELA PROFESINAL DE MEDICINA HUMANA
une a una estructura proteica, denominada apoenzima, y el complejo
apoenzima-cofactor recibe el nombre de holoenzima.
Aquellos cofactores que estn covalentemente unidos a la apoenzima
son denominados grupos prostticos, ya sean orgnicos (coenzimas) o
inorgnicos.
Los cofactores son bsicamente de dos tipos, iones metlicos y
molculas orgnicas, denominadas coenzimas.
BIBLIOGRAFA
Murray, R.K., Granner, D.K., Mayes, P.A., Rodwell, V.W. 1996.
Bioqumica de Harper, I Edicin. Editorial
El manual
moderno S.A de C.V. Santaf, Bogot.77, 87, 91, 119
https://es.wikipedia.org/wiki/Cofactor
BIOQUIMICA Y NUTRICION
Вам также может понравиться
- Cinética Enzimática y El Efecto de La Concentración de Sustrato y La Temperatura Sobre La Actividad CatalíticaДокумент4 страницыCinética Enzimática y El Efecto de La Concentración de Sustrato y La Temperatura Sobre La Actividad CatalíticaCitlalli Damian VertizОценок пока нет
- Bioenergética y MetabolismoДокумент13 страницBioenergética y MetabolismoBerta González GómezОценок пока нет
- Reacciones de La Fase Luminosa de La FotosíntesisДокумент3 страницыReacciones de La Fase Luminosa de La FotosíntesisCarmen AvilaОценок пока нет
- Ing. EnzimáticaДокумент46 страницIng. EnzimáticaArmando Montoya García100% (1)
- Reporte Practica 4Документ4 страницыReporte Practica 4Alfonso RodríguezОценок пока нет
- Vía de Las Pentosas FosfatoДокумент59 страницVía de Las Pentosas FosfatoAndrea Ximena Aquino ReyesОценок пока нет
- Biosintesis de AminoacidosДокумент3 страницыBiosintesis de AminoacidosKevinxdОценок пока нет
- Enriquecimiento y Aislamiento de CultivosДокумент17 страницEnriquecimiento y Aislamiento de CultivosIsrael Alvarez RojasОценок пока нет
- TallerДокумент3 страницыTallerLuis Drn AngrtОценок пока нет
- Cinética Enzimática BBM 2018Документ45 страницCinética Enzimática BBM 2018Karen CuencaОценок пока нет
- Informa Fosfatasa PDFДокумент26 страницInforma Fosfatasa PDFMaria Jose Ramirez BuitragoОценок пока нет
- Practica 2 Equilibrio QuimicoДокумент12 страницPractica 2 Equilibrio QuimicoKarla P. SanmorОценок пока нет
- 7 PKa de Un Indicador Acido BaseДокумент8 страниц7 PKa de Un Indicador Acido Basedaisuke_123Оценок пока нет
- Temp pptx-1569100278Документ14 страницTemp pptx-1569100278Paloma MartinezОценок пока нет
- Cromatografia para Purificación de ProteínasДокумент55 страницCromatografia para Purificación de ProteínasAlejandro VieyraОценок пока нет
- Beneficios de La Aplicación de Un Campo Eléctrico A Un Biorreactor de MembranaДокумент7 страницBeneficios de La Aplicación de Un Campo Eléctrico A Un Biorreactor de Membranaanon_999497818Оценок пока нет
- Historia de La ENCBДокумент6 страницHistoria de La ENCBHansel CM100% (2)
- Cinética Química Practica.9Документ11 страницCinética Química Practica.9Adilene Perez AnchondoОценок пока нет
- Secuenciación de ProteínasДокумент6 страницSecuenciación de ProteínasVALERIA ALZATE MERIZALDEОценок пока нет
- Cinética EnzimáticaДокумент11 страницCinética EnzimáticaVirginia Elena Jimenez JimenezОценок пока нет
- Efecto HomotropicoДокумент3 страницыEfecto HomotropicoYeisyAlayo0% (1)
- Informe de Reacciones NeutralizacionДокумент17 страницInforme de Reacciones NeutralizacionJorge UquillasОценок пока нет
- Propiedades Cinéticas de Las EnzimasДокумент14 страницPropiedades Cinéticas de Las EnzimasMilagros Trujillo Mucha0% (1)
- Crucigrama de ProteinasДокумент2 страницыCrucigrama de ProteinasJonnyОценок пока нет
- Cinética Química y Transporte de MembranaДокумент33 страницыCinética Química y Transporte de Membranaapi-3802973100% (1)
- Informe de LipidosДокумент5 страницInforme de LipidosFabiana TorresОценок пока нет
- Determinación de La Actividad Enzimática de La Fosfatasa Ácida Frente A La Variación de Diferentes FactoresДокумент8 страницDeterminación de La Actividad Enzimática de La Fosfatasa Ácida Frente A La Variación de Diferentes FactoresJuan Jose Villalobos MoraОценок пока нет
- Reacciones EnzimaticasДокумент9 страницReacciones EnzimaticasYesenia CuellarОценок пока нет
- Practica 3 Corregida Utp Glucolisis AnaerobiaДокумент6 страницPractica 3 Corregida Utp Glucolisis AnaerobiaJessica Valentina Zarama BuriticaОценок пока нет
- Reacción de Yodación de La Acetona - PPSXДокумент19 страницReacción de Yodación de La Acetona - PPSXSofia Ojeda100% (1)
- Cinética de Sistemas Inmovilizados - CДокумент31 страницаCinética de Sistemas Inmovilizados - CDavid RamírezОценок пока нет
- Tarea Cinética Enzimática IIIPAC-2020 PDFДокумент11 страницTarea Cinética Enzimática IIIPAC-2020 PDFKatherine SusethОценок пока нет
- EnzimasДокумент30 страницEnzimasCésar TerronesОценок пока нет
- Solucionario Taller de ProteinasДокумент14 страницSolucionario Taller de ProteinasAndrés Felipe AcostaОценок пока нет
- Cinetica Enzimatica para Los AlumnosДокумент47 страницCinetica Enzimatica para Los AlumnosMazinges Ajesa100% (1)
- Cinetica LactasaДокумент122 страницыCinetica LactasaalvarezriОценок пока нет
- Trabajo de Investigacion 8 Quimica GeneralДокумент5 страницTrabajo de Investigacion 8 Quimica GeneralYamila PerezОценок пока нет
- Examen EqДокумент4 страницыExamen EqAnni VОценок пока нет
- Luciferina para Hacer Brillar A Los Animales en La OscuridadДокумент19 страницLuciferina para Hacer Brillar A Los Animales en La OscuridadJavier SánchezОценок пока нет
- Discusion de Grupo N 3Документ14 страницDiscusion de Grupo N 3RubenPerez100% (4)
- Fenomenos InterfacialesДокумент28 страницFenomenos InterfacialesFernando100% (1)
- Fosforilación Oxidativa y Cadena Transporte ElectronesДокумент29 страницFosforilación Oxidativa y Cadena Transporte ElectronesniamineОценок пока нет
- Previo Fraccionamiento CelularДокумент7 страницPrevio Fraccionamiento CelularMontserrat Martz0% (1)
- Fotosintesis y Ciclo de CalvinДокумент6 страницFotosintesis y Ciclo de CalvinEstefany PeraltaОценок пока нет
- Diseño de Reactores - NitrotoluenoДокумент31 страницаDiseño de Reactores - NitrotoluenoGina ArquiОценок пока нет
- Qué Es Un ColoideДокумент1 страницаQué Es Un ColoideMiiky De Giio R. M100% (1)
- 6° Reporte OrgánicaДокумент4 страницы6° Reporte OrgánicaPoncho MalagónОценок пока нет
- Determinación de La Actividad de La Enzima Succinato DeshidrogenasaДокумент5 страницDeterminación de La Actividad de La Enzima Succinato DeshidrogenasaCarlos Fabian GuevaraОценок пока нет
- Espectro de Infrarrojo de Los Ácidos CarboxílicosДокумент18 страницEspectro de Infrarrojo de Los Ácidos CarboxílicosViridianaGarcia50% (2)
- E3P3M1012Документ18 страницE3P3M1012Floriano YusselОценок пока нет
- Tema 6, Tema 7 Alquinos SN1 y SN2 20 Mayo 2020Документ17 страницTema 6, Tema 7 Alquinos SN1 y SN2 20 Mayo 2020Alan YañezОценок пока нет
- DISOLUCIONESДокумент44 страницыDISOLUCIONESMagaly BenaventeОценок пока нет
- FFFFFFFFFFFFFFFДокумент42 страницыFFFFFFFFFFFFFFFAlexisОценок пока нет
- Actividad EnzimaticaДокумент8 страницActividad EnzimaticaLaura Franco SalazarОценок пока нет
- Factores Que Influyen en El Equilibrio QuímicoДокумент5 страницFactores Que Influyen en El Equilibrio QuímicoFrancisco GlezОценок пока нет
- Enzimas ReguladorasДокумент7 страницEnzimas ReguladorasLuzMa ViñasОценок пока нет
- Regresión - Tratamiento POLINOMIALДокумент11 страницRegresión - Tratamiento POLINOMIALFernanda GuatibonzaОценок пока нет
- Trabajo Microbiologia EnzimasДокумент38 страницTrabajo Microbiologia EnzimasacpdhОценок пока нет
- Informe Práctica 4 - 8Документ23 страницыInforme Práctica 4 - 8lionz1010Оценок пока нет
- Informe Lab. EnzimasДокумент14 страницInforme Lab. EnzimasFabian Romero santosОценок пока нет
- CLASE 06 - FarmacocineticaДокумент19 страницCLASE 06 - FarmacocineticaGuillermo PretellОценок пока нет
- FarmacotoxiaДокумент11 страницFarmacotoxiaJesus Flores Campos100% (3)
- FarmacotoxiaДокумент11 страницFarmacotoxiaJesus Flores Campos100% (3)
- Marco Teorico Sobre Nutricion y Rendimiento EscolarДокумент5 страницMarco Teorico Sobre Nutricion y Rendimiento EscolarJesus Flores Campos50% (2)
- Bacterias Gram y Crecimiento BacterianoДокумент18 страницBacterias Gram y Crecimiento BacterianoJesus Flores CamposОценок пока нет
- Bioquimica Informe 3Документ19 страницBioquimica Informe 3Jesus Flores CamposОценок пока нет
- Informe de Bioquimica 9Документ17 страницInforme de Bioquimica 9Jesus Flores Campos75% (4)
- Cetoacidosis Diabetica Jesus MartyДокумент19 страницCetoacidosis Diabetica Jesus MartyJesus Flores Campos100% (3)
- Bioquimica 11 Masa ProteicaДокумент23 страницыBioquimica 11 Masa ProteicaJesus Flores Campos75% (8)
- Bioquimica Informe 1Документ13 страницBioquimica Informe 1Jesus Flores Campos80% (5)
- Laminas de Embriologia 2 PacialДокумент6 страницLaminas de Embriologia 2 PacialJesus Flores CamposОценок пока нет
- Cetoacidosis Diabetica Jesus MartyДокумент19 страницCetoacidosis Diabetica Jesus MartyJesus Flores Campos100% (3)
- Producción de Proteína y Biomasa Probiótica de Lactobacillus Casei Liofilizadas A Partir de Suero deДокумент11 страницProducción de Proteína y Biomasa Probiótica de Lactobacillus Casei Liofilizadas A Partir de Suero desamyОценок пока нет
- BALSAДокумент4 страницыBALSARODRIGO DE JESUS VARGAS MARTINEZОценок пока нет
- Buen Uso Del LaboratorioДокумент6 страницBuen Uso Del Laboratoriobelen_reija_otero5038Оценок пока нет
- Fisio 123Документ7 страницFisio 123Ximena SantosОценок пока нет
- Dinámica LinealДокумент3 страницыDinámica LinealjobishОценок пока нет
- Transiciones e Imbricaciones Estéticas en El Umbral Del Metro de Medellín. Jua Felipe Suescún PDFДокумент165 страницTransiciones e Imbricaciones Estéticas en El Umbral Del Metro de Medellín. Jua Felipe Suescún PDFRojo RestrepoОценок пока нет
- Plan de Refuerzo ReligionДокумент2 страницыPlan de Refuerzo ReligionMonica Martinez50% (2)
- Motor DSPICДокумент10 страницMotor DSPICGustavo Choque CuevaОценок пока нет
- Sweet WardДокумент94 страницыSweet Wardcamila larrosa100% (1)
- Como DetectarДокумент5 страницComo DetectarGERARDO DAVID GERARDO DAVIDОценок пока нет
- Trabajo Grupal - Semana 6Документ6 страницTrabajo Grupal - Semana 6fernando jose carbajal carbajalОценок пока нет
- Tarea 2 Clasificación de Los Seres VivosДокумент8 страницTarea 2 Clasificación de Los Seres VivosAlexan EscañoОценок пока нет
- Laboratorio Tema 1 RLSДокумент3 страницыLaboratorio Tema 1 RLSanahi tristanОценок пока нет
- Informe 2. Sistema Masa-Resorte 1Документ4 страницыInforme 2. Sistema Masa-Resorte 1Leandra ÁlvarezОценок пока нет
- Taller de Costos 2Документ2 страницыTaller de Costos 2Martha Ortega MorenoОценок пока нет
- Estructuras de MaderaДокумент60 страницEstructuras de MaderaScarlett De La Rosa100% (3)
- Diccionario Arabe Ilustrado PDFДокумент40 страницDiccionario Arabe Ilustrado PDFFamilia Tejada AlonsoОценок пока нет
- Física 03 AnualДокумент6 страницFísica 03 AnualELMER TIGRE HUAMANОценок пока нет
- Cimentaciones (Historia, Importancia y Consecuencias)Документ31 страницаCimentaciones (Historia, Importancia y Consecuencias)Jason juleОценок пока нет
- Primeros Auxilios 2Документ12 страницPrimeros Auxilios 2HBZ385Оценок пока нет
- Control 8° Básico Lenguaje Textos Poéticos 2015Документ8 страницControl 8° Básico Lenguaje Textos Poéticos 2015tito00771Оценок пока нет
- Evaluacion Trabajo en CalienteДокумент2 страницыEvaluacion Trabajo en Calientegonzors0% (1)
- Descripción y Análisis de Los Puquios Como TecnologíaДокумент16 страницDescripción y Análisis de Los Puquios Como TecnologíajuanisОценок пока нет
- Laboratorio Anato Pato IДокумент48 страницLaboratorio Anato Pato IMedicina Humana 7Оценок пока нет
- CarolinaДокумент18 страницCarolinaCristofer Miñan EspinozaОценок пока нет
- DisposicionesNCh236VsASCE7 AplicacinaMarcosdeMomentoДокумент13 страницDisposicionesNCh236VsASCE7 AplicacinaMarcosdeMomentoAlvaro Toro DíazОценок пока нет
- Exam Bimes Iii 3° Raz Verb 08-10-20Документ2 страницыExam Bimes Iii 3° Raz Verb 08-10-20Yenny Samil CbОценок пока нет
- Nomenclatura Con SelloДокумент3 страницыNomenclatura Con SelloAgus LazarteОценок пока нет
- Tecnica de SeldingerДокумент14 страницTecnica de Seldingerapi-4725336910% (1)
- Almendros Nestor - Dias de Una CamaraДокумент183 страницыAlmendros Nestor - Dias de Una CamaraDaniela MuñozОценок пока нет