Академический Документы
Профессиональный Документы
Культура Документы
Correction - Chimie CH2 Et CH3 - Acide Sulfurique Du Commerce
Загружено:
la physique selon le programme FrançaisОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Correction - Chimie CH2 Et CH3 - Acide Sulfurique Du Commerce
Загружено:
la physique selon le programme FrançaisАвторское право:
Доступные форматы
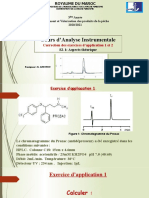
CORRECTION EXERCICE ACIDE SULFURIQUE
Sur l’étiquette d’un flacon contenant une solution commerciale S 0 d’acide sulfurique H 2 SO4 on lit :
Pourcentage massique 95%, densité d = 1,83 .
1. Calculer la concentration molaire C0 de la solution commerciale.
Masse volumique de la solution :
ρ ( sol ) = d ( sol ) × ρ ( eau ) = 1,83 × 1,00.103 = 1,83.103 g.L−1 avec ρ ( eau ) = 1,00.10 g .L
3 −1
Masse de la solution :
m( sol ) = ρ ( sol ) × V( sol ) = 1,83.103 × 1,00 = 1,83.103 g avec V( sol ) = 1,00 L
Masse d’acide pur :
95 95
m( H 2 SO4 ) = × m( sol ) = × 1,83.103 = 1,74.103 g
100 100
Quantité de matière d’acide pur :
m( H 2 SO4 ) 1,74.103
n( H 2 SO4 ) = = = 17,7 mol avec M ( H 2 SO4 ) = 2 M ( H ) + M ( S ) + 4 M ( O ) = 98,1g .mol −1
M ( H 2 SO4 ) 98,1
Concentration de la solution commerciale :
n( H 2 SO4 ) 17,7
C ( H 2 SO4 ) = = = 17,7mol.L−1
V( sol ) 1,00
On procède à la dilution de cet acide afin d’obtenir V1 = 250mL de solution S1 , de concentration
C1 = 1,0mol.L−1 .
2. Calculer le volume V0 de solution commerciale S0 à prélever pour obtenir S1 .
Lors d’une dilution, la quantité de matière de soluté ne varie pas :
C1 1,0
n0 = n1 donc C0 .V0 = C1.V1 donc V0 = × V1 = × 250 = 14mL
C0 17,7
On fait réagir cette solution sur de la poudre de fer : il se forme des ions fer(II) et un dégagement de
dihydrogène.
3. Ecrire l’équation de la réaction et dresser un tableau d’avancement.
+
La solution aqueuse d’acide sulfurique contient des ions H 3O et des ions SO42− d’après l’équation de
2− +
dissolution suivante : H 2 SO4( l ) → SO4 ( aq ) + 2 H 3O ( aq )
eau
+
Ce sont donc les ions oxonium H 3O de cette solution qui réagissent avec le fer :
2 H 3O + ( aq ) + Fe ( s)
→ Fe 2+
( aq ) + 2 H 2O( l ) + H 2 ( g )
EI ni ( H 3O + ) ni ( Fe) 0mol Excès 0mol
EF ni ( H 3O ) − 2 xMAX ni ( Fe) − xMAX
+
xMAX Excès xMAX
Dans un tube on introduit une masse m = 0,48 g de poudre de fer et de la solution S1 en excès, on récupère le
gaz formé.
4. Calculer la quantité de matière de dihydrogène formé.
m( Fe ) 0,48
Le réactif limitant est le fer, d’où : ni ( Fe ) − xMAX = 0 et xMAX = ni ( Fe ) = = = 8,6.10 −3 mol
(
M Fe ) 55,8
Or n f ( H 2 ) = xMAX = 8,6.10 mol
−3
5. En déduire le volume de dihydrogène recueilli sous une pression de p = 1,010.105 Pa et à une
température θ = 20°C .
Volume de dihydrogène :
n f ( H 2 ).R.T 8,6.10 −3 × 8,314 × 293
p.V ( H 2 ) = n f ( H 2 ).R.T d’où V ( H 2 ) = = 5
= 1,1.10 −4 m3 = 1,1.10 2 mL
p 1,010.10
Вам также может понравиться
- Applications de la spectrophotomérie en phytochimie: sciencesОт EverandApplications de la spectrophotomérie en phytochimie: sciencesОценок пока нет
- Travaux Diriges GPC 402Документ6 страницTravaux Diriges GPC 402Benito BenitoОценок пока нет
- TP PH Metre ATHIR - New1Документ8 страницTP PH Metre ATHIR - New1samibenhabileОценок пока нет
- TP 1 Preparation Solution 2020 2021 1Документ6 страницTP 1 Preparation Solution 2020 2021 1BillarjohnОценок пока нет
- TP4 La Reaction Persulfate IodureДокумент4 страницыTP4 La Reaction Persulfate IodureSellam Anis100% (1)
- coursGMP - Opérations Unitaires1-Pr MisbahiДокумент32 страницыcoursGMP - Opérations Unitaires1-Pr MisbahiMeryem MabroukОценок пока нет
- Mode Opératoire SpectroДокумент2 страницыMode Opératoire SpectroMushy Sõft Thiñg100% (2)
- LPVPT - TD N°1 - TD N°2Документ30 страницLPVPT - TD N°1 - TD N°2Mimi BCGОценок пока нет
- Des Ex Cour de Chimie ElectrochimieДокумент21 страницаDes Ex Cour de Chimie ElectrochimieImene GhmrОценок пока нет
- Electrochimie GP Ef 2017correctionДокумент4 страницыElectrochimie GP Ef 2017correctionAbdelatif100% (2)
- TD1 Genie Des Procedes L3MGPДокумент3 страницыTD1 Genie Des Procedes L3MGPEnoc LataОценок пока нет
- GP Licence L2 L3 - FICHES - TECHNIQUESДокумент81 страницаGP Licence L2 L3 - FICHES - TECHNIQUESallali hanaa0% (1)
- TP Benamara WДокумент3 страницыTP Benamara Wabir ben100% (1)
- TPДокумент5 страницTPمحمد ضياء الحقОценок пока нет
- TP AnalytiqueДокумент7 страницTP AnalytiqueRoubio Hiba100% (1)
- Chimie (TP)Документ1 страницаChimie (TP)bounegabОценок пока нет
- Chimie 03 2020-2021: Données: ρ (H O) = 1 Kg.L ; M = 40 g.molДокумент1 страницаChimie 03 2020-2021: Données: ρ (H O) = 1 Kg.L ; M = 40 g.molRomaissa Loulhaci100% (1)
- Dosage Des Ions FluoruresДокумент6 страницDosage Des Ions Fluoruresselmi nourelhoudaОценок пока нет
- S6 Chapitre 6 Cinetique Chimique PDFДокумент12 страницS6 Chapitre 6 Cinetique Chimique PDFAzizElheni100% (1)
- Oxy Do ReductionДокумент35 страницOxy Do ReductionMoustapha SallОценок пока нет
- Rhaoui AbdoДокумент9 страницRhaoui AbdoAli BoutaharОценок пока нет
- Rapport Final de L Electrochimie - CopieДокумент34 страницыRapport Final de L Electrochimie - CopieMgouni Ismail100% (1)
- MANGANIMÉTRIEДокумент2 страницыMANGANIMÉTRIEDiallo100% (1)
- Gee L1gi Zenasni TPДокумент65 страницGee L1gi Zenasni TPSoumia SalhiОценок пока нет
- Cinetique en Phase LiquideДокумент10 страницCinetique en Phase LiquideKARIMA BОценок пока нет
- FlammeДокумент13 страницFlammeilyesОценок пока нет
- Correct EX APL1 2Документ9 страницCorrect EX APL1 2Fatima IrjdalnОценок пока нет
- Travaux Pratiques L2 G Nie Des Proc D SДокумент23 страницыTravaux Pratiques L2 G Nie Des Proc D SHafsa MajentaОценок пока нет
- Rapport de Stage 22Документ26 страницRapport de Stage 22siwar khmissiОценок пока нет
- TP CPG PDFДокумент11 страницTP CPG PDFnadpharm13Оценок пока нет
- Exercices N 5 Et 6Документ7 страницExercices N 5 Et 6ahlemmОценок пока нет
- L'adsorption de Méthylène PDFДокумент12 страницL'adsorption de Méthylène PDFAymene Salah BendrihemОценок пока нет
- Série de TD N° (Extraction Liquide-Liquide)Документ1 страницаSérie de TD N° (Extraction Liquide-Liquide)Soudani Sara100% (2)
- TD Chromatographie en Phase Gazeuse de L3Документ6 страницTD Chromatographie en Phase Gazeuse de L3Kharoubi NassimaОценок пока нет
- TP N10vesДокумент6 страницTP N10vesAli AsmaraniОценок пока нет
- TP Spectroscopie M1 Chim Des MatДокумент7 страницTP Spectroscopie M1 Chim Des MatIbtissam EnnaouiriОценок пока нет
- Détermination de Point de Charge NulleДокумент13 страницDétermination de Point de Charge NulleBoudjaoui50% (2)
- Dossier Soude FR BD PDFДокумент24 страницыDossier Soude FR BD PDFNayla AllacheОценок пока нет
- TP ConductimetrieДокумент5 страницTP ConductimetriePedro Assassi100% (1)
- Introduction SoudeДокумент5 страницIntroduction SoudeBéchir GhorbélОценок пока нет
- Compte Rendu 2Документ10 страницCompte Rendu 2Houssam moussaОценок пока нет
- Correction Du TD-Inégnierie de La Réaction CatalytiqueДокумент4 страницыCorrection Du TD-Inégnierie de La Réaction CatalytiqueBenito BenitoОценок пока нет
- TP de Chimie Organique II - 22-23Документ9 страницTP de Chimie Organique II - 22-23Ayoub Ichfi0% (1)
- CCMДокумент2 страницыCCMlmd2009100% (1)
- TP AbsorptionДокумент8 страницTP Absorptiondadi sihemОценок пока нет
- Compte Rendu de TP DistilationДокумент8 страницCompte Rendu de TP DistilationABDELALI SASSIOUIОценок пока нет
- Première Phase:: A. en Utilisant Le DiethyletherДокумент7 страницPremière Phase:: A. en Utilisant Le Diethyletherufuq matarОценок пока нет
- Determination Du Taux D'iodeДокумент4 страницыDetermination Du Taux D'iodeKonan Richard KouassiОценок пока нет
- TP N°2 ChimieДокумент5 страницTP N°2 ChimieDenilson Josemir100% (1)
- Cours Extraction Partie IДокумент51 страницаCours Extraction Partie IMaissa Boucif100% (1)
- Titrage de La Solution FeSO4 Par La Solution KMnO4Документ7 страницTitrage de La Solution FeSO4 Par La Solution KMnO4Tahar YahiaouiОценок пока нет
- Chap III IV Et V l3 CAДокумент17 страницChap III IV Et V l3 CAFatouma ShОценок пока нет
- P2016 CM11 TP FasciculeДокумент44 страницыP2016 CM11 TP FasciculeRochdi BAATIОценок пока нет
- Fiche Methode PhosphatesДокумент2 страницыFiche Methode PhosphatesSk CisseОценок пока нет
- P 41-46Документ6 страницP 41-46Nina PassiflowraОценок пока нет
- FICHE DE TP Eau de JavelДокумент3 страницыFICHE DE TP Eau de JavelAbdelhamid ABDENNOURIОценок пока нет
- Serie 0 RévisionДокумент1 страницаSerie 0 RévisionAhmed ElhammadiОценок пока нет
- TP Potentio Corr PDFДокумент4 страницыTP Potentio Corr PDFPS HadjerОценок пока нет
- (1bis) Solutions DétailléesДокумент7 страниц(1bis) Solutions DétailléescharleyrandrianjatovoОценок пока нет
- Exercices de Re Visions - PC - Ts-2Документ16 страницExercices de Re Visions - PC - Ts-2baatout oumaymaОценок пока нет
- Eni Geipi Physique 2009Документ9 страницEni Geipi Physique 2009la physique selon le programme FrançaisОценок пока нет
- Corrige Geipi QCM 2006Документ7 страницCorrige Geipi QCM 2006la physique selon le programme FrançaisОценок пока нет
- ENI GEIPI Physique 2010Документ9 страницENI GEIPI Physique 2010la physique selon le programme FrançaisОценок пока нет
- Tagemage AnnalesДокумент32 страницыTagemage AnnalespfservantОценок пока нет
- Eni Geipi Physique 2009Документ9 страницEni Geipi Physique 2009la physique selon le programme FrançaisОценок пока нет
- Corrige ENI GEIPI Physique 2009Документ8 страницCorrige ENI GEIPI Physique 2009la physique selon le programme FrançaisОценок пока нет
- Corrige Eni Geipi Sujet 1Документ7 страницCorrige Eni Geipi Sujet 1la physique selon le programme FrançaisОценок пока нет
- Cours ConductimetrieДокумент8 страницCours Conductimetrienico21du13Оценок пока нет
- Corrige GEIPI Sujet 1Документ9 страницCorrige GEIPI Sujet 1la physique selon le programme FrançaisОценок пока нет
- Corrige ENI GEIPI Physique 2009Документ8 страницCorrige ENI GEIPI Physique 2009la physique selon le programme FrançaisОценок пока нет
- Epreuve de Physique 2005 Concours D Admission Al ESSAДокумент4 страницыEpreuve de Physique 2005 Concours D Admission Al ESSAla physique selon le programme FrançaisОценок пока нет
- 08 PhysMPДокумент8 страниц08 PhysMPla physique selon le programme FrançaisОценок пока нет
- DS de Physique-Chimie N°3 Mercredi 10 Novembre 2010Документ4 страницыDS de Physique-Chimie N°3 Mercredi 10 Novembre 2010la physique selon le programme Français100% (1)
- Cond 02Документ17 страницCond 02la physique selon le programme FrançaisОценок пока нет
- Dusa 2 Dspe 2 Dsujet 2 Dtitragechlorureconductimetrie 2 D 4 PtsДокумент3 страницыDusa 2 Dspe 2 Dsujet 2 Dtitragechlorureconductimetrie 2 D 4 Ptsla physique selon le programme FrançaisОценок пока нет
- Corrige Exercices Conductimetrie Feuille Travaux DirigesДокумент3 страницыCorrige Exercices Conductimetrie Feuille Travaux Dirigesla physique selon le programme Français89% (9)
- en Raisonnant Sur Un Ion I, de Concentration C V: F Où F Est Le Faraday e 9, 65.10Документ3 страницыen Raisonnant Sur Un Ion I, de Concentration C V: F Où F Est Le Faraday e 9, 65.10la physique selon le programme FrançaisОценок пока нет
- 2004 Specialite SujetsДокумент54 страницы2004 Specialite Sujetsla physique selon le programme FrançaisОценок пока нет
- S Physique Chimie Obligatoire 2010 Metropole SujetДокумент10 страницS Physique Chimie Obligatoire 2010 Metropole SujetTHT31Оценок пока нет
- Corrige Exercices Conductimetrie Feuille Travaux DirigesДокумент3 страницыCorrige Exercices Conductimetrie Feuille Travaux Dirigesla physique selon le programme Français89% (9)
- 2010 Pondichery Exo1 Sujet Polonium 6ptsДокумент2 страницы2010 Pondichery Exo1 Sujet Polonium 6ptsla physique selon le programme FrançaisОценок пока нет
- 2010 Polynesie Spe Exo3 Sujet AnanasДокумент4 страницы2010 Polynesie Spe Exo3 Sujet Ananasla physique selon le programme FrançaisОценок пока нет
- S Physique Chimie Obligatoire 2010 Metropole SujetДокумент10 страницS Physique Chimie Obligatoire 2010 Metropole SujetTHT31Оценок пока нет
- Devoir Commun 1S 2005 Exercice 1:: SO (Aq) + I (Aq) + 2 H O SO (Aq) + 2 I (Aq) + 4 H (Aq)Документ2 страницыDevoir Commun 1S 2005 Exercice 1:: SO (Aq) + I (Aq) + 2 H O SO (Aq) + 2 I (Aq) + 4 H (Aq)la physique selon le programme FrançaisОценок пока нет
- 1s DST 3Документ4 страницы1s DST 3la physique selon le programme FrançaisОценок пока нет
- 2010 Pondichery Exo1 Correction Polonium 6ptsДокумент2 страницы2010 Pondichery Exo1 Correction Polonium 6ptsla physique selon le programme FrançaisОценок пока нет
- 2010 Pondichery Exo2 Spe Correction Eugenol 4ptsДокумент2 страницы2010 Pondichery Exo2 Spe Correction Eugenol 4ptsla physique selon le programme FrançaisОценок пока нет
- 2010 Polynesie Spe Exo3 Correction AnanasДокумент2 страницы2010 Polynesie Spe Exo3 Correction Ananasla physique selon le programme FrançaisОценок пока нет
- 2010 Pondichery Exo2 Spe Sujet Eugenol 4ptsДокумент4 страницы2010 Pondichery Exo2 Spe Sujet Eugenol 4ptsla physique selon le programme FrançaisОценок пока нет