Академический Документы
Профессиональный Документы
Культура Документы
Ejercicios de Termo Procesos Termodinamicos
Загружено:
Armando Perez Jr.Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Ejercicios de Termo Procesos Termodinamicos
Загружено:
Armando Perez Jr.Авторское право:
Доступные форматы
19.4 Seis moles de gas ideal estn en un cilindro provisto en un extremo con un pistn mvil.
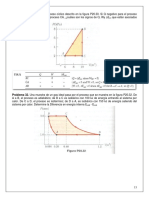
La temperatura inicial del gas es 27.0 C y la presin es constante. Como parte de un proyecto de diseo de maquinaria, calcule la temperatura final del gas una vez que ha efectuado 1.75x10J de trabajo. n= 6 moles Proceso Isobarico T?= 27C P=CTE. W=1.75*10J PV=nRT V?= Vf= W=P ( - ) Pf= P?=P W= (nRTf - nRT?) W + nRT? = nRTf Tf= Tf= Tf= 335.24K 19.8 Trabajo efectuado en un proceso cclico. a) En la figura 19.8a, considere el ciclo cerrado 1 3 2 4 1. Este es un proceso cclico en el que los estados inicial y final son el mismo. Calcule el trabajo total efectuado por el sistema en este proceso y demuestre que es igual al rea encerrada por el ciclo. b) Qu relacin hay entre el trabajo efectuado por el proceso de la parte (a) y el efectuado si se recorre el ciclo en la direccin opuesta, 1 4 2 3 1? Explique. Proceso 1-3 Isobrico 3-2 Isocorico 2-4 Isobrico 4-1 Isocorico a)Wt=W1-3 + W3-2 +W2-4+W4-1 Wt= P1 (V3-V1)+ P2 (V4-V2) Pero V1=V4 y V2= V3 sustituyendo Wt=P1(V2-V1)+P2(V1-V2)= P1(V2-V1)-P2(V2-V1) Wt=(P1-P2)(V2-V1) b*h b) proceso 1-4 Isocorico 3-1 Isobrico 2-3 Isocorico 4-2 Isobrico
Wt= W1-4 + W4-2 + W2-3 + W3-1 Wt=P1(V3-V1) + P2(V4-V2 V1=V4 y V2=V3 Wt =P1(V3-Vl)+P2 (V4-V2)= -P1(V3+V1)+P2(V4-V2) Wt= (-p1 +p2)(V2-V1) Explicacin El rea es la misma lo que cambia es el signo 19.17 Un sistema se lleva por el ciclo de la figura 19.23, del estado a al b y de regreso al a. El valor absoluto de la transferencia de calor durante un ciclo es de 7200 J. a) El sistema absorbe o desprende calor cuando recorre el ciclo en la direccin indicada en la figura? Cmo lo sabe? b) Qu trabajo W efecta el sistema en un ciclo? c) Si el sistema recorre el ciclo en direccin antihoraria, absorbe o desprende calor en el ciclo? Qu magnitud tiene el calor absorbido o desprendido en un ciclo antihorario?
V a) El calor depende de la trayectoria Q=+ absorbe calor se sabe por medio de la trayectoria de a - b da mayor calor que de b - a b) Cuando es un ciclo cerrado U=0 Q= 7200J Q-W= U Q=W W= 7200J El sistema realiza trabajo sobre sus alrededores c) a-b positivo (+) y b-a negativo (-) Da signo negativo nada ms que desprendera calor Q= -7200J desprende calor Q= -7200 =7200 J Magnitud del calor absorbe calor de calort del didteme 19.21 En un experimento para simular las condiciones dentro de un motor de automvil, 645 J de calor se transfieren a 0.185 moles de aire contenidos en un cilindro cuyo volumen es de 40.0 cm. En un principio, el aire est a una presin de 3.00 10? Pa y una temperatura de 780 K. a) Si el volumen del cilindro se mantiene fijo, qu temperatura final alcanza el aire? Suponga que el aire es prcticamente nitrgeno puro y use los datos de la tabla 19.1 aunque la presin no es baja. Dibuje una grfica pV para este proceso. b) Calcule la temperatura final del aire si se permite que el volumen del cilindro aumente mientras la presin se mantiene constante. Dibuje una grfica pV para este proceso. Q=645J n=0185 mol V=40.0 cm P?=3.00x10? Pa T?=780K a)Tf=? Cuando el volumen es constante Cv=20.76 J/mol.k Q=nCvT (Tf-T?)=
Tf= Tf= Tf= Tf= 167.97K + 780K Tf= 947.97K
b) Cp=29.7J/molK Q=nCpT T= (Tf-T?)= Tf= Tf= Tf=899.89 K 19.27 La temperatura de 0.150 moles de gas ideal se mantiene constante en 77.0C mientras su volumen se reduce al 25.0% de su volumen inicial. La presin inicial del gas es de 1.25 atm. a) Determine el trabajo efectuado por el gas. B) Determine el cambio de energa interna. c) El gas intercambia calor con su entorno? Si lo hace, cunto es? El gas absorbe o desprende calor? T=77.0C CTE. T=77C+273016=350.16K n=0.150mol Vf=25%-V? P?=1.25atm U=0 R=8.314J/molK a) Q=W=nRTLn(Vf/V?) Pv=nRT V?= V?= V?=4.31lt 4.31*10m Vf=4.31-75% Vf=1.08lt 1.08*10m W=nRTLn (Vf/V?) W=0.150mol(8.314J/molK)(350.16K) Ln (8.62*10?m/3.45*10m) W=-605.63 Los alrededores realizan trabajo sobre el sistema. b) U=0 porque es un proceso Isotrmico c) Si, el gas intercambia calor con su entorno
Q=W=U Q=W W<0 Q=-605.63 El calor liberado es de 605.63J 19.30 Un cilindro contiene 0.250 moles de dixido de carbono (CO?) gaseoso a una temperatura de 27.0 C. El cilindro cuenta con un pistn sin friccin, el cual mantiene una presin constante de 1.00 atm sobre el gas. El gas se calienta hasta que su temperatura aumenta a 127.0C suponga que el CO? se puede tratar como gas ideal. a) Dibuje una grfica pV para este proceso. b) Cunto trabajo efecta el gas en este proceso? c)Sobre qu se efecta ese trabajo? d) Cundo cambia la energa interna del gas? e)Cunto calor se suministro al gas? f) Cunto trabajo se habra efectuado si la presin hubiera sido 0.50 atm? n=0.250mol T?=27.0C 300.16K P=1.00 atm CTE. Tf=127.0C 400.16K a) Grafica Pv b) W=P(Vf-V?) Pv=nRT V?= V?= V?=6.16Lt 6.16*10m Vf= Vf= Vf=8.21Lt 8.21*10m W=P(Vf-V?) W=1.013*10?pa(8.21*10m-6.16*10m) W=207.7 J c) EL Trabajo est en el pistn d) U=nCvT T=Tf-T?=400.16K-300.16K=100K CO? Cv=28.46J/molK U=(0.250mol)(28.46J/molK)(100K) U=711.5J e) Q=?
Q-W=U Q=U+W Q=711.5J+207.7 Q=919.2J f) El trabajo seria el mismo sea 207.85J 19.34 Dos moles de monxido de carbono (CO) estn a una presin de 1.2 atm y ocupan un volumen de 30 litros. Despus, el gas se comprime adiabticamente a ? de ese volumen. Suponga que el gas tiene comportamiento ideal. Cunto cambia su energa interna? La energa interna aumenta o disminuye? La temperatura del gas aumenta o disminuye durante el proceso? Explique. n=2mol P?=1.2 atm V?=30 Lt Vf= V?=Vf=10 Lt U=? Q=0 = = U incrementa porque el trabajo del gas > 0 La temperatura aumenta porque la U est incrementando porque es un gas ideal. 19.39 Una cantidad de dixido de azufre (SO?) gaseoso ocupa un volumen de 5.00 10 m a una presin de 1.10 10? Pa. El gas se expande adiabticamente a un volumen de 1.00 10 m. Suponga que el gas tiene comportamiento ideal. a) Calcule la presin final del gas. (Sugerencia: Vase la tabla 19.1. b) Cunto trabajo efecte el gas sobre su entorno? c) Determine la razn temperatura final: temperatura inicial del gas. V?=5.00*10 m P?=1.10*10Pa =1.29 V?=1.00*10m a) P?=?
P?= P?=44.98.59 Pa P?=4.5*10?Pa b) W=? W= W=
W=334.83 J c) T?:T?
La Temperatura final (T?) est bajando
19.44 Un sistema termodinmico se lleva del estado a al estado c de la figura 19.29 siguiendo la trayectoria abc, el trabajo W efectuado por el sistema es de 450 J. Por la trayectoria abc, W es de 120 J. las energas internas de los cuatro estados mostrados en la figura son: Ua = 150 J, Ub = 240 J, Uc = 680 J y Ud = 330 J. Calcule el flujo de calor Q para cada uno de los cuatro procesos: ab, bc, ad y dc. En cada proceso, El sistema absorbe o desprende calor? Wabc=450J Wadc=120J Ua=150J Ub=240J Uc=680J Ud=330J Q-W=U Q=U+W Q=(Uf-U?)+W Flujo de calor en ab Q=(240J-150J) Q(240J1505J+W Q=90J Flujo decalir en bc Q=(680J-240J)+450J Q=890J Flujo de calor en a1 Q=(330J-150J)120j Q=300J Flujo se calor en dc Q=(680J-330J)+W Q=350J El sistema recibe calor en cada proceso.
19.47 Dos moles de un gas monoatmico con comportamiento ideal se someten al ciclo abc. En un ciclo completo, salen 800 J de calor del gas. El proceso ab se efecta a presin constante; y el bc, a volumen constante. Los estados a y b tienen temperaturas Ta = 200 K y Tb = 300 K. a) Dibuje una grfica pV para el ciclo. b) Cunto trabajo W se efecta en el proceso ca? Q=-800J n=2mol Ta=200K R=8.314J/mol.K Tb=300K a) ab=Presin Constante bc=Volumen Constante b) Q-W=U Q-W=(Uf-U?) U?=Uf Q-W=0 Q=W -800 J Sale calor del sistema y se realiza trabajo Q < 0 y W<0 Wab=P(Vf-V?) Wab=P V Wab=nR T Wab=(2mol)(8.314J/molK)(300K-200K) Wab=1662.8J Wtotal=Wab+Wbc+Wca Wca=Wtotal-Wab Wca=-800J-1662.8J Wca=-2462.8J
Вам также может понравиться
- Fisica MecanicaДокумент54 страницыFisica MecanicaDavid ReyesОценок пока нет
- Cap11 Primera Ley de La TermodinamicaДокумент20 страницCap11 Primera Ley de La TermodinamicaRenzo Rodriguez64% (25)
- Ficha de Trabajo 5 CalorimetriaДокумент2 страницыFicha de Trabajo 5 Calorimetriajeefrey100% (2)
- Problemas A ResolverДокумент11 страницProblemas A ResolverROMERO CUBAS GERMAN SMITH100% (3)
- PROBLEMAS FisicaДокумент44 страницыPROBLEMAS FisicaSabrina Maida0% (1)
- PROBLEMAS FisicaДокумент54 страницыPROBLEMAS FisicaMaxRamirezCastro100% (2)
- Tarea Resuelta - Fisica IIДокумент11 страницTarea Resuelta - Fisica IIROMERO CUBAS GERMAN SMITHОценок пока нет
- FisicaДокумент2 страницыFisicaIsai Mejia100% (1)
- 19 1Документ22 страницы19 1Diego100% (1)
- Ejercicios de Fisica - Parte 2Документ3 страницыEjercicios de Fisica - Parte 2JEFALEVALVEG100% (2)
- SoluciónДокумент1 страницаSoluciónCesar Linarez Chavez100% (2)
- Informe SerwayДокумент9 страницInforme SerwayLuiza Fernanda Narvaez TimanaОценок пока нет
- Actividad 3 Julieth Alvis 6 - G4 - SolДокумент8 страницActividad 3 Julieth Alvis 6 - G4 - SolJulieth Alvis100% (2)
- Taller 1 de Fisica IiiДокумент17 страницTaller 1 de Fisica IiiAndreyGomez50% (2)
- Mecanismos de Transferencia de CalorДокумент6 страницMecanismos de Transferencia de CalorBarrientos RichiОценок пока нет
- Termo Ej 6 Carlos Valb.Документ4 страницыTermo Ej 6 Carlos Valb.Carlos Valbuena0% (2)
- Calorimetria y Cambios de FaseДокумент7 страницCalorimetria y Cambios de FaseBarrientos Richi100% (1)
- Ejercicios CalorimetriaДокумент5 страницEjercicios CalorimetriaEvelynLluén50% (2)
- Problemas Resueltos TermodinamicaДокумент15 страницProblemas Resueltos TermodinamicaErick Mata50% (10)
- Taller CooperativoДокумент2 страницыTaller CooperativoAndreyGomezОценок пока нет
- Problemas de TermoДокумент3 страницыProblemas de TermoAlan CortesОценок пока нет
- Taller 5Документ9 страницTaller 5William Quinchia100% (1)
- EjerciciosДокумент1 страницаEjerciciososcar perez100% (2)
- Fisica II - Problemas - SearsДокумент5 страницFisica II - Problemas - SearsJorge Yonel Terrones Hernandez100% (7)
- Ejercicios OndasДокумент2 страницыEjercicios Ondasluz100% (1)
- Tratando de Mantenerse Despierto Toda La NocheДокумент2 страницыTratando de Mantenerse Despierto Toda La NocheAzury Sugy Cortegana CruzadoОценок пока нет
- Practica 1 ResueltoДокумент3 страницыPractica 1 ResueltoDoris Zegarra100% (1)
- Ejercicio 29 PDFДокумент4 страницыEjercicio 29 PDFirvinОценок пока нет
- Actividad 4.3 - Procesos TermodinámicosДокумент9 страницActividad 4.3 - Procesos TermodinámicosÁngel Ayala GonzalezОценок пока нет
- Taller 6Документ6 страницTaller 6William Quinchia100% (1)
- Respuestas de TermoДокумент6 страницRespuestas de TermoRei Armella100% (1)
- 23Документ2 страницы23Carlos Angel Vilcapaza Caceres0% (2)
- p7 Procesos TermodinamicosДокумент12 страницp7 Procesos TermodinamicosRoberto Pu83% (23)
- Tarea - Tercer Examen Calor Temperatura y Propiedades Termica de Los CuerposДокумент6 страницTarea - Tercer Examen Calor Temperatura y Propiedades Termica de Los CuerposROMERO CUBAS GERMAN SMITHОценок пока нет
- Prueba 3 Calor y Propiedades Térmicas de La MateriaДокумент4 страницыPrueba 3 Calor y Propiedades Térmicas de La MateriadennysquimiОценок пока нет
- Fisica DilatacionДокумент2 страницыFisica DilatacionRoberto Romero100% (1)
- Taller s04 Solucion Fisica 2 UpcДокумент3 страницыTaller s04 Solucion Fisica 2 UpcAnthony LC100% (1)
- Preguntas Capitulo 17Документ4 страницыPreguntas Capitulo 17Mahitecita Taborga0% (1)
- Ep-B 16918 FisicaДокумент5 страницEp-B 16918 FisicaAlexi AdmsОценок пока нет
- Ejercicio 17.31 - Reina Pelaez - Calor y OndasДокумент2 страницыEjercicio 17.31 - Reina Pelaez - Calor y OndasReina PelaezОценок пока нет
- Clase14octubreFis2 PDFДокумент11 страницClase14octubreFis2 PDFDilas Veld100% (1)
- Transferencia de Calor Por Conducción, Convección y Radiación 2Документ11 страницTransferencia de Calor Por Conducción, Convección y Radiación 2Enzo ReyesОценок пока нет
- Ejercicio P 1720 SДокумент2 страницыEjercicio P 1720 SDIEGO OSVALDO OCAMPO RODRIGUEZ100% (1)
- ED - 02 (C) SolДокумент2 страницыED - 02 (C) SolJEAN MARCO SALAZAR ACEVEDOОценок пока нет
- TermodinamicaДокумент2 страницыTermodinamicaDaviiSanchez0% (1)
- SOLUCION2PARCIALSEGUNDOCUATRIMESTREFISICADOSFIDELITAS2015G002Документ4 страницыSOLUCION2PARCIALSEGUNDOCUATRIMESTREFISICADOSFIDELITAS2015G002GustavoОценок пока нет
- PROBLEMAS CAPITULO 10 - Maquinas Termicas, Entropia y 2° Ley de La TermodinamicaДокумент6 страницPROBLEMAS CAPITULO 10 - Maquinas Termicas, Entropia y 2° Ley de La TermodinamicaRafael Quispe Velasquez0% (1)
- Practica de Aula No. 03 FluidosДокумент3 страницыPractica de Aula No. 03 Fluidosmilajis0% (1)
- EjerciciosДокумент2 страницыEjerciciosJane BerrioОценок пока нет
- 9 HGДокумент25 страниц9 HGCarlos Angel Vilcapaza Caceres100% (1)
- Primera Ley de La TermodinamicaДокумент18 страницPrimera Ley de La TermodinamicaYorvi LliqueОценок пока нет
- Problemas Tema 2Документ5 страницProblemas Tema 2Odin PerezОценок пока нет
- Problemas Tema 2 2020-21Документ2 страницыProblemas Tema 2 2020-21José Antonio BayónОценок пока нет
- p7 Procesos TermodinamicosДокумент12 страницp7 Procesos TermodinamicosJean Marco Morales AlcántaraОценок пока нет
- TermodinamicaДокумент16 страницTermodinamicaEmmanuel AlvaradoОценок пока нет
- Primera Ley TermodinámicaДокумент32 страницыPrimera Ley TermodinámicaAlexander Micha Tello50% (2)
- Deber 6Документ4 страницыDeber 6jhonОценок пока нет
- Re CALORIMETRÍAДокумент14 страницRe CALORIMETRÍAJuan Gonzalo Rose0% (1)
- GUIAДокумент18 страницGUIALeonardo GarayОценок пока нет