Академический Документы
Профессиональный Документы
Культура Документы
Termofisica y Termoquimica
Загружено:
Ruben Manuel Moyer ManzurОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Termofisica y Termoquimica
Загружено:
Ruben Manuel Moyer ManzurАвторское право:
Доступные форматы
TERMOFISICA CAMBIOS DE ENTALPA PARA TRANSICIONES DE FASE
1) ) La teora molecular de la materia supone que en un lquido consiste en molculas agrupadas regularmente cerca unas de otras. 1) 1) Las molculas tienen una energa cintica media que esta relacionada con la temperatura del lquido, sin embargo no todas las molculas se mueven con la misma velocidad, algunas se mueven mas rpido. 2) 2) Debido a que las molculas estn muy cercanas entre s, las fuerzas entre ellas son relativamente grandes.
Caractersticas de los Lquidos.
1) 1) Cohesin: fuerza de atraccin entre molculas iguales. 2) 2) Adhesin: fuerza de atraccin entre molculas diferentes. 3) 3) Viscosidad: resistencia que manifiesta un lquido a fluir, su unidad es el Poise=dina seg./cm2 4) 4) Tensin Superficial: fuerza que se manifiesta en la superficie de un lquido, por medio de la cual la capa exterior del lquido tiende a contener el volumen de este dentro de una mnima superficie. 5) 5) Capilaridad: facilidad que tienen los lquidos para subir por tubos de dimetros pequesimos (capilares) donde la fuerza de cohesin es superada por la fuerza de adhesin.
Cambios de fase.
La energa trmica perdida o ganada por los objetos se llama calor. El calor es otra forma de energa que puede medirse solo en funcin del efecto que produce. El trabajo mecnico puede convertirse en calor. Para medir el calor se emplean las siguientes unidades:
Calora: es la cantidad de calor necesaria para elevar un grado Celsius la temperatura de un gramo de agua. Kilocalora: cantidad necesaria para elevar en un grado Celsius un kilogramo de agua. Joule: cantidad de energa requerida para elevar la temperatura de un kilogramo de sustancia en 100 grados Kelvin. La diferencia entre calor y temperatura es que el calor depende de la masa y la temperatura no, ya que la temperatura es la medida del promedio de las energas cinticas de las molculas y el calor es la suma de las energas cinticas de las molculas. Cuando una sustancia absorbe una cantidad dada de calor, la velocidad de sus molculas se incrementa y su temperatura se eleva. lquido hierve. Sin embargo, ocurren ciertos fenmenos curiosos cuando un slido se funde o un En estos casos la temperatura permanece constante hasta que todo el slido se funde o hasta que todo el lquido pase a fase vapor. Si cierta cantidad de hielo se toma de un congelador a -20 C y se calienta, su temperatura se incrementa gradualmente hasta que el hielo comience a fundirse a 0 C ; durante el proceso de fusin permanece constante, hasta que todo el hielo pase a agua. Una vez que el hielo se funde la temperatura comienza a elevarse otra vez con una velocidad uniforme hasta que el agua empiece a hervir a 100 C, durante el proceso de vaporizacin la temperatura permanece constante, si el vapor de agua se almacena y se contina el calentamiento hasta que toda el agua se evapore de nuevo la temperatura comenzar a elevarse.
Cambios de estado. Calores latentes
Uno de los efectos ms comunes del aporte de energa calorfica es el cambio de estado de los cuerpos. Es bien conocido que el hielo, al calentarse, se convierte en agua lquida, y que sta se transforma en vapor por encima de cierta temperatura. Esta sucesin de fases se reproduce, en
distintas formas y con rasgos diferentes, en todas las sustancias de la naturaleza.
Cambios de estado Durante los procesos de cambio de estado o de fase de un cuerpo no se produce un incremento de temperatura cuando se aporta calor. En la mayora de las sustancias, cabe distinguir los siguientes tipos de cambios de estado:
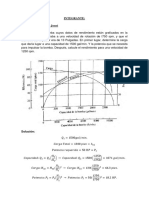
Esquema grfico de los cambios de estado.
Fusin, de estado slido a lquido. Sublimacin, de slido a gas o a la inversa, sin pasar por el estado lquido. Vaporizacin o evaporacin, de lquido a gas. Condensacin, de vapor a lquido. Solidificacin, de lquido a slido.
Estos cambios de fase se deben a modificaciones en la estructura molecular ntima de los cuerpos por efecto de la aportacin de una energa calorfica. Calores latentes El calor necesario para provocar el cambio de estado completo de una unidad de masa de la sustancia dada se denomina calor latente. Para cada proceso de cambio de estado existe un calor latente distinto (por ejemplo, calor latente de fusin, de vaporizacin, de condensacin, etc). As, el calor latente de fusin es la cantidad de calor necesaria para fundir completamente una masa m de un slido, y se expresa como:
Los calores latentes de vaporizacin, condensacin, sublimacin, etc., se definen de forma anloga a la anterior. Todos los calores latentes son parmetros caractersticos de cada sustancia, y su valor depende de la presin a la que se produzca el cambio de fase para la misma.
CALOR LATENTE DE FUSIN El calor latente de fusin es el calor absorbido en la fusin de 1 g de sustancia a temperatura constante. Los calores de fusin de las sustancias son muy inferiores a sus calores de vaporizacin. Para el hielo es igual a 79,7 caloras por gramo. La temperatura de fusin varia, aunque muy poco, con la presin aplicada a la sustancia; en general, en los slidos ms densos que el lquido la temperatura de fusin aumenta al elevar la presin, mientras que el caso contrario tal como el hielo, la temperatura de fusin disminuye al elevar la presin.
CALOR DE SUBLIMACIN El calor de sublimacin es la cantidad de calor necesario para sublimar a temperatura constante 1 g de sustancia en estado slido. El calor de sublimacin de una sustancia es igual a la suma del calor de fusin ms el calor de vaporizacin, ya que el paso directo de slido-vapor puede realizarse en las dos etapas equivalentes slido-liquido y liquidovapor.
CALOR DE VAPORIZACIN Cuando un lquido se encuentra a la temperatura de ebullicin, para pasarlo a estado de vapor hay necesidad de aplicarle una cantidad de calor adicional, para romper las fuerzas atractivas intermoleculares, a este calor
necesario para evaporar cierta cantidad de sustancia se le conoce con el nombre de calor de vaporizacin.
Mtodos para estimar el calor latente de vaporizacin
Вам также может понравиться
- Memoria Estructural Rotulo BanproДокумент18 страницMemoria Estructural Rotulo BanproRamon Rodriguez CastroОценок пока нет
- Quimica ExhcobaДокумент4 страницыQuimica ExhcobaMauricio Flores Aguilar50% (2)
- Calor LatenteДокумент6 страницCalor LatenteKARENОценок пока нет
- Preparar y acondicionar elementos y máquinas de la planta química. QUIE0108: Operaciones básicas en planta químicaОт EverandPreparar y acondicionar elementos y máquinas de la planta química. QUIE0108: Operaciones básicas en planta químicaРейтинг: 3 из 5 звезд3/5 (2)
- PDF 20220731 113523 0000Документ16 страницPDF 20220731 113523 0000Pancho JuanetesОценок пока нет
- Cuestionario 4 Balance de MateriaДокумент5 страницCuestionario 4 Balance de Materiaruthy4545100% (1)
- Ejercicio Reemplazar PolaresДокумент2 страницыEjercicio Reemplazar PolaresCristhian Nc100% (2)
- Clases N°1-2-3Документ101 страницаClases N°1-2-3Rodrigo constenlaОценок пока нет
- Cambios de estado y sus procesosДокумент11 страницCambios de estado y sus procesosMARIОценок пока нет
- Resumen y Glosario de Termodinamica - CynthiaДокумент5 страницResumen y Glosario de Termodinamica - CynthiaCynthia GooОценок пока нет
- Los cambios de estado de la materiaДокумент5 страницLos cambios de estado de la materiaAlejandro Nicolas SchunkeОценок пока нет
- 4º Equilibrio Fisico-QuimicoДокумент25 страниц4º Equilibrio Fisico-QuimicoSaid TintayaОценок пока нет
- Principios de La CalorimetríaДокумент3 страницыPrincipios de La CalorimetríaPiero Cardenas VillasanteОценок пока нет
- Cambios Del Estado de La MateriaДокумент4 страницыCambios Del Estado de La MateriaMarcela Cors MenaОценок пока нет
- Calor LatenteДокумент2 страницыCalor LatenteMARTHAОценок пока нет
- Chichi Doria Klor Latente y VaporizacionДокумент4 страницыChichi Doria Klor Latente y VaporizacionSaudith MoscoteОценок пока нет
- Física aplicada a la arquitectura: Calor y cambios de estadoДокумент10 страницFísica aplicada a la arquitectura: Calor y cambios de estadoMatias PosstaОценок пока нет
- Informe de 212 - Calor y Dilatacion LinealДокумент11 страницInforme de 212 - Calor y Dilatacion LinealGustavo Barcia100% (1)
- Profundizando Conceptos 2do Cambio de FaseДокумент3 страницыProfundizando Conceptos 2do Cambio de FaseFdadadawd dadadaОценок пока нет
- Calor y TemperaturaДокумент7 страницCalor y TemperaturaBETINA SANCHEZ NIZОценок пока нет
- P4-Quimica Inorganico Estados de La MateriaДокумент19 страницP4-Quimica Inorganico Estados de La MateriaHector BolОценок пока нет
- Cambios Por Accion Del CalorДокумент12 страницCambios Por Accion Del Calortotalwet60% (5)
- P4-Quimica Inorganico Estados de La MateriaДокумент19 страницP4-Quimica Inorganico Estados de La MateriaHector BolОценок пока нет
- Propiedades físicas materiaДокумент24 страницыPropiedades físicas materiaLeydi VenegasОценок пока нет
- Apunte Calor TeóricoДокумент16 страницApunte Calor Teóricobarbapilar.674aОценок пока нет
- Cambios de Estado de La MateriaДокумент18 страницCambios de Estado de La MateriaCarlos GómezОценок пока нет
- Lab. 1 - Cambios de Fase Del AguaДокумент6 страницLab. 1 - Cambios de Fase Del AguaJosé María Quintero Q.Оценок пока нет
- Tema 2 Leyes FundamentalesДокумент8 страницTema 2 Leyes FundamentalesVerónica Pérez BarreraОценок пока нет
- ENTALPIAДокумент5 страницENTALPIAMaría Rosmeri Sánchez AymaОценок пока нет
- Transformaciones estado materiaДокумент10 страницTransformaciones estado materiaAna Gonzalez67% (3)
- Cuestionario Previo. Entalpia de Transformación Del AguaДокумент3 страницыCuestionario Previo. Entalpia de Transformación Del AguaDiego CárdenasОценок пока нет
- Analisis y ConclusionДокумент5 страницAnalisis y ConclusionMariZpОценок пока нет
- Estado LiquidoДокумент21 страницаEstado LiquidoRenataAlvaradoОценок пока нет
- Los efectos del calor en la materiaДокумент6 страницLos efectos del calor en la materiagustavo Chi Dzul100% (1)
- Tipos de transferencia de calor y sus aplicaciones principalesДокумент6 страницTipos de transferencia de calor y sus aplicaciones principalesBrandon AbundisОценок пока нет
- Los Cambios de EstadoДокумент4 страницыLos Cambios de EstadoLuis David Daza SalasОценок пока нет
- Física TermodinamicaДокумент2 страницыFísica TermodinamicaJavier CujilemaОценок пока нет
- Generalidades de La FisicaДокумент8 страницGeneralidades de La FisicaLalita Duran AlvearОценок пока нет
- Cambios de EstadoДокумент36 страницCambios de Estadogualberto_pillcoОценок пока нет
- Apunte Teórico Sobre - Los Efectos Del Calor en La MateriaДокумент8 страницApunte Teórico Sobre - Los Efectos Del Calor en La MateriaCol Trinidad Camacho PinzónОценок пока нет
- Calorimetría II: Calor latente y cambios de faseДокумент2 страницыCalorimetría II: Calor latente y cambios de faseJose Fernando Lozano PanibraОценок пока нет
- Informe Tema 7 Lab - FisicoquimicaДокумент11 страницInforme Tema 7 Lab - FisicoquimicaDaniel Vargas TrujilloОценок пока нет
- s11.01 Transferencia de CalorДокумент19 страницs11.01 Transferencia de CalorFernando Silva PaucarОценок пока нет
- Calor LatenteДокумент2 страницыCalor LatenteAlvarez IgnacioОценок пока нет
- Calor y TemperaturaДокумент4 страницыCalor y TemperaturaJorge MéndezОценок пока нет
- Lab 8Документ12 страницLab 8Jocfran12Оценок пока нет
- Conclusión TermodinamicaДокумент2 страницыConclusión TermodinamicaDomitila CorreaОценок пока нет
- Calor y TemperaturaДокумент43 страницыCalor y TemperaturaMa LucíaОценок пока нет
- Calor Latente de FusionДокумент12 страницCalor Latente de FusionYAnethОценок пока нет
- Propiedades de los estados de la materiaДокумент8 страницPropiedades de los estados de la materiaYeniffer MarinОценок пока нет
- Examen 20%Документ10 страницExamen 20%Alejandro BritoОценок пока нет
- LECTURA0402Документ20 страницLECTURA0402YENIFER ANAY SANCHEZ DIAZОценок пока нет
- Eventos Termodinámicos ModuloДокумент7 страницEventos Termodinámicos ModuloBimbi CotОценок пока нет
- Taller No 003 Calor y TemperaturaДокумент7 страницTaller No 003 Calor y TemperaturaFreddy Santiago Navarro100% (4)
- Informe 06 (CurvasdeCalenyEnfr)Документ6 страницInforme 06 (CurvasdeCalenyEnfr)Valeria AmpudiaОценок пока нет
- Apa Activ. 1 Transferencia de Calor !Документ12 страницApa Activ. 1 Transferencia de Calor !Ricaardo CastellanossОценок пока нет
- Andrea Lizeth Rivera Arellano: Reporte de InvestigaciónДокумент8 страницAndrea Lizeth Rivera Arellano: Reporte de InvestigaciónAdrián Garcia HinojosaОценок пока нет
- Cambios de Estado de La MateriaДокумент12 страницCambios de Estado de La MateriaanaОценок пока нет
- Informe Laboratorio 6 Quimica Basica Fiis UniДокумент20 страницInforme Laboratorio 6 Quimica Basica Fiis UniAndtimon100% (2)
- Calor Latente, Punto Triple, Transición VitreaДокумент19 страницCalor Latente, Punto Triple, Transición VitreaJocelynОценок пока нет
- Cambios de estado: fusión, vaporización y másДокумент6 страницCambios de estado: fusión, vaporización y másAnonymous 28kKgaePОценок пока нет
- Fisica LabДокумент5 страницFisica LabJohana Vargas BarretoОценок пока нет
- Calor, Dilatación y TermoДокумент29 страницCalor, Dilatación y TermomilifacultadfcmОценок пока нет
- Aprender sobre la energía geotérmica (Finding Out about Geothermal Energy)От EverandAprender sobre la energía geotérmica (Finding Out about Geothermal Energy)Оценок пока нет
- Taller Ley de GaussДокумент2 страницыTaller Ley de GaussGloria Patricia Gelvez Hernandez0% (1)
- Preparación de soluciones químicasДокумент7 страницPreparación de soluciones químicasCristian PuentesОценок пока нет
- Laminado y EstampadoДокумент3 страницыLaminado y EstampadoVittilugaОценок пока нет
- Electrónica de Potencia II (Parte 3)Документ109 страницElectrónica de Potencia II (Parte 3)alexОценок пока нет
- FisicaДокумент8 страницFisicaValeria Masías GómezОценок пока нет
- Trabajo de Mecánica de Fluidos. 2017-I PDFДокумент7 страницTrabajo de Mecánica de Fluidos. 2017-I PDFJoseОценок пока нет
- Características de La Aleación de Níquel-TitanioДокумент6 страницCaracterísticas de La Aleación de Níquel-Titanioj7teranОценок пока нет
- Historia de La QuímicaДокумент3 страницыHistoria de La QuímicamaikandreasОценок пока нет
- Diseño de AliviaderosДокумент11 страницDiseño de AliviaderosKevinBallesterosCirineoОценок пока нет
- Practicas Autocad 2 EsoДокумент7 страницPracticas Autocad 2 Esotutoria2cОценок пока нет
- Test Ciencia MaterialesДокумент8 страницTest Ciencia MaterialesPatrick LopezОценок пока нет
- Guia MEC FLUIDOS. Banco de Pruebas en Carabobo..Документ23 страницыGuia MEC FLUIDOS. Banco de Pruebas en Carabobo..LeinedRazalasОценок пока нет
- Diagramas de Fases en 38Документ14 страницDiagramas de Fases en 38Juan Pablo Velásquez VidalОценок пока нет
- Efecto de La Fuerza Iónica Sobre La Estructura de Las ProteínasДокумент2 страницыEfecto de La Fuerza Iónica Sobre La Estructura de Las ProteínasRakel Vasquez MaytaОценок пока нет
- Guia fisicaFINAL2019Документ54 страницыGuia fisicaFINAL2019Ramiro KantutaОценок пока нет
- Trabajo Encargado de Metodos NumericosДокумент8 страницTrabajo Encargado de Metodos NumericosfernnyОценок пока нет
- Principios de La Técnica NIRSДокумент3 страницыPrincipios de La Técnica NIRSDaniel SaniОценок пока нет
- Tarde - El KankaДокумент4 страницыTarde - El KankaManuel GonzálezОценок пока нет
- Determinacion Simultanea de Co y Ni - Analisis Instrumental UnacДокумент17 страницDeterminacion Simultanea de Co y Ni - Analisis Instrumental UnacJuan Pablo Moran Caballero0% (1)
- Todos Los Relatos Por Orden AlfabéticoДокумент113 страницTodos Los Relatos Por Orden AlfabéticoWilliam MagañaОценок пока нет
- Calibración termómetros guíaДокумент41 страницаCalibración termómetros guíaKarem LastarriaОценок пока нет
- FORMATO Entrega de Tarea Cap 16Документ7 страницFORMATO Entrega de Tarea Cap 16JosueОценок пока нет
- Trayectorias OrtogonalesДокумент9 страницTrayectorias OrtogonalesMafe Velasco100% (1)
- Puente Trasero de La TransmisionДокумент4 страницыPuente Trasero de La TransmisionElvis SaОценок пока нет
- Carbono 14Документ4 страницыCarbono 14LESLIE CedeñoОценок пока нет
- 4º ESO CinematicaДокумент21 страница4º ESO CinematicapachimolОценок пока нет