Академический Документы
Профессиональный Документы
Культура Документы
Trabajo de Enzimas
Загружено:
Marii Cl ToИсходное описание:
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Trabajo de Enzimas
Загружено:
Marii Cl ToАвторское право:
Доступные форматы
1. Introduccin 2. Evolucion de la enzimologia 3. Las enzimas 4. Importancia biomedica de las enzimas 5. Caracteristicas de las enzimas 6. La estructura enzimtica 7.
Naturaleza qumica de las enzimas 8. Composicin qumica de las enzimas 9. Nomenclatura y clasificacion de las enzimas 10.Partes del sistema enzimatico 11. Coenzima y grupos prostticos 12. Activadores 13. Las enzimas son catalizadores estereoespecficos 14. Especificidad enzimtica 15. Preparacin y purificacin de las enzimas 16. Isoenzimas 17. Cinetica de las reacciones enzimaticas 18. Relaciones entre la enzima y el sustrato. 19. Accion de inhibidores. 20. Inhibicion por competencia 21. Inhibicion por no competencia 22. Antagonismo metaboloco (antimetabolitos) 23. Inhibicion alosterica 24. Enzimas: regulacion de actividades 25. Bibliografia 5.1 Funcin de las enzimas Las enzimas son protenas que catalizan todas las reacciones bioqumicas. Adems de su importancia como catalizadores biolgicos, tienen muchos usos mdicos y comerciales. Un catalizador es una sustancia que disminuye la energa de activacin de una reaccin qumica. Al disminuir la energa de activacin, se incrementa la velocidad de la reaccin. La mayora de las reacciones de los sistemas vivos son reversibles, es decir, que en ellas se establece el equilibrio qumico. Por lo tanto, las enzimas aceleran la formacin de equilibrio qumico, pero no afectan las concentraciones finales del equilibrio.
5.2 Clasificacin de las enzimas
5.2.1 Clasificacin de las enzimas de acuerdo a su complejidad De acuerdo a su complejidad las enzimas se clasifican como:
En las protenas conjugadas podemos distinguir dos partes:
Apoenzima: Es la parte polipeptdica de la enzima. Cofactor: Es la parte no proteica de la enzima.
La combinacin de la apoenzima y el cofactor forman la holoenzima. Los cofactores pueden ser: *Iones metlicos: Favorecen la actividad cataltica general de la enzima, si no estn presentes, la enzima no acta. Estos iones metlicos se denominan activadores. Ejemplos: Fe2+, Mg2+, Cu2+, K+, Na+ y Zn2+ *La mayora de los otros cofactores son coenzimas las cuales generalmente son compuestos orgnicos de bajo peso molecular, por ejemplo, las vitaminas del complejo B son coenzimas que se requieren para una respiracin celular adecuada. Regreso al incio de enzimas 5.2.2 Clasificacin de las enzimas segn su actividad.-
Tipo de enzimas Hidrolasas
Isomerasas Ligasas Liasas
Oxidorreductasas
Tansferasas
Actividad Catalizan reacciones de hidrlisis. Rompen las biomolculas con molculas de agua. A este tipo pertenecen las enzimas digestivas. Catalizan las reacciones en las cuales un ismero se transforma en otro, es decir, reacciones de isomerizacin. Catalizan la unin de molculas. Catalizan las reacciones de adicin de enlaces o eliminacin, para producir dobles enlaces. Catalizan reacciones de xido-reduccin. Facilitan la transferencia de electrones de una molcula a otra. Ejemplo; la glucosa, oxidasa cataliza la oxidacin de glucosa a cido glucnico. Catalizan la transferencia de un grupo de una sustancia a otra. Ejemplo: la transmetilasa es una enzima que cataliza la transferencia de un grupo metilo de una molcula a otra.
Regreso al incio de enzimas
5.3 Actividad enzimtica La sustancia sobre la cual acta una enzima se llama sustrato. Los sustratos son especficos para cada enzima: La sacarosa es el sustrato de la sacarasa que acta rompindola en sus componentes. Las enzimas actan de acuerdo con la siguiente secuencia: La enzima (E) y el sustrato (S) se combinan para formar un complejo intermedio enzima sustrato (ES), el cual se descompone formando un producto y regenerando la enzima.
El grado de especificidad de las enzimas es muy alto, pueden distinguir incluso entre diferentes tipos de ismeros. Se cree que la especificidad de la enzima es debido a la forma particular de una pequea parte conocida como sitio activo, la cual se fija a la contraparte complementaria en el sustrato. Regreso al incio de enzimas
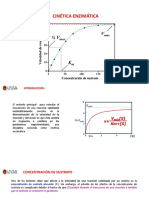
5.4 Factores que afectan la actividad enzimtica.Concentracin del sustrato.- A mayor concentracin del sustrato, a una concentracin fija de la enzima se obtiene la velocidad mxima. Despus de que se alcanza esta velocidad, un aumento en la concentracin del sustrato no tiene efecto en la velocidad de la reaccin. Concentracin de la enzima.- Siempre y cuando haya sustrato disponible, un aumento en la concentracin de la enzima aumenta la velocidad enzimtica hacia cierto lmite.
Temperatura.- Un incremento de 10C duplica la velocidad de reaccin, hasta ciertos lmites. El calor es un factor que desnaturaliza las protenas por lo tanto si la temperatura se eleva demasiada, la enzima pierde su actividad. pH.- El pH ptimo de la actividad enzimtica es 7, excepto las enzimas del estmago cuyo pH ptimo es cido. Presencia de cofactores.- Muchas enzimas dependen de los cofactores, sean activadores o coenzimas para funcionar adecuadamente. Para las enzimas que tienen cofactores, la concentracin del cofactor debe ser igual o mayor que la concentracin de la enzima para obtener una actividad cataltica mxima. Lectura 4.1 Lea el texto titulado "Enzimas de fuerza industrial" y realice un cuadro sinptico que muestre los usos de las enzimas indicados en la lectura. Enve su trabajo al correo electrnico del profesor.
Los enzimas son catalizadores muy potentes y eficaces, qumicamente son protenas Como catalizadores, los enzimas actan en pequea cantidad y se recuperan indefinidamente. No llevan a cabo reacciones que sean energticamente desfavorables, no modifican el sentido de los equilibrios qumicos, sino que aceleran su consecucin. Las enzimas son grandes protenas que aceleran las reacciones qumicas. En su estructura globular, se entrelazan y se pliegan una o ms cadenas polipeptdicas, que aportan un pequeo grupo de aminocidos para formar el sitio activo, o lugar donde se adhiere el sustrato, y donde se realiza la reaccin. Una enzima y un sustrato no llegan a adherirse si sus formas no encajan con exactitud. 2. Accin De Enzimas La accin enzimtica se caracteriza por la formacin de un complejo que representa el estado de transicin. El sustrato se une al enzima a travs de numerosas interacciones dbiles como son: puentes de hidrgeno, electrostticas, hidrfobas, etc, en un lugar especfico , el centro activo. Este centro es una pequea porcin del enzima, constituido por una serie de aminocidos que interaccionan con el sustrato.
Con su accin, regulan la velocidad de muchas reacciones qumicas implicadas en este proceso. El nombre de enzima, que fue propuesto en 1867 por el fisilogo alemn Wilhelm Khne (1837-1900), deriva de la frase griega en zyme, que significa 'en fermento'. En la actualidad los tipos de enzimas identificados son ms de 2.000. 3. Clasificacin de las enzimas 1. xido-reductasas ( Reacciones de oxido-reduccisn). 2. Transferasas (Transferencia de grupos funcionales) 3. Hidrolasas (Reacciones de hidrlisis) 4. Liasas (Adicisn a los dobles enlaces) 5. Isomerasas (Reacciones de isomerizacisn) 6. Ligasas (Formacisn de enlaces, con aporte de ATP) 1.Oxido-reductasas: Son las enzimas relacionadas con las oxidaciones y las reducciones biolgicas que intervienen de modo fundamental en los procesos de respiracin y fermentacin. Las oxidoreductasas son importantes a nivel de algunas cadenas metablicas, como la escisin enzimtica de la glucosa, fabricando tambin el ATP, verdadero almacn de energa. Extrayendo dos tomos de hidrgeno, catalizan las oxidaciones de muchas molculas orgnicas presentes en el protoplasma; los tomos de hidrgeno tomados del sustrato son cedidos a algn captor. En esta clase se encuentran las siguientes subclases principales: Deshidrogenasas y oxidasas. Son ms de un centenar de enzimas en cuyos sistemas actan como donadores, alcoholes, oxcidos aldehidos, cetonas, aminocidos, DPNH2, TPNH2, y muchos otros compuestos y, como receptores, las propias coenzimas DPN y TPN, citocromos, O2, etc. 2.Las Transferasas: Estas enzimas catalizan la transferencia de una parte de la molcula (dadora) a otra (aceptora). Su clasificacin se basa en la naturaleza qumica del sustrato atacado y en la del aceptor. Tambin este grupo de enzimas actan sobre los sustratos mas diversos, transfiriendo grupos metilo, aldehdo, glucosilo, amina, sulfat, sulfrico, etc. 3.Las Hidrolasas: Esta clase de enzimas actan normalmente sobre las grandes molculas del protoplasma, como son la de glicgeno, las grasas y las protenas. La accin cataltica se expresa en la escisin de los enlaces entre tomos de carbono y nitrgeno (C-Ni) o carbono oxigeno (C-O); Simultneamente se obtiene la hidrlisis (reaccin de un compuesto con el agua)de una molcula de agua. El hidrgeno y el oxidrilo resultantes de la hidrlisis se unen respectivamente a las dos molculas obtenidas por la ruptura de los mencionados enlaces. La clasificacin de estas enzimas se realiza en funcin del tipo de enlace qumico sobre el que actan.
A este grupo pertenecen protenas muy conocidas: la pepsina, presente en el jugo gstrico, y la tripsina y la quimiotripsina, segregada por el pncreas. Desempean un papel esencial en los procesos digestivos, puesto que hidrolizan enlaces ppticos, estricos y glucosdicos. 4.Las isomerasas: Transforman ciertas sustancias en otras ismeras, es decir, de idntica formula emprica pero con distinto desarrollo. Son las enzimas que catalizan diversos tipos de isomerizacin, sea ptica, geomtrica, funcional, de posicin, etc. Se dividen en varias subclases. Las racemasas y las epimerasas actan en la racemizacin de los aminocidos y en la epimerizacin de los azcares. Las primeras son en realidad pares de enzimas especficas para los dos ismeros y que producen un solo producto comn. Las isomerasas cis trans modifican la configuracin geomtrica a nivel de un doble ligadura. Los xidos reductasas intramoleculares catalizan la interconversin de aldosas y cetosas, oxidando un grupo CHOH y reduciendo al mismo tiempo al C = O vecino, como en el caso de la triosa fosfato isomerasa, presente en el proceso de la gluclisis; en otros casos cambian de lugar dobles ligaduras, como en la (tabla) isopentenil fosfato isomerasa, indispensable en el cambio biosintico del escualeno y el colesterol. Por fin las transferasas intramoleculares (o mutasas) pueden facilitar el traspaso de grupos acilo, o fosforilo de una parte a otra de la molcula, como la lisolecitina acil mutasa que transforma la 2 lisolecitina en 3 lisolecitina, etc. Algunas isomerasa actan realizando inversiones muy complejas, como transformar compuestos aldehdos en compuestos cetona, o viceversa. Estas ultimas desarrollan una oxidorreduccin dentro de la propia molcula (oxido reductasa intramoleculares)sobre la que actan, quitando hidrgeno, a algunos grupos y reduciendo otros; actan ampliamente sobre los aminocidos, los hidroxcidos, hidratos de carbono y sus derivados. 5.Las Liasas: Estas enzimas escinden (raramente construyen) enlaces entre tomos de carbono, o bien entre carbono y oxigeno, carbono y nitrgeno, y carbono y azufre. Los grupos separados de las molculas que de sustrato son casi el agua, el anhdrido carbnico, y el amoniaco. Algunas liasa actan sobre compuestos orgnicos fosforados muy txicos, escindindolos; otros separan el carbono de numerosos sustratos. 6.Las Ligasas: Es un grupo de enzimas que permite la unin de dos molculas, lo cual sucede simultneamente a la degradacin del ATP, que, en rigor, libera la energa necesaria para llevar a cabo la unin de las
primeras. Se trata de un grupo de enzimas muy importantes y recin conocidas, pues antes se pensaba que este efecto se llevaba a cabo por la accin conjunta de dos enzimas, una fosfocinasa, para fosforilar a una sustancia A (A + ATP A - + ADP) y una transferasa que pasara y unira esa sustancia A, con otra, B (A - + B A B + Pi ). A este grupo pertenecen enzimas de gran relevancia reciente, como las aminocido ARNt ligasas conocidas habitualmente con el nombre de sintetasas de aminocidos ARNt o enzimas activadoras de aminocidos que representan el primer paso en el proceso biosinttico de las protenas, y que forman uniones CO; las cido-tiol ligasas, un ejemplo tpico de las cuales es la acetil coenzima. A sintetasa, que forma acetil coenzima. A partir de cido actico y coenzima A ; las ligasas cido amoniaco (glutamina sintetasa), y las ligasas cido-aminocido o sintetasas de pptidos, algunos de cuyos ejemplos ms conocidos son la glutacin sintetasa, la carnosina sintetasa, etc. 4. Importancia del ATP (Trifosfato de adenosina) Es importante ya que es la principal fuente de energa de los seres vivos y se alimenta de casi todas las actividades celulares, entre ellas el movimiento muscular, la sntesis de protenas, la divisin celular y la transmisin de seales nerviosas. Esta molcula se encuentra en todos los seres vivos y constituye la fuente principal de energa utilizable por las clulas para realizar sus actividades. Se origina por el metabolismo de los alimentos en unos orgnulos especiales de la clula llamados mitocondrias. Composicin Del ATP El ATP se comporta como una coenzima, ya que su funcin de intercambio de energa y la funcin cataltica (trabajo de estimulacin) de las enzimas estn ntimamente relacionadas. La parte adenosina de la molcula est constituida por adenina, un compuesto que contiene nitrgeno (tambin uno de los componentes principales de los genes) y ribosa, un azcar de cinco carbonos. Cada unidad de los tres fosfatos (trifosfato) que tiene la molcula, est formada por un tomo de fsforo y cuatro de oxgeno y el conjunto est unido a la ribosa a travs de uno de estos ltimos. Los dos puentes entre los grupos fosfato son uniones de alta energa, es decir, son relativamente dbiles y cuando las enzimas los rompen ceden su energa con facilidad. Con la liberacin del grupo fosfato del final se obtiene siete kilocaloras (o caloras en el lenguaje comn) de energa
disponible para el trabajo y la molcula de ATP se convierte en ADP (difosfato de adenosina). La mayora de las reacciones celulares que consumen energa estn potenciadas por la conversin de ATP a ADP, incluso la transmisin de las seales nerviosas, el movimiento de los msculos, la sntesis de protenas y la divisin de la clula. Por lo general, el ADP recupera con rapidez la tercera unidad de fosfato a travs de la reaccin del citocromo, una protena que se sintetiza utilizando la energa aportada por los alimentos. En las clulas del msculo y del cerebro de los vertebrados, el exceso de ATP puede unirse a la creatina, proporcionando un depsito de energa de reserva.
5. Funciones de las enzimas En su estructura globular, se entrelazan y se pliegan una o ms cadenas polipeptdicas, que aportan un pequeo grupo de aminocidos para formar el sitio activo, o lugar donde se adhiere el sustrato, y donde se realiza la reaccin. Una enzima y un sustrato no llegan a adherirse si sus formas no encajan con exactitud. Este hecho asegura que la enzima no participa en reacciones equivocadas. La enzima misma no se ve afectada por la reaccin. Cuando los productos se liberan, la enzima vuelve a unirse con un nuevo sustrato. INTRODUCCIN Todas las reacciones metablicas que ocurren en nuestro organismo se hayan mediados por enzimas, estas en su mayora son de naturaleza proteica (algunas como la ribozima son formadas por RNA). Puede definirse a las enzimas (ez) como catalizadores, capaces de acelerar las reacciones qumicas en ambos sentidos, sin consumirse en ella, ni formar
parte de los productos. La diferencia fundamental es que tienen gran especificidad de reaccin o sea por el sustrato sobre el cual actan. Un catalizador es una sustancia que disminuye la energa de activacin de una reaccin qumica. Al disminuir la energa de activacin, se incrementa la velocidad de la reaccin qumica y que no se altera de forma permanente por la reaccin. 3. Las enzimas Cada clula y cada tejido tienen su actividad propia, lo que comporta continuos cambios en su estado bioqumico, en la base de la cual estn las enzimas, que tienen el poder de catalizar, facilitar, y agilizar determinados procesos sintticos y analticos. Los propios genes son reguladores de la produccin de las enzimas; por tanto, genes y enzimas pueden considerados como las unidades fundamentales de la vida. Las enzimas, como catalizadores que son, no modifican la constante de equilibrio y tampoco se transforman, recuperndose intactas al final del proceso. La rapidez de actuacin de las enzimas y el hecho de que se recuperen intactas para poder actuar de nuevo es la razn de que se necesiten en pequesimas cantidades. Distribucin de las enzimas en los espacios extra e intracelular En la clula las ez pueden encontrarse en el lquido celular (citosol) o bien pueden estar fijadas a determinadas organelas (ej. Adheridas a las mitocondrias). Hay enzimas 100 % citoplasmticas es decir que se encuentran solamente en el citosol, a estas se las llama uniloculadas. Por ejemplo GPT (glutmico-pirvico transaminasa) LDH (lctico deshidrogenasa). Otras enzimas estn en un cierto porcentaje en las organelas y otro porcentaje en el citoplasma, es decir que son biloculadas, como la GOT (glutmico-pirvico transaminasa) que est 60% en el citoplasma y 40% en mitocondria, MDH (malato deshidrogenasa) 50 % en citoplasma y 50% en mitocondria. En las clulas somticas normales, las actividades catalticas de las numerosas enzimas se mantienen muy constantes, ya que existe un equilibrio entre la sntesis y la degradacin enzimtica, pero constantemente llegan al espacio extracelular pequesimas cantidades de muchas enzimas intracelulares. En muchas enfermedades orgnicas est aumentada la salida de enzimas desde el interior celular, esto puede deberse por un aumento de la permeabilidad de las membranas
celulares, o bien por disolucin de la estructura celular. De esta manera se originan modificaciones del nivel enzimtico en el plasma sanguneo, de indudable valor que ayudan a realizar un diagnstico
5. Caracteristicas de las enzimas Desde el punto de vista qumico, las enzimas estn formadas de carbono (C), Hidrgeno (H), oxigeno (O), Nitrgeno (Ni), y Azufre (S) combinados, pero siempre con peso molecular bastante elevado y comn propiedades catlicas especificas. Su importancia es tal que puede considerarse la vida como un "orden sistemtico de enzimas funcionales". Cuando este orden y su sistema funcional son alterados de algn modo, cada organismo sufre mas o menos gravemente y el trastorno puede ser motivado tanto por la falta de accin como por un exceso de actividad de enzima.
Las enzimas son catalizadores de naturaleza protenica que regulan la velocidad a la cual se realizan los procesos fisiologicos, producidos por los organismos vivos. En consecuencia, las deficiencias en la funcion enzimatica causan patologias. Las enzimas, en los sistemas biolgicos constituyen las bases de las complejas y variadas reacciones que caracterizan los fenmenos vitales. La fijacin de la energa solar y la sntesis de sustancias alimenticias llevadas a cabo por los vegetales dependen de las enzimas presentes en las plantas. Los animales, a su vez, estn dotados de las enzimas que les permiten aprovechar los alimentos con fines energticos o estructurales; las funciones del metabolismo interno y de la vida de relacin, como la locomocin, la excitabilidad, la irritabilidad, la divisin celular, la reproduccin, etc. Estn regidas por la actividad de innumerables enzimas responsables de que las reacciones se lleven a cabo en condiciones favorables para el individuo, sin liberaciones bruscas de energa a temperaturas fijas en un medio de pH, concentracin salina, etc.; prcticamente constante. A diferencia de un catalizador inorgnico que interviene en numerosas reacciones las enzimas producidas por los organismos vivos habitualmente solo catalizan un tipo de reaccin o solo una reaccin determinada; la especificidad de las enzimas es tan marcadas que en general actan exclusivamente sobre sustancias que tienen una configuracin precisa; por ejemplo, si solo atacan a los aminocidos que tienen su carbono a , asimtrico, con estructura L-, no muestran la menor actividad sobre formas idnticas de dichos aminocidos, pero que sean del tipo D-. En los sistemas biolgicos se llevan a cabo diversas reacciones a partir de la misma sustancia; por ejemplo algunos microorganismos convierten la glucosa en alcohol y bixido de carbono, al paso que otros grmenes la convierten en cido lctico o cido pirvico o acetaldehido. Esto quiere decir que la glucosa puede descomponerse en distintos productos y aunque todas las posibilidades son tericas y prcticamente posibles la presencia de ciertas enzimas favorece uno de los caminos que llevan a la acumulacin de determinados compuestos. Las enzimas, por lo tanto, se consideran como catalizadores altamente especficos que:
Modifican la velocidad de los cambios promovidos por ellas.
Determinan que sustancias particulares, de preferencia a otras distintas son las que van a sufrir los cambios. Impulsan dentro de los distintos cambios posibles que pueda seguir una sustancia, cual de ellos en especial, ser el utilizado.
Las enzimas representan las sustancias encargadas de graduar la velocidad de una reaccin determinada en el interior de las clulas; como en las diversas clulas se realizan infinidad de reacciones, ya que en una de ellas se encuentran varios miles de sustancias, se deduce, tambin, la presencia de varios miles de enzimas. Es posible, por lo tanto, que la mayor parte de esta estructura protenica celular est formada por enzimas, encargadas de las diversas funciones de sntesis, degradacin, oxidacin, etc. caractersticas de la actividad vital de los distintos organismos. 6. La estructura enzimtica Por su estructura y composicin qumica puede afirmarse que el origen de las enzimas esta vinculando al origen de las sustancias proteicas. Al hablar del origen de la vida se ha citado el xito de los experimentos realizados en el laboratorio para la produccin de aminocidos; estos aminocidos son los que precisamente constituyen la base del edificio proteico. Tambin en el laboratorio se ha intentado la sntesis de protenas a partir de aminocidos. La sede de las enzimas es el citoplasma. Los cloroplastos vegetales contienen una amplia gama enzimas encargadas de la funcin cloroflica, proceso que a travs de reacciones qumicas complejas y encadenadas transforman compuestos inorgnicos, como el agua, y el anhdrido carbnico, en sustancias complejas adecuadas para ser entre otras cosas el alimento fundamental de los animales. En las mitocondrias existe un sistema de transporte de electrones que determinan importantes fenmenos de oxidorreduccin, durante los cuales se forman notables cantidades de ATP, que es un compuesto altamente energtico del que depende la mayor parte de metabolismo, y coma, por tanto el trabajo de las clulas; en las mitocondrias se produce el metabolismo enzimtico de los cidos grasos, los cuales son en parte elaborados tambin en el citoplasma. En los ribosomas tiene lugar concretamente todas la s sntesis de las sustancias proteicas, mientras que en los lisosomas se producen enzimas hidrolticos cuya misin escindir, con la intervencin del agua, molculas
grandes en otras menores, que pueden a su vez ser utilizadas por las clulas; en cambio, las enzimas glucolticos estn difundidos en el citoplasma. La localizacin de las sedes de las distintas operaciones enzimticas antes mencionadas ha sido posible a travs del sistema de ruptura de las clulas y de la separacin de los distintos componentes mediante centrifugacin diferencial del homogeneizado de estas la ruptura celular y la subdivisin de los componentes subcelulares se realizan actualmente utilizando los tejidos, por ejemplo con saltos bruscos desde temperaturas inferiores a 0 C hasta temperaturas mas elevadas con cambios de presin osmtica o mediante ultrasonidos. 7. Naturaleza qumica de las enzimas Existen numerosas razones para afirmar que las enzimas son proteinas. La ms importantes son las siguientes: a. El anlisis de las enzimas obtenidas en forma ms pura, criatalizada, demuestra que son protenas. b. Las enzimas son inactivadas a altas temperaturas y, en geeral, la cintica de la desnaturalizacin trmica de las enzimas da resultados muy parecidos a los de la desnaturalizacin trmica de las protenas; por ejemplo el Q10 de la mayora de las reacciones qumicas es de 2 a 3, y, en el casod e las enzimas, a temperaturas elevadas, alrededor de 60 a 70 C, la actividad neta aumeta varios cientos, como sucede con la velocidad de la desnaturalizacin trmica de las protenas. c. Las enzimas son activadas en unas zona muy restringida de pH, y presenta un punto ptimo de ph donde su actividad es mayor. Las protenas en su punto isoelctrico, muestran propiedades parecidas desde el punto de vista de viscosidad, solubilidad, difucin, etc., que resulta del todo similares a las propiedades de este tipo que muestran las enzimas. d. Todos los agentes que desnaturalizan a las protenas tambin destruyen o inactivan a las enzimas, ya sea el calor, los cidos fuertes, o los metales pesados que puedesn combinarse con ellas. e. Los problemas de solubilidad y de precipitacin son comunes a las protenas y las enzimas; en general, son solubles en agua o
soluciones salinas, insolubles en alcohol, precipitan determinadas concentraciones de sales neutras, etc. 8. Composicin qumica de las enzimas
con
Los conocimientos sobre la composicin qumica de las enzimas constituyeron materia de numerosas controversias hasta 1926, cuando J.B Sumner (1887-1955) consigui cristalizar la ureasa, enzima que transforma la urea en anhdrido carbonico y amoniaco, y demostrar que era una sustancia proteica. A, partir de entonces fueron aisladas otras enzimas en forma pura, cristalina, y el anlisis demostraba siempre la presencia de una proteina, simple o conjugada. Cuando los analisi qumicos demuestran que la enzima es una protena conjugada, pueden distinguirse en el dos partes bien diferenciadas:
El grupo prosteico (Coenzima) La proteina (Apoenzima)
En algunas enzimas oxidantes fue observada la presencia de la promoporteinas, en las cuales el grupo prosptico esta representado por un compuesto que contiene Fe y otro elemento, el cual desmpea un papel importante en la combinacin de la proteina con el sustrato; otras veces este grupo prosttico es derivada de vitaminas (como la vitamina B); 4en muchos casos resulta facil de separar de la molcula proteica. No obstante una vez separadas, las dos unidades no muestran actividad enzimtico; por tanto el grupo proteico (coenzima) y el grupo proteico (apoenzima) han de estar ntimamente ligados entre si para ser operativos. Por consiguiente, de las enzimas pueden distinguirse los formados por:
Solo protenas, que difieren entre si por la secuencia con que los aminocidos estn combinados, como la ureasa y las enzimas digestivas (la pepsina y la tripsina) Los conjugados, separados en dos entidades qumicas bien definidas: la coenzima y la apoenzima.
Despus del descubrimiento de Sumner, el numero de la enzimas y el estudio de sus actividades qumicas proporcionaron un notable impulso en la enzimologa, y la gran cantidad de las enzimas que rpidamente se acumulaban determinaron la necesidad de utilizar una clasificacin o
nomenclatura para evitar errores y facilitar la comprensin de futuros investigadores. 9. Nomenclatura y clasificacion de las enzimas Cien aos atrs solo se conocian enzimas, muchas de estas, catalizaban la hidrlisis de enlaces covalentes. Algunas enzimas, de manera especial las que fueron descubiertas en un principio, recibieron nombres ligados mas bien a su sitio de procedencia anatmica que no siguen ninguna regla ni sistema; tal es el caso de la ptialina de la saliva, que ataca al almidn de la pepsina del estmago y de la tripsina del pncreas, que atacan protenas; de la renina, que cuagula la leche; de la papaina, enzima proteoltica que se encuentra en la papaya y de las catepsinas, tambin proteasas, que se encuentran en las clulas. Las enzimas relacionadas con la cuagulacin de la sangre, como son la trombina, la plasmina, el plasmingeno, etc. reciben tambin nombres sistematizados. Al descrubir nuevas enzimas y proceder a su caracterizacin estricta se aplicaron reglas de nomenclatura basadas en el nombre del sustrato atacado, o en el tipo general de sustrato, o en la reaccin catalizada y se ha aadido convencionalmente, la terminacin -asa. Por ejemplo: las lipasas (hidrolizan lipidos o grasas), las amilasas (hidrolizan almidon), las proteasas (hidrolizan proteinas), las esterasas (basado en la unin general de tipo ster presentes en muchas sustancias), colesterol estrerasa (si la esterasa es especfica de los esteres de colesterol) y acetilcolina esterasa (si la estersa de la acetilcolina). Otros ejemplos: Las fosfatasas son enzimas que atacan las uniones ster, pero en este caso, toman su nombre del grupo vecino a la unin que van a atacar, de manera que se denominan fosfatasas (cuando quitan una molcula de monofosfato), pirofosfatasas (cuando quitan el cido fosfrico como esteres dobles (pirofosfatos), o triples, etc.) De la misma manera, las carbohidrasas se denominan as genericamente, pero pueden comprender enzimas con nombres proveniente del sustrato particular sobre el que actuan como la amilasa que ataca al almidn y la celulasa que acta sobre la celulosa y, en otras ocaciones, se denominan de acuerdo con la unin atacada, como la b glucosidasa que acta sobre las uniones b -glucosdicas. Los ejemplos se pueden extender a todos los terrenos de la actividad enzimtica, como en las enzimas proteolticas, las fosforilasas, las nucleasas, etc. Esta manera de llamarlas, se demostro que era inadecuada porque al descubrirse varias enzimas, notaron que varias enzimas catalizaban
reacciones diferentes del mismo sustrato, por ejemplo, oxidacion o reduccion de la funcion alcohol de un azucar. Aunque el sufijo asa continua en uso; actualmente, al nombrar a las enzimas, se enfatiza el tipo de reaccion catalizada. Por ejemplo: las hidrogenasas catalizan la eliminacion de hidrogeno y las transferasas, reacciones de transferencia de grupo. Con el descubrimiento de mas y mas enzimas, surgieron ambiguedades y con frecuencia no estaba claro cual era la enzima que un investigador deseaba estudiar. Para remediar esta deficiencia, la Comisin para el estudio de las enzimas, que constituye con respecto a los sistemas anteriores un punto de vista ms uniforme, preciso y descriptivo; esta formada por la Union Internacional de Bioquimica (IUB) adopto, en 1964, un sistema complejo pero inequivoco de la nomenglatura enzimatica basado en el mecanismo de reaccion. El sistema se basa en la reaccin qumica catalizada que es la propiedad especfica que caracteriza a cada enzima las cuales se agrupan en clases, porque catalizan procesos semejantes, y en subclases que especifican con mayor exactitud la reaccin particular considerada. En general, las enzimas reciben un nombre de acuerdo con el sustrato o los sustratos que participan en la reaccin seguido por el tipo de reaccin catalizada y, por fin, la terminacin -asa. A menudo los nombres as obtenidos resultan largos y complejos, por lo que es muy dificil que en la prctica se pueda excluir el uso de los nombres triviales, consagrados por la costumbre. Sin embargo, con fines de sistematizacin, se reconoce la necesidad de aceptar el nuevo sistema. Aunque su claridad y carencia de ambigedad recomiendan al sistema de nomenglatura IUB para trabajos de investigacion, nombres mas ambiguos, pero basante mas cortos persisten en libros de texto y en el laboratorio clinico. Por esta razon, a continuacion solo se presenta principios generales del sistema IUB: 1. Las reacciones y las enzimas que las catalizan se dividen en 6 clases principales, cada una con 4 a 13 subclases. 2. El nombre de la enzima tiene 2 partes: la primera es el nombre del o los sustratos; la segunda, con terminacion asa, indica el tipo de reaccion catalizada. 3. Informacion adicional, si es necesario aclarar la reaccion, puede seguir el parentesis. Por ejemplo: la enzima que cataliza L-malato +
NAD= = piruvato + CO2 NADH + H= , se denomina como 1.1.1.37 Lmalato:NAD+ oxidorreductasa (descarboxilante). 4. Cada enzima tiene un numero clave (E.C.) que caracteriza al tipo de reaccion segn la clase (primer digito), subclase (segundo digito) y subclase (tercer digito). El cuarto digito es para la enzima especifica. Asi, E.C. 2.7.1.1 denota la clase 2 (una transferasa), subclase 7 (transferencia de fosfato), sub-clase 1 (una funcion alcohol como aceptor de fosfato). El ultimo digito denota a la enzima hexocinasa o ATP: D-hexosa-6-fosforotransferasa, enzima que cataliza la transferencia de fosfato desde el ATP al grupo hidroxilo de carbono 6 de la glucosa. Al final de sus y trabajos, clasifico las enzimas en seis grupos principales, correspondientes por sus trminos a las raciones que cada enzima ejerce sobre el sustrato. Estos grupos se subdividen en otro, segn el tipo de sustrato y los tomos concretos que son sensibles a sus acciones. Estos seis grupos son los siguientes: 1. 2. 3. 4. 5. Oxidoreductasas Transferasas Hidrolasas Isomerasa Liasas
1.Oxido-reductasas: Son las enzimas relacionadas con las oxidaciones y las reducciones biolgicas que intervienen de modo fundamental en los procesos de respiracin y fermentacin. Las oxidoreductasas son importantes a nivel de algunas cadenas metablicas, como la escisin enzimtica de la glucosa, fabricando tambin el ATP, verdadero almacn de energa. Extrayendo dos tomos de hidrgeno, catalizan las oxidaciones de muchas molculas orgnicas presentes en el protoplasma; los tomos de hidrgeno tomados del sustrato son cedidos a algn captor. En esta clase se encuentran las siguientes subclases principales: Deshidrogenasas y oxidasas. Son ms de un centenar de enzimas en cuyos sistemas actan como donadores, alcoholes, oxcidos aldehidos, cetonas, aminocidos, DPNH2, TPNH2, y muchos otros compuestos y, como receptores, las propias coenzimas DPN y TPN, citocromos, O2, etc. 2.Las Transferasas: Estas enzimas catalizan la transferencia de una parte de la molcula (dadora) a otra (aceptora). Su clasificacin se basa en la
naturaleza qumica del sustrato atacado y en la del aceptor. Tambin este grupo de enzimas actan sobre los sustratos mas diversos, transfiriendo grupos metilo, aldehdo, glucosilo, amina, sulfat, sulfrico, etc. 3.Las Hidrolasas: Esta clase de enzimas actan normalmente sobre las grandes molculas del protoplasma, como son la de glicgeno, las grasas y las protenas. La accin cataltica se expresa en la escisin de los enlaces entre tomos de carbono y nitrgeno (C-Ni) o carbono oxigeno (C-O); Simultneamente se obtiene la hidrlisis (reaccin de un compuesto con el agua)de una molcula de agua. El hidrgeno y el oxidrilo resultantes de la hidrlisis se unen respectivamente a las dos molculas obtenidas por la ruptura de los mencionados enlaces. La clasificacin de estas enzimas se realiza en funcin del tipo de enlace qumico sobre el que actan. A este grupo pertenecen protenas muy conocidas: la pepsina, presente en el jugo gstrico, y la tripsina y la quimiotripsina, segregada por el pncreas. Desempean un papel esencial en los procesos digestivos, puesto que hidrolizan enlaces ppticos, estricos y glucosdicos. 4.Las isomerasas:Transforman ciertas sustancias en otras ismeras, es decir, de idntica formula emprica pero con distinto desarrollo. Son las enzimas que catalizan diversos tipos de isomerizacin, sea ptica, geomtrica, funcional, de posicin, etc. Se dividen en varias subclases. Las racemasas y las epimerasas actan en la racemizacin de los aminocidos y en la epimerizacin de los azcares. Las primeras son en realidad pares de enzimas especficas para los dos ismeros y que producen un solo producto comn. Las isomerasas cis trans modifican la configuracin geomtrica a nivel de un doble ligadura. Las xido reductasas intramoleculares cetalizan la interconversin de aldosas y cetosas, oxidando un grupo CHOH y reduciendo al mismo tiempo al C = O vecino, como en el caso de la triosa fosfato isomerasa, presente en el proceso de la gluclisis ; en otros casos cambian de lugar dobles ligaduras, como en la (tabla) isopentenil fosfato isomerasa, indispensable en el cambio biosintico del escualeno y el colesterol. Por fin las transferasas intramoleculares (o mutasas) pueden facilitar el traspaso de grupos acilo, o fosforilo de una parte a otra de la molcula, como la lisolecitina acil mutasa que transforma la 2 lisolecitina en 3 lisolecitina, etc. Algunas isomerasa actan realizando inversiones muy complejas, como transformar compuestos aldehdos en compuestos cetona, o viceversa. Estas ultimas desarrollan una oxidorreduccin dentro de la propia
molcula (oxido rreductasa intramoleculares)sobre la que actan, quitando hidrgeno, a algunos grupos y reduciendo otros; actan ampliamente sobre los aminocidos, los hidroxcidos, hidratos de carbono y sus derivados. 5.Las Liasas: Estas enzimas escinden (raramente construyen) enlaces entre tomos de carbono, o bien entre carbono y oxigeno, carbono y nitrgeno, y carbono y azufre. Los grupos separados de las molculas que de sustrato son casi el agua, el anhdrido carbnico, y el amoniaco. Algunas liasa actan sobre compuestos orgnicos fosforados muy txicos, escindindolos; otros separan el carbono de numerosos sustratos. 6.Las Ligasas: Es un grupo de enzimas que permite la unin de dos molculas, lo cual sucede simultneamente a la degradacin del ATP, que, en rigor, libera la energa necesaria para llevar a cabo la unin de las primeras. Se trata de un grupo de enzimas muy importantes y recin conocidas, pues antes se pensaba que este efecto se llevaba a cabo por la accin conjunta de dos enzimas, una fosfocinasa, para fosforilar a una sustancia A (A + ATP A - + ADP) y una transferasa que pasara y unira esa sustancia A, con otra, B (A - + B A B + Pi ). A este grupo pertenecen enzimas de gran relevancia reciente, como las aminocido ARNt ligasas conocidas habitualmente con el nombre de sintetasas de aminocidos ARNt o enzimas activadoras de aminocidos que representan el primer paso en el proceso biosinttico de las protenas, y que forman uniones CO; las cido-tiol ligasas, un ejemplo tpico de las cuales es la acetil coenzima. A sintetasa, que forma acetil coenzima. A partir de cido actico y coenzima A ; las ligasas cido amoniaco (glutamina sintetasa), y las ligasas cido-aminocido o sintetasas de pptidos, algunos de cuyos ejemplos ms conocidos son la glutacin sintetasa, la carnosina sintetasa, etc. La accin de estas enzimas se manifiesta con la formacin de enlaces entre tomos de carbono y oxigeno de diversas molculas, o bien entre carbono y azufre, carbono y nitrgeno y carbono y carbono. Las ligasas utilizan siempre, para el proceso de reaccin, la energa proporcionada por el ATP o compuestos homlogos que son degradados, Por consiguiente las enzimas de esta clase son los nicos que intervienen en reaccin no espontnea desde un punto de vista termodinmico; Actan sobre los sustratos ms diversos y revisten particular importancia en el metabolismo de los cidos nucleicos.
Estas reacciones enzimticas se desarrollan en dos tiempos: en el primero se forma un complejo intermedio con potencia energtica muy alta-, en el segundo utilizan la energa obtenida para realizar la reaccin de sntesis. Grupo 1. Oxidoreductasas Accion ejemplos
Catalizan reacciones de Dehidrogenasas oxidorreduccin. Tras la accin catlica quedan modificados en su Aminooxidasa grado de oxidacin por lo que debe ser transformados antes de Deaminasas volver a actuar de nuevo. Catalasas
2. Transferasas
Transfieren grupos activos Transaldolasas (obtenidos de la ruptura de ciertas molculas)a otras Transcetolasas sustancias receptoras. Suelen actuar en procesos de Transaminasas interconversiones de azucares, de aminocidos, etc Verifican reacciones de hidrlisis Glucosidasas con la consiguiente obtencin de monmeros a partir de polmeros. Lipasas Suele ser de tipo digestivo, por lo que normalmente actan en Peptidasas primer lugar Esterasas Fosfatasas
3. Hidrolasas
4. Isomerasas
Actan sobre determinadas Isomerasas molculas obteniendo de ellas sus azcar ismeros de funcin o de posicin. Suelen actuar en Epimerasas procesos de interconversion Mutasas Realizan la degradacin o sntesis Aldolasas (entonces se llaman sintetasas) de los enlaces denominados fuertes Decarboxilasas sin ir acoplados a sustancias de alto valor energtico.
de
5. Liasas
6. Ligasas
Realizan la degradacin o sntesis Carboxilasas de los enlaces fuertes mediante el acoplamiento a sustancias ricas Peptidosintetasas en energa como los nucleosidos del ATP
10.Partes del sistema enzimatico Los sistemas enzimticos en general, estn formados por la enzima propiamente dicha (apoenzima), el sustrato o los sustratos un grupo proteico ( o coenzimas) y sustancias activadoras. La estructura formada por la apoenzima y la coenzima se denomina boloenzima; con cierta frecuencia se reconocen sistemas enzimaticos que no tienen grupo prosttico o activadores reconocidos. Apoenzima: concepto del centro activo La apoenzima es la enzima propiamente dicha, de naturaleza proteica formada por cadenas de polipptidos, con peso molculas elevado, no dializable y termolbil. Las estudiadas analticamente hasta ahora, han sido, por razones tcnicas de peso molecular bajo, 12 a 24 000, tienen una sola cadena polipeptdica (ribonucleasa, papaina, tripsina, pepcina, etc.) excepto uno o dos casos (a - quimotripsina y aldolasa) que tienen dos. El anlisis de los aminocidos que componen a diversas enzimas demuestran que tienen una estructura similar a la de cualquier protena; existen, de hecho unos cuantos casos en los que se ha determinado su secuencia completa, es decir, el orden en el que estn dispuestos todos ellos en la cadena. El anlisis de la estructura secundaria de la protena, osea el modo como la cadena peptdoica se dispone a lo largo de su eje mayor y el de la estructura terciaria, osea la forma en que la cadena se pliega y se acomoda para formar una estructura tridimensional se conocen muy mal para todas las enzimas. Solo en el caso de la lisozima (enzima presente en las lgrimas donde funciona como un antisptico suave y que tiene la capacidad de atacar a los polisacridos que forman la pared de diversas bactrias) se ha determinado la estructura tridimensional de una enzima; para este fin se aplican las tcnicas de cristalografa de rayos x, con una solucin de dos , lo que demostr que la lisosima es una protena con su cadena de 129 aminocidos
ampliamente plegada y en la que se reconoce una hendidura representante del centro activo donde se acomodan muy bien los inhibidores ciertos compuestos del tipo de carbohidratos que nulifican su actividad enzimtica. Se ha demostrado, en este caso, que es cierta regla general de que el modo como se ordenan y disponen los aminocidos de termoina el arreglo espacial que permite a las otras partes del sistema enzimtico sustratos, cofactores, iones, etc. adaptarse, en el espacio, en forma adecuada, para que se lleve a cabo la accin cataltica. Por lo tanto, las estructuras indispensables que permiten la combinacin con el sustrato y que confieren propiedades enzimticas a la molcula se denomina "centro activo". Se acepta que el centro activo no es una parte muy grande de la enzima completa y, en ciertos sistemas estudiados por medio de bloqueos qumicos no parece constituir una zona de ms de 20 de dimetro. Es muy posible que el centro activo est formado por la contribucin de grupos funcionales de aminocidos situados en distintas cadenas o en diferentes repliegues de una cadena, asiendo aparecer a dichos grupos muy distantes entre ellos si se considera el orden que guardan a lo largo de la cadena polipeptdica. Un caso muy ilustrativo sobre lo que significa la estructura del centro activo desde el punto de vista de la composicin de los aminocidos es el de la triptofano pirrolasa, enzima ampliamente estudiada en bacterias desde el punto de vista de la bioqumica gentica. En ella, la modificacin de algunos aminocidos produce perdida e la actividad enzimtica, que se recupera si vuelve a incluirse los aminocidos en el orden original; sin embargo, se pueden reemplazar dos de ellos por otros completamente distintos, y la enzima vuelve a ser totalmente activa. Es posible que con estos nuevos aminocidos se consigan tambin las condiciones de distribucin espacial de grupos funcionales y estructuras necesarias para la actividad enzimtica. El concepto de arreglo tridimensional adecuado de los aminocidos que forman la cadena polipeptdica de la enzima para lograr la actividad funcional correcta permite entender numerosos denmenos: la necesidad de que la molcula proteica ntegra est preservada en su forma; el hecho de que la desnaturalizacin de la enzima al permitir la separacin de los pliegues, conduce a la perdida de la actividad enzimtica; que al calentar una enzima con su sustrato (por ejemplo, la invertasa con sacaroza, la transaminasa con cido a -cetoglutrico), se impide una desnaturalizacin que sin ellos se producira, pues es posible que el propio sustrato
contribuya a sostener y reforzar la aproximacin de los pliegues de la cadena, etc. Tambin se entiende por que al atacar la ribonucleasa con pepsina y romper una sola unin peptdica que separa un tetrapptido del extremo con grupo carboxilo libre se pierde la actividad, mientras que si solo se quita los tres ltimos disminuye su accin sugiriendo as la importancia del residuo de cido asprtico para sostener el centro activo en condiciones de eficiencia, o lo que es ms probable, para formar parte del propio centro activo. Si se parte la ribonucleasa entre los aminocidos 20 y 21, y se separan los dos fragmentos, ninguno es activo, pero basta mezclarlos para que se unan en tal forma que se restablece la actividad, aunque un poco menor que la originalmente observada. El estudio detallado de la estructura del centro activo se hace por medio de inhibidores o de reactivos que se combinan de modo especfico, con algunos de los aminocidos del centro activo tales como el diisopropilfluorofosfato (DFP), que se combina con el OH del aminocido serina, en diversas esterasas, peptidasas, etc. , e inactiva el centro activo del que forman parte dicho aminocido; este inhibidor, an a concentraciones de 10-10 M, inhibe a la acetilcolinesterasa; mucho de los derivados del DFP se utilizan como gases de guerra o como insecticidas (parathion), y su utilidad se debe, en rigor a su capacidad para destruir funcionalmente ciertas enzimas. La unin del DFP al aminocido cedina es muy estrecha y a permitido el anlisis de los aminocidos vecinos a l, haciendo un estudio de su ordenamiento en el centro activo. La secuencia de los centros activos de diversas enzimas hidrolticas sensibles al DFP, se demuestran que la mayora tienen cerina y a dems un aminocido dicarboxlico (asprtico o glutmico) y en el otro un aminocido neutro (alanina o glicina). Tambin se ha demostrado que la histidina, cuando menos para el caso de la quimotripsina, forma parte del centro activo an cuando el anlisis de la secuencia no demuestra que exista cerca de la cerina ninguna histidina; se trata, por lo tanto, de otro ejemplo de una aminocido, alejado e otro, y en distinto pliegue de la cadena, que integra el centro activo. Teniendo en cuenta estos hechos, se deduce, por lo tanto, que la actividad de la enzima depende en parte de la disposicin o arreglos de los aminocidos y grupos prostticos en determinada regin de la protena. Los aminocidos que componen a las protenas pueden tener moderadas
actividades catalticas, aunque de ninguna manera comparable en su magnitud, cuando se les considera en forma aislada, a las que muestran la gran molcula proteica. De hecho para muchos sistemas enzimticos se han ideado modelos anlogos, osea sustancias qumicas sencillas que suelen reproducir los efectos ocasionados por la enzima, tal es el caso de los anlogos, a base de piridoxsal que representan la parte activa de enzimas descarboxilantes y transaminantes. Esto no significa que necesariamente, en el estado natural, la enzima funcione como lo hace el anlogo pues muchos sistemas pudieran tener otro mecanismo de operacin; la hidrlisis del almidn lo mismo se logra con la adicin del cido que con la enzima especfica amilasa, an cuando en el primer caso se atacan indiscriminadamente numerosas uniones glucosdicas, y con la enzima, en cambio solo se desprenden, uno tras otro fragmentos de dos unidades de glucosa de los extremos de las ramificaciones.
Conformacin de la enzima y propiedades del centro activo. La propiedad cataltica de las enzimas parece depender de la facilidad con la que ayudan a que se pongan en contacto las sustancias reaccionantes para dar el producto o los productos de la reaccin. Esto implica que el sistema enzimtico tenga una conformacin especial osea, una disposicin adecuada de os grupos funcionales aminocidos de la apoenzima y grupos prostticos, cuando existen estos y de las molculas mismas de los sustratos que se unirn a aquellos y permitirn que se lleve a cabo la reaccin qumica. Este acercamiento de las sustancias reaccionantes de los grupos prostticos y los grupos funcionales fue las razn del modelo de Ehrlich, conocido clsicamente como de la "llave y la cerradura". As la enzima sera un molde tridimensional en negativo, de la estructura tambin tridimensional, en positivo de los reaccionantes que se adaptaran perfectamente a ala disposicin de la enzima. Sin embargo ha sido necesario reconsiderar esta situacin y sugerir de acuerdo con Koshland la teora de un "acomodo inducido".
As las enzimas pueden sufrir un cambio en su estructura desde el momento en que entran en contacto con los reaccionantes, sustratos y cofactores, y es posible que todos ellos modifiquen el arreglo tridimensional de la enzima; la enzima los recibe en un orden determinado y cada uno de ellos al unirse a la enzima modifica su estructura. La nueva analoga es la del "guante y la mano"; aquel no representa una estructura de negativo tridimensional mientras no se halla la mano en el, ya que antes pueden tener diversas formas y disposiciones,
una vez que ha entrado la mano - que a su vez tambin puede adoptar distintas posiciones se ponen en contacto todas las partes correspondientes, es decir, en el caso de la enzima, las partes reactivas del sistema enzimtico, con las partes reaccionantes, osea los sustratos. Se ha preservado con esta nueva idea, el aspecto de la armona estructural entre el sustrato y la enzima pero se introduce el nuevo concepto de que es necesario provocar un cambio en la estructura proteica que favorezca la colocacin adecuada de todos los elementos que interviene en la reaccin enzimtica. Los cambios de la estructura protica se denominan "conformacionales". El cambio en la disposicin tridimensional puede hacerse a distancia y en muchas ocasiones la unin del sustrato a una parte de la enzima modifica otras zonas de ella y an su estructura completa, debido a plegamientos que acercan o alejan diversos grupos colocados a lo largo del pptido que forma la enzima. Esta alteracin mltiple y de tipo flexible, permite entender mejor el proceso de entrada ordenada de los sustratos, y los cofactores y la reaccin en la que se participan. Tambin permiten comprender porque un sustrato entra a una enzima y es atacado y uno que no lo es an muy parecido a l, puede quedar excluido del centro activo. Se ejemplifican estas ideas en A se encuentra la enzima en una forma desplegada con ciertos grupos reactivos (+) y (-), colocados en una zona de la superficie de la enzima. La entrada de un cofactor F1, modifica una parte del sistema (B); se introduce en el sistema un nuevo arreglo a base de la reactividad de tipo electrnico entre la zona (+) y una parte del cofactor F1, recin introducido; por fin la entrada de un nuevo reaccionate F2 modifica la parte terminal de la enzima de manera que permite la entrada del otro reaccionante (sustrato) que se acomoda en un lugar preparado previamente por los reaccionantes F1 y F2, y permite de esta manera echar a andar la reaccin cataltica. Los cambios conformacionales, se pueden demostrar con diversos mtodos algunos de tipo fsico, como son las modificaciones en la rotacin ptica o en el patrn de sedimentacin en el campo gravitacional de la ultracentrfuga, o qumicos como el aumento o la disminucin de la actividad enzimtica bajo la influencia de cambios trmicos o la adicin de agentes desnaturalizantes. Basten unos cuantos ejemplos: la transaminasa a cetoglutrica se pude calentar a 65 C. en presencia de su sustrato sin que se afecte, al paso que la enzima sola es rpidamente degradada, cambia de configuracin y se precipita; la miosina, protena muscular contrctil, en presencia de ATP hace ms notable su forma de espiral y permite el reconocimiento de aminocidos previamente ocultos en sus pliegues; la D-
amino oxidasa, al unirse a su cofactor, el FAD, pasa de la forma espiral en a -hlice, a una disposicin irregular distribuida al azar. 11. Coenzima y grupos prostticos Aparte del sustrato, cuya transformacin ser condicionada por la enzima, existe otra parte del sistema enzimtico, de peso molculas bajo y por lo tanto dializable, termostable y en general, no protica, adherida de mas o menos laxa a la apoenzima y a la cual se le llama grupo prosttico, si est muy intimanente ligada a la apoenzima como es el caso del ncleo porfirnico de numerosas oxidasas o la estructura flavnica de la deshidrogenasa succnica o coenzima cuando la unin es dbil y se separan fcilmente, como por ejemplo el DPN y el TPN que asisten a las funciones de varias deshidrogenasas. Es muy grande la importancia del grupo prosttico o de la coenzima desde el punto de vista funcional pues suelen ceder y recibir alternadamente parte de los productos de la reaccin. Por ejemplo en las reacciones de oxido reduccin los hidrgenos desprendidos de un sustrato deben ser captados por una sustancia con lo que se expulsa al sustrato oxidado y es posible recibir una nueva molcula del sustrato con hidrgenos. Tal sustancia es una coenzima, como el DPN, el TPN, el FAD, etc., que, a su vez, suele cederlos a una tercera sustancia o, cuando las reacciones son reversibles los pasan al sustrato oxidado para reducirlo. Algunos autores denominan cosustratos a estos agrupamientos coenzimticos para hacer nfasis en su carcter reversible, no cataltico y equimolecular con respecto al sustrato. Una proporcin de las vitaminas forman parte de molculas mas complejas que funcionan como coenzimas en diversas reacciones.
Muchas enzimas requieren una coenzima
Muchas enzimas que catalizan la transferencia de grupos y otras reacciones requieren, adems de su sustrato, una segunda molcula orgnica conocida como coenzima sin la cual son inactivas. Para distinguirlas de iones metlicos activadores y de las enzimas mismas, las coenzimas se definen como compuestos orgnicos termoestable, de peso molecular bajo, requeridas para la actividad de las enzimas. La mayor parte de las coenzimas se unen a las enzimas por fuerza no covalentes. Las que forman enlace covalentes con las enzimas se denominan tambin grupos prostticos. Entre las reacciones que requieren coenzimas estn las oxidorreducciones, las reacciones de transferencia de grupo e
isomerizacin y las reacciones que forman enlaces covalentes (claves 1,2,5 y 6;IUB). Las reacciones lticas que comprenden reacciones hidrolticas catalizadas por enzimas digestivas no requieren de coenzimas.
Las coenzimas pueden considerarse como segundo sustrato
La coenzima puede considerarse como un segundo sustrato o cosustrato por dos razones. En primer lugar, los cambios qumicos en la coenzima compensa exactamente a los que realizan en el sustrato. Por ejemplo, en las reacciones o oxidorreduccin (deshidrogenasa), una molcula de sustrato es oxidasa y una molcula de coenzima es reducida. Una segunda razn para dar igual nfasis a las reacciones de la coenzima es que, en realidad, este aspecto de la reaccin es el que puede ser de significado fisiolgico fundamental. Por ejemplo, la importancia de la capacidad del msculo que trabaja en condiciones anaerobias para convertir el piruvato en lactato no residen en el piruvato ni en el lactato. La reaccin sirve solamente para oxidar la coenzima reducida NADH a NAD+. Sin NAD+ la gluclisis no puede continuar y la sntesis anaerobias de ATP (y por tanto, el trabajo) tiene que cesar. En condiciones anaerobias, la reduccin del piruvato en lactato reoxida al NADH y permite la sntesis de ATP. Otras reacciones pueden servir igualmente bien. Por ejemplo, en las bacterias o levaduras que crecen en medio anaerobio, algunos metabolitos derivados del piruvato son utilizados como oxidante para el NADH y son reducidos en el proceso.
Las coenzimas funcionan como reactivos en la transferencia de grupos
Las reacciones bioqumicas de transferencia de grupo del tipo. DG+A=AG+D En la cual un grupo funcional, G es transferido de una molcula denadora, D-G, a una molcula aceptora, A, por lo general comprende la participacin de una coenzima como ltimo aceptor (por ejemplo, reacciones de dehidrogenacin) o como portador intermediario del grupo (por ejemplo, reacciones de transaminacin). El esquema siguiente muestra el ltimo concepto. D-H CoE A-G D CoE-G A Aunque estos sugiere la formacin de un complejo sencillo CoE-G, durante el curso de la reaccin global, pueden intervenir varios
complejos intermediarios CoE-G en una reaccin particular (por ejemplo, transaminacin). Cuando el grupo transferido es el hidrgeno, es costumbre representar slo la "mitad izquierda de la reaccin": D-H CoE D CoE-H Que esto representa en realidad slo un caso especial de la transferencia general de grupos puede apreciarse mejor en trminos de las reacciones que ocurren en las clulas intactas. Se pueden representar de las siguientes manera: D-H CoE A-H D CoE-H A
Las coenzimas pueden clasificarse de acuerdo al grupo cuya transferencia facilitan
Basndose en este concepto podra clasificarse a las coenzimas como sigue: Para la transferencia de grupos distintos del hidrgeno:
Fosfatos de azcares CoASH Pirofosfato de tiamina. Fosfato de piridoxal Coenzimas del folato Biotina Coenzimas de cobamida (B12) cido lipoico Para la transferencia del hidrgeno: NAD+, DADP+ FMN, FAD. cido lipoico Coenzima Q.
-Muchas coenzimas derivan de vitamina B y del monofosfato de adenosina Las vitaminas B forman parte de la estructura de numerosas coenzimas. Las vitaminas B; nicotinamida, tiamina, riboflavina y cido pantotnico son constituyentes esenciales de las coenzimas para las oxidaciones y las
reducciones biolgicas y las coenzimas cido flico y cobamida funcionan en el metabolismo de compuestos de un solo carbono. Numerosas coenzimas contienen adenina, ribosa y fosfato y se derivan del monofosfato de adenosina AMP. Los ejemplos incluyen NAD+ y NADP+ 12. Activadores Las enzimas son catalizadores orgnicos que disminuyen la barrera denominada energa de activacin; y por tanto facilitan el que se inicie una reaccin. Este proceso implica el trabajo necesario para poner a dos molculas en un contacto lo suficientemente estrecho como para que reaccionen; adems, el trabajo debe realizarce sobre la unin qumica una con covalencia en sentido estricto para que pueda romperse y formar otros compuestos. Las enzimas, como muchos catalizadores, son partculas de gran superficie y muestran que tienen capacidad para atraer y captar diversas molculas. Cualquier factor que permita por una parte atraer al sustrato a su centro activo se pude considerar como un activador, adems algo que permita la rpida salida de los productos tambin pude considerarse como un activador. Asi se reconocen diversas posibilidades:
Activacin inica. Numerosos metales monodivalentes son necesarios para la actividad enzimtica de diversos sistemas. Destacan entre ellos los siguientes: K+, Mn++, Mg++, Ca++, Fe+++, Cu+, Cu++, etc. A menudo el metal, a estas condiciones, es el centro que permite la unin conjunta del sustrato, de la coenzima y de la misma apoenzima con la que forma quelatos (de chelos, garra; complejos moleculares sostenidos por un metal) al unirse con grupos cargados electricamente. Muy amenudo se demuestra que es posible sustituir los metales divalentes entre ellos, sin grandes modificaciones de la velocidad de la reaccin.
Los metales como el hierro, el cobre y el molibdeno, actan a menudo como transportadores de electrones y no se les puede considerar activadores en el sentido estricto pues forman parte integral del grupo prosttico. Algunos aniones tambin son necesarios para la actividad de ciertas enzimas; bien conocido es el caso del Cl-, el que puede sustituirse, a un cuando con baja de la velocidad, por Br-, para la amilasa salival; o el propio radical fosfato que se requiere en reacciones de fosforilacin.
Activacin por el grupo prosttico. En determinadas reacciones estos son indispensables para el trabajo de la enzima y constituyen, en rigor, la parte funcional activa del sistema.
Activacin de la apoenzima. Consisite en la obtencin de una correcta estructura del centro activo de la proteina con actividad enzimtica, ya referido anteriormente. Integridad de los grupos funcionales del centro activo. Destaca la relacionada con los grupos sulfhidrilo, -SH. Cualquier alteracin qumica que los destruya, bloquee u oxide a disulfuro, -S-S-, puede inactivar a las enzimas. Esto puede suceder incluso en las suaves condiciones del trabajo celular por exposicin a agentes oxidantes o al oxigeno mismo, aunque puede lograrse por el efecto de sustancias que los ataquen y que combinen con ellos como la yodacetamida. En otras ocaciones la destruccin de los grupos SH, aun la distancia del centro activo modifica de tal manera la estructura tridimencional de la enzima que el centro activo se deforma al grado de que no puede llevar a efecto su accin sobre las sustancias reaccionantes. Existen otros grupos funcionales cuyo bloqueo acaba por completo con la actividad enzimatica; en tal caso estara la accin de inhibidores o venenos enzimticos. Medida de la actividad enzimtica. Aparte del problema de medir las pequesimas cantidades de enzimas presentes en los tejidos; muy pocas de ellas poseen caractersticas qumicas o espectroscpicas particulares que permita medirlas directamente. En general, las enzimas se cuantean siguiendo la actividad de la reaccin que catalizan y se aceptan, en principio que dicha actividad es proporcional a la cantidad de enzima presente. Como la actividad de un enzimas slo rara vez se puede expresar en relacin a su peso absoluto o a la molaridad de la enzima, lo habitual es expresarla en "unidades" fijadas de modo convencional con relacin a la proteina presente en la preparacin.
La actividad enzimtica se mide por la desaparicin del sustrato o la aparicin de alguno de los productos de la reaccin, siguiendo dichos cambios en el tiempo. Sin embargo, las condiciones del sistema no son uniformes a lo largo del tiempo: el grado de saturacin de la enzima con el sustrato cambia constantemente, los productos que aparecen suelen inhibir a la enzima o se presentan modificaciones del pH que afectan a la reaccin, etc. Para evitar estos problemas se hace la medida de la velocidad inicial, tomando en cuenta solo el comienzo, en forma de lnea recta de la grfica, lo que sucede en general cuando se ha consumido no ms de una cuarta parte del sustrato.
La actividad puede espresarce, una vez determinada la reaccin, en relacin con el tiempo empleado por la enzima para producir un cambio determinado; mientras mayor sea el tiempo, la actividad de la enzima es menor. Por lo tanto, la recproca del tiempo (la inversa del tiempo osea el valor que resulta de dividir la unidad sobre el tiempo, 1/T) es una medida de la actividad enzimtica. 13. Las enzimas son catalizadores estereoespecficos Casi todos los sustratos forman por lo menos tres enlaces con las enzimas. Esta adherencia en tres puntos pueden conferir asimetra a una molcula por otro lado simtrica. La figura * muestra una molcula de sustrato, representada como un tomo de carbono que tiene tres grupos diferentes, prximos a adherirse en tres puntos a un sitio de la enzima. Si el sitio puede ser alcanzado slo desde un lado y nicamente los tomos complementarios y los silios pueden interactuar (ambos suposiciones vlidas para las enzimas reales), la molcula se unir slo en una forma. La reaccin misma puede estar confinada a los tomos unidos en los sitios 1 y 2 an, cuando los tomos 1 y3 sean idnticos. Girando mentalmente la molcula de sustrato en el espacio, ntese que puede adherirse en tres puntos a un costado del sitio planar con una sola orientacin. En consecuencia, los tomos 1 y 3 aunque sean idnticos viene a ser distintos cuando el sustrato est adherido a la enzima. Por tanto, un cambio qumico puede afectar el tomo uno (pero no al tomo tres) o viceversa. Esto puede explicar el porqu la reduccin, catalizada enzimticamente de la molcula del piruvato pticamente inactiva, forma L- y no D,L-lactato. 14. Especificidad enzimtica Los distintos grupos de enzimas muestran variaciones considerables en su grado de especificidad. Algunas de ellas muestran requerimientos estrictos tanto para el sustrato (o los sustratos si se trata de reacciones bimoleculares) como para el tipo de unin qumica sobre el que van a actuar; pequeos cambios en cualquiera de ellos bastn para inactivar la reaccin; tal es el caso de la mayora de las enzimas. En otras ocaciones, la deshidrogenasa alcohlica, que funciona con DPN como coenzima, es absolutamente especfica para el DPN, pero pude actuar sobre diversos alcoholes aparte del etlico que es su sustrato caracterstico. Asi mismo, las enterasas, las fosfatasas y ciertas peptidasas a menudo solo son especficas para el tipo de unin atacada ster, peptdica, etc. y no requieren estructuras definidas en el sustrato, a ambos lados de la unin. Hay ejemplo de especificidad doble: la xantina oxidasa, altamente especfica para la xantina a la que convierte en cido rico, y por otro lado
muy activa, pero en forma inespecfica, al mostrar gran capacidad para mostrar la activacin de gran variedad de aldehidos. El requisito de estereoespecificidad para los sustratos es muy importante. Las enzimas que habitualmente atacan a los azcares naturales con configuracin D-, no lo hacen sobre sus ismeros artificiales L-; las enzimas tan activas en la naturaleza sobre los aminocidos comunes tipo L- so inactivas para los aminocidos artificiales (o muy raros en los organismos vivos) de tipo D-. Esto es tan absoluto que cuando existen mezclas racmicas de ismeros D- y L-, un mtodo conveniente de separarlas, es el de dejar que actue sobre ellas una enzima que degradar exclusivamente a uno de los dos ismeros dejando al otro intacto. Cuando el sustrato es simtrico y el producto es asimtrico, la enzima provoca, especficamente, la formacin de uno solo de los productos asimtricos, aquel para el que la enzima es activa; tal es el caso de la deshidrogenasa lctica que, al actuar sobre el cido pirvico (simtrico) produce exclusivamente cido D-lctico y no cido L-lctico, y el de la deshidrogenasa glutmica que al atacar el cido a -cetoglutrico produce solo cido L-glutmico: CH3CH3 || C = O HCOH || COOH COOH cido pirvico cido D-lctico Existen otras formas de isomerismo geomtrico aparte del isomerismo D-, L-, suceptibles de ser reconocidas por enzimas. Tal es la situacin de los ismeros cis trans en que solo uno de los tipos del par es atacado. La fumarasa introduce una molcula de agua en el cido fumrico trans, pero el ismero cis, o sea el cido maleico, no es atacado. H C COOH H C COOH HOOC C H H C COOH cido fumrico (trans) cido malico (cis) Las enzimas tambin pueden distinguir molculas que desde el puntod e vista estructural, como compuestos qumicos, son identicas. Por ejemplo, la glicerol cinasa, por medio de ATP, convierte al glicerol en L-grlicerol 3fosfato, osea produce su fosforilacin, pero exclusivamente en la posicin
3, hecho que se ha demostrado con glicerol marcado con C radiactio, C14, en las dos posiciones posibles 1 y 3. Los mismo sucede con el cido ctrico que al ser oxidado y descarboxilado hasta producir cido a -cetoglutrico adquiere un grupo C=O, en uno de los lados de la molcula, quimicamente simtrica. Esta capacidad de la enzima para reconocer el sustrato obedece a que debe tener por lo menos tres grupos qumicos orientados en el espaciod e tal modo que el sustrato, aunque en apariencia simtrico, solo puede adaptarse por completo a la enzima en una sola posicin. De todo esto se desprende por el sustrato a los sustratos necesitan tener un patrn peculiar de grupos qumicos, especficos para cada enzima particular, de modo que se adapte perfectamente a su centro activo; mientras mayor y ms complejo sea este requerimiento mayor ser la especificidad de la enzima. 15. Preparacin y purificacin de las enzimas Aun cuando se sabe que las propiedades de las enzimas in situ puden ser muy diferentes a las de las enzimas puras estudiadas en el laboratorio, est plenamente justificada la necesidad de tener preparaciones puras para hacer el estudio qumico completo de su actividad. En la actualidad se han cristalizado o purificado de manera adecuada cerca de unas 200 enzimas (del posible total de unas 5000 ) y quizas en los prximos aos aumente de modo considerable este nmero. Para extraer las enzimas de las clulas que las contienen, a menudo es necesario dividir finamente el tejido, por medio de un homogeneizador o una licuadora; los tratamientos ms enrgicos comprenden la molienda del tejido con arena el empleo de vibraciones ultrasnicas, los procesos alternados de congelamiento y descongelamiento, la autolsis , el desecado con calor o el emmpleo de solventes como la caetona, el ter y el tolueno. El desecado con acetona y la produccin de los llamados polvos acetnicos constituyen un excelente ejemplo de rotura de la menbrana celualr y la obtencin de un material rico en enzimas y de fcil concervacin. Cuando las enziams estn asociadas a lpidos, como sucede con als enzimas mitocondriales, es ventajoso el tratamiento con sustancias de tipo detergente o con butanol que disgregan la estructura lipoprotica y permiten la salida de las enzimas. La purificacin de las enzimas con mtodo de precipitacin fraccionada recurre a diversos procedimientos, el cambio de pH quita las nucleoprotenas y el material grueso, con lo que se facilitan los pasos siguientes. Con el empleo del calor a veces se logra la desnaturalizacin de material protico inactivo; por ejemplo, en la purificacin de la
transaminasa se aade el sustrato de la enzima cido a - cetoglutrico al homogenado y se calienta hasta 65 C, con lo que muchas enzimas se desnaturalizan y precipitan, lo que no sucede con la transaminasa as protegida. En otros casos se emplean solventes orgnicos como el etanol, muy utilizado para separar diversas protenas del suelo sanguneo y la caetona; o las sales, como el sulfato de amonio, que es muy soluble en agua, por lo que se puede manejar a elevadas concentraciones, y en general no ataca la estructura de las enzimas. la absorcin fraccional tiene gran utilidad para absorver gran material indeseable o para absorber la enzima y luego desprenderla del material absorbente en una forma ms pura; muy usado con este fin en el gel de aluminio C. En los ltimos aos se han logrado adelantos notables en materia de fraccionamiento protico con el empleo de tcnicas coromatogrficas en columnas que se basan en fenmenos de absorcin, de intercambio inoco o de una verdadera "filtracin molecular". Se agraga a una columna con el material activo la solucin de la enzima que queda fijada a dicho material; se lava la columna con soluciones de sales, cada vez ms concentradas o con distinto pH, etc. , y se recogen los lavados en fracciones de volmenes determinadas; en alguna porcin sale la enzima en estudio, en forma ms pura. Los materiales ms usados para este fin son ciertas formas de fosfato de calcio hidroxiapatita -, resians de intercambio inico, como las Amberlitas o las Dowex (aunque tienen el inconveniente de desnaturalizar a las protenas y de tener poca superficie til) y diversos derivados de la celulosa, tales como la dietilaminoetil celulosa (DEAE celulosa) y la carboximetil celulosa (CM celulosa). Ejemplos de los filtros moleculares lo constituye el material que est compuestod e un polisacrido que forma una rejilla tridimensional, el Sephadex, que puede retener protenas con peso molecular aproximado de 25 000 hasta 200 000 segn el tipo que se emplee. El paso final de la purificacin es el de la cristalizacin de la enzima que debe repetirse varias veces pues los primeros cristales suelen estar contaminados con otras enzimas. A pesar de esto, la obtencin de cristales no demustra que la enzima est 100% pura, es solo obtencin de una actividad especfica de un valor constante ante las recristalizaciones repetidas la que ofrece la seguridad de su pureza. El estudio de la pureza de una enzima comprende la aplicacin de las tcnicas empleadas para el estudio de la pureza de las portenas, el anlisis por ultracentrfuga, el anlisis el electrofortico, etc. Sin embargo,
an es podsible, si se somete la enzima a fraccionamientos ms sensitivos, como losd e la electroforsis en gel de agar, de almidn, o de acrilamida demostrar que la enzima en cuestin puede estar formada por varias protenas, algunas de las cuales tienen la misma actividad enzimtica, pero que por tener propiedades fsicas o estructurales diferentes se deben considerar como isoenzimas, y otras que son proteinas que se han procesado a lo largod e todas las etapas de purificacin. En general las enziams se consideran especies qumicas homogneas y puras cuando llenan requisitos como los siguientes: su actividad no debe aumentar despus de que se la recristaliza repetidas veces; su solubilidad no aumenta al elevar la cantidad de cristales de la protena problema que se pone en solucin; tanto en el anlisis realizado con la ultracentrfuga como en los diversos mtodos electroforticos se encuentra un patrn de mobilidad nico y persistente. 16. Isoenzimas Al hacer el estudio electrofortico del suero humano normal y hacer un revelado de la actividad de la deshidrogenasa lctica se encontr distribuida en cinco bandas diferentes; se lleg as al concepto que es posible que en un tipo de tejido existan diversas y mltiples formas moleculares de una enzima, a las que se denominan isoenzimas. Son por lo tanto protenas con actividad cataltica que favorece la misma reaccin pero que pueden distinguirse por alguna caracterstica fsica, estructural, inmunolgica, etc. En el ejemplo antereior sus diferencias se rejistraron en la velocidad de migracin electrofortica. En otras ocaciones la diferencia eside en las propiedades cinticas; por ejemplo, existen dos deshidrogensas mlicas que catalizan la misma reaccin; sin embargo, actuan de modo distinto cuando se les pone en contacto con los anlogos artificiales del DPN y, adems, una es de origen mitocondrial, la otra se encuentra en el sobrenadante celular. Sin embargo, este concepto tiene sus limitaciones; el caso de la deshidrogenasa lctica es muy ilustrativo. Esta enzima se diferencia en 5 isienzimas denominadas I, II, III, IV y V que parecen ser caractersticas de distintos tejidos; en el corazn dominan el I y la II, el higado tiene un predominio de la V, etc. al tratar la enzima que pesa 135 000 con rea o guanidina, su molcula se fragmenta en cuatro porciones, cada una de las cuales tiene un peso molecular de unos 35 000. Las cinco isoenzimas comunes de la hidrogenasa lctica parecen sermezclas de dos tipos bsicos A y B, o H (de "heart", corazn) y de m (msculo) de la siguiente manera:
HHHH Tipo I, miocrdico, H HHHM Tipo II HHMM Tipo III HMMM Tipo IV MMMM Tipo V, muscular, M Se ha confirmado inmunolgicamente su presencia; los anticuerpos preparados contra ambas molculas originales H o M nomuestran reaccin cruzada entre si, pero si reaccionan con los hbridos formados de H y de M. Del mismo modo, muestran diferencias considerables en su composicin de aminocidos. No solo las caractersticas fisicoqumicas son diferentes; quiz aun ms importante sea el aspecto funcional. La actividad de las deshidrogenasas lcticas ante sus sustratos normales, lactato, piruvato, y ante los anlogos del DPN indican el papel de la enzima en la regulacin de las relaciones DPN/DPNH2, que a su vez, regulan funciones celulares importantes. Es muy notable la diferencia en la inhibicin producida por un exceso de piruvato sugerente de que, en rigor, la enzima tipo M o V funciona ms bien como una reductasa del piruvato. Esta forma (M o V) es muy til en los msculos voluntarios que presentan demandas bruscas de energa proporcionadas por la gluclisis, o en tejidos con poco oxgeno (anaerobiosis). Por el contrario la tipo H (I) funcionan preferentemente en msculos que deben realizar un ejercicio sostenido y en los que las necesidades energticas se satisfacen por medio de un metabolismo aerbico intenso; este tipo, por lo tanto, est capacitado, funcionalmente, para lograr una mayor exidacin del lactato a cido pirvuco. La distribucin de la enzima con respecto a la aerobiosis (o anaerobiosos) del tejido se ha comprobado en varios casos: la de tipo H (I) es ms abundante en la corteza renal (cerca de 100%) que en la mdula (50%) en las papilas (10%), en razn directa con el grado deaerobiosis de esas zonas renales. Lo mismo sucede con msculos de un mismo animal; si tienen que trabajar constantemente muestran grandes proporciones de la forma H (I), como el dorsal ancho de las gallinas que casi en el 100% muestran dicha forma; el pectoral, en cambio tiene menos del uno por ciento de ella, en cambio, en los pectorales de las aves migratorias que deben sostener por horas y aun das, esfuerzoz extraordinarios, aparece nuevamente la forma H (I) de preferencia a la M (V). Es obio que cuando son muy marcadas las diferencias de pesos moleculares, composicin de aminocidos, caractersticas cineticas y otras
propiedades fsicas, es dificil hablar de isoenzimas; ms conveniente es considerarlas entonces como enzimas distintas que simplemente catalizan la misma reaccin reservando el trmino de isoenzima para aquellas situaciones como la de la deshidrogenasa lctica que representan agregados hbridos de composicin relativamente parecida. 17. Cinetica de las reacciones enzimaticas Aunque las leyes generales de la catlisis debieran ser vlidas para las enzimas, el hecho de que stas sean sustancias complejas, de alto peso molecular, de tamao coloidal y de composicin difcil de precisar, impide la aplicacin de dichas leyes de una manera estricta; por ejemplo, su tamao coloidal puede causar fenmenos de adsorcin o diversas reacciones debidas a sus numerosas cargas elctricas. No obstante, los factores que afectan la velocidad de la reaccin enzimtica son los ya sealados a propsito de las reacciones qumicas en general, como la temperatura y las concentraciones de las sustancias reaccionantes que, en este caso particular, son la enzima el sustrato. Adems intervienen el PH medio donde se realiza la reaccin, la presencia de los productos de la reaccin, y otros factores secundarios como las radiaciones y los efectos xido reductores. 18. Relaciones entre la enzima y el sustrato. Es universalmente aceptado, que la enzima, como todo catalizador, participa de una manera activa en la reaccin. Existen pruebas experimentales de esta situacin cuando menos para algunos. Un ejemplo bien conocido es el de la peroxidasa que, en presencia de perxido de hidrgeno, H2O2, y un acceptor de hidrgeno adecuado, produce la reduccin del H2O2, . La peroxidasa en ausencia de H2O2 muestras unas bandas de absorcin caractersticas en el espectro visible; cuando se combina con el H2O2 , pero sin que exista el acceptor de los hidrgenos, aparece una nueva distribucin de las bandas. Si se permite el paso de los hidrgenos a un acceptor, automticamente desaparecen las bandas nuevas y reaparecen las originales de peroxidasa. Se acepta corrientemente una hiptesis propuesta por Michaelis para explicar la actividad enzimtica, sobre la base de la informacin de un compuesto de la enzima con el sustrato (complejo enzima sustrato), previamente al ataque del sustrato por la enzima y a la liberacin de los productos de la reaccin. El desarrollo matemtico que permiti a Michaelis formular su hiptesis, estuvo acorde con los datos experimentales obtenidos una vez vencidos los enormes obstculos de
orden tcnico para llevar a cabo la confirmacin de la teora en el laboratorio. Si se hace el estudio de la actividad de una enzima en relacin con la concentracin de sustrato. En ella se registran, en las abscisas, la cantidad creciente de sustrato y, en las ordenadas, la cantidad de uno de los productos de la reaccin liberada de un tiempo dado, que expresa, en rigor, la actividad de la enzima. La curva obtenida es la de una hiprbola rectangular, la cual tiene algunas propiedades interesantes; por ejemplo, la velocidad lmite o velocidad mxima, es el valor que trata de alcanzar la curva a medida que se aumenta el sustrato y que, en la figura, est sealada con la lnea V. Existe un punto, fijado arbitrariamente, en el que la mitad de la velocidad lmite corresponde a una concentracin especfica del sustrato; esta concentracin de sustrato se representa habitualmente como KM, y se denomina constante de Michaelis, valor caracterstico para un par enzima sustrato y que, por lo tanto, es la concentracin de sustrato con la cual se alcanza la mitad de la velocidad lmite o velocidad mxima de la reaccin. Los resultados obtenidos experimentalmente concuerdan con los derivados de modo matemtico, sobre la hiptesis de formacin de un complejo enzima sustrato. La constante de Michaelis, KM, indica en trminos generales, las relaciones de afinidad entre el sustrato y la enzima; un KM, implica la necesidad de una alta concentracin de sustrato que, al combinarse con una enzima, produzca la mitad de la velocidad mxima, o sea, que la afinidad por la enzima y sustrato es pobre; por el contrario, si la concentracin de sustrato que se requiere para alcanzar la mitad de la velocidad es muy pequea (KM pequea), quiere decir que el sustrato tiene una gran afinidad por la enzima. En ocasiones, la misma enzima puede ser ms afn a un sustrato que a otro; por ejemplo, la sacarasa es 16 veces ms activa para atacar a la sacarosa que a la rafinosa. Se conocen con exactitud los valores de KM para muchos sustratos y enzimas, con los siguientes: la pepsina, actuando sobre albmina, de huevo: KM de 4.5. por ciento; la tripsina sobre la casena :KM de 2 por ciento; la amilasa sobre el almidn en presencia de Cl : KM de 0.4 por ciento ; la sacarasa de levadura, sobre la sacarosa : KM 0.016 a 0.04 M, etc. La explicacin de la curva hiperblica que implica la formacin del complejo enzima sustrato parece depender de la existencia fsica, en la enzima, de determinados sitios donde se absorbe el sustrato para ser
activado. Al principio de la curva se puede aumentar la concentracin del sustrato y la enzima es capaz de activarlo con toda eficiencia; pero como una vez activado el sustrato se separa en forma de los productos, y la velocidad con la que stos se separan no es igual a la velocidad con la que captado el sustrato, y en vista de la cantidad creciente del sustrato, la lnea obtenida no es una recta, sino la curva sealada. Cuando la cantidad de sustrato ha sobrepasado la capacidad fsica de la enzima para recibirlo y poder transformarlo, la curva alcanza una meseta, lo que significa que la reaccin prosigue a la misma velocidad, independientemente de la cantidad de sustrato adicionada. De acuerdo con los trminos ligados a la velocidad de reaccin, expresados en la pgina 36, se encuentra que, al principio del experimento, la reaccin depende exclusivamente de la concentracin del sustrato y se trata de una reaccin de primer orden; al final de ella, cuando hay un exceso de sustrato, la reaccin es independiente de la cantidad de sustrato y, por lo tanto, es de orden cero. Otra caracterstica en relacin con la finalidad de la enzima por el sustrato es la comprendida en el llamado nmero de recambio, el cual representa los moles de sustrato atacados por un mol de enzima en una unidad de tiempo determinada, generalmente un minuto. Este nmero de recambio, en algunas ocasiones, es muy elevado, como sucede con la catalasa que a 0 C., tiene un nmero de recambio de 2.5 millones; es decir, un mol de enzima es capaz, en un minuto, de desdoblar dos y medio millones de moles de H2O2 ; el citrocomo c, a 38 C, tiene un nmero de recambio de 1.4 X 103 ; la carboxialasa a 30 C., da un nmero de recambio de 1 X 103 , etc. Mecanismo Ping Pong En la transaminacin, la reaccin avanza a travs de los fenmenos alternos de adicin de sustrato y liberacin de producto . Iones sustrato Estos facilitan la fijacin del sustrato y la catlisis por creacin de varias de complejo de puente constituidos por un enzima, metal y sustrato en la que os iones metlicos pueden actuar como catalizadores cidos generales o facilitar la aproximacin de los reactantes. 19. Accion de inhibidores. Si a un sistema enzimtico se aaden sustancias que impidan la realizacin de la actividad propia de la enzima, se dice que el sistema ha sido inhibido, y la sustancia usada con estos fines se denomina inhibidor.
Muchos inhibidores son agentes que desnaturalizan a las enzimas, ya que stas son molculas protenicas, susceptibles a una diversidad de agentes, especialmente qumicos, como aniones complejos o metales pesados, Zn ++, Pb ++, Ag ++, etc. A menudo estos agentes que impiden la actividad enzimtica actan sobre casi todas las enzimas, lo que demuestra que su accin no es especfica, sino que afectan a tosa molcula protenica . Tal es el caso de los inhibidores de sufhidrilos, -SH, los cuales forman parte de una gran variedad de enzimas. Otras sustancias bloquean especficamente determinadas reacciones enzimticas y su especificidad es tal, que slo cierto sustrato y cierta enzima son los susceptibles. De acuerdo con esto, es posible clasificar los fenmenos de inhibicin enzimtica en diversos grupos : inhibicin por competencia e inhibicin por no competencia y sta, a su vez, en la debida a agentes desnaturalizantes y a agentes inespecficos. 20. Inhibicion por competencia En este caso el inhibidor no permite la formacin del complejo enzima sustrato normal, ya que se forma un complejo enzima inhibidor ; una vez que el inhibidor ocupa el lugar activo de la enzima, el complejo enzima inhibidor, no se separa, en vista de que la enzima no tiene accin sobre el inhibidor y, por lo tanto, queda bloqueada la parte activa de la enzima. El sustrato no puede entrar al lugar activo, que est ocupado por el inhibidor y, de esta manera, se impide la accin enzimtica. El ejemplo clsico de inhibicin competitiva es el de la enzima deshidrogenasa succnica que, en presencia de cido succnico en cido fumrico, reduciendo, simultneamente, al acceptor de H. Diversas sustancias parecidas al cido succnico, como el cido malnico, el oxlico y el glutrico, se pueden combinar con la enzima e impiden su accin sobre el cido succnico. Al aadir el inhibidor, la actividad enzimtica disminuye sin embargo, si se aaden cantidades mayores del sustrato natural de la enzima (en el ejemplo anterior, de cido succnico) nuevamente empieza a aparecer actividad enzimtica, y cuando las cantidades de cido succnico aadido sobrepasan considerablemente a las presentes del inhibidor, la actividad enzimtica se restablece por completo. Esta situacin representa, aparentemente, un fenmeno de competencia entre el sustrato natural y el inhibidor para ocupar el sitio activo de la enzima; la cantidad presente de una sustancia o de otra , en un momento dado, en el sitio de la reaccin , determina si se dirige en un sentido o de otro; si hay ms inhibidor, la enzima queda bloqueada por ste, y no se lleva a cabo la
reaccin enzimtica ; si an en presencia de importantes cantidades de inhibidor existen mayores cantidades del sustrato natural, ste domina al inhibidor y llega a desplazarlo introducindose en los sitios activos de la enzima para permitir que se reanude la actividad cataltica. 21. Inhibicion por no competencia Cuando las sustancias inhibidoras actan independientemente de la calidad del sustrato natural presente, se trata de inhibicin por no competencia. En este caso, el inhibidor bloquea loas sitios activos de la enzima de modo irreversible ; en ocasiones se trata de la desnaturalizacin de la enzima, como cuando se aaden aniones o cationes que precipitan las protenas. En otros casos la combinacin irreversible se hace con sustancias que actan de manera especfica sobre ciertos grupos activos de la enzima, o sobre la conformacin o estructura completa de ella ; sin embargo, en estas circunstancias, se ven afectadas por igual todos o cuando menos varios tipos de enzimas. Existen algunos inhibidores no competitivos que muestran cierta especificidad, como los agentes bloqueadores del radical sulfhidrilo, -SH, presente en las cadenas laterales del aminocido cistena, comn a todas las molculas protenicas y, por lo tanto, a las enzimas. Entre los inhibidores de sulfhidrilos ms conocidos se encuentran el ferricianuro, el yodacetato, el famoso gas usado con fines blicos, la lewisita, y otras sustancias de tipo arsenical que deben sus efectos letales a su combinacin con los grupos sulfhidrilo de protenas y enzimas de gran importancia fisiolgica. Hay enzimas que contienen iones metlicos indispensables para su actividad y que son susceptibles a la accin inespecfica de agentes que afectan dichos iones; tal es el caso de las enzimas con hierro que son intoxicadas por medio del cianuro o el H2S. De la misma manera, la adicin de oxalato a un sistema puede precipitar el calcio o el magnesio, e impedir la actividad de enzimas que los requieren. 22. Antagonismo metaboloco (antimetabolitos) Las enzimas pueden ser inhibidas por diversos compuestos, especialmente los que presentan una estructura parecida al sustrato natural, como expres en el caso del cido malnico y el cido succnico con respecto a la deshidrogenasa succnica. Esta inhibicin se denomina metabolitos las sustancias presentes o producidas en el curso del metabolismo celular, y antimetabolitos las sustancias parecidas a aqullos, y que impiden su aprovechamiento y
utilizacin ; en general, se trata de sustancias que compiten, a nivel enzimtico, en vista de su parecido estructural, con los metabolitos naturales. Numerosos hongos, actinomicetos, bacterias, etc., producen sustancias que muestran actividad contra otros microorganismos. Estas sustancias se han denominado antibiticos y, en principio, se deben considerar como antimetabolitos que impiden, por razones de competencia , el crecimiento de determinadas formas microbianas. En medicina ha resultado del mayor inters el aislamiento y la actividad de los antibiticos, ya que en ciertas condiciones se usan para reprimir el desarrollo de grmenes patgenos para los seres humanos. El estudio de los antimetabolitos probablemente se inici al observar que numerosas bacterias podan crecer en un medio que tuviera sulfanilamida, que normalmente es un inhibidor de su crecimiento, siempre que se aadieran grandes cantidades de cido p-aminobenzoico, una vitamina necesaria para la nutricin celular. En vista del parecido estructural entre las dos molculas, la sulfanilamida y el cido p-aminobenzoico, se acept que los fenmenos de inhibicin tenan una base estructural. Entre los antibiticos, existen algunos de gran utilidad teraputica, como la penicilina, aislada de diversos hongos Penicillium ; la estreptomicina, proveniente de cultivos de Streptomyces griseus, y las tetracilinas, sustancias que tienen amplio campo de accin de diversas infecciones producidas por bacterias grampositivas o gramnegativas. Qumicamente, son sustancias complejas formadas por distintos grupos :por ejemplo, la estreptomicina contiene glucosamina, estreptosa y estreptidina. Algunos antibiticos son pptidos, de tipo bsico, aislados de bacterias, tales como la gramicidina y las tirocidinas. Un ejemplo peculiar de antibitico producido por el hongo Pemicillium notatum es la notatina, idntica a la enzima glucosa oxidasa que ataca a la glucosa permitiendo su conversin a gluconolactona y cido glucnico ; es posible que de esta manera ejerza su accin de antibitico. Muchos antimetabolitos suelen intervenir de modo especfico a nivel de las coenzimas o de los grupos prostticos, cuando stos son del tipo de las vitaminas. Se trata, por lo tanto, en estos casos, de antivitaminas , muy comunes en las del grupo B. As, la tiamina modificada en su estructura qumica para formar piritiamina o oxitiamina, no participa en los procesos de descarboxilacin. El cido piridn 3 sulfnico impide la accin de la vitamina natural parecida a l, o cido nicotnico y perturba numerosas reacciones de
deshidrogenacin. La piridoxina es antiorganizada por la desoxipiridoxina y la biotina, de la misma manera, por la destiobiotina. Se han preparado numerosas sustancias parecidas a las bases pricas y pirimidnicas con la finalidad de bloquear los sistemas de formacin de protena, que dependen de la presencia de cidos nucleicos que contienen dichas bases, en el interior de la clulas; estos trabajos se han planeado para deprimir la velocidad de desarrollo de clulas cancerosas. Entre las sustancias obtenidas en fechas recientes se puede sealar el grupo del 5 fluorouracilo, que produce inhibicin tumoral por el siguiente mecanismo, que puede ser comn a un gran nmero de sustancias con estas propiedades : en el tumor falta la enzima que destruye el antimetabolito, en este caso el 5 fluorouracilo, el cual se vuelve muy agresivo hacia el tumor ya que no es degradado por l; en cambio, dicha sustancia es menos txica para el tejido normal que s est en posibilidad de destruirlo. 23. Inhibicion alosterica De gran importancia en el fenmeno de la actividad enzimtica es el hecho de que, en las protenas, pueden existir dos (o cuando menos dos) sitios diferentes desde el punto de vista estereo- especfico y que, adems, estn en lugares distintos. Un de estos sitios es el centro activo, donde el sustrato es atacado para dar origen a los productos de la reaccin y por lo tanto donde reside el aspecto funcional de la protena. El otro sitio denomina sitio alostrico y en l puede acomodarse de manera complementaria - pero reversible - alguna sustancia llamada efector alostrico ; al efectuarse esta unin se produce una alteracin discreta de la estructura de la protena, la transicin alostrica, que modifica la actividad biolgica de la protena, porque altera la distancia, las propiedades del sitio activo. Es muy importante que el efector alostrico normal no tiene relacin qumica o metablica alguna con el sustrato de dicha enzima y que su accin tan especfica se debe a que altera de tal modo la conformacin de la protena que modifica su centro activo. El efecto alostrico se ha estudiado de manera especial en bacterias, pero ocurre tambin en animales superiores. En un principio se reconoci como un efecto inhibidor que, por su caractersticas, fue denominado "por retro- alimentacin" o "por producto final" . En rigor, en las bacterias, es la regla que el metabolito formado al final de un camino metablico, resulte un poderoso inhibidor de su propia sntesis. Parte de la explicacin de este efecto (pg. 535) se debe a que dicho metabolito inhibe especficamente a una sola enzima localizada en el camino metablico que forma a dicha
sustancia, y de manera curiosa, la enzima sensible al metabolito final es la primera de este camino metablico. En un ejemplo de camino A B C D E, siendo E el metabolismo final, ste inhibira a la primera enzima la que forma B a partir de A. En este captulo en que se estudia la regulacin metablica se analizan con detalle algunos de estos ejemplos y las reacciones qumicas individuales afectadas. La inhibicin alostrica demuestra la alta especializacin de las enzimas que reconocen tanto al sustrato como al inhibidor, siendo muy especficas para ambos. Como qumicamente el sustrato y el efector alostrico son muy distintos, se acepta que la unin con la enzima debe efectuarse en sitios diferentes, lo que ha demostrado con mutantes bacterianas no sensibles al efector alostrico . Adems, no hay interaccin directa entre el sustrato y el inhibidor puesto que los sitios receptores estn muy separados. Las protenas alostricas pueden corresponder a polmeros, es decir, a molculas compuestas de sub- unidades idnticas, con ejes de simetra definidos. El hecho de que se agreguen las subunidades, por una parte, y el que al estar en forma polimrica adopten diversas situaciones conformaciones, hace susceptibles a la enzima a los inhibidores, o por el contrario, a recibir (fig. 3-10) al sustrato y llevar a efecto su accin caracterstica. Ms an, para el caso de la transcarbamilasa asprtica se ha demostrado que una subunidad se combina con el sustrato y otra, distinta, con el inhibidor. Estos fenmenos adquieren una importancia de tipo general, al demostrarv que es factible modificar la accin de las enzimas por cambios en la estructura cuaternaria de las protenas, basados en la asociacin y disociacin de subunidades. Algunos ejemplos particulares son los siguientes : la deshidrogenasa glutmica, con peso molecular de cerca de 1 milln puede partirse en subunidades de 250 000 por diversos agentes : DPN, ADP, estrgenos tiroxina y ciertos aminocidos . Otro ejemplo es la carboxilasa de la acetil coenzima. A, que es activada por la adicin de citrato, el cual cambia el coeficiente de sedimentacin de la enzima de 18 S a 43 S, o sea la molcula pasa a forma de polmero activo a partir de monmeros inactivos. Un caso ya clsico es el de la fosforilasa inactiva que se convierte en activa cuando se fosforila; la estructura inactiva est formada por 2 unidades y la activa por 4. 24. Enzimas: regulacion de actividades La regukacion del metabolismo logra la homeostacia La regulacin de la actividad enzimtica contribuye en gran parte a preservar la homeostasia que, mantiene un entorno intracelular e
intraorgnico relativamente constante en presencia de fluctuaciones amplias en al medio ambiente externo, como cambios de temperatura, presencia o ausencia de agua o tipos especficos de alimentos. Como conservar la homeostasia Las concentraciones locales de sustrato , comparticin de enzimas y secrecin como proenzimas o cimogenos ( como por ejemplo la quimiotripsina ) sin actividad cataltica contribuyen a la regulacin de los procesos metablicos . Adems , las alteraciones rpidas y mnimas en la actividad cataltica de enzimas reguladas clave tienen funciones importantes en la canalizacin selectiva de metabolitos hacia uno u otro proceso metablico . Las enzimas reguladoras Tienden a ser aquellas que catalizan una reaccin temprana nica ( con frecuencia la primera ) de una secuencia determinada de reacciones metablicas . La actividad cataltica de las enzimas reguladas puede modularse por ejemplo ,cambios repetidos entre estados bajo y alto de actividad cataltica ; cuando no hay sntesis protenica nueva ni degradacin protenica . La modulacin se logra cuando matabolitos especficos se unen en forma covalente y no covalente, a la enzima regulada en general a sitios ( alostricos ) bastantes separados del sitio cataltico . Tres mecanismos generales regulan la actividad enzimatica Por ejemplo el flujo neto de carbono en una reaccin catalizada en una reaccin enzimtica podra ser influido 1. Cambiando la cantidad absoluta de enzima presente . 2. Alterando el tamao del conjunto de sustancias reaccionantes distintas de la enzima. 3. Alterando la eficacia cataltica de la enzima (estas tres opciones son utilizadas e casi todas las formas de vida). La modulacin de actividad enzimtica por cambios en la conformacin del sitio cataltico puede incluir la alteracin de Km para un sustrato de Vmax para la reaccin global o para efectos sobre los dos, Km y Vmax. A menudo las curvas de saturacin de sustrato para la inhibicin alostrica son sigmoideas, por ende la ecuacin de Michaelis Menten no se aplica. 25. Bibliografia
I. II.
Rodwel. et alli Bioquimica de Harper, 13 ed., s.d. Laguna, Jose Bioquimica, 2 ed., Facultad de Medicina, UNAM, Mexico D.F., Fournier S.A., 1969.
Tema : Enzimas Curso : Qumica Ao:1999 Resumen: trata de las enzimas, que tienen el poder de catalizar, facilitar, y agilizar determinados procesos sintticos y analticos de la vida , contiene la evolucion de la enzimologia caracteriasticas como actuan en el organismo , etc
Вам также может понравиться
- EnzimasДокумент8 страницEnzimasGiulliana Jurado100% (1)
- Las Enzimas PDFДокумент9 страницLas Enzimas PDFTriny VilladiegoОценок пока нет
- Caracteristicas y Propiedades de Los LiquidosДокумент7 страницCaracteristicas y Propiedades de Los LiquidosSisley Rosario Baez MauricioОценок пока нет
- Desnaturalizacion de Las EnzimasДокумент24 страницыDesnaturalizacion de Las EnzimasJshon CusiОценок пока нет
- Extracción e Identificación de LípidosДокумент4 страницыExtracción e Identificación de LípidosNimbe Cuervo GamaОценок пока нет
- Tema16fisiovegetal Sintresis Del AlmidonДокумент8 страницTema16fisiovegetal Sintresis Del AlmidonJulio GuzmanОценок пока нет
- Pared CelularДокумент5 страницPared CelularColumba LopezОценок пока нет
- ENZIMASДокумент46 страницENZIMASVane Rubii CamposОценок пока нет
- Resumen LISOSOMAДокумент1 страницаResumen LISOSOMASamuel Lopez ChanganaquiОценок пока нет
- 12enzima Catalasa en AlimentosДокумент2 страницы12enzima Catalasa en AlimentoskarinaszlОценок пока нет
- CerebrosidosДокумент2 страницыCerebrosidosJose Gregorio Davila HernandezОценок пока нет
- Informe S11 Lípidos Quimica SeminarioДокумент11 страницInforme S11 Lípidos Quimica SeminarioAlexander E. Bruckmann AvilaОценок пока нет
- Sobre La Termodinamica de Las Soluciones ElectroliticasДокумент16 страницSobre La Termodinamica de Las Soluciones ElectroliticasNatalia StefaniaОценок пока нет
- Hormonas EsteroideasДокумент14 страницHormonas EsteroideasJosue60% (10)
- Formulario KPSI Características Del Cuerpo HumanoДокумент1 страницаFormulario KPSI Características Del Cuerpo HumanogladyseugeniarodriguОценок пока нет
- Importancia de Las EnzimasДокумент6 страницImportancia de Las EnzimasYerika Cañizalez de Partidas100% (1)
- CuestionarioДокумент4 страницыCuestionarioyandra Salas AlemánОценок пока нет
- Síntesis de NucleótidosДокумент3 страницыSíntesis de NucleótidosAnonymous guhIUozОценок пока нет
- Presentacion 6 Cinetica EnzimaticaДокумент46 страницPresentacion 6 Cinetica EnzimaticaE Clinton LMОценок пока нет
- Practica Bioquímica CatalasaДокумент9 страницPractica Bioquímica CatalasaPedro ManceraОценок пока нет
- Clasificación de EnzimasДокумент5 страницClasificación de EnzimasJaimecesar Ch MОценок пока нет
- Definición de Enzima y EstructuraДокумент10 страницDefinición de Enzima y EstructuraImnova TecОценок пока нет
- Tipos de Reacciones Redox y SolucionesДокумент47 страницTipos de Reacciones Redox y SolucionesgeilermtОценок пока нет
- Accion de La Lipasa PancreaticaДокумент8 страницAccion de La Lipasa PancreaticaPedro Sánchez VegaОценок пока нет
- T 14 A Oxido Reduccion BiologicaДокумент19 страницT 14 A Oxido Reduccion BiologicaElias Del aguila Perez100% (1)
- Taller Nomenclatura de EnzimasДокумент2 страницыTaller Nomenclatura de Enzimaskitty0% (1)
- Ficha NucleótidosДокумент2 страницыFicha NucleótidosProf. Víctor M. VitoriaОценок пока нет
- Exposicion Diapositivas Carbohidratos (Autoguardado)Документ23 страницыExposicion Diapositivas Carbohidratos (Autoguardado)Elizabeth Clorinda Huaman EleraОценок пока нет
- Guias y Lab Oratorios de Ciclo Celular Mitosis y MeiosisДокумент8 страницGuias y Lab Oratorios de Ciclo Celular Mitosis y MeiosisAle Aguirre LopezОценок пока нет
- AMILOPLASTOSДокумент7 страницAMILOPLASTOSgabyОценок пока нет
- EnzimasДокумент21 страницаEnzimasLuisa BernalОценок пока нет
- Mecanismo de Reacción de Las EnzimasДокумент10 страницMecanismo de Reacción de Las EnzimasAle Alexandra Yanque MuñozОценок пока нет
- Cambios Bioquimicos en Los Alimentos-105-136Документ32 страницыCambios Bioquimicos en Los Alimentos-105-136Dahana carolina100% (1)
- Importancia de La FisicoquimicaДокумент1 страницаImportancia de La FisicoquimicaCintya Reyes RiveraОценок пока нет
- Metales Pesados - Toxicología PDFДокумент9 страницMetales Pesados - Toxicología PDFTavo YIОценок пока нет
- LisosomasДокумент39 страницLisosomaskarimОценок пока нет
- Catálisis CovalenteДокумент3 страницыCatálisis CovalenteconniewlgОценок пока нет
- Los Cristales de Oxalato de Calcio en Las MonocotiledóneasДокумент4 страницыLos Cristales de Oxalato de Calcio en Las MonocotiledóneasPepe Kaztor MarinОценок пока нет
- Informe Activida Enzimatica Biologia 4to AñoДокумент6 страницInforme Activida Enzimatica Biologia 4to AñoKrlen krvajlcmОценок пока нет
- Tipos de PlasmidosДокумент4 страницыTipos de PlasmidosDILAN DANIEL GUERRA ZEPEDAОценок пока нет
- ALQUINOSДокумент12 страницALQUINOSsilviaОценок пока нет
- Anexo Bioelementos y Biomol.Документ9 страницAnexo Bioelementos y Biomol.Jhancarlos Quiss100% (1)
- Lab EnzimasДокумент8 страницLab EnzimasAdalberto CustodioОценок пока нет
- Cuestionario Actividad EnzimaticaДокумент3 страницыCuestionario Actividad EnzimaticaGraciela ReyesОценок пока нет
- BIOPOLÍMEROДокумент5 страницBIOPOLÍMEROAnonymous 6w5SkeОценок пока нет
- Entalpias de Formacion, Reaccion y CombustionДокумент4 страницыEntalpias de Formacion, Reaccion y CombustionMarco CastilloОценок пока нет
- Informe Laboratorio EnzimasДокумент11 страницInforme Laboratorio Enzimasdanna varonОценок пока нет
- Fermentacion LacteaДокумент9 страницFermentacion LacteaJhandessi SánchezОценок пока нет
- Sistemas DispersosДокумент52 страницыSistemas DispersosJesusJua100% (1)
- ISOMERÍAДокумент6 страницISOMERÍAyubetzys tovarОценок пока нет
- Biotransformacion de ToxicosДокумент21 страницаBiotransformacion de Toxicosnoan mОценок пока нет
- TallerДокумент3 страницыTallerLuis Drn AngrtОценок пока нет
- AlcaloidesДокумент27 страницAlcaloidesKarla Hernandez Perez0% (1)
- Practica 1-Reacción Catalasa OMCДокумент3 страницыPractica 1-Reacción Catalasa OMClhorkeОценок пока нет
- Metabolismo CelularДокумент4 страницыMetabolismo CelularDayán Wéndoly Pimentel ValdeiglesiasОценок пока нет
- ENZIMASДокумент17 страницENZIMASJuan Carlos Castillo ZamoraОценок пока нет
- Bioquimica Tercer ParcialДокумент39 страницBioquimica Tercer Parcialsabriii Mapofseul7 BTSОценок пока нет
- BacteriasДокумент4 страницыBacterias5B SyM VARGAS RODRIGUEZ LAURA ALEJANDRAОценок пока нет
- Tema-7-Biología Cpi-Enzimas y Vitaminas.Документ2 страницыTema-7-Biología Cpi-Enzimas y Vitaminas.Christian David Rolón VázquezОценок пока нет
- Biocatalizadores y Referencias BibliograficasДокумент6 страницBiocatalizadores y Referencias BibliograficasMaria Elizabeth M. Alberca0% (1)
- Publicacion Cronograma Capacitacion para JuradosДокумент4 страницыPublicacion Cronograma Capacitacion para JuradosMarii Cl ToОценок пока нет
- Imba SДокумент9 страницImba SMarii Cl To100% (2)
- Craqueo TermicoДокумент9 страницCraqueo TermicoMarii Cl To50% (2)
- Craqueo TermicoДокумент9 страницCraqueo TermicoMarii Cl To50% (2)
- FORMALDEHÌDOДокумент8 страницFORMALDEHÌDOAlexander GuerreroОценок пока нет
- Propiedades de Los AlquenosДокумент5 страницPropiedades de Los AlquenosLuis Augusto Calizaya CastilloОценок пока нет
- Valoracion de Activos Financieros A Largo PlazoДокумент37 страницValoracion de Activos Financieros A Largo PlazoNelly GamboaОценок пока нет
- Sintesis de La AcetanilidaДокумент6 страницSintesis de La AcetanilidaBetzaBa2633% (3)
- 4eso For7Документ50 страниц4eso For7bernallauraОценок пока нет
- 9 Geometria MolecularДокумент12 страниц9 Geometria MolecularMittzii GodinezОценок пока нет
- Materiales 3, 4, 5Документ53 страницыMateriales 3, 4, 5Alicia Del Rocío Sani0% (1)
- Ejemplo Examen BioquimicaДокумент3 страницыEjemplo Examen BioquimicaClaudia GodrieОценок пока нет
- Bioquimica - ColagenoДокумент18 страницBioquimica - ColagenoEstefaniaОценок пока нет
- 3552225Документ23 страницы3552225Juan Jose YaraОценок пока нет
- AcetonaДокумент5 страницAcetonaSofia WeidnerОценок пока нет
- PROBLEMASDEQUIMICAORGÁNICAДокумент15 страницPROBLEMASDEQUIMICAORGÁNICAIvan OsorioОценок пока нет
- Muestra de Reporte. Síntesis de Colorante Azoico Sudan IДокумент3 страницыMuestra de Reporte. Síntesis de Colorante Azoico Sudan IIelena Bloox0% (1)
- Radio AtomicoДокумент3 страницыRadio AtomicoNancy100% (1)
- Los Enlaces QuímicosДокумент2 страницыLos Enlaces QuímicosN.R SquireОценок пока нет
- Informe ObtencionesДокумент5 страницInforme ObtencionesDarioОценок пока нет
- Inf. 2 Preparación de AcetanilidaДокумент7 страницInf. 2 Preparación de AcetanilidaTatiana del PilarОценок пока нет
- Polimeros WordДокумент17 страницPolimeros WordSergio AguilarОценок пока нет
- PracticA 6 ALQUINOSДокумент10 страницPracticA 6 ALQUINOSGuadalupe Flores FuentesОценок пока нет
- Poli MerosДокумент17 страницPoli Meroslord_helix_hell666Оценок пока нет
- Reducción de Halogenuros de Alquilo y AriloДокумент17 страницReducción de Halogenuros de Alquilo y AriloSilvia Rivera Sivila100% (4)
- Monocristales y PolicristalesДокумент57 страницMonocristales y PolicristalesRubén Sáenz de Tejada67% (6)
- Atomo Del CarbonoДокумент2 страницыAtomo Del CarbonoEdgard Fredy Mamani CosiОценок пока нет
- Inter HalogenosДокумент5 страницInter HalogenosLiliana Bueno100% (1)
- TrabajoДокумент9 страницTrabajoMelo Marin KaritoОценок пока нет
- Bonos 1a ParteДокумент35 страницBonos 1a ParteCesar Zarate100% (1)
- Nomenclatura de Compuestos AromaticosДокумент4 страницыNomenclatura de Compuestos AromaticosCarlos EekhoutОценок пока нет
- Geometría MolecularДокумент5 страницGeometría Molecularmg88mgОценок пока нет
- QUIMICATALLERДокумент5 страницQUIMICATALLERjacobo galicinoОценок пока нет
- Enlace QuimicoДокумент22 страницыEnlace QuimicoJurgenz Fp YtzОценок пока нет