Академический Документы
Профессиональный Документы
Культура Документы
Tesis+Electro Lixiviacion+de+Oro+Con+Tiourea
Загружено:
wjoselАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Tesis+Electro Lixiviacion+de+Oro+Con+Tiourea
Загружено:
wjoselАвторское право:
Доступные форматы
-6-
Firmado digitalmente por Rudyard Torres Nombre de reconocimiento (DN): cn=Rudyard Torres, o, ou, email=rwtorresd@yahoo.com, c=PE Fecha: 2010.01.19 21:58:55 -05'00'
INDICE GENERAL
INDICE GENERAL.. 6 INDICE DE TABLAS.. 11 INDICE DE GRAFICOS... 13 Nomenclatura... 14 Introduccin................ 16 Objetivos............. 17
CAPITULO I 1.1. 1.2. 1.3.
GENERALIDADES............................................................. 18
Usos... 18 Produccin y demanda mundial de oro.... Estadstica de Produccin nacional de oro... 20 22
1. ORO 18
2. MINERALOGIA Y OCURRENCIA DEL ORO.. 24 3. ORO EN EL PERU.... 28 CAPITULO II PROCESOS METALURGICOS PARA EL BENEFICIO DE MINERALES AURIFEROS... 30
1. METODOS HIDROMETALURGICOS... 30 1.1. Separacin gravimtrica.. 30 1.2. Amalgamacin..... 33 1.3. Flotacin.. 35 1.4. Lixiviacin.. 37 1.5. Bio-lixiviacin.... 39 2. AGENTES DE LIXIVIACIN DE ORO. 40 2.1. Cianuro.... 40 2.2. Tiourea..... 41 2.3. Tiosulfato 42 2.4. Tiocianato 43
-7-
2.5. Amoniaco..... 43 2.6. Bisulfuro.. 44 2.7. Halgenos 44 2.8. Malonitrilo... 45 3. TECNOLOGIAS DE RECUPERACION DE ORO A PARTIR DE LICORES
DE LIXIVIACION..... 46
3.1. Carbn activado.. 46 3.1.1. 3.1.2. 3.1.3.
Carbn en columna.... 47 Carbn en pulpa. 47 Carbn en lixiviacin..... 47
3.2. Resinas de intercambio inico (Resina en pulpa).. 48 3.3. Cementacin........ 49 CAPITULO III TIOUREACION............................................................... 50 1. ANTECEDENTES. 50 2. CINETICA Y MECANISMO DE LIXIVIACION... 53 3. EFECTO DE LAS DIFERENTES VARIABLES DE PROCESO... 55 3.1. Efecto de la concentracin de Tiourea... 55 3.2. Efecto de la concentracin de Disulfuro Formamidina. 56 3.3. Efecto de la naturaleza del agente oxidante... 57 3.4. Efecto del pH de la solucin... 58 3.5. Efecto del potencial redox...... 59 3.6. Efecto de la temperatura..... 61 3.7. Efecto de la velocidad de agitacin.... 62 3.8. Efecto del radio slido/lquido........ 62 3.9. Efecto de la concentracin inicial de cido........ 63 4. ELECTRO-OXIDACION DE TIOUREA Y ORO....... 64 4.1. Parmetros de control..... 64 3.4. Electrodeposicin.... 49
-8-
4.1.1. 4.1.2.
pH... 65 Potencial REDOX 65
4.2. Curvas voltamperomtricas... 66 4.3. Estabilidad del complejo Oro-Tiourea (Au-TU)... 68 5. RECUPERACION DE ORO DE LICORES DE TIOUREACIN.
68
5.1. Carbn activado...... 68 5.2. Resinas de intercambio inico... 69 5.3. Cementacin con polvo de aluminio..... 69 5.4. Electrodeposicin... 70 5.5. Extraccin con solvente P507... 5.6. Extraccin slido-lquido con alfalfa.... 6. ELECTRODEPOSICIN DIRECTA.. 6.1. Generalidades.... 6.2. Efectos de los diferentes parmetros de operacin... 6.2.1. 6.2.2. 6.2.3. 6.2.4. 6.2.5.
Concentracin de Tiourea libre.... Concentracin de Disulfuro Formamidina... Concentracin del complejo Au-TU.... 70 71 71 71 72 73 75 76
Temperatura... 77 Densidad de corriente... 77
CAPITULO IV ESTUDIO EXPERIMENTAL.... 78 1. VARIABLES DE ESTUDIO... 2. RECURSOS EMPLEADOS.... 2.1. Equipos..... 2.2. Materiales...... 2.3. Reactivos....... 3. DESARROLLO EXPERIMENTAL... 3.1.1. Caracterizacin del mineral....
78 79 79 80 80 81
3.1. Datos...... 81
81
-9-
A. Anlisis mineralgico...... B. Anlisis granulomtrico...
81 82
3.1.2. Experimentacin....... 82
A. Voltamperometra..... 83 B. Electro-oxidacin de Tiourea....... C.1. Estudio de parmetros operativos.. 1) Influencia de la concentracin inicial de Tiourea (TU). 2) Influencia de la concentracin inicial de FDS... 3) Influencia de concentraciones variables de TU y FDS.. 4) Orden global de reaccin.... 5) Influencia del pH de la solucin..... C.2. Lixiviacin ptima por tiempos prolongados.... 87 90 91 92 94 96 96 97 C. Lixiviacin........ 90
D. Electro-deposicin.... 98
3.2. RESULTADOS EXPERIMENTALES..... 102 3.2.1. Voltamperometra..... 102 3.2.2. Electro-oxidacin de Tiourea....... 103 3.2.3. Lixiviacin.... 107
A. Determinacin de parmetros ptimos de operacin...... A.1. Efecto de la concentracin inicial de Tiourea.... 1) Efecto sobre el grado de conversin de oro....... 2) Efecto de [TU] sobre el Orden de Reaccin...... 3) Efecto sobre el Modelo Matemtico de disolucin... A.2. Efecto de la concent. inicial de Disulfuro Formamidina 1) Efecto sobre el grado de conversin de oro... 2) Efecto de [FDS] sobre el Orden de Reaccin.... 3) Efecto sobre el Modelo matemtico de disolucin.... A.3. Pruebas de lixiviacin con XTU constante...... 1) Clculo de CTU y CFDS por balance estequiomtrico. 2) Modelo matemtico de cintica de disolucin.. 3) CTU y CFDS iniciales para el orden global de reaccin.. A.4. Clculo del orden global de reaccin..... 107 107 107 108 110 111 111 112 114 115 115 116 117 117
- 10 -
A.5. Efecto del pH de la solucin lixiviante.. B. Estudio de lixiviacin por tiempos prolongados. B.1. XAu y modelo matemtico de la etapa controlante. B.2. Modelos matemticos de las etapas de lixiviacin..... B.3. Balance de masa en la lixiviacin de oro con Tiourea...
120 121 121 122 123
C. Electrodeposicin. Balance Metalrgico.. 125 D. Discusin de resultados 127
CAPITULO V
ESTUDIO DE PRE-FACTIBILIDAD PARA LA INSTALACION DE UNA PLANTA DE PROCESO DE 25 TM/DIA. 128
1. PRESUPUESTO ESTIMADO DE EQUIPOS..... 129 2. COSTOS OPERATIVOS... 129 3. PRODUCCION SUPUESTA DE ORO........ 129 4. FLUJO DE CAJA ECONOMICO ESTIMADO DE PROCESOS DE
TIOUREACION Y CIANURACION.. 130 131
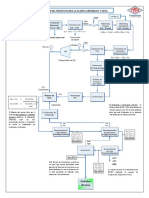
5. FLOW SHEET PLANTA DE TIOUREACION PROPUESTO.
CAPITULO VI CONCLUSIONES, OBSERVACIONES Y RECOMENDACIONES 132 ANEXOS
ANEXO I. ANEXO II. ANEXO III. ANEXO IV. ANEXO V. ANEXO VI. Mtodo Analtico para Cuantificacin de Tiourea.. 137 Reacciones Qumicas... 138 Modelos Matemticos de las Reacciones Slido/Lquido. Electrodilisis.. Clculo del orden de reaccin por mnimos cuadrados. Fotografas... 140 145 148 150 156 160
REFERENCIAS BIBLIOGRFICAS. GLOSARIO...
- 11 -
INDICE DE TABLAS
TABLA IV-1. TABLA IV-2. TABLA IV-3. TABLA IV-4. TABLA IV-5. TABLA IV-6. TABLA IV-7. TABLA IV-8. TABLA IV-9. Composicin mineralgica del concentrado aurfero 81
Granulometra del concentrado aurfero 82 Voltamperometra experimental de Tiourea.. Oxidacin de TU Conversin en funcin del peso inicial de TU.. Extraccin de Au en funcin de la [TU]... Tasa de disolucin inicial de Au en funcin de [TU] Extraccin de Au en funcin de [FDS] Tasa inicial de disolucin de Au en funcin de [FDS]. 85 89 90 91 92 93 94 95 95 96 96 97 98 101 101 101 102 105 105 107 108 109
TABLA IV-10. Cuantificacin de [TU] con conversin constante y CAu...... TABLA IV-11. Tasa inicial de disolucin de Au con XTU constante..... TABLA IV-12. Efecto de diferentes [TU] y [FDS] sobre la disolucin de Au. TABLA IV-13. Pesos disueltos de TU para pruebas del efecto de pH.. TABLA IV-14. Efecto del pH de solucin sobre la disolucin de Au.. TABLA IV-15. Lixiviacin de oro en tiempos prolongados.. TABLA IV-16. Balance de masa en solucin impregnada... TABLA IV-17. Balance de masa en catolito y en ctodo de lana de acero.. TABLA IV-18. Concentracin de TU residual. TABLA IV-19. Determinacin de FEM de oxidacin de TU. TABLA IV-20. Determinacin del grado de conversin apropiado de TU TABLA IV-21. Conversin de TU en 2 horas de oxidacin.. TABLA IV-22. Efecto de la [TU]0 sobre la conversin de Au. TABLA IV-23. Efecto de la [TU]0 sobre extraccin inicial de Au... TABLA IV-24. Efecto de la [TU]0 sobre la tasa inicial de disolucin de Au.
- 12 -
TABLA IV-25. Modelo matemtico referido a la [TU]0...
110
TABLA IV-26. [Au] en solucin estimado por modelo de Esfera Decreciente referido a la [TU]... TABLA IV-27. Efecto de [FDS]0 sobre la conversin de Au. TABLA IV-28. Efecto de la [FDS]0 sobre la extraccin inicial de Au. TABLA IV-29. Efecto de la [FDS]0 sobre la tasa inicial de disolucin de Au. TABLA IV-30. Modelo matemtico referido a la [FDS]0 111 111 112 113 114
TABLA IV-31. [Au] en solucin estimado por modelo de Esfera Decreciente referido a la [FDS]0. TABLA IV-32. CTU y CFDS por balance estequiomtrico referido a CAu.... TABLA IV-33. Modelo matemtico referido tanto a [TU] como a [FDS] TABLA IV-34. CTU y CFDS relacionados al Orden Global de Reaccin... TABLA IV-35. Efecto del pH sobre el grado de conversin de Au.. TABLA IV-36. Determinacin de XAu y 1-(1-XAu)1/3. Control por reaccin. TABLA IV-37. Balance de masa de TU y Au despus de la lixiviacin... TABLA IV-38. Anlisis mineralgico del residuo slido de lixiviacin 115 115 116 117 120 121 123 124
- 13 -
INDICE DE GRAFICOS
GRAFICO IV-1. GRAFICO IV-2. GRAFICO IV-3. GRAFICO IV-4. GRAFICO IV-5. GRAFICO IV-6. GRAFICO IV-7. GRAFICO IV-8. GRAFICO IV-9. Corriente andica vs FEM aplicada.. Corriente vs E andico sobre electrodo de grafito....... Conversin de TU a FDS. Efecto de la [TU]0 sobre la disolucin de Au...... [Au] disuelto respecto a [TU]0 para 1 hora de reaccin... Efecto de la [FDS]0 sobre la disolucin de Au [Au] disuelto respecto a [FDS]0 para 1 hora de reaccin. Efecto de [TU]0 y [FDS]0 sobre la lixiviacin de Au....... [Au] en funcin del pH de solucin. 86 86 89 91 92 93 94 95 97 98 103
GRAFICO IV-10. [Au] para tiempos prolongados de lixiviacin. GRAFICO IV-11. Determinacin grfica de la FEM de oxidacin..
GRAFICO IV-12. Determinacin de la constante de oxidacin referido a la conversin de TU calculado por volumetra.... 106 GRAFICO IV-13. Determinacin de la constante de oxidacin referido a la conversin de TU calculado por estequiometria.. 106 GRAFICO IV-14. Efecto de la [TU] sobre el grado de conversin de Au... GRAFICO IV-15. Orden de Reaccin respecto a la concentracin de TU... GRAFICO IV-16. Modelo matemtico de reaccin respecto a [TU]0.. GRAFICO IV-17. Efecto de la [FDS] sobre el grado de conversin de Au. GRAFICO IV-18. Orden de Reaccin respecto a la concentracin de FDS. GRAFICO IV-19. Modelo matemtico de reaccin respecto a [FDS]0..... GRAFICO IV-20. Modelos cinticos para diferentes [TU]0 y [FDS]0... GRAFICO IV-21. Efecto del pH de solucin sobre la conversin de Au..... GRAFICO IV-22. Conversin de Au en tiempos de reaccin prolongados.. GRAFICO IV-23. Etapa controlante de la lixiviacin de oro con TU...... GRAFICO IV-24. Etapas controlantes del proceso de lixiviacin con TU... 108 109 110 112 113 114 116 120 121 122 122
- 14 -
NOMENCLATURA
TU: TUT: TUL: [TUT]: [TUL]: [TUT]i: [TUT]0: [TUL]t: [TUL]0: [TU]oxid: [TU]prom: CTU: CiTU: CTUt: CTU0: WTU bruto: WTU neto: WAu: FDS: FDS.H6 FDS.H82+: [FDS]: [FDS]0: [FDS]prom: CFDS: CFDS0: CFDSt: [Au]: [Ag]: CAu: CwAu: Au-Tu: AuTU2+: XTU: XAu: f ([TU]): f ([FDS]):
Tiourea. Tiourea total. Tiourea libre. concentracin de TU total (msica o molar). concentracin msica de Tiourea libre (msica o molar) <> [TU]. concentracin de TU total al inicio de la oxidacin. concentracin de TU total al inicio de la lixiviacin. concentracin de TU libre en un instante t de reaccin. concentracin de TU libre al inicio de la lixiviacin. concentracin de Tiourea oxidada <> [FDS]. concentracin promedio de TU. concentracin molar de TU. concentracin molar inicial de TU total. concentracin molar de TU libre en un instante t de reaccin. concentracin molar de TU libre al inicio de la lixiviacin. peso bruto de TU disuelto. peso neto de TU disuelto. peso de oro. Disulfuro Formamidina. Disulfuro Formamidina no protonado. Disulfuro Formamidina protonado o simplemente FDS. concentracin de FDS (msica o molar). concentracin de FDS al inicio de la lixiviacin. concentracin promedio de FDS. concentracin molar de FDS. concentracin molar de FDS al inicio de la lixiviacin. concentracin molar de FDS en un instante t de reaccin. concentracin msica de oro. concentracin msica de plata. concentracin molar de oro. concentracin en peso de oro <> [Au]. Representacin literal del complejo Tiourea-Oro. Representacin molecular del complejo Tiourea-Oro. Grado de conversin de Tiourea. fraccin de extraccin o disolucin de oro en funcin a concentracin de Tiourea en funcin a concentracin de FDS.
- 15 -
toxid: tLix: K X: Vsol: Vol: GastoKIO3: rAu: WmTU: PM: FEM: Eanod: Ecelda: I, i: icelda: ianod: V: mA: SHE: p.o e.: p. ej.: ppm: grs.F: Refdo:
tiempo de oxidacin. tiempo de lixiviacin. pendiente de ecuacin lineal XTU = f(t). volumen de solucin. volumen. Volumen gastado de KIO3 en titulacin de TU. velocidad de disolucin de oro. peso de Tiourea en muestra titulada. peso molecular. Fuerza Electromotrz. potencial andico. potencial de celda. intensidad de corriente. intensidad de corriente de celda. intensidad de corriente andica. voltios. mili amperios. siglas en ingls de Electrodo Estandar de Hidrgeno. peso especfico. por ejemplo. partes por milln (mg/L). gramos de oro fino. referido a.
Nomenclatura especial Mathcad: CTU.0: CFDS.0: PurTU: concentracin molar de TU al inicio de la lixiviacin. concentracin molar de FDS al inicio de la lixiviacin. Pureza de TU.
- 16 -
INTRODUCCIN
La lixiviacin con cianuro es el mtodo comnmente usado para beneficio de minerales aurferos, sin embargo este lixiviante -adems de los elevados niveles de toxicidad- muestra bastantes limitaciones respecto a minerales refractarios los cuales normalmente son sometidos a pre-tratamientos muy costosos. En este sentido, se ha buscado otros agentes alternativos de lixiviacin. La lixiviacin con Tiourea es uno de los avances ms prometedores dentro de estas nuevas tcnicas. Las estrictas regulaciones para la calidad del agua podran ser la razn para el reemplazo gradual de procesamientos txicos. Desde que Plaskin propuso por primera vez (1941) el uso de la Tiourea como reemplazo del cianuro, considerables investigaciones han estado dirigidas hacia el uso de la Tiourea como un liante alternativo del cianuro para lixiviacin de oro (Groenewald, 1975, 1976; hasta Wan, 1995.). Como consecuencia de estos resultados, varias tcnicas para recuperar oro a partir de estas soluciones han sido investigadas. Cementacin con polvo de aluminio (desde Randol, 1981, hasta Lapidus y Gonzales, 2001), carbn activado (Gabra, 1984; Huyhua y Gundiler, 1986.), intercambio inico (Becker, Knothe y Lobel, 1983; Schulze, 1985; Conradie, 1994.), y electrodeposicin (Deschenes, 1986; Jurez y Dutra, 2000.). La aplicacin comercial en la extraccin de oro y plata es realizada en algunas regiones (Hisshion y Waller, 1984; Randol, 1981; Hillgrove, Australia, 1990) Sin embargo, a pesar de las ventajas que presenta la Tiourea respecto al cianuro como reactivo lixiviante, requiere un control riguroso del potencial de electroqumico para lograr la oxidacin en condiciones reversibles a Disulfuro Formamidina el cual acta como catalizador en la lixiviacin cida de oro. Esta reaccin reversible se logra en potenciales menores a 430 mV respecto al electrodo normal de hidrgeno (NHE), usando agentes oxidantes adecuados, evitando de esta manera un consumo excesivo de Tiourea el cual podra inviabilizar econmicamente el proceso.
- 17 -
OBJETIVOS
Objetivo General Proponer una tecnologa innovadora que combina la hidrometalurgia y la electroqumica para la recuperacin de oro a partir de minerales sulfurados aurferos mediante la lixiviacin con Tiourea electro-oxidada y electro-deposicin secuencial instantnea haciendo uso de la electrodilisis para viabilizar econmicamente el proceso, comprobando de este modo las ventajas del uso de la Tiourea como agente complejante del oro, tales como la alta cintica de disolucin, baja toxicidad y efecto mnimo de las sustancias interferentes en comparacin a la cianuracin.
Objetivos Especficos 1. Determinar la conversin ptima de Tiourea a Disulfuro Formamidina a partir de la electro-oxidacin del primero en un reactor de flujo. 2. Determinar los rangos de pH y concentracin de reactivos para lograr una alta eficiencia de extraccin. 3. Estudiar la viabilidad del uso de membranas selectivas de intercambio inico para la concentracin de soluciones diluidas con contenido aurfero va electrodilisis para una subsecuente electrodeposicin en lnea.
- 18 -
CAPITULO I GENERALIDADES
1. ORO
El oro es un elemento qumico de nmero atmico 79 situado en el grupo II de la tabla peridica. Su smbolo es Au (del latn aurum). El oro es un metal de transicin blando, brillante, amarillo, pesado, maleable, dctil que no reacciona con la mayora de productos qumicos, pero es sensible al cloro y al agua regia. De hecho, una onza (28,35 g) de oro puede moldearse en una sbana que cubra 28 m. Como es un metal blando, las aleaciones con otros metales con el fin de proporcionarle dureza son frecuentes. El metal se encuentra normalmente en estado puro y en forma de pepitas y depsitos aluviales y es uno de los metales tradicionalmente empleados para acuar monedas. El oro se utiliza en la joyera, la industria y la electrnica. Se trata de un metal muy denso, con un alto punto de fusin y una alta afinidad electrnica. Sus estados de oxidacin ms importantes son +1 y +3 1.1. Usos El oro puro es demasiado blando para ser usado normalmente y se endurece alendolo principalmente con plata y/o cobre para ser usados en joyera, fabricacin de monedas y como patrn monetario. En Joyera se utilizan diferentes aleaciones para obtener diferentes colores y matices, a saber:
Oro amarillo = 1000 g de oro amarillo tienen 750 g de oro, 125 de plata y
125 de cobre.
Oro rojo = 1000 g de oro rojo contienen 750 g de oro y 250 de cobre.
- 19 -
Oro rosa = 1000 g de oro rosa contienen 750 g de oro, 50 g de plata y 200
de cobre.
Oro blanco = 1000 g de oro blanco tienen 750 g de oro y de 100 a 160 de
paladio y el resto de plata.
Oro gris = 1000 g de oro gris tienen 750 g de oro, alrededor de 150 de
nquel y el resto de cobre.
Oro verde = 1000 g de oro verde contienen 750 g de oro y 250 g de plata.
Debido a su buena conductividad elctrica y resistencia a la corrosin, as como una buena combinacin de propiedades qumicas y fsicas, se comenz a emplear a finales del siglo XX como metal en la industria donde tiene las siguientes aplicaciones: El oro ejerce funciones crticas en ordenadores, comunicaciones, naves espaciales, motores de aviones a reaccin, y otros muchos productos. Su alta conductividad elctrica y resistencia a la oxidacin ha permitido un amplio uso como capas delgadas electro depositadas sobre la superficie de conexiones elctricas para asegurar una conexin buena, de baja resistencia. Como la plata, el oro puede formar fuertes amalgamas con el mercurio que a veces se emplea en empastes dentales. El oro coloidal (nano partculas de oro) es una solucin intensamente coloreada que se est estudiando en muchos laboratorios con fines mdicos y biolgicos. Tambin es la forma empleada como pintura dorada en cermicas. El cido cloro urico se emplea en fotografa. El istopo de oro 198Au, con un periodo de semi-desintegracin de 2,7 das, se emplea en algunos tratamientos de cncer y otras enfermedades.
- 20 -
Se emplea como recubrimiento de materiales biolgicos permitiendo ser visto a travs del microscopio electrnico de barrido (SEM). Se emplea como recubrimiento protector en muchos satlites debido a que es un buen reflector de la luz infrarroja. En la mayora de las competiciones deportivas es entregada una medalla de oro al ganador, entregndose tambin una de plata al subcampen y una de bronce al tercer puesto. 1.2. Produccin y demanda mundial de oro. Actualmente, el primer productor de oro a nivel mundial es Sudfrica (296 toneladas) seguido por Estados Unidos, Australia, China y Per (207 toneladas). Alrededor del 68 por ciento de la produccin mundial est concentrada en nueve pases que son principales productores de oro del mundo, entre ellos el Per. En el ao 2003, la produccin de Sudfrica, lder mundial, disminuy debido a dificultades operativas, menores leyes de mineral y consolidaciones empresariales que han conducido a la suspensin de la actividad en reas con producciones marginales. De todas formas, la contribucin del pas a la produccin mundial se mantiene en el 15%. En el caso contrario se encuentra Australia, que ha visto incrementada su produccin en un 6%, lo que junto al descenso sufrido por Estados Unidos, la ha situado como segundo productor mundial de oro. La principal zona productora es Australia Occidental, con el 70%, seguida por Queensland y Nueva Gales del Sur, cada una con el 10% de la produccin. China y Rusia tambin han aumentado sus producciones en 2003, ocupando el cuarto y sexto lugar mundial, respectivamente. Per, lder en Iberoamrica, increment su produccin en un 7%, principalmente gracias a la produccin de Yanacocha, la segunda mina de oro a escala mundial, que aument su produccin en un 23%, respecto a 2002.
- 21 -
Los mayores descensos se han producido
en Estados Unidos,
principalmente debido al proceso de consolidacin entre las ms importantes empresas productoras de oro, y en Canad, que ha pasado a ocupar la sptima posicin mundial, tras el cierre de varias minas (cese de actividad minera en Kiena, en septiembre de 2002, y de las minas Con y Lupin, en agosto de 2003).
Cuadro I-1. Principales productores de oro en el mundo hasta el ao 2003 (kg de Au contenido) [1]
1999 Sudfrica Estados Unidos Australia China Per Rusia Canad Indonesia Uzbekistn Ghana Papa Nueva Guinea Tanzania Colombia Mali Brasil 451 341 299 165 128 125 157 129 88 78 65 4 34 23 51 200 481 750 680 486 870 755 032 100 660 747 890 599 688 422 2000 428 353 296 176 132 142 155 127 87 78 74 15 37 28 50 200 437 420 910 585 500 538 192 500 399 540 060 018 717 393 2001 394 335 280 181 138 152 160 166 85 70 67 30 21 42 42 757 000 080 870 022 500 200 090 400 049 043 088 813 288 884 2002 398 298 266 189 157 170 151 139 87 69 61 36 20 57 41 258 000 140 810 013 872 218 650 800 575 379 000 820 964 730 2003 372 277 282 210 172 170 141 141 86 70 68 48 46 45 40 766 000 000 000 619 068 548 019 000 552 106 128 501 528 438
Sin embargo, en los ltimos aos, China, Australia han incrementado su produccin de oro y la tendencia es que desplacen a Sudfrica del primer lugar. La demanda mundial por oro durante el 2005 fue de 2,708 toneladas, teniendo entre los principales compradores a India, Estados Unidos, China, Turqua y Arabia Saudita, los que en conjunto representaron el 56 por ciento de la demanda de oro para joyera. Sin embargo, a enero del 2006 segn estadsticas del World Gold Council la produccin mundial de oro alcanzaba las 2.400 toneladas anuales, mientras que la demanda sobrepasaba las 3.600 toneladas. Entre los principales demandantes de oro para inversiones (como valor de refugio), con 387.9 toneladas en total, estn la India (37.4 por ciento), Turqua (14.9 por ciento), Japn (11.1 por ciento) y Vietnam (9.5 por ciento).
- 22 -
1.3.
Estadstica de Produccin Nacional de Oro Desde el ao 2003, el Per ha pasado a ocupar el quinto lugar en la
produccin mundial de oro, gracias al incremento de produccin de la Minera Yanacocha, la segunda mina de oro a escala mundial. Se estima que en el ao 2008 las minas aurferas peruanas y los lavaderos de oro produjeron 5.8 millones de onzas, 13.5% menos que en el 2005, en el que se alcanz una produccin de 6.7 millones debido a la mejor produccin de Yanacocha y el inicio de produccin de la mina Alto Chicama de Barrik. Per produce el 8% del oro del mundo, detrs de Sudfrica (1 con 17%, Australia (2, con 11%) y USA (3 con 10%).
7,000 6,000 Aluvial Filoneano 413 602 577 725 3,554 3,732 2,304 3,919 4,463 530 534 6,170 6,013 5,137 5,094 475 517 508 526 537
Miles de Onzas Finas
5,000 4,000 3,000 2,000 1,000 0
4,947 5,246
1998 1999 2000 2001 2002 2003 2004 2005 2006 2007 2008
Figura I-1.
Produccin de Oro en Per hasta el 2008[2]
Hasta el ao 2008 los principales departamentos productores de oro en el Per segn fuentes del Ministerio de Energa y Minas (Anuario Minero 2008) eran: Cajamarca 31.9%, La Libertad 31.8%, Madre de Dios 9.3%, Arequipa 9%, Ancash 7%, Moquegua 2.6%, Ayacucho 2.4 y Puno 1.8%. El resto es producido por otros departamentos como Pasco Junn, Huancavelica, Cuzco, Lima, Apurmac y Tacna. Segn la misma fuente, la gran y mediana minera produce
- 23 -
aproximadamente el 88% del total de oro extrado de los diferentes yacimientos aluviales y filonianos.
OTROS 22.8% YANACOCHA 31.2%
PODEROSA 1.8% RETAMAS 2.4% ARUNTANI 2.6% HORIZONTE 2.9% SANTA ROSA 2.9% BUENAVENTURA 6.3%
BARRICK 27.2%
Figura I-2.
Produccin de Oro en Per por empresas (2006)
[2]
Segn fuentes de la Sociedad Nacional de Minera y Petrleo, los destinos de las exportaciones de oro en el 2008 fueron: Suiza 60.7%, Canad 23.7%, Estados Unidos 12.0%, Reino Unido 2.4%, Mxico 0.7% y otros 0.6%[3]. Segn el anuario del Ministerio de Energa y Minas, el Per export oro en el 2008 por un valor de 5,588 millones de dlares lo cual representa el 30.0% del valor de las exportaciones mineras del mismo ao, esto, debido al incremento en el precio internacional de este metal el cual lleg en cierta poca a US$ 1,100 por onza troy. Del total de exportaciones mineras, el oro ocupa el segundo lugar despus del cobre. Pero mientras el precio del cobre lleg a su pico mximo en julio del 2008 luego del cual tuvo una fuerte cada, el precio del oro se ha ido incrementando obteniendo un precio promedio de US$ 872 por onza troy en el
- 24 -
mismo ao; y segn expertos, la tendencia del precio es a mantenerse con elevados precios al menos por los siguientes tres aos.
Zinc Plata Hierro Otros 8% Estao 3% 2% 6% Plomo 4% 6% Cobre 41%
Oro 30%
Figura I-3.
Exportaciones Metales Varios 2008[2]
En trminos generales, podemos decir que las exportaciones mineras representan el 59.5% del total de exportaciones de la economa peruana. Segn fuentes del Ministerio de Energa y Minas,[2] a diciembre del 2007, las reservas probadas de oro en el Per estaban estimadas en 16 millones 300 mil onzas troy, de los cuales el 55% correspondan a los departamentos de Cajamarca y La Libertad.
2.
MINERALOGIA Y OCURRENCIA DEL ORO Se forma en filones hidrotermales, normalmente relacionados con cuarzo y
sulfuros, diseminados en rocas. Filones de cuarzo y depsitos de aluvin aurfero y pepitas. La principal ocurrencia mineralgica del oro es como oro nativo y fino en forma de inclusiones dentro de otros minerales: piritas, arsenopiritas, calcopiritas, esfaleritas, limonitas, cuarzo y en materia carbonosa.
- 25 -
La mineraloga del oro est determinada por la forma como se presenta: Electrum: Cuando el contenido de plata es 20 % o ms. Minerales oxidados: La oxidacin y otras alteraciones hidrotrmicas permite el rompimiento de la estructura de la roca, incrementando su permeabilidad. Minerales sulfurados : Asociaciones comunes con piritas, arsenopiritas Minerales carbonceos: Los componentes de carbn adsorben el oro disuelto durante la lixiviacin (preg-robbing). Teluros: Qumica de tratamiento compleja. Formas comunes Silvanita, Calaverita, Petzita. El oro nativo se presenta generalmente aleado con plata como la principal impureza y en aleaciones con plata, cobre y fierro. Adems con teluros, selenio, bismuto, mercurio, platino, bismuto.
Figura I-4.
Oro Nativo[4]
Se debe distinguir entre: Oro libre.- Posee bordes de contacto propio con otros minerales, ejemplo: Oro en vetillas Oro encapsulado.- El oro se encuentra alojado al interior de otro mineral de tamao bastante mayor. Los yacimientos aurferos estn clasificados en:
Vetas y filones. El oro se encuentra atrapado dentro de lo no valioso.
- 26 -
Cuadro I-5.
Yacimiento Aurfero en Vetas[5]
Placeres. En los placeres, el oro metlico aparece mezclado con guijos,
arena o arcilla, al haber sido transportado desde su lugar de origen por la accin del agua y depositado en su nuevo emplazamiento por accin mecnica, por deposicin qumica o por una y otra.
Figura I-6.
Explotacin de Oro en Placeres (Ros)[6]
Diseminados. El oro se encuentra libre, fino y esparcido o diseminado
en grandes extensiones de terreno formando bolsones. El cuerpo mineral est cubierto por una capa de poco espesor de material no mineralizado. La ley de oro en este tipo de ocurrencia por lo general es relativamente bajo.
- 27 -
Cuadro I-7. Explotacin a Tajo Abierto de Oro Diseminado[7]
Oro como sub-producto. Oro asociado a sulfuros (ejemplo calcopiritas)
que fue concentrado juntamente con el metal base (cobre), tratado por mtodos piro-metalrgicos y separado en los procesos de electrorefinacin.
Figura II-1. Obtencin de Oro como subproducto de fundicin.
[8]
- 28 -
3.
ORO EN EL PERU El Per es un mendigo sentado en un banco de oro Antonio Raymondi El Per, pas minero por tradicin, desde la poca preincaica ya se obtena
de la naturaleza, cobre, oro, plata y las aleaciones, dndole prestancia personal y social al que lo usaba como obras de arte en diferentes formas de presentacin. A lo largo de la historia el Per se ha caracterizado por ser el mejor exponente artesanal y orfebre de Amrica. Desde tiempos precolombinos se desarrollaron diferentes culturas a lo largo de nuestro territorio, como Chavn, Moche y Chim. Ellos dejaron como testimonio sus trabajos en oro plata y otros. La cultura Chim fue la ms avanzada en el trabajo en oro. Tenemos como ejemplo los Tumis, que eran cuchillos ceremoniales para sus diferentes ritos. La cultura Moche dejo un legado importante con sus trabajos, muchos de los cuales podemos apreciar en el Seor de Sipn.
Figura II-2. Mascara de Oro de la Cultura Chim.
[9]
Las regiones donde estn los mayores yacimientos de oro son Cajamarca, La Libertad, Arequipa, Ancash; mientras que las principales empresas mineras aurferas son Yanacocha y Barrick en la gran minera y Buenaventura, Aruntani, Ares y Santa Rosa en la mediana minera. La explotacin de los yacimientos de oro es generalmente a tajo abierto.
- 29 -
Sin embargo, no hay regin del Per que no ofrezca algn depsito aurfero; los cerritos que forman pequeas cadenas en la llana regin de la Costa; las profundas quebradas de la Sierra; la elevada e inhospitalaria Cordillera, los vrgenes bosques de la Montaa; en una palabra, todas las zonas ofrecen minas o lavaderos de oro. El oro es sumamente repartido en toda la extensin del Per; y si es verdad que hay lugares donde la cantidad de este metal contenida en terrenos aurferos es demasiado pequea para pagar los gastos de extraccin, lo es tambin que hay otros en que las minas y lavaderos pagan dichos gastos con usura. La riqueza del Per en metales preciosos es proverbial, siendo muy comn el or decir, exagerando la riqueza de un lugar o el valor de una cosa, es rico como el Per o vale un Per. [10]
- 30 -
CAPITULO II PROCESOS METALURGICOS PARA EL BENEFICIO DE MINERALES AURIFEROS
1.
1.1. METODOS HIDROMETALURGICOS Separacin gravimtrica Los mtodos de separacin gravimtrica se usan para tratar una gran variedad de minerales, que varan desde los sulfuros pesados como la galena (peso especfico 7,5) hasta el carbn (peso especfico 1,3), y tamaos de partculas en algunos casos por debajo de 50 m. Las plantas de concentracin gravimtrica tienen dos propsitos:
Separacin de acuerdo a una clasificacin por tamaos, minerales de la
misma densidad (clasificacin).
Separacin de acuerdo a diferentes densidades de minerales de
aproximadamente el mismo rango de tamao (concentracin). La concentracin gravimtrica separa minerales de diferentes densidades debido a un movimiento relativo debido a la gravedad y otras fuerzas, como la que ofrece al movimiento de un cuerpo un fluido viscoso, como el agua, aire, etc. Para una separacin efectiva es esencial que exista una marcada diferencia de densidades entre el mineral y la caja. Una idea del tipo de separacin posible puede obtenerse de la relacin:
Dh Df Dl Df
(E1)
Donde Dh es el peso especfico del mineral pesado, Dl es el peso especfico del mineral liviano, y Df es el peso especfico del medio fluido.
- 31 -
En trminos generales, cuando el cociente es mayor que 2,5, ya sea positivo o negativo, la separacin gravimtrica es fcil. Cuando este valor va decreciendo, la eficiencia de la separacin tambin decrece, y por debajo de 1,25 la separacin gravimtrica ya no es factible econmicamente. (1) Los procesos gravimtricos son muy sensibles a la presencia de lamas, consiguientemente se debe evitar en lo posible la generacin de finos (lamas). Los equipos ms conocidos de separacin gravimtrica de oro son:
Jigs.- son normalmente usado para concentrar material relativamente
grueso y, si el material de alimentacin es relativamente uniforme, entre 3 10 mm, no es difcil lograr una buena separacin de minerales con un rango de pesos especficos estrecho en la alimentacin (por ejemplo fluorita, p.o e. 3,2, del cuarzo, p.o e. 2.7) y si la diferencia de pesos especficos es mayor la separacin ser mejor.
Canaletas.- Son canaletas corrientes, champa lavador, canaln
prefabricado, mesas rayadas, canoa. La inclinacin de la canaleta segn la forma de operacin y tamao de grano de la alimentacin: 2 8 para pre concentracin de alimentacin de minerales pesados; alrededor de 14,8 para post lavado de concentrados clasificados con estrecho rango de tamao de grano en ritmo de trabajo intermitente en Bolivia. Las canaletas pueden ser de 2 m de largo por 0,5 m de ancho por 0.5 m de profundidad. En Tailandia pueden ser ms largas. Los champa lavadores son canaletas con piso de plantas de lodazales y que aumentan la capacidad de adhesin en el piso. Tambin se usan las trancas en las canaletas, las cuales tienen diferentes secciones y cambian la velocidad del flujo de la pulpa, las partes livianas pasan y las partes pesadas se depositan tras las trancas y de esta manera se logra la concentracin.
Conos.- El cono Reichert, es un dispositivo de concentracin por
gravedad en hmedo diseado para instalaciones de gran capacidad. Su
- 32 -
principio de operacin es el mismo que el de las canaletas descritas interiormente, pero el flujo no est restringida o influenciada por las paredes laterales. Una unidad industrial consta de varios conos instalados uno sobre otro que conducen a una mejor recuperacin. Estos conos se fabrican en fibra vidrio y vienen en estructuras de 6 m de alto. Los conos tienen un dimetro de 2 m y no se mueven.
Espirales.- Los concentradores a espiral han encontrado muchas
aplicaciones con buenos resultados. Se usan desde 1943. Tiene una forma semicircular. La pulpa debe ingresar con un 15 a 45% de slidos y un tamao entre 3 mm y 75 m en la parte superior del equipo.
Mesas Concentradoras.- La mesa es una superficie plana ligeramente
inclinada A (Fig. 7) a la cual llega la pulpa con un 25 % de slidos en peso por medio de un cajn alimentador y es distribuida a lo largo de C; el agua de limpieza es suministrada a lo largo de la canaleta D. La mesa vibra longitudinalmente, por medio del mecanismo B, usando una carrera adelante lento y un retorno rpido, el cual hace que las partculas de mineral se arrastre lentamente a lo largo de la mesa y paralela a la direccin de su movimiento.
Figura III-1: Mesa de Concentracin Gravimtrica (Wifley)
(1)
- 33 -
Concentradores
centrfugos.-
Los
concentradores
centrfugos
constituyen la principal innovacin realizada a los implementos de concentracin gravimtrica de oro. En un tiempo muy corto, han ganado gran aceptacin para la recuperacin gravimtrica de oro en minas grandes; frecuentemente en los circuitos de molienda para separar oro libre y evitar sobre molienda y antes de plantas de cianuracin o flotacin para recuperar el oro grueso. Tambin existen muchas aplicaciones en plantas industriales en la minera aurfera aluvial. Otra aplicacin especial para los concentradores centrfugos es la recuperacin del oro como un producto secundario, por ejemplo en canteras de grava. Todos los concentradores centrfugos operan con el mismo principio: bsicamente, un recipiente que rota efecta la separacin gravitacional de la carga en un campo centrfugo. Los tipos de concentradores centrfugos ms utilizados estn basados en el mismo principio pero difieren en su diseo tcnico. Se encuentran los concentradores Knelson, Knudsen y Falcon.[11] 1.2. Amalgamacin La amalgamacin es un proceso que se aplica para recuperar oro y plata nativa de materiales aurferos o argentferos. El oro, la plata y varios otros metales y sus compuestos son capaces de alearse con el mercurio. Dichas aleaciones se conocen como amalgamas. La amalgamacin en la minera aurfera sirve para recuperar el oro en forma de amalgama y as separarlo de los minerales acompaantes. La amalgama se forma por el contacto entre mercurio y oro en una pulpa con agua. El oro libre (nativo) en un tamao de grano entre 20-50 mm y 1-2mm es apropiado para la amalgamacin. El oro grueso se puede recuperar fcilmente con mtodos gravimtricos. En el proceso de amalgamacin, el oro se disuelve mnimamente en el mercurio. La amalgama contiene generalmente partculas de oro superficialmente aleadas con el mercurio y ligadas entre s por el mismo.
- 34 -
Figura III-2: Amalgamacin Artesanal[12]
Figura III-3: Amalgama de Oro
[13]
En principio, todo el oro libre y limpio (p. ej. No cubierto por xidos de hierro) se amalgama. Sin embargo, frecuentemente el mineral bruto puede contener ciertos minerales acompaantes y/o impurezas con efectos negativos para el proceso de amalgamacin. Algunos de tales problemas se describen a continuacin:[14]
Los sulfuros de arsnico, antimonio y bismuto reaccionan con el
mercurio, produciendo una prdida significativa del mineral precioso y mercurio. En un ambiente oxidante (por ej. Con aguas cidas de mina), tambin la pirrotina y en menor grado la pirita y calcopirita pueden tener un efecto negativo sobre la amalgamacin. La adicin dosificada de cal neutraliza parcialmente dichos efectos.
Los lubricantes y las grasas son extremadamente problemticos, porque
se fijan al mercurio y tienden a atrapar sulfuros, talco, arcillas y otros minerales formando una slida pelcula de finas partculas.
Adicionalmente, los lubricantes o grasas causan la flotacin del oro, el cual es alejado del contacto con el mercurio. Tales factores, naturalmente bajan la recuperacin del metal precioso en un proceso de amalgamacin. Las medidas preventivas para evitar dichos factores negativos incluyen, aadir agentes limpiadores, algn detergente fuerte o la savia (jugo) de una planta; el objetivo de su uso es saponificar el aceite y la grasa.
- 35 -
Los metales de aluminio, cobre, plomo, zinc pueden amalgamar,
consumir y ensuciar el mercurio; dispersndose en forma de partculas finsimas bajo condiciones oxidantes.
La baritina, el talco, la esteatita y otros silicatos hidratados de
magnesio y aluminio tambin podran interrumpir el proceso e incrementar las prdidas de oro y mercurio. Finalmente, la amalgama es sometida a un quemado directo al ambiente para eliminar el mercurio y dejar libre el oro. 1.3. Flotacin En la flotacin se aprovechan las diferentes caractersticas fsico-qumicas de la superficie de los minerales para el proceso de separacin: algunos minerales en una pulpa de grano fino se vuelven hidrfobos aadindoles reactivos (colectores, activadores). El aire inyectado al tanque (celda de flotacin) que contiene la pulpa lleva las partculas hidrfobas a la superficie, donde flotan en forma de espuma, y entonces se retira. Gracias a las variaciones de pH de la pulpa y a los reactivos adicionados, se puede recuperar selectivamente diferentes minerales. La flotacin se utiliza muy poco en la minera aurfera para slo recuperar oro libre, y s ms a menudo para recuperar sulfuros aurferos junto con el oro liberado (bulk flotation). Existen diferentes tipos de celdas de flotacin en uso, en las que se combina la agitacin de la pulpa y su aireacin. En varios casos, la flotacin ha sido probada para separar el oro libre de concentrados de sulfuros, reemplazando la amalgamacin. Esto funciona solamente para un tamao limitado de granos, debido a que el oro ms grueso, por su masa, no flota tan fcilmente. Tambin es difcil hacer flotar las partculas ultra finas. Sin embargo, en un tamao de grano apropiado (aproximadamente 100 a 20 m), la separacin del oro y sulfuros puede funcionar. El uso de la flotacin implica otros problemas ambientales, porque es necesario el uso de varios reactivos, especialmente cal, para el ajuste del pH,
- 36 -
colectores (xantatos), espumantes y otros, como en el caso de una flotacin selectiva de oro, donde se emplea cianuro o cromato para deprimir la pirita. Generalmente, las minas pequeas no disponen de los conocimientos ni de los fondos de inversin necesarios para controlar eficientemente estos reactivos, que son despus vaciados a los ros. Adems, el mismo proceso de flotacin, por su complicado manejo (control de pH, dosificacin de reactivos, tiempos de acondicionamiento, etc.), presupone un grado de conocimientos tcnicos que rara vez se encuentra entre pequeos mineros. Por esto, el uso de la flotacin queda restringido (con algunos excepciones) a la minera industrial.[15]
Figura III-4: Celda de Flotacin
[16]
Las parmetros usuales de operacin en la flotacin de piritas aurferas son: pH = 6-7, Molienda: 55% -200 Malla. Por otro lado, los reactivos ms usados en la flotacin de menas aurferas son: Xantato Amlico de Potasio y Aeropromter 404 como colectores; Teuton 100 como espumante; NaCO3 modificador de pH que sirve para separar sulfuros y dispersar lamas; Cal para deprimir oro si es lo que se desea; CuSO4 para activar la arsenopirita, es el ms usado en la flotacin de oro. Como depresor es ms usado el silicato de sodio para deprimir cuarzo, silicatos.
- 37 -
1.4.
Lixiviacin La lixiviacin es una operacin unitaria que consiste en una extraccin
slido lquido empleada para separar los constituyentes solubles de un slido inerte con un solvente. El proceso completo de extraccin suele comprender la recuperacin por separado del solvente y del soluto. La extraccin slido-lquido tiene gran importancia en un gran nmero de procesos industriales. En metalurgia en la extraccin de: cobre con cido sulfrico, oro y plata con cianuro, etc. Debido a que usualmente se utiliza el cianuro como agente lixiviante, mencionar los cuatro mtodos de lixiviacin2)
Dump Leaching.- Su campo de aplicacin est enfocado a los
minerales permeables a las soluciones lixiviantes debido que utilizan un sistema de percolacin. Este mtodo consiste en el amontonamiento del mineral tal como sale de la Mina, con el menor manipuleo del material, se procesan en gran volumen (millones de toneladas) con camas de una altura de ms de 80 metros, su sistema de riego es por goteo con soluciones cianuradas de bajsima concentracin, los contenidos de oro en los minerales es bajo estn alrededor de 1 gramo por tonelada de mineral.
Figura III-5: DUMP. Leyes menores a 1 gr/TM
[17]
Heap Leaching.- Este mtodo es similar al Dump Leach, con la
diferencia de que en este mtodo, el mineral es previamente aglomerado. La analoga es el apilamiento o lo que es lo mismo formar pilas de mineral para
- 38 -
ser rociadas por soluciones cianuradas por el sistema de goteo, aspersin o tipo ducha.
Figura III-6: HEAP. Leyes menores a 3 gr/TM[18]
El volumen de material es menor que el Dump pero los contenidos de oro son mayores a 1 gramos por tonelada, lo que permite en la mayora de las operaciones Heap una etapa de chancado a un tamao de de pulgada al 100 %.
Vat Leaching.- El nombre del mtodo est referido a que el mineral
esta en un recipiente tipo Batea, entonces el Vat Leaching sera el acumulamiento de mineral en una batea o un equivalente que puede ser pozas de concreto o mantas transportables, en el que se agrega las soluciones cianuradas por INUNDACIN, las operaciones pueden ser de diverso tamao, las leyes en oro deben justificar la molienda, previamente a los riegos de soluciones cianuradas, se realiza una aglomeracin al material molido.
Figura III-7: VAT. Leyes mayores a 6 gr/TM
[19]
- 39 -
Lixiviacin por agitacin.- Es aplicable a minerales impermeables que
requieren de una molienda fina para la mxima liberacin de valores, y as obtener buenas recuperaciones en oro, si el oro es ms expuesto a las soluciones cianuradas, mayor ser su disolucin del oro. La recuperacin de oro de las soluciones ricas se realiza en dos formas: una es la del Carbn activado (CIP) y la otra tcnica es la de precipitar con polvos de zinc ( Merril Crowe).
Figura III-8: Leyes mayores a 8 gr/TM
[20]
1.5.
Bio-lixiviacin Este proceso es aplicable a minerales refractarios de oro en los cuales ste
se encuentra incluido dentro de una matriz mineral de sulfuros, lo cual dificulta su posterior recuperacin. La bacteria aerbica ms usada llamada Acidithiobacillus ferro-oxidans es responsable de la actividad lixiviante. El mecanismo de accin bacteriana consiste bsicamente en transformar sulfuros, que no se solubilizan en medios acuosos, en sulfatos que se disuelven fcilmente en soluciones acuosas. La capacidad de aquella bacteria para crecer en presencia de cidos y de altsimas concentraciones de metales, sumado a que no necesita fuentes orgnicas para procurarse carbono y que crece a temperaturas moderadas, la hace ideal para los procesos de recuperacin de metales a partir de minerales.
- 40 -
La accin de las bacterias elimina esta matriz del mineral liberando al oro y haciendo as ms eficaz su recuperacin y con una marcada disminucin del gasto en cianuro que, en caso contrario, es consumido por hierro y cobre que suelen estar presentes en la matriz de sulfuros. La bio-oxidacin se realiza frecuentemente en grandes tanques agitados a los cuales se agregan los microorganismos, las soluciones acuosas, con un mnimo de sales requeridas por los microorganismos, y el mineral. Posteriormente, el mineral lavado en condiciones apropiadas es expuesto a una solucin de cianuro para lixiviar el oro
[2]
obteniendo recuperaciones comercialmente aceptables. AGENTES DE LIXIVIACION DE ORO Una reaccin fisicoqumica en el cual se hallan involucradas una fase
2.
slida y otra lquida se consuma en las cinco etapas siguientes: 1. Difusin de los reactantes desde la solucin hasta la interface slidolquido. 2. Adsorcin de los reactantes en la superficie del slido. 3. Reaccin en la superficie. 4. Desorcin de los productos de la reaccin de la superficie del slido. 5. Difusin de estos productos de la interface slido-lquido a la solucin. En todos los casos donde el oro es sometido a un proceso de lixiviacin, la disolucin est regida por los principios electroqumicos de la Corrosin, en donde el mecanismo de reaccin depende de cada sustancia lixiviante. 2.1. Cianuro Dado que todo fenmeno de corrosin est basado en la formacin de dos medias celdas de reaccin, una catdica y otra andica; la reduccin del oxgeno sobre la superficie metlica en la zona catdica va acompaada por la oxidacin del oro en la zona andica de acuerdo a las siguientes reacciones:
O2 + 2 H 2 O + 2 e H 2 O2 + 2 OH
(R1)
- 41 -
2 Au 2 Au + + 2e
Au + + 2CN Au(CN ) 2
(R2) (R3)
La ecuacin fundamental de cianuracin segn Elsner es:
4 Au + 8 NaCN + O2 + 2 H 2 O 4 NaAu (CN ) 2 + 4 NaOH
(R4)
La cianuracin requiere de condiciones bsicas y concentraciones de cianuro libre relativamente diluidas. En valores de pH por debajo de 10, el cianuro se hidroliza lo que ocasiona mayor consumo por formacin de gases HCN lo cual es altamente txico. En pH mayores de 12, la velocidad de cianuracin se inhibe. El rango de pH recomendado est entre 10.5 y 11.5. En lo que respecta a la concentracin del cianuro libre en la solucin la mayora de especialistas coinciden en que lo valores recomendados oscilan entre 0.05 y 0.1% de porcentaje en peso. Las concentraciones bajsimas de oro menores a 0.001% no disuelven el oro. Del mismo modo, a altas concentraciones de cianuro, por encima de 0.25% provocan la pasivacin del oro por las reacciones colaterales con otros elementos que provocan la formacin de pelculas sobre las partculas de metal. 2.2. Tiourea(3) Tiene mayores ventajas que el cianuro sobre todo en minerales refractarios. Es el lixiviante alternativo que mayor atencin ha recibido por parte de los investigadores interesados en la lixiviacin de oro y plata. Este inters se debe sobre todo a dos factores: (1) Es mucho menos txica que el cianuro y (2) Altas tasas inciales de disolucin. Las principales caractersticas inherentes del proceso son:
Operacin en medio cido, pH entre 1.5 y 3.0 Posibilidad de usar varios agentes oxidantes, entre ellos el Fe3+.
- 42 -
La disolucin de oro involucra la formacin de un complejo catinico a diferencia de la cianuracin que es un complejo aninico.
El mecanismo de reaccin est dado por las siguientes etapas:
2 Fe3+ + 2CS( NH 2 ) 2 H 3 N ( NH )CSSC( NH ) NH 3
2+
+ 2 Fe2+ (R5)
Au +
1 (H 3 N ( NH )CSSC( NH ) NH 3 )2+ + CS( NH 2 ) 2 Au(CS( NH 2 ) 2 ) + 2 2 (R6)
La reaccin global de disolucin para la formacin del complejo catinico est representado por:
Au 0 + 2 SC( NH 2 ) 2 Au[SC( NH 2 ) 2 ]2 + e
+
(R7)
2.3.
Tiosulfato(3) La limitacin principal de Tiosulfato parecera consistir en su aplicabilidad
(la mayora de pruebas han sido realizados en minerales tipo carbonceos). Similar a la Tiourea, la reaccin de lixiviacin es muy sensible al potencial de pH y Redox. El Tiosulfato es tambin inherentemente metaestable y se descompone fcilmente a sulfato por una serie de especies de oxgeno azufre (principalmente tetrationato) y sulfuros. Por consiguiente, su reutilizacin no parecera ser posible. Sin embargo, la oxidacin (desintoxicacin) a sulfato es posible, pero esto sera sumamente costoso ya que la demanda qumica de oxgeno sera considerable y los costos operativos aumentaran significativamente puesto que cuatro moles de oxgeno son requeridas por mol de Tiosulfato para obtener sulfato. El uso de Tiosulfato como un lixiviante alternativo ha pasado de escala de laboratorio a una escala piloto archivado en una aplicacin en Nevada, USA. Actualmente est por entrar en operacin una Planta de Tiosulfatacin en el oriente de Bolivia. El pH de operacin vara entre 8 y 11. La reaccin de disolucin del oro est dado por:
Au + 2 S2 O3
2
Au( S2 O3 ) 2
+ e
(R8)
- 43 -
2.4.
Tiocianato(3) Por mucho tiempo se ha sabido que el Tiocianato acta como un lixiviante
del oro. No est considerado aqu el mecanismo para la formacin del in cianuro en el rango cido y neutro de pH en presencia de un oxidante como agua oxigenada. En los ltimos aos, Barbosa-Filho y Monhemins mostraron que el Tiocianato puede lixiviar oro en el rango de pH de 1 3 en altas temperaturas (hasta 85 C). El bajo pH y las altas temperaturas indicaran que altos costos de capital seran requeridos para una planta de lixiviacin. Las temperaturas superiores tambin querran decir que altos costos operativos seran requeridos comparado con la cianuracin. La disponibilidad de Tiocianato tambin puede ser una restriccin y si se tiene que desintoxicar el Tiocianato, se necesitara una demanda considerable de oxgeno, lo cual incrementara aun ms los costos operativos. La ecuacin global de reaccin es:
Au + 2 SCN Au( SCN ) 2 + e
2.5. Amoniaco(3)
(R9)
Xinghui ha descrito el uso de amonaco como un lixiviante para minerales refractarios a temperaturas entre 100 y 300 C y 1.7 a 7.9 bar. El uso de amonaco es ms comnmente conocido como un reactivo adicional en la cianuracin para cuerpos de mineral que contienen cobre. Las altas temperaturas y las presiones requeridas indicaran inversin altos de capital para una planta de lixiviacin de este tipo. Aunque los tiempos cortos de reaccin de 2 4 h fueron reportados para 88 95% de recuperacin, los costos operativos pareceran ser prohibitivos debido a las altas temperaturas y las presiones de por s. La disponibilidad de amonaco y su costo, sin embargo, no seran una restriccin. El amonaco tendra que ser reciclado y no podra ser desintoxicado fcilmente. Este reactivo aun puede estar disponible para la mayora de tipos del mineral, pero no puede ser selectivo lixiviando especialmente para cuerpos de mineral cuprferos. Esto es debido a la formacin de tetra-amina de cobre a partir de la mayora de minerales
- 44 -
de cobre. El sistema tendra que estar cerrado para impedir la emisin de amonaco. Esto es especialmente verdad con respecto a regulaciones prximas de emisiones gaseosas como el Toxic Release Inventory (TRI) en USA y el NPI en Australia. La reaccin qumica con el oro es la siguiente:
Au + 2 NH 3 Au( NH 3 ) 2 + e
+
(R10)
2.6.
Bisulfuro(3) Hunter y otros investigadores de YES Technologies describi un proceso
visionario que usa bisulfuro como lixiviante de oro. El tiempo de residencia demasiado largo y circuito cerrado, que probablemente sera requerido, significara altos costos de capital para la inversin en una planta de lixiviacin. Sin embargo, la disponibilidad y el precio razonable de bisulfuro y sus fuentes indican una economa razonable de extraccin y porque el H2S es regenerado desde sulfato usando bacteria. Los costos operativos consideran desintoxicacin, sin embargo, sera muy alto, porque una demanda qumica alta de oxgeno tambin sera necesaria. Una de las limitaciones parecera la aplicabilidad exclusiva de este proceso a minerales bio-oxidados, porque una fuente de in sulfato es requerida para la regeneracin del bisulfuro. Este proceso es reciclable, pero tericamente una oxidacin a sulfato tambin sera posible, aunque este tambin costara caro. Ninguna aplicacin a gran escala de este proceso es conocida por los autores. 2.7. Halgenos(3) El bromuro, el cloruro y el ioduro, especialmente cloruro, son conocidos como lixiviantes del oro. En el caso del bromuro y del cloruro, la economa de extraccin pareciera ser razonable. Sin embargo, el uso de un oxidante, usualmente el halgeno del haluro mismo, conducira altos costos de capitales de inversin para la prevencin de corrosin y el uso de un circuito cerrado. La
- 45 -
disponibilidad de los halgenos no es una restriccin, sin embargo, los haluros, siendo iones, no pueden ser tratados y podran requerir oxidacin electroqumica para reciclarlo. La ventaja del uso de haluros / halgenos podran dar la apariencia de su aplicabilidad universal a la mayora de tipos de mineral como es el caso de la cianuracin. El uso de cloruro es una tecnologa probada en la refinacin de oro. Sin embargo, ninguna corriente que las aplicaciones grandes de escala de plantas del blanqueador son conocidas.Sin embargo, actualmente no se sabe de su uso a gran escala en las plantas de lixiviacin. Comparado a la cianuracin, se ha publicado que la viabilidad econmica es similar, con respecto a los costos de operacin e inversin de capitales. Sin embargo, los autores esperan, que la regeneracin elctrica de los halgenos y el circuito cerrado necesario conduzcan a una menor economa favorable. El factor limitante aqu es, sin embargo, que los oxidantes usados son sobre todo el halgeno de los haluros mismos, que tienen valores lmite permisibles VLP (=TLV) mucho ms bajos que los del cianuro de hidrgeno. Es tambin posible que puedan formar compuestos orgnicos halogenados, los que son generalmente muy txicos incluso en concentraciones muy bajas. Por lo tanto, los haluros no se pueden considerar como alternativas favorables al cianuro. Las reacciones de los haluros con el oro son:
Au + 2 X AuX 2 + e
(R11) (R12)
Au + 4 X AuX 4 + 3 e
Donde: 2.8. Malonitrilo(3)
X = Cl, Br, I
El es un reactivo orgnico cuya frmula es C3H2N2. La cintica de disolucin del oro presenta una velocidad de reaccin bastante alta en comparacin a la cianuracin. Sin embargo, su alta toxicidad y su naturaleza explosiva no han permitido llevar a cabo ensayos ms all del nivel laboratorio. Las primeras pruebas con este reactivo publicadas se hicieron en 1977 donde se
- 46 -
obtuvieron recuperaciones del orden del 95% con una solucin 0.05% a las pocas horas de iniciado la prueba. Los otros nombres con los que se les conoce son: Ciano acetonitrilo, Di ciano metano, Dinitrilo Malonico. El efecto de varios oxidantes sobre la velocidad inicial de disolucin de oro con ciertos agentes lixiviantes determinadas con la tcnica de disco rotatorio, se muestra en el siguiente cuadro. (4)
Reactivo Tiourea Tiourea Cianuro Tiocianato Tiosulfato De yodo / yoduro de Oxidante Fe2(SO4)3 FDS O2 aire Fe2(SO4)3 CuSo4 Nal3 Tasa inic (mg / cm2h) 4,35 3,70 1,90 0,50 0,60 1,72 Condiciones experimentales (Init.) [TU] = 4 g / l, [Fe3 +] 0,2 g / l, pH 1,5, 25 C, 200 rpm. [TU] = 4 g / l, [FDS] = 1,0 g / l, pH 1,5, 25 C, 200 rpm. [NaCN] 1,5 g / l, pH 11, 25 C, 300 rpm. [NaSCN] = 9,0 g / l, [Fe3 +] = 1,0 g / l, pH 1,5, 25 C, 200 rpm. [Na2S2O3] = 0,1 M, [NH4OH] = 0,1 M, [CuSo4] = 0,0005 M, 25 C, 800 rpm. [I2] = 5 10-3M, [Nal] = 10-2Rpm M, 25 C, pH (natural) 4-6.0, 500. Referencias Li (2004) Li y Miller (2002) Kudryk y Kellogg (1954) Li y Miller (2002) Li y Miller (1998) Qi y Hiskey (1991)
3.
TECNOLOGIAS DE RECUPERACION DE ORO A PARTIR DE LICORES DE LIXIVIACION
3.1.
Carbn activado A diferencia de la extraccin por solventes, el mecanismo de adsorcin es
enteramente fsico, ligado a las propiedades superficiales del carbn, su porosidad y su estructura molecular. No tiene lugar un intercambio inico (p. ej. De un ion metlico absorbido con formacin de un chelate y cesin de un ion H+ que regenera cido de la fase acuosa), sino toda la molcula compleja de cianuro de oro (y/o plata) es atrada y retenida en los poros superficiales del carbn activado, sin ionizacin ni reaccin qumica.
- 47 -
Figura III-9: Carbn Activado(5)
La tecnologa del uso del carbn activado comprende 3 tcnicas a saber5) 3.1.1. Carbn en columna (CIC).- Aplicable a soluciones claras salientes de lixiviacin por percolacin en bateas o pilas, normalmente en varias etapas y en contracorriente. 3.1.2. Carbn en pulpa (CIP).- Aplicable a pulpas salientes de lixiviacin por agitacin. Se trata sin separacin slido/lquido, en tanques separados en varias etapas y en contracorriente. 3.1.3. Carbn en lixiviacin (CIL).- Consiste en adsorber el oro en carbn durante y no despus de la lixiviacin, llevndose a cabo la misma en los mismos estanques lixiviadores, pero moviendo el carbn en contracorriente con la pulpa del mineral. Una vez que el complejo Au-CN se ha cargado sobre el carbn activado, es necesario desorberlo para obtener una solucin ms concentrada la cual podr ser sometida a un proceso de electrodeposicin. Pero cuando se trabaja en pequea escala, es ms conveniente calcinar el carbn para obtener el oro metlico.
- 48 -
3.2.
Resinas de intercambio inico (Resina en Pulpa RIP). Poco despus de que las resinas de intercambio inico fueron usadas
comercialmente para
la purificacin de agua, los metalurgistas iniciaron la
investigacin de su posible uso en la recuperacin de metales a partir de soluciones diluidas. El trabajo pionero para la posible recuperacin de oro desde soluciones de cianuro fue realizado por Hussey en Salt Lake City una sucursal de la United States Bureau of Mines disponibles en el mercado. Hay inters renovado en la tecnologa RIP debido a dos ventajas potenciales sobre la tecnologa CIP:
1.
(6) .
Desde entonces, numerosas marcas estn
Los procesos de elusin y regeneracin para las resinas pueden ser ms simples que para el carbn activado, haciendo al RIP el favorito para plantas ms pequeas.
2.
El proceso RIP puede mantener su eficiencia cuando la materia orgnica (reactivos de flotacin, etc.) est presente en la pulpa.
Figura II-10. Carga del complejo Au-CN sobre Resina.[22]
Tal como en la Desorcin del carbn activado, la elucin del complejo AuCN desde las resinas es necesario para su posterior electrodeposicin. Las caractersticas del eluente son propias de cada tipo de resinas y de las recomendaciones del fabricante.
- 49 -
3.3.
Cementacin Como en cualquier otro proceso de cementacin, la qumica est basada en
el hecho de que el metal a ser recuperado (oro o plata) a partir de la solucin, es ms noble que el metal usado para la cementacin (Fe, Zn, Al). Mientras el oro es noble en comparacin a la mayora de metales, el hecho de estar presente en forma de complejo en la solucin impregnada ha limitado la seleccin de metales que puedan ser usados para efectuar la cementacin. El polvo de aluminio es preferentemente usado para precipitar oro a partir de soluciones que contienen el complejo Au-TU, pero tambin es usado para cementar oro desde soluciones de cianuro de electroplating en joyera. Mientras que el uso del polvo de zinc se ha generalizado en la cementacin desde soluciones cianuradas, este mtodo es conocido como Merril Crowe y la reaccin simplificada es:
2 Au(CN ) 2 + Zn 2 Au + Zn(CN ) 4
2
(R13)(7)
3.4.
Electrodeposicin La aplicacin de electrodeposicin est limitada a soluciones con
contenido de oro de por lo menos 80 ppm, esto debido a las bajsimas eficiencias de corriente que se obtienen con soluciones ms diluidas. Esto significa que las soluciones impregnadas que salen de los procesos de lixiviacin necesariamente deben ser concentradas en el contenido del complejo inico aurfero para poder electro depositar el oro. Esta concentracin se logra con la tecnologa del carbn activado o con las resinas de intercambio inico. Tanto los cationes como los aniones tambin se pueden concentrar mediante Membranas de Intercambio Inico. Esta tcnica se denomina Electrodilisis cuyo mecanismo se menciona en el Anexo III.
- 50 -
CAPITULO III
TIOUREACION
1. ANTECEDENTES
La Tiourea, CS(NH2)2 o simplemente TU, es una sustancia orgnica blanca, cristalina, soluble en agua y en alcohol, con punto de fusin de 180-182 C. A temperatura ambiente una solucin saturada de Tiourea tiene una concentracin cerca de 140 g/l. La Tiourea puede ser obtenida haciendo calentar Tiocianato de amonio (NH4SCN) concentrado en presencia de Disulfuro de carbono (CS2); esta reaccin es catalizada en presencia de almina.
Figura III-1: Estructura Qumica de la Tiourea(8)
Comercialmente, la Tiourea puede tambin ser obtenida por reaccin de gas sulfhdrico (H2S) con cianamida (CN NH2), de acuerdo a la reaccin siguiente:
H 2 S + NH 2 C N CS( NH 2 ) 2
(R14)
La Tiourea tiene varias aplicaciones en la industria qumica y metalrgica, por ejemplo, puede ser usada con eficiencia como aditivo orgnico a fin de mejorar las cualidades del cobre durante su refinacin electroltica; confiere al nylon resistencia al fuego; puede ser usada como inhibidor del blanqueado y amarillamiento de las lanas cuando son expuestas a la luz solar. La Tiourea (TU) es el lixiviante alternativo del cianuro que ha recibido mayor atencin por los investigadores interesados en la lixiviacin del oro y la
- 51 -
plata. Este inters reside principalmente en el hecho de que la Tiourea no es tan txica como el cianuro, adems su empleo en la lixiviacin de oro y plata estn asociadas a altas tasas de disolucin. De hecho se ha observado que las tasas inciales de disolucin de oro es cercano a diez veces ms que el proceso de cianuracin (Chen, 1980; Hiskey, 1981). La posibilidad de disolver oro empleando Tiourea fue reconocida por primera vez por Moir en 1906. En esa ocasin fueron establecidas las principales caractersticas del proceso, incluyndose la necesidad de trabajar en soluciones cidas, la presencia de un agente oxidante de Tiourea apropiado (ver pgina 57) y la formacin de un complejo de oro catinico, diferencindose por tanto del complejo aninico formado en el proceso convencional de cianuracin. Moir mostr que el oro disuelto en una solucin de Tiourea podra ser recuperado por precipitacin con zinc.(8) Sin embargo, los primeros reportes de la TU como agente complejante del oro datan de 1941 (Plaskin y Kozhukhova). Desde entonces innumerables investigaciones han sido dirigidas hacia el uso de este reactivo como ligante alternativo del cianuro para la lixiviacin de oro tal como mencionan los reportes de Kazakov, 1964; Tataru, 1968; Groenewald, 1975, 1976; Chen, Lung y Wang, 1980; Hiskey, 1981; Randol, 1981; Bodson, 1981; Van Lierde, Ollivier y Lesoille, 1982; Becker, Knothe y Lobel, 1983; Gabra, 1984; Potamianos y Kontapoulos, 1984; Hisshion y Waller, 1984; Simpson, Peterson y Sandberg, 1984; Schulze, 1984, 1985; Yen y Wyslouzil, 1985, 1986; Huyhua y Gundiler, 1986; Pesic y Wey, 1986; Deschenes, 1986, 1988; Brukard, 1993; Wan, 1995.(9,10) La semi-reaccin de la celda para la disolucin del oro en soluciones cidas de Tiourea fue dada por Kazakov (1964) como sigue:
Au + 2CS ( NH 2 ) 2 Au (CS ( NH 2 ) 2 ) 2 + e
+
E 0 = 0.38V ( SHE )
(R15)(11)
Esto muestra que la disolucin del oro requiere un oxidante apropiado, tal como perxido de hidrgeno, hierro frrico, oxgeno o aire, dixido del manganeso, etc. Sin embargo, la Tiourea por s misma es inestable bajo algunas
- 52 -
condiciones oxidantes, y se descompone tal como es descrito por las reacciones siguientes (Gupta, 1963), (10)
2 CS ( NH 2 ) 2 (CSNH 2 ( NH )) 2 + 2 H + + 2 e E 0 = 0.42V ( SHE ) (R16)
(CSNH 2 ( NH )) 2 CS( NH 2 ) 2 + Componentes Sulfnicos
(R17) (R18)
Componentes Sulfnicos = CN NH 2 + S0
La reaccin (R16) es una reaccin reversible entre la Tiourea (CS(NH2)2) y el Disulfuro Formamidina (NH2(NH)CSSC(NH)NH2). El Disulfuro
Formamidina (FDS) se descompone relativamente lento a subproductos de Tiourea (TU) bajo algunas condiciones y un componente sulfnico el cual puede rpidamente descomponerse en cianamida y sulfuro elemental. En soluciones ligeramente cidas a neutras, la Tiourea es relativamente estable (pK=4.3) pero en condiciones cidas muy rigurosas se hidroliza para formar urea y gas sulfhdrico de acuerdo a:
CS( NH 2 ) 2 + H 2 O CO( NH 2 ) 2 + H 2 S
(R19)(8)
La lixiviacin de minerales de oro con Tiourea normalmente es efectuada en valores de pH cercanos a 1.5. En presencia de un oxidante y valores de pH encima de 4.0, la Tiourea se oxida formando Disulfuro de Formamidina no protonado (FDS H6),
extremadamente inestable, conforme a la reaccin (R16) cuya representacin es:
2 CS( NH 2 ) 2 H 2 N C(: NH )S S(: NH )C NH 2 + 2 H + + 2 e
(R20)
En medio cido (pH debajo de 4.0), la Tiourea se oxida formando Disulfuro de Formamidina protonado (FDS H82+) o simplemente FDS tal como se muestra en la reaccin (R5). La formacin de FDS H82+ es un paso necesario para efectuar la disolucin de oro y por lo tanto no debe ser evitado. Sin embargo, el FDS H82+ es menos
- 53 -
estable que la Tiourea y, en condiciones de oxidacin muy severas, esta podra oxidares irreversiblemente a urea y sulfato, volviendo al proceso antieconmico.(8) En medio alcalino, el FDS H6 se descompone para formar azufre elemental, Tiourea y cianato de acuerdo a la reaccin siguiente:
(CS NH 2 ( NH )) 2 CN ( NH 2 ) + S + CS( NH 2 ) 2
(R21)
Tiourea
Disulfuro de Formamidina
no Protonado FDS H6
Disulfuro de Formamidina Protonado FDS H82+
Figura III-2: Representacin Qumica de la Tiourea y el Disulfuro (8) Formamidina, su producto inmediato de oxidacin.
2.
CINETICA Y MECANISMO DE LIXIVIACION
La Tiourea es un compuesto orgnico que forma complejos estables con
ciertos iones de metales de transicin. (12)
Men+ + kCS(NH 2 )2 {Me[CS(NH 2 )2 ]k }
n+
(R22)
En el caso del oro, la reaccin viene dada por (R6), que en forma simplificada viene a ser:
Au +
1 2+ FDS H 8 + TU 2
+ AuTU 2
(R23) puede decirse que el mecanismo de
De acuerdo a Lacconi y Macagno
(13)
oxidacin de la Tiourea sobre un electrodo de carbn vtreo es el siguiente:
(R24)
- 54 -
(R25)
(R26) La reaccin (R26), muestra como producto final el Disulfuro Formamidina protonado (FDS H8+) el cual conjuntamente con una molcula de Tiourea (TU) disuelven al oro tal como se muestra en la reaccin (R23). Para algunos investigadores, el mecanismo de reaccin para la oxidacin de Tiourea involucra etapas intermedias de formacin de radicales libres de TU
(13)
, tal como se ilustra a continuacin:
Finalmente se tiene:
TUTU
FDS + H + + e
(R27)
- 55 -
Este mecanismo es reversible. Existe un gran desequilibrio de voltaje asociado con la reaccin Redox TU/FDS, el cual se explica en trminos de reacciones adicionales dando como resultado la prdida de radicales. Se ha determinado que estas reacciones corresponden a reacciones radical-radicales:
TU + TUTU TU + FDS
2 TUTU 2 TU + FDS
(R28) (R29)
Cualquiera de las formas que sea el mecanismo correcto, es indudable que la disolucin de oro requiere la presencia de FDS, ya que ms que un catalizador este subproducto acta como oxidante en la reaccin de lixiviacin, el cual en trminos generales queda expresado por la siguiente reaccin:
2 Au + FDS + 2 TU + 2 H + 2 AuTU 2+
(R30)
3.
3.1.
EFECTO DE LAS DIFERENTES VARIABLES DE PROCESO
Efecto de la concentracin de Tiourea (TU) La siguiente figura muestra la dependencia de la velocidad de disolucin
del oro respecto a la concentracin de TU.
Figura III-3: Efecto de la [TU] sobre la disolucin del oro.(10)
- 56 -
Investigaciones previas han mostrado que la velocidad de reaccin en el proceso de disolucin de oro es de primer orden con respecto a la concentracin de TU, lo cual se demostrar experimentalmente en este trabajo. De la Figura III3, se puede notar que en ausencia de TU, la disolucin de oro no es posible tal como se esperaba al examinar la reaccin (R33), el cual muestra que el Disulfuro Formamidina mismo no genera la suficiente cantidad de TU para mantener la reaccin. Evidentemente es necesario la adicin de TU. 3.2. Efecto de la concentracin de Disulfuro Formamidina (FDS) El efecto de la concentracin de Disulfuro Formamidina (FDS) desde 0.5 g/l hasta 8.0 g/l es mostrado en la Figura III-4. En ella se puede notar que el efecto es significativo en el rango de concentracin desde 0.5 hasta 2.0 g/l, y se vuelve bastante insignificante cuando la concentracin del FDS es incrementada desde 2.0 hasta 8.0 g/l. Esto indica que cuando la concentracin del FDS est por encima de 2.0 g/l, la carga de esta sobre la superficie de oro es relativamente estable.
Figura III-4: Efecto de la [FDS] sobre la velocidad de disolucin del oro(10)
Algunos investigadores determinaron que la velocidad de reaccin es aproximadamente de medio orden respecto a la concentracin del FDS. (10)
- 57 -
La cintica de reaccin para la disolucin de oro en una solucin de Tiourea cida, est dada por la siguiente ecuacin:
dC Au ( I ) dt = k CTU C FDS
0.5
(E2)
Las evidencias experimentales sugieren que la velocidad de disolucin est controlada por la reaccin en la superficie. 3.3. Efecto de la naturaleza del agente oxidante Pruebas experimentales para comparar los efectos de ciertos oxidantes como sulfato frrico, aire y oxgeno sobre la velocidad de disolucin del oro mostraron que la recuperacin de oro fue levemente mayor cuando se us el sulfato frrico. (7) Otros investigadores (Deschenes y Ghali)
(8)
compararon los efectos del
perxido de hidrgeno, del sulfato frrico y del aire como oxidantes de la TU. Ellos determinaron que se obtenan mejores resultados con perxido de hidrgeno. Sin embargo al ser ste, un fuerte oxidante el consumo de Tiourea se vio incrementado, lo cual es una desventaja del proceso. Estos resultados nos llevan a la conclusin que el reactivo que mejor acta como oxidante es el Fe3+, el cual podra resultar ms ventajoso sobre todo si se trata de minerales pirticos. Para evitar un alto consumo de TU debido a una excesiva oxidacin, se suele adicionar a la solucin agentes reductores como SO2 o bisulfito de sodio (NaHSO3). Sin embargo esto no siempre produce los resultados esperados ya que la velocidad de disolucin de oro podra bajar drsticamente. La oxidacin de TU tambin se puede efectuar electroqumicamente, esto se logra induciendo cargas en una solucin cida de TU; sin embargo, esta operacin debe ser efectuada con absoluto cuidado ya que se debe procurar no sobrepasar el potencial de oxidacin de TU, el cual queda establecido por el
- 58 -
Diagrama de Pourbaix para el sistema agua-TU tal como se muestra en la figura siguiente:
Figura III-5: Diagrama Eh x pH para el sistema TU-H2O(8)
3.4.
Efecto del pH de la solucin El valor del pH es un parmetro crtico en la lixiviacin con Tiourea y se
ha determinado que en valores por encima de 4.0 la Tiourea se descompone irreversiblemente lo cual hace antieconmico el proceso.
Figura III-6: Efecto del pH sobre la velocidad de disolucin de oro
(10)
La Figura III-6 est relacionado a pruebas realizadas con disco rotatorio de oro con valores de pH entre 1.0 y 3.0 donde se determin que la velocidad inicial
- 59 -
de disolucin del oro en este rango es independiente del valor de pH y adems se establece un equilibrio entre la TU y el FDS, esto indica que la etapa que limita la velocidad de disolucin de oro cuando se usa como agente oxidante el FDS no implica el in hidrgeno. Sin embargo cuando se realizaron pruebas con sulfuros aurferos, se determin que la lixiviacin de oro procede con bastante eficiencia a valores de pH por debajo de 2. En valores superiores la velocidad de disolucin decae en forma inversamente proporcional al valor de pH. La siguiente figura muestra este comportamiento:
Figura III-7: Extraccin de Oro como funcin del pH de la solucin
(7)
3.5.
Efecto del Potencial REDOX. Un estudio realizado por un equipo de investigadores quienes efectuaron
mediciones voltamperomtricas asistidas con espectrometra IR permiti identificar los productos de oxidacin y reduccin en las reacciones de disolucin de oro con TU cida. (14) Se pudo determinar que la oxidacin de TU empieza casi simultneamente con la disolucin de oro a 0.15V respecto al electrodo de referencia de hidrgeno (SHE). Adems, se encontr que la electro-disolucin de oro en soluciones cidas que contienen TU procede con 100% de eficiencia para Eh < 0.3V (SHE),
- 60 -
mientras que para Eh > 0.3V, la reaccin es acompaada por una electro-oxidacin de TU a FDS, azufre y trazas de sulfato. El Diagrama de Pourbaix (Eh vs pH) muestra las especies existentes para el sistema TU-Au-H2O8)
Figura III-8: Diagrama de Pourbaix para H2O-TU-Au. [TU]=0.1M, [Au]=10-6M
(8)
Segn los espectros FTIRRAS (14) (Fourier Transform Infrared ReflectionAbsorption Spectroscopy), la electro-oxidacin de TU y la electro-disolucin de oro son procesos simultneos que en potenciales debajo de 0.9V, produce especies solubles de FDS y Au(TU)2+, verificndose de este modo la reaccin (R15). A partir de 1.2V, la formacin de iones sulfato y bisulfato debido a la oxidacin de TU se acenta, esto debido a que en este potencial toma lugar la formacin de oxgeno a partir de la electrlisis del agua; esto tambin da lugar a la formacin de especies de hidrxido urico. Para Eh 1.3V, la oxidacin de TU, origina la formacin de especies CN (cianamidas) y dixido de carbono promovido por las especies OH/O. Para E 1.5V, la TU se oxida completamente a especies de sulfato y cianamidas. Los parmetros involucrados en la electro-oxidacin de TU y oro en soluciones cidas se describen en detalle en la pgina 64.
- 61 -
3.6.
Efecto de la temperatura Investigaciones previas(7,10) han mostrado que el incremento de la
temperatura de operacin, acelera la disolucin de oro en una solucin de TU cida. Sin embargo, este efecto beneficioso tiene la desventaja de que ocasiona un mayor consumo de TU por la degradacin que este sufre a altas temperaturas.
Figura III-9: Efecto de la temperatura sobre el tiempo de lixiviacin.(10)
Segn el grfico anterior obtenido para una solucin compuesta por 4.0 g/l de TU, 2.0 g/l de FDS y pH = 1.5, y haciendo uso de la ecuacin de Arrhenius, la Energa de Activacin aparente es 10.4 kcal/mol (43.4 kJ/mol)(10). Otras pruebas de Tioureacin efectuadas en el rango de temperatura entre 2 60 C (para 15 g/l de TU, 6 g/l de Fe2(SO4)3, H2SO4 0.35N y radio slido/lquido 30 %), mostraron que la mayores extracciones (95 %) se obtuvieron en el rango de 25 35 C en 60 minutos(7). A una temperatura de 60 C, la TU comienza a descomponerse resultando en una menor extraccin de oro (60 %). En el rango de temperatura entre 2-35 C, la energa de activacin aparente encontrada fue 8.538 KJ/mol (2.039 Kcal/mol). Los bajos valores de energa de activacin encontrada en las dos pruebas por distintos investigadores, sugieren que la velocidad de disolucin est controlada por la reaccin en la superficie, es decir est controlada por difusin.
- 62 -
3.7.
Efecto de la velocidad de agitacin Dado que la influencia de la temperatura determina que la energa de
activacin se site dentro del rango en el cual el proceso es controlado por un fenmeno fsico, los investigadores tuvieron la necesidad de estudiar los efectos de la velocidad de agitacin sobre la velocidad de reaccin.
Figura III-10: Efecto de la Velocidad de Agitacin sobre la velocidad de reaccin(7)
Una prueba realizada con una solucin compuesta de TU 15 g/l, Fe2(SO4)3 6 g/l, H2SO4 0.35N y radio slido / lquido 30 % a 25 C, en un rango de 0 1200 rpm, mostr que la velocidad de reaccin es independiente de la difusin de la solucin bulk en tanto la velocidad de agitacin sea mantenida en un valor 200 rpm(7). Los valores de energa de activacin obtenidos indicaron que hasta 1200 rpm, la velocidad de reaccin est limitada por un fenmeno de transporte. Esto indica que la etapa limitante de la velocidad no es controlada qumicamente. 3.8. Efecto del radio slido/liquido Investigaciones realizadas con las mismas concentraciones de reactivos de la solucin anterior, en un rango de slido/lquido de 10 60 %, mostraron que se pudo alcanzar una extraccin de oro del 94 % cuando el radio slido/lquido fue
- 63 -
de 50%. Recuperaciones menores se obtienen al aumentar la relacin slido/lquido.(7)
Figura III-11: Efecto del porcentaje de slidos sobre la velocidad de reaccin
(7)
3.9.
Efecto de la concentracin inicial de cido Pruebas diversas efectuadas con soluciones de igual concentracin de TU
variando las concentraciones iniciales de cido desde 0.035N hasta 0.35N, se encontr que el aumento de la concentracin inicial de cido incrementa la velocidad de extraccin de oro.(7) Se determin que el pH de las soluciones de lixiviacin aumenta gradualmente segn procede la reaccin. El incremento de pH es menor cuanto mayor es la concentracin inicial de cido. Estos investigadores llegaron a la conclusin de que la velocidad ptima de reaccin se efecta cuando la concentracin de cido es de 0.35N.
Figura III-12: Efecto de la concentracin inicial de cido sulfrico
(7)
- 64 -
4.
ELECTRO-OXIDACION DE TIOUREA Y ORO
Tal como se mencion anteriormente, antes de iniciar el proceso de
lixiviacin de oro con TU, para que se pueda llevar a cabo la disolucin del metal, es preciso oxidar previamente una parte del reactivo lixiviante para producir FDS (Disulfuro Formamidina). Esto se logra mediante la adicin de un agente oxidante o electro-qumicamente. Un estudio referido a la electro-oxidacin de Tiourea sobre un electrodo de carbn vtreo, muestra que conversin de TU se inicia a potenciales por encima de 300 mV referido al Electrodo de Referencia de Hidrgeno(12)
Figura III-13: Oxidacin de TU sobre electrodo de carbn vtreo (SHE)(12).
Como mtodo operatorio, esta Tesis contempla la electro-oxidacin de la TU sobre carbn (usado en electro-erosin) previa a la etapa de disolucin de oro. 4.1. Parmetros de control En general la lixiviacin de oro con solucin cida de TU, requiere un riguroso control de pH y del potencial redox. Estos controles se deben efectuar desde la etapa de conversin (oxidacin) de TU a FDS estableciendo ambos parmetros dentro de los lmites establecidos por el diagrama de Pourbaix tal
- 65 -
como se mostr en la Figura III-5 para la oxidacin y en la Figura III-8 para la lixiviacin. A continuacin se explica brevemente el efecto del pH y del potencial redox en la electro-oxidacin de TU. 4.1.1. pH Como se puede deducir de la Figura III-5, el pH mximo de operacin en la oxidacin de TU debe ser igual a 4.0 para mantener la produccin de FDS H82+ en un nivel ptimo y sin obtener productos no deseados. Por cuestiones prcticas la mayora de autores coinciden en recomendar que el pH de trabajo debiera estar en el rango de 1.5 a 2.5 para poder controlar con mayor facilidad un incremento sbito de este parmetro como consecuencia de las reacciones colaterales durante la lixiviacin. En este sentido, durante una operacin a escala industrial, es recomendable automatizar el proceso instalando un controlador de pH el cual permitir mantener la concentracin de cido dentro de los niveles recomendables. 4.1.2. Potencial REDOX Como se pudo notar en la Figura III-13, para garantizar una alta eficiencia de disolucin de oro, es necesario mantener el potencial de oxidacin por encima de 0.3V respecto al Electrodo Normal de Hidrgeno, o 0.095V respecto al Electrodo de Ag/AgCl, KCl (3.5M). Aunque debe tenerse en cuenta que este potencial de oxidacin depende del tipo de material del que est constituido el electrodo donde se lleva a cabo la oxidacin. Una forma de evaluar la magnitud del ptimo potencial Redox de celda, es realizar balances de masas en ciertos intervalos de tiempo para determinar las condiciones de oxidacin para producir la cantidad adecuada de FDS sin llegar a los extremos donde se inicia la descomposicin irreversible de la TU. A escala industrial, si la oxidacin se realiza con un agente qumico, es recomendable disponer de un stock de reductor adecuado para minimizar los riesgos de una oxidacin excesiva de TU. Los agentes oxidantes o reductores se
- 66 -
podrn dosificar instalando un controlador de Potencial Redox (ORP siglas en ingls). 4.2. Curvas voltamperomtricas Las curvas voltamperomtricas son curvas i-E (corriente-voltaje) que nos muestra la magnitud de la corriente para un correspondiente voltaje durante el desarrollo de una reaccin oxido-reduccin. Los picos de corriente en estas curvas representan ya sea la oxidacin o reduccin de los reactantes. La oxidacin se lleva a cabo en el rango de corrientes positivas, mientras que la reduccin en el rango de corrientes negativas. La forma de estas curvas depende de la concentracin de los anolitos, de la velocidad de barrido del voltamperograma y de la naturaleza del electrodo usado como nodo. En nuestro caso, los picos de estas curvas, nos dan una clara idea de las magnitudes de los potenciales de oxidacin de TU y reduccin de FDS en diferentes tipos de electrodos. A continuacin, se muestran algunas curvas tpicas de polarizacin de la oxidacin de TU y reduccin de FDS sobre diferentes materiales.
Figura III-14: Oxidacin de TU y reduccin de FDS sobre un electrodo de Pt (13)
- 67 -
Figura III-15: Oxidacin de TU y reduccin de FDS en un electrodo de carbn vtreo (13)
En los dos grficos anteriores, el pico A representa el valor de la corriente andica relacionado al potencial mximo de oxidacin. A partir de este punto si se incremente el valor del potencial de oxidacin, la reaccin se vuelve irreversible originndose especies diferentes al FDS los cuales se depositan sobre el electrodo ocasionando una cada de la corriente andica debido al fenmeno de pasivacin. En los mismos grficos, C representa el valor del corriente catdica relacionado al voltaje a partir del cual se inicia la reduccin de FDS a TU. Del mismo modo, se pueden ilustrar las curvas i-E para la oxidacin de oro y reduccin del complejo AuTU2+ referido a cada tipo de electrodo; sin embargo para lograr esto habra que usar un electrodo inerte o de algn metal noble que resista el ataque de cidos de tal modo que se pueda oxidar la TU. A continuacin se muestra un voltamperograma de la oxidacin de la TU y del oro, adems de la reduccin del complejo Au(TU)2+ sobre un electrodo de oro. El pico A2 representa la disolucin del oro, el pico A3, la oxidacin de la TU y el pico C2 representa la reduccin del complejo Au-TU y del FDS.
- 68 -
Figura III-16: Curva i-E de la oxidacin de TU y Oro y reduccin de Au(TU)2+ (13)
4.3.
Estabilidad del complejo Oro-Tiourea (Au-TU) La estabilidad del complejo Au-TU depende sobre todo del potencial
Redox de reaccin en el seno de la solucin. Las curvas voltamperomtricas muestran el rango de potencial dentro del cual el complejo Au-TU es estable en determinadas concentraciones de anolitos. Algunos investigadores
(14)
han determinado que el complejo Au-TU es
estable por encima de 0.15 V (NHE) reducindose por debajo de este potencial. Sin embargo, tambin podemos recurrir al uso del diagrama de Pourbaix para determinar las zonas de valores de pH y Potencial donde el complejo Au-TU es estable electro-qumicamente.
5.
5.1.
RECUPERACION DE ORO DE LICORES DE TIOUREACION
Carbn activado La precipitacin de oro sobre carbn activado a partir de soluciones cidas
de TU ha sido estudiado en detalle por varios investigadores. Sin embargo, este
- 69 -
mtodo presenta serias dificultades ya que la TU tiene afinidad por el carbn, en consecuencia reduce el espacio para la deposicin del complejo AuTU2+, por lo que es necesario hacer uso de una mayor cantidad de carbn y como consecuencia de ello el consumo de TU aumenta considerablemente. La otra dificultad que se presenta es en la desorcin del complejo AuTU2+, ya que la extrema afinidad de este catin por el carbn requiere de mayores tiempos de operacin. Sin embargo, en la medida que se pueda establecer y mantener las condiciones de operacin ptimas, es posible obtener resultados aceptables en la adsorcin del complejo de AuTU2+. 5.2. Resinas de intercambio inico. El uso de las resinas de intercambio inico para la adsorcin de oro est limitado al costo y duracin de este material adsorbente. Existen a la fecha algunos tipos de resinas de intercambio inico para el proceso de Tioureacin, entre las que podemos mencionar los siguientes tipos: Dowex, Bio-Rad, Bayer Lewatit y Duolite. 5.3. Cementacin con polvo de aluminio. El proceso de precipitacin de oro con aluminio en polvo a partir de soluciones impregnadas de Tioureacin, ha sido ampliamente estudiado. Quiz despus de la electrodeposicin directa, este mtodo sea el ms aconsejable debido a su alta eficiencia en condiciones de operacin ptimas. La reaccin de reduccin del complejo AuTU2+ con aluminio en polvo es: (R31) La principal desventaja de este mtodo es que la cintica de reduccin del complejo de AuTU2+ es bastante lento. La ventaja es que permite una mayor reutilizacin de la TU ya que se logra una mayor regeneracin de este reactivo. Actualmente se est probando sales de flor para acelerar la precipitacin de oro a
- 70 -
partir de complejos de AuTU2+ en solucin. Los resultados hasta el momento han sido alentadores. 5.4. Electrodeposicin.(15) Debido a que la eficiencia de corriente en las reacciones de electrodeposicin disminuye a medida que la concentracin de iones metlicos disminuye, es aconsejable llevar a cabo la operacin con soluciones cuya concentracin de oro sea por lo menos 10 ppm o 5.08x10-5 M como AuTU2+. Dado que en la mayora de los casos, la lixiviacin se lleva a cabo con minerales aurferos de baja ley, entonces se obtendr soluciones impregnadas de bajo valor en oro. Por lo tanto para elevar la concentracin de oro en solucin es necesario proceder previamente con una adsorcin de la solucin impregnada ya sea con carbn activado o con resinas de intercambio inico y posteriormente someter a una elucin para obtener una solucin enriquecida con alto contenido aurfero que permita mantener una eficiencia de corriente aceptable durante la
electrodeposicin de oro. Sin embargo, es posible obtener soluciones impregnadas con alto contenido de oro disuelto si se lixivia concentrados aurferos que permitan obtener electrolitos de ms de 10 ppm en oro. Este es el caso de este tema de investigacin. 5.5. Extraccin con solvente P507(16) Se investig la eficiencia del compuesto orgnico P507 (2-Etilhexil 2Etilhexil Fosfato), en la extraccin de oro a partir de soluciones cidas cargadas con AuTU2+. El oro fue extrado con P507 de 1.65 mol/L de concentracin en kerosene bajo las siguientes condiciones de operacin: H2SO4 0.335 mol/L y relacin de fases 1:1, y tiempo de contacto de 5 min. El porcentaje de extraccin en una sola etapa fue de 99.8%. Cuando 50 g/L de Na2SO3 fue usado para la extraccin, el porcentaje de extraccin en una sola etapa alcanzado fue 82.45%, y el oro fue separado de los materiales ferrosos por una operacin de extraccin.
- 71 -
C4H9CHCH2 C2H5
P
C4H9CHCH2O C2H5
Figura III-17: Estructura molecular del P507
OH
5.6.
Extraccin slido-liquido con alfalfa(17) Los experimentos batch de laboratorio sealan que la alfalfa liga al oro
(III) rpidamente y en un modo independiente del pH. Los experimentos de la capacidad de ligamiento de oro (III) realizados con las races y brotes de la alfalfa han mostrado los siguientes resultados: 40.9 el oro mg por gramo de tejidos finos de brotes; 18.7 el oro mg por gramo de tejidos finos de raz. Se pudo recuperar hasta 99.1 % del metal ligado de oro tratada con 0.2 M TU cida. Sorprendentemente descubrimos que el oro capturado vir a color prpura, queriendo decir que el oro (III) haba sido reducido al oro (0). Esto fue confirmado por un anlisis microscpico de transmitancia electrnica (TEM). Adems, los experimentos en columna fueron realizados con alfalfa inmovilizada en slice para determinar la capacidad de aglutinacin del oro (III) bajo condiciones de flujo. Esto a su vez podra constituir una tecnologa innovadora de prevencin de contaminacin del medio ambiente e impedir el uso de productos qumicos nocivos que podran contaminar aguas subterrneas.
6.
6.1.
ELECTRODEPOSICION DIRECTA
Generalidades Respecto a la electrodeposicin de oro a partir de soluciones cidas de TU,
se han realizado pocas investigaciones. La mayor parte fueron efectuados durante los aos 70 y los aos 80 y se refiri a la extraccin electroltica del oro en celdas de ctodos tridimensionales (Maslii y otros., 1973; Maslii y otros., 1976;
- 72 -
Varentsov y Belyakova, 1983; Zamyatin y otros., 1983; Zamyatin y Bek, 1984). Las extracciones de oro alrededor del 98% fueron alcanzadas en una planta experimental. Tambin fue divulgado que una gota en la concentracin de TU caus un aumento en la eficiencia de corriente y en la tasa de extraccin de plata. Dupuis y Ghali (1989) investigaron la electrodeposicin directa de oro a partir de los licores de lixiviacin de TU que se fluidifica a travs de una celda, con un ctodo de carbn en forma de filtro y un nodo de plomo separados por una membrana catinica. Un 99% de recuperacin de oro y una eficiencia de corriente menor que 10% fueron reportados. Adems, un aumento en intensidad de corriente caus una disminucin de la eficiencia de corriente, aunque la efectividad de la electrlisis fue incrementada hasta cierto lmite. Conradie y otros. (1994) demostraron que el oro se podra retirar de resinas de intercambio inico con soluciones cidas de TU y electro-depositadas en un ctodo de malla de acero inoxidable con eficiencias de corriente cerca de 100%, a bajas densidades de corriente y concentraciones de oro alrededor 1400 ppm. Todos los investigadores mencionados arriba, concluyeron que la electrodeposicin de oro a partir de soluciones de TU, consiste en una reaccin que implica la reduccin del complejo Au-TU y la formacin de molculas de TU a partir de la reduccin de molculas de FDS, los cuales van acompaados por la reaccin de evolucin de hidrgeno. Estas reacciones vienen expresadas por:
Au(CS( NH 2 ) 2 ) 2 + e Au + 2CS( NH 2 ) 2
(CSNH 2 ( NH )) 2 + 2 H + + 2 e 2 CS( NH 2 ) 2 2 H + + 2 e H 2
6.2.
E 0 = 0.38V ( SHE) (R15)
E 0 = 0.42V ( SHE)
(R16) (R32)
0.0V ( SHE)
Efectos de los diferentes parmetros de operacin Para tratar sobre este tema, tomaremos como referencia a la investigacin
realizada hace pocos aos por los doctores C.M. Jurez y A. J. B. Dutra referido a la Electrodeposicin de Oro a partir de soluciones de TU. (15)
- 73 -
En esta investigacin se determin que de los varios mecanismos de reaccin de las reacciones del electrodo descritas por Paunovic (1967), los que mejor satisfacen los resultados experimentales son aquellos que involucran la adsorcin de especies electro-activas y un establecimiento lento del equilibrio de adsorcin antes de la reaccin electroqumica, de acuerdo al esquema cintico siguiente: (R33) (R34)
(R35)
Como las especies adsorbidas son reducidas ms fcilmente que las especies en solucin, esto quiere decir que la reduccin del complejo AuTU2+, se lleva a cabo en dos etapas, ocurriendo primero la reaccin R34 y finalmente la reaccin R35. 6.2.1. Concentracin de Tiourea libre En un experimento sobre un electrodo de oro inmerso en una solucin de cido sulfrico 0.1M, pudo demostrarse que la presencia de TU desplaza la reaccin de evolucin de hidrgeno a potenciales ms negativos (mas catdicos), aproximadamente 200mV. A concentraciones de TU mayores que 0.0131M, ocurre una disminucin progresiva de la densidad de corriente en alrededor de 350mV, lo cual indica que la adsorcin de TU podra cubrir parcialmente la superficie del electrodo. En otro experimento sobre un electrodo (del mismo tipo que el del anterior experimento) inmerso en una solucin compuesta por 0.1M cido sulfrico, 5.08x10-4M FDS y 5.08x10-4 M Au-TU y concentraciones de TU de: (a) 0.0131M y (b) 0.131M, (Figura III-18), pudo observarse que un incremento en la concentracin de TU desplaza la curva a potenciales mas catdicos impidiendo la reduccin de oro y FDS. En este caso, la cada de densidad de corriente es muy alta, posiblemente debido a la generacin de TU en la superficie del electrodo (el
- 74 -
cual acta como aislante impidiendo mayor depsito de oro) por las reacciones R15 y R16.
Figura III-18: Influencia de la [TU] sobre el potencial de reduccin
(15)
En ausencia de FDS, la influencia de la TU en la curva de polarizacin catdica para una solucin 0.1M de cido sulfrico y 5.08x10-4M del complejo Au-TU es mostrado en la siguiente figura.
(a) (b) (c) (d)
0.0131M TU 0.131M TU 0.262M TU 0.525M TU
Figura III-19: Influencia de [TU] sobre el potencial catdico
(15)
- 75 -
En esta se puede observar que un incremento en la concentracin de TU desplaza la curva a potenciales ms catdicos, impidiendo la reduccin de oro. Como la concentracin de TU es incrementada, el equilibrio de reaccin R15 es desviado hacia la izquierda, desplazando su potencial de equilibrio hacia valores ms pequeos. Adems, la adsorcin de TU que bloquea la superficie del electrodo, tambin contribuye al desplazamiento de estas curvas. Ya que la concentracin de TU no influye notablemente en la pasivacin, sta podra deberse en su mayor parte por la TU producida junto con el oro metlico en la superficie del electrodo por la reaccin R15. 6.2.2. Concentracin de Disulfuro Formamidina La influencia de la concentracin de FDS sobre la curva de polarizacin catdica para un electrodo de oro en una solucin 0.1M de cido sulfrico, 0.131M TU y 5.08x10-4M complejo Au-TU es mostrado en la Figura III-20. Este indica que un incremento en la concentracin de FDS, en presencia del complejo Au-TU, desplaza la curva de polarizacin a potenciales ms catdicos y est precedido por un pico muy alto de densidad de corriente que lo delimita, aunque la cada de corriente despus de este pico no cambie significativamente.
(a) 5.08 x 10-4 M FDS (b) 1.52 x 10-3 M FDS
Figura III-20: Influencia de [FDS] sobre el potencial catdico
(15)
- 76 -
Se puede afirmar que la presencia de una mnima cantidad de FDS minimiza la pasivacin del ctodo ya que la capa de TU (formada a partir de la reduccin del complejo Au-TU) es nuevamente oxidada por efecto del FDS circundante. Sin embargo hay que tener bastante cuidado con un exceso ya que por estar en medio cido, podra promoverse la protonacin del FDS el cul se reducira sobre el ctodo formando una pelcula de TU que actuara como aislante. 6.2.3. Concentracin del complejo Au-TU La influencia de la concentracin del complejo Au-TU sobre la curva de polarizacin catdica para un electrodo de oro en una solucin 0.1M de cido sulfrico y 0.0131M de TU es mostrada en la Figura III-21. Un pico limitante de densidad de corriente en -170mV, seguido por una pasivacin del proceso se hace evidente. Como la concentracin de TU en solucin no es lo suficientemente alta para producir dicha pasivacin, tal como se muestra en la Figura III-19 (curva a), esto puede ser atribuido primordialmente a la adsorcin de especies producidas por la reaccin R15. La forma de las curvas de polarizacin indican que la reduccin del complejo Au-TU es controlado por una transferencia de carga para potenciales ms altos que 70 mV (curva d) y por transporte de masa para potenciales ms catdicos que -50mV.
(a) (b) (c) (d)
5.08x10-5 M 1.02x10-4 M 2.03x10-4 M 5.08x10-4 M
Au-TU Au-TU Au-TU Au-TU
Figura III-21: Influencia de [AuTU2+] sobre el potencial catdico
(15)
- 77 -
6.2.4. Temperatura La movilidad inica de los electrolitos es directamente proporcional al aumento de temperatura.
Figura III-22: Influencia de la Temperatura sobre el potencial catdico
(15)
En la Figura III-22 se muestra la reduccin del complejo AuTU2+ sobre un electrodo de oro. Un mayor nivel de densidad de corriente y una reduccin de la pasivacin es observado a temperaturas ms elevadas. Adems, la disminucin de la densidad de corriente observado, para las concentraciones de TU alrededor de 0.0131M, en-300mV se hace ms pequeo, lo que puede ser atribuido a un incremento en la tasa de descomposicin de la TU y/o a una disminucin de la adsorcin de la TU sobre la superficie del electrodo a temperaturas ms elevadas. 6.2.5. Densidad de corriente. La densidad de corriente tiene un efecto inversamente proporcional sobre la eficiencia de corriente catdica en la, es decir la eficiencia de corriente decrece con un incremento de densidad de corriente. La evolucin de hidrgeno es la reaccin principal a ms altas densidades de corriente, pero la reduccin del FDS a TU tambin contribuye a aminorar la eficiencia de corriente ya que contribuye a la pasivacin del ctodo debido a la formacin de una pelcula aislante de TU.
- 78 -
CAPITULO IV ESTUDIO EXPERIMENTAL
Tomando como referencia algunos artculos cientficos a los que se hace referencia en la bibliografa y teniendo en cuenta la naturaleza del presente trabajo, en este captulo se describe los parmetros que afectan directamente en el proceso de tioureacin, as como la metodologa usada para estos anlisis los equipos usados y la instalacin de los mismos. Sin embargo, por cuestiones prcticas y con la finalidad de simplificar la parte experimental, las pruebas de esta investigacin estn orientadas especficamente a determinar la influencia de los parmetros que ms influyen en el proceso de lixiviacin con Tiourea.
1.
VARIABLES DE ESTUDIO
La recuperacin de oro a partir de minerales aurferos por el mtodo
propuesto consta de tres etapas, a saber: 1. Oxidacin de Tiourea para producir Disulfuro Formamidina 2. Lixiviacin del concentrado aurfero con la mezcla TU-FDS 3. Electrodeposicin de oro a partir de la solucin impregnada producida en la lixiviacin. Este trabajo se centr en el estudi de los siguientes parmetros: Potencial de oxidacin reversible de TU sobre un nodo de grafito. Grado de conversin de TU a FDS en funcin del tiempo de electrooxidacin Influencia de la concentracin inicial de TU libre sobre la lixiviacin de oro. Influencia de la concentracin inicial de FDS sobre la lixiviacin.
- 79 -
Influencia del pH de la solucin lixiviante sobre el grado de disolucin de oro.
No se estudian los otros parmetros de control (densidad de pulpa, relacin slido/lquido, variacin de la concentracin de cido, variacin del potencial redox, velocidad de agitacin, temperatura) que afectan la lixiviacin ya que basados en experiencias adquiridas y en resultados de otros investigadores, estos se operan en condiciones ptimas. Finalmente, la etapa de electrodeposicin se realiza en condiciones ptimas en cuando se refiere a los parmetros de operacin (pH, tiempo de electrodeposicin, corriente y voltaje de celda). No se estudia la eficiencia de transferencia de carga a travs de las membranas ya que no se hace un estudio comparativo entre membranas, solo se determina la eficiencia de una membrana en particular.
2.
2.1.
RECURSOS EMPLEADOS
Equipos 1). Rectificador de corriente con selector de voltaje (0.0-10.0V). 2). Agitador. 3). 02 Potencimetros (uno para medir pH y otro para medir ORP). 4). 03 Multitester (uno para medir corriente y dos para medir voltaje). 5). Celda electroltica de tres compartimentos separados por membranas de intercambio inico (Fotografa IV-11). 6). Varilla de grafito (0.9x14.0 cmxcm = xL). nodo. Oxidacin de TU. 7). Tubo de grafito de 7x0.7x4.4 cmxcmxcm: Ctodo. Oxidacin de TU. 8). Alambre de plomo de 0.5 cm dimetro. nodo. (Electrodeposicin). 9). Lana de acero. Ctodo. Electrodeposicin. 10). Electrodo de Referencia de Ag/AgCl en KCl 3.5M. 11). Electrodo de Vidrio para medicin de pH. 12). Balanza analtica de 04 decimales de precisin. 13). 2 Mini-bombas de 24 voltios.
- 80 -
2.2.
Materiales 1). Bureta graduada de 10 ml con escala de 0.02 ml 2). Pipeta de 5 ml y 10 ml. 3). Piceta 4). Beaker de 10 ml y 25 ml 5). Matraz de 250 ml 6). Bageta 7). Embudo kitasato 8). Papel y tela de polipropileno para filtracin. 9). Soporte universal 10). Frascos goteros 11). Frascos para muestras 12). 01 beaker de 1.2 L / Celda Andica (Curva Voltamperomtrica). 13). 01 beaker de 600 mL / Celda catdica (Curva Voltamperomtrica) 14). 01 recipiente de 3.2 L para agitacin de anolito (Oxidacin de TU). 15). 01 recipiente de 0.6 L para catolito (Oxidacin de Tiourea). 16). 01 recipiente de 5 L para pruebas de lixiviacin 17). 01 recipiente de Acero Inoxidable de 8.5 L. (Lixiviacin final) 18). 01 Celda de Electrodeposicin conformado por un recipiente central de 1.5 L. y dos compartimentos adyacentes separados con membranas aninica y catinica para el anolito y catolito respectivamente. 19). Tubo de vidrio en forma de U 20). Membrana Catinica tipo MC-3470 Sybron Chemicals Inc. 21). Membrana Aninica tipo MA-3475 Sybron Chemicals Inc.
2.3.
Reactivos 1). Tiourea Q.P. (99.34%). 2). cido sulfrico tcnico (95%). 3). Yodato de Potasio Q.P. (99.7%). 4). Almidn Q.P. 5). Polvo de zinc
- 81 -
3.
3.1.
DESARROLLO EXPERIMENTAL
DATOS
3.1.1. Caracterizacin del mineral El mineral estudiado es un concentrado sulfuro aurfero obtenido por concentracin gravimtrica de arenas aluviales del ro Tablachaca (Ancash). Esta mesa gravimtrica est especialmente diseada para concentrar oro de granulometra muy fina y gruesa. A simple vista se poda notar una apreciable cantidad de oro en estado libre; adems se poda notar abundante cantidad de material sulfurado en forma de pirita. El peso total del concentrado fue 27 Kg de los cuales se us 26 kg en todas las pruebas de lixiviacin. El anlisis mineralgico y granulomtrico realizado de este concentrado se muestra en las tablas siguientes. A. Anlisis mineralgico Efectuando un muestreo riguroso al concentrado aurfero, se obtuvo una muestra de 0.5 kg cuyo anlisis qumico se muestra en la siguiente tabla.
Tabla IV-1. Composicin
mineralgica del concentrado aurfero
Elemento Azufre total (S) Arsnico (As) Antimonio (Sb) Cobre (Cu) Fierro (Fe) Oro (Au) Plata (Ag)
Concentracin 18,91% 4,22% 0,23% 0,85% 28,54% 337,24 g/TM 52,36 g/TM
La tabla anterior, muestra los principales elementos que confieren refractoriedad a un mineral. Los principales elementos que consumen una considerable cantidad de Cianuro en el Proceso de Cianuracin de minerales
- 82 -
aurferos son azufre (S), arsnico (As), cobre (Cu) y en menor grado el fierro (Fe). Los efectos de estos elementos sobre la lixiviacin se pueden deducir a partir de un anlisis qumico de los residuos finales.
B.
Anlisis granulomtrico Todo el concentrado fue sometido a una molienda en seco para poder
obtener una mejor liberacin de valores. El anlisis granulomtrico se muestra a continuacin:
Tabla IV-2. Granulometra
del concentrado molido
Malla + 120 Mesh + 140 Mesh - 140 Mesh
Porcentaje 12,40% 26,60% 61,00%
La experiencia en el proceso de metalurgia de oro, recomienda que el tamao mximo de una partcula de oro libre debiera ser menor de 147 micras (Malla -100) para que pueda ser disuelta con efectividad dentro de las 24 horas de lixiviacin. 3.1.2. Experimentacin Se ha dicho que para que ocurra la disolucin de oro con una solucin de TU cida, es imprescindible que previamente se lleve a cabo la formacin de un subproducto catinico (Disulfuro Formamidina) a partir de la oxidacin de la TU. Para obtener este compuesto catinico hay dos opciones: (1) Adicin de un agente oxidante (H2O2, Fe2(SO4)3, KmnO4, etc.), (2) oxidacin electroqumica. La
metodologa de esta Tesis contempla la segunda opcin. La oxidacin electroqumica requiere conocer las caractersticas de la curva corriente potencial (voltamperograma) de la tiourea para poder determinar la magnitud de la FEM mxima necesaria para oxidar reversiblemente la tiourea.
- 83 -
En este sentido, el primer paso es obtener la curva voltamperomtrica de oxidacin. El segundo paso es oxidar electroqumicamente diferentes cantidades de TU durante diversos periodos determinando la cantidad de FDS formado. El tercer paso es usar estas soluciones tratadas para lixiviar el concentrado aurfero y evaluar cuales son las condiciones ptimas de operacin para obtener una solucin de lixiviacin que permita extraer ms eficientemente el oro contenido en el mineral. El ltimo paso es efectuar la electrodeposicin considerando un mnimo consumo de reactivos.
A.
Voltamperometra El objetivo de esta prueba es determinar la mxima FEM que se debe
aplicar a la celda electroqumica para efectuar la electro-oxidacin reversible de la TU. Esta FEM queda determinada en el punto en que la corriente andica alcanza su nivel mximo. El reactor usado en esta prueba, consta de 2 recipientes cilndricos (andico y catdico) unidos por un puente salino (Reactor 1); para su construccin se siguieron los siguientes pasos: 1) En un beaker de 1.2 L de capacidad (Recipiente 1), se diluy 0.65 ml de H2SO4 (95%) en 0.5 L de agua des-ionizada, luego se agreg ms agua destilada hasta completar 1 L de volumen de solucin. El pH final medido fue 1.50. Luego se agreg 15.1003 gr de Tiourea (99.34%) y se agit hasta total disolucin. 2) En otro beaker de 0.6 L (Recipiente 2), se prepar una solucin acidulada constituida por 0.5 L de agua destilada y 0.15 ml de H2SO4. 3) Se prepar una emulsin (gel) disolviendo 3 gr. de agar en 150 ml de una solucin acuosa de KCl al 15% con calentamiento y agitacin hasta emulsin transparente. Este gel an caliente, se verti a un tubo en forma de U para usarlo como puente salino entre los recipientes 1 y 2 que funcionaron como celda andica y celda catdica
respectivamente.
- 84 -
4)
Se introdujo un electrodo de grafito (usado en electro-erosin) de 0.9 cm de dimetro x 14 cm de longitud en el Recipiente 1, de tal modo que 9 cm de la varilla estuviera bajo el nivel de la solucin. Se sujet esta varilla con una pinza de tal modo que se mantuviera suspendida dentro de la solucin. Esta varilla de grafito se us como nodo y sobre l se llev a cabo la electro-oxidacin de la TU.
5)
En el recipiente 2, se introdujo, un tubo cilndrico de grafito de 7.0 cm de longitud, 0.7 cm de espesor y 4.4 cm de dimetro externo el cual se conect al polo negativo del rectificador de corriente. Este tubo sirvi como ctodo.
6)
Cada electrodo se conect al rectificador en sus respectivos bornes usando alambres de cobre.
7)
Para la medicin del potencial Redox se us un electrodo de referencia Ag/AgCl en KCl 3.5M marca Hanna modelo HI 5311.
8)
Para la medicin del pH se us el electrodo simple de vidrio marca Hanna modelo HI 2110. Adems se us un pH-metro tipo lapicero como equipo auxiliar marca Hanna modelo pHep 5.
9)
Para la medicin del ORP de la Celda Electroqumica, se us el electrodo simple de vidrio marca Hanna modelo HI 3133.
10) Las mediciones de pH y ORP se tomaron con un potencimetro marca Hanna modelo HI 211. 11) Las mediciones de los potenciales de oxidacin se realizaron con un Multitester digital, cuyos terminales fueron conectados al electrodo de referencia y al nodo (electrodo de grafito). Del mismo modo, las mediciones de la intensidad de corriente andica se tom con un ampermetro digital. 12) La FEM aplicada por el rectificador de corriente, se gradu con la ayuda de un voltmetro digital. Los datos experimentales de esta prueba se muestran en las Tablas IV-3 y las curvas de oxidacin se representan en los grficos IV-1 y IV-2.
- 85 -
Tabla IV-3. Voltamperometra de Tiourea. pH =1.50, [TU]0 = 15 g/L
EAg/AgCl(3,5M KCl) H2
FEM (V) Aplicado 0,4 0,5 0,6 0,7 0,8 0,9 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 1,9 2,0 2,1 2,2 2,3 2,4 2,5 2,6 2,7 2,8 2,9 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 3,8 3,9 4,0 4,1 4,2 4,3 4,4 4,5 4,6 4,7 4,8 4,9 5,0 5,1
= 205 mV (Potencial del electrodo de AgCl respecto H2) Eanod (mV) Refdo (H2) 321,0 344,9 357,4 368,9 377,6 385,9 393,4 411,4 422,5 430,4 439,1 449,6 461,1 470,5 481,3 493,2 504,8 513,3 524,7 533,9 544,2 555,6 564,6 574,7 585,9 595,4 605,1 616,3 626,2 635,8 645,7 656,5 665,5 675,6 684,9 694,6 706,8 714,4 724,0 730,5 747,3 775,3 783,1 794,8 800,4 810,9 820,7 833,4 Ecelda (mV) Refdo (AgCl) 107,9 116,3 122,3 124,9 128,6 131,5 135,3 152,8 159,3 164,2 166,8 173,8 180,9 186,0 190,0 197,2 204,2 209,6 213,7 215,1 223,2 228,7 235,8 242,7 253,6 260,5 265,6 270,5 276,6 278,2 284,5 286,8 292,3 302,2 308,3 312,4 317,2 322,2 327,8 331,4 337,2 346,4 351,5 358,6 365,5 372,7 376,3 381,3 Ecelda (mV) Refdo (H2) 312,9 321,3 327,3 329,9 333,6 336,5 340,3 357,8 364,3 369,2 371,8 378,8 385,9 391,0 395,0 402,2 409,2 414,6 418,7 420,1 428,2 433,7 440,8 447,7 458,6 465,5 470,6 475,5 481,6 483,2 489,5 491,8 497,3 507,2 513,3 517,4 522,2 527,2 532,8 536,4 542,2 551,4 556,5 563,6 570,5 577,7 581,3 586,3 i (mA) experim. 0,001 0,039 0,74 1,15 1,52 1,80 1,90 2,00 2,10 2,20 2,30 2,40 2,50 2,60 2,70 2,80 3,00 3,50 3,70 3,90 4,10 4,30 4,50 4,60 4,70 4,80 5,00 5,60 5,70 6,00 6,50 7,00 8,00 9,00 10,00 12,00 14,00 16,00 19,00 29,00 49,00 50,50 50,00 48,00 47,20 47,00 47,10 47,70
Eanod (mV) Refdo (AgCl) 116,0 139,9 152,4 163,9 172,6 180,9 188,4 206,4 217,5 225,4 234,1 244,6 256,1 265,5 276,3 288,2 299,8 308,3 319,7 328,9 339,2 350,6 359,6 369,7 380,9 390,4 400,1 411,3 421,2 430,8 440,7 451,5 460,5 470,6 479,9 489,6 501,8 509,4 519,0 525,5 542,3 570,3 578,1 589,8 595,4 605,9 615,7 628,4
- 86 -
60 50 40
i celda (mA)
30 20 10 0 0.0 1.0 2.0 3.0 4.0 5.0 6.0
FEM (V)
Grfico IV-1. Corriente Andica en funcin de FEM aplicada
Icelda vs Eanod
60 50 40 30 20 10 0 100 300 500 700 900 Electrodo (Ag/AgCl 3.5M KCl)
Ianod (mA)
Eanod (mV)
Grfico IV-2. Corriente de Celda en funcin de Potencial Andico
- 87 -
B.
Electro-oxidacin de Tiourea Las reacciones electroqumicas son reacciones qumicas heterogneas que
ocurren va transferencia de carga a travs de la interfase entre un electrodo y un electrolito. En el caso de una celda electroqumica, los procesos parciales se llevan a cabo independientemente. El ctodo es el lugar donde ocurre la reduccin y el nodo es el lugar de la oxidacin, cada uno con su propio electrodo (interfaz entre un conductor electrnico y un conductor inico). De manera particular, en una celda de electrlisis se identifica a uno de los electrodos como electrodo de trabajo debido a que tiene un rea constante y conocida y su potencial puede ser controlado por un potenciostato con respecto a un electrodo de referencia. El otro electrodo por lo tanto, se denomina contra electrodo y tiene una rea superficial mucho mayor que el electrodo de trabajo de tal forma que el comportamiento del proceso electroqumico sea controlado por el paso de corriente a travs del compartimiento que contiene el electrodo de trabajo
Figura IV-1.Esquema del reactor de oxidacin de TU a FDS. ER: electrodo de trabajo (nodo), ER: electrodo de referencia (Ag/AgCl KCl 3.5M), EA: electrodo auxiliar (ctodo).
La figura IV-1, esquematiza el reactor donde se lleva a cabo la oxidacin de TU a FDS. La oxidacin se lleva a cabo en el nodo (electrodo de trabajo), por la prdida de electrones hacia el electrodo. En el ctodo tiene lugar la reduccin de H+ mediante ganancia de electrones desde el electrodo. Por otra parte, se
- 88 -
incorpora una membrana aninica que sirve para dividir nodo y ctodo, evitando la mezcla de los productos del ctodo y del nodo (con objeto de mantener estabilidad qumica) y eliminando la posibilidad de cortos redox parsitos (es decir reacciones que involucran la reduccin de una especie en el ctodo seguida de su oxidacin en el nodo). De esta manera se asegura una alta eficiencia de corriente para la reaccin deseada. Para garantizar una buena performance y duracin de las membranas, por recomendacin del fabricante se les realiz un pre-tratamiento sumergindolos por 3 horas en una solucin de H2SO4 a pH 1.5 Por otra parte, el reactor electroqumico es una celda de dos tubos concntricos (Ver Fotografa IV-8) y opera continuamente con recirculacin. El electrolito y el reactivo son depositados en un tanque exterior (cuya capacidad es mucho mayor al del reactor) donde se agita continuamente y luego es recirculado al reactor para continuar la oxidacin de la TU. El proceso de oxidacin y recirculacin se mantiene hasta obtener una solucin con la proporcin TU/FDS deseada la cual ser usada en la lixiviacin. Las ventajas de utilizar estos tipos de reactores son las siguientes: La capacidad del electrolito se aumenta considerablemente. Se puede corregir el pH y la composicin del electrolito soporte mediante adiciones. Se puede llevar a cabo convenientemente la preparacin y mezcla de reactivos en el depsito. El tanque tambin puede actuar como desgasificador del electrolito, incluso como un separador slido-lquido. El circuito de flujo o el tanque pueden ser equipados con un intercambiador de calor para controlar la temperatura. Debido a la poca precisin de la bureta usada (precisin 0.02mL), el volumen de las alcuotas tomadas fueron relativamente altos para permitir gastos de solucin titulante apreciables. En tal sentido se procedi del siguiente modo: 1). El tanque de agitacin es un recipiente de 3.2 L (Fotografa IV-6).
- 89 -
2). Se prepar una solucin de TU con aproximadamente 3 L de agua destilada a pH 1.52 y un peso bruto de 45.4216 g de TU. 3). Se prepar una solucin con 0.1010 g de KIO3 (99.7%) en 1 L de agua destilada. Se estandariz con 0.5032 g de TU (99.34%) y se encontr que el KIO3 tena una concentracin de 0.00048M. 4). Para la determinacin de TU se sigui el mtodo analtico indicado en el Anexo A-I, por lo que se tom alcuotas de 20 ml, de los cuales se us 10 ml para TU libre y luego de calculado este, se aadi los otros 10 ml restantes para calcular la TU total, usando polvo de zinc para reducir el FDS formado. Como reactivo indicador se us 5 gotas de una solucin acuosa de almidn al 0.2% en peso. Las muestras se tomaron cada 15 minutos y la prueba se realiz durante 165 minutos. 5). Se calcul la concentracin inicial de TU, encontrando que era 15.0406 g/L. Las condiciones de operacin fueron: pH = 1.52 PMTU = 76.12 g/mol PMKIO3 = 214 g/mol PMFDS = 152.24 g/mol
Tabla IV-4. Oxidacin TU toxid Vsol GastoKIO3 (ml) (min) (ml) TUL TUT
0 15 30 45 60 75 90 105 120 135 150 165 3000 2980 2960 2940 2920 2900 2880 2860 2840 2820 2800 2780 0,68 0,66 0,64 0,62 0,60 0,57 0,56 0,54 0,51 0,50 0,48 0,46 1,36 1,36 1,36 1,36 1,36 1,36 1,36 1,35 1,35 1,35 1,35 1,35
FEM = 4.5 V Pureza TU = 99.34% Pureza KIO3 = 99.7%
16
[TUL], [FDS] vs toxid
[TU]
TU FDS
[TUL], [FDS] (g/L)
12 8 4 0 0
[FDS]
15 30 45 60 75 90 105 120 135 150 165
toxid (min)
Grfico IV-3. Conversin de TU a FDS
- 90 -
Tabla IV-5. Conversin en funcin del peso inicial de TU. Prueba 1 2 3 WTU bruto (g) 20,1385 45,4216 60,4005 WTU neto (g) 20,0056 45,1218 60,0019 Vsol (mL) 2000 3000 3000 [TUT ]i (g/L) Tiempo Oxid GastoKIO3 (ml) TUL 0,34 0,51 0,68 TUT 0,90 1,35 1,80
10,0028 120 min 15,0406 120 min 20,0006 120 min
C.
Lixiviacin Para la oxidacin de TU se us el mismo equipo que se us en la prueba B,
pero la etapa de lixiviacin se llev a cabo en otro recipiente de 5.0 L. Por cuestiones prcticas, y con la finalidad de simplificar la parte experimental, el mtodo operatorio para la lixiviacin del concentrado aurfero es el siguiente: Pre-lixiviacin con una solucin de cido sulfrico al 0.5% con el fin de eliminar todos los elementos y/o compuestos que consumen cido. Filtracin de la pulpa y lavado de los slidos con agua des-ionizada hasta pH neutro. Lixiviacin del concentrado con la solucin de TU electro-oxidada.
Los dos primeros pasos permiten la lixiviacin a pH contante durante todo el proceso por lo que no tiene sentido estudiar el efecto de la concentracin inicial de cido durante la Tioureacin en cada prueba. La relacin slido/liquido para todas las pruebas fue 1:2. C.1. Estudio de parmetros operativos Se realizaron pruebas de lixiviacin con diferentes concentraciones inciales de TU y FDS, as como de pH de la solucin lixiviante para determinar el efecto sobre la disolucin de oro. Para esto, se parti del supuesto de que la velocidad inicial de disolucin de oro est controlado por reaccin qumica y que sigue el modelo de la esfera decreciente Slido-Lquido). Solo en las pruebas donde se estudia la lixiviacin con igual conversin de TU el tiempo de oxidacin es 2.5 horas, en los dems casos son diferentes.
(17)
(Levenspiel Cap. 12 Reacciones
- 91 -
1)
Influencia de la concentracin inicial de Tiourea Las condiciones de operacin son: pH = 1.51 Vsol = 3004 mL Peso mineral = 1.5 kg, WAu = 0.50586 g V solucin para anlisis de Au = 5 mL
Tabla IV-6. Extraccin de Au en funcin de [TUL]0 Prueba [TUT ]i (g / L) CTU (mol / L) CFDS0 (mol / L) Vsol (mL) 3000 2995 2990 2985 2980 2975 2970
0
1 13,0009 0,1279 0,0215 ( ppm ) 0,00 14,38 28,66 39,47 53,86 65,14 74,81
2 15,0005 0,1541 0,0215 ( ppm ) 0,00 17,35 33,82 46,73 63,53 76,59 86,85
3 17,0007 0,1804 0,0215 ( ppm ) 0,00 19,94 37,35 57,03 70,21 86,32 99,28
tLix (min) 0 60 120 180 240 300 360 120 100 80
Concentracin de Au en Solucin
[Au] (ppm)
[TU] = 9.733 g/L Ideal [TU] = 11.733 g/L Ideal [TU] = 13.733 g/L Ideal [TU] = 9.733 g/L Experim (0.1279M) [TU] = 11.733 g/L Experim (0.1541M) [TU] = 13.733 g/L Experim (0.1804M)
60 40 20 0 0 75 150
tLix (min)
225
300
375
Grfico IV-4. Concentracin de Au en solucin con FDS constante. [FDS]0 =3.268 g/L (0.0215M), pH = 1.51.
- 92 -
Tabla IV-7. Tasa de disolucin inicial de Au en funcin de [TU]. W TU bruto (g) 39,3142 42,3379 45,3608 48,3857 51,4095 W TU neto (g) 39,0547 42,0585 45,0614 48,0664 51,0702 [TUT]i (g/L) 13,0009 14,0008 15,0005 16,0008 17,0007 toxid (min) 129,23 120,00 112,00 105,00 98,82 [TUL]0 (g/L) 9,733 10,733 11,733 12,733 13,733 [Au] (ppm) 14,38 15,87 17,35 18,75 19,94
Prueba 1 2 3 4 5 21 20 19
13.733, 19.94 12.733, 18.75 11.733, 17.35
[Au] (ppm)
18 17 16 15 14 13 9 10 11 12 9.733, 14.38 10.733, 15.87
13
14
[TUL]0 (g/L)
Grfico IV-5. Concentracin de Au en una hora de lixiviacin para diferentes concentraciones iniciales de TU libre.
2)
Influencia de la concentracin inicial de Disulfuro Formamidina Las condiciones de operacin son: pH = 1.52 Vsol = 3004 mL Peso mineral = 1.5 kg. WAu = 0.50586 g V solucin para anlisis de Au = 5 mL
- 93 -
Tabla IV-8. Extraccin de Au en funcin de [FDS]0 Prueba [TUT ]i (g / L) CTU0 (mol/L) CFDS0 (mol/L) Vsol (mL) 3000 2995 2990 2985 2980 2975 2970 1 13,0034 0,1452 0,0128 ( ppm ) 0,00 11,85 23,78 33,83 45,41 54,05 63,45 2 15,0005 0,1452 0,0259 ( ppm ) 0,00 17,68 34,02 47,24 63,41 76,39 88,51 3 16,9999 0,1452 0,0391 ( ppm ) 0,00 21,93 40,82 56,78 74,62 88,06 102,55
tLix (min) 0 60 120 180 240 300 360
Concentracin de Au en Solucin
120 [FDS] = 1.948 g/L [FDS] = 3.945 g/L [FDS] = 5.945 g/L [FDS] = 1.948 g/L [FDS] = 3.945 g/L [FDS] = 5.945 g/L Experim (0.0128M) Experim (0.0259M) Experim (0.0391M) Ideal Ideal Ideal
100
80
[Au] (ppm)
60
40
20
0 0 80 160 240 320 400
Tiempo (min)
Grfico IV-6. Extraccin de Au con TU constante. [TUL]0 = 11.055 g/L (0.1452M), pH = 1.52.
- 94 -
Tabla IV-9. Tasa inicial de disolucin de Au en funcin de [FDS]0. W TU bruto (g) 39,3217 42,3419 45,3608 48,3904 51,4069 W TU neto (g) 39,0622 42,0624 45,0614 48,0710 51,0676 [TUT]i (g/L) 13,0034 14,0021 15,0005 16,0023 16,9999 toxid (min) 77,02 108,20 135,22 158,95 179,80 [FDS]0 (g/L) 1,948 2,947 3,945 4,947 5,945 [Au] (ppm) 11,85 15,22 17,68 19,89 21,93
Prueba 1 2 3 4 5
23 5.945, 21.93 20 4.947, 19.89 3.945, 17.68
[Au] (ppm)
17 2.947, 15.22 14 1.948, 11.85 11 1 2
[FDS]0 (g/L)
Grfico IV-7. Concentracin de Au en una hora de lixiviacin para diferentes concentraciones iniciales de FDS.
3)
Influencia de concentraciones variables de TU y FDS Las condiciones de operacin son: pH = 1.52 toxid = 2.5 horas Vsol = 3004 mL Peso mineral = 1.5 kg WAu = 0.50586 g Volumen de solucin para determinacin de Au = 5 mL Volumen de solucin para determinacin de TU = 4 mL
- 95 -
Tabla IV-10. Cuantificacin volumtrica de TU y efecto de [TU] con igual conversin sobre la disolucin de Au
PRUEBA 1 2 3
tLix (min) 0 60 120 180 240 300 360
Vsol GastoKIO3 (mL) (mL) TUL TUT 3000 0,13 0,18 2991 0,13 0,18 2982 0,13 0,18 2973 0,13 0,18 2964 0,12 0,17 2955 0,12 0,17 2946 0,12 0,17
[Au] GastoKIO3 (mL) [Au] GastoKIO3 (mL) [Au] (ppm) TUL TUT (ppm) TUL TUT (ppm) 0,00 0,19 0,27 0,00 0,26 0,36 0,00 9,53 0,19 0,27 18,75 0,26 0,36 26,34 19,17 0,19 0,27 35,16 0,26 0,36 48,93 26,06 0,18 0,26 53,29 0,25 0,35 71,92 37,28 0,18 0,26 67,17 0,25 0,35 89,46 44,05 0,18 0,26 79,86 0,25 0,35 105,69 52,62 0,18 0,26 93,40 0,25 0,35 119,06
140 [TU] = 7.083 g/L; [FDS] = 2.918 g/L 120 100 [TU] = 10.624 g/L; [FDS] = 4.376 g/L [TU] = 14.166 g/L; [FDS] = 5.835 g/L
[Au] (ppm)
80 60 40 20 0 0 100 200 300 400
Tiempo (min)
Grfico IV-8. Efecto de [TU]0 y [FDS]0 sobre la lixiviacin de Au
Tabla IV-11. Tasa inicial de disolucin de Au en funcin de [TU] con igual conversin. Prueba 1 2 3 W TU bruto (g) 30,2412 45,3603 60,4815 [TUT]i (g/L) 10,0005 15,0003 20,0008 [TUL]0 (g/L) 7,083 10,624 14,166 [FDS]0 (g/L) 2,918 4,376 5,835 [Au] (ppm) 9,53 18,75 26,34
- 96 -
4)
Orden global de reaccin Condiciones de operacin: pH = 1.5 (cte.) Radio slido/liquido = tLix = 1 hora
FEM = 4.5 Voltios Velocidad de agitacin = cte.
Tabla IV-12. Efecto de diferentes [TUL]0 y [FDS]0 sobre la disolucin de Au. toxid (min) 150,00 150,00 150,00 77,02 108,20 135,22 158,95 179,80 129,23 120,00 112,00 105,00 98,82 WTU bruto (g) 30,2412 45,3603 60,4815 39,3217 42,3419 45,3608 48,3904 51,4069 39,3142 42,3379 45,3608 48,3857 51,4095 [TUL]0 (g/L) 7,083 10,624 14,166 11,055 11,055 11,055 11,055 11,055 9,733 10,733 11,733 12,733 13,733 [FDS]0 (g/L) 2,918 4,376 5,835 1,948 2,947 3,945 4,947 5,945 3,268 3,268 3,268 3,268 3,268 CwAu (ppm) 9,53 18,75 26,34 11,85 15,22 17,68 19,89 21,93 14,38 15,87 17,35 18,75 19,94
5)
Influencia del pH de la solucin Tomando en consideracin los datos de la Tabla IV-10 (Prueba 2), se realiz dos pruebas adicionales con pH 3 y 4.51. Condiciones de operacin: Vsol = 3004 mL toxid = 150 min
Volumen de solucin para anlisis de Au = 5 mL
Tabla IV-13. Peso disueltos de TU en cada prueba de pH. Prueba 1 2 3 pH 1,52 3,00 4,51 WTU bruto (g) 45,3603 45,3614 45,3608 WTU neto (g) 45,0609 45,0620 45,0614 [TUT ]i (g/L) 15,0003 15,0007 15,0005
CiTU
(mol/L) 0,1971 0,1971 0,1971
- 97 -
Tabla IV-14. Efecto del pH de solucin lixiviante sobre la disolucin de oro. Prueba pH tLix (min) 0 60 120 180 240 300 360 Vsol (mL) 3000 2995 2990 2985 2980 2975 2970 1 2 3 1,52 3,00 4,51 Concentracin de Au en Solucin ( ppm ) 0,00 18,75 35,16 53,29 67,17 79,86 93,40 ( ppm ) 0,00 17,85 34,32 49,74 63,58 75,64 87,25 ( ppm ) 0,00 12,28 24,15 35,46 40,20 43,92 44,28
100 90
Concentracin de Au
80 70 60 50 40 30 20 10 0 0 50 100 150 200 250 300 350 400 pH = 1.52 pH = 3.00 pH = 4.51
Tiempo (min)
Grfico IV-9. Efecto del pH sobre la disolucin de Au. [TUL]0 = 10.624 g/L, [FDS]0 = 4.376 g/L.
C.2.
Lixiviacin con parmetros ptimos por tiempos prolongados
Debido a la naturaleza de la prueba, sta se llev a cabo en un laboratorio externo usando un recipiente de acero inoxidable de 8.5 L de capacidad. Las condiciones globales de operacin: pH = 1.5 Vsol = 4 L toxid = 150 min Peso neto disuelto de TU = 60.0823 g XTU = 0.292 [TUT] = 15.0206 g/L
- 98 -
[TUL]0 = 10,6383 g/L Ley Au = 337.24 g Au / TM mineral
[FDS]0 = 4,3823 g/L Peso de mineral 2 kg.
Tabla IV-15. Lixiviacin Tiempo (Hrs) 0 2 4 6 8 10 12 14 16 18 20 22 23 160 Au (ppm) 0,00 38,55 70,68 97,08 118,25 132,80 142,16 152,05 153,32 156,21 156,76 157,05 157,07 Vsol (mL) 4000 3995 3990 3985 3980 3975 3970 3965 3960 3955 3950 3945 3940
Concentracin de Au (ppm)
140 120 100 80 60 40 20 0 0 5
Tiempo (Hrs)
10
15
20
25
Grfico IV-10. [Au] en lixiviacin por tiempos prolongados.
D.
Electro-deposicin Se lleva a cabo en una celda de Electrodilisis de tres compartimentos
separados por membranas de intercambio inico (Ver Figura IV-2).
- 99 -
1 +
A Componentes de la celda electroqumica de tres compartimentos
12
4 7 9
AuTU2+ 1
11
(1) (2) (3) (4) (5) (6) (7) (8) (9) (10) (11) (12)
Rectificador de corriente TK de recirculacin de catolito Solucin enriquecida de AuTU2+ Ctodo (Lana de acero) Membrana catinica Solucin impregnada de AuTU2+ Agitador Membrana aninica nodo (alambre helicoidal de plomo) TK de recirculacin de anolito Solucin de H2SO4 a pH = 2. TK de recirculacin de solucin impregnada
10
3 5
Figura IV-2.Representacin esquemtica del circuito de electrodilisis usado para llevar a cabo la electrodeposicin de Au desde una solucin de tioureacin
- 100 -
Para el uso de la celda descrita en el esquema anterior, se tom en cuenta las recomendaciones dadas por Jurez y Dutra (15) se efectu la electrodeposicin desde la solucin obtenida en la prueba final en valores de potencial catdico cercano a -0.18 V. Tanto el catolito como el anolito se mantienen en permanente recirculacin por sus respectivos circuitos y estn separadas de la solucin impregnada por las membranas correspondientes (Ver fotografa IV-11 y esquema de
electrodeposicin). En el compartimento andico se coloc un alambre de plomo de de 4 mm de dimetro enrolladlo en forma helicoidal. El anolito consiste en una solucin acidulada de H2SO4 (pH = 2). Se establece una velocidad de agitacin mnima en el compartimento central de tal modo que no interfiera en la migracin de los iones hacia la interfase membrana-solucin. Las caractersticas de las membranas de intercambio inico IONAC publicadas por el fabricante estn descritas en el siguiente cuadro.
Tipo de Membrana Espesor (mils). 1 mil = 0,001 pulg Capacidad de Intercambio (meq/mol-g) Resistencia (Ohm/cm) Temperatura mx. estabilidad (C) Permeabilidad al agua (ml/hr/ft2 a 5psi) pH de estabilidad qumica Densidad de corriente mx. (amp/ft2) Catinica 15 1,4 25 80 25 1 a 10 50 Aninica 16 0,9 50 80 25 1 a 10 50
Condiciones de operacin: Anolito: Vol pH = 0.35 L = 10.5 (inicial)
nodo de plomo Catolito: Vol pH = 0.5 L = 1.5 (se mantiene constante adicionando H2SO4)
Ctodo de lana de acero
- 101 -
Solucin impregnada: Vol pH Peso de Au en proceso PM de complejo AuTU2
+
=2L = 1.5 = 0.3141 g = 349.21 g/mol = 35 C = 100 110 mA = -0.18 V = 4 horas
Temperatura promedio de operacin Intensidad de corriente Potencial catdico Tiempo de electrlisis
Tabla IV-16. Balance de masa en solucin impregnada en la electrodeposicin. Solucin Impregnada Tiempo Hrs 0 2 4 [Au] ppm 157,07 81,04 54,15 Gasto KIO3 (mL) TUL 0,680 0,680 0,675 TUT [TU] g/L [FDS] g/L 4,1288 4,0551 4,0551 [Ag] ppm 24,87 15,08 11,23
0,960 10,0271 10,0271 0,955 0,950 9,9533
Tabla IV-17. Balance de masa en catolito y en ctodo de lana de acero despus de electrodeposicin. Solucin Catolito Tiempo Hrs 0 4 [Au] ppm 0 14,26 Gasto KIO3 (mL) TUL -0,700 TUT [TU] g/L [FDS] g/L -0,5161 Peso Lana (g) 9,8845 10,0993
- - 10,0005 0,735 10,3220
Tabla IV-18. [TU] residual Titulacin final TUL TUT KIO3 (mL) 0,68 0,96
- 102 -
3.2.
RESULTADOS
3.2.1. Voltamperometra
Tabla IV-19. Determinacin de la FEM necesaria para efectuar la oxidacin reversible de TU a FDS FEM (V) Aplicado 1,6 1,7 1,8 1,9 2,0 2,1 2,2 2,3 2,4 2,5 2,6 2,7 2,8 2,9 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 3,8 3,9 4,0 4,1 4,2 4,3 4,4 4,5 4,6 4,7 4,8 4,9 5,0 5,1 I (mA) experiment 2,50 2,60 2,70 2,80 3,00 3,50 3,70 3,90 4,10 4,30 4,50 4,60 4,70 4,80 5,00 5,60 5,70 6,00 6,50 7,00 8,00 9,00 10,00 12,00 14,00 16,00 19,00 29,00 49,00 50,50 50,00 48,00 47,20 47,00 47,10 47,70 FEM prom (V) 1,65 1,75 1,85 1,95 2,05 2,15 2,25 2,35 2,45 2,55 2,65 2,75 2,85 2,95 3,05 3,15 3,25 3,35 3,45 3,55 3,65 3,75 3,85 3,95 4,05 4,15 4,25 4,35 4,45 4,55 4,65 4,75 4,85 4,95 5,05 I / V (A/V) 1,00 1,00 1,00 2,00 5,00 2,00 2,00 2,00 2,00 2,00 1,00 1,00 1,00 2,00 6,00 1,00 3,00 5,00 5,00 10,00 10,00 10,00 20,00 20,00 20,00 30,00 100,00 200,00 15,00 -5,00 -20,00 -8,00 -2,00 1,00 6,00
Se puede observar que a 4.5 voltios hay un cambio de signo de I/V.
- 103 -
225 200 175 150
I/V (A/V)
125 100 75 50 25 0 -25 0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 5 5.5
FEM (V)
Grfico IV-11. Determinacin grfica de la fuerza electromotriz de oxidacin de TU en condiciones reversibles.
Del cuadro anterior y del grfico se puede deducir que la fuerza electromotriz necesaria para oxidar reversiblemente la Tiourea es aproximadamente 4.5 V, por lo tanto todos los experimentos posteriores de electro-oxidacin se realizarn fijando en la fuente de corriente continua un potencial igual a 4.5 voltios.
3.2.2. Electro-oxidacin de Tiourea Para realizar el balance de materia en el reactor de electrooxidacin, se supone que la reaccin de oxidacin de TU est bajo control completo de transporte de materia, por lo tanto la velocidad de cambio de concentracin de reactivo con el tiempo queda descrito por: (Ec IV-1) Donde: VR es volumen del reactor km es el coeficiente de transporte de materia A rea del electrodo
- 104 -
Integrando entre los lmites: t = 0, CTU = CTU0 y t = t, CTU = CTUt, se obtiene la siguiente ecuacin: (Ec IV-2) Lo que quiere decir que la concentracin de TU disminuye
progresivamente con el tiempo de una manera determinada por las condiciones de flujo, la geometra del electrodo y el volumen del electrolito. El trmino kmA/VR, se puede calcular por dos mtodos: 1 En funcin de las concentraciones de TU calculadas por volumetra
con KIO3
(Ec IV-3)
2 En funcin de los grados de conversin de TU calculados
estequiomtricamente. (Ec IV-4) La Tabla IV-20, muestra los valores de CTU y XTU calculados por volumetra y por estequiometria respectivamente. Los grficos IV-12 y IV-13 representan las ecuaciones Ec IV-3 y Ec IV-4, a partir de estos se puede calcular grficamente el valor del trmino por regresin lineal, y podemos notar
claramente en estos grficos que los valores de la pendiente son dismiles a pesar que representan el mismo trmino. Esto se debe a que los mtodos de clculo son diferentes y conllevan errores de diferente naturaleza. Sin embargo, se debe tener presente que en el mtodo volumtrico se us buretas de poca precisin por lo que podemos deducir que los resultados tambin sern poco exactos, lo que significa que al momento de elegir el mtodo para los clculos posteriores es recomendable optar por el uso del mtodo estequiomtrico. Una valoracin potenciomtrica es mucho ms exacta y hubiera representado mejor los resultados experimentales.
- 105 -
Tabla IV-20. Determinacin de la conversin de TU a FDS por titulacin volumtrica con KIO3 y por estequiometria. Eleccin del tiempo de oxidacin y grado de conversin ideal. t (min) 0 15 30 45 60 75 90 105 120 135 150 165 Vsol (ml) 3000 2980 2960 2940 2920 2900 2880 2860 2840 2820 2800 2780 WmTU (gr) Libre 0,1504 0,1460 0,1416 0,1371 0,1327 0,1261 0,1239 0,1194 0,1128 0,1106 0,1062 0,1017 Total 0,3008 0,3008 0,3008 0,3008 0,3008 0,3008 0,3008 0,2986 0,2986 0,2986 0,2986 0,2986 TUL (gr) 45,1218 43,5027 41,9014 40,3177 38,7517 36,5619 35,6728 34,1599 32,0365 31,1871 29,7273 28,2852 [TUL] (g/L) 15,0406 14,5982 14,1559 13,7135 13,2711 12,6076 12,3864 11,9440 11,2805 11,0593 10,6169 10,1745 0,00000 0,02985 0,06062 0,09237 0,12516 0,17646 0,19416 0,23052 0,28768 0,30748 0,34831 0,39087 [TUT ] (g/L) 15,041 15,041 15,041 15,041 15,041 15,041 15,041 14,930 14,930 14,930 14,930 14,930 [TU]oxid (g/L) 0,000 0,442 0,885 1,327 1,769 2,433 2,654 2,986 3,650 3,871 4,313 4,755 XTU ( [TU] ) 0,000 0,029 0,059 0,088 0,118 0,162 0,176 0,206 0,250 0,265 0,294 0,324 ( [FDS] ) 0,000 0,029 0,059 0,088 0,118 0,162 0,176 0,199 0,243 0,257 0,287 0,316 Prom 0,000 0,029 0,059 0,088 0,118 0,162 0,176 0,202 0,246 0,261 0,290 0,320 [TU]prom [FDS]prom (g/L) (g/L) 15,041 14,598 14,156 13,713 13,271 12,608 12,386 11,999 11,336 11,115 10,672 10,230 0,000 0,442 0,885 1,327 1,769 2,433 2,654 3,041 3,705 3,926 4,368 4,811
Tabla IV-21. Conversin para varios pesos de TU en 2 horas de oxidacin Prueba 1 2 3 [TUT ]i (g/L) [TUL] (g/L) [TUT ] (g/L) 9,953 14,930 19,907 [TU]oxid (g/L) 2,433 3,650 4,866 Convers (XTU) 0,248 0,250 0,248
7,5203 10,0028 15,0406 11,2805 20,0006 15,0406
- 106 -
Ln([TUT]i/[TUL]t) vs toxid
0.35 Ln ([TUT]i/[TUL]t) = 2,379E-03 t
Ln ( [TUT]i / [TUL]t )
0.25
0.15 Experimental 0.05 -0.05 0 25 50 75 100 Regresin 125 150 175
t (min)
Grfico IV-12. Determinacin de la constate a partir de los valores de [TU] calculados por volumetra.
0.35 0.30 0.25
Grado Conversin (XTU) vs toxid
XTU = 1,94510-3 t
XTU
0.20 0.15 0.10 0.05 0.00 0 25 50 75 Experimental Regresin
t (min)
100
125
150
175
Grfico IV-13. Determinacin de la constate KX a partir de los valores promedio de XTU.
- 107 -
3.2.3. Lixiviacin Para un mejor estudio, esta etapa se dividi en dos partes. En la primera parte se determina los parmetros ptimos de operacin y en la segunda parte se usan los parmetros ptimos de operacin para evaluar la lixiviacin por tiempos prolongados. A. Determinacin de parmetros ptimos de operacin Los parmetros operativos estudiados fueron pH de solucin,
concentracin de TU libre inicial y concentracin de FDS inicial. A.1. 1) Efecto de la concentracin inicial de Tiourea Efecto sobre el grado de conversin de oro Para el clculo del porcentaje de extraccin usaremos la siguiente expresin: (Ec IV-5)
Teniendo en cuenta que la Ley de Au es 337.24 g/TM y que el peso de muestra es 1.5 kg, tenemos que el peso de Au en muestra es 0.50586 g; entonces, a partir de este resultado y de los datos de la tabla IV-6 se tiene:
Tabla IV-22. Influencia de la [TUL]0 sobre el porcentaje de disolucin de Au. CFDS = 0.0215M. Prueba [TUT ]i (g / L) 1 13,0009 0,1279 2 15,0005 0,1541 3 17,0007 0,1804
CTU0 (mol / L)
tLix (min) 0 60 120 180 240 300 360 Vsol (mL) 3000 2995 2990 2985 2980 2975 2970
Concentracin de Au en Solucin % = XAu 0,0% 8,5% 17,0% 23,3% 31,8% 38,4% 44,0% % = XAu 0,0% 10,3% 20,0% 27,6% 37,5% 45,1% 51,1% % = XAu 0,0% 11,8% 22,1% 33,7% 41,4% 50,8% 58,4%
- 108 -
La representacin grfica de la tabla anterior es:
60%
[TU] = 9.733 g/L (0.1279M) [TU] = 11.733 g/L (0.1541M) [TU] = 13,733 g/L (0.1804M)
100XAu (% Extraccin de Oro)
50% 40% 30% 20% 10% 0% 0
75
Tiempo (min)
150
225
300
375
Grfico IV-14. Extraccin porcentual de Au para diferentes concentraciones de TU. [FDS]0 = 3.268 g/L
2)
Efecto de la concentracin de Tiourea sobre el Orden de Reaccin A partir de los datos de la Tabla IV-7 fijando una misma concentracin de FDS producido a partir de diferentes pesos iniciales de TU, determinamos el grado de conversin necesario para cada caso y el peso de tiourea al final de la oxidacin, el cual ser el peso de TU libre al inicio de la lixiviacin. Los resultados se muestran en la siguiente tabla.
Tabla IV-23. Efecto de la concentracin inicial de TU libre [TU]0 sobre la extraccin inicial de Au. Prueba 1 2 3 4 5 XTU 0,2514 0,2334 0,2178 0,2042 0,1922 [TUL]0 mol / L 0,1279 0,1410 0,1541 0,1673 0,1804 g/L 9,733 10,733 11,733 12,733 13,733 [FDS]0 mol / L 0,0215 0,0215 0,0215 0,0215 0,0215 g/L 3,268 3,268 3,268 3,268 3,268
CAu
mol / L 7,30E-5 8,06E-5 8,81E-5 9,52E-5 1,01E-4
- 109 -
Teniendo en cuenta que la concentracin inicial de FDS es constante, la ecuacin matemtica de la cintica de disolucin de oro respecto a la concentracin inicial de TU (Anexo II) viene representada por: (Ec IV-6) Donde kR y n son la constante de reaccin y orden de reaccin respectivamente en funcin de la concentracin de TU, estos parmetros se determinan experimentalmente por mnimos cuadrados aplicando regresin lineal a la Ec. IV-6; para ello, construimos la tabla de clculos IV-24. Los valores de kR y n se muestran en la ecuacin del grfico IV-15.
Tabla IV-24. Velocidad de inicial disolucin de Au Prueba 1 2 3 4 5 - rAu mol/(L min) 1,22E-06 1,34E-06 1,47E-06 1,59E-06 1,69E-06 ln(-rAu) -13,619 -13,521 -13,432 -13,354 -13,292 ln CTU de
-2,0568 -1,9590 -1,8699 -1,7881 -1,7125
0.12 -13.25 -13.30
0.13
0.14
0.15
0.16
0.17
0.18
0.19
Ln (rAu) mol L-1 min-1
-13.35 -13.40 -13.45 -13.50 -13.55 -13.60 -13.65
Experimental Regresin
Ln (rAu) = 0,96ln CTU0 - 11,65 R = 1,00
CTU0 (mol/L)
Grfico IV-15. Determinacin experimental del orden de reaccin de la velocidad de disolucin de Au respecto a la [TU]
- 110 -
3)
Efecto sobre el Modelo Matemtico de cintica de disolucin Para comprobar que la disolucin de oro con TU est controlado por reaccin qumica tal como se menciona en el Anexo III, hacemos uso de los valores del grado de conversin de Au (disolucin fraccional) durante la etapa de lixiviacin. Los resultados se muestran a continuacin:
Tabla IV-25. Modelo del ncleo decreciente en funcin de la conversin de Au t (min) 0 60 120 180 240 300 360 0.30 XAu 1 0,000 0,085 0,170 0,233 0,318 0,384 0,440 2 0,000 0,103 0,200 0,276 0,375 0,451 0,511 3 0,000 0,118 0,221 0,337 0,414 0,509 0,584
1 ( 1 XAu )1/3
1 0,0000 0,0293 0,0601 0,0847 0,1197 0,1490 0,1757 2 0,0000 0,0355 0,0718 0,1021 0,1450 0,1813 0,2120 3 0,0000 0,0411 0,0799 0,1281 0,1633 0,2108 0,2534
0.25
0.20
1 - (1-XAu)1/3
13 g/L 15 g/L 17 g/L 13 g/L 15 g/L 17 g/L
Experimental Experimental Experimental Regresin Regresin Regresin
1-(1-XAu)1/3 = 7,04210-4 t [TUL]0 = 13.733 g/L
0.15
0.10
1-(1-XAu)1/3 = 5,957 10-4 t [TUL]0 = 11.733 g/L 1-(1-XAu)1/3 = 4,91810-4 t [TUL]0 = 9.734 g/L 0 100 200 300 400
0.05
0.00
Tiempo (min)
Grfico IV-16. Cintica de Disolucin de Au controlada por Reaccin Qumica durante las primeras seis horas de lixiviacin con diferentes concentraciones de TU. Modelo del Ncleo Decreciente. [FDS]0 = 3.268 g/L (0.0215M).
- 111 -
Tabla IV-26. Clculo de las Concentraciones de Au estimados por el modelo de Esfera Decreciente
t
(min)
1 ( 1 XAu )1/3
1 0,000 0,029 0,059 0,088 0,118 0,147 0,177 2 0,000 0,036 0,071 0,107 0,143 0,178 0,214 3 0,000 0,042 0,084 0,126 0,169 0,211 0,253 1 0,000 0,086 0,166 0,242 0,313 0,380 0,442
XAu 2 0,000 0,103 0,199 0,288 0,370 0,445 0,514 3 0,000 0,121 0,232 0,333 0,425 0,508 0,583
0 60 120 180 240 300 360
[Au] ajustado (ppm) 1 2 3 0,00 0,00 0,00 14,49 17,44 20,47 28,17 33,68 39,29 41,06 48,79 56,51 53,20 62,78 72,21 64,59 75,71 86,45 75,27 87,62 99,31
Los valores de [Au] ajustados estn representados por las correspondientes lneas continuas del Grfico IV-4. A.2. 1) Efecto de la concentracin inicial de Disulfuro Formamidina (FDS) Efecto sobre el grado de conversin de oro. Las condiciones de operacin son las mismas que en el estudio del efecto de la concentracin de TU. Teniendo en cuenta estas atingencias, a partir de la Tabla IV-8 y usando la ecuacin Ec IV-5 elaboramos una tabla indicando los grados de conversin (extraccin fraccional) de Au en funcin del tiempo, la cual se muestra a continuacin:
Tabla IV-27. Influencia de [FDS]0 sobre el porcentaje de disolucin de Au. CTU0 = 0.1452M. Prueba [TUT ]i (g / L) CFDS0 (mol/L) tLix (min) 0 60 120 180 240 300 360 Vsol (mL) 3000 2995 2990 2985 2980 2975 2970 1 13,0034 0,0128 2 15,0005 0,0259 3 16,9999 0,0391
Concentracin de Au en Solucin % = XAu 0,0% 7,0% 14,1% 20,0% 26,8% 31,8% 37,3% % = XAu 0,0% 10,5% 20,1% 27,9% 37,4% 45,0% 52,1% % = XAu 0,0% 13,0% 24,2% 33,6% 44,0% 51,9% 60,3%
- 112 -
70% [FDS]0 = 1.948 g/L 60% [FDS]0 = 3.945 g/L [FDS]0 = 5.945 g/L
% Extraccin de Au
50% 40% 30% 20% 10% 0% 0
100
200
300
400
Tiempo (min)
Grfico IV-17. Extraccin porcentual de Au para diferentes concentraciones de FDS. [TUL]0 = 11.055 g/L
2)
Efecto de la concentracin de FDS sobre el Orden de Reaccin. Como en el caso del estudio del efecto de la concentracin inicial de TU libre, a partir de la Tabla IV-9 donde se ha fijado contante el valor de la concentracin inicial de TU libre y se determina las concentraciones molares de oro para la primera hora de lixiviacin respecto a la concentracin inicial de FDS formada por oxidacin de TU. Estos clculos se muestran en la siguiente tabla:
Tabla IV-28. Concentraciones molares de Au despus de una hora de lixiviacin Prueba 1 2 3 4 5 XTU 0,1498 0,2104 0,2630 0,3092 0,3497 [TUL]0 mol / L 0,1452 0,1452 0,1452 0,1452 0,1452 g/L 11,055 11,055 11,055 11,055 11,055 [FDS]0 mol / L 0,0128 0,0194 0,0259 0,0325 0,0391 g/L 1,9480 2,9467 3,9452 4,9472 5,9450
CAu
mol / L 6,016E-5 7,727E-5 8,976E-5 1,010E-4 1,113E-4
- 113 -
En forma similar a la ecuacin Ec IV-6, la ecuacin matemtica de la cintica de lixiviacin respecto a la concentracin inicial de FDS es: (Ec IV-7) kR y n se determinan experimentalmente. La Tabla IV-29 muestra los valores de las velocidades de disolucin de Au al cabo de la primera hora de lixiviacin en funcin a las concentraciones iniciales de FDS. Los valores de la constante de reaccin y del orden de reaccin se muestran en la ecuacin de regresin del grfico IV-18.
Tabla IV-29. Velocidad de inicial disolucin de Au Prueba 1 2 3 4 5 - rAu mol/(L min) 1,00E-06 1,29E-06 1,50E-06 1,68E-06 1,86E-06 ln(-rAu) 13,813 -13,563 -13,413 -13,295 -13,197 de
ln CFDS -4,3587 -3,9448 -3,6530 -3,4266 -3,2429
0.00 -13.1 -13.2
0.01
0.02
0.03
0.04
0.05
Ln(rAu) mol L-1 min-1
-13.3 -13.4 -13.5 -13.6 -13.7 -13.8 -13.9
Experimental Regresin
Ln (rAu) = 0,54 Ln(CFDS) - 11,41
[FDS]0 mol / L
la velocidad de disolucin de Au respecto a la [FDS]0
Grfico IV-18. Determinacin experimental del orden de reaccin de
- 114 -
3)
Efecto sobre el Modelo Matemtico de cintica de disolucin Se comprob la influencia de la concentracin de FDS en la etapa controlante de disolucin de oro, para ello como en el caso del estudio de la influencia de la concentracin inicial de TU libre, elaboramos una tabla de clculos para evaluar el modelo matemtico del ncleo decreciente a partir de la conversin de oro tal como se indica en el Anexo III.
Tabla IV-30. Modelo del ncleo decreciente en funcin de la conversin de Au t (min) 0 60 120 180 240 300 360 0.30 0.25 0.20 XAu 1 0,000 0,070 0,141 0,200 0,268 0,318 0,373 2 0,000 0,105 0,201 0,279 0,374 0,450 0,521 3 0,000 0,130 0,242 0,336 0,440 0,519 0,603
1 ( 1 XAu )1/3
1 0,0000 0,0240 0,0493 0,0717 0,0987 0,1199 0,1442 2 0,0000 0,0362 0,0722 0,1034 0,1446 0,1807 0,2173 3 0,0000 0,0454 0,0881 0,1274 0,1759 0,2164 0,2651
1-(1-XAu)1/3
13 g/L 15 g/L 17 g/L 13 g/L 15 g/L 17 g/L
Experimental Experimental Experimental Ideal Ideal Ideal
1-(1-XAu)1/3 = 7,29210-4 t [FDS]0 = 5.9467 g/L
0.15 0.10 0.05 0.00 0 100 200 1-(1-XAu)1/3 = 6,03110-4 t [FDS]0 = 3.9469 g/L 1-(1-XAu)1/3 = 4,01110-4 t [FDS]0 = 1.9475 g/L 300 400
Tiempo (min)
Grfico IV-19. Cintica de Disolucin de Au controlada por Reaccin Qumica durante las primeras seis horas de lixiviacin con diferentes concentraciones de TU. Modelo del Ncleo Decreciente. [TUL]0 = 11.055 g/L (0.1452M).
- 115 -
Tabla IV-31. Clculo de las Concentraciones de Au estimadas por el modelo de Esfera Decreciente
t
(min)
1 ( 1 XAu )1/3
1 0,000 0,024 0,048 0,072 0,096 0,120 0,144 2 0,000 0,036 0,072 0,108 0,144 0,181 0,217 3 0,000 0,044 0,087 0,131 0,175 0,218 0,262 1 0,000 0,070 0,137 0,201 0,261 0,319 0,373
XAu
2 0,000 0,104 0,201 0,291 0,374 0,450 0,519 3 0,000 0,125 0,240 0,344 0,438 0,522 0,598
[Au] ajustado (ppm) 1 0,00 11,88 23,23 34,06 44,38 54,20 63,53 2 3 0,00 0,00 17,64 21,17 34,07 40,55 49,32 58,24 63,44 74,29 76,47 88,80 88,45 101,83
0 60 120 180 240 300 360
Los valores de [Au] ajustados estn representados por las correspondientes lneas continuas del Grfico IV-6.
A.3. 1)
Pruebas de lixiviacin con conversin de TU constante. Clculo de las concentraciones molares de TU y FDS por balance estequiomtrico. De los datos de concentracin de oro mostrados en la Tabla IV-10 se calcula la concentracin de TU y FDS por balance estequiomtrico. El porcentaje de disolucin de oro, obtenido al variar simultneamente la concentracin de TU libre inicial y la concentracin de FDS inicial. Los resultados se muestran en la siguiente tabla:
Tabla IV-32. Determinacin de CTU y CFDS por balance estequiomtrico respecto a la concentracin de oro disuelto Pba 1 2 3
tLix
min 0 60 120 180 240 300 360
CAu
mol/L x 10-4 0,00 0,48 0,97 1,32 1,89 2,24 2,67
CTU
(mol/L) 0,09305 0,09300 0,09295 0,09292 0,09286 0,09283 0,09278
CFDS
mol/L x 10-2 1,916 1,914 1,912 1,910 1,907 1,905 1,903
CAu
mol/L x 10-4 0,00 0,95 1,78 2,70 3,41 4,05 4,74
mol/L (mol/L) x 10-2 0,13957 2,875 0,13947 2,870 0,13939 2,866 0,13930 2,861 0,13923 2,858 0,13916 2,854 0,13909 2,851
CTU
CFDS
CAu
mol/L x 10-4 0,00 1,34 2,48 3,65 4,54 5,37 6,04
CTU
(mol/L) 0,18609 0,18596 0,18585 0,18573 0,18564 0,18556 0,18549
CFDS
mol/L x 10-2 3,833 3,826 3,820 3,815 3,810 3,806 3,803
- 116 -
2)
Modelo matemtico de cintica de disolucin Para las tres pruebas efectuadas con concentraciones iniciales diferentes de TU y FDS, se determinaron las extracciones fraccionales de oro a partir del los cuales se pudo modelara la ecuacin matemtica que describe la etapa controlante del proceso de disolucin. Los resultados se muestran en la Tabla IV-33 y su representacin en el Grfico IV-20.
Tabla IV-33. Grado de conversin de Au desde la muestra slida al seno de la solucin. TLix (min) 0 60 120 180 240 300 360
Au (ppm)
1 0,00 9,53 19,17 26,06 37,28 44,05 52,62 0.40 0.35 0.30 2 0,00 18,75 35,16 53,29 67,17 79,86 93,40 3 0,00 26,34 48,93 71,92 89,46 105,69 119,06 1 0,000 0,056 0,114 0,154 0,221 0,261 0,312
XAu
2 0,000 0,111 0,208 0,316 0,398 0,474 0,554 3 0,000 0,156 0,290 0,427 0,531 0,627 0,706 1 0,000 0,019 0,039 0,054 0,080 0,096 0,117
1-(1-XAu)1/3
2 0,000 0,039 0,075 0,119 0,156 0,193 0,236 3 0,000 0,055 0,108 0,169 0,223 0,280 0,335
[TU] =7.083 g/L; [FDS] = 2.918 g/L [TU] = 10.624 g/L; [FDS] = 4.376 g/L [TU] = 14.166 g/L; [FDS] = 5.835 g/L
1 - (1-XAu)1/3)
0.25 0.20 0.15 0.10 0.05 0.00 0
1-(1-XAu)1/3 = 9,34610-4 t [TUT]i = 20 g/L 1-(1-XAu)1/3 = 6,52810-4 t [TUT]i = 15 g/L
1-(1-XAu)1/3 = 3,24910-4 t [TUT]i = 10 g/L 50 100 150 200 250 300 350 400
t (min)
Grfico IV-20. Reaccin qumica como etapa controlante en las primeras seis horas de lixiviacin con concentraciones diferentes de TU y FDS. Modelo del ncleo decreciente
- 117 -
3)
Concentraciones molares iniciales de TU y FDS para el clculo del orden global de reaccin
Tabla IV-34.
GastoKIO3 (mL) Pba. TUL TUT
1 2 3 0,13 0,18 0,19 0,27 0,26 0,36
[TUL]0 [FDS]0 (g/L) (g/L)
XTU
[TUL]0 g/L mol / L
[FDS]0 g / L mol / L 2,918 4,376 5,835 0,019 0,029 0,038
7,189 2,765 0,292 10,506 4,424 0,292 14,377 5,530 0,292
7,083 0,093 10,624 0,140 14,166 0,186
Clculos Volumtricos
Clculos Estequiomtricos
A.4.
Clculo del Orden Global de Reaccin Para determinar el orden global de reaccin en funcin de la concentraciones de TU y FDS, tendremos en cuenta la ecuacin (E2) que en su forma general viene expresada por:
Donde: KR a : constante de reaccin : orden de reaccin respecto a la concentracin de TU : orden de reaccin respecto a la concentracin de FDS
experimentales de concentraciones de TU, FDS y Au mostrados en la
Los parmetros KR, a, y b, se determinarn a partir de los datos
Tabla IV-12 efectuando una regresin lineal multivariable por mnimos cuadrados (Anexo IV). Para ello primero expresamos la ecuacin cintica anterior en forma lineal tomndole logaritmos naturales a ambos trminos de la ecuacin como se muestra a continuacin:
- 118 -
Aplicando los criterios del Anexo IV y haciendo uso del Software de Ingeniera Mathcad pudimos determinar los parmetros requeridos. El planteamiento y los clculos para llegar a la solucin deseada son mostrados a continuacin en formato Mathcad:
i := 1 .. n
:=
W TU
CwAu i 9.53 18.75 26.34 11.85 15.22 17.68 19.89 21.93 14.38 15.87 17.35 18.75 19.94
150 150 150 77.02 108.2 135.22 158.95 179.80 129.23 120 112 105 98.82
30.2412 45.3603 60.4815 39.3217 42.3419 45.3608 48.3904 51.4069 39.3142 42.3379 45.3608 48.3857 51.4095
XTU := KX t i i
CwAu i CAu := PM 1000 i Au W TUi PurTU 1000 CiTU := Vsol PM i
TU
CTU.0 := CiTU 1 XTU i i i
CAu i rAu := i tLix
rAu = i 8.0610-7 1.5910-6 2.2310-6 1.0010-6 1.2910-6 1.5010-6 1.6810-6 1.8610-6 1.2210-6 1.3410-6 1.4710-6 1.5910-6 1.6910-6
CFDS.0 := CiTU i i
XTU i 2
XTU = i 0.292 0.292 0.292 0.150 0.210 0.263 0.309 0.350 0.251 0.233 0.218 0.204 0.192
CiTU = i 0.131 0.197 0.263 0.171 0.184 0.197 0.210 0.223 0.171 0.184 0.197 0.210 0.223
CTU.0 = i 0.0930 0.1396 0.1861 0.1452 0.1452 0.1452 0.1452 0.1452 0.1279 0.1410 0.1541 0.1673 0.1804
CFDS.0 = i 0.0192 0.0287 0.0383 0.0128 0.0194 0.0259 0.0325 0.0391 0.0215 0.0215 0.0215 0.0215 0.0215
CAu = i 4.8410-5 9.5210-5 1.3410-4 6.0210-5 7.7310-5 8.9810-5 1.0110-4 1.1110-4 7.3010-5 8.0610-5 8.8110-5 9.5210-5 1.0110-4
Se tiene el siguiente sistema de ecuaciones
A 1 x + B1 y + C1 z D1 A 2 x + B2 y + C2 z D2 A 3 x + B3 y + C3 z D3
- 119 -
Donde:
D1 :=
i=1
ln rAu
D2 :=
i=1
ln CTU.0i ln rAu i
D3 :=
i=1
ln CFDS.0 ln rAu
i
C1 :=
i=1
ln CFDS.0
C2 :=
i=1
ln CTU.0 ln CFDS.0 C3 := i i
i=1
ln CFDS.0i
B1 :=
i=1
ln CTU.0
B2 :=
i=1
ln CTU.0 i
B3 := C2
A 1 := n
A 2 := B1
A 3 := C1
Resolviendo los valores de las sumatorias, tenemos:
A 1 = 13.00000 A 2 = 25.05867 A 3 = 48.59820 B1 = 25.05867 B2 = 48.65172 B3 = 93.85749 C1 = 48.5982 C2 = 93.85749 C3 = 182.81605 D1 = 174.89701 D2 = 337.56512 D3 = 654.59486
Luego, resolviendo el sistema de ecuaciones por Mathcad, tenemos:
xval yval := Find ( x, y , z) zval
xval = 9.61 yval = 0.98 zval = 0.52
Finalmente, en la ecuacin cintica: KR = e
xval
, por lo tanto: y
KR = 6.7 x 10-5
a = yval = 0.98 = 1.0
por tanto:
a + b = 1.5 (orden global de reaccin)
b = zval = 0.52 = 0.5
- 120 -
A.5.
Efecto del pH de la solucin lixiviante Todas las pruebas tuvieron las siguientes caractersticas:
XTU 0,292 [TUL]0 mol / L 0,1396 g/L 10,624 [FDS]0 mol / L 0,0287 g/L 4,376
El efecto del pH sobre la lixiviacin de oro calculado a partir de la Tabla IV-14, se muestran en la Tabla y grafico siguientes:
Tabla IV-35. Efecto del pH de solucin sobre el grado de conversin de oro. pH tLix (min) 0 60 120 180 240 300 360 60% 50% Vsol (mL) 3000 2995 2990 2985 2980 2975 2970 1.52 3.00 4.51 Concentracin de Au en Solucin % = XAu 0.0% 11,1% 20,8% 31,5% 39,6% 47,0% 54.9% % = XAu 0,0% 10,6% 20,3% 29,4% 37,5% 44,6% 51,3% % = XAu 0,0% 7,3% 14,3% 21,0% 23,7% 25,9% 26,0%
% Extraccin de Au
40% 30% 20% 10% 0% 0 50
pH = 1.52 pH = 3.00 pH = 4.51
100
Tiempo (min)
150
200
250
300
350
400
Grfico IV-21. Efecto del pH en la extraccin de Au. [TUL]0 = 10.624g/L, [FDS]0 = 4.376 g/L
- 121 -
B. B.1.
Estudio de lixiviacin por tiempos prolongados Conversin de oro y modelo matemtico de la etapa controlante Con los datos mostrados en la Tabla IV-15, calculamos las conversiones de oro y asumiendo que la etapa controlante est gobernada por reaccin qumica y sigue el modelo del ncleo decreciente calculamos 1-(1-XAu)1/3.
Tabla IV-36. Clculo XAu y 1-(1-XAu)1/3. Control por reaccin. Tiempo (Hrs) 0 2 4 6 8 10 12 14 16 18 20 22 23 100% 90% 80% 70% CAu (mol/L) 0,000E+0 1,957E-4 3,588E-4 4,929E-4 6,003E-4 6,742E-4 7,217E-4 7,719E-4 7,784E-4 7,931E-4 7,959E-4 7,973E-4 7,974E-4 [TUL] (mol/L) 0,13976 0,13956 0,13940 0,13926 0,13916 0,13908 0,13904 0,13899 0,13898 0,13896 0,13896 0,13896 0,13896 [FDS] (mol/L) 0,02879 0,02869 0,02861 0,02854 0,02849 0,02845 0,02842 0,02840 0,02840 0,02839 0,02839 0,02839 0,02839 XAu 0,0000 0,2286 0,4192 0,5757 0,7013 0,7876 0,8431 0,9017 0,9093 0,9264 0,9297 0,9314 0,9315 1-(1-XAu)1/3 0,00000 0,08289 0,16565 0,24858 0,33152 0,40332 0,46062 0,53854 0,55064 0,58093 0,58721 0,59061 0,59084
% Extraccin
60% 50% 40% 30% 20% 10% 0% 0 5 10
pH = 1.50 Peso TU = 15.0206 g/L Inicio de Lixiviacin: [TUL]0 = 10.6383 g/L [FDS]0 = 4.3823 g/L
Tiempo (Hrs)
15
20
25
Grfico IV-22. Disolucin de oro por tiempos prolongados
- 122 -
0.35 0.30 0.25 Datos Experimentales
1-(1-XAu)1/3
0.20 0.15 0.10 0.05 0.00 0 100 200 300 400 500 1-(1-XAu)1/3 = 6,9110-4 t R = 1,0
Tiempo (min)
Grfico IV-23. Reaccin Qumica como etapa controlante durante las primeras 8 horas de lixiviacin. Modelo del Ncleo Decreciente.
B.2.
Modelos matemticos de las etapas del proceso de lixiviacin Las etapas de la cintica de lixiviacin se muestran en el siguiente grfico:
0.75 Etapa Controlante: Rxn Qumica experimental
1-(1-XAu)1/3
0.50
0.25
Despus de 8 horas de lixiviacin el proceso pasa a ser gobernado por un mecanismo de difusin a travs de los slidos
0 5 10 15 20 25
0.00
Tiempo (Hrs)
Grfico IV-24. Etapas controlantes de la cintica de lixiviacin de oro
- 123 -
B.3.
Balance de masa en la lixiviacin de Au con TU Para efectuar la cuantificacin del balance de materia para determinar el peso de TU consumido, se puede seguir dos criterios: 1. En base a los resultados obtenidos de la titulacin volumtrica con KIO3, los que son aproximados. 2. En base a un balance estequiomtrico referido a la concentracin de oro en la solucin el cul fue determinado por absorcin atmica en laboratorio externo. En esta parte, para la evaluacin del consumo de reactivos, tomaremos en cuenta los resultados obtenidos por titulacin volumtrica.
Tabla IV-37. Balance de masa (volumetra) y
terico (estequiometria) de TU y Au despus de la lixiviacin. KIO3 (mL) 0,68 0,96 0,28 Reactivos TU y FDS Real (g/L) 10,0271 14,1559 4,1288 0,1571 Terico (g/L) 10,5776 14,8992 4,3216 Total 40,1083 56,6234 16,5152 0,6283
Reactantes TUL TUT FDS Au
El requerimiento de TU para una lixiviacin de un concentrado aurfero de las caractersticas de la muestra tiene los siguientes componentes: % Extraccin en 23 horas de Lixiviacin: Peso Total remanente de TU: Peso de TU consumido por rxn con Au: Peso total real de TU consumido: Peso de TU consumido en rxns colaterales: Consumo porcentual de TU: Consumo global de TU: 93.15% 56.6234 g 0.4856 g 3.4589 g 2.9733 g 5.76% 1.73 kg / TM mineral
- 124 -
Para poder determinar de un modo ms explcito el balance de de TU, encargamos un anlisis del residuo slido del concentrado obtenido despus de la lixiviacin. Los resultados de este anlisis se muestran a continuacin:
Tabla IV-38. Anlisis mineralgico del residuo slido de lixiviacin
Elemento Azufre total (S) Arsnico (As) Antimonio (Sb) Cobre (Cu) Fierro (Fe) Oro (Au) Plata (Ag)
Concentracin 18,96% 4,22% 0,23% 0,84% 28,53% 23,05 g/TM 2,62 g/TM
A partir de los resultados de la tabla anterior, podemos discriminar el consumo de TU como consecuencia de todas las interacciones ocurridas durante el proceso de lixiviacin. De este modo se tiene: % Extraccin de Ag =(52.36-2.62)*100/52.36 = 95% Peso de Ag extrado = (52.36-2.62)*2/1000 = 0.0995 g Peso de TU consumido por Ag = 0.2106 g Peso S final Peso S inicial = (18.96-18.91)*2000/100 = 1 g Peso de TU convertido a S = 1*76.12/32 = 2.3788 g Peso de TU consumido en otras reacciones = 2.9733-2.3788-0.2106 = 0.3839 g
- 125 -
C.
Electrodeposicin Haciendo uso del Reactor 3 representado por la Figura IV-2 y Fofo IV-11
en esta etapa experimental y con los datos de las Tablas IV-16, IV-17 y IV-18, en las condiciones descritas en la pgina 98, despus de 4 horas de electrodeposicin tenemos: Balance Metalrgico: Por Au: Peso inicial disuelto en solucin impregnada: Peso final disuelto en solucin impregnada: % de Au transferido a travs de membrana: Peso de Au transferido a travs de membrana: Peso residual de Au disuelto en catolito: Peso de Au electrodepositado en lana: % Eficiencia electrodeposicin de Au: % Eficiencia de Electrodilisis de Au: %Recuperacin Global Au: Por Ag: Peso inicial disuelto en solucin impregnada: Peso final disuelto en solucin impregnada: % de Ag transferido a travs de membrana: Peso de Ag transferido a travs de membrana: Por TU: Licor de lixiviacin (2 litros): [TUT] en licor de lixiv. inicio de electrodeposicin: [TUT] en solucin barren final de la prueba: (1) Peso total perdido de TU en licor de lixiviacin: AuTU2+ transferido a travs de membrana: (2) Peso de TU transferido como complejo AuTU2+: 14.1559 g/L 14.0084 g/L 0.2949 g 1.045 x 10-3 moles 0.1591 g 0.0497 g 0.0225 g 54.8% 0.0273 g 0.3141 g 0.1083 g 65.5% 0.2058 g 0.0071 g 0.1987 g 96.5% 63.3% 58.9%
- 126 -
Catolito: [TUT] inicio de electrodeposicin: [TUT] final de electrodeposicin: (3) Peso total de TU ganado en el catolito: (4) Peso total de TU en reaccin [(1)+(2)]: TU consumido en electrodeposicin {(4)-(3)}: Consumo especfico de TU: Electrodeposicin: Lixiviacin: Consumo total de TU: Por H2SO4 (5 mL <> 10.6311 g): Pre-lixiviacin (0.5% v/v solucin): Preparacin de solucin lixiviante: 10 mL / kg de mineral 1.3 mL / kg de mineral 0.0352 kg TU / TM mineral 1.7294 kg TU / TM mineral 1.7647 kg / TM mineral 10.0005 g/L 10.8381 g/L 0.4188 g 0.4540 g 0.0352 g
Preparacin del catolito (oxidacin): 0.35 mL (pH = 1.4, V = 0.5 L) Control de pH catolito (oxidacin): Lixiviacin (regulacin de pH): Electrodeposicin En catolito (para control pH = 1.5): 0.6 mL (en 4 hrs) En anolito (pH inicial = 10.5): Requerimiento total de H2SO4: Consumo neto de H2SO4: Finalmente: Consumo neto de H2SO4: 11.00 L / TM mineral 23.39 kg / TM mineral Consumo neto de NaOH: 0.3 kg / TM mineral 0.3 g de NaOH 12.65 mL / kg mineral 11.00 mL / kg mineral 0.4 mL (2.5 hrs oxidacin) 0.0 mL (constante)
- 127 -
D.
Discusin de Resultados.
[1] Los grficos IV-1 y IV-11 indican que al usar un electrodo rgido de
grafito para electro-oxidar en condiciones reversibles la TU, el potencial impuesto por la fuente de corriente continua debe ser aproximadamente como mximo 4.5 V Sin embargo, si se usara un electrodo fabricado con otro(s) material(es), el potencial impuesto por la fuente ser diferente ya que la polarizacin y la energa de activacin son propios del tipo de material del que est compuesto el electrodo, los cuales no fueron determinados por que estn fuera del alcance de este trabajo.
[2] En la determinacin de la constante cintica (
en las reacciones
de electro-oxidacin de TU, un mtodo ms riguroso con fines de investigacin sera la determinacin de la conversin de XTU a partir de las concentraciones del reactivo determinadas por titulaciones
potenciomtricas con KIO3. Sin embargo, el grado de conversin de TU alcanzado en 2.5 horas de oxidacin est dentro del promedio con el que varios investigadores realizaron pruebas de lixiviacin usando oxidantes qumicos para formar FDS en un nivel deseado.
[3] Las pruebas de lixiviacin nos muestra que cuanto ms alto es la
concentracin de TU, ms alto es la velocidad de lixiviacin inicial de oro. Este comportamiento no es igual respecto al FDS, ya que solo cuando la concentracin es mayor o igual a 4 g/L aumenta apreciablemente la velocidad de disolucin. En cuanto al efecto del pH, este tiene efecto positivo en el rango de 1.5 a 3.0; a mayores valores, el porcentaje de extraccin se ve afectado probablemente por una reduccin drstica de la concentracin de TU.
[4] El incremento de concentracin de TU total en el catolito durante la
electrodeposicin se debe fundamentalmente a la reduccin del complejo AuTU2+ sobre el ctodo y, a la reduccin del FDS que se transport desde el licor de lixiviacin hasta el catolito a travs de la membrana catinica y se redujo sobre el ctodo.
- 128 -
CAPITULO V ESTUDIO DE PREFACTIBILIDAD PARA INSTALACION DE UNA PLANTA DE PROCESO DE 25 TM/DIA
Si tenemos en cuenta las ventajas que presenta la tiourea respecto al cianuro como agente lixiviante del oro en lo que corresponde a la cintica de disolucin, podemos decir que la cantidad de mineral procesado con el primer reactivo es por lo menos el doble que el procesado con el segundo. Esto quiere decir por ejemplo que mientras con el proceso de tiourea se podra procesar 25 TM de mineral por da, con el proceso de cianuracin slo podramos tratar alrededor de 12.5 TM/da. Esto representa una gran ventaja ya que al hacer una evaluacin econmica el horizonte de proyecto en el caso de la tioureacin sera la mitad del proceso de cianuracin. Otra de las ventajas es que el proceso de tioureacin es menos susceptible a las interferencias de los materiales refractarios y esto traduce en un mayor grado de disolucin de oro, lo que a la postre conduce a una mayor rentabilidad ya que se puede extraer mas produccin de oro por cada TM de mineral. Una ventaja adicional del proceso propuesto es la electrodeposicin directa del oro a partir de los licores de lixiviacin, lo cual se logra va concentracin del electrolito (AuTU2+) por electrodilisis. En este sentido se puede obviar el proceso de desorcin de carbn activado para la elucin de los complejos valiosos. Por lo expuesto anteriormente podemos estimar un estudio de pre factibilidad comparando ambos procesos, para lo cual debemos tener en cuenta los siguientes supuestos:
Ley Au Precio internacional Costo de Produccin de Mineral + Transporte (US $/TM) Das de Operacin por ao Capacidad de Planta (TM/Da) 0,5 800 110 336 25 Oz/TM $/Oz $/TM DIAS TM/Da
- 129 -
La inversin estimada para cada proceso vine dado por: 1. PRESUPUESTO ESTIMADO DE EQUIPOS
EQUIPOS TOLVA GRUESOS FAJA TRANSPORTADORA CHANCADORA FAJA TRANSPORTADORA TOLVA DE FINOS FAJA TRANSPORTADORA MOLINO DE BOLAS 4 X 5 BOMBA DE PULPA 2 X 2 1/2 HIDROCICLON D6 MESA GRAVIMETRICA ESPESADOR TANQUES DE 3 m X 3,5 m FILTRO PRENSA DESORCION 2 CONTROLADORES DE pH 1 CONTROLADOR REDOX CELDA DE ELECTRODIALISIS CELDA ELECTROQUIMICA RECTIFICADOR DE CORRIENTE FUNDICION Y REFINACION BOMBAS DE AC. INOXIDABLE REACTOR ELECTRO-OXIDACION MEMBRANAS DE INTERCAMBIO IONICO (3,5 m2) TUBERIAS Y ACCESORIOS GENERADOR ELECTROGENO RELAVERA LABORATORIO OTROS TU 2500 3000 7000 2500 2000 2000 18000 2400 1500 5000 15000 60000 15000 14000 7000 5000 2500 3000 2100 3000 3500 1500 70000 35000 25000 30750 1000 2500 3000 2100 3000 3500 1500 70000 35000 25000 22550 CN 2500 3000 7000 2500 2000 2000 18000 2400 1500 5000 15000 18000
2. COSTOS OPERATIVOS
COSTO DE PROCESO (MAQUILA) (US $/TM) COSTO TOTAL PRODUCCION (US $/TM) CAPITAL DE TRABAJO DIAS INVERSION INICIAL EN TIOUREA TOTAL CAPITAL DE TRABAJO 85 195 80 190
7 11250 45375
33250
3. PRODUCCION SUPUESTA DE ORO
Total Au/Da Recuperacin Total Au por ao (Onzas Troy) 12,5 80% 3360 12,5 70% 2940
- 130 -
4. FLUJO DE CAJA ECONOMICO ESTIMADO DE PROCESO DE TIOUREACION Y CIANURACION
TU CN TECNOLOGIA Invers. en Activos Fijos (US$) 350000 250000 Costo de Instalacin (US$) 51000 37000 Capital de Trabajo (US$) 45000 33000 Costo de Producc. (US$/Ao) 1638000 1596000 Gastos en Ventas (US$/Ao) 79800 79800 Costo de Manten. (US$/Ao) 49140 47880 Vida til 5 aos Valor de Recupero (US$) 75000 40000 Depreciacin (US$) 70000 50000 Ao Inversin Inicial (US $) Ingresos (US $) Egresos (US $) Flujo antes de I R (US $) I. R. (US $) Flujo despus de I R (US $) Venta Activos Fijos (US $) Retorno Cap. Trabajo (US $) Escudo Fiscal (US $) Flujo Neto de Fondos 0 446000 1 TIOUREA 2 3
I.R. = 30.0% T.D. = 13.3% 4 5 0 320000 1 CIANURO 2 3 9 5
2688000 2688000 2688000 2688000 2688000 1766940 1766940 1766940 1766940 1766940 921060 921060 921060 921060 921060 276318 276318 276318 276318 276318 644742 644742 644742 644742 644742 75000 33750 21000 21000 21000 21000 21000 -446000 665742 665742 665742 665742 774492 TIRTIOUREA = 148% VPN = 1709424 VPNIngresos = 2382778 B/C = 5,3
2352000 2352000 2352000 2352000 2352000 1723680 1723680 1723680 1723680 1723680 628320 628320 628320 628320 628320 188496 188496 188496 188496 188496 439824 439824 439824 439824 439824 40000 33000 15000 15000 15000 15000 15000 -320000 454824 454824 454824 454824 527824 TIRCIANURO = 141% VPN = 1153734 VPNIngresos = 1627180 B/C = 5,1
- 131 -
FLOW SHEET DE PLANTA DE TIOUREACION PROPUESTA
(1) Mineral, (2) Tolva (3) y (6) Fajas transportadoras (4) Chancadora, (5) Zaranda (7) Molino, (8) Bomba de pulpa (9) Hidrocicln (10) Decantador esttico (11), (12) y (13) Reactores de lixiviacin (14) Filtro rotatorio contnuo (15) Celda de Electrodilisis (16) Precipitado de oro sobre lana de acero (17) Tanque de preparacin de TU y cido (18) y (21) Bombas centrfugas INOX (19) Reactor de electro-oxidacin de TU (20) Tanque de solucin cida (pH=2) (22) Relavera (23) Bomba centrfuga (24) Tanque de neutralizacin
- 132 -
CAPITULO VI
OBSERVACIONES, CONCLUSIONES Y RECOMENDACIONES
[1]
El electrodo en el que se llev a cabo la electro-oxidacin de TU, consta de una varilla de grafito usada en procesos de electro-erosin. Esta varilla fu unida por uno de sus extremos a un alambre de cobre con una resina epxica permitiendo que estuvieran en contacto en forma permanente. En la etapa de oxidacin se pudo notar que el potencial en el cual la corriente andica alcanza su valor mximo, es 4.5 voltios, lo cual difiere con el valor hallado por algunos investigadores con otros tipos de electrodos (Pt, Ti, Au). Este hecho nos permite comprobar que el potencial de oxidacin de la TU depende del material usado como electrodo de trabajo.
[2]
En la etapa de oxidacin de Tiourea, se observ un constate desprendimiento de gases desde el ctodo con un olor caracterstico a Hidrgeno, adems de que continuamente se incrementa el pH, lo que nos lleva a concluir que en la superficie de este electrodo se lleva a cabo la reaccin de reduccin del hidrgeno por lo que es recomendable adicionar cada cierto tiempo una dosis de cido sulfrico para mantener el pH constante.
[3]
Cuando la FEM estuvo por encima de 4.5 V, se pudo notar una ligera evolucin de gas desde el nodo y una cada de la corriente andica, los cuales evidencian que por encima de este potencial se lleva a cabo la reduccin de oxgeno formando una especie de colchn sobre la superficie del electrodo el que se comporta como un aislante evitando un flujo normal de corriente. Adems su pudo percibir un olor caracterstico a gases sulfhdricos lo que indica descomposicin de la Tiourea.
- 133 -
[4]
En razn de lo dicho anteriormente, podemos deducir que para el tipo de electrodo usado en la prueba, el mximo valor de la FEM aplicado por el Rectificador de corriente es 4.5 V. Para otros tipos de electrodos, se sugiere hacer pruebas preliminares a fin de determinar el potencial de oxidacin.
[5]
El grado de conversin de TU a FDS, es proporcional al tiempo de aplicacin de corriente. Lo que nos indica que si se pudiera aumentar el flujo de corriente manteniendo la FEM constante, el tiempo de oxidacin podra ser menor. Para ello la solucin electroltica debera contener mas iones disueltos, pero ello implicara la presencia de algn agente qumico oxidante que podra afectar a la Tiourea.
[6]
Se comprueba experimentalmente que el orden de reaccin de la velocidad de disolucin de oro es 1 respecto a la concentracin inicial de TU, y 0.5 respecto a la concentracin de FDS. Estos resultados contrastan con lo que menciona otra investigacin efectuada por J.D. Miller en Marzo de 1999, tal como se menciona en la Ecuacin (E2).
[7]
Se puede comprobar, que la velocidad de disolucin de oro es mayor cuanto ms alto es la concentracin inicial de Tiourea, pero por cuestiones de economa es recomendable trabajar con una concentracin inicial de TU disuelta en el orden de 15 g/L.
[8]
En el rango de 1.5 a 3, el pH de la solucin tiene poca influencia sobre el nivel de extraccin de oro (Grfico IV-21). Sin embargo, es aconsejable trabajar a pH cercano a 1.5 para mantener un margen de seguridad ante subidas imprevistas del pH
[9]
La cintica de disolucin de oro sigue el modelo de la esfera decreciente controlado por reaccin qumica durante las primeras 8 horas de lixiviacin, donde el grfico 1-(1-XAu)1/3 vs tLix es una lnea recta. Despus de las 8 horas la reaccin se hace ms lenta ya que la concentracin de oro libre ha disminuido notablemente, por lo que la reaccin pasa a ser
- 134 -
controlada por difusin de la Tiourea a travs de los slidos hasta alcanzar las partculas de oro. Esto se muestra en el Grfico IV-24.
[10]
Durante la lixiviacin, el pH, se mantuvo casi inalterable debido a que el slido fue tratado previamente con una solucin de cido sulfrico, eliminndole todos los agentes consumidores de cido. A escala industrial, sera aconsejable instalar un sistema automatizado para controlar el pH.
[11]
Se puede comprobar experimentalmente que la lixiviacin de concentrados sulfurosos de oro se lleva cabo con bastante eficiencia por el mtodo Acido-Tioureacin, alcanzando una extraccin porcentual de 93.15% para el oro y 95% para la plata en 23 horas de operacin, comparado a tiempos ms prolongados requeridos por la cianuracin los cuales son reportados en Plantas Metalrgicas.
[12]
El efecto de los agentes cianicidas sobre la disolucin de oro por Tiourea es mnimo, ello de demuestra por la escasa variacin de concentracin respecto al anlisis inicial de estos elementos.
[13]
El bajo ndice de consumo de TU en la lixiviacin de oro y la posibilidad de regenerar la mayor parte de ella durante la electrodeposicin, muestran que esta tecnologa es una alternativa viable para su uso a nivel comercial en los procesos de beneficio de minerales aurferos previamente concentrados.
[14]
En la prueba de electrodeposicin realizada por Jurez y Dutra, se us una membrana catinica marca Dupont tipo Nafion 417 el cual segn catlogo tiene una resistencia superficial entre 3.0 y 3.5 /cm2 y un espesor de 0.43 mm. En la prueba realizada en la presente Tesis, se us una membrana catinica marca Sybron Chemicals tipo MC-3470 cuya resistencia superficial est entre 10 a 25/cm 2 con un espesor de 15 mils (0.38 mm); lo que indica que la membrana tipo Nafion permite el paso a travs de ella de los cationes con mayor facilidad que la MC-3470. Adems que tiene mayor duracin por ser ligeramente ms grueso.
- 135 -
[15]
De lo anterior se puede deducir el motivo por el cual, slo el 65.5% de iones Au-Tu, lograron atravesar la membrana catinica hacia el compartimento catdico a pesar que se emple 4 horas en comparacin al empleado por Jurez y Dutra (2 horas). En todo caso a nivel comercial es recomendable usar las membranas Nafion por ser ms eficientes. Otra causa probable para una escasa transferencia de iones a travs de la membrana es el rea de transferencia reducida en comparacin al volumen del tanque contenedor del licor de lixiviacin. Para fines comerciales, habra que disear un sistema de intercambio de iones similar al de un equipo tubular de smosis inversa, conservando los mismos principios de la electrodilisis.
[16]
Lo anterior no aplica a la membrana aninica, porque en este caso, el objetivo es impedir el paso del DSF protonado hacia el nodo, y cuanto mayor resistencia tenga es mejor porque se evita mayor oxidacin de Tiourea.
[17]
Haciendo un balance global del consumo de Tiourea, se concluye que en total solo se ha consumido 1.76 kg de TU (1.8 kg) por tonelada mtrica de mineral, lo que representa una viabilidad econmica muy alta para el uso de este reactivo a escala industrial. Sin embargo, el consumo en casos reales, el consumo podra incrementarse levemente si no se efecta un pre tratamiento al mineral.
[18]
En trminos generales, la lixiviacin de minerales aurferos con Tiourea es una alternativa bastante interesante por la viabilidad econmica que muestra una rentabilidad bastante alta en las actuales circunstancias y porque se ha demostrado representa un menor riesgo de contaminacin respecto a la cianuracin.
- 136 -
- 137 -
ANEXO I
MTODO ANALTICO PARA CUANTIFICACIN DE TIOUREA Un mtodo bastante prctico y aproximado para cuantificar la concentracin de tiourea en una solucin es la Volumetra para el cual se utiliza Yodato de Potasio 0.1N como solucin titulante y como indicador una solucin acuosa de almidn al 0.2%. El punto final queda determinado por el viraje de color desde incoloro hacia azul violceo. Los criterios de cuantificacin son:
Figura IV-1: Tiourea
libre
La concentracin de Tiourea libre en una solucin cida se determina titulando con una solucin 0.1N de Yodato de Potasio utilizando como indicador almidn acuoso al 0.2%. La reaccin estequiomtrica es:
6 TU + KIO3 + 6 H + 3 FDS + 3 H 2 O + KI
Oxidacin: Reduccin: De donde se tiene:
En las reacciones de oxidacin y reduccin la TU pierde 1 electrn y el KIO3 gana 6 electrones. Por lo tanto TU=1 y KIO3=6.
Figura IV-2: Tiourea
total
Para determinar Tiourea total (TU y DFS), primero se reduce el DFS a TU con una pizca de zinc en polvo, se deja cinco minutos y se filtra el zinc en exceso. Luego, se titula la Tiourea con el yodato. De esta forma se sabe la concentracin del FDS por diferencia.
- 138 -
ANEXO II
REACCIONES QUIMICAS
Dependiendo del nmero de fases involucrado en las reacciones, existen dos tipos de reacciones qumicas: a) Reacciones homogneas: Donde todas las sustancias reaccionantes se encuentran en una sola fase: gaseosa, lquida o slida. Si la reaccin es catalizada, entonces el catalizador tambin deber estar en la misma fase. Tpicamente en los sistemas homogneos, la velocidad de reaccin est basada en la unidad de volumen del fluido reaccionante. De este modo, la velocidad de reaccin con respecto a un componente cualquiera se expresa por:
b)
Reacciones heterogneas: Donde estn involucrados dos a ms fases. Es indiferente si la Es
indiferente que la reaccin heterognea tenga lugar en una, dos, o ms fases, o en la interfase, o si los reactantes y los productos estn distribuidos entre las fases o estn todos contenidos en una sola fase; lo nico que interesa es que se necesitan, al menos, dos fases para que la reaccin transcurra del modo que lo hace. La ecuacin cintica de una reaccin heterognea, en general toma en cuenta ms de un proceso al incorporar en una ecuacin cintica global los distintos procesos que implican tanto etapas de transporte fsico como etapas de reaccin. Por lo tanto, la velocidad global de reaccin, simplemente ser la suma de todas las velocidades individuales de cada proceso, esto es:
- 139 -
Una reaccin controlada por transporte de materia, est definido por:
Y la etapa de reaccin se define por:
Es decir, la velocidad de reaccin en un sistema heterogneo se basa en la unidad de superficie. En una reaccin slido-fluido con densidad constante de la fase fluida, el proceso se puede llevar a cabo en un reactor de volumen constante, en este caso se tiene:
Donde VR CA km S n : Volumen del reactor : Concentracin del reactivo A en un tiempo cualquiera : Coeficiente de transporte de materia : Superficie de la fase slida : Orden de reaccin
Tanto la reaccin de electro-oxidacin de TU como la disolucin de oro, corresponden a reacciones heterogneas de volumen constante. Por lo tanto, la ecuacin anterior es aplicable tanto a la oxidacin electroqumica de la TU como a la lixiviacin del oro.
- 140 -
ANEXO III
MODELOS DE REACCIONES DE DISOLUCIN DE SLIDOS
En trminos generales, la extraccin de un metal por medios lixiviantes se lleva a cabo en un sistema slido-lquido. Existen diferentes modelos que describen el comportamiento cintico del proceso, entre los cuales los ms usados son de conversin progresiva y de ncleo decreciente o sin reaccionar. Modelo de Conversin progresiva: Se aplica a partculas porosas, en el cual se considera que el lquido lixiviante penetra y reacciona simultneamente en toda la partcula, pero lo ms probable es que las velocidades de reaccin son diferentes en distintos puntos de la partcula, debido a los perfiles de concentracin de los reactivos y productos. Por lo tanto, el reactante slido se est convirtiendo continua y progresivamente en toda la partcula tal como se muestra en la siguiente figura:
Figura II-1: Modelo de Conversin Progresiva. La reaccin se desarrolla en forma continua en toda la partcula slida.
Modelo de ncleo sin reaccionar: En este caso la reaccin tiene lugar primero en la superficie exterior de la partcula slida, despus la zona de reaccin se desplaza hacia el interior del
- 141 -
slido dejando atrs material completamente convertido y slido inerte (cenizas). De este modo durante la reaccin existir un ncleo de material sin reaccionar cuyo tamao ir disminuyendo a medida que transcurre la reaccin.
ELECCION DEL MODELO: El modelo de ncleo decreciente se aplica a partculas no porosas y ha demostrado, en la mayora de los casos y con base en evidencia experimental, ser el que representa con ms fidelidad el comportamiento real de lixiviacin en concentrados minerales. Se pueden considerar dos casos diferentes en relacin con este modelo. El primero de ellos supone que la formacin continua de producto slido y material inerte (ceniza), sin desprendimiento de escamas, mantendra invariable el tamao de la partcula. En el segundo, el tamao de la partcula vara en funcin del desarrollo de la reaccin, debido a la formacin de productos gaseosos, el desprendimiento de escamas de los slidos, etc. (mejor conocido como el modelo de partcula decreciente). La lixiviacin selectiva de metales preciosos de minerales y concentrados sulfurados, tiene un comportamiento que se adapta al modelo de ncleo decreciente, puesto que las partculas minerales no son porosas. Adems, dado que la partcula contiene ms de 90% de materiales inertes a las reacciones de lixiviacin, estos constituyen, junto con los productos de la reaccin, una capa de inertes, formando una estructura porosa firme. De esa manera la partcula conserva su forma y tamao durante el transcurso del proceso (Figura II-2). En este sistema se considera que la reaccin presenta las cinco etapas siguientes: 1. Transporte del agente lixiviante (TU) desde el seno de la solucin a la parte exterior de la partcula. 2. Difusin del agente lixiviante (tu) a travs de la capa de slidos inertes y sulfuros hasta el ncleo o superficie de reaccin. 3. Reaccin del lixiviante (TU) con el oro en la superficie slida del ncleo.
- 142 -
4.
Difusin del oro inico y otros productos de la reaccin formados, a travs de la capa de inertes hacia la superficie exterior del slido.
5.
Transporte de los productos disueltos desde la superficie de la partcula al seno de la solucin.
2 Au[CS(NH2)2]2+
Au2S
Au2S
1/2 FDS2+ + TU
Figura II-2: Modelo del ncleo decreciente
Si bien todos estos procesos ocurren, cualquiera o una combinacin de los mismos pueden controlar la velocidad de reaccin de la lixiviacin. La formulacin del modelo matemtico tradicional usado hasta la fecha para verificar el paso controlante de un sistema a partir de datos experimentales se basa adems en las siguiente suposiciones (Levenspiel, 1972). a) El sistema se considera isotrmico, es decir, que no existe gradiente de temperatura entre la solucin lixiviante y la partcula slida. b) Se considera que la partcula del mineral es aproximadamente esfrica y mantiene esta forma y tamao durante toda la lixiviacin. c) Dadas las bajas concentraciones de reactivo y producto en la solucin, se puede despreciar el flujo neto del lquido debido a la difusin en los poros. d) Se considera una cintica irreversible de primer orden con respecto a la concentracin del agente lixiviante (TU) del tipo:
- 143 -
aA(l) + bB(s) productos(fluido y/o slido) Donde a y b son coeficientes estequiomtricos. e) El agente lixiviante (TU) se encuentra en exceso estequiomtrico, por ende puede considerarse que la concentracin es constante durante todo el tiempo de lixiviacin. f) Se considera que el sistema se encuentra en estado pseudo-estacionario. Esto implica que la difusin a travs de la capa de inertes es rpida comparada con la velocidad de desplazamiento del plano de reaccin. En este trabajo, la agitacin utilizada es suficiente para poder despreciar la resistencia por la transferencia de masa en la pelcula de fluido externa al slido. Por eso, las concentraciones de las especies qumicas en la superficie de la partcula son consideradas iguales a las del seno de la solucin. Para estas partculas esfricas de tamao constante el tiempo de lixiviacin para alcanzar una conversin determinada, XB, vara de acuerdo con la etapa controlante. Estas funciones se muestran en la siguiente tabla.
Partcula de Tamao Constante Esfera Controlada por difusin en la pelcula Controlada por difusin en las cenizas Controlada por reaccin
Donde:
Donde:
Donde:
Rc: radio del ncleo
sin reaccionar
Donde:
molar De: difusividad efectiva de A en ks: constante cintica del oro en el mineral la capa de inertes n: orden de reaccin Rp: radio de la CAg: concentracin de A en el kg: coeficiente de partcula transferencia de seno del fluido masa
B:densidad
b: coeficiente estequiomtrica
Tabla A II-1. Expresiones conversin-tiempo para partculas esfricas de tamao cte.
- 144 -
Dado que las resistencias actan en serie, el tiempo necesario para alcanzar cualquier grado de conversin es igual a la suma de los tiempos necesarios, si cada resistencia actuara aisladamente. Finalmente, con el objeto de la determinacin de la cintica y de las etapas controlantes de la velocidad en una reaccin slido-fluido, se grafica la conversin de las partculas (expresiones de la Tabla A II-1) con respecto al tiempo, dando una lnea recta que pasa a travs del origen cuando alguna de las etapas controla. En esta investigacin se asume que cuando las partculas de oro se encuentran en estado libre, la disolucin estar controlada por reaccin qumica; pero cuando las partculas de oro forman parte de un conglomerado junto a otras partculas inertes, la disolucin est gobernada por difusin a travs de las cenizas.
- 145 -
ANEXO IV
ELECTRODIALISIS
Es un procedimiento de separacin con membranas que tiene por objeto concentrar (o diluir) disoluciones de electrolitos mediante el uso de membranas de intercambio inico y la aplicacin de un potencial elctrico.[23] La electrodilisis tiene bastante aplicacin en el tratamiento de aguas, pero ltimamente se estn probando con mucho xito en los circuitos de electroobtencin de cobre.
Bajo los efectos de una corriente elctrica los aniones y cationes pasan por las membranas y forman una solucin electroltica concentrada, lo que separa las impurezas del agua residual que est siendo tratada.
Figura A III-1. Funcionamiento de un Mdulo de Electrodilisis
[24]
Las unidades de electrodilisis consisten en lotes de membranas alternas de intercambio de cationes e intercambio de aniones, (frecuentemente dos
- 146 -
membranas o ms que estn colocadas a manera de una pila en forma anloga al intercambiador de calor), que son permeables a los cationes y aniones respectivamente.[25] Toda la pila se coloca entre una serie de electrodos de corriente Directa (CD) que forman un campo elctrico, bayo cuya influencia los cationes migran en direccin de la corriente elctrica, esto es, al polo negativo y pasan a travs de la membrana catinica hacia la solucin salina de lavado, que se recicla durante la operacin. Los aniones migran en direccin opuesta de la corriente elctrica, es decir, hacia el polo positivo y pasan a travs de la membrana aninica hacia la solucin salina de lavado.[26] Una Celda de Electrodilisis de tres compartimentos tal como se usa en esta investigacin tiene la siguiente forma:
Figura A III-2. Celda de Electrodilisis de tres compartimentos[27]
- 147 -
Figura II-11. Esquema de una unidad de Electrodilisis
[28]
- 148 -
ANEXO V
DETERMINACION DEL ORDEN DE REACCION POR EL METODO DE LOS MINIMOS CUADRADOS 1. 1.1. Regresin Lineal por el Mtodo de Mnimos Cuadrados Regresin Lineal: Se define como un procedimiento mediante el cual se trata de determinar si existe o no relacin de dependencia entre dos o ms variables. Es decir, conociendo los valores de una o ms variables independientes, se trata de estimar los valores, de una variable dependiente. La regresin lineal puede ser simple o mltiple. Regresin Lineal Simple.- Este tipo se presenta cuando una variable independiente ejerce influencia sobre otra variable dependiente. Ejemplo: y = f(x) Regresin Lineal Mltiple.- Este tipo se presenta cuando dos o ms variables independientes influyen sobre una variable dependiente. Ejemplo: y = f(x1, x2,., x3). 1.2. Anlisis de Regresin Lineal:[29] Si en una investigacin se efectan i pruebas y se obtienen i resultados experimentales de y a partir de i datos de xk, entonces el anlisis de regresin lineal de estas pruebas experimentales se puede realizar mediante la siguiente ecuacin de regresin: yi = a0 + a1 x1i + a2 x2i + a3 x3i +..+ ak xki en donde k es el nmero de variables independientes y a0, a1, a2,.., ak; son parmetros constantes que se determinan a partir de los datos experimentales generando un sistema de k+1 ecuaciones por el mtodo de mnimos cuadrados. Este sistema de ecuaciones est dado por:
- 149 -
Estas ecuaciones se pueden resolver para a0, a1, a2,..., ak mediante cualquier mtodo apropiado para resolver sistemas de ecuaciones lineales. 2. Orden de Reaccin por el Mtodo de Mnimos Cuadrados Dada la siguiente reaccin qumica: y, si consideramos que la velocidad de reaccin de A depende de las concentraciones de B y C, entonces se tiene que:
Esta ecuacin se puede linealizar tomando logaritmos a ambos miembros y expresndolo de la siguiente manera:
La ecuacin anterior tiene la siguiente forma:
Aplicando mnimos cuadrados se tiene el siguiente sistema de ecuaciones:
- 150 -
ANEXO VI
FOTOGRAFIAS
Figura IV-1: Mesa gravimtrica usada en la obtencin del concentrado
Figura IV-2: Obtencin del concentrado aurfero sobre Mesa gravimtrica
- 151 -
Figura IV-3: Presentacin de Tiourea y Yodato de Potasio usados
Figura IV-4: Voltamperometra. Celdas andica y catdica unidas con puente salino. Anodo: varilla de grafito, Catodo: tubo de grafito.
- 152 -
Figura IV-5: Pruebas de Voltamperometra. Mediciones de potencial andico (varilla de grafito) respecto al electrodo de AgCl.
Figura IV-6: Circuito de Electro-oxidacin de Tiourea. (1) reactor electroqumico de flujo, (2) Tanque de agitacin de 3.2 L.
- 153 -
Figura IV-7: Estructura del reactor electroqumico
1 2
Figura IV-8: Partes del reactor electroqumico. (1) Anodo, en su superficie se oxida la tiourea; (2) Ctodo; (3) Membrana aninica.
- 154 -
Figura IV-9: Reactor de pruebas Figura IV-10: Reactor para pruebas de cortas de lixiviacin en lixiviacin prolongados. operacin. 5 L. Acero Inoxidable. 8.5 L.
Figura IV-11: Reactor de electrodeposicin. Colocando el nodo de plomo (izquierda) y el ctodo de lana de acero (derecha).
- 155 -
Figura IV-12: Reactor de electro-dilisis en funcionamiento. Borne color rojo (polo negativo) en compartimento catdico.
Figura IV-13: Electro-obtencin de oro sobre lana de acero. Se nota el amarillamiento de la lana debido al depsito de oro comparado con el color inicial del acero.
- 156 -
REFERENCIAS BIBLIOGRAFICAS
PGINAS WEB:
[1]
www.igme.es/internet/recursosminerales/panoramaminero/minerales/oro03 .htm
[2]
www.minem.gob.pe/publicacion.php?idSector=1&idPublicacion=6. Anuario Minero 2008, Anexo Estadstico.
[3] [4]
www.snmpe.org.pe/pdfs/Informe_Quincenal/EEES-IQ-08-2004-IA.pdf http://pe.kalipedia.com/fotos/oronativo.html?x=20070417klpcnatun_41.Ies
[5]
http://images.google.com.pe/imgres?imgurl=http://img.mercadolibre.com.p e/jm/img%3Fs%3DMPE%26f%3D7735567_3130.jpg%26v%3DP&imgref url=http://articulo.mercadolibre.com.pe/MPE-7735567-mina-de-oro-a-seish.
[6] [7] [8] [9] [10] [11] [12] [13]
http://www.youtube.com/watch?v=nG9IptCOrzA&feature=related http://www.elestanque.com/articulos/contaminacion_esquel.html http://news.bbc.co.uk/hi/spanish/business/newsid_2592000/2592367.stm http://www.skyscrapercity.com/showthread.php?t=271077&page=18 http://sisbib.unmsm.edu.pe/BibVirtualData/libros/ecologa/Oro_del_Peru http://www.gama-peru.org/libromedmin/capitulo/5/5-4-2-1-6.htm www.youtube.com/user/fhruschka http://geco.mineroartesanal.com/tikibrowse_image.php?galleryId=7&sort_mode=created_desc&imageId=110 &scalesize=500
[14] [15]
www.gama-peru.org/libromedmin/capitulo/5/5-3-1.htm www.gama-peru.org/libromedmin/capitulo/5/5-6-2.htm
- 157 -
[16] [17] [18] [19] [20]
http://www.flickr.com/photos/on_om/1132742236/ http://www.copper.rs/copper_ore.html http://www.drm.cl/softdrm.htm http://www.arasi.com.pe/conte_descrip_proce.htm http://www.pacificrim.com.sv/s/El_Uso_del_Cianuro_en_la_Mineria_de_ Oro.asp
[21] [22] [23] [24] [25] [26] [27] [28] [29]
www.conicet.gov.ar/diarios/2005/julio/012.php www.pucp.edu.pe/acad/ciuf/metalurgia/E/pdf/Evaluacion.pdf http://emhd.es/doc/presentacion.ppt http://cabierta.uchile.cl/revista/29/mantenedor/sub/educacion_4.pdf www.aguamarket.com/diccionario/terminos.asp?Id=755 www.geafiltration.com/Espanol/electrodialisis.htm http://www.ucm.es/info/diciex/proyectos/agua/mares_central.html http://www.infoambiental.es/html/files/pdf/amb/iq/361/04articulo.pdf www.uesiglo21.edu.ar/site/departamentos/.../UNIDAD07.pdf
TEXTOS Y ARTICULOS:
(1)
EDGAR B. ALACAL C., ALFREDO FLORES C., ARTURO BELTRN A. Manual de Entrenamiento en Concentracin de Minerales. Seccin V. Servicio Nacional de Geologa y Tcnico de Minas SERGEOTECMIN. Bolivia. www.sergeomin.gov.bo/Documentos/
(2)
SACC INGENIEROS SRL. Metalurgia del Oro en la Franja Aurfera Palpa-Ocoa. Mdulos de Capacitacin Tcnico Ambiental. Mollehuaca, Ica, Lima, 2004. Geco.mineroartesanal.com/tiki-
download_wiki_attachment.php?attId=135
- 158 -
(3)
STEPHEN GOS, ANDREAS RUBO. The Relevance of Alternative Lixiviants With Regard to Technical Aspects, Work Safety and Environmental Safety. Degussa AG, Rodenbacher Chaussee 4, Hannau, Germany.
(4)
JINSHAN LI, JAN D. MILLER. A Review of Gold Leaching in Acid Thiourea Solutions. Department of Metallurgical Engineering. University of Utah. Mineral Processing and Extractive Metallurgy Review.2006
(5) (6) (7) (8)
TECSUP VIRTUAL. Hidrometalurgia del Oro. FIDEL MISARI. Metalurgia del Oro. V-I. FIDEL MISARI. Metalurgia del Oro. V-II. ROBERTO DE B. EMERY TRINDATE. Tiouria e Bromo como Lixiviantes Alternativos Cianetao do Ouro. Srie Tecnologa Mineral, Rio de Janeiro, n. 67, 1994.
(9)
G. DESCHENES. Investigation on the Potential Techniques to Recover Gold From Thiourea Solution. Gold Metallurgy, Mineral Sciences Laboratories. CANMET, Energy, Mines and Resources Canada.
(10)
J. LI, J.D. MILLER. Reaction Kinetics for Gold Dissolution in Acid Thiourea Solution Using Formamidine Disulfide as Oxidant. SME Annual Meeting. Preprint 99-62. 1999, Denver, Colorado.
(11)
S. AGUAYO SALINAS, M.A. ENCINAS ROMERO, I. GONZALES. Electrochemical Dissolution of Calaverite (AuTe2) in Thiourea Acidic Solutions. 1996. Journal of Applied Electrochemistry 28 (1998) 417-422.
(12)
HARVANOV J. The Electrochemical Study of Thiourea Behaviour by Cyclic Voltamperometry. Acta Metallurgica Slovaca, 4, Special Issue 4/2001, (58 61).
(13)
HONGGUANG ZHANG, IAN M. RITCHIE, AND STEVE R. LA BROOY. Electrochemical Oxidation of Gold and Thiourea in Acidic
- 159 -
Thiourea Solutions. Journal of The Electrochemical Society. 148 (10) D146-D153 (2001)
(14)
A. E. BOLZN, T. IWASITA, A. J. ARVIA. In situ FTIRRAS study of the electro-oxidation reactions of thiourea and gold in aqueous acid solutions. Journal of Electroanayitical Chemistry 554-555 (2001) 49-60. Science Direct.
(15)
C. M. JUAREZ, A. J. B. DUTRA. Gold Electrowinning from Thiourea Solutions. Minerals Engineering, Vol. 13, No. 10-11, pp. 1083-1096, 2000. Elsevier Science Ltd.
(16)
ZHU
Ping,
GU
Guo-bang,
JIA
Bao-qiong.
SOUTH
CHINA
UNIVERSITY OF TECHNOLOGY. Recovery of Gold from Goldleaching Acidic Thiourea Solution by P507 Extraction and Na2SO3 Stripping. The Chinese Journal of Process Engineering, Vol. 2, No. 2, Apr 2002.
(17)
JL GARDEA-TORRESDEY, K.J. TIEMANN, G. GAMEZ, K. DOKKEN, M.J. YACAMAN. Innovative Technology to Recover Gold(III) from Aqueous Solution by Using Medicago Sativa (Alfalfa). University of Texas at El Paso. Department of Chemistry and Environmental Sciences and Engineering. Proceedings of the 1998 Conference on Hazardous Waste Research.
(18)
OCTAVE LEVENSPIEL. Ingeniera de las Reacciones Qumicas. Segunda Edicin. Editorial Reverte. 1986.
(19)
OROPEZA M. T. PONCE DE LEN, C., Y GONZLEZ, I., Principios y Aplicaciones de los Procesos Electroqumicos. Universidad Autnoma Metropolitana. Unidad Iztapalapa, 2000.
- 160 -
GLOSARIO
Almina La Almina es el xido de aluminio (Al2O3). Junto con la slice, es el ingrediente ms importante en la constitucin de las arcillas y los barnices, confirindoles resistencia y aumentando su temperatura de maduracin. Es un material cermico muy verstil, sus propiedades la hacen especialmente apta para aplicaciones en donde la temperatura es un factor crtico (tiene un punto de fusin mayor que el aluminio), adems de su relativa facilidad para adaptarse a diversos trabajos y usos. Su dureza ha permitido darle forma a la industria del abrasivo, que es de las ms antiguas, y rentables. El xido de aluminio existe en la naturaleza en forma de corindn y de esmeril. Tiene la particularidad de ser ms duro que el aluminio.
Amalgama. En qumica se denomina as a la mezcla homognea entre el mercurio (metal lquido) y cualquier otro metal noble (plata, oro, platino, paladio, rodio).
Anolito Solucin electroltica del compartimento andico de una celda electroqumica.
Arsenopirita Es un mineral perteneciente a la familia de los sulfuros que tiene como frmula FeAsS. Contiene aproximadamente 46% de arsnico, 34.3% de hierro y un 19.7% de azufre, junto a otros minerales. Se encuentra en yacimientos magmticos de diferentes tipos y metamrficos. Se usa para la extraccin de arsnico y puede ser explotable por su contenido de oro, plata y nquel. Tiene un color blanco a gris azulado con brillo metlico. La arsenopirita forma cristales prismticos con caras estriadas
- 161 -
Bulk flotation Recuperacin por flotacin de todas las especies valiosas en un solo concentrado.
Calcopiritas Mineral perteneciente a la familia de los sulfuros (mena metlica) que tiene como frmula qumica CuFeS2. Es de color amarillo latn -parecido al de la pirita, pero ms intenso-, con matices verdosos, a menudo con ptina abigarrada, brillo metlico y raya negra verdosa. Es un mineral frgil, de exfoliacin apenas perceptible y fractura concoidal. Cristaliza en el sistema tetragonal, con cristales pseudotetradricos y pseudooctadricos, por maclado polisinttico a menudo con formas difciles de identificar, por lo general compactas. Se presenta en granitos y filones de casiterita, en filones hidrotermales, en pegmatitas, en pizarras negras. Su origen es magmtico, hidrotermal y sedimentario, en asociacin con esfalerita, galena, tetraedrita, pirita y muchos otros sulfuros.
Carbn activado. Por muchos aos las propiedades adsorbentes del carbn fueron conocidas y se estudiaron, inclusive, antes que se ideara la expresin de carbn activado. El carbn activado puede ser obtenido a partir de una variedad de materias primas, incluyendo cscaras de nuez, pepas de frutas, madera, carbn bituminoso y cscaras de coco, pero este ltimo es el que se usa preferentemente en la recuperacin de oro.
Carbn Vtreo El carbn vtreo es un material de gran utilidad en electroqumica debido a sus propiedades conductoras y su estabilidad frente a cidos y bases fuertes en un amplio rango de temperaturas. Para sus usos prcticos, se requiere aumentar el rea electroqumicamente activa con acceso adecuado de reactivos desde la disolucin. Una manera de realizarlo es creando macro poros (>50 nm de
- 162 -
dimetro segn IUPAC) en el material. De esta manera puede aplicarse en electrodos porosos, filtros de absorcin, soportes catalticos, etc.
Catolito. Solucin electroltica del compartimento catdico de una celda electroqumica. Est en contacto con el ctodo.
Cuarzo El Cuarzo es un mineral compuesto por dixido de silicio. Tiene tanta dureza que puede rayar los aceros comunes. Su tenacidad es frgil. El cuarzo se forma mediante la cristalizacin lenta de los magmas terminales muy cidos. Su forma cristalizacin es hexagonal en las formas de alta temperaturas (superior a 537C). El cuarzo es qumicamente muy inerte y resiste la meteorizacin que provoca la intemperie. Otras propiedades son las siguientes; Cuando se comprime se produce una diferencia de tensin y de forma reciproca, reacciona mecnicamente cuando se somete a un cierto voltaje, lo que hace de este mineral un elemento de gran utilidad para muchos transductores, desde mecheros hasta altavoces. Otra caracterstica es su capacidad de presentar un comportamiento resonante. El cuarzo tambin tiene termoluminiscencia, que es la capacidad de emitir luz cuando es calentado. Se utiliza como abrasivo emplendose en la fabricacin de lijas, discos o bloques, y en sistemas de abrasin por chorro de agua a presin. Por inhalacin causa silicosis y en la actualidad est siendo sustituido por otros abrasivos de menor riesgo, menos en los pases subdesarrollados. El cuarzo es el mineral ms abundante en la corteza terrestre y tambin el mineral de formacin de roca ms importante. Se presenta como componente de granitos, cuarzo piritas, gneis, pegmatitas; en drusas en pegmatitas, en filones de filones pneumatolcos; como ganga en filones metalferos, en rocas de sedimentacin, en geodas alpinas. Su origen es magmtico en diferentes tipos de rocas, principalmente en granitos, pegmatitas granticas y rocas, principalmente en granitos, pegmatitas granticas y rocas granticas y rocas volcnicas, metamrfico en varios tipos de rocas,
- 163 -
principalmente en cuarcitas y esquistos de mica; hidrotermal en diferentes tipos de venas metalferas y de tipo alpino; secundario en la zona de oxidacin de yacimientos metalferos; tambin en diferentes tipos de rocas sedimentarias y en rocas sedimentarias y en restos orgnicos, adems de en placeres.
Electroplating Palabra inglesa cuyo significado en espaol es Galvanoplastia. es un proceso de revestimiento que utiliza corriente elctrica para reducir los cationes de un material que desee de una solucin y un abrigo de objeto conductor con una fina capa del material, como un metal. Galvanoplastia se utiliza principalmente para depositar una capa de material de conferir una caracterstica deseada (por ejemplo, la abrasin y resistencia al desgaste, la proteccin a la corrosin, la lubricidad, cualidades estticas, etc.) a una superficie que de lo contrario carece de esa propiedad. El proceso utilizado en el revestimiento se llama electrodeposicin. Es similar a una pila galvnica actuando en sentido inverso. La parte a ser plateado es el ctodo del circuito En una tcnica, el nodo es del metal plateado en la parte Ambos componentes se sumergen en una solucin denominada electrolito que contenga uno o ms metales disueltos las sales, as como los iones de otros que permitan el flujo de electricidad. Un rectificador suministra corriente al nodo, la oxidacin de los tomos de metal que lo componen y que les permite que se disuelva en la solucin. En el ctodo, los iones metlicos disueltos en la solucin electroltica se reducen en la interfase entre la solucin y el ctodo.
Energa de activacin La energa de activacin ( ) en qumica y biologa es la energa que necesita
un sistema antes de poder iniciar un determinado proceso. La energa de activacin suele utilizarse para denominar la energa mnima necesaria para que se produzca una reaccin qumica dada. Para que ocurra una reaccin entre dos
- 164 -
molculas, stas deben colisionar en la orientacin correcta y poseer una cantidad de energa mnima. A medida que las molculas se aproximan, sus nubes de electrones se repelen. Esto requiere energa (energa de activacin) y proviene del calor del sistema, es decir de la energa traslacional, vibracional, etctera de cada molcula. Si la energa es suficiente, se vence la repulsin y las molculas se aproximan lo suficiente para que se produzca una reordenacin de los enlaces de las molculas.
Esfaleritas La Blenda o Esfalerita est compuesta por sulfuro de Zinc. Por su aspecto se confunde con la galena. Es la principal mena de zinc. El sulfuro de zinc es incoloro, pero la blenda contiene siempre sulfuro ferroso, que la oscurece. En masas fibrosas o compactas son frecuentes las maclas. Si su contenido en hierro es alto se le llama marmatita, pero si ese contenido es bajo se le llama blenda acaramelada. Su origen es magmtico (lquido en pegmatitas), hidrotermal en yacimientos de baja y alta temperatura, yacimientos sedimentarios hidrotermales; raramente sedimentario y metamrfico. Aparece combinado con galena, pirita, calcopirita, marcasita, fluorita, barita, cuarzo y otros.
Galvanostato Es un potenciostato al que se le ha conmutado la retroalimentacin desde la seal de voltaje de la celda. En consecuencia el instrumento controla la corriente ms que el voltaje.
Hidrometalurgia Parte de la Metalurgia que estudia los procesos de lixiviacin selectiva de menas y posterior recuperacin de valores desde la solucin. Ligante Compuesto qumico que tiene afinidad para acomplejarse con otro compuesto.
- 165 -
Limonitas Limonita es un mineral que consiste en una mezcla de hidratado xido-hidrxido del hierro (III) de la composicin que vara. La frmula genrica se escribe con frecuencia como FeO (el OH)nH2O, aunque esto no es enteramente exacto pues la limonita contiene a menudo una cantidad que vara de xido comparada al hidrxido. Junto con hematita, ha sido minado como mineral para la produccin de hierro. La limonita es pesada y de color marrn amarillento. Es una sustancia amorfa muy comn sin embargo puede ser difcil encontrar cuando est minado con hematita y mineral del pantano. La limonita se ha sabido para formar pseudomorphs despus de otros minerales por ejemplo pirita, significar que el desgaste por la accin atmosfrica qumico transforma el cristal de la pirita en la limonita pero guarda la forma externa del cristal de la pirita. Tambin se ha formado de los otros xidos, hematita y magnetita del hierro; el carbonato siderita y los silicatos ricos del hierro
Materiales carbonosos. Son minerales con alto contenido de carbn por ejemplo en forma de grafito. Tienen capacidad de adsorcin de cualquier complejo inico.
Membranas de intercambio inico Las membranas de intercambio inico usadas en Electrodilisis son lminas delgadas, densas e insolubles, constituidas por un material polmero permeable a los iones que, colocadas entre dos soluciones, permite una transferencia selectiva de iones de una solucin hacia la otra, bajo la accin de un campo elctrico. La pareja de membranas empleadas, se componen de una membrana catinica y de una membrana aninica. La membrana catinica es un polmero que permite el paso preferente de los cationes, en particular de los cationes: K+ , Ca++. La
- 166 -
membrana aninica es un polmero que permite el paso preferente de los aniones, en particular del anin tartrato.
Metaestable La metaestabilidad es la propiedad que un sistema con varios estados de equilibrio tiene de exhibir durante un considerable espacio de tiempo un estado de equilibrio dbilmente estable. Sin embargo, bajo la accin de perturbaciones externas (a veces no fcilmente detectables) dichos sistemas exhiben una evolucin temporal hacia un estado de equilibrio fuertemente estable. Normalmente la metaestabilidad es debida a transformaciones de estado lentas.
Microscopio electrnico de barrido (SEM -Scanning Electron Microscopy) Es aquel que utiliza un haz de electrones en lugar de un haz de luz para formar una imagen. Tiene una gran profundidad de campo, la cual permite que se enfoque a la vez una gran parte de la muestra. Tambin produce imgenes de alta resolucin, que significa que caractersticas espacialmente cercanas en la muestra pueden ser examinadas a una alta magnificacin. La preparacin de las muestras es relativamente fcil pues la mayora de SEMs slo requieren que estas sean conductoras. En el microscopio electrnico de barrido la muestra es recubierta con una capa de carbn o una capa delgada de un metal como el oro para darle propiedades conductoras a la muestra. Posteriormente es barrida con los electrones acelerados que viajan a travs del can. Un detector mide la cantidad de electrones enviados que arroja la intensidad de la zona de muestra, siendo capaz de mostrar figuras en tres dimensiones, proyectados en una imagen de TV o una imagen digital. Su resolucin est entre 3 y 20 nm, dependiendo del microscopio. Mineral refractario. Es una clasificacin al que corresponden algunos minerales donde el material valioso (en nuestro caso el oro) se encuentra ocluida dentro de la matriz del
- 167 -
mineral lo cual dificulta su liberacin con una simple molienda y por lo tanto es difcil su recuperacin por un proceso de cianuracin convencional.
Minera a Tajo abierto El minado (explotacin) a Tajo Abierto o cielo abierto se realiza cuando los yacimientos son de gran tamao, presentan una forma regular, y estn ubicados en la superficie o cerca de sta. Este es un proceso eficiente en la medida en la que el costo de extraer el mineral (incluyendo la movilizacin de material no comercial que los cubre), sea menor que el precio de comercializacin del mineral a extraer. El tajo abierto se ve como un gran tazn y este se va construyendo en la medida en que la operacin va avanzando, tanto lateralmente como en profundidad. A medida que se va trabando, se genera una especie de anfiteatro (por su forma escalonada) cuya forma puede ir cambiando en la medida en que avanza la operacin.
Minera subterrnea (Socavn) La explotacin de minerales de forma subterrnea es la extraccin a travs de diversos mtodos de ingeniera debajo de la superficie del terreno. Este tipo de extraccin se realiza cuando la cubierta de rocas (o material sin presencia de mineral) es de un espesor tal que el costo de removerlo para hacer un tajo abierto no es econmico (como, por ejemplo, del interior de un cerro). Este tipo de explotacin se usa cuando las zonas mineralizadas (comnmente llamadas vetas) son angostas y profundas, por lo que es preferible hacer perforaciones en la roca para acceder a las mismas. Para acceder a las zonas mineralizadas se penetra la roca desde la superficie a travs de perforaciones horizontales (tneles o galeras), verticales (piques o chimeneas), inclinadas (rampas), ubicadas en diferentes niveles con la finalidad de fragmentar (partir), cargar y transportar el mineral desde el interior hasta la superficie. Asimismo, es necesario tambin
- 168 -
construir conductos de ventilacin, rieles para carros mineros (de ser necesario), instalacin de lneas de energa, accesos para el agua, servicios higinicos, almacenes, entre otros.
Onza troy. La onza troy es una unidad de masa usada antiguamente en Roma. Actualmente la onza troy se usa en la joyera y orfebrera y por lo tanto se usa en algunos casos para pesar monedas. La onza troy equivale exactamente a la doceava parte de una libra troy, y su factor de conversin a gramos es: 1 onza troy = 31.1034768 gramos.
Pirita. Es un bisulfuro de hierro y su estructura se basa en fuertes enlaces covalentes S-S y enlaces inicos Fe2+ y S22- en coordinacin octadrica. Su frmula es FeS2. Forma cristales cbicos y pentadodecaedros con estriacin en las caras. Tiene un color amarillo latn con brillo metlico. Tiene dureza alta y es muy pesado. No se raya con la punta del acero. Tiene origen magmtico y, por ello, aparecen accidentalmente en las rocas gneas, aunque puede tener tambin origen metamrfico y presentarse en este ltimo tipo de rocas.
Pirrotina Es un mineral poco frecuente cuya composicin es sulfuro de hierro (II) con un contenido variable de hierro: Fe(1-x)S (x = 0 to 0.2). Se encuentra junto a la pentlandita en rocas gneas bsicas, en filones y en rocas metamrficas. Tambin se encuentra a menudo junto a la pirita, marcasita y magnetita, o presente en los meteoritos llegados a la Tierra. El miembro final de la serie de minerales de frmula FeS es conocido como troilita. La pirrotina es tambin llamada pirita magntica porque su color es similar a la pirita y es dbilmente magntica. El
- 169 -
magnetismo se incrementa cuando disminuye el contenido de hierro, y la troilita es no-magntica.
Polarizacin Se llama polarizacin electroqumica a la reduccin de la fuerza electromotriz de un elemento voltaico como consecuencia de las alteraciones que su propio funcionamiento provoca en sus partes constituyentes, los electrodos y el electrolito. La reduccin del voltaje que aparece en los bordes equivale a un aumento de la resistencia interna del elemento. Esta modificacin es en parte transitoria, pues, tras interrumpirse la circulacin de la corriente, es normal que se recupere, en parte y espontneamente, la situacin anterior al cabo de cierto tiempo (p. ej., por difusin de un gas en el electrolito), pero a la larga es acumulativa y termina por hacer inservible la celda. Naturalmente es un inconveniente serio, que priva de utilidad a los elementos voltaicos de estructura sencilla, ya que la corriente que pasa por el circuito externo disminuye continuamente, a veces con gran rapidez.
Potenciostato Es un instrumento que controla la diferencia de voltaje entre un electrodo de trabajo y un electrodo de referencia que estn sumergidos en una celda electroqumica.
Solucin Barren Es la misma solucin de lixiviacin a la que se le ha extrado todos lo valores (oro y plata entre otros) por mtodos de adsorcin, precipitacin o electrodeposicin. Por lo general tambin tiene poca concentracin de reactivo lixiviante. Preg robbing Adsorcin del oro lixiviado sobre material carbonoso natural, previniendo as su recuperacin ya sea por precipitacin con zinc o adsorcin sobre carbn activado.
- 170 -
Voltamperometra. Parte de la Qumica que estudia el comportamiento de las curvas intensidadpotencial de soluciones electrolticas donde ocurren reacciones xido-reduccin.
Yacimiento filoniano Es un tipo de mineralizacin que se presenta en forma de filones (vetas) incrustados entre dos capas de material estril. Se forma a partir de materiales profundos de la corteza terrestre. Los prfidos filonianos (roca eruptiva, compacta y dura) se producen al originarse filones o diques, es decir, masas magmticas aisladas que se elevan verticalmente cortando los estratos o se introducen paralelamente a los mismos; los magmas arrastran otros materiales y los envuelven por lo que se aprecia la presencia de grandes cristales (fenocristales).
Yacimiento aluvial. Se denomina con este trmino a los depsitos de algn tipo de material arrastrados por una corriente de agua. En minera de oro, se denomina yacimiento de oro aluvial a un depsito de oro que ha sido estratificado bajo la superficie de una corriente de agua (ro o aluvin) formando estratos con carga aurfera. Este tipo de depsitos se originan por erosin o meteorizacin de los yacimientos filonianos lo que dan lugar a depsitos de arenas, gravas y conglomerados ricos en oro.
Вам также может понравиться
- Prácticas de refrigeración y aire acondicionadoОт EverandPrácticas de refrigeración y aire acondicionadoРейтинг: 5 из 5 звезд5/5 (6)
- Calificacion SOLDADORДокумент2 страницыCalificacion SOLDADORAnonymous tVXaV5ojОценок пока нет
- IMmaarjaДокумент131 страницаIMmaarjaEDSON ALEXANDER JARA CANTUОценок пока нет
- Tratamiento de Minerales Auriferos Complejos - Angel AzañeroДокумент24 страницыTratamiento de Minerales Auriferos Complejos - Angel Azañerojames9jos99ju9rez9muОценок пока нет
- Obtención y Refinación de Oro y Plata 2Документ28 страницObtención y Refinación de Oro y Plata 2zammy21Оценок пока нет
- Cianicidas-Hidro 2Документ19 страницCianicidas-Hidro 2Juan Diego Falcon ChuraОценок пока нет
- Fundicion de Oro, Mejora ContinuaДокумент35 страницFundicion de Oro, Mejora ContinuaBerzuly Marcela Cundumi OcoroОценок пока нет
- Electrolisis ElectrometalurgiaДокумент8 страницElectrolisis ElectrometalurgiaNandher Condori GuerreroОценок пока нет
- ESQUEMA DEL PROCESO PARA LA PLANTA AMONIACO Y UREA (YPFB) Act07-08-2014Документ1 страницаESQUEMA DEL PROCESO PARA LA PLANTA AMONIACO Y UREA (YPFB) Act07-08-2014Mauricio AlvaradoОценок пока нет
- Modelación y Simulación Del Estado Estacionario de Un Reactor de Reformación Catalitica de Naftas PDFДокумент112 страницModelación y Simulación Del Estado Estacionario de Un Reactor de Reformación Catalitica de Naftas PDFAndres Pedraza CerusolyОценок пока нет
- Óxidos de CobreДокумент7 страницÓxidos de CobreeaceneoОценок пока нет
- Flotacion OxidosДокумент6 страницFlotacion OxidosJessica ShepardОценок пока нет
- LX de Oro Con Tiosulfato PDFДокумент6 страницLX de Oro Con Tiosulfato PDFchapuchinoОценок пока нет
- Informe de Lixiviacion de Cu en ColumnaДокумент5 страницInforme de Lixiviacion de Cu en ColumnaEdwin Rodriguez MelgarejoОценок пока нет
- Determinacion Grado Liberacion MineralogicaДокумент33 страницыDeterminacion Grado Liberacion Mineralogicaselaris11100% (7)
- 7 Espesamiento y FiltraciónДокумент14 страниц7 Espesamiento y FiltraciónPiero Loayza0% (1)
- C072E - S2 - Técnicas de Concentración de MineralesДокумент36 страницC072E - S2 - Técnicas de Concentración de MineralesRenzo VegaОценок пока нет
- 11.0 Semana 11 - Flotacion de Minerales de OroДокумент15 страниц11.0 Semana 11 - Flotacion de Minerales de OroLucy Flores100% (1)
- 12Документ165 страниц12Rubén Chávez TitoОценок пока нет
- Informe de FlotacionДокумент17 страницInforme de FlotacionpoyorОценок пока нет
- Tesis MetalurgicaДокумент112 страницTesis MetalurgicaGiovani RamosОценок пока нет
- 05 Uso de Colectores Cytec en Plantas de Flotación de Polimetálicos en La Minería de Bolivia - Luis Cuevas PetroquimДокумент14 страниц05 Uso de Colectores Cytec en Plantas de Flotación de Polimetálicos en La Minería de Bolivia - Luis Cuevas PetroquimdikoОценок пока нет
- Efecto de CianicidasДокумент1 страницаEfecto de CianicidasJusmel RonyОценок пока нет
- Introduccion A La Dinamica de Fluidos Computacionales (CFD) Por El Metodo de Volumenes FinitosДокумент26 страницIntroduccion A La Dinamica de Fluidos Computacionales (CFD) Por El Metodo de Volumenes Finitosraul19rsОценок пока нет
- Semana 14 y 15 ExtractivaДокумент71 страницаSemana 14 y 15 ExtractivaRAMOS QUISPE FranОценок пока нет
- Electrodeposicion Del OroДокумент10 страницElectrodeposicion Del OroYanina Silvestre Mendoza100% (1)
- Lixiviacion Minerales CobreДокумент5 страницLixiviacion Minerales Cobreoskar0706Оценок пока нет
- Electrorrefinacion y Electrodeposicion Del Oro2Документ21 страницаElectrorrefinacion y Electrodeposicion Del Oro2alex sandersОценок пока нет
- 06 - Apunte MoliendaДокумент23 страницы06 - Apunte MoliendaJosé Andrés Toro BelmarОценок пока нет
- Disolución Del OroДокумент8 страницDisolución Del OroJesica Lizana TaipeОценок пока нет
- MODULO V Refinacion de OroДокумент19 страницMODULO V Refinacion de Orojuan carlos apazaОценок пока нет
- Lixiviación Con Tiourea SCДокумент7 страницLixiviación Con Tiourea SCDavid SuasacaОценок пока нет
- Recuperación de Plata A Partir de Relaves de FlotaciónДокумент7 страницRecuperación de Plata A Partir de Relaves de Flotaciónoskar0706Оценок пока нет
- Flotación de Minerales Oxidados de PlomoДокумент11 страницFlotación de Minerales Oxidados de PlomoAnthony EchevarriaОценок пока нет
- Laboratorio 2Документ18 страницLaboratorio 2Devora Miluska AlfaroОценок пока нет
- Lixiviacion de Oro TioureaДокумент5 страницLixiviacion de Oro TioureaElver Jaime Quispe MamaniОценок пока нет
- Articulo Termodinamica Lixiviacion Oro - En.esДокумент15 страницArticulo Termodinamica Lixiviacion Oro - En.esJose MorenoОценок пока нет
- 1 CobreДокумент38 страниц1 CobreRuthОценок пока нет
- Flotacion de Minerales PDFДокумент62 страницыFlotacion de Minerales PDFBryan Anthony Yucra CayoОценок пока нет
- 1 Tecsup Termodinamica de La Cianuracion 777777Документ36 страниц1 Tecsup Termodinamica de La Cianuracion 777777Gianfranco Ampuero VillavicencioОценок пока нет
- Obtención de Manganeso Metálico Por Desoxidación de Mineral de PirolusitaДокумент6 страницObtención de Manganeso Metálico Por Desoxidación de Mineral de Pirolusitaandrew850800Оценок пока нет
- Concentración GravitacionalДокумент5 страницConcentración GravitacionalYerika Lisbeth Rivera AtoОценок пока нет
- TIOUREACIONДокумент9 страницTIOUREACIONCamilo SanaОценок пока нет
- Resumen de HidrometalurgiaДокумент6 страницResumen de HidrometalurgiaViridianaGarciaОценок пока нет
- Informe Lixiviacion de Minerales Aurifero Con TiosulfatoДокумент9 страницInforme Lixiviacion de Minerales Aurifero Con Tiosulfatofoss93Оценок пока нет
- Uso Del Cianuro en La Industria Del OroДокумент9 страницUso Del Cianuro en La Industria Del OroHenry Casimiro CabreraОценок пока нет
- Lixiviacion de Minerales de OroДокумент2 страницыLixiviacion de Minerales de OroCarolay Chavez CallupeОценок пока нет
- Informe de Quimica Organica 6Документ25 страницInforme de Quimica Organica 6Ruben Cabanillas RequizОценок пока нет
- Lixiviacion de Zinc Sesion Vi PDFДокумент14 страницLixiviacion de Zinc Sesion Vi PDFAntonio FernandezОценок пока нет
- Tiouria PDFДокумент13 страницTiouria PDFRosmery TurpoОценок пока нет
- Lixiviacion Con Tiourea (METALURGIA de ORO)Документ15 страницLixiviacion Con Tiourea (METALURGIA de ORO)Joselito Enriquez AndresОценок пока нет
- Módulo de Merrill Crowe PDFДокумент30 страницMódulo de Merrill Crowe PDFEder Aranda CarbonellОценок пока нет
- Hidrometalurgia Del OroДокумент24 страницыHidrometalurgia Del OroJhosy JrplОценок пока нет
- Informe BuenoДокумент18 страницInforme BuenoBoni Luz Luna ChallaОценок пока нет
- Practica 1 CementacionДокумент2 страницыPractica 1 CementacionGuille AngonaОценок пока нет
- Tratamiento Alta Ley de OroДокумент14 страницTratamiento Alta Ley de OroYely Lisbeth Vilca Canaza100% (1)
- Cianuracion Intensiva de Un Concentrado AuríferoДокумент12 страницCianuracion Intensiva de Un Concentrado AuríferopaulОценок пока нет
- Minería Del OroДокумент14 страницMinería Del OroDanessi RomeroОценок пока нет
- Flotación de Minerales de CobreДокумент10 страницFlotación de Minerales de CobreEddie WinterОценок пока нет
- Ladrillos de CromoДокумент144 страницыLadrillos de Cromolore orellanaОценок пока нет
- Análisis Técnico Del Sistema Uni - AquinoДокумент222 страницыAnálisis Técnico Del Sistema Uni - AquinoElizabeth Calamani CanoaОценок пока нет
- Tesishho PDFДокумент107 страницTesishho PDFArturo ArroyoОценок пока нет
- T Senescyt 0312Документ175 страницT Senescyt 0312Jose Rios CevallosОценок пока нет
- Opee 1Документ119 страницOpee 1Glen Miguel IbañezОценок пока нет
- T Senescyt 0312 PDFДокумент175 страницT Senescyt 0312 PDFKatherine Benavides VillenaОценок пока нет
- Granulometria PDFДокумент15 страницGranulometria PDFHernando GuerreroОценок пока нет
- Apuntes-Mecanica de Fluidos 2011Документ101 страницаApuntes-Mecanica de Fluidos 2011Julio Miguel Fernández PradoОценок пока нет
- Informe Minero Peru MundoДокумент212 страницInforme Minero Peru MundoDanny Daniel Valderrama Gutiérrez100% (1)
- Vidal Loli Manuel Calculo Camiones Operacion MineraДокумент66 страницVidal Loli Manuel Calculo Camiones Operacion MineraEdwin Daniel Cereceda EspinozaОценок пока нет
- Economia MineraДокумент15 страницEconomia MineraMijael Correa SalinasОценок пока нет
- Catalogo Industria 2011 PDFДокумент36 страницCatalogo Industria 2011 PDFEsteban GabrielОценок пока нет
- Los Laboratorios Del IGMEДокумент49 страницLos Laboratorios Del IGMEwjoselОценок пока нет
- Experimentos FactorialesДокумент99 страницExperimentos FactorialeswjoselОценок пока нет
- Diseño ExperimentalДокумент94 страницыDiseño ExperimentalwjoselОценок пока нет
- Diseño ExperimentalДокумент94 страницыDiseño ExperimentalwjoselОценок пока нет
- Lix CloruranteДокумент151 страницаLix ClorurantewjoselОценок пока нет
- Metodología de La Investigación. Pedro SalinasДокумент182 страницыMetodología de La Investigación. Pedro SalinasISBETH FLORIMAR MIJARESОценок пока нет
- Tema 3 - Reduccion de Tamano-Trituracion PDFДокумент147 страницTema 3 - Reduccion de Tamano-Trituracion PDFFreddy E. Pérez CaljaroОценок пока нет
- PE Series Jaw CrusherДокумент4 страницыPE Series Jaw CrusherwjoselОценок пока нет
- FlotacionДокумент17 страницFlotacionwjoselОценок пока нет
- A 08 V 14 N 26Документ20 страницA 08 V 14 N 26josecaciqxeОценок пока нет
- Apuntes MaterialesДокумент44 страницыApuntes Materialeswjosel100% (1)
- 06 Momento de InerciaДокумент28 страниц06 Momento de InerciawjoselОценок пока нет
- ApTecnico PropiedadesMecanicasДокумент17 страницApTecnico PropiedadesMecanicasMarcelo RondinaОценок пока нет
- HidrocarburosДокумент7 страницHidrocarburosilzZe OroZzcoОценок пока нет
- Combustibles Pirometalurgia PDFДокумент33 страницыCombustibles Pirometalurgia PDFeder jhonОценок пока нет
- Osmosis UltraДокумент8 страницOsmosis Ultrajose manuel martinezОценок пока нет
- Equipo 2 - Defecto de Los Materiales de Frenkel, Defecto deДокумент13 страницEquipo 2 - Defecto de Los Materiales de Frenkel, Defecto deEduardo ReyesОценок пока нет
- TPR - Balance de Materia Con Reacción Química (1era. Parte)Документ20 страницTPR - Balance de Materia Con Reacción Química (1era. Parte)Joao SarangoОценок пока нет
- Esterilización Con GasesДокумент4 страницыEsterilización Con Gasesliz.Оценок пока нет
- Tipo de AleacionesДокумент9 страницTipo de AleacionesKarina MorenoОценок пока нет
- MS 02 312 PDFДокумент7 страницMS 02 312 PDFRicardo Rioja RochaОценок пока нет
- Análisis OrsatДокумент4 страницыAnálisis OrsatJuan PedrerosОценок пока нет
- Tratamiento de Agua de CalderasДокумент8 страницTratamiento de Agua de CalderasmcОценок пока нет
- Practica 2 Quimica Organica I REACTIVIDAD Y CARACTERIZACIÓN DE HIDROCARBUROSДокумент5 страницPractica 2 Quimica Organica I REACTIVIDAD Y CARACTERIZACIÓN DE HIDROCARBUROSJeison ArguelloОценок пока нет
- Ejercicios Tema 2Документ5 страницEjercicios Tema 2Manuel Alejandro Siguencia PiñaОценок пока нет
- Análisis Físico y Químico en CarnesДокумент5 страницAnálisis Físico y Químico en CarnesDianaPariPerezОценок пока нет
- Act.6-El Efecto Del Valor de PH en Los Suelos de Uso AgrícolaДокумент8 страницAct.6-El Efecto Del Valor de PH en Los Suelos de Uso AgrícolaAngela Vera LaraОценок пока нет
- Cloruro de CobreДокумент5 страницCloruro de Cobrekrmeli_21100% (3)
- Análisis de Mineral de Hierro Por Valoración Con Dicromato de PotasioДокумент3 страницыAnálisis de Mineral de Hierro Por Valoración Con Dicromato de PotasioBryan Flores MogollonОценок пока нет
- TRABAJO GRUPAL. Oxido-De-ZirconioДокумент6 страницTRABAJO GRUPAL. Oxido-De-ZirconioMary SuarezОценок пока нет
- Métodos de Separación Por Extracción Con SolventesДокумент5 страницMétodos de Separación Por Extracción Con SolventesGerardo Arratia RamírezОценок пока нет
- Exposicion Soldadura Bajo El Agua ModificadaДокумент16 страницExposicion Soldadura Bajo El Agua ModificadaDuvan Chacon BallesterosОценок пока нет
- (ACTIVIDAD 2) - Materiales No FerrososДокумент5 страниц(ACTIVIDAD 2) - Materiales No FerrososXimena SanchezОценок пока нет
- Resina CationicaДокумент5 страницResina CationicaFrancisco FalconОценок пока нет
- Guía de LaboratorioДокумент14 страницGuía de LaboratorioMilagros UrrutiaОценок пока нет
- Para Estudiar BiodieselДокумент5 страницPara Estudiar BiodieselAmérika Lin AmazonasОценок пока нет
- Sistemas Coloidales .EstabilidadДокумент27 страницSistemas Coloidales .EstabilidadabelОценок пока нет
- Analitica - Ejercicios-1Документ4 страницыAnalitica - Ejercicios-1Jorge Luis LudeñaОценок пока нет
- Transporte de MetanolДокумент11 страницTransporte de MetanolLionel Pedraza100% (1)
- Informe de Laboratorio - BiologiaДокумент6 страницInforme de Laboratorio - BiologiaFabricio FigueroaОценок пока нет
- Catalogo AnodosДокумент1 страницаCatalogo AnodosIsmael CaballeroОценок пока нет