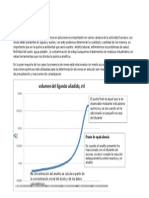
Академический Документы
Профессиональный Документы
Культура Документы
Ter U2 A6 Fecf
Загружено:
primitivo58Оригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Ter U2 A6 Fecf
Загружено:
primitivo58Авторское право:
Доступные форматы
Actividad 6.
Unidad 2: INICIANDO CON LA APLICACIN DE MODELOS Fernando Castillo Flores AL12510308
Problemas de la Primera Ley de la Termodinmica. Resuelve los siguientes ejercicios.
1. Menciona el modelo matemtico de la primera Ley de la Termodinmica y describe su significado.
donde representa la sumatoria El modelo matemtico de la primera ley de la termodinmica es de energas intercambiadas, es decir el resultado de la variacin de energas entre los dos cuerpos, esta sumatoria de energas intercambiadas, es como su nombre lo indica EI = calor + trabajo. Esto es, la energa en forma de calor que se gan o perdi ms la energa en forma de trabajo que se gan o perdi.
2. Menciona las siguientes ecuaciones termodinmicas a) ecuacin de estado de un gas ideal = n b) ecuacin de una transformacin adiabtica. pVr=cte
c) ndice adiabtico de un gas ideal
1. Las unidades de calor son:
2. a)calora b) Kelvin c) Watt d)Joule
Se comprime un gas a presin constante de 0.8atm de un volumen de 9 L a un volumen de 2 L. En el proceso se escapan del gas 400 J de energa calorfica. Cul es el trabajo realizado por el gas?
P= 0.8atm Vi= 91 Vf= 21 Q= 400 J
W= P(Vf Vi) = .8 (2 9) = -5.6 atm 1 atm = 101.3 J -5.6 * 101.3= -567.28 J
U= Q W = -400 + 567.28 = 167.28 J
Un sistema termodinmico sigue un proceso en el cual su energa interna disminuye 500 J. Si al mismo tiempo se hacen 220 J de trabajo sobre el sistema, encuentre el calor transferido por o hacia el sistema.
U= -500J W= -220J U= Q W Q= AU + W = -500 + (-220) = -720 J
El calor es transferido hacia el sistema Cinco moles de un gas ideal se expanden isotrmicamente a 127 C hasta cuatro veces su volumen inicial. Encuentre el trabajo realizado por el gas y el flujo de calor hacia el sistema. Ambos en joules.
n= 5 mol t= 127 C T= 400.15 K Vf= 4Vi
W= (5 moles) (8.3145 J/mol K)(400.15 K)ln(4) W= 23061J U = Q W = 0 23061 = 23061 J.
Cuanto trabajo hace el sistema cuando 1 mol de agua a 100C hierve y se convierte en un mol de vapor a 100C a una presin de un atm? N= 1 mol M= 18g = .018 kg t= 100 C 100C + 273.15= 373.15K Lv= 2.26 * 10-6 J Kg -1 542.4 calg-1 El calor que se absorbe entonces sera: Q= .018 * (2.26 * 106) = 4.68 * 104
8. Retomando los datos del problema anterior determine el cambio en la energa interna de vapor al evaporarse. Considere el vapor como un gas ideal.
W = P * Vv = nRT = a* 8.3145 * 373.15=
=3102.56 J
9. Las unidades de trabajo mecnico en el sistema internacional son: Cal b) Watt c) Kelvin d)joule.
10. Comentarios sobre los problemas. Me pareci muy buena idea que estuvieran mezclado tanto problemas como teora, ya que sirve que muy bien para relacionar y tener un mejor entendimiento de los temas.
Вам также может понравиться
- TERLRESPALDOДокумент14 страницTERLRESPALDOprimitivo58Оценок пока нет
- Eab U1 A2 PrazДокумент1 страницаEab U1 A2 Prazprimitivo58Оценок пока нет
- Tgam U1 Asignacion1 PrazДокумент4 страницыTgam U1 Asignacion1 Prazprimitivo58Оценок пока нет
- Etapas Del Sistema de Gestión de Residuos en La Ciudad de Chetumal Quintana Roo Municipio de Othon PДокумент5 страницEtapas Del Sistema de Gestión de Residuos en La Ciudad de Chetumal Quintana Roo Municipio de Othon Pprimitivo58Оценок пока нет
- Cin U1 A3 PrazДокумент6 страницCin U1 A3 Prazprimitivo58Оценок пока нет
- PasstДокумент26 страницPasstDaniel Chilaca AlmazánОценок пока нет
- PasstДокумент26 страницPasstDaniel Chilaca AlmazánОценок пока нет
- Terl U1 Ea PrazДокумент16 страницTerl U1 Ea Prazprimitivo58Оценок пока нет
- Unidad 1. Economia y AmbienteДокумент48 страницUnidad 1. Economia y Ambienteprimitivo58Оценок пока нет
- Residuos SolidosДокумент5 страницResiduos Solidosprimitivo58Оценок пока нет
- Tsha Atr U2 VemsДокумент9 страницTsha Atr U2 Vemsprimitivo58Оценок пока нет
- Unidad 2. Contaminantes Del Medio AcuosoДокумент33 страницыUnidad 2. Contaminantes Del Medio Acuosoprimitivo58Оценок пока нет
- Cerveza MioДокумент38 страницCerveza Mioprimitivo58Оценок пока нет
- Carta de La Tierra. México PDFДокумент32 страницыCarta de La Tierra. México PDFMαriselα De lα RosαОценок пока нет
- Ttar U2 Ea PrazДокумент10 страницTtar U2 Ea Prazprimitivo58Оценок пока нет
- Qam U2 A5 PrazДокумент15 страницQam U2 A5 Prazprimitivo58Оценок пока нет
- Análisis de IonesДокумент1 страницаAnálisis de Ionesprimitivo58Оценок пока нет
- EnsayoДокумент10 страницEnsayoRuBy AscencioОценок пока нет
- Lyn U3 Ea PrazДокумент1 страницаLyn U3 Ea Prazprimitivo58Оценок пока нет
- CALCULOU1A1PRAZДокумент1 страницаCALCULOU1A1PRAZprimitivo58Оценок пока нет
- Lyn U3 Ea PrazДокумент18 страницLyn U3 Ea Prazprimitivo58Оценок пока нет
- Multiculturalismo Dé Los Países Bajos1Документ10 страницMulticulturalismo Dé Los Países Bajos1primitivo58Оценок пока нет
- Cin U1 Atr PrazДокумент1 страницаCin U1 Atr Prazprimitivo58Оценок пока нет
- Qan - Tratamiento de Aguas ResidualesДокумент10 страницQan - Tratamiento de Aguas Residualesprimitivo58Оценок пока нет
- Evidencia de Aprendizaje 1calculodiferencialДокумент5 страницEvidencia de Aprendizaje 1calculodiferencialprimitivo58Оценок пока нет
- Evidencias D Aprendizaje QanДокумент13 страницEvidencias D Aprendizaje Qanprimitivo58Оценок пока нет
- Actividad Tema IV Derecho ConstitucionalДокумент5 страницActividad Tema IV Derecho Constitucionalprimitivo58Оценок пока нет
- Act 5 DM IiДокумент2 страницыAct 5 DM Iiprimitivo58Оценок пока нет
- Act 5 DM IiДокумент2 страницыAct 5 DM Iiprimitivo58Оценок пока нет
- Act 2 DM IiДокумент5 страницAct 2 DM Iiprimitivo58Оценок пока нет