Академический Документы
Профессиональный Документы
Культура Документы
Lab 1 3208
Загружено:
Morita JudithОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Lab 1 3208
Загружено:
Morita JudithАвторское право:
Доступные форматы
1.- INTRODUCCION.
-
El estudio de una reaccin qumica puede hacerse desde el punto de vista
termodinmico o desde el cintico. El estudio termodinmico permite conocer la
posicin en la cual la reaccin alcanzar el equilibrio. Cuantitativamente la
posicin de equilibrio viene definida por la constante de equilibrio, que representa
el cociente de las actividades de productos y reaccionantes:
El valor de la constante es una indicacin de la extensin en la que se producir la
reaccin. Sin embargo, no da ninguna informacin relacionada con la duracin del
proceso. Los criterios termodinmicos no incluyen la variable tiempo, puesto que
slo consideran la diferencia de propiedades del sistema entre los estados inicial y
final y, por lo tanto, no se ocupan de la velocidad a la que tiene lugar la reaccin ni
los estados intermedios por los que transcurre. Debido a esto, existen procesos
termodinmicamente espontneos que no se producen a velocidad apreciable o
que lo hacen a velocidades muy pequeas.
1.1PRINCIPIOS TEORICOS.-
Cuando se aborda el estudio cintico de una reaccin, el primer objetivo es
establecer la ecuacin de velocidad. Lo cual supone la determinacin de los
rdenes de reaccin y de la constante de velocidad. As, si se estudia una
reaccin de la forma:
a A + b B --> P
Como primera aproximacin, podemos suponer una ley general del tipo:
v = k [A]
n
[B]
m
Para determinar los rdenes de reaccin se puede hacer uso del mtodo de las
velocidades iniciales, el cual se basa en la medida de la velocidad inicial, v
o
, para
a diversas mezclas de reaccin en las que se mantienen constantes todas las
concentraciones excepto una. En esas condiciones la velocidad aparece como
una funcin de la nica concentracin variable y, por lo tanto, se puede determinar
fcilmente el orden de reaccin respecto a dicha especie. As, en la reaccin
anterior, para determinar n se mantendra constante la concentracin de B y se
hara uso de la expresin:
v
o
= k' [A]
o
n
donde k' incluye el trmino constante de concentracin de B. Tomando logaritmos
resulta:
log v
o
= log k' + n log [A]
o
que es la ecuacin de una recta. Una serie de experiencias realizada para
diversas concentraciones iniciales de A nos permitir obtener diversos puntos de
la recta. El orden de reaccin, n, es la pendiente de la recta, que puede obtenerse
ajustando por mnimos cuadrados.
Experimentalmente, la determinacin de la velocidad inicial se lleva a cabo
tomando medidas de la concentracin dentro de un intervalo de tiempo
suficientemente pequeo al comienzo de la reaccin. As por ejemplo, si se toman
una serie de medidas de la concentracin de A a diferentes valores del tiempo t
desde el instante inicial donde t = 0, la velocidad inicial se puede calcular como:
1 [A]
t
- [A]
o
v
o
= --- . ---------------
a t
Las series de medidas de v
o
permitirn calcular el orden de reaccin respecto a A.
Las medidas de la concentracin del reactivo se toman haciendo uso de un
mtodo analtico suficientemente sensible, rpido y selectivo. Usualmente se
emplea un mtodo basado en la medida de una propiedad fsica proporcional a la
concentracin de la especie de inters, tal como la absorbancia, o el potencial de
un electrodo selectivo.
Una vez determinado el orden de la reaccin respecto a una especie, se procede
a determinar el orden respecto a otra y as sucesivamente. En el caso de
reacciones complejas es necesario estudiar el orden de reaccin respecto a las
concentraciones de los productos, puesto que en numerosas ocasiones tambin
estn incluidos en la ley de velocidad. Cuando se conocen todos los rdenes se
puede determinar la constante de velocidad de la forma:
v
o
k = -----------------
[A]
o
n
[B]
o
m
Alternativamente se puede ajustar la recta:
log v
o
= log k + log ( [A]
o
n
[B]
o
m
)
y obtener k de la ordenada en el origen.
La descomposicin del perxido de hidrogeno se da de manera espontanea y
lenta en soluciones acuosas, de acuerdo con la ecuacin qumica
2 2 2 2
2
1
O O H O H +
Dicha descomposicin puede ser acelerada por la presencia de cationes y aniones
provenientes de sustancias orgnicas e inorgnicas que pueden estar o no en
fase liquida por lo que puede ser considerada como una reaccin cataltica
homognea en dependencia del catalizador utilizado.
Para el estudio de la velocidad de reaccin del
2 2
O H se utilizara el mtodo
gasomtrico aprovechando la caracterstica del sistema reaccionante que produce
oxigeno gaseoso y es esta propiedad que se usa para efectuar el seguimiento de
desprendimiento gaseoso en funcin del tiempo.
1.2 OBJETIVOS.-
Determinar el orden de la reaccin y coeficiente estequiometrico de una reaccin,
haciendo uso de una propiedad caracterstica del sistema reaccionante.
2.- METODOLOGIA
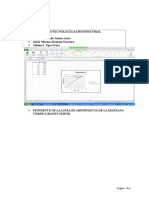
2.1 DESCRIPCION DEL EQUIPO Y MATERIALES
Con los materiales siguientes, se disponen el equipo mostrado en la figura:
Un matraz de 100ml, tapn y tubo de vidrio para conexin
Un recipiente de bao mara o termostato de bao
Un cristalizador de 2L de capacidad
Una bureta, tapn y tubo de vidrio para conexin
Cronometro
Reactivos: perxido de hidrogeno, agua destilada, clorruro de fierro
2.2 PROCEDIMIENTO EXPERIMENTAL
El recipiente de reaccin (matraz) se llenara con la solucin del catalizador de tal
manera que la altura del espacio de aire entre el nivel del liquido y el tapn no
supere 2cm y se coloca en el balo mara a temperatura indicada.
El recipiente de 2L y bureta se llenan con agua y el nivel de agua en la bureta se
establece a la altura de la llave superior. Despus de mantener 30 minutos en el
bao mara, en el matraz de reaccin se vierte una cantidad de agua determinada
de perxido de hidrogeno.
La solucin se agita minuciosamente con una varilla de vidrio y el recipiente se
tapa con el tapn. La terminal de la conexin de goma a la bureta se mantienen
sin conectar durante uno o dos minutos para que el aire sea desplazado por el
oxigeno desprendido en el recipiente de reaccin, luego se conecta a la bureta,
abrindose la llave de esta comunicndose de esta manera el vaso de reaccin
con la bureta de gas. Se hace la primera medicin y se anota el nivel en la bureta
y tiempo del cronometro, cada medicin siguiente se acompaa de tal anotacin.
Es conveniente anotar el nivel del agua en la bureta cada 2-5 min. Despus de
cesar la reaccin, el vaso de reaccin se sumerge en bao mara hirviendo donde
se mantiene hasta la descomposicin completa, el matraz se enfra hasta la
temperatura de reaccin y si el nivel del liquido en la bureta deja de variar, se mide
y se da por terminada la realizacin del trabajo experimental.
2.3 TRATAMIENTO DE DATOS
En la elaboracin de datos experimentales por el inicio de reaccin se toma la
tercera o cuarta medicin(es decir las mediciones hechas en condiciones de un
rgimen ya establecido).
- Elaborar el siguiente cuadro, en base a las consideraciones anteriores:
- Ajuste los datos a una ecuacin cintica de primer orden por el mtodo de
mnimos cuadrados
n t (s) V (ml)
1 0 0
2 1 1.9
3 2 2.3
4 3 3.7
5 4 5
6 5 6.5
7 6 7.2
8 7 8
9 8 8.7
10 9 9.7
ml V 38 =
o
- ajuste de los datos a una ecuacin cintica de primer orden por el mtodo
de mnimos cuadrados.
kt
V V
V
bx m Y
bx V V V
i
i
=
|
|
.
|
\
|
=
=
o
o
o o
ln
) ln( ln(
Graficando los datos experimentales:
De la ecuacin:
y = -0.0321x + 3.6262
R = 0.9921
3.3
3.35
3.4
3.45
3.5
3.55
3.6
3.65
0 2 4 6 8 10
v
o
l
u
m
e
n
tiempo
Vol vs tiempo
Series1
Linear (Series1)
t ) ln(
i
V V
o
0 0
1 1.9
2 2.3
3 3.7
4 5
5 6.5
6 7.2
7 8
8 8.7
9 9.7
032 . 0
:
992 . 0
626 . 3 032 . 0
2
=
=
+ =
K
DONDE
R
X Y
PARA Ki:
t ) / ln(
i
V V V
o o
I
K
1 1.9 0.0513
2 2.3 0.0312
3 3.7 0.0341
4 5 0.0352
5 6.5 0.0375
6 7.2 0.0350
7 8 0.0337
8 8.7 0.0325
9 9.7 0.0327
PROMEDIO=0.0359
0039 . 0 032 . 0 0359 . 0 032 . 0 = = K
CONCLUCIONES.-
Mediante la practica experimental se pudo comprobar que la cintica de la
reaccin es de primer orden y que para tiempos infinitos el volumen ser
constante
Finalmente con la representacin grafica se pudo obtener el valor de la constante
cinetica igual a: 0.032
BIBLIOGRAFA
Gua de laboratorio ing. Jorge amusquivar
Jos Lpez Vivar, Eugenia guila Garay. Qumica III educacin media. Editorial
Santillana, 2001. Pginas 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 55, 56, 60, 63,
64.
Вам также может понравиться
- Biotecnología agroindustrial: parámetros cinéticos PPO manzanasДокумент8 страницBiotecnología agroindustrial: parámetros cinéticos PPO manzanasYeltsin FNОценок пока нет
- Yacimientos de Gas CondensadoДокумент32 страницыYacimientos de Gas CondensadoAlex Mamani Cuiza100% (3)
- ElectrodeposiciónCobreДокумент8 страницElectrodeposiciónCobreFoster Alberto Zavala AlegreОценок пока нет
- Descripción Del Proceso de Una Planta de DeshidrataciónДокумент7 страницDescripción Del Proceso de Una Planta de DeshidrataciónakileslabraОценок пока нет
- Metodos Opticos 1 InacapДокумент35 страницMetodos Opticos 1 InacapadsfbyessvhjОценок пока нет
- TERMOQUIMICAДокумент20 страницTERMOQUIMICAMerinoAlvan75% (8)
- EJERCICIOSДокумент2 страницыEJERCICIOSRocio MillaОценок пока нет
- Poster ElectrólisisДокумент1 страницаPoster ElectrólisisAndrés BolívarОценок пока нет
- Cinetica y EquilibrioДокумент19 страницCinetica y EquilibriolocouniОценок пока нет
- Guia de Ejercicios 3Документ6 страницGuia de Ejercicios 3Jhoselyn Pijuan ViscarraОценок пока нет
- Prob 4.14 de FelderДокумент5 страницProb 4.14 de FelderDavid SotoОценок пока нет
- Unidades Quimicas de ConcentracionДокумент4 страницыUnidades Quimicas de ConcentracionOsiris Rodríguez ValenciaОценок пока нет
- II Unidad - ProblemasДокумент4 страницыII Unidad - ProblemasMiguel04_1995Оценок пока нет
- 1-s2 0-S2451910321000041-Main en EsДокумент6 страниц1-s2 0-S2451910321000041-Main en Esreyna ocampoОценок пока нет
- Introducción A La Termodinamica 2Документ250 страницIntroducción A La Termodinamica 2cualquieraquesea100% (1)
- Salud y Psicología: EscuelaДокумент5 страницSalud y Psicología: EscuelaESMARLIS BELLO JOSEОценок пока нет
- Puentes de HidrógenoДокумент9 страницPuentes de HidrógenoAna Elizabeth Batista Sánchez100% (2)
- Presentación 1Документ16 страницPresentación 1Santiago Ferrufino PerezОценок пока нет
- Análisis Cloruro de Sodio Un Compuesto Iónico Común e ImportanteДокумент3 страницыAnálisis Cloruro de Sodio Un Compuesto Iónico Común e ImportantelauraОценок пока нет
- Ley de RauoltДокумент13 страницLey de RauoltPaolo Guarniz TufinioОценок пока нет
- Práctica de Laboratorio #3 Determinación Del PH de Ácidos y BasesДокумент7 страницPráctica de Laboratorio #3 Determinación Del PH de Ácidos y BasesDsam IIОценок пока нет
- Examen Segundo Trimestre Ciencias 3°Документ3 страницыExamen Segundo Trimestre Ciencias 3°eduardo mendezОценок пока нет
- Degradación fotocatalítica de paracetamol con TiO2Документ7 страницDegradación fotocatalítica de paracetamol con TiO2Priscila HerreraОценок пока нет
- Termodinámica de compresión de gasesДокумент36 страницTermodinámica de compresión de gasesAngelo MoraОценок пока нет
- Cuestionario de Reversibilidad Jair Castillo 6AДокумент3 страницыCuestionario de Reversibilidad Jair Castillo 6AJair CastilloОценок пока нет
- Cuadernillo Semana 05Документ3 страницыCuadernillo Semana 05MISHELL JULISA MAMANI FLORESОценок пока нет
- Preguntas para El Examen Oral de Termodinamica IДокумент14 страницPreguntas para El Examen Oral de Termodinamica IKarlos Eduardo Ccala Molina100% (1)
- Instalaciones Superficiales de ProduccionДокумент34 страницыInstalaciones Superficiales de ProduccionalmanzamosОценок пока нет
- Reacciones químicas: Magnesio, ácido clorhídrico y NaOHДокумент12 страницReacciones químicas: Magnesio, ácido clorhídrico y NaOHBrayan GamboaОценок пока нет
- Turbinas de vapor: generación eléctricaДокумент9 страницTurbinas de vapor: generación eléctricaJulio Cesar Guzmán ZeballosОценок пока нет