Академический Документы
Профессиональный Документы
Культура Документы
Lewis
Загружено:
cerdinanАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Lewis
Загружено:
cerdinanАвторское право:
Доступные форматы
Estructuras de Lewis
Elaborado por: Armando Marn B. Jesus Gracia M. Laura Gasque S.
NaClO4
HNO3
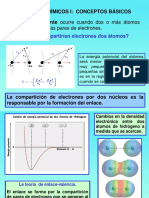
Una estructura de Lewis no es ms que un modelo con el cual se pretende ilustrar la distribucin ms plausible o probable de los electrones de valencia. Las estructuras de Lewis se generan con la idea de conseguir que todos los tomos involucrados cumplan la regla del octeto, (donde todos los tomos involucrados tengan al menos ocho electrones de valencia en su entorno). Debido a que tanto los elementos de transicin como los de transicin interna (bloques d y f) en general no obedecen esta regla, el mtodo que en este documento se describe no es til para generar las estructuras de Lewis de los compuestos de esos elementos. Cuando generamos una estructura de Lewis lo hacemos a partir de una frmula mnima, por lo que el mtodo que a continuacin se describe funciona para proponer estructuras de especies inorgnicas sencillas, (como NO3-, PSCl3, SF4 etc.). Por su gran variedad isomrica, no es posible proponer una estructura de Lewis de un compuesto orgnico basndose nicamente en la frmula mnima, tenemos que conocer el nombre de la sustancia para poder proponer su estructura, (por ejemplo la frmula C2H6O corresponde tanto etanol como el dimetil ter). En este documento no se abordan las estructuras de Lewis de compuestos orgnicos. Probablemente recordaras dos estructuras que aparecen en casi todos los libros de qumica, estas son las de H2O y la de NaCl:
Este par de estructuras ilustran algunas reglas importantes: el hidrgeno nunca completa 8 electrones, tan solo se rodea de 2. Si la interaccin entre dos tomos es principalmente covalente entonces un guin o lnea () que une a los smbolos representa al par de electrones involucrados en el enlace. Los pares de electrones no compartidos suelen representarse empleando dos puntos () aunque tambin pueden representarse con una raya ().
Cuando la interaccin entre dos especies es predominantemente inica no se dibuja un guin entre ellos. Tomando en cuenta estas dos reglas la representacin de NaCl puede ser:
En el caso del in Na+, observa que no representamos electrones de valencia en su entorno, pues ya ha perdido el nico electrn de valencia que posea. Esta regla te ser muy til al representar sales inicas poliatmicas. (p. ej. Na2SO4). Al representar especies como Na2SO4, NaHSO4 H2SO4 es mucho ms sencillo llegar a la representacin correcta si PRIMERO representamos correctamente al anin SO42- y a este agregamos los cationes: H+, Na+ o K+ segn sea necesario, (esta recomendacin se aplica para todos los oxoaniones, no solo para el in sulfato). Para proponer una estructura de Lewis puedes emplear el siguiente procedimiento (ilustraremos el mtodo usando las siguientes especies: NO2+, SF4, PO43- y SOCl2). 1) El primer paso es saber cuntos electrones de valencia tenemos que distribuir en total. Recuerda que, en el caso de los elementos representativos, (bloques S y P) el nmero de electrones de valencia coincide con el nmero ROMANO de la familia (por ejemplo: P familia 15 o VA: participa con 5 electrones de valencia). As para la especie SOCl2, debemos distribuir un total de 26 electrones (6 que aporta el tomo de azufre + 6 que aporta el oxgeno + (7x2) que aportan los tomos de cloro) 2) Si la especie a representar es un anin, debe adems adicionarse un nmero de electrones igual a la carga de ion (por ejemplo en el PO43- deben aadirse 3 electrones: (1x5) + (4x6) +3 = 32 electrones totales). Si la especie a representar es un catin hay que restar tantos electrones como cargas positivas tenga el ion (por ejemplo NO2+ debe restarse 1 electrn: (1x5) + (2x6) - 1 = 16 electrones totales).
especie Electrones totales
SOCl2
PO43-
SF4
NO2+
6+6+(2x7) = 26
5 + (4x6) + 3= 32
6 + (4x7) = 34
5+ (2x6)-1 = 16
3) De entre todos los elementos del bloque p presentes en la frmula mnima, selecciona al menos electronegativo como el tomo central. Enlaza a los elementos restantes, cada enlace que dibujes consume 2 electrones, hay que llevar la cuenta de los electrones remanentes. (Nota: al proponer los enlaces es importante recordar la regla del enlace inico mencionada anteriormente)
especie Electrones totales
SOCl2
PO43-
SF4
NO2+
6+6+ (2x7) = 26
5 + (4x6) + 3= 32
6 + (4x7) = 34
5+ (2x6)-1 = 16
Electrones restantes
26 6 = 20
32 8 = 24
34 8 = 26
16 4 = 12
4) Cada elemento debe estar rodeado de 8 electrones. Una vez dibujado el esqueleto bsico, evaluamos cuantos electrones requiere cada tomo para completar el octeto, y comparamos el total de electrones que hacen falta con los electrones restantes.
especie Electrones totales
SOCl2
PO43-
SF4
NO2+
6+6+(2x7) = 26
5 + (4x6) + 3= 32
6 + (4x7) = 34
5+ (2x6)-1 = 16
Electrones Restantes
26 6 = 20
32 8 = 24
34 8 = 26
16 4 = 12
Electrones requeridos
2 Cl (6e) = 12 S (2e) = 2 O (6e) = 6 Total = 20
4 O (6e) = 24 P (0e) = 0 Total = 24
4 F (6e) = 24 S (0e) = 0 Total = 24
2 O (6e) = 12 N (4e) = 4 Total = 16
5) En el caso de SOCl2 y PO43- el nmero de electrones requeridos coincide con el de electrones disponibles (restantes) por lo que simplemente los aadimos segn se requiera. En el caso de SF4, despus de aadir 6 electrones a cada tomo de flor, aun tendremos 2 electrones sobrantes (hay ms electrones disponibles que los que se requieren para completar el octeto de todos los tomos). Cuando esto sucede y el tomo central es un elemento del tercer perodo (o mayor), los electrones restantes se adicionan al tomo central. Esto implica que este elemento no cumple la regla de los 8 electrones pues expande el octeto. Esto es frecuente en muchos compuestos de elementos pesados tales como IF3, IF5, PF6- , XeF4 etc. Las estructuras de Lewis resultantes para SOCl2 , PO43- y SF4 son:
F F S F
F 6) Observa como en el caso de NO2+, se requieren 16 electrones pero slo hay 12 electrones disponibles. Cuando esto sucede recurrimos a la formacin de dobles enlaces, (recuerda que cada enlace consume dos electrones). Con frecuencia, como en este caso, es necesario proponer ms de un doble enlace a fin de conseguir que el nmero de electrones disponibles coincida con el nmero de electrones requeridos:
electrones disponibles: 12 electrones requeridos : 16
electrones disponibles: 10 electrones requeridos : 12
electrones disponibles: 8 electrones requeridos : 8
La estructura de Lewis propuesta para NO2+ es: Claramente tambin podramos proponer la siguiente estructura: La cual cumple con la regla del octeto, sin embargo, una estructura ms simtrica es ms probable que sea correcta que una asimtrica. Las estructuras generadas hasta este punto pueden o no ser correctas. Una forma de verificarlo es a travs del anlisis de CARGAS FORMALES: El anlisis de cargas formales tiene por objeto contar los electrones de valencia que posee cada tomo comparndolo con los que debera tener. Para ello suponemos que todos los enlaces formados son 100% covalentes, en donde cada tomo aporta 1 electrn al enlace: 4
Por lo tanto, al contar los electrones que pertenecen a cada tomo, solo contamos 1 electrn por cada enlace formado y pero 2 electrones por cada par no compartido. Al comparar el nmero de electrones que efectivamente pertenecen a cada tomo con los electrones de valencia que le corresponden (los que asignamos a un tomo neutro) puede ocurrir una de las siguientes tres situaciones: El nmero de electrones alrededor del tomo es mayor que el nmero de electrones de valencia. Podemos decir entonces que alrededor de ese tomo hay un exceso de electrones, por lo que se le asignar una carga formal negativa igual al nmero de electrones en exceso. El nmero de electrones alrededor del tomo es menor que el nmero de electrones de valencia. En este caso, alrededor de ese tomo hay una deficiencia de electrones, por lo que se le asignar una carga formal positiva igual al nmero de electrones faltantes. El nmero de electrones alrededor del tomo es igual al el nmero de electrones de valencia. En este caso la carga formal es igual a cero (no hay exceso ni defecto de electrones). (Tip: Carga formal = electrones de valencia electrones asignados) El anlisis de cargas formales para NO2+, SF4, PO43- y SOCl2 arroja los siguientes resultados
Especie
SOCl2
NO2+
PO43-
SF4
F F S F F
Estructura de Lewis
Nmero de electrones alrededor de cada tomo
O
6
O
6
+1
Carga Formal asignada
O
0
O
0
Suma de cargas En la especie
+1
-3
Si las cargas formales fueron correctamente asignadas, la suma de estas debe ser igual a la carga de la especie que se intenta describir (observa el ltimo rengln de la tabla anterior). En la estructura propuesta para el SOCl2 podemos observar que, con la distribucin electrnica propuesta, el tomo de oxgeno presenta un exceso de electrones mientras que el azufre tiene una deficiencia. Es poco probable que esta estructura sea correcta pues los electrones (en exceso) del oxgeno se sentiran atrados por la carga positiva en el azufre. Una forma de representar esto es proponiendo la formacin de un enlace adicional entre stos tomos:
Nota que con la nueva distribucin se disminuyen las cargas formales en ambos tomos. Este procedimiento podemos efectuarlo siempre que existan tomos con carga negativa contiguos a un tomo con carga positiva y podemos repetirlo cuantas veces sea necesario (esto sucede con iones como SO42- y ClO4-). En la estructura anterior puedes observar que ahora alrededor del azufre hay 4 pares electrnicos de enlace y un par no enlazante por lo que alrededor de este tomo podemos contar un total de 10 electrones. Como se mencion con anterioridad, si el tomo central es del tercer perodo (o mayor), existe la posibilidad de plantear estructuras en donde el tomo central viole la regla del octeto. (En el caso del in NO3- no es posible plantear la reduccin de cargas formales pues el tomo central DEBE cumplir la regla del octeto pues pertenece al segundo perodo, observa la figura de la pgina 1). Para el in fosfato tambin es posible plantear la minimizacin de cargas usando el procedimiento descrito anteriormente:
As las estructuras de Lewis para las especies NO2+, SF4, PO43- y SOCl2 son:
En ellas, la suma de las cargas formales es igual a la carga de la especie, no existen cargas positivas contiguas a cargas negativas y todos los tomos presentan al menos 8 electrones en su entorno. Plantear estructuras de Lewis para sustancias como Na3PO4, K2HPO4, NaH2PO4 y H3PO4, puede parecer imposible pues son demasiados tomos. Con frecuencia se comete el error de intentar adicionar todo a la vez al tomo central por lo que se terminan proponiendo estructuras como:
Al enfrentar problemas como el anterior es mucho ms fcil plantear primero la estructura del anin para posteriormente adicionarle los cationes correspondientes: Na3PO4, (32 electrones totales) = PO43- + 3Na+. K2HPO4, (32 electrones totales) = PO43- + H+ + 2Na+. NaH2PO4, (32 electrones totales) = PO43- + 2H+ + Na+. H3PO4, (32 electrones totales) = PO43- + 3H+. Al plantear correctamente la estructura del anin PO43-, del anlisis de cargas formales, podemos saber en donde estn localizadas las cargas negativas en este anin, por lo que al considerar la interaccin con cationes como H+ o Na+ estos deben estar tan cerca como sea posible de la(s) carga(s) negativa(s). Usando como ejemplo al NaH2PO4, podemos proponer en primera instancia que la estructura debe ser cercana a:
O P O
PO43- + 2H+ + Na+ =
Na
H
Como mencionamos al principio del documento, cuando la interaccin entre dos especies es predominantemente inica no se dibuja un guin entre ellos, (lo cual ocurre entre el ion Na+ y el O -1). Sin embargo, en el caso de la interaccin del in H+ y el O-1, podemos considerar que esta tiene un importante carcter covalente por lo que podemos usar el mtodo de minimizacin de cargas y compartir uno de los pares de electrones del O-1 con el in H+:
Usando este mtodo quiz encuentres sencillo plantear las estructuras de: H2SO4 a partir de 2H+ + SO42-, HCN a partir de H+ + CN-, H2O2 a partir de 2H+ +O22- y HClO4 a partir de H+ + ClO4-. Intenta seguir el mtodo y compara tus resultados con las siguientes estructuras:
Las estructuras de Lewis (cuando se plantean correctamente) pueden darte mucha informacin: Con ellas podemos por ejemplo, localizar los sitios ms reactivos (en donde hay exceso o defecto de electrones) predecir la forma de una molcula (empleando el modelo de repulsin de pares electrnicos de valencia). Adicionalmente las estructuras de Lewis pueden ayudarnos a asignar los estados de oxidacin de cada uno de los tomos en una molcula o in. Esto puede ser de particular utilidad en sustancias que presentan tomos de un mismo elemento en distintos estados de oxidacin (lo cual sucede en casi todos los compuestos orgnicos). Con frecuencia solemos calcular los estados de oxidacin a partir de frmulas mnimas, en donde siempre asignamos al tomo de oxgeno un estado de oxidacin -2, (salvo en los perxidos) y al hidrgeno y los metales alcalinos +1 (salvo en los hidruros). El estado de oxidacin de los dems elementos suele calcularse por diferencia: +1 -2 +1 +7 -2 +1 +6 -2 +1 +6 -2 +1 +2 -2 +1 -1
H2 O
KMnO4
Na2SO4
K2Cr2O7
Na2S2O3
H 2 O2
Sin embargo cuando nos enfrentamos a sustancias como el cido actico C2H4O2, al anin tetrationato S4O62- o al cido propinico C2H6O2, al calcular los estados de oxidacin nos encontramos con sorpresas: X +1 -2 X -2 X +1 -2
2-
C 2 H 4 O2
2X + 4 4 = 0 X= 0?
S4 O6
C 3 H 6 O2
3X +6 -4 = 0 X = -2/3?
4X -12 = -2 X = + 2.5?
Es importante mencionar que cuando se calculan los estados de oxidacin a partir de frmulas mnimas, lo que se obtiene es el promedio de los estados de oxidacin de cada elemento. Sin embargo, cuando se calculan los estados de oxidacin empleando las estructuras de Lewis podemos obtener los estados de oxidacin para cada tomo. 8
Cabe mencionar que los estados de oxidacin representan la carga que cada tomo tendra si se considera que todos los enlaces formados son inicos. Es por esto que al oxgeno siempre se le asigna estado de oxidacin de 2 pues despus del flor es el elemento ms electronegativo de la tabla peridica. Qu estado de oxidacin debe asignarse al oxgeno en el compuesto OF2? +2!. A partir de las estructuras de Lewis podemos calcular los estados de oxidacin simplemente asignado el par de electrones que dos tomos comparten al tomo ms electronegativo. Si dos tomos del mismo elemento se encuentran enlazados, a cada tomo le corresponder un electrn del enlace (en ese caso la diferencia de electronegatividad es de cero por lo que el enlace no puede considerarse como inico). Una vez que se han repartido todos los electrones de los enlaces, el estado de oxidacin se calcula de la misma forma en que lo hicimos anteriormente con la carga formal: comprando los electrones alrededor de cada tomo con los electrones de valencia que deba poseer. Si a un tomo le sobran electrones se le asignar un estado de oxidacin negativo cuyo valor es igual al nmero de electrones sobrantes, mientras que si le faltan electrones el estado de oxidacin ser positivo. En el caso del agua:
Despus de reorganizar inicamente todos los electrones, alrededor del oxgeno hay 8e-, (sobran 2e- en relacin a los 6e- valencia que le corresponden) mientras que alrededor de los tomos de hidrgeno no hay electrones (les hace falta 1e- a cada uno). Es por esto que asignamos los estados de oxidacin en este caso como -2 (para el Oxgeno) y +1 (para los tomos de Hidrgeno). En el caso del perxido de hidrgeno y del OF2:
+1
-1
-1
+1
-1
+2
-1
En el caso del perxido, debido a que la diferencia de electronegatividad de los tomos que participan en el enlace O O es de cero, del par de electrones del enlace asignamos un electrn a cada uno de estos tomos por lo que alrededor de cada tomo de oxgeno podemos contar 7 electrones (1 electrn de ms), por lo que el estado de oxidacin que le corresponde es -1. En el caso de OF2, el tomo de oxgeno queda con tan solo cuatro electrones por lo que se le asigna un estado de oxidacin de +2. Al efectuar este mismo anlisis con el anin tetrarionato:
O = 8 electrones: E. de Ox. = -2
S = 6 electrones: E.de Ox. = 0 S = 1 electrn: E.
de Ox. = +5
Como en el anin tetrationato (S2O62-) hay dos tomos de azufre con estado de oxidacin +5 y 2 tomos de azufre con estado de oxidacin cero, en promedio el estado de oxidacin para este elemento es de +2.5, que coincide con el calculado anteriormente. En el caso del cido actico C2H4O2 y el cido propinico C2H6O2, a partir de sus estructuras de Lewis podemos calcular los siguientes estados de oxidacin:
H H H
C: -3 (7e-), C: +3 (1e-), En promedio C: (-3 +3 )/2 = 0 H: +1 (0e-), O: -2 (8e-)
H C C H C
O H
C: -3 (7e-), C:-2 (6e-), C: +3 (1 e-) En promedio C: (-3 -2 +3 )/3 = -2/3 H: +1 (0e-), O: -2 (8e-)
Nota como el promedio de los estados de oxidacin del carbono coinciden con los calculados anteriormente.
10
Вам также может понравиться
- QUI-115 Quimica General I - Unidad 3-Semana 7 - 3.5-3.13 DISCU 3Документ68 страницQUI-115 Quimica General I - Unidad 3-Semana 7 - 3.5-3.13 DISCU 3AleОценок пока нет
- 1enlace Quimico QgeДокумент59 страниц1enlace Quimico QgeSANDILY DEYSI PAUCCAR PANIHUARAОценок пока нет
- Estructuras de LewisДокумент17 страницEstructuras de LewisEmmanuel CocomОценок пока нет
- Notas Tercer ParcialДокумент68 страницNotas Tercer ParcialRuiz AlbertoОценок пока нет
- 1 Enlace QuimicoДокумент87 страниц1 Enlace QuimicoWalker ApazaОценок пока нет
- Capitulo V Enlace QuimicoДокумент26 страницCapitulo V Enlace QuimicoLUIS FERNANDO TAPARA QUISPEОценок пока нет
- Enlace CovalenteДокумент6 страницEnlace CovalenteDario JiménezОценок пока нет
- E Structur As LewisДокумент32 страницыE Structur As LewisMarco AlvarezОценок пока нет
- Geometría Molecular 1Документ56 страницGeometría Molecular 1Kevin Guao BolañoОценок пока нет
- Simbolos Lewis y Regla Del OctetoДокумент9 страницSimbolos Lewis y Regla Del OctetoLuz Marina M. SancaОценок пока нет
- Enlaces químicos y estructuras de LewisДокумент23 страницыEnlaces químicos y estructuras de LewisCGOROZCOОценок пока нет
- Estructura LewisДокумент10 страницEstructura LewisJluissilvОценок пока нет
- Excepciones A La Regla Del OctetoДокумент4 страницыExcepciones A La Regla Del OctetoTatiana HerediaОценок пока нет
- Estructuras de Lewis, carga formal y resonanciaДокумент6 страницEstructuras de Lewis, carga formal y resonanciaOmar NuñezОценок пока нет
- Quimica YadesДокумент45 страницQuimica YadesCUBAS WILL ANGELОценок пока нет
- Escribe Las Estructuras de Lewis de Los Siguientes CompuestosДокумент8 страницEscribe Las Estructuras de Lewis de Los Siguientes CompuestosGuada LuОценок пока нет
- Enlace CovalenteДокумент5 страницEnlace CovalentelabeitiОценок пока нет
- Química - Estructura de Lewis de moléculas orgánicas e inorgánicasДокумент6 страницQuímica - Estructura de Lewis de moléculas orgánicas e inorgánicasMaria GonzalezОценок пока нет
- Estructuras de Lewis y Carga FormalДокумент5 страницEstructuras de Lewis y Carga FormalHirianny OlavesОценок пока нет
- Estructuras de LewisДокумент4 страницыEstructuras de LewisUrdaneta Rogelio100% (1)
- Química General: 3.4.1. Cómo Determinar La Estructura de Lewis: Teoría RPECVДокумент4 страницыQuímica General: 3.4.1. Cómo Determinar La Estructura de Lewis: Teoría RPECVvictor1080Оценок пока нет
- Enlace CovalenteДокумент24 страницыEnlace CovalenteMiranda De la VegaОценок пока нет
- Estructuras de Lewis y Geometría MolecularДокумент75 страницEstructuras de Lewis y Geometría MolecularSebastián RoqueОценок пока нет
- Quimica OdtДокумент6 страницQuimica Odtyolly hernandezОценок пока нет
- Carga FormalДокумент17 страницCarga FormalmilitarmlОценок пока нет
- Uniones Químicas o Enlace QuímicoДокумент21 страницаUniones Químicas o Enlace QuímicoLaura BaezОценок пока нет
- Clase 20. Modelos y TeoríasДокумент30 страницClase 20. Modelos y TeoríasFreddy Rafael Altamirano ApanОценок пока нет
- Estructura de Lewis del ácido fosfórico H3PO4Документ2 страницыEstructura de Lewis del ácido fosfórico H3PO4Roger Antonio Urbina Vallejos100% (2)
- U3 Enlaces Quimicos PDFДокумент66 страницU3 Enlaces Quimicos PDFPabloVelezОценок пока нет
- Unidad III - Enlaces Quimicos - 2020Документ14 страницUnidad III - Enlaces Quimicos - 2020Mirna Josefina Alemán FrancoОценок пока нет
- Estructura de Lewis: representación gráfica de enlaces y electronesДокумент29 страницEstructura de Lewis: representación gráfica de enlaces y electronesjcОценок пока нет
- SESION - 7 - Teoría Enlace QuímicoДокумент6 страницSESION - 7 - Teoría Enlace QuímicohhuataybuОценок пока нет
- Estructura de Lewis - Wikipedia, La Enciclopedia LibreДокумент30 страницEstructura de Lewis - Wikipedia, La Enciclopedia LibreVero MedinaОценок пока нет
- Modelo Lewis - UvaДокумент14 страницModelo Lewis - UvahoneyyesОценок пока нет
- Enlaces QuímicosДокумент27 страницEnlaces QuímicosFernando ZuñigaОценок пока нет
- Enlaces químicos: ionicos, covalentes y sus característicasДокумент10 страницEnlaces químicos: ionicos, covalentes y sus característicasJoaquin MartinОценок пока нет
- GuiaДокумент8 страницGuiaFrancisca Aravena MéndezОценок пока нет
- Estructura de LewisДокумент22 страницыEstructura de LewisErick David0% (1)
- Estructura de Lewis - Wikipedia, La Enciclopedia LibreДокумент6 страницEstructura de Lewis - Wikipedia, La Enciclopedia LibreHamilton Davila CordobaОценок пока нет
- Configuracion Electronica 18 03 ProfeДокумент9 страницConfiguracion Electronica 18 03 Profedenis_wadeОценок пока нет
- Estructura de LewisДокумент7 страницEstructura de LewisManuel Vazquez PerezОценок пока нет
- Unidad 2 Lección 1 Taller ResonanciaДокумент22 страницыUnidad 2 Lección 1 Taller ResonanciamariaОценок пока нет
- Estructura de LewisДокумент13 страницEstructura de LewisAntonio VnsОценок пока нет
- 6 - en 2Документ18 страниц6 - en 2Willy Uio0% (2)
- Estructura de Lewis y Regla Del Octeto Quimica UVGДокумент6 страницEstructura de Lewis y Regla Del Octeto Quimica UVGLopez Lopez Hugo FranciscoОценок пока нет
- Enlace CovalenteДокумент18 страницEnlace CovalenteManuelReznorОценок пока нет
- Enlace Quimico Completo PDFДокумент38 страницEnlace Quimico Completo PDFkatherineОценок пока нет
- Enlaces QuimicosДокумент7 страницEnlaces QuimicosArnol RodriguezОценок пока нет
- Regla Del OctetoДокумент2 страницыRegla Del OctetoMiguel SaucedoОценок пока нет
- Clasificacion Enlaces Quimicos (Autoguardado)Документ57 страницClasificacion Enlaces Quimicos (Autoguardado)Nancy FloresОценок пока нет
- TEORÍA LEWIS - ROctetoДокумент19 страницTEORÍA LEWIS - ROctetomarcos edúОценок пока нет
- Enlace Químico 3Документ38 страницEnlace Químico 3LolaОценок пока нет
- Estructura de LewisДокумент9 страницEstructura de Lewisgabrielmoraiti332Оценок пока нет
- Estructuras de LewisДокумент4 страницыEstructuras de LewiscatoshОценок пока нет
- LewisДокумент14 страницLewisAlfredo GsОценок пока нет
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaОт EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaРейтинг: 5 из 5 звезд5/5 (1)
- Mecánica Cuántica Relativista y No Relativista: las dos a la vez: Parte I: Estados estacionariosОт EverandMecánica Cuántica Relativista y No Relativista: las dos a la vez: Parte I: Estados estacionariosОценок пока нет
- Proc Bloqueo y CandadeoДокумент16 страницProc Bloqueo y CandadeoGustavoОценок пока нет
- Marco TeoricoДокумент10 страницMarco TeoricoJhorman Mejia FloresОценок пока нет
- Matriz BAFI MetodologiaДокумент5 страницMatriz BAFI MetodologiaMaritere ValenciaОценок пока нет
- Quinto Anual SimulacroДокумент1 страницаQuinto Anual SimulacroJaime Juárez quispeОценок пока нет
- Identidades NotablesДокумент3 страницыIdentidades NotablesWilfredo ReynosoОценок пока нет
- Sobretensiones en Los Transformadores Miguel Angel Rodriguez PozuetaДокумент6 страницSobretensiones en Los Transformadores Miguel Angel Rodriguez PozuetaenriqueunoОценок пока нет
- Repaso de Naturales - 6Документ7 страницRepaso de Naturales - 6nelsonОценок пока нет
- Laboratorio Liquido-LiquidoДокумент12 страницLaboratorio Liquido-LiquidoGabriel Rios100% (1)
- Germinación y crecimiento de plántulas de maízДокумент11 страницGerminación y crecimiento de plántulas de maízJesús Rafael Méndez NateraОценок пока нет
- Organelos de La CélulaДокумент16 страницOrganelos de La CélulaSu SaucedoОценок пока нет
- Zw32-12d Interruptor de Potencia Sojo - 1Документ5 страницZw32-12d Interruptor de Potencia Sojo - 1Luis Francisco Calderon EspinozaОценок пока нет
- DEVASC Module 3Документ95 страницDEVASC Module 3Brian Villota Ceballos100% (1)
- Prueba hidrostática cañeríaДокумент5 страницPrueba hidrostática cañeríaGabo ContrerasОценок пока нет
- El Calor y La Temperatura: IdentificaciónДокумент13 страницEl Calor y La Temperatura: IdentificaciónargaxdОценок пока нет
- Unidad 1. Acción 1.3. Mapa Conceptual. Clasificación de Operaciones Unitarias.Документ3 страницыUnidad 1. Acción 1.3. Mapa Conceptual. Clasificación de Operaciones Unitarias.Manuel Arellano100% (2)
- Instrumentos de Medision de PresionДокумент11 страницInstrumentos de Medision de PresionDennys FumaОценок пока нет
- Conjuntos Numéricos GUIÓN CEVAДокумент11 страницConjuntos Numéricos GUIÓN CEVAcvcarlosvilla1100% (14)
- Ondas Electromagnéticas - ViДокумент5 страницOndas Electromagnéticas - ViRichard Jhonn Salas GutierrezОценок пока нет
- Cinematica - EjerciciosДокумент1 страницаCinematica - EjerciciosFlorencia Yessenia Chacon ParedesОценок пока нет
- Evolución del coeficiente de arrastre y área frontal en el MustangДокумент10 страницEvolución del coeficiente de arrastre y área frontal en el MustangKeto BAОценок пока нет
- 11-Compresores para Frenos de AireДокумент22 страницы11-Compresores para Frenos de AireLuigui Lopez LlancaОценок пока нет
- M19S2AI4Документ6 страницM19S2AI4Hugo AG100% (1)
- PDF 1 Desigualdades Lineales 1variable m1 l2Документ17 страницPDF 1 Desigualdades Lineales 1variable m1 l2Fabian Gomez AlvarezОценок пока нет
- GuiaДокумент9 страницGuiaDANIEL JULIOОценок пока нет
- Mapa Conceptual de Los Paradigmas y Lenguajes de La Programación RepresentativaДокумент1 страницаMapa Conceptual de Los Paradigmas y Lenguajes de La Programación RepresentativaAlan yaer Esteban EstradaОценок пока нет
- Cromatografia LiquidaДокумент21 страницаCromatografia LiquidaRicardo Ramirez QuitoОценок пока нет
- 2012-1 Ensayo de Dureza LeebДокумент12 страниц2012-1 Ensayo de Dureza LeebLUZ MARINA TAIPE TUNQUIPAОценок пока нет
- Taller de MembranasДокумент6 страницTaller de MembranasFidel Tovar100% (1)
- Cooper PracticaДокумент1 страницаCooper PracticaWILLIAM YOEL PARI CUTIPAОценок пока нет
- Boquillas cierre máquina embalajeДокумент5 страницBoquillas cierre máquina embalajeCamilo Jose Atehortua QuicenoОценок пока нет