Академический Документы
Профессиональный Документы
Культура Документы
Solidos Ionicos PDF
Загружено:
Enrico169Оригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Solidos Ionicos PDF
Загружено:
Enrico169Авторское право:
Доступные форматы
Tema 10: slidos inicos
TEMA 10 SLIDOS INICOS Introduccin
De forma muy simplificada, un slido inico es un slido que est formado por cationes y aniones unidos por la accin de fuerzas electrostticas. Los slidos inicos presentan una serie de propiedades caractersticas:1 Son slidos cristalinos a temperatura ambiente Presentan altos puntos de fusin y ebullicin debido a la alta energa necesaria para romper las uniones electrostticas entre cationes y aniones en las tres direcciones del espacio de la red tridimensional. Son duros, aunque en comparacin con los slidos metlicos son menos duros, ms quebradizos y ms frgiles. ndices de coordinacin tpicos en el intervalo 4-8, por lo que son menos densos que los metales. No son tan elsticos y plsticos como los metales y aleaciones, es decir, no son fcilmente mecanizables. Son solubles en disolventes polares. No conducen la corriente elctrica, es decir son aislantes. Fundidos, presentan una alta conductividad (la conduccin tiene lugar por movimiento de iones). La estructura, propiedades y naturaleza de estos compuestos se puede explicar haciendo uso de un modelo denominado Unin Inica: dicho modelo considera estos slidos como un conjunto de esferas cargadas (iones) que interaccionan entre s mediante fuerzas electrostticas de tipo coulombiano.
Es importante recordar que estas propiedades tpicas no siempre estn presentes en todos los slidos inicos, al igual que sucede con las propiedades generales de otros tipos de slidos. Por ejemplo la familia de los lquidos inicos se caracteriza por ser compuestos inicos lquidos a temperatura ambiente. Otro ejemplo son las bateras de litio constitudas por xidos u oxoaniones complejos de Li+ (no por Li metal), que presentan estructuras con muchos huecos y con defectos, y que siendo slidos inicos son conductores (en realidad es una conduccin por movimiento del pequeo in litio, no por movimiento de electrones como sucede en los metales).
Tema 10: slidos inicos
Estructuras caractersticas de los slidos inicos
En primer lugar describiremos las estructuras ms habituales que presentan los slidos inicos. Son estructuras basadas en empaquetamientos de esferas con los huecos ocupados. Dicho modelo trabaja con capas compactas de esferas dispuestas unas sobre otras. Este modelo es muy til y eficaz para sistematizar y clasificar las estructuras ms corrientes y usuales de los slidos inicos. La tcnica de difraccin de Rayos X ha permitido estudiar las estructuras cristalinas de multitud de slidos inicos. Como sucede en cualquier slido cristalino, los cationes y aniones de un slido inico se disponen ordenadamente en una red cristalina. Puesto que las fuerzas que mantienen unidos a los iones son de naturaleza electrosttica, la red cristalina formada debe cumplir con ciertos requisitos o reglas bsicas: Cada catin debe agrupar a su alrededor (y en contacto) el mximo nmero posible de aniones; por otra parte, cada anin debe hacer lo propio con los cationes (mximo nmero coordinacin posible para ambos iones). La separacin entre iones de la misma carga debe ser la mxima posible, compatibilizndola con la mnima separacin factible entre iones de diferente carga (optimizacin de las fuerzas de atraccin-repulsin electrostticas). En todo caso debe respetarse la neutralidad elctrica de la estructura; es decir, la proporcin de cationes y aniones debe ser la correspondiente a la estequiometra del compuesto (NaCl, CaF2, Cs2O, etc.) Las estructuras toman el nombre de un compuesto determinado y as se denominan (por ejemplo, se dice que el MgSe presenta una estructura tipo NaCl). En general se considera un empaquetamiento del in ms voluminoso (anin) y los huecos se ocupan por el menos voluminoso (normalmente, catin). Veamos a continuacin una serie de estructuras tipo basadas en diferentes empaquetamientos: 1. Estructuras basadas en empaquetamiento cbico compacto 1.a. Estructura del NaCl Esta estructura tambin se denomina estructura de la sal gema. La estructura del NaCl se basa en un empaquetamiento cbico compacto de aniones Cl-, voluminosos, en la que los cationes ocupan todos los huecos octadricos. Celdilla unidad: Los Cl- ocupan los vrtices y el centro de las caras y los Na+ ocupan los 12 centros de las aristas y el centro del cubo. La Figura 10.1 muestra la celdilla unidad del NaCl.
Tema 10: slidos inicos
Figura 10.1. Celdilla unidad del NaCl. Observando atentamente la celdilla podemos ver que el catin tambin forma un empaquetamiento cbico compacto desplazado media arista respecto al del anin. De hecho la celdilla se puede visualizar como un ecc de cationes con los aniones ocupando los huecos octadricos. Igualmente si nos fijamos en el catin que ocupa el centro del cubo, podemos ver cmo est rodeado de 6 aniones a una distancia a/2; despus est rodeado de 12 cationes (los de los centros de las aristas) a una distancia de media diagonal de la cara (a/22); 8 aniones (los de los vrtices) a media diagonal del cubo (a/23). Representacin de una vista en la direccin del empaquetamiento:
C OA B OC A OB C OA B OC A Cl Na+ Cl Na+ Cl Na+ Cl Na+ Cl Na+ Cl
Coordinacin: Cada uno de los iones est rodeado por un octaedro de seis iones contrarios. Por tanto, el nmero de coordinacin de cada in es 6, y se dice que es una estructura de coordinacin (6,6). Para establecer el nmero de iones que hay de cada tipo en una celda elemental, se debe recordar que: a) Interior. Un Na+ del interior de la celda pertenece completamente a ella y cuenta como 1. b) Aristas. Un Na+ situado en el centro de cada arista es compartido por cuatro celdas y, por tanto, contribuye con : 12/4
Tema 10: slidos inicos
c) Caras. Un Cl situado en el centro de cada cara es compartido por dos celdas y contribuye con a la celda en cuestin: 6/2 d) Vrtices. Un Cl situado en cada vrtice es compartido por las ocho celdas que tienen ese vrtice comn, por lo que contribuye con 1/8: 8/8 El nmero de unidades frmula contenidos en la cedilla unidad es 4: (NaCl)4. Ejemplos de estructuras tipo NaCl (6,6): LiCl, KBr, AgBr, MO (M = Mg, Ca, Ti, Fe, Ni) 1.b. Estructura de la fluorita (CaF2) La estructura de la fluorita (CaF2) se basa en un empaquetamiento cbico compacto, pero de cationes. En ella, los aniones (de los que hay el doble que de cationes) ocupan todos los huecos tetradricos. El Ca2+ y el F tienen tamaos muy parecidos, por lo que lo ms correcto es hablar de un ecc expandido de cationes (para que los aniones tengan espacio para colocarse en los huecos). Celdilla unidad: Los Ca2+ ocupan los vrtices y el centro de las caras y los F ocupan los ocho huecos Td, situndose en la prolongacin desde el vrtice hacia el interior. La Figura 10.2 muestra la celdilla unidad de la fluorita.
Figura 10.2. Celdilla unidad de la fluorita.
Tema 10: slidos inicos
Representacin de una vista en la direccin del empaquetamiento:
Coordinacin: En la estructura de la fluorita, los aniones en sus huecos tetradricos tienen cuatro vecinos inmediatos. El sitio del catin est rodeado por una disposicin cbica de ocho aniones, por lo que la red tiene coordinacin (8,4) (Ver Figura 10.3).
Figura 10.3. Coordinacin (8,4) de la fluorita. Si contamos los iones de la celdilla unidad, podemos determinar que el nmero de unidades frmula es 4. Ejemplos de estructuras tipo fluorita (8,4): UO2, BaCl2, HgF2, PbO2 1.c. Estructura de la antifluorita (K2O) La estructura antifluorita, adoptada por el K2O, es la inversa a la estructura fluorita, en el sentido de que se han invertido las posiciones de los cationes y aniones. En ella los iones O2 forman un empaquetamiento cbico compacto y los cationes K+ ocupan todos los huecos tetradricos (Figura 10.4). En la estructura de antifluorita, la coordinacin es la opuesta a la de la fluorita, es decir, (4,8).
Tema 10: slidos inicos
Figura 10.4. Celdilla unidad de la antifluorita (K2O). Ejemplos de estructuras tipo antifluorita (4,8): K2O, K2S, Li2O, Na2O, Na2O, Na2Se. Un ejemplo interesante de estructura tipo antifluorita se da en el compuesto K2[PtCl6]. Su estructura consiste en cationes K+ ocupando los dos tipos de huecos tetradricos y aniones poliatmicos [PtCl6] formando un empaquetamiento cbico compacto (Figura 10.5).
Figura 10.5. Celdilla unidad del complejo K2[PtCl6]. Si contamos los iones de la celdilla unidad, podemos determinar que el nmero de unidades frmula es 4. 1.d. Estructura de la esfalerita o blenda de cinc (ZnS) La estructura de la esfalerita (ZnS) o blenda de cinc, se basa en un empaquetamiento cbico compacto de S2, pero ahora los cationes ocupan slo la mitad de los huecos tetradricos. Celdilla unidad: Los S2- ocupan los vrtices y el centro de las caras y los Zn2+ ocupan la mitad de los huecos tetradricos alternadamente (igual que en el diamante: obtenemos la misma celdilla pero en lugar de todo tomos de C, ahora tenemos aniones y cationes), situndose en la prolongacin desde el vrtice hacia el interior. (Figura 10.6).
Tema 10: slidos inicos
Figura 10.6. Celdilla unidad de la blenda. A continuacin se representa una vista en la direccin del empaquetamiento, donde podemos observar que slo se ocupa una de las dos capas de huecos T, quedando la otra capa sin ocupar:
A TA S2 Zn2+ S2 Zn2+ S2 Zn2+ S2
TC
TB
Coordinacin: Cada in est rodeado de cuatro vecinos, coordinacin (4,4) (Figura 10.7).
Figura 10.7. Coordinacin (4,4) de la blenda. Si contamos los iones de la celdilla unidad, podemos determinar que el nmero de unidades frmula es 4. Ejemplos de estructuras tipo esfalerita (4,4): CuCl, CdS, HgS, GaP, InAs (semiconductor con estructura tipo diamante, que curiosamente tambin muestran el Si y el Ge semiconductores intrnsecos)
Tema 10: slidos inicos
2. Estructuras basadas en empaquetamiento hexagonal compacto 2.a. Estructura de la wurtzita (ZnS) La estructura de la wurtzita toma su nombre de otro polimorfo del sulfuro de cinc. Difiere de la esfalerita en que deriva de un empaquetamiento hexagonal compacto de S2 en lugar de una disposicin cbica centrada en las caras, pero, como en la esfalerita, los cationes ocupan un tipo de huecos tetradricos (la mitad por lo tanto). La estructura de la wurtzita tiene coordinacin (4,4), es la adoptada por ZnO, BeO o AgI. Es la misma estructura que la de la tridimita- (ver Tema 9, slidos covalentes no metlicos).
La Figura 10.8 representa la celdilla unidad de la wurtzita
Figura 10.8. Celdilla unidad de la wurtzita. Si contamos los iones de la celdilla unidad, podemos determinar que el nmero de unidades frmula es 6. Representacin de una vista en la direccin del empaquetamiento:
Tema 10: slidos inicos
2.b. Estructura del NiAs La estructura del arseniuro de nquel (NiAs) se basa tambin en un empaquetamiento hexagonal compacto de aniones, donde los cationes Ni3+ ocupan ahora los huecos octadricos. Celdilla unidad: Los As3- ocupan los vrtices, el centro de las caras hexagonales y tres en medio de la celdilla formando un tringulo; los Ni3+ ocupan todos los huecos O, formando dos tringulos que se superponen entre s (y girados respecto al formado por lo aniones), justo en mitad de las capas. (Figura 10.9).
Figura 10.9. Celdilla unidad del NiAs. Coordinacin: Cada ion est rodeado de seis vecinos, coordinacin (6,6) (Figura 10.10). En Figura 10.10 se han representado tres capas de tomos de Ni (ocupando huecos octadricos) y dos capas de As (capas A y B del empaquetamiento ehc). Como se puede observar, cada tomo de arsnico est en el centro de un prisma trigonal de tomos de nquel. Por lo tanto la coordinacin es octadrica para los cationes pero de prisma trigonal alrededor de los aniones.
10
Tema 10: slidos inicos
Figura 10.10. tomos de As ocupando el hueco prismtico generado por seis tomos de Ni. Ejemplos de estructuras tipo NiAs (6,6): NiS, FeS, CoS, PtSn. Esta estructura es tpica de aniones muy polarizables (grandes y con gran carga) por lo que como veremos con ms detalle en el tema siguiente, presentan un alto grado de covalencia (enlace covalente) y en muchos casos enlaces M-M. 2.c. Estructura del rutilo La estructura del rutilo TiO2 es un ejemplo de red de aniones en empaquetamiento hexagonal compacto con una distorsin tetragonal, pero ahora los cationes ocupan slo la mitad de los huecos octadricos. La Celdilla unidad resultante es un prisma cuadrado donde los TiIV ocupan los vrtices y el centro; hay 4 oxgenos en la cara superior e inferior cerca de vrtices alternos, y 2 oxgenos cerca del centro del cubo. (Figura 10.11). La estructura consta de octaedros TiO6, con los tomos de O compartidos por tomos de Ti vecinos.
Tema 10: slidos inicos
11
Figura 10.11. Celdilla unidad del rutilo. Coordinacin: Cada tomo de titanio est rodeado por seis tomos de oxgeno (octadrico), y cada tomo de oxgeno lo est por tres de titanio (trigonal plano); resulta, por tanto, que la coordinacin es (6,3). Ejemplos de estructuras tipo rutilo: SnO2, MnO2, WO2 y varios fluoruros (NiF2, MgF2). 3. Otros empaquetamientos muy comunes 3.a. Estructura de la perovskita Es un xido doble cuya estructura se puede visualizar como un empaquetamiento cbico compacto de cationes calcio y aniones oxgeno: los cationes calcio en los vrtices y aniones oxgeno en el centro de las caras. El titanio ocupa de los huecos octadricos (si nos fijamos en una celdilla unidad tpica de un ecc, el Ti4+ ocupara el hueco octadrico que est en el centro de la celdilla).
Figura 10.12. Celdilla unidad de CaTiO3. Normalmente la celdilla unidad de la perovskita se dibuja como se recoge en la figura 10.13. Un Ca2+ en el centro de un cubo cuyos vrtices estn ocupados por los cationes Ti4+ y los centros de las aristas estn ocupados por los O2. Para pasar al centro el Ca hay que moverlo desde el vrtice hasta
12
Tema 10: slidos inicos
el centro de la arista y despus hacia el centro de la cara y como ltimo movimiento al centro del cubo. El resto de los tomos se deben desplazar de la misma manera. De este modo se observa claramente que el Ca2+ est rodeado de 12 O2 (centro de las 12 aristas); el O2 de dos Ti4+ (dos vrtices a distancia arista/2) y cuatro Ca2+ a una distancia mayor (media diagonal de cara) o sea un octaedro distorsionado tetragonalmente; cada Ti est rodeado de 6 aniones formando un octaedro.
Figura 10.13. Otra forma de celdilla de CaTiO3. Estequiometra CaTiO3: 8 Ca2+ , uno en cada vrtice (compartido por 8 cubos):1 6 O2 cada uno en el centro de la cara (compartida por 2 cubos): 3 1 Ti4+ Podemos determinar que el nmero de unidades frmula es 1. La estructura de la perovskita est relacionada con materiales de gran importancia tecnolgica por poseer propiedades elctricas especiales como la piezoelectricidad, ferroelectricidad y superconductividad a alta temperatura. 3.b. Estructura del CsCl La estructura del CsCl tiene una celda cbica simple en la que cada punto reticular est ocupado por un ion haluro y el catin metlico se sita en el centro de la celda. La estructura tambin se puede visualizar como una celda cbica simple en la que cada punto reticular est ocupado por un catin y el anin se sita en el centro de la celda.
Tema 10: slidos inicos
13
Figura 10.14. Celdilla unidad del CsCl. Coordinacin: El nmero de coordinacin de ambos tipos de iones es 8. Sus radios son tan semejantes que es posible este elevado ndice de coordinacin, muy favorable energticamente, con numerosos iones contrarios adyacentes a un in determinado.
Figura 10.15. Detalle del empaquetamiento (8,8) del CsCl. Ejemplos de estructuras tipo CsCl: CsBr y CsI, as como algunos compuestos formados por iones de radios semejantes a stos, entre los que se encuentra el NH4Cl. En general son cloruros, bromuros o yoduros de cationes muy voluminosos.
Defectos Estructurales
Hasta ahora hemos supuesto que los materiales cristalinos poseen un ordenamiento perfecto. Sin embargo, ese slido ideal que muchos autores denominan cristal perfecto, formado por redes en las cuales cada posicin est ocupada por el tipo correcto de tomo o in no existe ms que a 0 K. Por encima de esa temperatura los materiales presentan diversos tipos de imperfecciones y defectos de red, que afectan a muchas de sus propiedades fsicas y mecnicas, algunas veces de modo negativo
14
Tema 10: slidos inicos
y otras veces, beneficiosamente. La energa que se requiere para crear un defecto est compensada por el aumento de entropa de la estructura resultante. De hecho, la entalpa asociada a la formacin de defectos es positiva ya que produce inestabilidad en la red cristalina, pero el aumento de entropa es ms importante, lo que hace que, globalmente, sea favorable el hecho de que existan defectos. Por tanto, aunque la creacin de un defecto a partir de un cristal ideal es un proceso endotrmico est favorecida por la entropa ya que se introduce un cierto grado de desorden en la red. El equilibrio entre H y TS es fundamental. G= H TS A temperaturas superiores a 0 K, el equilibrio termodinmico favorece la presencia de defectos y el valor mnimo de G se alcanza para una determinada concentracin de defectos en el equilibrio. Dicha concentracin depende de la temperatura. Los defectos influyen sobre importantes caractersticas tecnolgicas, como la capacidad de formacin de aleaciones, la plasticidad, la conductividad elctrica de los semiconductores, a resistencia mecnica, la velocidad de difusin de los tomos y la corrosin de los metales. Existen muchos tipos de defectos y muchas maneras de clasificarlos: - Defectos puntuales o extendidos: los efectos puntuales afectan nicamente a algn punto de la red. Por el contrario, los defectos extendidos afectan a zonas amplias del cristal en una dos o tres dimensiones. - Defectos que modifican la estequiometra del compuesto o defectos que la mantienen. - Defectos intrnsecos, si tienen lugar en compuestos puros, o extrnsecos, que son el resultado de la adicin de dopantes. Trataremos a continuacin los defectos ms habituales que se pueden encontrar en redes cristalinas: a) Defecto de Schottky: Se da cuando un tomo o un in de la red ha dejado una vacante, es decir, un espacio vaco. Este tipo de defectos no afecta a la composicin del cristal, ya que existirn el mismo nmero de vacantes en las posiciones del catin y del anin (Figura 10.16). Por tanto, se mantienen tanto la estequiometra como la neutralidad elctrica del compuesto. Tambin se denomina defecto del par inico vacante.
Figura 11.16. Defecto de Schottky
Tema 10: slidos inicos
15
Los defectos que pertenecen a esta categora son por ejemplo: Una posicin vacante de tomo en una red metlica Una posicin vacante de catin y una de anin en una red MX Dos posiciones vacantes de catin y una de anin en una red MX2
Los defectos de Schottky se pueden clasificar como defectos puntuales que no afectan a la estequimetra del compuesto y adems son intrnsecos. Los defectos de Schottky se dan en haluros de alcalinos, si bien son muy poco numerosos (un defecto por cada 1014 unidades frmula). Son mucho ms numerosos en algunos compuestos de metales de transicin (por ejemplo, el TiO a alta temperatura puede llegar a tener hasta un defecto por cada 10 unidades frmula). Hay varios mtodos que pueden utilizarse para estudiar la incidencia de los defectos de Schottky en cristales estequiomtricos pero el ms sencillo, en principio, es medir la densidad del cristal. Una moderada concentracin de este tipo de defectos conduce a que la densidad observada sea ms baja que la calculada a partir de la difraccin de rayos X y de datos basados en el tamao y en la estructura de la celdilla unidad. Los defectos de Schottky pueden afectar a las propiedades elctricas (aumento de la conductividad) y a las propiedades mecnicas (fragilidad, dureza). b) Defecto de Frenkel: Se da cuando un tomo o in se ha desplazado de una de las posiciones de la red a un hueco de la misma (por ejemplo, el AgCl tiene estructura tipo NaCl pero algunos cationes se desplazan a huecos T que estn sin ocupar en la red cristalina).
Figura 10.17. Defecto de Frenkel Un ejemplo de red con defectos Frenkel es la del AgBr, que es del tipo del NaCl (es decir, basada en empaquetamiento cbico compacto de los aniones, donde los cationes ocupan los huecos octadricos): La migracin del catin Ag+ a un hueco tetradrico previamente sin ocupar genera un
16
Tema 10: slidos inicos
defecto de Frenkel en la red. En este caso, el catin debe ocupar un hueco tetradrico que es apreciablemente ms pequeo que la posicin octadrica. En general, los defectos de Frenkel se dan en estructuras ms abiertas, donde hay ms huecos vacantes y el catin tiene el tamao adecuado, como en estructuras tipo blenda o wurtzita, que pueden acomodar cationes sin que se genere un esfuerzo excesivo en la red. Los defectos de Frenkel se pueden clasificar como defectos puntuales que no afectan a la estequiometra del compuesto y adems son intrnsecos. Si se mide la densidad de un cristal con defectos Frenkel sta no vara ya que estos defectos no suponen cambio en el nmero de tomos o iones presentes. En la siguiente figura se representa el resultado de la existencia de los dos tipos de defectos descritos hasta el momento en un cristal perfecto.
Figura 10.18. (a) Cristal perfecto; (b) Defecto de Schottky, (c) Defecto de Frenkel c) Defectos que alteran la estequiometra del compuesto Otro defecto puntual importante ocurre cuando un in de una carga reemplaza otro in de diferente carga. Por ejemplo un in de carga 2+ reemplaza a un in de carga 1+. En este caso una carga extra positiva se introduce dentro de la estructura. Para mantener un balance de carga, se debe crear una vacante de una carga positiva (un catin 1+).
Figura 10.19. Defecto que altera la estequiometra por introduccin de Ca2+ en una red de NaCl, se obtiene un slido de estequiometra: Na1-2xCaxCl.
Tema 10: slidos inicos
17
Esta alteracin de la red cristalina da lugar a una sustancia no estequiomtrica, es decir, una sustancia que presenta una composicin variable, pero mantiene el mismo tipo de estructura. Por ejemplo, la composicin del monxido de hierro a 1000C es siempre deficiente en Fe y su composicin vara entre Fe0,89O y Fe0,96O. Al variar la composicin aparecen cambios en el tamao de la celdilla unidad, aunque el resto de las caractersticas del cristal se mantienen en ese intervalo de composicin. Como la formacin de un compuesto no estequiomtrico requiere cambios globales en la composicin, tambin se necesita que exista al menos un elemento en ms de un estado de oxidacin. As, en el Fe1-xO algunos cationes Fe(II) deben oxidarse a Fe(III) en la estructura (por ej. por la presencia de oxgeno del aire) al incrementarse x. Por tanto, las variaciones en la estequiometra son comunes en elementos de los bloques d y f, los cuales comnmente adoptan dos o ms estados de oxidacin y para algunos metales pesados del bloque p que tengan dos estados de oxidacin accesibles. d) Adicin de dopantes La adicin de algunos dopantes a los slidos cristalinos produce defectos que pueden ser de importancia comercial. Los cationes dopantes deben ser de un tamao similar a los de la red precursora. La introduccin de un dopante puede traducirse en un cambio en el estado de oxidacin de posiciones metlicas en la red precursora: un ejemplo muy citado es el dopaje de NiO con Li2O en presencia de oxgeno. Cuando se sustituye un in Ni2+ por un Li+ la neutralidad elctrica se mantiene por la oxidacin de Ni2+ a Ni3+.
e) Centros de color (centros F) Los defectos originados por la presencia de electrones atrapados en una red cristalina dan lugar a cambios de color. Por ejemplo, si se calienta NaCl en vapor de Na, los tomos de Na entran en la red
18
Tema 10: slidos inicos
cristalina. El Na se oxida a Na+, de manera que el electrn que se produce en la oxidacin queda atrapado en la red cristalina. El tomo de sodio se podra incorporar en una posicin de los cationes y el electrn ocupando la posicin de un anin. Existen otro tipo de centros de color donde el catin se coloca en un hueco no ocupado de la red y el electrn en otro (ver Figura 10.20).
Figura 10.20. Centros de color producidos por exceso de metal en la red cristalina. La excitacin y consiguiente relajacin del electrn ocasiona la emisin de radiacin en la regin del visible. El color depende de la red y no de la fuente de procedencia del electrn. El centro electrnico se conoce como centro F (farbe, color en alemn). Un ejemplo de un mineral con centro F es el Blue John, que es una rara forma azul-violeta del espato flor, muy apreciada en joyera.
Racionalizacin de la estructura de un slido inico: radios inicos
Para explicar o racionalizar por qu un compuesto inico adopta una estructura y no otra necesitamos conocer el tamao de los iones que lo forman, es decir los radios inicos (se estudi en el tema 3). Los valores de radios se pueden obtener a partir de datos de difraccin de rayos X. Sin embargo, los datos experimentales slo dan la distancia internuclear y, en el caso de los radios inicos esta distancia es la suma de los radios inicos del catin y del anin ms prximo en la red cristalina, por lo tanto determinar el radio inico no es dividir por dos el dato experimental como sucede con los radios covalentes y metlicos. Distancia internuclear catinanin = rcatin + ranin Esto supone considerar un modelo de esferas rgidas con iones de carga opuesta en contacto entre s en la red cristalina. Por tanto, la asignacin de radios inicos individuales tras esta aproximacin es
Tema 10: slidos inicos
19
problemtica y puede ser un tanto arbitraria. Ha habido muchos intentos de solucionar este problema: - Se ha intentado determinar el radio del anin suponiendo que en las combinaciones con cationes muy pequeos como Li+ los aniones prcticamente se tocan (Figura 10.21). De esta manera, se puede tomar la distancia aninanin como dos veces el radio del anin, lo que permite obtener rLi+ despejando de la ecuacin anterior.
Figura 10.21. Teniendo un valor se puede entonces determinar el radio de otros cationes y aniones, buscando un conjunto consistente de valores. Se han obtenido as los radios inicos de Land (rX-) y de Goldschmidt (rO2 = 1.32 ). - Otro conjunto de valores de radios inicos se han obtenido combinando los datos experimentales con clculos tericos basados en la carga nuclear efectiva para los electrones de cationes y aniones: radios inicos de Pauling con rO2 = 1.40 . - Ms recientemente, en 1976 Shannon y Prewitt realizaron un gran trabajo de revisin cristalogrfica asignando rO2 = 1.26 y usando dicho valor en multitud de compuestos para calcular el radio del catin con el fin de comprobar que las distancias catinanin experimentales se reproducen. Adicionalmente, se ha observado que el tamao inico aumenta al aumentar el nmero de coordinacin (esta es la tabla que se adjunta al final de este tema: radios inicos segn IC). Mediante tcnicas de difraccin de rayos X a baja temperatura se puede medir con ms precisin la densidad electrnica entre dos tomos vecinos de manera que se pueden obtener mapas de densidad electrnica. As, el mnimo de densidad electrnica ser la frontera entre el catin y el anin (Figura 10.22), aunque muchas veces el mnimo es ancho y de ah la dificultad en su determinacin: en general los cationes son algo ms grandes de lo estimado y por lo tanto los aniones algo ms pequeos.
20
Tema 10: slidos inicos
Figura 10.22. Ejemplo de mapa de densidad electrnica. Se compara este radio experimental moderno con los radios propuestos por G (Goldschmidt), S (Shannon) y P (Pauling). Como conclusin debemos tener en cuenta que nicamente se pueden hacer comparaciones utilizando la misma tabla y, si es posible, utilizando el radio inico tabulado para el mismo ndice de coordinacin. Tendencias peridicas en radios inicos Las tendencias generales para los radios inicos son iguales que para los radios atmicos (tema 3): Aumentan al descender en un grupo (la contraccin lantnida restringe el aumento entre iones metlicos de las series 4d y 5d). Para iones de la misma carga, disminuye al avanzar en un periodo: rCa2+ > rZn2+ Para cationes de un mismo elemento en diferentes estados de oxidacin: disminuye cuando aumenta la carga del catin: rFe2+ > rFe3+ Los cationes son ms pequeos que los aniones para elementos con nmeros atmicos similares ya que la carga positiva indica un nmero de electrones reducido y en consecuencia una atraccin nuclear ms fuerte.
Tema 10: slidos inicos
21
Si un in puede existir en diferentes ndices de coordinacin, su radio aumenta a medida que se incrementa el nmero de coordinacin. el radio de un catin disminuye al aumentar su carga y el radio de un anin aumenta al aumentar su carga.
Relacin numrica entre radios inicos La relacin entre radios (rcatin / ranin) se suele emplear para racionalizar estructuras (en general se utiliza el cociente entre el radio ms pequeo y el ms grande). Esfera de empaquetamiento Esfera que cabe justamente en un hueco cbico Esfera que cabe justamente en un hueco octadrico Esfera que cabe justamente en un hueco tetradrico
rc = 0.732R
ro = 0.414R
rt = 0.225R
cationes a huecos cbicos
cationes a huecos octadricos
cationes a huecos tetradricos
Si esta relacin entre radios est por debajo del mnimo calculado, los iones de carga opuesta no estn en contacto y por tanto los iones de la misma carga se tocarn, lo que supondr una repulsin. Por tanto, el nmero de coordinacin ms bajo, donde los iones de distinta carga pasan de nuevo a estar en contacto, est favorecido. Supongamos un slido inico donde el catin ocupa el hueco octadrico. Los aniones, por tanto, estn formando el empaquetamiento compacto. Tal y como se coment en el tema 8, el radio de un hueco octadrico es 0.414ra Situaciones en las que la relacin rc/ra < 0.414 pueden dara lugar a repulsiones entre los aniones, lo que aumentara la inestabilidad de la red cristalina. En estos casos el catin tiende a rodearse de un menor nmero de aniones, es decir, el ndice de coordinacin ms favorable para el catin es IC = 4.
22
Tema 10: slidos inicos
Cuando la relacin rc/ra 0.414 se alcanza un ndice de coordinacin 6, ya que el catin es ms grande y esto obliga a los aniones a separarse. Esta situacin es favorable hasta un valor en el que es ms estable que el catin se rodee de ms aniones, ocupando un hueco cbico, donde el ndice de coordinacin es 8. Aspectos energticos del enlace qumico La estabilidad de una red inica procede principalmente de la fuerza de atraccin entre iones de carga opuesta y es medida por la entalpa de red (HR) que se define como la entalpa correspondiente al proceso de ruptura de la red en los iones gaseosos separados por distancias infinitas (situacin en la que no existe interaccin entre iones). La entalpa de red mide la fortaleza de cohesin dentro del cristal o, lo que es lo mismo, la fortaleza del enlace inico. KCl(s) K+(g) + Cl(g) HR(KCl)
No es posible medir experimentalmente las entalpas reticulares, pero s se pueden calcular tericamente o, alternativamente, determinarse indirectamente mediante ciclos de Born-Haber basados en la ley de Hess. a) Clculos tericos de la entalpa de red Considerando que el slido inico est formado por esferas con carga indeformables, y teniendo en cuenta las posibles atracciones y repulsiones entre los iones, se pueden obtener una serie de expresiones para calcular la entalpa de red.
n= n iones por unidad frmula d(ec. de Born Mayer) = distancia internuclear (suma de radios inicos) d(ec. de Kapustinskii) = suma de radios inicos para IC = 6 A = constante de Madelung (depende del tipo de red)
Tema 10: slidos inicos
23
Para determinar la entalpa empleando la frmula de Born-Mayer es preciso conocer la estructura del compuesto; sin embargo, si se utiliza la ecuacin de Kapustinskii basta con saber la frmula del compuesto y los radios inicos para IC = 6. b) Determinacin indirecta mediante ciclos de Born-Haber basados en la ley de Hess La ley de Hess establece que la entalpa de una reaccin es la misma si la reaccin se lleva a cabo en un solo paso o si lo hace en varios. El ciclo de Born-Haber no es ms que un ciclo termodinmico til para visualizar las etapas formalmente involucradas en la formacin de un compuesto qumico.
Na(s)
(Na) !Hat
+ 1/2 Cl2(g)
!Hf(NaCl)
NaCl(s)
1/2 !Hdis (Cl2)
(NaCl) !HR
Na(g)
+ Cl(g)
(Cl) !H1AE (Na) !H1EI
Na+(g) +e
+ Cl(g)
e
o o o o o "H o f (NaCl) = "H at (Na) + "H1EI (Na) + 1/2 "H dis (Cl2) + "H1AE (Cl) "H R (NaCl)
Los ciclos de Born-Haber pueden ser muy tiles para estimar los calores de formacin de ! ! ! de la entalpa ! de red calculada y para determinar la compuestos inexistentes (NaCl2, ! CaCl), a partir razn de su inestabilidad.
24
Tema 10: slidos inicos
Carcter covalente parcial del enlace inico Cuando se comparan los valores de la entalpa de red estimados tericamente con los calculados mediante el ciclo de Born-Haber puede suceder: Que los valores sean concordantes, en cuyo caso el compuesto se comporta como un slido inico ideal. Que el valor calculado sea significativamente menor que el estimado tericamente; en este caso, el compuesto no se puede describir como estrictamente inico sino que posee un cierto carcter covalente. Esta situacin se abordar en detalle en el Tema 11.
tema 10
tema 10
tema 10
Вам также может понравиться
- Sep Resumen Sobre Cerámicas IónicasДокумент10 страницSep Resumen Sobre Cerámicas IónicasqamhОценок пока нет
- U1 Introducción A La CaracterizacionДокумент46 страницU1 Introducción A La CaracterizacionMaría GonzálezОценок пока нет
- Estructuras de Tipo AX, AmXnДокумент15 страницEstructuras de Tipo AX, AmXncristiangggОценок пока нет
- Estructura Molecular - InteraccionesДокумент7 страницEstructura Molecular - InteraccionesJHAROD ALEXIS CORTES FLORESОценок пока нет
- Introducción A Los Sólidos CristalinosДокумент33 страницыIntroducción A Los Sólidos CristalinosMaría GonzálezОценок пока нет
- Estructura Cristalina de Materiales IonicosДокумент8 страницEstructura Cristalina de Materiales IonicosBrillit Alarcon QuirozОценок пока нет
- Solidos Ionicos TutorialДокумент15 страницSolidos Ionicos TutorialSheila DSОценок пока нет
- Tema 6 Química IIДокумент10 страницTema 6 Química IISandra Sánchez GomezОценок пока нет
- Estructuras Cristalinas de Ceramicos SimplesДокумент7 страницEstructuras Cristalinas de Ceramicos SimplesRodrigoRodríguezEscareñoОценок пока нет
- Tema 5 Solidos Ionicos14Документ17 страницTema 5 Solidos Ionicos14DokamОценок пока нет
- Copia de Cristalografia y Fuerzas Intermoleculares - Docx - 1474504066250Документ10 страницCopia de Cristalografia y Fuerzas Intermoleculares - Docx - 1474504066250Valdr Nilsen StiglitzОценок пока нет
- Temas 1-2-3Документ6 страницTemas 1-2-3Steve RamírezОценок пока нет
- Apuntes Enlace Químico Tema 6Документ8 страницApuntes Enlace Químico Tema 6jhon vigilio pardoОценок пока нет
- 2013 Solidos Ionicos2Документ90 страниц2013 Solidos Ionicos2Joyce PadillaОценок пока нет
- 9 - CristaloquimicaДокумент5 страниц9 - CristaloquimicaPedro ParamoОценок пока нет
- Tipos de Estructuras CristalinasДокумент11 страницTipos de Estructuras CristalinasDaniel Andrés Vallejo AráuzОценок пока нет
- Cloruro de CesioДокумент5 страницCloruro de CesioDavid Donoso80% (5)
- Los Solidos IonicosДокумент6 страницLos Solidos IonicosAlexander Campos ZuloetaОценок пока нет
- Edafología Tema 4Документ16 страницEdafología Tema 4Davinia García MolinaОценок пока нет
- Estructuras CristalinasДокумент17 страницEstructuras CristalinasJuan Carlos Medina ArribasplataОценок пока нет
- Estructuras Cristalinas ComplejasДокумент31 страницаEstructuras Cristalinas ComplejasDamián Cando33% (3)
- Estructuras Cristalinas ComplejasДокумент10 страницEstructuras Cristalinas ComplejasEber ChoqueОценок пока нет
- Cristales Iónicos ExpДокумент18 страницCristales Iónicos ExpWilliam ValenciaОценок пока нет
- Sólidos IIIДокумент51 страницаSólidos IIIEdu Gomez PerezОценок пока нет
- Tema 4 Ciencias de Materiales UalДокумент10 страницTema 4 Ciencias de Materiales UalPaqui Lopez RamosОценок пока нет
- 2 Enlace Quimico. Parte 3Документ42 страницы2 Enlace Quimico. Parte 3ROCIO COAQUIRAОценок пока нет
- Reglas de PaulingДокумент4 страницыReglas de PaulingLuis Carlos BerlangaОценок пока нет
- Estructuras Cristalinas Simples PDFДокумент7 страницEstructuras Cristalinas Simples PDFOCTAVIO FERNANDO PICON MEDINAОценок пока нет
- Material Calculo AvanzadoДокумент142 страницыMaterial Calculo AvanzadontrsupreminuwuОценок пока нет
- 0sistema NerviosoДокумент27 страниц0sistema NerviosoalumnaОценок пока нет
- MAPACONCEPTUALEQUIPO5 Unidad 3Документ14 страницMAPACONCEPTUALEQUIPO5 Unidad 3Alexis CastilloОценок пока нет
- Ceramicos PDFДокумент41 страницаCeramicos PDFlucho caballeroОценок пока нет
- Simulación Con El Software de CrystalMakerДокумент6 страницSimulación Con El Software de CrystalMakerSarahit Bolaños VelardeОценок пока нет
- Exfq1 Enlace Quimico SolДокумент4 страницыExfq1 Enlace Quimico SolVeronica Simon OteroОценок пока нет
- EL ENLACE QUÍMICO - ResumenДокумент4 страницыEL ENLACE QUÍMICO - ResumenAlexiaОценок пока нет
- Actividad Clase Semana 2 CM RealizadoДокумент3 страницыActividad Clase Semana 2 CM RealizadoHector MUndarain100% (1)
- Cuestionario Grupal SMVMДокумент4 страницыCuestionario Grupal SMVMHarold FranzОценок пока нет
- Estruturas TipoДокумент12 страницEstruturas TipoJuan Alonso Quijano EsdrasОценок пока нет
- Tema 3 Ciencias de Materiales UalДокумент7 страницTema 3 Ciencias de Materiales UalPaqui Lopez RamosОценок пока нет
- 10.enlaceionico 11656Документ24 страницы10.enlaceionico 11656Yusvelis Tovar PeyoniОценок пока нет
- T1b Sólidos 2º 2015Документ21 страницаT1b Sólidos 2º 2015MonicaChRzОценок пока нет
- Tarea N°7Документ10 страницTarea N°7Daniel PaladinesОценок пока нет
- Tema10 Resumido Enlace QuimicoДокумент25 страницTema10 Resumido Enlace QuimicoAna RuscherОценок пока нет
- Enlace IónicoДокумент4 страницыEnlace Iónicomilton ramos seguelОценок пока нет
- Sitios IntersticialesДокумент7 страницSitios IntersticialesrОценок пока нет
- Clase 8 - MORFOLOGÍA DE LOS CRISTALESДокумент40 страницClase 8 - MORFOLOGÍA DE LOS CRISTALESEnrique Daniel ValderramaОценок пока нет
- Tema 4 - El Enlace QuímicoДокумент5 страницTema 4 - El Enlace QuímicomartaОценок пока нет
- Estructuras CristalinasДокумент7 страницEstructuras CristalinasAndrea PalenciaОценок пока нет
- La Zeolita, La Piedra Que HierveДокумент5 страницLa Zeolita, La Piedra Que HiervePedro CoronadOyarvideОценок пока нет
- Solidos CristalinosДокумент21 страницаSolidos Cristalinoshelbert-okОценок пока нет
- Quimica Del Estado SolidoДокумент27 страницQuimica Del Estado SolidoKitsuneMasterОценок пока нет
- 1.3.1.-Caracteristicas de Los Cristales Iónicos.Документ3 страницы1.3.1.-Caracteristicas de Los Cristales Iónicos.Gabriela Fernandez ChanОценок пока нет
- Enlace QuímicoДокумент11 страницEnlace Químicoceo_quercusОценок пока нет
- Enlace QuímicoДокумент11 страницEnlace QuímicoSara SanchezОценок пока нет
- UntitledДокумент33 страницыUntitledstefania sanmartinОценок пока нет
- Tareas de Ciencia e Ingeniería Los MaterialesДокумент30 страницTareas de Ciencia e Ingeniería Los MaterialesMarco GuardiolaОценок пока нет
- QGI 16-17 Tema 2BДокумент29 страницQGI 16-17 Tema 2BFernando López ExpósitoОценок пока нет
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaОт EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaРейтинг: 5 из 5 звезд5/5 (1)
- MaderaДокумент26 страницMaderaBrenda Janeth Carrizosa RamosОценок пока нет
- Procesamiento de Celulosa - PapelДокумент0 страницProcesamiento de Celulosa - PapelEstefania ArizagaОценок пока нет
- Fabricacion PapelДокумент15 страницFabricacion PapelcaportlandОценок пока нет
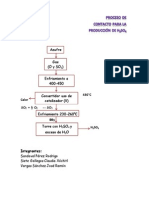
- Proceso de Contacto para La Producción de H2so4Документ1 страницаProceso de Contacto para La Producción de H2so4Enrico169Оценок пока нет
- Difraccion - Rayosx (Muy Bueno)Документ31 страницаDifraccion - Rayosx (Muy Bueno)Leo DanОценок пока нет
- Monocristales Fase Vapor PDFДокумент6 страницMonocristales Fase Vapor PDFEnrico169Оценок пока нет
- Cartilla 1.20 Ultima Actualizacion 2020Документ56 страницCartilla 1.20 Ultima Actualizacion 2020macarena muñozОценок пока нет
- Cuestionario 16-10 CorrectoДокумент7 страницCuestionario 16-10 CorrectoVictor Sotelo JimenezОценок пока нет
- Enlace Quimico - 1º BachillerДокумент8 страницEnlace Quimico - 1º BachillervitoОценок пока нет
- FINAL Tesis IRNR Ortiz Cazares Giovanni Diciembre 2013Документ54 страницыFINAL Tesis IRNR Ortiz Cazares Giovanni Diciembre 2013Giovanni OrtizОценок пока нет
- Chemlok 252X TDSДокумент4 страницыChemlok 252X TDSVicente VillaltaОценок пока нет
- Propiedades Físicas de Los MetalesДокумент4 страницыPropiedades Físicas de Los MetalesAngel CiberОценок пока нет
- Fundamentos de Manufactura ModernaДокумент12 страницFundamentos de Manufactura ModernaHernandez Hernandez JavierОценок пока нет
- Desgaste y Fallas MecánicasДокумент17 страницDesgaste y Fallas MecánicasLuisPa Flores100% (1)
- Biciencias 5 Bonaerense - CapmodeloДокумент23 страницыBiciencias 5 Bonaerense - CapmodeloBárbara SchmidtОценок пока нет
- Solidificación y EnfriamientoДокумент9 страницSolidificación y EnfriamientoAndy SanchezОценок пока нет
- Tesis OdontologiaДокумент121 страницаTesis OdontologiaArula666Оценок пока нет
- Zarate Monje Juan Soldeo Aleaciones Aluminio Materiales PDFДокумент96 страницZarate Monje Juan Soldeo Aleaciones Aluminio Materiales PDFAbraham Vizalla AucaОценок пока нет
- Análisis de Falla Por Carga EstáticaДокумент10 страницAnálisis de Falla Por Carga EstáticaROSMARY MALDONADO100% (1)
- Cuadernillo Introducción A La QuímicaДокумент81 страницаCuadernillo Introducción A La QuímicaAndrea Jenisel GGОценок пока нет
- Informe N9Документ10 страницInforme N9Daniela SuarezОценок пока нет
- Av Alloy 2013Документ40 страницAv Alloy 2013Anonymous lR81vpb6Оценок пока нет
- Cuarto Semestre Segunda ParteДокумент10 страницCuarto Semestre Segunda PartejudithruizcabreraОценок пока нет
- PIROMETALURGIAДокумент15 страницPIROMETALURGIAIvan Daza Prada50% (2)
- Presentacion Enlace QuimicoДокумент56 страницPresentacion Enlace QuimicoAlvaro MorenoОценок пока нет
- Viguetas PrefabricadasДокумент60 страницViguetas PrefabricadasJhap ChzОценок пока нет
- Difusion de Materiales No MetalicosДокумент4 страницыDifusion de Materiales No MetalicosJavier Betancourt Z.Оценок пока нет
- 5.6.9.10 TDR Aislador Polmero Susp-Retencin 69 y 138 KV ETED-CCC-LPN-2016-11Документ23 страницы5.6.9.10 TDR Aislador Polmero Susp-Retencin 69 y 138 KV ETED-CCC-LPN-2016-11andresfelipe910429Оценок пока нет
- Proceso de Soldadura SMAW y L.A.V.A.DДокумент5 страницProceso de Soldadura SMAW y L.A.V.A.DAntonio Jr Taylor DayleyОценок пока нет
- Purificación de Los MetalesДокумент45 страницPurificación de Los MetalesLuis Andrade33% (6)
- El Mantenimiento Oportuno de DuctosДокумент4 страницыEl Mantenimiento Oportuno de DuctosHoa Oscori AlmarazОценок пока нет
- Evidencia 2 Respel CorrecciónДокумент36 страницEvidencia 2 Respel CorrecciónTANIA LIZETH MORENO MARTINОценок пока нет
- Ciencia Con Enfasis en QuimicaДокумент1 страницаCiencia Con Enfasis en QuimicaDecoraciones EstradaОценок пока нет
- Malleus GL 3500Документ2 страницыMalleus GL 3500Roger ObregonОценок пока нет
- Tratado de Electrónica Automotriz-Volúmen 1-Electrónica Básica-Capítulo IДокумент59 страницTratado de Electrónica Automotriz-Volúmen 1-Electrónica Básica-Capítulo IJose GonzalezОценок пока нет
- Pnicógenos (Va)Документ10 страницPnicógenos (Va)Sonalo WYZОценок пока нет