Академический Документы
Профессиональный Документы
Культура Документы
Laboratorio #2 Fenoles
Загружено:
Ruben FonsecaОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Laboratorio #2 Fenoles
Загружено:
Ruben FonsecaАвторское право:
Доступные форматы
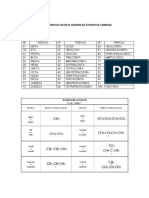
Universidad Pedaggica Nacional Facultad de Ciencia y Tecnologa Departamento de Qumica Sistemas Orgnicos II
Laboratorio N 2 Fenoles (Reconocimiento de propiedades fsicas y qumicas)
Los fenoles: son compuestos que presentan uno o ms grupos hidroxi (OH) unidos directamente a un anillo aromtico. El fenol es el miembro ms sencillo de esta serie homloga y es denominado tambin hidroxi-benceno. Los fenoles son sustancias acidas, cuya acidez se explica por contribuciones de estructuras de resonancia al ion fenoxido. Los fenoles presentan algunas propiedades semejantes a los alcoholes, debido a la presencia del grupo OH. Sin embargo conforman otra familia qumica y la mayora de sus propiedades y los mtodos para su obtencin son diferentes. Los fenoles ms sencillos son lquidos o slidos blandos e incoloros y se oxidan con facilidad por lo que se encuentran coloreados. En presencia de impurezas o bajo influencia de la luz, el aire y ciertos compuestos como el cobre y el hierro, el fenol puede teirse de amarillo, marrn o rojo.
OBJETIVOS
1. A partir de la discusin de los conceptos sobre acidez de los grupos hidroxilos unidos a un radical o a un anillo y diferenciando de esta forma, entre un alcohol y un fenol, el alumno estar en condiciones de identificar los grupos hidroxilos fenlicos en una muestra natural o en un producto preparado. 2. Mediante el anlisis de resultados, el estudiante podr deducir los orientaciones del grupo hidroxilo fenlico a las posiciones orto y para del anillo aromtico.
Rubn Fonseca --- Kevin Pinzn --- Yolanda Andrade
Universidad Pedaggica Nacional Facultad de Ciencia y Tecnologa Departamento de Qumica Sistemas Orgnicos II
Materiales 8 tubos de ensayo 1 tubo de ensayo desechable Pipeta graduada de 10 ml Agitador de vidrio Esptula Mechero Vidrio de reloj termmetro PROCEDIMIENTO Y RESULTADOS. Solubilidad.
Reactivos Fenol, hidroquinona Hidrxido de sodio 5% Bicarbonato de sodio 5% Cloruro frrico 1% Hexametilentetramina Benceno Eteno acetona
Para hacer el ensayo de solubilidad tomamos 1g de fenol y 3 ml de agua y calentamos, luego tomamos la temperatura mxima a la cual se presenta solubilidad total del fenol hasta el punto de que la temperatura mxima llega a ser 75 C y luego dejamos enfriar y cuando la temperatura de la solucin va llegando a los 60C empieza un enturbiamiento de solucin. Ya que el fenol es poco soluble en agua, aunque presentan el puente de hidrgeno, la proporcin de carbonos con respecto a la cantidad de OH es muy baja por ese calentamos para acelerar la cintica de la reaccin. Para que los compuestos que contienen grupos OH sean solubles en agua la razn entre carbonos y grupos OH no debe ser mayor de 3:1. El fenol es el miembro ms pequeo de este grupo y contiene 6 tomos de carbono y slo uno de OH. Los dems mono fenoles poseen mayor nmero de carbonos y slo un grupo OH, por ello son insolubles en agua. Los di fenoles y poli fenoles con ms de un grupo OH presentan mayor solubilidad en el agua.
Acidez. En la prueba de acidez de los fenoles, se tomaron dos tipos de fenoles (fenol e hidroquinona) tomamos cristalitos y los agregamos a hidrxido de sodio al 5% y bicarbonato de sodio al 5%.
Pudimos evidenciar la teora que indica que los fenoles pueden comportarse como cidos frente a indicadores, al tornasol y al indicador universal de pH, pero no descomponen el bicarbonato de sodio como si lo haran los verdaderos cidos
Rubn Fonseca --- Kevin Pinzn --- Yolanda Andrade
Universidad Pedaggica Nacional Facultad de Ciencia y Tecnologa Departamento de Qumica Sistemas Orgnicos II
Basicidad o acidez Para esta prueba tomamos cristales de los dos fenoles empleados y los disolvimos en 1 ml de agua y con ayuda de indicadores comprobamos que los fenoles si son sustancias acidas, echo que se evidencio cuando el indicados cambio de color virando a violeta.
Prueba con cloruro frrico. Para este procedimiento usamos una solucin amarilla naranja de cloruro frrico 1% luego se le agreg una solucin de fenol, en este caso se produce un cambio de color en la solucin donde hay un viraje de color verde al violeta, el pardo y el rojizo. Este color se debe a la complejidad de los productos y la oxidacin que se produce. Luego para realizar la identificacin usamos el ltex de pltano, donde tomamos la cascara y agregamos un poco de esta solucin obtenida.
Reaccin de Lieberman. En este proceso se hizo la prueba con cido nitroso. Los fenoles al ser tratados con cido nitroso producen una reaccin de nitracin, donde el grupo hidroxilo orienta el grupo nitro a posiciones para. La reaccin se hizo con cristales de nitrato de sodio y 3 ml de cido sulfrico concentrado, luego se agreg 0.5 g de fenol y se agito
luego de esto se agreg 10 gotas de esta mezcla en 20 ml de agua. Luego se hace un anlisis de eta sustancia, mezclndola con hidrxido de sodio (base), donde se evidencia que la mezcla se vuelve viscosa, se torna rojiza y libera calor (exotrmica). Y el segundo anlisis que se hace es con una mezcla de la solucin obtenida y bicarbonato de sodio donde la mezcla se torna azul oscura.
Formacin de resinas fenlicas. Para este proceso se utiliz un tubo de ensayo desechable, donde se agreg 1 g de fenol y 0.3 g de hexametilentetramina y se aadan unos trocitos de piedra
Rubn Fonseca --- Kevin Pinzn --- Yolanda Andrade
Universidad Pedaggica Nacional Facultad de Ciencia y Tecnologa Departamento de Qumica Sistemas Orgnicos II
pmez, agitamos y calentamos un poco hasta formar una mezcla viscosa. Luego tratamos de tomar una porcin de la resina y buscamos disolverla en benceno, en etanol y en acetona, donde pudimos evidenciar que la resina si es soluble en los tres casos.
Anlisis de resultados: En cuanto a la solubilidad de los fenoles en agua podemos decir que a un temperatura igual o mayor a los 66c el fenol es soluble en agua mientras que por debajo de esta temperatura aparecern dos fases, la solubilidad frente al etanol Forma dispersiones ms estables que con el agua Pero no hay reaccin Qumica al igual que la solucin con benceno y acetona. El fenol Qumicamente al comportarse como cido dbil produce por lo tanto iones hidrgeno al disociarse Con respecto a las reacciones, el fenol al ser un cido dbil, reacciona con facilidad con una base fuerte como la del sodio formando sales:
Al ser una base fuerte es capaz de desprotonar al fenol pero no surge reaccin con el bicarbonato de sodio ya que no es una base tan fuerte y no puede desprotonar al fenol. Como cidos dbiles y bases dbiles, los fenoles se disocian muy poco en solucin acuosa diluida donando un protn al agua.
Rubn Fonseca --- Kevin Pinzn --- Yolanda Andrade
Universidad Pedaggica Nacional Facultad de Ciencia y Tecnologa Departamento de Qumica Sistemas Orgnicos II
En la reaccin de Lieberman correspondi a una reaccin de sustitucin aromtica electrofilica, en donde el fenol reacciona con el nitrosonio (NO+), el cual se forma al mezclar nitrito de sodio con cido sulfrico:
La Nitrosacin donde el grupo activador del grupo hidroxilo es tan grande que el fenol reacciona con cido nitroso, con formacin de p-nitrosofenol, este compuesto es tautomero de la monoxima de quinona, si se efectua la reaccin en presencia de cido sulfrico concentrado, se produce ms condensacin con fenol y se forma una solucin de sulfato cido de indofenol, de color azul obscuro. al diluir la solucin cida con agua, se libera el Indofenol rojo (fenilindofenol).
Cuando se le agrego hidrxido sdico en exceso, se forma la sal sdica, de color azul intenso esto se debi a la resonancia de estructuras equivalentes y a sus altos momentos dipolares.
CUESTIONARIO. 1 reacciones Reaccin del fenol con hidrxido de sodio:
Rubn Fonseca --- Kevin Pinzn --- Yolanda Andrade
Universidad Pedaggica Nacional Facultad de Ciencia y Tecnologa Departamento de Qumica Sistemas Orgnicos II
Reaccin de Lieberman:
4-nitrosofenol
Rubn Fonseca --- Kevin Pinzn --- Yolanda Andrade
Universidad Pedaggica Nacional Facultad de Ciencia y Tecnologa Departamento de Qumica Sistemas Orgnicos II
CONCLUSIONES. 1. Se logr evidenciar algunas propiedades fsicas y qumicas de los compuestos fenlicos, como lo es la acides y algunos comportamiento fuera de lo natural, evidenciados en el casa de no poder descomponer el bicarbonato de sodio. 2. Otra de las observaciones claras q se evidenciaron durante el experimento es la comprobacin de la teora de las orientaciones del grupo hidroxilo hacia las sustituciones de otro compuestos.
Rubn Fonseca --- Kevin Pinzn --- Yolanda Andrade
Вам также может понравиться
- Calidad del agua para estudiantes de ciencias ambientalesОт EverandCalidad del agua para estudiantes de ciencias ambientalesОценок пока нет
- 1.-Introducción-Compuestos FenólicosДокумент4 страницы1.-Introducción-Compuestos Fenólicoscarolvazsan50% (2)
- Borrador Estudio Impacto AmbientalДокумент280 страницBorrador Estudio Impacto AmbientalHernan MendozaОценок пока нет
- Avance Programático Tercer GradoДокумент16 страницAvance Programático Tercer GradoadrelaОценок пока нет
- Especificaciones Tecnicas Conache - SaneamientoДокумент43 страницыEspecificaciones Tecnicas Conache - SaneamientoAnonymous E7zQQp100% (1)
- Notas Taxonomicas Ilustradas Acerca de Los Ordenes de Hexapoda VivientesДокумент65 страницNotas Taxonomicas Ilustradas Acerca de Los Ordenes de Hexapoda Vivienteschimolo VanegasОценок пока нет
- Cultivo de Lechuga PDFДокумент36 страницCultivo de Lechuga PDFAriana PuiconОценок пока нет
- 1.2 Estudios PreliminaresДокумент8 страниц1.2 Estudios PreliminaresCarlos JimenezОценок пока нет
- Informe 4 FenolesДокумент13 страницInforme 4 FenolesTatiana GuashpaОценок пока нет
- Quimica Informe 11Документ15 страницQuimica Informe 11Lara DanielОценок пока нет
- Informe Laboratorio Practica 7Документ7 страницInforme Laboratorio Practica 7Andres Felipe Forero SandovalОценок пока нет
- Practica N 5 Fenoles y DerivadosДокумент6 страницPractica N 5 Fenoles y DerivadosJorge CruzОценок пока нет
- FENOLДокумент6 страницFENOLFavio Cardoso Velasco100% (1)
- Lab 11 Reacciones Del FenolДокумент11 страницLab 11 Reacciones Del FenolMARIELY DEL ROSARIO GUERRERO TORRESОценок пока нет
- INFORME 3 - Pruebas Generales de AlcoholesДокумент4 страницыINFORME 3 - Pruebas Generales de AlcoholesALEXANDRA CABALLERO TURIZOОценок пока нет
- Experiencia 13Документ6 страницExperiencia 13Laura MarcelaОценок пока нет
- Ecuaciones Quimicas y Mecanismos de ReaccionДокумент5 страницEcuaciones Quimicas y Mecanismos de ReaccionIsaac Farfan CondorОценок пока нет
- Practica N 5 Alcoholes y FenolesДокумент5 страницPractica N 5 Alcoholes y FenolesSaul LopezОценок пока нет
- Propiedades Químicas de Alcoholes y FenolesДокумент8 страницPropiedades Químicas de Alcoholes y Fenolesalejo ossaОценок пока нет
- Síntesis de IndicadoresДокумент10 страницSíntesis de IndicadoresjumabatiОценок пока нет
- Propiedades Quimicas de Alcoholes y FenolesДокумент9 страницPropiedades Quimicas de Alcoholes y FenolesMaritza Grisales SilvaОценок пока нет
- Alcoholes y FenolesДокумент6 страницAlcoholes y FenolesYJPT 111005Оценок пока нет
- Alcoholes y AldehidosДокумент13 страницAlcoholes y AldehidosMaria Del Cielo Ym�n ChambiОценок пока нет
- Practica 4Документ3 страницыPractica 4sonia gonzalezОценок пока нет
- Reconocimiento de Aldehidos y CetonasДокумент9 страницReconocimiento de Aldehidos y CetonaslicheОценок пока нет
- Informe 6. Grupos FuncionalesДокумент7 страницInforme 6. Grupos FuncionalesAnousha BarriosОценок пока нет
- Informe Alcoholes y FenolesДокумент12 страницInforme Alcoholes y FenolesvaleriaОценок пока нет
- Alcoholes y FenolesДокумент16 страницAlcoholes y FenolesMarialejandra Inga CanalesОценок пока нет
- Practica # 5 Caracterización de Compuestos AromáticosДокумент4 страницыPractica # 5 Caracterización de Compuestos Aromáticosdiana paola camelo escobarОценок пока нет
- Informe 7 Propiedades Fisicas y Quimicas de Alcoholes. Fenoles y Esteres20190715-121882-Svcwoi-with-cover-page-V2Документ5 страницInforme 7 Propiedades Fisicas y Quimicas de Alcoholes. Fenoles y Esteres20190715-121882-Svcwoi-with-cover-page-V2Gloria FajardoОценок пока нет
- Informe N°6Документ11 страницInforme N°6Antonio TelloОценок пока нет
- Informe 1 - Alcoholes y Fenoles PDFДокумент27 страницInforme 1 - Alcoholes y Fenoles PDFRenzo Trujillo0% (2)
- Informe de Alcoholes y FenolesДокумент8 страницInforme de Alcoholes y FenolesDanielRosas0% (1)
- Propiedades Químicas de Alcoholes y Fenoles"Документ11 страницPropiedades Químicas de Alcoholes y Fenoles"christinna gissell Del Aguila MauriОценок пока нет
- Sintesis de La Fenoftaleina y FluoresceinaДокумент4 страницыSintesis de La Fenoftaleina y FluoresceinaDavid Valencia Carreño100% (1)
- Prueba de Caracterización de HidrocarburosДокумент11 страницPrueba de Caracterización de HidrocarburosRamirez KvnОценок пока нет
- Propiedades de Los FenolesДокумент5 страницPropiedades de Los FenolesTanato Tartaro50% (2)
- Informe Practica 2 de Quimica OrganicaДокумент17 страницInforme Practica 2 de Quimica OrganicawalterОценок пока нет
- Alcoholes y FenolesДокумент10 страницAlcoholes y FenolesCAROLОценок пока нет
- QOFI-practica14 Fenoles y TiolesДокумент12 страницQOFI-practica14 Fenoles y TiolesRicardo QuirogaОценок пока нет
- Obtención de Fenol Desde CumenoДокумент5 страницObtención de Fenol Desde CumenoJael TorrezОценок пока нет
- QO2-R5-Acido PicricoДокумент4 страницыQO2-R5-Acido PicricoAldair HernandezОценок пока нет
- Lab #1 Quím. - 2TДокумент6 страницLab #1 Quím. - 2TIVETH ZHANG WUОценок пока нет
- Nitración Del Fenol y Separación Del Orto y Para-NitrofenolДокумент3 страницыNitración Del Fenol y Separación Del Orto y Para-Nitrofenol70817086% (7)
- Copia de PRACTICO DE ALCOHOLES, FENOLES, ALDEHIDOSДокумент13 страницCopia de PRACTICO DE ALCOHOLES, FENOLES, ALDEHIDOSRomina Mosqueira TuctoОценок пока нет
- Informe 1 Reacciones de Alcoholes y FenolesДокумент7 страницInforme 1 Reacciones de Alcoholes y Fenolesalexis florezОценок пока нет
- Lab. Q.orgánica II I.QДокумент17 страницLab. Q.orgánica II I.QDanielОценок пока нет
- Guia de Alcoholes y FenolesДокумент3 страницыGuia de Alcoholes y FenolesPaulo Alejandro Araos Brito100% (1)
- Alcoholes FenolesДокумент8 страницAlcoholes FenolesSantiago LópezОценок пока нет
- Informe 7 Alcoholes y FenolesДокумент11 страницInforme 7 Alcoholes y FenolesMayra Esther Barreto SotoОценок пока нет
- Reacciones de Alcoholes, Aldehidos y CetonasДокумент10 страницReacciones de Alcoholes, Aldehidos y CetonasDavid Mauricio Ojeda ZapataОценок пока нет
- Los ÓxidosДокумент7 страницLos ÓxidosLucía CornejoОценок пока нет
- Compuestos HidroxÍlicos y CarbonÍlico (Lab Oratorio)Документ13 страницCompuestos HidroxÍlicos y CarbonÍlico (Lab Oratorio)api-3802973100% (6)
- Practica 4Документ5 страницPractica 4Luisa OrtizОценок пока нет
- FenolesДокумент14 страницFenolesDARWIN ALEJANDRO VASQUEZ MOLLEAPAZAОценок пока нет
- Lab Oratorio 7Документ9 страницLab Oratorio 7panamapuroОценок пока нет
- Informe de Alcoholes y FenolesДокумент8 страницInforme de Alcoholes y FenolesJerry Isaac Guerra HilarioОценок пока нет
- Informe #9 Laboratorio de Química - MROДокумент8 страницInforme #9 Laboratorio de Química - MROMario Medina ÀlvarezОценок пока нет
- Informe5 Aldehidos y CetonasДокумент12 страницInforme5 Aldehidos y CetonasWilberth Vedia VeraОценок пока нет
- FENOLДокумент8 страницFENOLGariTo Gomez0% (1)
- Lab. Quimica Organica I Informe 7. Carac PDFДокумент4 страницыLab. Quimica Organica I Informe 7. Carac PDFValentina Rodriguez SuarezОценок пока нет
- Pruebas de Caracterización de Derivados HalogenadosДокумент4 страницыPruebas de Caracterización de Derivados HalogenadosalissonОценок пока нет
- Pruebas Generales de Alcoholes, Fenoles y Éteres.Документ5 страницPruebas Generales de Alcoholes, Fenoles y Éteres.Emmanuel ArizaОценок пока нет
- NICK Acidos CarboxilicosДокумент8 страницNICK Acidos CarboxilicosNico Ariel JaramilloОценок пока нет
- Preguntas Decimso (Recuperado Automáticamente)Документ1 страницаPreguntas Decimso (Recuperado Automáticamente)Ruben FonsecaОценок пока нет
- Taller de Nivelación - Química °11Документ3 страницыTaller de Nivelación - Química °11Ruben FonsecaОценок пока нет
- Parametros Del Informe de LaboratorioДокумент5 страницParametros Del Informe de LaboratorioRuben FonsecaОценок пока нет
- Taller de Nivelación - Química °10Документ4 страницыTaller de Nivelación - Química °10Ruben Fonseca100% (1)
- Taller de Factores Que Afectan El EquilibrioДокумент1 страницаTaller de Factores Que Afectan El EquilibrioRuben FonsecaОценок пока нет
- Taller de Nivelación - Bioquímica °10Документ3 страницыTaller de Nivelación - Bioquímica °10Ruben FonsecaОценок пока нет
- Taller Desarrollo Competencias Quimica I PDFДокумент32 страницыTaller Desarrollo Competencias Quimica I PDFYonathan Alberto Charris TorresОценок пока нет
- Evaluaciones de NivelacionДокумент2 страницыEvaluaciones de NivelacionRuben FonsecaОценок пока нет
- Parametros Del Informe de LaboratorioДокумент5 страницParametros Del Informe de LaboratorioRuben FonsecaОценок пока нет
- Ensayo Consumo HumanoДокумент5 страницEnsayo Consumo HumanoRuben FonsecaОценок пока нет
- Evaluaciones de NivelacionДокумент2 страницыEvaluaciones de NivelacionRuben FonsecaОценок пока нет
- 02 - Ecuación de Cantidad de Movimiento IДокумент29 страниц02 - Ecuación de Cantidad de Movimiento IRuben FonsecaОценок пока нет
- HeuristicosДокумент3 страницыHeuristicosRuben FonsecaОценок пока нет
- Sintesis Documental Colombia ViveДокумент7 страницSintesis Documental Colombia ViveRuben FonsecaОценок пока нет
- Corre GidoДокумент9 страницCorre GidoRuben FonsecaОценок пока нет
- LABORATORIOДокумент3 страницыLABORATORIORuben FonsecaОценок пока нет
- PFD NylonДокумент2 страницыPFD NylonRuben FonsecaОценок пока нет
- Ean Bioquimica Ácidos Nucleicos, Enzimas y Vitaminas PDFДокумент69 страницEan Bioquimica Ácidos Nucleicos, Enzimas y Vitaminas PDFRuben FonsecaОценок пока нет
- Ean Bioquimica Fermentacion Octubre 2016 PDFДокумент37 страницEan Bioquimica Fermentacion Octubre 2016 PDFRuben FonsecaОценок пока нет
- Tabla de Prefijos Según El Numero de Atomos de CarbonoДокумент1 страницаTabla de Prefijos Según El Numero de Atomos de CarbonoRuben FonsecaОценок пока нет
- Ejerciciosdebalanceo 110220233026 Phpapp01 (Autoguardado)Документ4 страницыEjerciciosdebalanceo 110220233026 Phpapp01 (Autoguardado)Ruben FonsecaОценок пока нет
- Determine La Composición Porcentual de Cada Uno de Los Elementos en Los Siguientes CompuestosДокумент2 страницыDetermine La Composición Porcentual de Cada Uno de Los Elementos en Los Siguientes CompuestosRuben Fonseca100% (1)
- 6to Laboratorio Quimica Organica. PractiДокумент21 страница6to Laboratorio Quimica Organica. PractiIsaiasОценок пока нет
- Informe 4 - Ley de CharlesДокумент6 страницInforme 4 - Ley de CharlesOe Kryv50% (2)
- Proyecto AmbientalДокумент3 страницыProyecto AmbientalRuben FonsecaОценок пока нет
- Quimica Decimo Primer TallerДокумент1 страницаQuimica Decimo Primer TallerRuben FonsecaОценок пока нет
- Características Culturales de Estados UnidosДокумент2 страницыCaracterísticas Culturales de Estados UnidosRuben FonsecaОценок пока нет
- Organ Iz AdoresДокумент9 страницOrgan Iz AdoresRuben FonsecaОценок пока нет
- Gimnasio Los SaucesДокумент4 страницыGimnasio Los SaucesRuben FonsecaОценок пока нет
- Evaluación DisolucionesДокумент2 страницыEvaluación DisolucionesRuben Fonseca50% (2)
- Evolución en Plantas 2011 PDFДокумент20 страницEvolución en Plantas 2011 PDFLuisa PerdomoОценок пока нет
- Diagnostico de La Pesca Artesanal y Diversidad de Peces en El Río ApurimacДокумент9 страницDiagnostico de La Pesca Artesanal y Diversidad de Peces en El Río ApurimacAbraham GomezОценок пока нет
- Silabo-Curso Tratamiento de Aguas Residuales DomésticasДокумент5 страницSilabo-Curso Tratamiento de Aguas Residuales DomésticasAlexis AntúnezОценок пока нет
- NTE ISS SaneamientoДокумент47 страницNTE ISS SaneamientoMiguel Ángel de los RíosОценок пока нет
- Practica de Diseccion de Un OrganismoДокумент10 страницPractica de Diseccion de Un Organismofeliperey27Оценок пока нет
- EPR-Guías 1 Al 13 2017-I Química-I Ing. Industrial OkДокумент17 страницEPR-Guías 1 Al 13 2017-I Química-I Ing. Industrial OkReynaldo CarreñoОценок пока нет
- Desastres NaturalesДокумент47 страницDesastres NaturalesAnonymous tcrSgu2xcОценок пока нет
- Envasado de Carnes y Productos CarnicosДокумент59 страницEnvasado de Carnes y Productos CarnicosAlexis Monzon LlempenОценок пока нет
- Tefal Vitacuisine - VaporДокумент12 страницTefal Vitacuisine - VaporxavihostaОценок пока нет
- 8.1 Filtros Percoladores y BiodiscosДокумент34 страницы8.1 Filtros Percoladores y BiodiscosEdinson Fabian Prada JaimesОценок пока нет
- Palafoxia Texana DCДокумент77 страницPalafoxia Texana DCShizue OnoderaОценок пока нет
- Formato de Manejo Ambiental y Seguridad en ObraДокумент8 страницFormato de Manejo Ambiental y Seguridad en ObraPercy Alarcon HurtadoОценок пока нет
- Satipo FisiografiaДокумент30 страницSatipo FisiografiaGrupoComunidadesОценок пока нет
- Valorizacion Nº04 Ad.03Документ6 страницValorizacion Nº04 Ad.03Andre Leonardo Ventura AlvaОценок пока нет
- Microorganismos Degradadores de ColorantesДокумент62 страницыMicroorganismos Degradadores de Colorantescarlos rossell taypeОценок пока нет
- Casa de Maquinas HidroelectricaДокумент6 страницCasa de Maquinas HidroelectricaJohn AlcalaОценок пока нет
- Anexo No. 8 - Requisitos Minimos en ExcavacionesДокумент9 страницAnexo No. 8 - Requisitos Minimos en ExcavacionesViviana Espinosa UribeОценок пока нет
- Revision en Informe Final de PasantiaДокумент95 страницRevision en Informe Final de PasantiaJuan Camilo Sendoya VОценок пока нет
- Trabajo Nro 01Документ60 страницTrabajo Nro 01Brayan Anthony CYОценок пока нет
- Ciclo Agua WordДокумент2 страницыCiclo Agua WordKenethОценок пока нет
- Grupo 3 - Golpe de ArieteДокумент42 страницыGrupo 3 - Golpe de Arietepoma puente rafaelОценок пока нет
- Tratamiento Biologico de Aguas Residuales, Industriales y PeligrososДокумент12 страницTratamiento Biologico de Aguas Residuales, Industriales y PeligrososGonzalez Manuel G0% (1)
- PRACTICA No 5 PolimerizacionДокумент5 страницPRACTICA No 5 PolimerizacionMati PrezzoОценок пока нет
- Lab 3Документ5 страницLab 3EdsonОценок пока нет