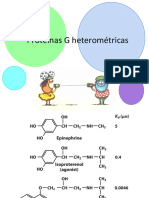
Академический Документы
Профессиональный Документы
Культура Документы
AMPLIAR EL ESPECTRO DE LAS ENFERMEDADES Proteína G
Загружено:
Franco RomeroИсходное описание:
Оригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
AMPLIAR EL ESPECTRO DE LAS ENFERMEDADES Proteína G
Загружено:
Franco RomeroАвторское право:
Доступные форматы
AMPLIAR EL ESPECTRO DE LAS ENFERMEDADES protena G
Mutaciones causantes de la enfermedad a menudo revelan las principales vas de la regulacin fisiolgica y sus mecanismos moleculares subyacentes. Las mutaciones en los nucletidos de guanina trimricas de unin a protenas (protenas G), que transmiten seales iniciadas por fotones, odorantes, y una serie de hormonas y neurotransmisores, causa muchas enfermedades. En su mayor parte, las enfermedades se limitan a un conjunto de fascinantes trastornos endocrinos bu raras (Tabla 1). Un estudio reciente sugiere que las mutaciones en las protenas G tambin puede conducir a la hipertensin esencial. Si este estudio es correcto, la hipertensin puede ser uno de varios trastornos comunes causadas por defectos en esta familia de molculas de sealizacin ubicua. Esta revisin se centra principalmente en los recientes descubrimientos que nos ayudan a comprender la patogenia y fisiopatologa de las enfermedades causadas por mutaciones g de protena. Tambin se discuten los mecanismos moleculares de la protena G de sealizacin, un tema que ha sido recientemente revisado en detalle en otra parte. Las mutaciones que alteran la activacin de la protena G puede causar trastornos caracterizados por una transmisin insuficiente o excesiva de seales (Tabla 1). Disminucin de la transmisin de seales - prdida de la funcin - el resultado de mutaciones que alteran la capacidad de la protena G que se activan por receptores de hormonas. Aumento de la transmisin de seales - ganancia de funcin - el resultado de mutaciones que imitan o aumentar la activacin de los receptores. ESTRUCTURA Y FUNCIN DE LAS PROTENAS G Protenas G retransmiten seales de cada uno de ms de 1000 receptores a muchos diferentes efectores intracelulares, incluyendo enzimas y canales inicos. La protena G est compuesta de una subunidad de una que se une dbilmente a un dmero estrechamente asociado formado por una subunidad y una subunidad ; cada una de las tres subunidades es
codificada por un gen separado, selecte de 16, 6, y genes 12 , respectivamente. Varios G protenas definen trmeros diferentes protenas G (Gs, Gq, Gi, Gt, etc), cada uno de los cuales regula un conjunto distintivo de las vas de sealizacin corriente abajo. La actividad de una protena G trimrica es regulada por la unin y la hidrlisis del trifosfato de guanosina (GTP) por la subunidad G . Una subunidad al que est enlazado difosfato de guanosina (GDP) es inactivo y se asocia con el dmero . Activacin de un receptor por un ligando provoca la complejo para liberar PIB. Esta liberacin es seguido por la unin de GTP a la subunidad , despus de lo cual los -GTP subunidad complejo se disocia de y desde el receptor. Este complejo o el dmero libre despus activa los efectores. La conversin de GTP a GDP unido termina la seal, porque PIB -subunidad complejos carecen de la capacidad para regular efectores e inactivar mediante la unin a ella. Defectos de protenas G pueden causar enfermedades en varias maneras. La produccin de una protena G que no se puede hidrolizar GTP y terminar los resultados de seales en la actividad persistentemente elevado del efector aguas abajo, incluso en ausencia de estmulos extracelulares. Disminucin de la produccin normal de una protena G o la produccin de una protena G inestable puede reducir la respuesta normal a la estimulacin hormonal. Anormalidades que afectan a la capacidad de una protena G para cambiar a la estado "encendido" puede resultar en un aumento o una disminucin en la seal descendente. Se produce un aumento en la protena defectuosa versiones PIB y el GTP se une ms rpidamente de lo normal, y se produce una disminucin en la protena libera PIB ms lento o se une GTP menos vidamente. DEFECTOS EN LA TERMINACIN DE LA PROTENA G SEALIZACIN Para apagar la seal, una protena G debe escindir el fosfato a partir de GTP en una reaccin que requiere la asociacin de los tomos de fsforo con el oxgeno de una molcula de agua. Para catalizar esta reaccin, los tomos
implicados deben estar dispuestos con precisin adyacente a vecinos aminocidos de G . Cuando la capacidad de estos aminocidos para estabilizar la disposicin exacta de los tomos se deteriora, la hidrlisis de GTP se hace ms lenta y la terminacin de la seal se retarda, causando trastornos caracterizados por una excesiva y persistente seales generadas por la protena G anormal. clera La diarrea acuosa causada por Vibrio cholerae resultados de la secrecin de sal y agua en el intestino, la secrecin estimulada por un aumento de las concentraciones de AMP cclico (AMPc) en clulas de la mucosa. Exotoxina de la bacteria patgena, una enzima, se conecta el difosfato de adenosina (ADP)-ribosa fraccin intracelular de dinucletido de nicotinamida adenina a la cadena lateral de un residuo de arginina tecla (en la posicin 201) en Gs , el regulador estimulante de la adenilato ciclasa. Al igual que un dedo se estabiliza una delicada pieza de la maquinaria, la cadena lateral de la arginina acelera la hidrlisis GTP mediante la celebracin de un tomo de oxgeno del fosfato exactamente en el lugar correcto. La unin de ADP-ribosa a la cadena lateral marcadamente ralentiza la hidrlisis de GTP y Gs bloquea en su forma activa unida a GTP forma. Toxinas similares son responsables de la diarrea del viajero causada por cepas de Escherichia coli certai. acromegalia Los primeros mutantes oncognicos G fueron encontrados en los genes Gs de tumores de pituitaria de pacientes con acromegalia. El mutante Gs oncogn , denominado gsp (para la protena G estimuladora), se encuentra en el 40 por ciento de los tumores somatotrpicas en tales pacientes. Las protenas codificadas por gsp tiene los mismos defectos de terminacin de seal que se producen en el clera - la incapacidad de hidrolizar GTP y la estimulacin persistente de la adenilato ciclasa. La protena codificada por gsp es oncognico, porque imita la seal intracelular provocada por el
crecimiento de la hormona liberadora de la hormona, que normalmente estimula un receptor que activa la sntesis de AMPc y G; como la liberacin de la hormona, gsp estimula la secrecin de la hormona de crecimiento y aumenta la proliferacin de somatotrofos. Como con la mayora de los oncogenes, gsp resultado de mutaciones somticas que se producen en el tejido afectado y, de hecho, una mutacin de la lnea germinal gsp es casi seguro que sea letal. La mayora de las mutaciones en gsp sustitutos otros aminocidos para el residuo de arginina que es un objetivo de la toxina del clera en clulas intestinales; unas pocas mutaciones reemplazan una glutamina cercano. Tanto la arginina y glutamina "dedos" mantener una rpida hidrlisis de GTP mediante la estabilizacin de la fosfato de GTP. Otras mutaciones activantes en G Las mutaciones en gsp se pueden encontrar en cualquier tumor derivadas de una clula en la que el cAMP estimula la proliferacin celular. El sndrome de McCune-Albright es un claro ejemplo de los efectos de estas mutaciones Este sndrome se caracteriza por displasia fibrosa poliosttica, regiones dispersas de hiperpigmentacin (caf au lait) de la piel, y la hiperfuncin autnoma de una o ms glndulas endocrinas y da lugar a la gonadotropina pubertad precoz independiente, hipertiroidismo, sndrome de Cushing, acromegalia o. Los tejidos afectados de los pacientes con este sndrome presentan mutaciones gsp que codifican sustituciones para el dedo de arginina que tambin est mutado en tumores hipofisarios. Todas las manifestaciones de esta congnita (pero no heredable) sndrome de reflejar una mutacin gsp que ocurri temprano en el desarrollo del embrin, en el ADN de una clula cuya progenie contribuir a la distribucin en mosaico de clulas afectadas ms tarde en la vida. CAMP intracelular, como un campamento de elevacin del hormonas, normalmente estimula la proliferacin de las clulas en las glndulas (tiroides, corteza suprarrenal, los ovarios y la pituitaria) que dan lugar a hiperfuncionante tumores en pacientes con el sndrome de McCune-Albright.
La hiperpigmentacin cutnea no resulta de la excesiva proliferacin de clulas, pero a partir de la imitacin del efecto normal de la hormona estimulante de melanocitos en los receptores que utilizan Gs para aumentar cAMP sntesis en los melanocitos. La patognesis de las lesiones seas no est claro. Gs activado por mutaciones puede ejercer su efecto patognico sobre los osteoclastos o fibroblastos, imitando los efectos normales de regulacin de la hormona paratiroidea, calcitonina, u otras hormonas. Los pacientes con el sndrome de McCune-Albright tambin tienen una mayor incidencia de arritmias y la muerte sbita en la infancia, tal vez los niveles elevados de actividad Gs en los miocitos cardacos y fibras conductoras producen los mismos efectos arritmognicos como amina adrenrgica Unos pocos funcionamiento autnomo adenomas tiroideos puerto mutaciones y mutaciones gsp gsp-como en el gen que codifica la subunidad a de Gi se han encontrado en un par adenomas de la corteza suprarrenal y los tumores endocrinos del ovario. Otros G subunidades activados por mutaciones pueden provocar la transformacin neoplsica de las clulas cultivadas, pero no han sido encontrados en los tumores en los seres humanos. El estudio de ratones transgnicos que sobreexpresan normales o activado por mutacin G subunidades en tejidos especficos puede resultar til en la prediccin de G enfermedades en los seres humanos. Por ejemplo, la sobreexpresin de Gq en los resultados cardacos en hipertrofia cardiaca grave e insuficiencia cardiaca posterior congestiv Reguladores de la hidrlisis de GTP Las enfermedades son probablemente el resultado de mutaciones en los genes que codifican los RGS recientemente descubiertos (regulador de la sealizacin de la protena G) protenas. Los miembros de esta gran familia de protenas (codificadas por 16 genes o MOR) acelerar la hidrlisis de GTP por Gi, Gt, Gq y G, terminando as seales en milisegundos en lugar de segundos. Protenas RGS se unen a G y estabilizar los dedos de arginina y glutamina en el sitio activo de la GTPasa.
Las protenas G regulados por protenas RGS mediar rpidas respuestas fisiolgicas, incluyendo vagal desaceleracin de la frecuencia cardaca (Gi), la deteccin de la retina de los fotones (Gt), y la contraccin del msculo liso vascular (GQ). Las protenas RGS probablemente desempean un papel clave en la terminacin de las seales intracelulares que median en cada una de estas respuestas. Por lo tanto, las mutaciones que afectan a genes que codifican las protenas RGS puede estar implicado en enfermedades asociadas con ganancia de funcin, que afectan a la visin, la regulacin cardiovascular, y otras funciones. Inactivacin gentica de subunidades de protenas G Seudohipoparatiroidismo Tipo I Seudohipoparatiroidismo tipo I es causada por la prdida gentica de Gs , la subunidad de Gs. Las caractersticas clnicas parecen a los de hipoparatiroidismo pero son causadas por resistencia heredada de los tejidos diana a la hormona paratiroidea en lugar de por la falta de la hormona. La inactivacin de un alelo del gen de la Gs causa la forma mejor entendido de esta enfermedad, Ia seudohipoparatiroidismo tipo. Se caracteriza por la resistencia a los efectos de la hormona paratiroidea y hormonas a veces tirotropina y otras que utilizan Gs y la adenilato ciclasa para generar AMPc como segundo mensajero en las clulas. Los pacientes afectados tienen un distintivo habitus - corta estatura, cabeza redonda, y los dedos cortos y dedos de los pies (braquidactilia) - llamada osteodistrofia hereditaria de Albright. La actividad de Gs eritrocitos se reduce en un 50 por ciento en pacientes con Ia seudohipoparatiroidismo tipo. Todos los pacientes son heterocigotos, con un alelo normal de Gs ; los alelos mutantes conducir a la produccin de Gs o inactivo a pequeas cantidades de activo Gs . El patrn de herencia dominante de Ia pseudohipoparatiroidismo tipo y la gravedad variable y la diversidad de sus manifestaciones clnicas son desconcertantes. La herencia dominante se ha atribuido a la llamada haploinsuficiencia del gen Gs , lo que significa que la protena producida por un solo alelo normal de Gs no puede apoyar la funcin normal, aunque
puede ser suficiente para la supervivencia. (Otros genes haploinsufficient son los que codifican el receptor de las lipoprotenas de baja densidad y el receptor sensor de calcio) Con la excepcin de las respuestas a la hormona paratiroidea y la tirotropina, la mayora de las respuestas a las hormonas que dependen de la sntesis de AMPc (respuestas, por ejemplo, a la corticotropina, glucagn, o aminas adrenrgicas) son afectados clnicamente en I. seudohipoparatiroidismo tipo para las respuestas de las hormonas ltimos, 50 por ciento de la dotacin normal de Gs basta . La inferencia de que la haploinsuficiencia de Gs es especfica de tejido explica la resistencia selectiva a las hormonas y el habitus caracterstica de los pacientes con AI seudohipoparatiroidismo tipo. Especfico de tejido haploinsuficiencia puede explicar slo una parte de la variabilidad, sin embargo. En una misma familia, algunos pacientes con un gen defectuoso Gs tienen una resistencia a la hormona paratiroidea, mientras que otros comparten con ellos el hbito de la osteodistrofia hereditaria de Albright, pero no son resistentes a la paratiroides hormona, este ltimo se dice que tienen seudoseudohipoparatiroidismo. Un anlisis de las genealogas de las familias que incluy a pacientes con cualquiera de los dos o pseudohipoparatiroidismo seudoseudohipoparatiroidismo revel que el 60 hijos que haban heredado el gen defectuoso de la madre tuvo Ia pseudohipoparatiroidismo tipo, mientras que el 6 hijos que haban heredado el gen del padre tuvo seudoseudohipoparatiroidismo. Este golpeteo sorprendente sugiere que el gen paterno Gs se no se expresa normalmente, debido a la impronta genmica, es decir, la modificacin de secuencias de ADN heredado del padre en el huevo fertilizado selectivamente impide la expresin de Gs codificada por el gen paterno en la progenie. Por lo tanto, los pacientes que heredan el gen defectuoso del padre tienen seudoseudohipoparatiroidismo porque el gen mutante no se expresa y dado que el producto de una sola herencia materna es suficiente Gs genes para las respuestas normales a la hormona paratiroidea y la tirotropina. Este patrn de impresin que ha encontrado en ratones knockout heterocigotos transgnicos que llevaban una normal y un gen
defectuoso Gs . slo los ratones que haban heredado el gen defectuoso de la madre eran resistentes a la hormona paratiroidea. La ocurrencia de la osteodistrofia hereditaria de Albright en pacientes con seudoseudohipoparatiroidismo, sin embargo, indica que uno Gs gen no es suficiente en todos los tejidos. Esta paradoja se puede explicar slo si imprinting altera la expresin de genes de un modo especfico de clula en la progenie, como se ha descrito para varios otros genes. As, los diferentes fenotipos probablemente el resultado de combinaciones de tissuespecific haploinsuficiencia y la impronta paterna (expresin exclusiva de la herencia materna del gen Gs ). Los defectos funcionales que slo se encuentran en pacientes con seudohipoparatiroidismo tipo Ia dependen de la actividad GS en clulas en las que el gen GS est sujeto a impronta paterna pero haplosufficient (un alelo normalmente es suficiente, por ejemplo, en respuesta hormona paratiroides-clulas del rin). El fenotipo de los resultados de osteodistrofia hereditaria de Albright de una funcin deficiente de sealizacin en las clulas en las que el gen GS es haploinsufficient pero no impresa (ambos alelos se expresan normalmente). Por ltimo, el AMPc dependiente de las funciones que no se ven afectados, ya sea de tipo Ia pseudohipoparatiroidismo o seudoseudohipoparatiroidismo se llevan a cabo por las clulas en las que el gen Gs es haplosufficient y no impreso. Otros posibles mutaciones en las protenas G Los pacientes con Ib seudohipoparatiroidismo tipo tiene hipocalcemia e hiperfosfatemia, como resultado de la resistencia a las acciones renales de la hormona paratiroidea que carecen de los habitus de los pacientes con osteodistrofia hereditaria de Albright, sin embargo, y no tienen la resistencia a la tirotropina u otras hormonas de la hormona paratiroidea. Este trastorno se hereda como un rasgo autosmico dominante, pero las mutaciones no se han encontrado en la Gs o genes paratiroides hormona-receptor, el gen mutante no ha sido identificado. Un estudio reciente que el mapeo de genes involucrados plante la posibilidad de provocacin que el defecto en pacientes con altera pseudohipoparatiroidismo tipo Ib expresin especfica
de tejido de GSA. En cuatro linajes, el gen desconocido fue impreso paternalmente, como Gs y se asigna a una pequea regin del cromosoma 20q13.3, muy cerca de (pero posiblemente separado de) el gen Gs s mismo. La interpretacin ms simple de estos resultados es que los pacientes ingenio Ib seudohipoparatiroidismo tipo heredar un promotor o potenciador mutante que ha perdido la capacidad para apoyar la expresin de Gs en el rin, pero no en otros tejidos. Los pacientes afectados de una familia con ceguera congnita hereditaria dominante noche se inform que llevan una mutacin puntual en el gen de la Gt, que media la clula de vstago respuestas a los fotones, el mecanismo bioqumico es unknown.46 De lo contrario, Gs es el nico G sabe que genticamente inactivado en una enfermedad humana. Esto se puede explicar por los fenotipos de ratones transgnicos que carecen de genes especficos G , llamado G ratones knockout. De acuerdo con la enfermedad en humanos, knockout del gen da Gs en la resistencia a la hormona paratiroidea y la evidencia de la impronta paterna del gen. En contraste, los octavos de final de otros genes G Gi, Go, Gq o G 13 Resultados en abnormalitie slo en los animales knockout homocigotos con heterocigotos, son normales. Esta discrepancia sorprendente probablemente refleja el hecho de que Gs es el nico miembro de la subfamilia expresado en la mayora de las clulas, la mayora de las clulas por lo general expresan varios miembros diferentes de cada una de las otras subfamilias. Esta redundancia funcional es poco probable que sea completa en todos los tejidos, por lo tanto, inactivacin de mutaciones en Gi , Gq, y otros genes humanos pueden contribuir a la disfuncin sutil, tissuespecific regulador en homocigotos y quizs incluso en heterocigotos. Los fenotipos de knockouts homocigotos en ratones sugieren que las mutaciones G puede ser encontrado en enfermedades hereditarias que afectan el tracto gastrointestinal, el corazn, el cerebro, las plaquetas y los vasos sanguneos. Otras mutaciones causantes de la enfermedad seguramente se encuentran en los genes que codifican la G y subunidades G.
INICIACIN ANORMAL DE LA SEAL DE PROTENA G La tos ferina La tos ferina es una enfermedad infecciosa comn conocida como tos ferina es causada por Bordetella pertussis organismos que viven en el rbol traqueobronquial. La infeccin causa una tos paroxstica que puede persistir durante semanas y puede complicarse con infecciones secundarias y la muerte. La toxina patgena principal de B. pertussis, como la de clera, es una enzima que cataliza la unin de ADP-ribosa a la cadena lateral de un aminocido especfico. En este caso el aminocido es una cistena localizado en el C-terminal colas de subunidades Ga pertenecientes a la familia Gi . La unin de ADP-ribosa en esta regin profundamente reduce la capacidad de respuesta a la activacin del receptor, ya que el terminal C de Ga interacta directamente con los receptores de hormonas. El conocimiento del mecanismo molecular de la toxina no se ha llevado todava a la comprensin de la patognesis celular de la tos ferina. Los sntomas pulmonares no han sido relacionados con alteracin en la activacin de cualquiera de los muchos efectores regulados por objetivos de la toxina, las protenas Gi. El mecanismo molecular, sin embargo, probablemente s explica la persistencia de la tos paroxstica mucho despus de B. pertussis se ha ido de las vas respiratorias, lo que probablemente refleja la persistencia de la irreversibilidad de la toxina catalizada por modificacin covalente y una baja rotacin de las clulas diana clave en las vas respiratorias epitelio (en contraste con la rpida rotacin del epitelio intestinal expuestos a la toxina del clera). Activacin Especficamente Seudohipoparatiroidismo Deterioro de Gs Tipo Ia
Dos mutaciones puntuales del gen Gs , que se encuentran en diferentes familias con seudohipoparatiroidismo tipo Ia, dan como resultado la produccin de cantidades normales de protenas defectuosas de
sealizacin. La sustitucin de la histidina por arginina en la posicin 385 en la cola C-terminal de Gs selectivamente impide Gs de ser estimulado por los receptores. La sustitucin de histidina por una arginina diferente (en la posicin 231) tambin impide Gs a partir de la respuesta a la estimulacin del receptor, pero mediante un mecanismo diferente. En el ltimo caso, un puente de sal entre el residuo de arginina y otro normalmente sirve como un cerrojo intramolecular, el bloqueo de GTP en su bolsillo de unin y permitiendo el G Ga-GTP complejo de disociarse de G. Al romper el cerrojo, la mutacin impide Arg231His receptor inducida por la unin de GTP y hace que Ia pseudohipoparatiroidismo tipo. El ensayo utilizado para la reconstitucin bioqumica Gs no puede detectar la deficiencia de Gs en el 10 a 20 por ciento de las familias que tienen el fenotipo clnico completo de tipo I. seudohipoparatiroidismo Como con los casos que implican la mutacin Arg231His, muchos de estos casos puede reflejar la relativa insensibilidad de la reconstitucin ensayo a un deterioro especfico de activacin del receptor. Testotoxicosis con el Tipo Ia Seudohipoparatiroidismo Testotoxicosis - produccin autnoma de la testosterona - Resultados de la pubertad precoz en los nios. Generalmente es causada por una mutacin que implica una ganancia de funcin en el receptor para la hormona luteinizante; esta mutacin estimula Gs, dando lugar a un exceso de produccin de la testosterona por las clulas testiculares de Leydig. porque pacientes con Ia seudohipoparatiroidismo tipo pueden tener resistencia a la hormona luteinizante y la insuficiencia testicular primaria, fue sorprendente encontrar testotoxicosis asociado con Ia seudohipoparatiroidismo tipo en dos boys.12 no relacionado tanto en los nios el trastorno resultado de mutaciones puntuales idnticas en el nucletido de guanina bolsillo de unin de Gs (en la posicin 366), lo que caus la prdida simultnea y ganancia de funcin GSA. Seudohipoparatiroidismo tipo Ia, caracterizado por una prdida de funcin Gs , los resultados de la inactivacin trmica de la protena mutante a la temperatura corporal. Testotoxicosis, una ganancia de funcin
Gs , los resultados de acelerar (independiente del receptor) liberacin de GDP y la consiguiente activacin mediante la unin de GTP, la temperatura ms baja de los testculos (34 C) protege la protena mutante de la inactivacin trmica. La hipertensin esencial Una mutacin en el gen que codifica una subunidad de la protena G pueden ser patgenos en algunos pacientes con hipertensin esencial. La deteccin de un aumento de la sealizacin dependiente de Gi en clulas cultivadas de pacientes con hipertensin llevado al descubrimiento de una mutacin aparente que implica una ganancia de funcin en el gen que codifica el miembro de la 3 G familia. Los resultados de mutacin en el corte y empalme aberrante de 3 ARN mensajero y la produccin de G 3-sa protena corta que carece de 41 residuos en el medio de la secuencia de aminocidos; G 3-S se encuentra en las plaquetas y clulas cultivadas de pacientes 2 afectados aunque la presencia de 3-s en clulas cultivadas se correlaciona bien con el aumento de las respuestas hormonales Gidependientes, el mecanismo molecular subyacente no se conoce. En un estudio de casos y controles con ms de 400 pacientes en cada grupo, el G-3 s alelo se encontr en el 53 por ciento de los pacientes con hipertensin y el 44 por ciento de subjects.2 normotensos Si esta pequea diferencia se confirma, esto sugiere que la mutacin podra ser responsable de la presin arterial elevada de 15 por ciento de los pacientes con hypertension54, en este caso, G-3 s representara un polimorfismo equilibrado cuya ventaja selectiva en la evolucin es equilibrada por el efecto deletreo de la hipertensin.
CONCLUSIONES
Debido a que las protenas G desempean un papel clave en la regulacin, el anlisis gentico es probable que revelan mutaciones adicionales en las protenas G que causan enfermedades en los seres humanos. Algunas de estas mutaciones causan las enfermedades raras, como el tipo de pseudohipoparatiroidismo I o acromegalia, pero sin embargo nos ensean lecciones acerca de los mecanismos bsicos de regulacin. En otros casos, tales como la mutacin 3 en la hipertensin, los polimorfismos equilibrada puede ser encontrado para contribuir a otras enfermedades crnicas comunes.
Вам также может понравиться
- Enfermedades Hereditarias Que Implican Proteínas GДокумент7 страницEnfermedades Hereditarias Que Implican Proteínas GUSMP FN ARCHIVOS67% (3)
- Las Proteínas G HeterotriméricasДокумент28 страницLas Proteínas G HeterotriméricasAbigail IturraldeОценок пока нет
- Importancia de Las Proteínas G Heterotriméricas en La Biología PDFДокумент7 страницImportancia de Las Proteínas G Heterotriméricas en La Biología PDFSariely Jazmín PerezОценок пока нет
- Proteinas GДокумент3 страницыProteinas Gcorrales.gersonОценок пока нет
- Señalización de Proteínas G y AMP CiclicoДокумент7 страницSeñalización de Proteínas G y AMP CiclicoAmílkar Ocegueda MaderaОценок пока нет
- Proteina GДокумент6 страницProteina GAngela Gonzales HerreraОценок пока нет
- Prot G Adenilato CiclasaДокумент5 страницProt G Adenilato CiclasaVictor VitoriaОценок пока нет
- Proteinas GДокумент19 страницProteinas GAnonymous 443xsmeqtОценок пока нет
- Transducción de SeñalesДокумент6 страницTransducción de SeñalesAgustin BarillaroОценок пока нет
- Ucsur Comunicacion Membrana 2019 MDДокумент50 страницUcsur Comunicacion Membrana 2019 MDAnthonyPacoGómezОценок пока нет
- Seminario #8 (Ii-3) Semana #11 Desordenes en Receptores CelularesДокумент15 страницSeminario #8 (Ii-3) Semana #11 Desordenes en Receptores CelularesSantiago Delgado ChumioqueОценок пока нет
- Las Proteínas G Heterotriméricas - Receptores 7 TM. Segundos Mensajeros. Síntesis y FunciónДокумент4 страницыLas Proteínas G Heterotriméricas - Receptores 7 TM. Segundos Mensajeros. Síntesis y FunciónAbigail IturraldeОценок пока нет
- Receptores Acoplados A ProteinasДокумент7 страницReceptores Acoplados A Proteinaspain667Оценок пока нет
- Proteinas GДокумент19 страницProteinas GEduardo P. FernándezОценок пока нет
- De Receptores Transmembrana: Rutas ProteolíticasДокумент125 страницDe Receptores Transmembrana: Rutas ProteolíticasPablo SPОценок пока нет
- Receptores de MembranaДокумент9 страницReceptores de MembranaAlexy SanchezОценок пока нет
- Receptores, Segundos Mensajeros y Vias de Senalizacion1Документ14 страницReceptores, Segundos Mensajeros y Vias de Senalizacion1SantiagoОценок пока нет
- Receptores, Segundos Mensajeros y Vias de Senalizacion1Документ14 страницReceptores, Segundos Mensajeros y Vias de Senalizacion1esrn4laboratorioОценок пока нет
- Comunicación CelularДокумент6 страницComunicación CelularLAURA VICTORIA OAXACA NEVAREZОценок пока нет
- Apuntes Proteinas GДокумент40 страницApuntes Proteinas GYulsAelbert ReRoОценок пока нет
- ReceptoresДокумент6 страницReceptoresNatasha GabrielleОценок пока нет
- BioquimicaДокумент3 страницыBioquimicahender sierraОценок пока нет
- Glucogenosis PDFДокумент10 страницGlucogenosis PDFAndrea TorrecillaОценок пока нет
- Seminario 3Документ27 страницSeminario 3Rafael Antonio Rodríguez DíazОценок пока нет
- Resume Del Cap de BioquimicaДокумент3 страницыResume Del Cap de Bioquimicanayeliceli2345Оценок пока нет
- Microclases ReceptoresДокумент5 страницMicroclases ReceptoresMilagros BritesОценок пока нет
- Proteína GДокумент42 страницыProteína GMiriam RoncalОценок пока нет
- Proteinas GДокумент2 страницыProteinas GJosé Fernando Salgado MorenoОценок пока нет
- Síntesis de Glucógeno, Regulación y AlteracionesДокумент15 страницSíntesis de Glucógeno, Regulación y AlteracionesIVONNE INGRID FLOREZ CCALLUCOОценок пока нет
- 14 Senales CelularesДокумент57 страниц14 Senales CelularesElbio AlvarezОценок пока нет
- Proteina G y Su Implicancia ClínicaДокумент16 страницProteina G y Su Implicancia ClínicaMarco PeraltaОценок пока нет
- Fisiologia GlucagonДокумент2 страницыFisiologia GlucagonValentina CastroОценок пока нет
- Glucogeno y DisacaridosДокумент11 страницGlucogeno y DisacaridosRhonny JhОценок пока нет
- Comunicacion CelularДокумент3 страницыComunicacion CelularCinthya RamirezОценок пока нет
- RECEPTORES ACOPLADOS A LA PROTEINA G Practica IДокумент5 страницRECEPTORES ACOPLADOS A LA PROTEINA G Practica IJose CarlosОценок пока нет
- Palabras ClaveДокумент6 страницPalabras ClaveGrisell RamírezОценок пока нет
- SEMINARIOS 3 4 5 y 6Документ83 страницыSEMINARIOS 3 4 5 y 6Ana Karina Tarco Perez100% (1)
- Galactose MiaДокумент9 страницGalactose MiaLuis Gilberto MoncadaОценок пока нет
- Acetilcolina en Muscula Cardiaco PDFДокумент10 страницAcetilcolina en Muscula Cardiaco PDFGonzalo UribeОценок пока нет
- Seminario PI3KA en Cancer de Colon (Autoguardado)Документ30 страницSeminario PI3KA en Cancer de Colon (Autoguardado)deividn30Оценок пока нет
- de Proteína GДокумент10 страницde Proteína GEvelin Alexandra Orozco MurgasОценок пока нет
- TRADUCCIONДокумент2 страницыTRADUCCIONAngie Nathalia MartinezОценок пока нет
- Taller de Señalización CelularДокумент6 страницTaller de Señalización CelularKevin PalacioОценок пока нет
- 17 RivoltaДокумент3 страницы17 RivoltaLeya Contreras AmorettiОценок пока нет
- Te 3 - Comunicación Celular. Receptores Acoplados A Proteína G y Tirosin QuinasaДокумент76 страницTe 3 - Comunicación Celular. Receptores Acoplados A Proteína G y Tirosin QuinasaJose VgОценок пока нет
- Receptores Acoplados A Proteina G Relacionados Con Patologias CardiovascularesДокумент5 страницReceptores Acoplados A Proteina G Relacionados Con Patologias CardiovascularesKarenGabrielaGTОценок пока нет
- MECANISMOS DE ACCIÓN Parte 2Документ7 страницMECANISMOS DE ACCIÓN Parte 2MARIA ALEJANDRA BERMUDEZ BUITRAGOОценок пока нет
- Bioquimica Proteiba GДокумент10 страницBioquimica Proteiba GIrma Elisa Huatay JaveОценок пока нет
- Mecanismo de AcciónДокумент2 страницыMecanismo de AcciónCitlalli TiendaОценок пока нет
- Acciones Biológicas de La Hormona de CrecimientoДокумент3 страницыAcciones Biológicas de La Hormona de CrecimientoDanna cárdenasОценок пока нет
- Bioquimica Ii Vias de Transducción de Señales: Dra. (C) Emma Urrunaga Soria Profesora Del CursoДокумент61 страницаBioquimica Ii Vias de Transducción de Señales: Dra. (C) Emma Urrunaga Soria Profesora Del CursoClinton LunaОценок пока нет
- Qué Es Una Proteína GДокумент1 страницаQué Es Una Proteína GErick Ramos OlivaОценок пока нет
- Enfermedad PompeДокумент15 страницEnfermedad PompeAnonymous j1xrYVRQvОценок пока нет
- Comunicación Intercelular. GPCRДокумент41 страницаComunicación Intercelular. GPCRIzumiОценок пока нет
- Clase EnzimopatíasДокумент36 страницClase EnzimopatíasSergio Matus CarterОценок пока нет
- Diabetes pt1Документ42 страницыDiabetes pt1Annie GómezОценок пока нет
- Interpretación de QUIMICA SANGUINEA VETERINARIA PDFДокумент9 страницInterpretación de QUIMICA SANGUINEA VETERINARIA PDFCristian E. Rosales100% (3)
- Absorción con filtro BK como terapia eficaz en el riñón del mieloma múltipleОт EverandAbsorción con filtro BK como terapia eficaz en el riñón del mieloma múltipleОценок пока нет
- Fractura de CaderaДокумент15 страницFractura de CaderaFranco Romero100% (2)
- Sem1 Trabajo de NeurotransmisoresДокумент19 страницSem1 Trabajo de NeurotransmisoresFranco RomeroОценок пока нет
- Fármacos Que Afectan La Motilidad IntestinalДокумент9 страницFármacos Que Afectan La Motilidad IntestinalFranco Romero100% (1)
- Protozoosis Transmitidas Por Fecalismo. PatogenicidadДокумент8 страницProtozoosis Transmitidas Por Fecalismo. PatogenicidadFranco RomeroОценок пока нет
- Origen y Evolución de La GeopolíticaДокумент4 страницыOrigen y Evolución de La GeopolíticaFranco Romero43% (7)
- Libro Poder Mental ExtrsensorialДокумент55 страницLibro Poder Mental Extrsensorialmat_ras100% (2)
- Mieloma MultipleДокумент15 страницMieloma MultipleNaye Recalde ErazoОценок пока нет
- 02 IPERC ALMACEN Rev. 04 - JRДокумент70 страниц02 IPERC ALMACEN Rev. 04 - JRJorge Eduardo Pinglo AguilarОценок пока нет
- Agentes Fisicos IДокумент38 страницAgentes Fisicos IMassiel Torres AriasОценок пока нет
- Volvulosexpolista1 130619142458 Phpapp02Документ38 страницVolvulosexpolista1 130619142458 Phpapp02Luis MuñozОценок пока нет
- Guía de Trabajo 1 de Ciencia y TecnologíaДокумент3 страницыGuía de Trabajo 1 de Ciencia y TecnologíaJesus Marcell Saforas LauraОценок пока нет
- Ficha de Monitoreo PROGRAMACION 2015Документ10 страницFicha de Monitoreo PROGRAMACION 2015Anonymous N9EBVnbОценок пока нет
- Ciclo de Vida PatogenosДокумент4 страницыCiclo de Vida PatogenosJaider eduardo Osorio ragoОценок пока нет
- Ejemplo Historia ClinicaДокумент8 страницEjemplo Historia ClinicaEduardo PerezОценок пока нет
- Mapa 9Документ2 страницыMapa 9cielo123456100% (1)
- Resumen Genética Parte1Документ46 страницResumen Genética Parte1CAMIОценок пока нет
- Temario de NefrologiaДокумент5 страницTemario de NefrologiaEnrique MartinezОценок пока нет
- Cafe PeruanoДокумент9 страницCafe Peruanopablopg_5Оценок пока нет
- El LimónДокумент9 страницEl LimónXchel Rocío MaldonadoОценок пока нет
- Valoracion PreoperatoriaДокумент56 страницValoracion PreoperatoriaPao solisОценок пока нет
- TomateДокумент4 страницыTomateFrancisco TeletorОценок пока нет
- El Aparato Circulatorio en Los AnimalesДокумент22 страницыEl Aparato Circulatorio en Los AnimalesMarta LozaОценок пока нет
- Boletin No 08 Informativos Administrativos Por LesionДокумент3 страницыBoletin No 08 Informativos Administrativos Por LesionDiomedes Diaz BotiaОценок пока нет
- MIPER Matriz de Identificación de Peligros y Evaluación de Riesgos V.2Документ9 страницMIPER Matriz de Identificación de Peligros y Evaluación de Riesgos V.2Daniela TroncosoОценок пока нет
- JUST IN CASE - Grupo 9Документ2 страницыJUST IN CASE - Grupo 9Mr. FrozonoОценок пока нет
- T-29 Metabolismo de ProteínasДокумент24 страницыT-29 Metabolismo de ProteínasAnonymous iIaMAfVОценок пока нет
- ANTIARRITMICOSДокумент12 страницANTIARRITMICOSValeria Neris Deineca100% (3)
- NÓDULO PULMONAR SOLITARIO TerminadaДокумент10 страницNÓDULO PULMONAR SOLITARIO TerminadaVictor Alfredo Siguas MenesesОценок пока нет
- Taller TBДокумент3 страницыTaller TBMaria Del Mar GarciaОценок пока нет
- Aciduria OroticaДокумент11 страницAciduria Oroticarionexpa50% (2)
- Oncologia de BolsilloДокумент356 страницOncologia de Bolsilloalejandra100% (2)
- Revista de Uso de AnticonceptivosДокумент23 страницыRevista de Uso de AnticonceptivosLila Seminario ParedesОценок пока нет
- Evidencia 3 Cuadro Comparativo Riesgos ProfesionalesДокумент5 страницEvidencia 3 Cuadro Comparativo Riesgos ProfesionalespipoОценок пока нет
- Eliminar El Estres Brian WeissДокумент50 страницEliminar El Estres Brian Weissplebeius31100% (5)
- Historia Cronológica de La MicrobiologíaДокумент5 страницHistoria Cronológica de La MicrobiologíaHestitaОценок пока нет