Академический Документы
Профессиональный Документы
Культура Документы
Tema 4 Enlace Covalente
Загружено:
danihidalgosnАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Tema 4 Enlace Covalente
Загружено:
danihidalgosnАвторское право:
Доступные форматы
1
TEMA IV UNIONES ENTRE TOMOS (II)
Existen compuestos moleculares
H
2
, Cl
2
, NH
3
, NH
4
+
, O
2
, N
2
Su formacin
no se explica
enlace Inico
enlace Metlico.
Se forman
Enlace
Covalente
Teora de Lewis
Mecnica Cuntica
Teora de Enlace Valencia (EV)
Teora de orbitales moleculares (OM)
2
Teora de Lewis :
Los tomos se unen compartiendo parejas de electrones (de su capa de valencia) para
adquirir la configuracin estable de ocho electrones (regla del octeto).
F
+
F
F F
o bien
tomo flor tomo flor
molcula flor
par de electrones
compartidos
Se representa
con una lnea
3
Si cada tomo enlazado aporta un electrn al par compartido, existe un enlace
covalente normal:
Si dos tomos comparten ms de un par de electrones se originan enlaces mltiples
Lewis represent las molculas mediante diagramas de estructura de Lewis,donde
los electrones del ltimo nivel energtico figuran como puntos o cruces agrupados por
parejas alrededor de los smbolos. Las parejas electrnicas tambin pueden sustituirse
por guiones
+
H H
H
H
H
H
O = O
O
+ O
O
O
N N
N + N
N N
4
Si los dos e
-
son aportados por uno slo de los tomos unidos, el enlace se llama
covalente dativo o coordinado.
H
+
N
H
H
H
+
molcula de
amoniaco
in hidrgeno
(tomo de H sin su electrn)
H
|
N
|
H
H H
in amonio
5
H O H
H
- -
+
i)
H N H
H
H +
j)
H H a)
H Br
- -
- -
-
- b)
H P H
H
- -
c)
S
H H
d)
f) Br
- -
- -
-
-
-
-
g)
- -
Na
- -
-
-
-
-
h) Ca
- -
-
-
-
-
- -
e)
O = C = O
- - - -
-
-
-
-
Representar las estructuras de Lewis de los siguientes iones:
a) H
2
b) HBr c) PH
3
d) H
2
S e) CO
2
f) Br
g) Na
+
h) Ca
++
i) H
3
O
+
j) NH
4
+
6
Excepciones a la regla del octeto
Existen algunas molculas que no cumplen la regla del octeto, tales como la de NO
o la de NO
2,
que contienen un nmero impar de electrones de valencia.
N
O
N
7
Ejercicios:
1. Represente las estructuras de Lewis de las siguientes molculas:
PCl
3
CH
4
NF
3
BCl
3
CCl
4
8
2. El Enlace Covalente: Ideas Mecanocunticas.
Mecnica
cuntica
Aplicada a la
molcula
Ecuacin de Ondas.
(muy compleja)
No tiene una
solucin exacta
Solucin
aproximada
Teora de E.V.
Teora de Orbitales Moleculares O.M.
9
Teora de Enlace de Valencia (EV):
Se puede resumir en los siguientes puntos:
Para que dos tomos se unan es necesario que stos posean orbitales atmicos
semiocupados .
Al acercarse los dos tomos, las nubes electrnicas de estos OA interaccionan
provocndose un solapamiento y apareciendo un nuevo orbital que ahora pertenece a
los dos tomos enlazados y que alberga la pareja de electrones.
Si el solapamiento de los OA es frontal, se formar un enlace covalente tipo sigma ( ).
Enlaces o
10
Enlaces
El nmero de enlaces covalentes que es capaz de formar un tomo (covalencias)
coincide con el nmero de electrones desapareados.
Si el solapamiento de los OA es lateral, se formar un enlace covalente tipo pi ( ).
Cuanto mayor es el solapamiento mayor es la estabilidad y por tanto la fuerza del
enlace.
Los OA que no solapan permanecen inalterados.
11
Molcula de hidrgeno H
2
: cada tomo de H posee un OA 1s semilleno
El solapamiento de los OA 1s
forma una zona de probabilidad
comn, responsable del enlace
Molcula de cloro (Cl
2
): cada tomo de Cl posee un OA 2p semilleno
El solapamiento frontal de
dos OA 2p forma una zona
de probabilidad comn
responsable del enlace
Algunas molculas descritas mediante la teora EV:
12
Cuando se produce ms de un solapamiento entre orbitales atmicos de distintos
tomos se originan enlaces mltiples
Ejemplos:
Molcula de oxgeno (O
2
)
Al acercarse dos tomos de oxgeno,
se solapan frontalmente sus OA 2p
x
semiocupados, originando un enlace o.
Tambin se solapan lateralmente los dos
OA 2p
y
, originando otro enlace t
Molcula de nitrgeno (N
2
)
Al aproximarse los tomos, se solapan
frontalmente sus OA 2p
x
semiocupados
(enlace o) y se producen solapamientos
laterales entre los dos OA 2p
y
y los dos
OA 2p
z
respectivamente, originando
dos enlaces t
13
Descripcin mediante la teora del enlace de valencia de la molcula de HF
X
Z
F
H
HF
Electrones
desapareados
F 1S
2
2S
2
2 P
x
2
Pz
2
Py
1
H 1S
1
14
Describe mediante la teora del enlace de valencia la molcula de HCl
Solucin:
Las configuraciones electrnicas de los tomos que forman la molcula son:
Cada tomo posee un orbital
con un electrn desapareado.
Dichos orbitales se solapan
formando un enlace o
H : 1s
1
Cl : 1s
1
2s
2
2p
6
3s
2
3p
5
Molcula de HCl
15
2.3 RESONANCIA:
Existen molculas que pueden ser descritas mediante varias estructuras y sin embargo ninguna de
ellas por separado se corresponde con las propiedades de la molcula. En estos casos la
descripcin de la molcula necesita de un nuevo concepto conocido con el nombre de
resonancia:
Un ejemplo tpico es la molcula de ozono, que puede ser descrita por dos posibles
estructuras, formadas por un enlace doble (+ corto) y otro sencillo (+ largo).
O
O
O
O
O
O
Experimentalmente se comprueba que el ozono tiene dos enlaces idnticos
16
En otras palabras hay molculas donde existen ciertos pares electrnicos que pueden
colocarse en distintas posiciones originando varias posibles estructuras (formas resonantes).
Aplicando el concepto de resonancia, podemos decir que estos pares se encuentran en un
orbital deslocalizados entre varios ncleos de tomos.
La hiptesis de la resonancia propone que en los casos en los que una
molcula pueda representarse por varias estructuras (llamadas estructuras
resonantes) la estructura real es el conjunto de dichas estructuras y se
denomina hbrido de resonancia
Formas resonantes
O
O
O
O
O
O
17
or
Otro ejemplo es la molcula de Benceno C
6
H
6
o
18
3. Parmetros Moleculares.
Los parmetros moleculares a tener en cuenta para entender la estructura de las
molculas son el ngulo de enlace, la longitud de enlace y la energa de enlace
Ejemplos:
Es el ngulo comprendido entre dos enlaces consecutivos de un tomo. Se miden entre
las lneas imaginarias que unen un ncleo con los ncleos de dos tomos enlazados con
l.
ngulo de enlace
La molculas de AsCl
3
, SbCl
3
y BiCl
3
poseen ngulos de enlace similares
al tricloruro de fsforo
19
Las molculas de SiH
4
, GeH
4
y SnH
4
poseen ngulos de
enlace similares al metano
Es la distancia entre los ncleos de dos tomos enlazados, y depende del compuesto
al que pertenece el enlace.
Por ejemplo, en el metano CH
4
la longitud de enlace es 0,109 nm, pero en el
benceno C
6
H
6
la longitud del enlace C-H es de 0,108 nm.
Longitud de enlace
20
Si uno de los tomos enlazados permanece fijo, la longitud de enlace aumenta
con el nmero atmico del otro.
Ejemplos:
H - F = 0,092 nm
H -Cl = 0,127 nm
H - Br = 0,141 nm
H - I = 0,160 nm
Los valores de las longitudes de enlace, junto con los ngulos de enlace
determinan la geometra de la molcula.
Energa de Enlace.
En las molculas diatmicas la energa de enlace es la que se intercambia en
la reaccin de disociacin de la molcula en sus dos tomos, estando todos en
estado gaseoso. Se suele medir en eV/tomo o en kJ/mol
Ejemplo:
H
2
(g) + 436 kJ/mol H (g) + H (g)
En molculas poliatmicas se define de la misma forma, pero la energa de
cada enlace est influida por el resto de los tomos de la molcula, siendo
necesario obtener valores promedios
21
4. Molculas Polares.
Dos cargas elctricas iguales y de signo contrario ,+q y -q, situadas a una cierta
distancia entre s, d, constituyen un dipolo que se caracteriza por su momento dipolar:
d q
=
Siendo d un vector con origen en +q y extremo en -q
En enlaces covalentes entre tomos diferentes, el ms electronegativo atrae con
ms intensidad a los electrones comunes del enlace. El desplazamiento de la carga
hacia el tomo ms electronegativo forma un dipolo permanente.
Los enlaces pueden clasificarse segn su polaridad o porcentaje de carcter inico,
desde el 0% (enlaces covalentes puros, sin momento dipolar o apolares), hasta el
100% (enlaces inicos puros).
Ejemplos:
Cl
2
Cl : Cl es un enlace covalente apolar
HCl H
+o
: Cl
-o
es un enlace covalente polar
NaCl Na
+
Cl
-
es un enlace inico (No forma molculas)
q q +
- -
22
El momento dipolar de una molcula es la suma vectorial de los momentos dipolares
de todos sus enlaces. Algunas molculas en su conjunto son apolares y, sin embargo,
contienen enlaces polares.
Pueden presentarse los siguientes casos:
En las molculas diatmicas coinciden la polaridad del enlace y la polaridad de
la molcula.
Molculas diatmicas
Molculas angulares o piramidales
Molculas apolares con enlaces covalentes polares
Cloruro de hidrgeno
o
+
o
-
Momentos dipolares moleculares
23
En las molculas angulares ( H
2
O) o piramidales (NH
3
), la polaridad de los enlaces
y la polaridad molecular son diferentes, pues los momentos dipolares de los enlaces se
suman como vectores
Molcula de H
2
O Molcula de NH
3
24
Molculas apolares, que poseen enlaces
covalentes polares debido a que, por motivos
simetra,los dipolos creados por los distintos
enlaces se pueden anular. Este caso puede
suceder en molculas lineales,triangulares
planas o tetradricas
Molcula lineal
Molcula triangular plana
Molcula tetradrica
25
El estudio experimental de la geometra de las molculas da resultados que a veces no
coinciden con la prediccin de la teora de EV
Por ejemplo, en la molcula de dicloruro de berilio BeCl
2
las configuraciones
electrnicas de los tomos son:
Luego segn la Teora EV se obtendra una molcula angular con momento dipolar
no nulo.
Be 1s
2
2s
2
2p
0
x
2p
0
y
2p
0
z
Cl 1s
2
2s
2
2p
6
3s
2
3p
2
x
3p
2
y
3p
1
z
5. Geometra Molecular.
Be
*
1s
2
2s
1
2p
1
x
2p
0
y
2p
0
z
Salto electrnico
26
Experimentalmente se demuestra que la molcula de BeCl
2
es lineal, con momento
dipolar nulo.
Para explicar este tipo de contradicciones la Teora EV introduce el
concepto de Hibridacin de Orbitales Atmicos:
Los orbitales atmicos (OA) se combinan dando lugar a otros orbitales
atmicos denominados orbitales hbridos.
27
Los orbitales hbridos iguales son tambin energticamente iguales.
28
SP-P
SP-P
Be -> 1S
2
2 S
2
2 P
0
Salto electrnico
Be
*
-> 1S
2
2 S
1
2P
x
1
Hibridacin SP
Be
*
-> 1S
2
2 (SP)
1
2(SP)
1
Cl -> 1S
1
2S
2
2P
6
3S
2
3P
5
De acuerdo con esto la formacin de la molcula de BeCl
2
se puede explicar
siguiendo el siguiente esquema:
Es decir molcula lineal y de momento dipolar cero.
29
Otros ejemplos de hibridacin
Molcula de BH
3
hibridacin SP
2
B -> 1S
2
2 S
2
2 P
1
Salto electrnico
B
*
-> 1S
2
2 S
1
2P
x
1
2P
y
1
Hibridacin SP
2
B
*
-> 1S
2
2 (SP
2
)
1
2(SP
2
)
1
2(SP
2
)
1
H -> 1S
1
30
Molcula de CH
4
hibridacin SP
3
Hibridacin SP
3
C -> 1S
2
2 S
2
2 P
2
Salto electrnico
C
*
-> 1S
2
2 S
1
2P
x
1
2P
y
1
2P
z
1
C
*
-> 1S
2
2 (SP
3
)
1
2(SP
3
)
1
2(SP
3
)
1
2(SP
3
)
1
H -> 1S
1
109,5
Hibridos sp
3
Molcula de metano CH
4
31
Orbitales hbridos ms importantes
32
Aplicacin del concepto de hibridacin
Problema: Qu clase de hbridos utiliza el tomo central en estas especies?
A) SiF
4
, B) BeF
2
, C) BH
4
-
C) BH
4
-
B (z=5) 1s
2
2s
1
2p
x
1
2p
y
1
2p
z
0
El boro acta como si tuviese otro electrn de valencia en el orbital 2p
z
Como los cuatro enlaces son iguales, corresponden con cuatro orbitales
hbridos sp
3
para unirse a los cuatro hidrgenos.
La molcula es tetradrica
Solucin:
A) SiF
4
Si (z=14) 1s
2
2s
2
2p
6
3s
1
3p
x
1
3p
y
1
3p
z
1
Se combinan los tres orbitales 3p y el orbital 3s
El silicio utiliza cuatro orbitales hbridos sp
3
. La molcula es tetradrica
Solucin:
B) BeF
2
Be (z=4) 1s
2
2s
1
2p
x
1
2p
y
0
2p
z
0
Se combinan el orbital 2s y el orbital 2p
x
.
El berilio utiliza dos orbitales hbridos sp. La molcula es lineal
Solucin:
33
Mtodo de la repulsin entre pares electrnicos de la capa de
valencia (RPECV).
Este mtodo predice la geometra de molculas sencillas a partir de la repulsin entre
los pares de electrones que rodean al tomo central (tanto los de enlace como los no
compartidos).
Las principales premisas de este mtodo son:
Los pares de electrones de valencia que rodean a un tomo central se repelen
entre s, separndose en la medida de lo posible para minimizar la energa del sistema
Los pares no compartidos estn ms dispersos y ejercen ms repulsin sobre los otros
pares, por lo que los ngulos de enlace que resultan son mayores que los tericos
34
Los pasos a seguir para aplicar este mtodo son:
a) Se dibuja la estructura de Lewis.
b) Se cuenta el n de pares de e- de enlace y de no enlace alrededor del
tomo central y se colocan de forma que minimicen las repulsiones:
Geometra de los pares de e-. (Geometras ideales)
c) La geometra molecular final vendr determinada en funcin de la
importancia de la repulsin entre los pares de e- de enlace y de no enlace.
PNC-PNC>PNC-PE >PE-PE
PNC= Par no compartido; PE= Par de enlace
35
N de
pares de e-
Geometra Angulo de
enlace
2 (AX
2
) Lineal 180
o
3 (AX
3
) Trigonal
Planar
120
o
4 (AX
4
) Tetradrica 109.5
o
5 (AX
5
) Bipirmide
trigonal
90
o
/ 120
o
6 (AX
6
) Octadrica 90
o
Geometra ideal
36
Trigonal piramidal Tetrahdrica
Angular
37
6. Fuerzas Intermoleculares.
Las fuerzas que unen las molculas entre s reciben el nombre genrico de fuerzas
de Van der Waals. La magnitud de estas fuerzas depende del nmero de electrones,
del tamao de la molcula y de la forma molecular, y pueden ser de tres tipos:
Fuerzas de atraccin dipolo-dipolo
Fuerzas de atraccin dipolo-dipolo inducido
Fuerzas de dispersin
Enlaces covalentes apolar y polar
F - F F - H
+
El enlace covalente polar se presenta entre tomos con distinta electronegatividad y
origina molculas con cierta polaridad elctrica llamadas dipolos permanentes.
38
Fuerzas de atraccin dipolo-dipolo
Se originan entre molculas que forman dipolos permanentes. La parte positiva de un
dipolo atrae a la parte negativa del dipolo ms prximo. Las molculas se orientan y se
atraen con una fuerza que aumenta con su momento dipolar.
A temperatura ambiente la mayora de las sustancias son lquidos o gases
debido a sus bajas temperaturas de fusin y ebullicin.
Ejemplos:
cido clorhdrico, etanol, agua, cloroformo
39
Enlace molecular por puente de hidrgeno
Es un caso especial de uniones dipolo-dipolo, entre tomos muy electronegativos
(F,O, y N) y el hidrgeno. Son fuerzas especialmente intensas.
Un caso tpico de enlace por
puente de hidrgeno se produce
entre las molculas de agua
Agua en estado slido:
Se establecen los cuatro enlaces por
puentes de hidrgeno posibles,
dando lugar a una estructura
tetradrica
Otros ejemplos de enlaces por puentes de Hidrgeno
Enlace entre molculas de HF
40
Fuerzas de atraccin dipolo-dipolo inducido
Tambin llamadas fuerzas de Debye, se producen cuando una molcula polar distorsiona
la nube electrnica de otra molcula prxima, creando en ella un dipolo instantneo o
dipolo inducido y surgiendo as una fuerza de atraccin entre ambas molculas.
Fuerzas de dispersin
Tambin llamadas London, se deben a dipolos instantneos que se originan en las
molculas apolares de forma aleatoria, debido al movimiento de los electrones.
Son fuerzas ms dbiles que las anteriores, por la brevedad de su existencia.
Originan el estado lquido y slido de molculas que son apolares por no tener
dipolos (O
2
,H
2
,N
2
) o por motivos de simetra (CO
2
,CCl
4
,CH
4
).
Crecen con la masa molecular o atmica de las sustancias. Por eso, las
sustancias formadas por molculas de alta masa molecular son lquidos o slidos
a temperatura ambiente.
41
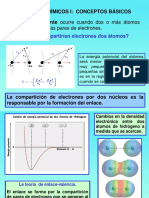
Las molculas son agrupaciones de tomos unidos por enlace covalente.Las sustancias
moleculares se caracterizan por la gran intensidad de las fuerzas de enlace entre los
tomos de la molcula y la debilidad de las fuerzas de unin entre las propias molculas.
H
muyfuerte
H
2 2
H .. ... .......... . H
muydbil
La mayora de estas sustancias tienen puntos de fusin y ebullicin bajos
Si las molculas tienen gran masa molecular pueden encontrarse en estado slido
o lquido a temperatura ambiente
Generalmente son gases en condiciones ordinarias de presin y temperatura
Oxgeno (gas molecular) Bromo (lquido molecular)
Yodo (slido molecular)
7. Sustancias Moleculares.
42
Los slidos covalentes,tambin llamados slidos atmicos o reticulares, son
sustancias cuyos tomos estn unidos entre s mediante enlaces covalentes, formando
redes tridimensionales.
Las uniones entre los tomos son muy fuertes, por lo que tienen temperaturas de
fusin y ebullicin muy altas y son muy duros.
Ejemplos:
Diamante (C)
Cuarzo (SiO
2
)
8. Slidos Covalentes
43
Propiedades de las sustancias moleculares y slidos covalentes
Molculas
apolares
Molculas
polares
Molculas con
Enlace hidrgeno
Slidos covalentes
Estado fsico en
condiciones estndar
Gas Gas o lquido Gas o lquido Slido
Solubilidad en
Disolventes apolares
Muy alta Muy baja Muy baja Muy baja
Solubilidad en
Disolventes polares
Muy baja Muy alta Muy alta Muy baja
Dureza (slidos) Muy blandos Muy blandos Muy blandos Muy duros
Conductividad en
Disolucin
No S S No
Ejemplo N
2
CO H
2
O SiO
2
Вам также может понравиться
- Enlace Quimico COVALENTE para ImprimirДокумент52 страницыEnlace Quimico COVALENTE para ImprimirAlejandro RecioОценок пока нет
- Clase Enlace Quimico ACTUALДокумент73 страницыClase Enlace Quimico ACTUALDanielLeMuzzОценок пока нет
- Tema 3 Enlace QuímicoДокумент12 страницTema 3 Enlace Químicohajar.ellouizi1Оценок пока нет
- Tema 3 - Quimica I - IAДокумент65 страницTema 3 - Quimica I - IARebeca RenedoОценок пока нет
- 1 Enlace QuimicoДокумент87 страниц1 Enlace QuimicoWalker ApazaОценок пока нет
- Presentacion Enlace CovalenteДокумент27 страницPresentacion Enlace CovalentePaulaОценок пока нет
- Enlace Quimico 2023Документ26 страницEnlace Quimico 2023deltaromero028Оценок пока нет
- 1enlace Quimico QgeДокумент59 страниц1enlace Quimico QgeSANDILY DEYSI PAUCCAR PANIHUARAОценок пока нет
- Simbolos Lewis y Regla Del OctetoДокумент9 страницSimbolos Lewis y Regla Del OctetoLuz Marina M. SancaОценок пока нет
- Capa de Valencia, Lewis, Octeto, Enlace QuímicoДокумент52 страницыCapa de Valencia, Lewis, Octeto, Enlace QuímicoAlexandra SánchezОценок пока нет
- 1 Formulas Lewis TomДокумент14 страниц1 Formulas Lewis TomMax Silverio ValverdeОценок пока нет
- Tema 5. Resumido (Teoría)Документ52 страницыTema 5. Resumido (Teoría)Pablo Merino DeniaОценок пока нет
- Enlaces QuímicosДокумент27 страницEnlaces QuímicosFernando ZuñigaОценок пока нет
- Enlaces CovalentesДокумент101 страницаEnlaces CovalentesRobert Velázquez LucianoОценок пока нет
- 3c Uniones Quimicas IEMДокумент54 страницы3c Uniones Quimicas IEMmartinutniemОценок пока нет
- Enlace QuimicoДокумент12 страницEnlace QuimicoMiguel Angel Criado AlonsoОценок пока нет
- Estructura MolecularДокумент79 страницEstructura Molecularverofranco983Оценок пока нет
- CTM Clase 11-2019-2Документ37 страницCTM Clase 11-2019-2Julio GiraldoОценок пока нет
- Unidad3Документ21 страницаUnidad3Jose Raul HolguinОценок пока нет
- 04 Excepciones Lewis y Geometria MolecularДокумент35 страниц04 Excepciones Lewis y Geometria MolecularEve ValdesОценок пока нет
- 2 EnlacecovДокумент13 страниц2 EnlacecovVictor Valdés AlvarezОценок пока нет
- Semana 7. Enlace QuimicoДокумент39 страницSemana 7. Enlace QuimicoAlexander DuránОценок пока нет
- Co ValenteДокумент34 страницыCo ValenteRosario BarraОценок пока нет
- 4 - Enlace QuimicoДокумент49 страниц4 - Enlace QuimicoDaniel Felipe Aguilar LozadaОценок пока нет
- Captura de Pantalla 2023-08-24 A La(s) 4.46.23Документ16 страницCaptura de Pantalla 2023-08-24 A La(s) 4.46.23Paola Esperanza Perez PeraltaОценок пока нет
- Clases 12-13-14 Enlace CovalenteДокумент62 страницыClases 12-13-14 Enlace CovalenteDayana Luz Garay RamirezОценок пока нет
- Enlace Quimico Completo PDFДокумент38 страницEnlace Quimico Completo PDFkatherineОценок пока нет
- Estructuras de LewisДокумент17 страницEstructuras de LewisEmmanuel CocomОценок пока нет
- Enlace CovalenteДокумент24 страницыEnlace CovalenteNúcleo de Investigación químicaОценок пока нет
- Clasificacion Enlaces Quimicos (Autoguardado)Документ57 страницClasificacion Enlaces Quimicos (Autoguardado)Nancy FloresОценок пока нет
- Enlaces Con AnimacionДокумент31 страницаEnlaces Con AnimacionVanessaSolarОценок пока нет
- Notas Tercer ParcialДокумент68 страницNotas Tercer ParcialRuiz AlbertoОценок пока нет
- EnlacecovalenteДокумент64 страницыEnlacecovalenteSergio QCОценок пока нет
- Uniones Químicas o Enlace QuímicoДокумент21 страницаUniones Químicas o Enlace QuímicoLaura BaezОценок пока нет
- Enlace CovalenteДокумент6 страницEnlace Covalentemaritza loyoОценок пока нет
- CTM Clase 11-2019-1Документ43 страницыCTM Clase 11-2019-1Joel GarcíaОценок пока нет
- Unidad 4Документ11 страницUnidad 4CarolinaОценок пока нет
- Tema 3.-Enlace Quimico y Fuerzas Intermoleculares (BN)Документ37 страницTema 3.-Enlace Quimico y Fuerzas Intermoleculares (BN)Nacho Sanchez MedinaОценок пока нет
- Ejercicios de Enlace QuimicoДокумент18 страницEjercicios de Enlace Quimicoafrunp5186Оценок пока нет
- Unidad 3-Enlace Químico, Compuestos Iónicos y Covalentes, Fórmulas de LewisДокумент21 страницаUnidad 3-Enlace Químico, Compuestos Iónicos y Covalentes, Fórmulas de LewisDaniel BedriñanaОценок пока нет
- KekuleДокумент15 страницKekuleAdriana CavazosОценок пока нет
- Los Enlaces QuímicosДокумент8 страницLos Enlaces QuímicosGeormanHernándezОценок пока нет
- ENLACE QUIMICO 1 (Modo de Compatibilidad)Документ54 страницыENLACE QUIMICO 1 (Modo de Compatibilidad)María Inés CisternaОценок пока нет
- SESION - 7 - Teoría Enlace QuímicoДокумент6 страницSESION - 7 - Teoría Enlace QuímicohhuataybuОценок пока нет
- Unidad 3 Enlaces QuímicosДокумент46 страницUnidad 3 Enlaces QuímicosAlexander HernándezОценок пока нет
- Unidad 3 Enlaces y Estructuras Químicas (Material de Trabajo)Документ7 страницUnidad 3 Enlaces y Estructuras Químicas (Material de Trabajo)michelle de Jesus Perez CorderoОценок пока нет
- QM1 Enlace QuímicoДокумент7 страницQM1 Enlace QuímicoNicolas GacituaОценок пока нет
- Quimica Unidad 3Документ10 страницQuimica Unidad 3Farid Jesús Pérez VeraОценок пока нет
- Diapositivas Unidad 4Документ70 страницDiapositivas Unidad 4agustin lopezОценок пока нет
- Semana 5 - INO1Документ51 страницаSemana 5 - INO1JOHAN PERCY CHULLUNCUY YUPANQUIОценок пока нет
- Taller de BioquimicaДокумент5 страницTaller de BioquimicaMauricio HerreraОценок пока нет
- ENLACE QUIMICO Ultimo-1Документ31 страницаENLACE QUIMICO Ultimo-1Julian CalaoОценок пока нет
- Enlace QuimicoДокумент23 страницыEnlace QuimicoJUNIOR JESUS VALENTE MAYHUIREОценок пока нет
- Clase 3 Parte 2Документ57 страницClase 3 Parte 2Fran Koo VilteОценок пока нет
- Practica 2 EnlacesДокумент16 страницPractica 2 Enlaceseulerlife03Оценок пока нет
- Enlace de ValenciaДокумент14 страницEnlace de ValenciaMiguel SánchezОценок пока нет
- Enlace QuimicoДокумент44 страницыEnlace QuimicoStephanieChávezОценок пока нет
- Teorias de EnlaceДокумент18 страницTeorias de EnlaceLia Alvarado MОценок пока нет
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaОт EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaРейтинг: 5 из 5 звезд5/5 (1)
- Locos BajitosДокумент2 страницыLocos BajitosdanihidalgosnОценок пока нет
- Intimidad (Comentario de Texto)Документ3 страницыIntimidad (Comentario de Texto)danihidalgosnОценок пока нет
- Fragmento Luces de Bohemia - Ramón María Del Valle (Comentario de Texto)Документ2 страницыFragmento Luces de Bohemia - Ramón María Del Valle (Comentario de Texto)danihidalgosnОценок пока нет
- La Abuela-Eduardo Galeano. (Comentario de Texto)Документ1 страницаLa Abuela-Eduardo Galeano. (Comentario de Texto)danihidalgosn33% (3)
- Dos Españas (Comentario de Texto)Документ2 страницыDos Españas (Comentario de Texto)danihidalgosnОценок пока нет
- El Arbol de La Ciencia, Pio Baroja (Fragmento) - Comentario de TextoДокумент2 страницыEl Arbol de La Ciencia, Pio Baroja (Fragmento) - Comentario de Textodanihidalgosn50% (4)
- Desahucio (Comentario de Texto)Документ3 страницыDesahucio (Comentario de Texto)danihidalgosnОценок пока нет
- Carpe Diem (Comentario de Texto)Документ2 страницыCarpe Diem (Comentario de Texto)danihidalgosnОценок пока нет
- Locos BajitosДокумент2 страницыLocos BajitosdanihidalgosnОценок пока нет
- Cuerpos (Comentario de Texto)Документ3 страницыCuerpos (Comentario de Texto)danihidalgosn100% (1)
- Resumen San Manuel Bueno Martir PDFДокумент6 страницResumen San Manuel Bueno Martir PDFdanihidalgosnОценок пока нет
- TragarДокумент2 страницыTragardanihidalgosnОценок пока нет
- Tema 5 FilosofiaДокумент3 страницыTema 5 FilosofiadanihidalgosnОценок пока нет
- COMPROBACION DE LECTURA No2Документ6 страницCOMPROBACION DE LECTURA No2Carlos SalazarОценок пока нет
- Memoria de Calculo Muro GavionesДокумент19 страницMemoria de Calculo Muro GavionesYasid Bernal TorresОценок пока нет
- Cinemática I PDFДокумент8 страницCinemática I PDFValeria Gutierrez OrellanaОценок пока нет
- Guias F-Q IIДокумент71 страницаGuias F-Q IIJulius Giron0% (1)
- Cap I. Fisica Ii. ElasticidadДокумент70 страницCap I. Fisica Ii. ElasticidadomarОценок пока нет
- Balances de Materia Sin Reaccion QuimicaДокумент3 страницыBalances de Materia Sin Reaccion QuimicaLuis David RodriguezОценок пока нет
- Enlace AtómicoДокумент8 страницEnlace AtómicoEdwis Castañeda VelásquezОценок пока нет
- Asepsia y Antisepsia Medico QXДокумент20 страницAsepsia y Antisepsia Medico QXgarfield_12100% (1)
- Filtros Pasivos y ActivosДокумент20 страницFiltros Pasivos y ActivosCar GuerraОценок пока нет
- Informe GeotecnicoДокумент19 страницInforme GeotecnicoWilson Salto CОценок пока нет
- Semana 02Документ27 страницSemana 02Julio Soto LovonОценок пока нет
- Low CD ES-04+Accurax-G5+Brochure+DataДокумент44 страницыLow CD ES-04+Accurax-G5+Brochure+DataGrover Oswaldo Villarpando CalleОценок пока нет
- Fricción y Anclajes de TuberíasДокумент11 страницFricción y Anclajes de TuberíasJOHANN SEBASTIAN SALAS DELGADOОценок пока нет
- 06020MgSO4 Hepth CompletaДокумент7 страниц06020MgSO4 Hepth CompletaJuan RoblesОценок пока нет
- Tarea Logica Difusa Grupo 6Документ4 страницыTarea Logica Difusa Grupo 6jmdelacruzvОценок пока нет
- La Astronomia en La AntiguedadДокумент4 страницыLa Astronomia en La Antiguedadtania gonzalesОценок пока нет
- Orificios y VertederosДокумент4 страницыOrificios y VertederosWalter Hernan Aguilar MolinaОценок пока нет
- Hormigon Fresco y EndurecidoДокумент45 страницHormigon Fresco y EndurecidoAntonio FoxОценок пока нет
- Representaciòn de Angulos Euler-YPRДокумент3 страницыRepresentaciòn de Angulos Euler-YPRJose Luis Romero CrespoОценок пока нет
- Práctica No. 1 Muestreador y RetenedorДокумент6 страницPráctica No. 1 Muestreador y RetenedorTobe CabreraОценок пока нет
- Actividad 2 Quimica GeneralДокумент4 страницыActividad 2 Quimica GeneralKarol Cantello ManchegoОценок пока нет
- Depositos de Suelos y Analisis Granulometricos PublicarДокумент34 страницыDepositos de Suelos y Analisis Granulometricos Publicarlili_gonzaОценок пока нет
- Metodologia Autoinducida para Constatar y Resolver El Problema de Las Interferencias AlienigenasДокумент38 страницMetodologia Autoinducida para Constatar y Resolver El Problema de Las Interferencias AlienigenaskinguОценок пока нет
- La Electricidad en La Vida Cotidiana: "Circuitos Eléctricos"Документ27 страницLa Electricidad en La Vida Cotidiana: "Circuitos Eléctricos"Alondra PeraltaОценок пока нет
- Modelo de Preguntas SimceДокумент10 страницModelo de Preguntas SimceGustavo FuentesОценок пока нет
- Carillas y AclaramientoДокумент11 страницCarillas y AclaramientoYenni FrancoОценок пока нет
- Balotario Primer Parcial de Mecanica de SuelosДокумент1 страницаBalotario Primer Parcial de Mecanica de SuelosEmilWaltherWissaОценок пока нет
- Estática y DinámicaДокумент2 страницыEstática y DinámicajosmarsОценок пока нет
- Calculo Retorno Agua Caliente IMSSДокумент11 страницCalculo Retorno Agua Caliente IMSSdanrpОценок пока нет