Академический Документы
Профессиональный Документы
Культура Документы
Relatorio 3
Загружено:
Murilo de LimaОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Relatorio 3
Загружено:
Murilo de LimaАвторское право:
Доступные форматы
1
1. Introduo
A velocidade de uma reao uma medida de quo rapidamente um reagente consumido ou um produto e formado. Esta velocidade pode ser aumentada ou diminuda dependendo das condies em que o meio reacional se encontra. Como as reaes envolvem a quebra e a formao de ligaes, as respectivas velocidades dependem da natureza dos reagentes entre si. Entretanto existem outros fatores que permitem a variao das velocidades. O aspecto fsico dos reagentes: quando os reagentes encontram-se em estados diferentes, por exemplo um slido e em lquido a velocidade da reao vai depender da superfcie de contato do reagente, portanto reaes com slidos tendem a prosseguir mais rapidamente se a rea superficial de contato for aumentada. A concentrao dos reagentes: as reaes tendem a se prosseguir mais rapidamente quando a concentrao do reagente e aumentada, pois medida que a concentrao aumenta tambm aumentada frequncia que as molculas se chocam levando a um aumento nas velocidades. A temperatura na qual a reao ocorre: a velocidade da reao tende a aumentar medida que a temperatura aumenta, pois o aumento da temperatura ocasiona um aumento nas energias cinticas das molculas, pois movendo-se mais rapidamente elas se chocam com mais frequncia e tambm com mais energia ocasionando um aumento de suas velocidades. A presso: com o aumento da presso em um recipiente, diminui o volume e desta forma aumenta a concentrao dos reagentes. As molculas se chocam mais, aumentando o nmero de colises e, portanto, aumenta a velocidade da reao. A velocidade de uma reao qumica e a variao da concentrao dos reagentes ou produtos por unidade de tempo, portanto as unidades para a velocidade da reao so geralmente concentrao em quantidade de matria por segundo (mol/L/s), isto a variao da concentrao dividida por um intervalo de tempo. (Vm = [ ] t)
2. Objetivos 2.1. Objetivo geral
Observar o efeito da influncia de diversos fatores na velocidade de uma reao qumica.
2.2. Objetivo especfico
Observar o efeito da temperatura, presso, concentrao e superfcie de contato na velocidade da dissoluo do comprimido efervescente.
3. Parte experimental 3.1. Reagentes e solues
Becker de 250 Ml; Termmetro; gua deionizada temperatura ambiente; gua deionizada gelada; Tela de amianto; Bico de bunsen; Trip; Almofariz; Pistilo; Esptula de metal; Copinho com tampa; Proveta 100 mL; Cronmetro; Comprimido Sonrisal (anticido analgsico): comprimido efervescente.
Composio: bicarbonato de sdio 1854 mg, carbonato de sdio 400 mg, cido acetilsaliclico 325 mg e cido ctrico 1413 mg. Dados do comprimido: Uso oral, uso adulto. Indicaes: azia, m digesto e dor de cabea. Dose: Um a dois comprimidos dissolvidos em um copo pequeno de gua (200 mL) podendo repetir o uso aps quatro horas. No exceder oito comprimidos por dia. Advertncias: Se voc tiver problemas nos rins, no fgado, presso alta, asma, rinite, estiver grvida ou amamentando, ou usando anticoagulantes orais, consulte seu mdico antes de tomar o medicamento. Contra indicaes: Alergia a componentes da frmula, ao cido acetilsaliclico ou a outro salicilatos, lcera, hemofilia, ou suspeita de dengue. Conservar em temperatura ambiente (15 a 30 C), proteger da luz e umidade.
Exija a bula Lote: SB0054V Fabricao: 02/13 Validade: 02/14 Glaxo Smithkline Brasil LTda Estrada dos Bandeirantes, 8.464 Rio de Janeiro RJ CNPJ33.247.743./0001-10Indstria Brasileira MS 1.0107.0141.002.1/1.0107.0141.001.-1 Farm. Resp.: Milton de Oliveira. CRF RJ N 5522 SAC0800 021.
3.2. Procedimento
Primeiramente no experimento padro foi medido o volume de 150 mL de gua deionizada utilizando uma proveta de 100 mL, depositando a gua medida em um bquer de 250 mL. Com um termmetro foi aferida a temperatura da gua, anotando-se o valor obtido. Em seguida adicionou-se um comprimido efervescente da marca Sonrisal no bquer com gua, e rapidamente foi acionado o cronmetro para obter o tempo necessrio para a dissoluo total do comprimido. Para a verificao do efeito da temperatura foi necessrio a utilizao de um bquer de 250 mL, o qual foi depositado o volume de 150 mL de gua gelada medida na proveta de 100 mL. Com o auxlio de um termmetro mediu-se a temperatura e anotou o valor obtido. Aps colocou-se um comprimido efervescente da marca Sonrisal no bquer contendo gua acionando o cronmetro para a verificao do tempo necessrio para que o comprimido se dissolva totalmente, comparando o tempo necessrio com o tempo do experimento padro. Neste experimento foi utilizado gua aquecida, ou seja, foi medida a quantidade de 150 mL de gua deionizada em uma proveta de 100 mL, adicionando esta quantia em um bquer de 250 mL, colocando o bquer sobre o trip e a tela de amianto aquecendo com a chama do bico de bunsen at a ebulio da gua. Com o auxlio de um termmetro mediu-se a temperatura, e retirou o bquer do aquecimento e assim depositando o comprimido efervescente sobre a gua acionando o cronmetro rapidamente anotando o tempo necessrio para total dissoluo do comprimido. No efeito da superfcie de contato foi necessrio a utilizao de um almofariz e um pistilo para a triturao de um comprimido efervescente da marca Sonrisal. No bquer de 250 mL preparado a quantia de 150 mL de gua deionizada medida em uma
proveta de 100 mL, aps foi medida e anotada sua temperatura usando um termmetro. O comprimido modo foi raspado do almofariz com o auxlio de uma esptula de metal no bquer contendo gua, observando o tempo no cronmetro at dissolver completamente o p. Aps comparou-se o tempo que resultou com o tempo que foi obtido no experimento padro. Em um copinho de plstico com tampa foi depositado 150 mL de gua deionizada medida em uma proveta de 100 mL, com o termmetro mediu-se a temperatura, a qual tambm foi anotada. Em seguida um comprimido efervescente foi depositado na gua tampando-se rapidamente o copinho, acionando assim o cronmetro para a observao do tempo necessrio para dissolver o comprimido totalmente. Para observar o efeito da concentrao adicionou-se 150 mL de gua deionizada medida em uma proveta de 100 mL em um bquer de 250 mL, mediu-se e a temperatura da gua com um termmetro, sendo esta anotada. Foi colocada no recipiente dois comprimidos efervescentes da marca Sonrisal, observando o tempo acionando o cronmetro at a dissoluo total do mesmo.
4. Resultados e discusso
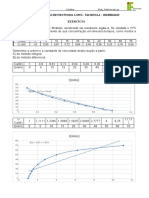
Tabela 1: Relao dos experimentos com a variao de tempo e temperatura. EXPERIMENTOS Padro H2O gelada H2O aquecida Superfcie de contato Presso Concentrao T/C 25 10 93 25 25 25 t/S 50,09 61,47 44,00 27,84 41,78 47,26
Efeito da Temperatura: Na prtica realizada, observamos como a temperatura interfere diretamente na velocidade das reaes. De acordo com a tabela acima, em temperaturas mais baixas a reao demora mais para acontecer, j em temperaturas mais altas a reao ocorre mais rapidamente e o comprimido ligeiramente dissolvido. Isso ocorre porque a temperaturas mais altas, uma frao muito maior de colises ocorre, devido vibrao
das molculas, assim cada segundo resulta em uma transformao qumica, de modo que os reagentes desaparecem mais rpidos a temperaturas mais elevadas. O aumento da temperatura do meio reacional faz com que a energia cintica das espcies qumicas reagentes se eleve o que normalmente acelera a quebra de ligaes e a formao de novas molculas. Uma elevao da temperatura aumenta a velocidade de uma reao porque aumenta o nmero de molculas dos reagentes com energia superior de ativao. Efeito da Superfcie de Contato: Comparando os experimentos da tabela acima, percebemos que o experimento que ocorreu mais rapidamente foi o da superfcie de contato, que teve o comprimido triturado. Quando se tem uma reao em que os reagentes esto em fases diferentes, chamamos de reao heterognea. Em uma reao deste tipo, os reagentes tm a capacidade de colidir somente na interface entre as fases, de modo que a rea de contato entre as fases um dos principais fatores na determinao da velocidade da reao. Essa rea controlada pelo tamanho das partculas dos reagentes. Atravs da triturao de um slido, como foi realizada na prtica, a rea da superfcie total pode ser aumentada. Isso maximiza o contato entre os tomos, ons ou molculas no estado slido com os que esto em uma fase diferente, no caso, lquida.
Efeito da Presso: O experimento com o efeito da presso ocorreu mais rapidamente do que o experimento padro, isso porque, presso a razo entre fora e rea, ou seja, fazer fora sobre uma determinada rea. Com o aumento da presso em um recipiente, ocorre a reduo do volume e desta forma aumenta-se a concentrao dos reagentes. Assim, as molculas se chocam mais, aumentando o nmero de colises e, portanto, aumentando a velocidade da reao.
Figura 1: Aumento de presso, diminuio do volume. Fonte: http://www.brasilescola.com/upload/e/pressao.jpg
Efeito da Concentrao: De acordo com a tabela de experimentos quando aumentamos a concentrao, a velocidade da reao aumenta. Isso ocorre porque a concentrao est relacionada quantidade de soluto e de solvente de uma substncia. Se aumentarmos a concentrao dos reagentes o nmero de colises por segundo de todos os tipos, incluindo o de colises efetivas, no pode deixar de aumentar. Nem todas as colises entre as molculas dos reagentes resultam em uma transformao qumica. Se todas as colises fossem efetivas, todas as reaes terminariam rapidamente. Assim, qualquer coisa que possa aumentar a frequncia das colises efetivas deve, portanto, aumentar a velocidade.
5. Concluso
A prtica nos permitiu identificar durante a realizao dos experimentos que os fatores temperatura, superfcie de contato, presso e concentrao influenciam na velocidade das reaes. Assim como, quanto mais baixa a temperatura a reao demora a acontecer e em temperaturas mais altas a reao ocorre rapidamente, a superfcie de contato depende da rea e o tamanho das partculas, como visto quando o comprimido foi triturado, com o aumento de presso aumenta a velocidade da reao, o efeito de concentrao quando aumentado a velocidade de reao aumenta. Os experimentos apenas colocaram em prtica a teoria, vista que realmente procede com os resultados.
6. Referncias bibliogrficas
7. Anexo
Disserte como a velocidade de uma reao qumica pode ser afetada pelos diferentes fatores descritos: temperatura, superfcie de contato, presso e concentrao.
A velocidade de uma reao qumica pode ser afetada por alguns fatores como a temperatura, superfcie de contato, presso e concentrao. A influncia da temperatura na velocidade se d quanto maior for a temperatura, maior ser a velocidade da reao, a transformao qumica pode ser analisada observando seu comportamento. Se aumentar a temperatura significa aumentar a energia cintica, ento, aumentando a velocidade do movimento, aumenta o nmero de choques e evidentemente o aumento da velocidade da reao. Com a superfcie de contato, a influncia que quanto maior for a superfcie, maior ser a velocidade da reao, pode-se dizer quando menor forem as partculas da reao, mais rpida ser a reao. Quando a velocidade da reao afetada pelo aumento da presso, ocorrem colises efetivas e consequentemente aumenta a sua velocidade. Quando afetada pela concentrao a velocidade de uma reao depende da concentrao dos reagentes, pois est relacionada com o nmero de choques entre as molculas, de forma que quanto maior a concentrao dos reagentes, maior ser as colises e maior ser a velocidade da reao.
Вам также может понравиться
- Experimentos para Aulas de Química - Ingrede Ferreira SilvaДокумент102 страницыExperimentos para Aulas de Química - Ingrede Ferreira SilvaAngela Leticia Nesso100% (2)
- Sobre o (Não) Domínio da Linguagem Química e sua Influência na AprendizagemОт EverandSobre o (Não) Domínio da Linguagem Química e sua Influência na AprendizagemОценок пока нет
- Espectroscopia UVДокумент122 страницыEspectroscopia UVjoaoquimicaОценок пока нет
- Determinação Do Teor de Sacarose Por PolarimetriaДокумент5 страницDeterminação Do Teor de Sacarose Por PolarimetriaRita FernandesОценок пока нет
- ELECTROQUÍMICA - Katia - GabrielДокумент46 страницELECTROQUÍMICA - Katia - GabrielMarciaОценок пока нет
- Skoog Capítulo 5Документ15 страницSkoog Capítulo 5Aline R. FernandesОценок пока нет
- Qumica Inorgânica Experimental IIДокумент33 страницыQumica Inorgânica Experimental IIRamalho Ferreira100% (1)
- Quimica AnaliticaДокумент32 страницыQuimica AnaliticaJose Licuco100% (1)
- Relatório de DensidadeДокумент12 страницRelatório de DensidadeMarcelo A. Costa JuniorОценок пока нет
- Relatório Química AnalíticaДокумент13 страницRelatório Química AnalíticaMiriely TorresОценок пока нет
- Relatorio n1 Licenciatura em Química - Transformação IsobaricaДокумент13 страницRelatorio n1 Licenciatura em Química - Transformação IsobaricaGeovany Braga Soares100% (1)
- Trabalho Sobre Equilibrio QuimicoДокумент10 страницTrabalho Sobre Equilibrio QuimicoYasmim Silva100% (1)
- Relatório TermoquímicaДокумент10 страницRelatório TermoquímicaThayssa VictóriaОценок пока нет
- Experiencia 12 ClasseДокумент23 страницыExperiencia 12 ClasseJorge Marcelo MadeiraОценок пока нет
- Lista Exercícios - 02 Gases ReaisДокумент2 страницыLista Exercícios - 02 Gases ReaisChris_Oliveira85Оценок пока нет
- Tema IV (Aula 1) - Propriedades Coligativas e SolucoesДокумент19 страницTema IV (Aula 1) - Propriedades Coligativas e SolucoesFernando BanzeОценок пока нет
- BLOCO D E BLOCO FДокумент17 страницBLOCO D E BLOCO FFabi MansillaОценок пока нет
- Lei de Ação Das MassasДокумент3 страницыLei de Ação Das Massasanastancia mucuhoОценок пока нет
- Artigo Oscilador Massa MolaДокумент6 страницArtigo Oscilador Massa MolaAlanne FerreiraОценок пока нет
- Exercícios Com Resolução - Físico-Química PDFДокумент33 страницыExercícios Com Resolução - Físico-Química PDFLuara Lima50% (2)
- Cetonas e AldeídosДокумент15 страницCetonas e AldeídosAna CristinaОценок пока нет
- Destilacao Fracionada PDFДокумент15 страницDestilacao Fracionada PDFCélia Maria Santos AntunesОценок пока нет
- Plano Analitico Quimica 8a - II Trimestre 2021Документ3 страницыPlano Analitico Quimica 8a - II Trimestre 2021StarHallackayОценок пока нет
- Relatório, Orgânica, Recristalização Do Ácido SalicílicoДокумент14 страницRelatório, Orgânica, Recristalização Do Ácido SalicílicoAnaОценок пока нет
- Relatório - Fosfato Refrigerante (Coca-Cola)Документ6 страницRelatório - Fosfato Refrigerante (Coca-Cola)Bruna FariasОценок пока нет
- Relatório de Fisica IДокумент12 страницRelatório de Fisica IDanielle Seixas ConstantinoОценок пока нет
- Termodinâmica Parte 1Документ147 страницTermodinâmica Parte 1JosianeОценок пока нет
- Exercício Cinética QuímicaДокумент6 страницExercício Cinética QuímicaLucas BentesОценок пока нет
- CQ243 - 1S2023 - Parte IДокумент21 страницаCQ243 - 1S2023 - Parte IGeisieli RodriguesОценок пока нет
- Atividade Avaliativa 1 - Leandro Assunção - 41812666Документ3 страницыAtividade Avaliativa 1 - Leandro Assunção - 41812666Victor BandeiraОценок пока нет
- Oxidação e ReduçãoДокумент8 страницOxidação e ReduçãoEduardo FilipeОценок пока нет
- Catalise Cinetica Quimica 1 PDFДокумент36 страницCatalise Cinetica Quimica 1 PDFmarcelolrvtОценок пока нет
- 01 Relatório de Medidas e VolumeДокумент6 страниц01 Relatório de Medidas e VolumeEdson LourençoОценок пока нет
- Experimento 1Документ6 страницExperimento 1Kayo Ramon OОценок пока нет
- Físico Química I Calor de DissoluçãoДокумент6 страницFísico Química I Calor de DissoluçãoProst Mohamed0% (1)
- Relatório - RefratometriaДокумент10 страницRelatório - RefratometriaFlávia FonsecaОценок пока нет
- EXTRATO DE BETERRABA COMO INDICADOR NATURAL DE PHДокумент9 страницEXTRATO DE BETERRABA COMO INDICADOR NATURAL DE PHCarlos Junior (LhPl4ys)Оценок пока нет
- Tecnologias de Exploração de Recursos Renováveis de EnergiaДокумент12 страницTecnologias de Exploração de Recursos Renováveis de Energiapedro ayaneОценок пока нет
- 2º Relatório - Pêndulo Físico e Pêndulos Simples AcopladosДокумент3 страницы2º Relatório - Pêndulo Físico e Pêndulos Simples Acopladosnoeliamar_2968Оценок пока нет
- Propriedades Químicas e Físicas Dos Alcanos e Alcenos.Документ4 страницыPropriedades Químicas e Físicas Dos Alcanos e Alcenos.DeborasSouza67% (3)
- Relatório 10 - Carvão AtivadoДокумент4 страницыRelatório 10 - Carvão AtivadoRailaneMonteiroОценок пока нет
- Apostila de Química - SuperiorДокумент57 страницApostila de Química - SuperiorGabriel DaniloОценок пока нет
- Os Fundamentos Da EletrostáticaДокумент11 страницOs Fundamentos Da EletrostáticaDavidson Sales100% (2)
- Catalizador Ziegler NattaДокумент6 страницCatalizador Ziegler NattaGenilson E Neliane Silva100% (1)
- Laboratorio IiДокумент14 страницLaboratorio Iinuro2010Оценок пока нет
- Gases ReaisДокумент21 страницаGases ReaisGuilherme MarangonОценок пока нет
- Aula 01Документ34 страницыAula 01pablojorgesilva100% (1)
- Apostila TMD Vol I v5-2 PDFДокумент40 страницApostila TMD Vol I v5-2 PDFAdriano SilvaОценок пока нет
- OSA - Analisador de Espectro Óptico MicrocontroladoДокумент115 страницOSA - Analisador de Espectro Óptico MicrocontroladoFelipe DAgostini ArcariОценок пока нет
- Lab. Mecânica ClássicaДокумент69 страницLab. Mecânica ClássicaTiago MeloОценок пока нет
- Determinação Das Propriedades Termodinâmicas de Ionização Do Ácido Acético PDFДокумент2 страницыDeterminação Das Propriedades Termodinâmicas de Ionização Do Ácido Acético PDFDanilo RodriguesОценок пока нет
- Transf. Massa - Difusão e Lei de FickДокумент27 страницTransf. Massa - Difusão e Lei de Fickfamaiaeletrica100% (1)
- Activdade 3 FidelДокумент9 страницActivdade 3 FidelFidel GuirrugoОценок пока нет
- FEI - Apostila Quimica Geral - Laboratorio 2009Документ88 страницFEI - Apostila Quimica Geral - Laboratorio 2009RafaelRodriguesОценок пока нет
- Relatorio N1 Licenciatura em Química - Transformação IsotermicaДокумент13 страницRelatorio N1 Licenciatura em Química - Transformação IsotermicaGeovany Braga SoaresОценок пока нет
- Dissolução e Diluição ApostilaДокумент4 страницыDissolução e Diluição ApostilaJamily JardimОценок пока нет
- Relatório de Química Experimental - Equilíbrio QuímicoДокумент11 страницRelatório de Química Experimental - Equilíbrio Químicoanardamasceno0% (1)
- Trabalho de Tecnologia IiДокумент14 страницTrabalho de Tecnologia IiAnatercia Dinis BangoОценок пока нет
- Relatório Tensão SuperficialДокумент13 страницRelatório Tensão SuperficialWagner ScheidtОценок пока нет
- Relatório Cinética QuímicasДокумент8 страницRelatório Cinética QuímicaspedroОценок пока нет
- LABTEST - BA 88A - Bioquímica 03-02-2014Документ52 страницыLABTEST - BA 88A - Bioquímica 03-02-2014Laboratorio de BioquimicaОценок пока нет
- Velocidade MédiaДокумент2 страницыVelocidade MédiaMariana CunhaОценок пока нет
- Diversidade Química Do Ambiente - Aula 14 - 587 PDFДокумент24 страницыDiversidade Química Do Ambiente - Aula 14 - 587 PDFCarlos Alberto de MendonçaОценок пока нет
- Relatório Cinética de Reaçao Persulfato-Iodeto - REACAo RelogioДокумент9 страницRelatório Cinética de Reaçao Persulfato-Iodeto - REACAo RelogioMichel Fonseca da SilvaОценок пока нет
- 1a - LISTA - EXERCICIOS - PROVA P1 - Reatores Quimicos I - 2018 - Noturno - UnifДокумент13 страниц1a - LISTA - EXERCICIOS - PROVA P1 - Reatores Quimicos I - 2018 - Noturno - UnifERICK GABRIEL DA CONCEICAOОценок пока нет
- Lista 05Документ4 страницыLista 05Nicole PacíficoОценок пока нет
- Lista de Exercicios Cinetica QuimicaДокумент4 страницыLista de Exercicios Cinetica QuimicaRodrigo MontesОценок пока нет
- Cinética Química Experiência - Concentração X TempoДокумент4 страницыCinética Química Experiência - Concentração X TempoÉrica LimaОценок пока нет
- Produção de Oxigenio Pela Decomposição Catalítica Do Peroxido de Hidrogenio Revisada ClaudioДокумент6 страницProdução de Oxigenio Pela Decomposição Catalítica Do Peroxido de Hidrogenio Revisada Claudiopernalonga100grОценок пока нет
- Didática - Plano de AulaДокумент12 страницDidática - Plano de AulaRaiana Canzian LimaОценок пока нет
- Relatório QEC 4Документ8 страницRelatório QEC 4Neu Pereira SantosОценок пока нет
- AVALIAÇÃO - Cinetica - 2º AnoДокумент3 страницыAVALIAÇÃO - Cinetica - 2º AnoLaiane AmericoОценок пока нет
- Lista de Exercícios Sobre Os Fundamentos Da Cinética EnzimáticaДокумент3 страницыLista de Exercícios Sobre Os Fundamentos Da Cinética EnzimáticaAldayr Melo100% (1)
- Artigo SBTA Cal e FilitoДокумент13 страницArtigo SBTA Cal e FilitoGrover GllОценок пока нет
- Reatores Lista1 LianaДокумент11 страницReatores Lista1 LianaAugusto PaesОценок пока нет
- EnzimasДокумент9 страницEnzimasFernando GabrielОценок пока нет
- Plano de Aula - Química Do ConcretoДокумент19 страницPlano de Aula - Química Do ConcretoCíntia MáximoОценок пока нет
- Cinética QuímicaДокумент27 страницCinética QuímicaPedro ThiessenОценок пока нет
- CinéticaДокумент2 страницыCinéticaPdb1 NTCОценок пока нет
- Prova Fisico Quima II Prova 3Документ4 страницыProva Fisico Quima II Prova 3ana beckertОценок пока нет
- Actividades Laboratoriais de Cinetica e ElectroquimicaДокумент43 страницыActividades Laboratoriais de Cinetica e ElectroquimicaDaqueuaho Afonso CalaveteОценок пока нет
- Questões de Cinética QuímicaДокумент5 страницQuestões de Cinética QuímicaAndré Luís Della VolpeОценок пока нет
- RELATÓRIO 1 - A Influência Da Concentração e Da Temperatura Na Velocidade Das ReaçõesДокумент12 страницRELATÓRIO 1 - A Influência Da Concentração e Da Temperatura Na Velocidade Das ReaçõesitalorodrigoqmcОценок пока нет
- Relatório 2: EFEITO DA CONCENTRAÇÃO E TEMPERATURA NA VELOCIDADE DE REAÇÃOДокумент9 страницRelatório 2: EFEITO DA CONCENTRAÇÃO E TEMPERATURA NA VELOCIDADE DE REAÇÃOVinicius MaquiavelОценок пока нет
- 07 - Cinética QuímicaДокумент6 страниц07 - Cinética QuímicaLindomar QuímicaОценок пока нет
- Aplicações Das Equações Diferenciais Jose, Daniel, JoãoДокумент9 страницAplicações Das Equações Diferenciais Jose, Daniel, JoãoJoão Vítor Fernandes DiasОценок пока нет
- MODELAGEMДокумент21 страницаMODELAGEMMarcelo SilvaОценок пока нет