Академический Документы
Профессиональный Документы
Культура Документы
Concentración Micelar Crítica El Documento
Загружено:
Fernanda MartinezОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Concentración Micelar Crítica El Documento
Загружено:
Fernanda MartinezАвторское право:
Доступные форматы
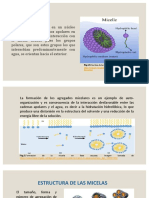
CMC (concentracin micelar crtica) Una micela es una formacin geomtrica de molculas que tienen una "cabeza" polar
y una "cola" de naturaleza no polar adheridas a un partcula o glbulo de una sustancia que se encuentra en un medio en el cual no es soluble. Un caso tpico de micela es la que forma el jabn en contacto con un glbulo de grasa adherido a un tejido. El jabn es en esencia una sal sdica de un cido graso que se obtiene mediante el proceso de saponificacin. Pues bien, la parte sdica de la molcula de jabn tiene caractersticas polares, es decir se disuelve en agua (que tambin es polar), mientras que la "cola" corresponde al resto de la cadena carbonada que es apolar y se disuelve en las grasas y aceites. Cuando lavamos un tejido con grasa, las colas de las molculas del jabn de disuelven y adhieren a las partculas de grasa mientras que la "cabeza" est disuelta y adherida al agua. Cuando la cantidad de colas de molculas han rodeado a la partcula de grasa es suficiente, estas son capaces de arrancarla del tejido y llevarla consigo arrastrada por el agua de lavado. Se ha formado una micela. En trminos menos exactos y ms coloquiales, las micelas son un forma aparente de "disolver" partculas en un medio en el cual no son solubles utilizando una suerte de "ganchos" que se clavan en la partcula mientras estn adheridos al mismo tiempo por el otro extremo al solvente. http://www.sabelotodo.org/quimica/micela.html
http://depa.fquim.unam.mx/amyd/archivero/CMCEcAdsGibbs_1826.pdf http://depa.fquim.unam.mx/fina/presenta/CMC.pdf
La concentracion micelar critica es un punto definido con precision para cada compuesto y se puede conocer mediante resonancia magnetica nuclear y otros metodos. Para tensioactivos ionicos el metodo mas sencillo y asequible es medir la conductividad molar () en funcion de la concentracion de tensioactivo, ya que depende directamente de la concentracion de la disolucion e inversamente de la concentracion de electrolito. Para obtener la CMC se utilizo la merocianina que es una molcula que posee una parte polar y una apolar que actuara como zonda, cambia su estructura de resonancia al estar unida a estructuras polares o apolares.
Tradicionalmente, se determina a partir del cambio de tendencia observado para diferentes propiedades como una funcin de la concentracin, entre ellas tensin superficial y conductividad elctrica. As mismo, la CMC depende de diversos factores, tales como la estructura del lquido inico, la forma en que se constituyen los agregados y las caractersticas del medio en el cual se solubiliza el lquido inico. 2 En este sentido, la temperatura y la presencia de sales afectan el proceso de agregacin. La relacin ms conocida entre la CMC y la estructura qumica de los surfactantes es la ecuacin de Stauff-Klevens, aplicable solamente a series homlogas. 3 Dicha ecuacin indica que existe una relacin logartmica entre la CMC y el nmero de tomos de carbono de la cadena alqulica:
Log CMC = A+Bn (1)donde A y B son constantes para una serie homloga particular y una temperatura dada, y n es el nmero de tomos de carbono de la cadena hidrocarbonada. Sin embargo, no existe hasta la fecha ninguna investigacin que haya estudiado de forma sistemtica el efecto del anin sobre la CMC. http://www.scielo.br/pdf/qn/v33n8/16.pdf El CMC es una caracterstica importante de un agente tensoactivo. Antes de llegar a la CMC, la tensin superficial cambia fuertemente con la concentracin del agente tensoactivo. Despus de alcanzar la CMC, la tensin superficial se mantiene relativamente constante o cambios de pendiente inferior. El valor de la CMC para un dispersante dado en un medio dado depende de la temperatura, la presin, y de la presencia y la concentracin de otras sustancias de superficie activa y electrolitos. Las micelas se forman slo sobre la temperatura crtica de micelas. http://centrodeartigos.com/articulos-para-saber-mas/article_42702.html http://www.firp.ula.ve/archivos/cuadernos/S201A.pdf En cuanto a las interacciones que desfavorecen la formacin de micelas, son de dos tipos. Primero aquellas que favorecen la solubilizacin monomolecular del surfactante en el agua, esencialmente por efecto de solvatacin del grupo polar. Cuando ms polar este grupo, menor la tendencia en formar micelas y por lo tanto mayor la CMC. El segundo efecto desfavorable a la formacin de micelas corresponde a las interacciones de tipo electrosttico que resultan en una repulsin entre las partes hidroflicas de las molculas de surfactantes asociadas en las micelas. Si las fuerzas de repulsin son demasiado grandes, las molculas no pueden acercarse suficientemente para que se produzca la interaccin hidrfoba entre grupos lipoflicos.
Вам также может понравиться
- Practica 3 FisicoquimicaДокумент7 страницPractica 3 FisicoquimicaQuique RosasОценок пока нет
- Valoración potenciométrica del ácido acético: determinación del pH en el punto de equivalenciaДокумент9 страницValoración potenciométrica del ácido acético: determinación del pH en el punto de equivalenciaGabriel lugoОценок пока нет
- Acido Oxalico y Carbon ActivadoДокумент11 страницAcido Oxalico y Carbon ActivadoSariita Espiinooza AlvaradoОценок пока нет
- Agentes TensoactivosДокумент11 страницAgentes TensoactivosAndres Polina ZuñigaОценок пока нет
- Determinación de La Concentración Micelar CriticaДокумент4 страницыDeterminación de La Concentración Micelar CriticaLorena VillarroelОценок пока нет
- Interfase Liquido - GasДокумент40 страницInterfase Liquido - GasDexhuj0% (1)
- Estudio Del Efecto de Cianuro y Determinación de Concentración Letal 50 en Artemias SalinasДокумент5 страницEstudio Del Efecto de Cianuro y Determinación de Concentración Letal 50 en Artemias SalinasReyes Martínez Pamela MontserrathОценок пока нет
- 2p Cinetica de Oxidacion de La Vitamina C Con Ferricianuro de Potasio PDFДокумент4 страницы2p Cinetica de Oxidacion de La Vitamina C Con Ferricianuro de Potasio PDFRuben FelipeОценок пока нет
- Obtención ácido fumárico cis-transДокумент4 страницыObtención ácido fumárico cis-transzackdricklОценок пока нет
- Experimental Feno No3Документ5 страницExperimental Feno No3casandra alvaradoОценок пока нет
- Reporte ViscosidadДокумент6 страницReporte ViscosidadJesus GuillenОценок пока нет
- Seminario 2 FisicoquimicaДокумент13 страницSeminario 2 FisicoquimicaAngel Santiago CabanzoОценок пока нет
- Formas de Expresar La ConcentraciónДокумент4 страницыFormas de Expresar La ConcentraciónleoespinoОценок пока нет
- Ley de Distribucion de NerstДокумент2 страницыLey de Distribucion de NerstMonica RiveraОценок пока нет
- Absorción de Ácido Acético Con Carbón ActivadoДокумент8 страницAbsorción de Ácido Acético Con Carbón ActivadoMariaElizabethSanchezОценок пока нет
- Espectrofotometría: Determinación concentración muestraДокумент5 страницEspectrofotometría: Determinación concentración muestraGerie AllccacoОценок пока нет
- Práctica N 5 - .Efecto Del Ión ComunДокумент4 страницыPráctica N 5 - .Efecto Del Ión ComunPiero RojasОценок пока нет
- Calor Diferencial de SoluciónДокумент4 страницыCalor Diferencial de SoluciónLuis Cifuentes IIОценок пока нет
- Actividad Superficial de Alcoholes AlifáticosДокумент3 страницыActividad Superficial de Alcoholes AlifáticosShyndellAyelénОценок пока нет
- Previo 1 Tension SupДокумент5 страницPrevio 1 Tension SupJose JesusОценок пока нет
- Reporte Solubilidad de Lípidos RDBMДокумент2 страницыReporte Solubilidad de Lípidos RDBMRicardo BenitezОценок пока нет
- Acetoacetato de EtiloДокумент5 страницAcetoacetato de Etilorenua21Оценок пока нет
- Isotermas de AdsorciónДокумент8 страницIsotermas de AdsorciónAnonymous ExcNQWv7PОценок пока нет
- CARTEL de La Práctica 4, NRC 13959Документ1 страницаCARTEL de La Práctica 4, NRC 13959Berenice Sanchez GalindoОценок пока нет
- 3MM2 Eq2 Pract6Документ15 страниц3MM2 Eq2 Pract6Karla OchoaОценок пока нет
- La Conductancia EquivalenteДокумент2 страницыLa Conductancia EquivalenteJose Sanchez100% (1)
- Determinación coeficiente partición ácido benzoicoДокумент10 страницDeterminación coeficiente partición ácido benzoicoDulzse Karynha XimenezОценок пока нет
- Cromatografía Del ColorДокумент5 страницCromatografía Del Colormiguel cordobaОценок пока нет
- Método DiferencialДокумент4 страницыMétodo DiferencialAlan RodríguezОценок пока нет
- Caídas de Presión en Tuberías (P7)Документ7 страницCaídas de Presión en Tuberías (P7)Josue HernandezОценок пока нет
- CoulombímetroДокумент3 страницыCoulombímetroJorge Lopez MendozaОценок пока нет
- Aplicaciones de La Electrosintesis de Compuestos Organicos e InorganicosДокумент2 страницыAplicaciones de La Electrosintesis de Compuestos Organicos e InorganicossantiagoОценок пока нет
- Propiedades cinéticas de sistemas coloidales II: Movimiento Browniano, difusión, ultracentrifugación y sedimentaciónДокумент6 страницPropiedades cinéticas de sistemas coloidales II: Movimiento Browniano, difusión, ultracentrifugación y sedimentaciónDaniel Horacio Mendoza CamarenaОценок пока нет
- Efecto de La Temperatura Sobre La Velocidad de ReacciónДокумент2 страницыEfecto de La Temperatura Sobre La Velocidad de ReacciónBren CooperОценок пока нет
- CuestionarioДокумент3 страницыCuestionarioCarlos Garcia100% (2)
- Una emELECTROДокумент1 страницаUna emELECTROjesus villalobosОценок пока нет
- Cuantificacion de Hierro en EspinacaДокумент8 страницCuantificacion de Hierro en EspinacaVladimir Quintero LeónОценок пока нет
- Práctica 1 - Cinética Por EspectrofotometríaДокумент9 страницPráctica 1 - Cinética Por EspectrofotometríaSoniaОценок пока нет
- Previo 4 - Lab. Orgánica I .CromatografíaДокумент17 страницPrevio 4 - Lab. Orgánica I .CromatografíaElizabeth0% (1)
- Reporte 1. Leyes de ElectrolisisДокумент8 страницReporte 1. Leyes de ElectrolisisKarla GarcíaОценок пока нет
- Previo B NerolinaДокумент6 страницPrevio B NerolinaRocioОценок пока нет
- Actividad 4Документ5 страницActividad 4Cherato Durán100% (1)
- Punto IsoeléctricoДокумент7 страницPunto IsoeléctricoZoiLa BakОценок пока нет
- Previo FELOFTALEÍNA Y FLUORESCEÍNAДокумент5 страницPrevio FELOFTALEÍNA Y FLUORESCEÍNASofíaManjarrezОценок пока нет
- Informe Coeficiente de Reparto RealДокумент20 страницInforme Coeficiente de Reparto RealDaniel MoralesОценок пока нет
- MitocondriasДокумент6 страницMitocondriasDianaBGОценок пока нет
- Balance de Materia Con Reaccion Quimica Hidratacion de Anhidrido AceticoДокумент9 страницBalance de Materia Con Reaccion Quimica Hidratacion de Anhidrido AceticoANAHI ALVARADO TOLENETINOОценок пока нет
- Métodos de medición de tensión superficialДокумент5 страницMétodos de medición de tensión superficialRousalkaОценок пока нет
- Formato Informe de Laboratorio BQDДокумент68 страницFormato Informe de Laboratorio BQDCarlos CastilloОценок пока нет
- Determinación tensión superficial líquidos purosДокумент6 страницDeterminación tensión superficial líquidos purosdany_289Оценок пока нет
- Yodacion-De-Acetona Muy DetalladoДокумент10 страницYodacion-De-Acetona Muy DetalladoPablo Reinado100% (1)
- Reporte Alquenos AlquinosДокумент8 страницReporte Alquenos AlquinosFredy HDОценок пока нет
- Práctica: Recristalización Del Ácido PícricoДокумент3 страницыPráctica: Recristalización Del Ácido PícricoFernanda GómezОценок пока нет
- Descomposición Catalítica Del Peróxido de HidrógenoДокумент6 страницDescomposición Catalítica Del Peróxido de Hidrógenocharalito123Оценок пока нет
- Determinación de HCl mediante valoración conductimétricaДокумент6 страницDeterminación de HCl mediante valoración conductimétricaJexsy Mata MillánОценок пока нет
- E3P3M1012Документ18 страницE3P3M1012Floriano YusselОценок пока нет
- Micelas: Fig.1.Estructura de La Micela Imagen Tomada deДокумент7 страницMicelas: Fig.1.Estructura de La Micela Imagen Tomada dePATRICIA ROSARIO SANTANDER SALASОценок пока нет
- Tensión Superficial y Catálisis.Документ19 страницTensión Superficial y Catálisis.Marta Blanco RíoОценок пока нет
- CMC Por ConductividadДокумент8 страницCMC Por ConductividadJefferson CobaОценок пока нет
- Formación micelas crudos pesadosДокумент2 страницыFormación micelas crudos pesadosKevin Andrès100% (1)
- Area Bajo La CurvaДокумент3 страницыArea Bajo La CurvaFernanda MartinezОценок пока нет
- Medios de CultivoДокумент3 страницыMedios de CultivoFernanda MartinezОценок пока нет
- Review ArticulosДокумент9 страницReview ArticulosFernanda MartinezОценок пока нет
- Estudio de BioequivalenciaДокумент33 страницыEstudio de BioequivalenciaFernanda MartinezОценок пока нет
- Practica de TermodinamicaДокумент7 страницPractica de TermodinamicaFernanda MartinezОценок пока нет
- Hemato Prac 3 - 2 y Previo 4Документ5 страницHemato Prac 3 - 2 y Previo 4Fernanda MartinezОценок пока нет
- AhorroДокумент4 страницыAhorroFernanda MartinezОценок пока нет
- Cómo Agrego Hipervínculos y Como Los AbroДокумент8 страницCómo Agrego Hipervínculos y Como Los AbroFernanda MartinezОценок пока нет
- Condensación de Claisen-SchmidtДокумент2 страницыCondensación de Claisen-SchmidtFernanda MartinezОценок пока нет
- Determinación Del Efecto Hipoglucemiante de La Insulina y La Glibenclamida en RatasДокумент4 страницыDeterminación Del Efecto Hipoglucemiante de La Insulina y La Glibenclamida en RatasFernanda MartinezОценок пока нет
- REPORTE 4. Grasa Cruda y Proteína CrudaДокумент5 страницREPORTE 4. Grasa Cruda y Proteína CrudaFernanda MartinezОценок пока нет
- Práctica 2. Estudio Cinético Efecto de La Fuerza Iónica y El PHДокумент21 страницаPráctica 2. Estudio Cinético Efecto de La Fuerza Iónica y El PHFernanda Martinez100% (1)
- Las Mejores Ideas de Negocios RentablesДокумент20 страницLas Mejores Ideas de Negocios RentablesFernanda MartinezОценок пока нет
- E1. Hidrólisis de Carbohidratos (Mecanismo, Resultados y Conclusiones)Документ6 страницE1. Hidrólisis de Carbohidratos (Mecanismo, Resultados y Conclusiones)Fernanda MartinezОценок пока нет
- Protocolo de Validación Del Proceso de FabricaciónДокумент10 страницProtocolo de Validación Del Proceso de FabricaciónFernanda Martinez89% (9)
- Protocolo de Validación Del Proceso de FabricaciónДокумент6 страницProtocolo de Validación Del Proceso de FabricaciónFernanda Martinez67% (3)
- Practica 9 (QG2)Документ5 страницPractica 9 (QG2)Fernanda MartinezОценок пока нет
- Monitoreo Del Proceso de Purificación de LDH 2014-1Документ11 страницMonitoreo Del Proceso de Purificación de LDH 2014-1Fernanda MartinezОценок пока нет
- Tec Farm - Supositorios - D D Flujo y PrevioДокумент2 страницыTec Farm - Supositorios - D D Flujo y PrevioFernanda MartinezОценок пока нет
- Isomeria de AbsorciónДокумент11 страницIsomeria de AbsorciónFernanda MartinezОценок пока нет
- Curvas Temporales y Tabla de PurificaciónДокумент5 страницCurvas Temporales y Tabla de PurificaciónFernanda MartinezОценок пока нет
- Reoceptico (Disolucion)Документ7 страницReoceptico (Disolucion)Fernanda MartinezОценок пока нет
- Fluidos No NeutonianosДокумент9 страницFluidos No NeutonianosFernanda MartinezОценок пока нет
- Precentacion Expo Inmuno 2Документ7 страницPrecentacion Expo Inmuno 2Fernanda MartinezОценок пока нет
- Calibracion de Una BuretaДокумент1 страницаCalibracion de Una BuretaFernanda MartinezОценок пока нет
- Preparación de Muestras IrДокумент4 страницыPreparación de Muestras IrFernanda Martinez100% (2)
- Proceso de Un LimonenoДокумент1 страницаProceso de Un LimonenoFernanda MartinezОценок пока нет
- ISO22716Документ9 страницISO22716Fernanda MartinezОценок пока нет
- Balance de Materia Con Reacciones QuimicaДокумент7 страницBalance de Materia Con Reacciones QuimicaFernanda MartinezОценок пока нет
- Cromatografia en Capa FinaДокумент3 страницыCromatografia en Capa FinaFernanda MartinezОценок пока нет
- Plantas de tratamiento de agua potableДокумент7 страницPlantas de tratamiento de agua potableacronimus1Оценок пока нет
- Asfalto VegetalДокумент42 страницыAsfalto VegetalJESULОценок пока нет
- SRC Edu234 Modulos Estatico PDF 62d952a31cf2c291464299Документ23 страницыSRC Edu234 Modulos Estatico PDF 62d952a31cf2c291464299miguel angel guaniloОценок пока нет
- Carlitos XDДокумент7 страницCarlitos XDOcampo Uribe JulhinaОценок пока нет
- INFORME DE LABORATORIO DECIMO B (2) La Importancia de La Quimica en La Vida DiariaДокумент7 страницINFORME DE LABORATORIO DECIMO B (2) La Importancia de La Quimica en La Vida DiariaEmely Alexandra Velasquez SuazoОценок пока нет
- Parte ExperimentalДокумент3 страницыParte ExperimentalPamelaAltamiranoОценок пока нет
- Cpi Dd-080 FichaДокумент2 страницыCpi Dd-080 FichaAlejandroMuñozОценок пока нет
- Sulfato de CalcioДокумент19 страницSulfato de CalcioalexanderОценок пока нет
- Cloruro Sódico y Su FormaciónДокумент5 страницCloruro Sódico y Su FormaciónJimmy Victorino CezpedezОценок пока нет
- Reduccion de La VainillinaДокумент2 страницыReduccion de La VainillinaMishel MijaresОценок пока нет
- Procesos de manufactura PM: ventajas, desventajas y aplicacionesДокумент5 страницProcesos de manufactura PM: ventajas, desventajas y aplicacionesPAUL SHIRILLAОценок пока нет
- PAEPA - MODELOS ATÓMICOS - Editorial SantillanaДокумент7 страницPAEPA - MODELOS ATÓMICOS - Editorial SantillanaShirley FloresОценок пока нет
- Importancia Del Agua en Los Procesos Bioquimicos - RecortadoДокумент88 страницImportancia Del Agua en Los Procesos Bioquimicos - RecortadoCarolina Lavalle Castillo100% (1)
- METABOLITOS PRIMARIOS Y SECUNDARIOS EN PLANTASДокумент7 страницMETABOLITOS PRIMARIOS Y SECUNDARIOS EN PLANTASKelly Panduro HoyosОценок пока нет
- U7 M2 HidrocarburosДокумент10 страницU7 M2 HidrocarburosRICARDO MANCILLAОценок пока нет
- Minerales TóxicosДокумент13 страницMinerales TóxicosGeorge AgamaОценок пока нет
- Riesgos Asociados A Envases y EmbalajesДокумент8 страницRiesgos Asociados A Envases y EmbalajesAna Bella Castro GavidiaОценок пока нет
- Consulta Maquinas de PolimerizacionДокумент12 страницConsulta Maquinas de PolimerizacionChristian CanchigniaОценок пока нет
- Gravimetría 2012Документ42 страницыGravimetría 2012Scarlette BalRo0% (2)
- Catalogo Productos LedДокумент27 страницCatalogo Productos Leddanilonav100% (1)
- Irrigación, Medicación y Obturación de Conductos Endodónticos.Документ5 страницIrrigación, Medicación y Obturación de Conductos Endodónticos.Sabrina SpellmanОценок пока нет
- Humus Liquido PDFДокумент50 страницHumus Liquido PDFFlavioTeixeiraОценок пока нет
- Composición Física Aguas NegrasДокумент2 страницыComposición Física Aguas NegrasAngelo Renato Lazo ParedesОценок пока нет
- La composición química de la gelatina fotográficaДокумент5 страницLa composición química de la gelatina fotográficaEsto Es Un Loop TeatroОценок пока нет
- Microestructuras en Los MaterialesДокумент57 страницMicroestructuras en Los MaterialesSteven Camilo IbarraОценок пока нет
- Procesos UnitariosДокумент2 страницыProcesos UnitariosFrancisco MelendezОценок пока нет
- Analitica Laboratorio 8Документ10 страницAnalitica Laboratorio 8Anonymous VcB5hZОценок пока нет
- Determinación Del Momento Dipolar Del 1,4-Dioxano y El P-NitrobencenoДокумент3 страницыDeterminación Del Momento Dipolar Del 1,4-Dioxano y El P-NitrobencenoKte WinaОценок пока нет
- GUIA 3 Profundizacion Tabla PeriodicaДокумент9 страницGUIA 3 Profundizacion Tabla Periodicajhonatan ochoaОценок пока нет
- Informe9 bq2Документ15 страницInforme9 bq2Jennifer CordobaОценок пока нет