Академический Документы
Профессиональный Документы
Культура Документы
Equilibrioentrefasescondensadas
Загружено:
Axel UrbinaАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Equilibrioentrefasescondensadas
Загружено:
Axel UrbinaАвторское право:
Доступные форматы
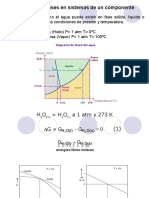
Equilibrio Lquido-Lquido En un sistema binario en fase lquida, Se tiene que es un lquido A puro y la otra fase una solucin saturada
de A en el lquido B. Se tiene que:
En una solucin ideal sera:
Los lquidos que son parcialmente miscibles forman soluciones reales( estn alejadas del comportamiento ideal de la solucin). La solubilidad de una solucin aumenta al aumentar la temperatura
En lagrficaa (sistema agua- Fenol), es un diagrama T vs X, se muestra como las curvas de solubilidad se unen a la temperatura critica de solucion, cualquier punto por encima de Tc dice que el agua y fenol son completamente miscibles. Entonces lo que est por debajo nos dice que de dos capas lquidas. Aunque llegan a existir sistemas que reducen su solubilidad al aumentar la temperatura como se muestra en el diagrama siguiente
En el diagrama de la nicotina se tiene una temperatura de consolucion inferior y una temperatura consolucion superior y lo que este afuera de esta curva representa un estado homogneo del sistema, entonces dentro de esta se encontrarn dos fases lquidas DESTILACION DE LIQUIDOS INMISCIBLES Y PARCIALMENTE MISCIBLES La miscibilidad parcial en temperatura bajas por lo general crea azetropos de ebullicin mnima aunque no siempre se cumple esto. La miscibilidad parcial dice que al mezclarse dos componentes tienen una mayor tendencia a evaporarse que en una solucin ideal. Si se disminuye la presin en el sistema indicado las temperaturas de ebullicin disminuirn. Cuando las presiones son suficientemente bajas las curvas de temperatura de ebullicin se insectaran con las curvas de solubilidad del liquido- liquido
Cuando se calienta un sistema de dos fases en el intervalo f y h entonces en tse encuentran presentes los lquidos f y g, entonces aparece el vapor h. En el punto h tiene la propiedad azeotrpica, en sistema de esta composicin destila sin cambiar. No puede separarse en sus componentes mediante destilacin. La destilacin de sustancias inmiscibles es ms fcil de analizar; la presin total de vapor es la suma de las presiones de vapor de los lquidos puros
EQUILIBRIO SLIDO-LQUIDO Si una solucin lquida de dos sustancias A y B se enfra lo suficiente, aparecer un slido. Entonces esta temperatura ser el punto de congelacin y esta depender de la composicin.
Los puntos sobre la curva representan estados lquidos del sistema, y los que estan por debajo representan estados en los cuales coexisten. Esta curva no puede representar la situacin en todo el intervalo de composicin. En la medida en que Xb se aproxima a 1,se esperara a congelacin del slido B, si la solucin es ideal la misma ecuacin es vlida para B:
La cantidad de lquido disminuye en tanto aumentan las dos fases slidas presentes; los puntos bajo la lnea DEF representan los estados del sistema en los cuales estn presentes solo los slido A y B. SISTEMAS EUTCTICOS SIMPLES La invariancia del sistema en la temperatura eutctica permite el empleo de mezclas eutcticas como baos de temperatura constante. Poniendo el sistema de cloruro de sodio con hielo en un recipiente evacuado a una temperatura de 0 C , en este caso el valor de la composicin NaCl se desplaza de 0% a algn valor positivo, la composicin disminuye la temperatura de congelacin por debajo de 0C por lo que funde un poco el hielo, si se aade la suficiente cantidad NaCl la temperatura decendera a la eutctica que es de - 21.1C en este punto coexisten en el equilibrio el hielo, sal solida y la solucin saturada.
DIAGRAMA DE TEMPERATURA DE CONGELACIN CON FORMACIN DE COMPUESTO Si dos sustancias forman uno o ms compuestos, el diagrama de temperaturas de congelacin muchas veces tiende a tener la apariencia de dos o ms diagramas eutcticos.
En el diagrama anterior se puede tomar como dos diagramas eutcticos simples unidos en donde marcan las flechas. Un mximo en la curva de temperatura de fusin de composicin casi siempre indica formacin de un compuesto. Tambin es posible que se formen ms de un compuesto entre las dos sustancias; este sera el caso de agua con sales.
COMPUESTOS CON TEMPERATURA DE FUSIN INCONGRUENTES
En el caso de este sistema, la curva de solubilidad de sodio no desciende lo suficientemente rpido como para intersectarse con la otra curva entre la composicin de Na2 K y Na puro, este se desva hacia la izquierda de la composicin Na2 K y se intersecta con la otra curva de solubilidad en el punto c, punto peritctico, la ecuacin que describe esto es:
Na2 K(s) Na(s) + c(l) Esta es una reaccin de fase, Se dice que el compuesto funde incongruentemente, ya que la mezcla fundida difiere en composicin del compuesto. Como hay tres fases presentes, el sistema es invariante; conforme se suministra calor al sistema la temperatura permanece constante hasta que funde completamente el compuesto slido. Si se enfra un sistema de composicin i, se forman en j cristales primarios de sodio. La composicin del lquido se desplaza a lo largo de jc a medida que se cristaliza ms sodio y en k se forma Na2 K slido, por la reaccin peritctica. Aunque la cantidad de sodio en la composicin i es insuficiente para convertir totalmente el lquido c en compuesto. Despus de haberse consumido el sodio, la temperatura desciende, cristaliza Na2 K y la composicin del lquido se desplaza a lo largo de cm. Cuando la temperatura alcanza el estado o, empieza cristalizar potasio puro y el lquido tiene la composicin eutctica p y el sistema se hace invariante hasta la desaparicin de la fase lquida.
MISCIBILIDAD EN EL ESTADO SLIDO
En esta grafica la curva superior es del lquido y la inferior es del slido. la interpretacin de la grfica es anloga la del lquido- vapor. El primer cristal tendra la composicin c, formando capas con composiciones de c hasta e en el exterior del primer cristal. El slido es ms rico en nquel de lo que debera de ser y se sita a la derecha de e. El lquido es ms rico en cobre de
lo normal y su temperatura de composicin se sita cerca de g, esto deja un cierto residuo de lquido por lo que necesita enfriamiento para que se solidifique totalmente. La mezcla de composicin correspondiente a un mximo o a un mnimo de la curva, funde relativamente ms rpido y parece una sustancia pura como un azetropo que hierve a una temperatura definida y destila sin cambiar aunque este tipo de mezclas son relativamente escasas. AUMENTO DE LA TEMPERATURA DE SOLIDIFICACIN El aumento en la temperatura de fusin puede producirse nicamente si el slido en equilibrio con el lquido no es puro sino una solucin slida Suponiendo que en el equilibrio de la solucin slida y solucin lquida los dos se comporten de manera ideal, la condicin de equilibrio sera
Resolviendo para obtener la temperatura
En esta ecuacin si estuviera presente el slido puro, entonces x1(s) sera igual a 1, entonces el segundo denominador sera positivo haciendo la fraccin entre corchetes menor que la unidad, de esta manera la temperatura de solidificacin sera menor.
MISCIBILIDAD PARCIAL EN EL ESTADO SLIDO Dos sustancias en estado slido normalmente no son completamente miscibles ni inmiscibles, cada sustancia tiene una solubilidad limitada.
Los puntos en la regin de x describen soluciones slidas de B en A mientras que los esten en la regin de beta son soluciones de A en B. Entonces en la regin x + describen estados en el que las dos soluciones saturadas coexisten.
En este sistema, se tiene un punto de transicin en vez de un punto eutctico. Un punto situado por encima de la lnea abc describe un sistema invariante en el que coexisten x, Beta y fundido de composicin c. La temperatura de abc es la temperatura de transicin. El enfriamiento producir la desaparicin de la mezcla
EQUILIBRIO GAS- SLIDO PRESIN DE VAPOR DE SALES HIDRATADAS A presiones bajas, si uno o varios de los componentes es voltil puede existir vapor en el equilibrio.
El diagrama representa esquemticamente la presin de vapor en funcin de la concentracin de sulfato de cobre, mientras ms sulfato de cobre aadimos al agua liquida la presion de vapor disminuye a lo largo de la curva ab. El establecimiento de un presin constante en un sistema de hidrato de sal requiere la presencia de tres fases, un hidrato simple no tiene una presin definida.
SISTEMAS DE TRES COMPONENTES En un sistema de tres componentes, los grados de libertad son F-3- P+2=5. No es posible dar una representacin grfica completa de esto sistemas en tres dimensiones y mucho menos en dos por eso se acostumbra representar estos sistemas a presin y temperatura constantes. Des esta manera el sistema tiene mximo dos variables y puede ser representado en el plano.
Los puntos A,B,C de los vrtices del tringulo representan el 100% de cada componente.
Si se mezclan dos sistemas cuyas composiciones estn representadas P y Q. la composicin de la mezcla obtenida estar representada por un punto x en cualquier parte de la lnea que une los puntos P y Q. Todos los sistemas representados por puntos sobre una lnea a travs de un vrtice contienen los otros dos componentes en la misma relacin.
EQUILIBRIO LQUIDO-LQUIDO En el sistema de cloroformo, agua y cido actico
En los puntos a y b representan las fases lquidas conjugadas en ausencia de cido actico, si se aade un poco de cido actico la composicin se desplaza a lo largo de la lnea que une con el vrtice del cido actico. Las lineas de union no son paralelas , el punto en el cual las dos soluciones conjugadas tienen la misma composicin no est situado encima de la curva binodal, sino en el punto k. Si la temperatura aumenta, se altera la extensin y la forma de la regin bifsica. Si dos de los pares A-B y B-C son parcialmente miscibles, puede aparecer dos curvas binodales, a temperaturas bajas pueden solaparse las dos curvas binodales .
SOLUBILIDAD DE LAS SALES. EFECTO DEL ION COMN En sistemas as cada sal influye sobre la solubilidad de la otra.
Los puntos entre A y a representan diferentes cantidades de NH4Cl slido en equilibrio con la solucin saturada a. los puntos entre a y C representan la solucin no saturada de NH4Cl. La presencia de (NH4)2SO4 cambia la solubilidad del NH4Cl a lo largo de la lnea ac, mientras que este lo afecta a lo largo de la lnea bc.
Las lneas de unin conectan la composicin de la solucin saturada y del slido en equilibrio con esta. FORMACIN DE SALES DOBLES Puede pasar que las dos sales formen un compuesto, una sal doble, en este caso la solubilidad del compuesto puede aparecer como una lnea de equilibrio en el diagrama.
La diferencia de comportamiento de los dos sistemas puede demostrarse de dos maneras. Primero comenzamos con el compuesto slido y aadimos agua, el punto de estado se empieza a desplazar a lo largo de DC , por tanto se dice que el compuesto se esta saturando congruentemente.La adicion de agua descompones, por tanto el compuesto en un slido A y una solucin. Se dice que ese compuesto se satura incongruentemente. MTODO DE LOS RESIDUOS HMEDOS La determinacin de la curvas de equilibrio en sistemas de tres componentes es en algunos aspectos ms sencilla que en sistemas de dos componentes. El mtodo de los residuos hmedos es superior al procedimiento empleado en sistemas de ms de dos componentes, donde la fase lquida y slida se deben separar y analizar individualmente. A menudo que se aada una tercera sustancia a un sistema de dos componentes, determinar la lneas de equilibrio y la composicin de la fases slidas por el mtodo de residuos hmedos y deducir la composicin del slido en el sistema de dos componentes por las caractersticas del diagrama triangular,
Вам также может понравиться
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesОт EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesОценок пока нет
- Equilibrio Entre FasesДокумент11 страницEquilibrio Entre FasesAnly MendozaОценок пока нет
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSОт EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSРейтинг: 4.5 из 5 звезд4.5/5 (7)
- Equilibrio Sólido-LíquidoДокумент4 страницыEquilibrio Sólido-LíquidoGalaHidalgo75% (4)
- Equilibrio Líquido Líquido y Sólido LíquidoДокумент21 страницаEquilibrio Líquido Líquido y Sólido LíquidoEsteban AmadorОценок пока нет
- Mezcla EutecticaДокумент25 страницMezcla EutecticaTania Mireya VillarroelОценок пока нет
- Destilacion de Liquidos Parcialmente MisciblesДокумент2 страницыDestilacion de Liquidos Parcialmente MisciblesElizabeth RamosОценок пока нет
- Mezcla EutéticaДокумент15 страницMezcla EutéticaDacia A. Flores OjedaОценок пока нет
- Resumen Capitulo 15Документ12 страницResumen Capitulo 15juan islasОценок пока нет
- Equilibrio Sólido LíquidoДокумент17 страницEquilibrio Sólido LíquidoJuan Cristobal HdzОценок пока нет
- Mezcla Eutect HДокумент19 страницMezcla Eutect HDavid QuispeОценок пока нет
- Diagrama de FasesДокумент7 страницDiagrama de Fasesyorgelis angelОценок пока нет
- Practica #2 Lineas de EquilibrioДокумент15 страницPractica #2 Lineas de EquilibrioErikaCorderoLópezОценок пока нет
- Diagramas Líquido VaporДокумент2 страницыDiagramas Líquido VaporLuis FlogОценок пока нет
- Diagramas de Fase y Grados de Libertad.1Документ6 страницDiagramas de Fase y Grados de Libertad.1Alicia Peñaranda100% (1)
- Quimica (Diagrama y EnLaces)Документ3 страницыQuimica (Diagrama y EnLaces)Eduardo GarcíaОценок пока нет
- Ciencia de Los Materiales. Diagrama de FasesДокумент10 страницCiencia de Los Materiales. Diagrama de FasesFelipe Balboa PolancoОценок пока нет
- Reacción 6lk5bvolátilДокумент34 страницыReacción 6lk5bvolátilXimena GutierrezОценок пока нет
- Diagrama de Fases o Diagrama de Equilibrio 1 PDFДокумент16 страницDiagrama de Fases o Diagrama de Equilibrio 1 PDFSylvia RodriguezОценок пока нет
- Mezcla Eutéctica GuiaДокумент6 страницMezcla Eutéctica GuiaUluri JoelОценок пока нет
- Diagramas de Fase Con TextoДокумент13 страницDiagramas de Fase Con TextoFernanda PascacioОценок пока нет
- Energía en Los Cambios QuímicosДокумент12 страницEnergía en Los Cambios QuímicossofiaОценок пока нет
- Resumen Cap 16Документ4 страницыResumen Cap 16Patricia LeónОценок пока нет
- Informe de Diagrama de Fases U5 GjpsДокумент16 страницInforme de Diagrama de Fases U5 Gjpsjose jose prieto santanaОценок пока нет
- Diagrama Eutectico Simple ExplicacionДокумент8 страницDiagrama Eutectico Simple ExplicacionJro Prz MntsОценок пока нет
- Actividad 10 Diagrama de FasesДокумент8 страницActividad 10 Diagrama de FasesCitlaly Montalvo100% (1)
- Fases de Transformaciones de Los MetalesДокумент8 страницFases de Transformaciones de Los MetalesbryanОценок пока нет
- Equilibrio QuimicoДокумент8 страницEquilibrio QuimicoDennis LinoОценок пока нет
- Equilibrio Sólido-LíquidoДокумент17 страницEquilibrio Sólido-LíquidoJuan Cristobal HdzОценок пока нет
- Tres ComponentesДокумент11 страницTres ComponentesJoel ArismendiОценок пока нет
- Mezclas de FasesДокумент12 страницMezclas de FasesMartín TapiaОценок пока нет
- Mezcla EuteticaДокумент17 страницMezcla EuteticaAnonymous XqOKlg0% (1)
- Equilibrio Líquido LíquidoДокумент14 страницEquilibrio Líquido LíquidoISABELLAОценок пока нет
- Diagramas de Fases Binarios NocionesДокумент14 страницDiagramas de Fases Binarios NocionesJosué LeónОценок пока нет
- Diagramas de FaseДокумент22 страницыDiagramas de Fasenuwanda646Оценок пока нет
- Diagrama de Fases L-L-Parc Miscibles Fico Ii (27-10-22)Документ5 страницDiagrama de Fases L-L-Parc Miscibles Fico Ii (27-10-22)DJ79Оценок пока нет
- Solido LiquidoДокумент17 страницSolido LiquidoRaque PcОценок пока нет
- Resumen Capitulo 15 CastellanДокумент30 страницResumen Capitulo 15 CastellanAlejandro Garcia GarciaОценок пока нет
- Equilibrio Líquido Vapor FisicoquimicaДокумент6 страницEquilibrio Líquido Vapor Fisicoquimicamelina0% (1)
- Informe 05 (1) FQДокумент13 страницInforme 05 (1) FQZuleyka Leyza LinoОценок пока нет
- Mezcla EutecticaДокумент16 страницMezcla EutecticaJoel ArismendiОценок пока нет
- Diagrama Eutectico SimpleДокумент6 страницDiagrama Eutectico SimpleJhon LeonОценок пока нет
- Curvas de EnfriamientoДокумент9 страницCurvas de EnfriamientomarzinusОценок пока нет
- Miscibilidad Parcial y Total Entre SólidosДокумент27 страницMiscibilidad Parcial y Total Entre SólidosAndrés Méndez EscurraОценок пока нет
- Destilación FraccionadaДокумент34 страницыDestilación FraccionadaAndrés Méndez EscurraОценок пока нет
- Sistemas de Tres LíquidosДокумент8 страницSistemas de Tres LíquidosevelinОценок пока нет
- Destilacion BinariaДокумент23 страницыDestilacion BinariaJacson Rios OjanamaОценок пока нет
- DestilacionДокумент9 страницDestilacionninrodОценок пока нет
- Sistema Termodinamica InformeДокумент22 страницыSistema Termodinamica InformeGénesis NrvzОценок пока нет
- Diagrama de FasesДокумент12 страницDiagrama de FasesJason Q. CruzОценок пока нет
- Diagrama de FasesДокумент26 страницDiagrama de FasesElizabeth Marlene LópezОценок пока нет
- Equilibrio Liquido VaporДокумент6 страницEquilibrio Liquido VaporAlexChacónОценок пока нет
- Relaciones de Maxwell y DiagramasДокумент8 страницRelaciones de Maxwell y DiagramasHeriibertooОценок пока нет
- Diagramas de Fases BinlollllariosДокумент76 страницDiagramas de Fases BinlollllariosEsteban Muñoz SalazarОценок пока нет
- Curvas de EquilibrioДокумент3 страницыCurvas de EquilibrioLizz SaavedraОценок пока нет
- Practica #5. Equilibrio Liquido-Liquido MiscibilidadДокумент7 страницPractica #5. Equilibrio Liquido-Liquido MiscibilidadChiquinquira AnguloОценок пока нет
- Diagramas T-X y Destilación Fraccionada para Colgar PDFДокумент10 страницDiagramas T-X y Destilación Fraccionada para Colgar PDFMónica González0% (1)
- 4to Lab Fisicoquimica-Temperatura de La Soluciu00F3nДокумент4 страницы4to Lab Fisicoquimica-Temperatura de La Soluciu00F3nSoledad Stacy Flores PantojaОценок пока нет
- Metalurgia 4 I y II Tipo de AleacionesДокумент10 страницMetalurgia 4 I y II Tipo de AleacionesHugo Castillo AguilarОценок пока нет
- MARCO TEÓRICO para Enviar Sol-LiqДокумент5 страницMARCO TEÓRICO para Enviar Sol-LiqafsasfОценок пока нет
- Legislación Industrial Letra de CambioДокумент8 страницLegislación Industrial Letra de CambioAxel UrbinaОценок пока нет
- Seminario de Fosfato Teoria PDFДокумент10 страницSeminario de Fosfato Teoria PDFcartarОценок пока нет
- Apuntes de Patología GeneralДокумент83 страницыApuntes de Patología GeneralAxel UrbinaОценок пока нет
- Balance de Materia y Energía en Un EvaporadorДокумент6 страницBalance de Materia y Energía en Un EvaporadorAxel Urbina100% (1)
- Energia Libre de GibbsДокумент5 страницEnergia Libre de GibbsAxel UrbinaОценок пока нет
- Resumen Calor y FríoДокумент11 страницResumen Calor y FríoRaúl ArroyoОценок пока нет
- Sonda de Prandtl y Tubo Vénturi (Práctica)Документ9 страницSonda de Prandtl y Tubo Vénturi (Práctica)Osiris Michael EspinosaОценок пока нет
- Cat NE-4-45-75-113-150-4 PDFДокумент3 страницыCat NE-4-45-75-113-150-4 PDFFrancisco Muñoz MartinezОценок пока нет
- LalalalaДокумент22 страницыLalalalaVictorBorboaОценок пока нет
- Densidad de Los LiquidosДокумент4 страницыDensidad de Los Liquidosrosali maurate fernandezОценок пока нет
- Etiqueta para Productos Químicos2Документ1 страницаEtiqueta para Productos Químicos2Paula Emilia Fajardo SilgadoОценок пока нет
- Sarta de VelocidadДокумент13 страницSarta de VelocidadOctavio gomezОценок пока нет
- Propuesta de Un Plan Manejo de Desechos Peligrosos en Ecuavia S.A 8 FINALДокумент45 страницPropuesta de Un Plan Manejo de Desechos Peligrosos en Ecuavia S.A 8 FINALkevin ronquilloОценок пока нет
- Ingenieria de Vacio en Fabricas de PapelДокумент17 страницIngenieria de Vacio en Fabricas de PapelDiana Katherine Rios GalvisОценок пока нет
- Congeladores Liquidos ImprimirДокумент5 страницCongeladores Liquidos ImprimirLeonardo VacaОценок пока нет
- FWKOДокумент17 страницFWKOFABGOILMAN0% (1)
- HIDROSTÁTICAДокумент12 страницHIDROSTÁTICANatalia Soledad Pennini FADU - UBAОценок пока нет
- Carta de PlasticidadДокумент6 страницCarta de PlasticidadDer MetzОценок пока нет
- Toretto - SDS MXДокумент13 страницToretto - SDS MXavo avoОценок пока нет
- Laboratorio N°2 Remoción de Anhidrido Carbónico Por El Método de GoteoДокумент14 страницLaboratorio N°2 Remoción de Anhidrido Carbónico Por El Método de GoteoCesarОценок пока нет
- Propiedades Termodinámicas de Un Fluido PDFДокумент13 страницPropiedades Termodinámicas de Un Fluido PDFMarcela TapiasОценок пока нет
- Proceso de Separación Del GasДокумент7 страницProceso de Separación Del Gasrafael100% (1)
- TesisДокумент35 страницTesisJanet LopezОценок пока нет
- La Extracción Es Una de Las Operaciones Básicas Del LaboratorioДокумент3 страницыLa Extracción Es Una de Las Operaciones Básicas Del LaboratorioAntonella HuizafОценок пока нет
- Guía de Problemas Sobre Hidrodinámica.Документ5 страницGuía de Problemas Sobre Hidrodinámica.Amaya AlejandroОценок пока нет
- Informe de Teorema de TorricelliДокумент5 страницInforme de Teorema de Torricellicamilaamado44% (9)
- Flujo Multifasico en Tuberias VerticalesДокумент67 страницFlujo Multifasico en Tuberias VerticalesCristopher Infante QuinterosОценок пока нет
- 14 - Simulador de Un Evaporador de Simple Efecto, para Concentrar Jugos de Frutas y LecheДокумент159 страниц14 - Simulador de Un Evaporador de Simple Efecto, para Concentrar Jugos de Frutas y LecheWilsonMamaniQuispeОценок пока нет
- Tension SuperficialДокумент4 страницыTension SuperficialMadeli Ruiz VásquezОценок пока нет
- Lubricantes y GrasasДокумент6 страницLubricantes y GrasasJorge ReynaОценок пока нет
- Ficha Técnica Cambios Físicos y QuímicosДокумент2 страницыFicha Técnica Cambios Físicos y QuímicosAnais Gonzales NonajulcaОценок пока нет
- Problemas ResueltosДокумент5 страницProblemas ResueltosEmilys65% (34)
- Tesis Pruebas de Presion PDFДокумент133 страницыTesis Pruebas de Presion PDFRuben Diaz JuarezОценок пока нет
- 07PP - Esfuerzo y Deformaciones - Rigido - KENSLABSДокумент25 страниц07PP - Esfuerzo y Deformaciones - Rigido - KENSLABSAdriánÁvilaSarmientoОценок пока нет
- Tensión SuperficialДокумент6 страницTensión SuperficialTahic PОценок пока нет
- Resetea tu mente. Descubre de lo que eres capazОт EverandResetea tu mente. Descubre de lo que eres capazРейтинг: 5 из 5 звезд5/5 (196)
- Tus Zonas Erroneas: Guía Para Combatir las Causas de la InfelicidadОт EverandTus Zonas Erroneas: Guía Para Combatir las Causas de la InfelicidadРейтинг: 4.5 из 5 звезд4.5/5 (1831)
- Yo Pude, ¡Tú Puedes!: Cómo tomar el control de tu bienestar emocional y convertirte en una persona imparable (edición revisada y expandida)От EverandYo Pude, ¡Tú Puedes!: Cómo tomar el control de tu bienestar emocional y convertirte en una persona imparable (edición revisada y expandida)Рейтинг: 5 из 5 звезд5/5 (7)
- Psicología oscura: Una guía esencial de persuasión, manipulación, engaño, control mental, negociación, conducta humana, PNL y guerra psicológicaОт EverandPsicología oscura: Una guía esencial de persuasión, manipulación, engaño, control mental, negociación, conducta humana, PNL y guerra psicológicaРейтинг: 4.5 из 5 звезд4.5/5 (766)
- Tu cerebro emocional: Saca partido de lo que sientes y transforma tu vidaОт EverandTu cerebro emocional: Saca partido de lo que sientes y transforma tu vidaРейтинг: 5 из 5 звезд5/5 (2)
- Cómo hacer que te pasen cosas buenas: Entiende tu cerebro, gestiona tus emociones, mejora tu vidaОт EverandCómo hacer que te pasen cosas buenas: Entiende tu cerebro, gestiona tus emociones, mejora tu vidaРейтинг: 5 из 5 звезд5/5 (1870)
- El poder del optimismo: Herramientas para vivir de forma más positivaОт EverandEl poder del optimismo: Herramientas para vivir de forma más positivaРейтинг: 5 из 5 звезд5/5 (16)
- Homo antecessor: El nacimiento de una especieОт EverandHomo antecessor: El nacimiento de una especieРейтинг: 5 из 5 звезд5/5 (1)
- Resumen de Pensar rápido pensar despacio de Daniel KahnemanОт EverandResumen de Pensar rápido pensar despacio de Daniel KahnemanРейтинг: 4.5 из 5 звезд4.5/5 (64)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaОт EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaРейтинг: 5 из 5 звезд5/5 (201)
- No desperdicies tus emociones: Cómo lo que sientes te acerca a Dios y le da gloriaОт EverandNo desperdicies tus emociones: Cómo lo que sientes te acerca a Dios y le da gloriaРейтинг: 5 из 5 звезд5/5 (12)
- Influencia. La psicología de la persuasiónОт EverandInfluencia. La psicología de la persuasiónРейтинг: 4.5 из 5 звезд4.5/5 (14)
- ¿Por qué mis padres no me aman?: Empezando a sanarОт Everand¿Por qué mis padres no me aman?: Empezando a sanarРейтинг: 4.5 из 5 звезд4.5/5 (33)
- Cómo Acertar en tu Nueva Relación de Pareja: Todas las claves para saber si tu relación tiene futuro... o te conviene salir corriendo de ahí.От EverandCómo Acertar en tu Nueva Relación de Pareja: Todas las claves para saber si tu relación tiene futuro... o te conviene salir corriendo de ahí.Рейтинг: 4.5 из 5 звезд4.5/5 (7)
- Cómo terminar lo que empiezas: El arte de perseverar, pasar a la acción, ejecutar los planes y tener disciplinaОт EverandCómo terminar lo que empiezas: El arte de perseverar, pasar a la acción, ejecutar los planes y tener disciplinaРейтинг: 4.5 из 5 звезд4.5/5 (6)
- Libro de Trabajo DE LA TERAPIA DE ACEPTACIÓN Y COMPROMISO (ACT). UNA GUÍA COMPLETA PARA CAMBIAR EL MINDFULNESS Y RECUPERARSE DE LA ANSIEDAD, LA DEPRESIÓN, LOS ATAQUES DE PÁNICO Y LA IRAОт EverandLibro de Trabajo DE LA TERAPIA DE ACEPTACIÓN Y COMPROMISO (ACT). UNA GUÍA COMPLETA PARA CAMBIAR EL MINDFULNESS Y RECUPERARSE DE LA ANSIEDAD, LA DEPRESIÓN, LOS ATAQUES DE PÁNICO Y LA IRAРейтинг: 4 из 5 звезд4/5 (26)
- La violencia invisible: Identificar, entender y superar la violencia psicológica que sufrimos (y ejercemos) en nuestra vida cotidianaОт EverandLa violencia invisible: Identificar, entender y superar la violencia psicológica que sufrimos (y ejercemos) en nuestra vida cotidianaРейтинг: 4 из 5 звезд4/5 (2)
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreОт EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreРейтинг: 5 из 5 звезд5/5 (3)
- Teoría polivagal práctica y terapiaОт EverandTeoría polivagal práctica y terapiaРейтинг: 5 из 5 звезд5/5 (4)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoОт EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoРейтинг: 5 из 5 звезд5/5 (2)
- Una mente en calma: Técnicas para manejar los pensamientos intrusivosОт EverandUna mente en calma: Técnicas para manejar los pensamientos intrusivosРейтинг: 4.5 из 5 звезд4.5/5 (142)
- Autismo: guía para padres sobre el trastorno del espectro autista En españolОт EverandAutismo: guía para padres sobre el trastorno del espectro autista En españolРейтинг: 4.5 из 5 звезд4.5/5 (4)