Академический Документы
Профессиональный Документы
Культура Документы
Ecuaciones de Estado
Загружено:
David PratoАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Ecuaciones de Estado
Загружено:
David PratoАвторское право:
Доступные форматы
1.
Fundamentos de termodinamica
15 de 76
1.2
Relaciones termodinmicas
Ecuaciones de estado
En cada estado de equilibrio, un sistema cerrado posee ciertos valores de sus variables, volumen V , presin P y temperatura T constantes en todo el sistema. Sin embargo para determinar el estado del sistema bastara con dar dos de esos tres valores, pues el tercero es funcin de los otros dos. Esta funcin recibe el nombre de ecuacin de estado termodinmica y es del tipo: F (P, V, T ) = 0 Si se representa en el espacio, utilizando como ejes P , V y T , la ecuacin de estado termodinmica, obtenemos una supercie denominada supercie de estado cuyos puntos representan cualquier estado estable del sistema. Cada sustancia posee su ecuacin de estado trmica que, en general, es muy difcil de obtener. No obstante, en algunos casos particulares, presenta formas relativamente sencillas. El conocimiento de la ecuacin de estado es fundamental para el estudio termodinmico de cualquier sistema. Existen bastantes ecuaciones de estado que se han recomendado para tener en cuenta el comportamiento no ideal de un gas. Este comportamiento aparece cuando la presin es relativamente alta (>4 MPa para la mayora de los gases) o cuando la temperatura es prxima a la de saturacin. No existen criterios aceptables que puedan utilizarse para determinar si puede usarse la ecuacin del gas ideal o si han de usarse las ecuaciones de gas no ideal. Las ecuaciones de estado son tiles para describir las propiedades de los uidos, mezclas, slidos o incluso del interior de las estrellas. Cada substancia o sistema hidrosttico tiene una ecuacin de estado caracterstica dependiente de los niveles de energa moleculares y sus energas relativas, tal como se deduce de la mecnica estadstica. El uso ms importante de una ecuacin de estado es para predecir el estado de gases y lquidos. Una de las ecuaciones de estado ms simples para este propsito es la ecuacin de estado del gas ideal, que es aproximable al comportamiento de los gases a bajas presiones y temperaturas mayores a la temperatura crtica. ITESCAM MTC-1017 Fundamentos de Termodinmica
16 de 76
1. Fundamentos de termodinamica
Ley de Boyle
La Ley de Boyle-Mariotte (o Ley de Boyle), formulada por Robert Boyle y Edme Mariotte, es una de las leyes de los gases ideales que relaciona el volumen y la presin de una cierta cantidad de gas mantenida a temperatura constante. La ley de Boyle establece que, a temperatura constante, la presin de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente. Esto quiere decir que si el volumen del contenedor aumenta, la presin en su interior disminuye y,viceversa, si el volumen del contenedor disminuye, la presin en su interior aumenta. Matemticamente: P1 V 1 = P2 V 2 La ley de Boyle permite explicar la ventilacin pulmonar, proceso por el que se intercambian gases entre la atmsfera y los alvolos pulmonares. El aire entra en los pulmones porque la presin interna de estos es inferior a la atmosfrica y por lo tanto existe un gradiente de presin. Inversamente, el aire es expulsado de los pulmones cuando estos ejercen sobre el aire contenido una presin superior a la atmosfrica.
Ley de Gay-Lussac
En 1802, Joseph Gay Lussac public los resultados de sus experimentos que, ahora conocemos como Ley de Gay Lussac. Esta ley establece, que, a volumen constante, la presin de una masa ja de un gas dado es directamente proporcional a la temperatura kelvin. Supongamos que tenemos un gas que se encuentra a una presin P1 y a una temperatura T1 al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor T2 , entonces la presin cambiar a P2 , y se cumplir: P2 P1 = T1 T2 Que es otra manera de expresar la ley de Gay-Lussac.
ITESCAM
MTC-1017
Fundamentos de Termodinmica
1. Fundamentos de termodinamica
17 de 76
Ley de Charles
Por otro lado, La Ley de Charles y Gay-Lussac (tambin llamada Ley de Charles) establece que el volumen de un gas es directamente proporcional a su temperatura absoluta, asumiendo que la presin de mantiene constante. Esto quiere decir que en un recipiente exible que se mantiene a presin constante,el aumento de temperatura conlleva un aumento del volumen. Esta ley puede expresarse como: V2 V1 = T1 T2 La ley fue publicada primero por Louis Joseph Gay-Lussac en 1802, pero haca referencia al trabajo no publicado de Jacques Charles, de alrededor de 1787, lo que condujo a que la ley sea usualmente atribuida a Charles. La relacin haba sido anticipada anteriormente en los trabajos de Guillaume Amontons en 1702.
Ley de Dalton
La Ley de Dalton establece que en una mezcla de gases cada gas ejerce su presin como si los restantes gases no estuvieran presentes. La presin especca de un determinado gas en una mezcla se llama presin parcial, p. La presin total de la mezcla se calcula simplemente sumando las presiones parciales de todos los gases que la componen.
Relaciones P -V -T para gases ideales
En las leyes de los gases, la de Boyle, la de Charles y la Gay Lussac, la masa del gas es ja y una de las tres variables,la temperatura, presin o el volumen, tambin es constante. Utilizando una nueva ecuacin, no solo podemos variar la masa, sino tambin la temperatura, la presin y el volumen. La ecuacin: P V = mRT, se conoce como ecuacin general de los gases, o mas comnmente como ecuacin del gas ideal. Empleando el concepto de volumen especco esta ecuacin se puede reescribir como: P v = RT
ITESCAM
MTC-1017
Fundamentos de Termodinmica
18 de 76
1. Fundamentos de termodinamica
Donde la constante R puede encontrarse a partir de la siguiente tabla.
Figura 1.3: Tabla de propiedades de gases ideales.
La ecuacin de los gases ideales realiza las siguientes aproximaciones: 1. Considera que las molculas del gas son puntuales, es decir que no ocupan volumen. 2. Considera despreciables a las fuerzas de atraccin-repulsin entre las molculas. La ecuacin de los gases ideales no tiene buena correlacin con el comportamiento de los gases reales. Al considerar el volumen molecular y las fuerzas de atraccin-repulsin despreciables, no es able cuando el volumen es pequeo o la temperatura es baja, ya que los factores que se despreciaron inuyen ms. Es por eso que se la utiliza a altas temperaturas (la energa cintica de las molculas es alta comparada con las fuerzas de atraccin-repulsin) y bajas presiones (el volumen es muy grande comparado con el volumen de las molculas del gas). En general el criterio utilizado es que se puede utilizar dicha ecuacin cuando la temperatura a la que se est trabajando (o el rango de temperaturas) es superior a dos veces la temperatura crtica del compuesto.
ITESCAM
MTC-1017
Fundamentos de Termodinmica
1. Fundamentos de termodinamica
19 de 76
Leyes de los gases reales
La ecuacin del gas ideal pierde mucha exactitud a altas presiones y bajas temperaturas, y no es capaz de predecir la condensacin de gas en lquido. Por ello, existe una serie de ecuaciones de estado ms precisas para gases y lquidos. Entre las ecuaciones de estado ms empleadas sobresalen las ecuaciones cbicas de estado. De ellas, las ms conocidas y utilizadas son la ecuacin de Peng-Robinson y la ecuacin de Redlich-Kwong-Soave. Hasta ahora no se ha encontrado ninguna ecuacin de estado que prediga correctamente el comportamiento de todas las sustancias en todas las condiciones. Adems de predecir el comportamiento de gases y lquidos, tambin hay ecuaciones de estado que predicen el volumen de los slidos, incluyendo la transicin de los slidos entre los diferentes estados cristalinos. Hay ecuaciones que modelan el interior de las estrellas, incluyendo las estrellas de neutrones.
Ecuacin de Van der Waals
Propuesta en 1873, la ecuacin de Van der Waals fue una de las primeras que describa el comportamiento de los gases visiblemente mejor que la ley del gas ideal. En esta ecuacin a se denomina el parmetro de atraccin y b el parmetro de repulsin o volumen molar efectivo. Mientras que la ecuacin es superior a la ley del gas ideal y predice la formacin de una fase lquida, slo concuerda con los datos experimentales en las condiciones en las que el lquido se forma. Mientras que la ecuacin de Van der Waals se suele apuntar en los libros de texto y en la documentacin por razones histricas, hoy en da es obsoleta. Otras ecuaciones recientes, un tanto ms complicadas son ms precisas.
ITESCAM
MTC-1017
Fundamentos de Termodinmica
20 de 76
1. Fundamentos de termodinamica
La ecuacin de Van der Waals puede ser considerada como la ley del gas ideal mejorada, por las siguientes razones: 1. Trata a las molculas como partculas con volumen, no como puntos en el espacio. Por ello V no puede ser demasiado pequeo, y se trabaja con (V b) en lugar de V . 2. Mientras que las molculas del gas ideal no interaccionan, Van der Waals considera que unas molculas atraen a otras dentro de una distancia equivalente al radio de varias molculas. No provoca efectos dentro del gas, pero las molculas de la supercie se ven atradas hacia el interior. Se ve esto al disminuir la presin exterior (usada en la ley del gas ideal). La ecuacin de estado de van der Waals propone tener en cuenta el volumen ocupado por las molculas del gas y las fuerzas de atraccin entre aqullas. Esto es: a RT 2 (1.6) p= vb v donde las constantes a y b estn relacionadas con los datos del punto crtico por: a= 27R2 Tc2 64pc b= RTc 8 pc (1.7)
Estas constantes se presentan tambin en tablas para simplicar los clculos.
Figura 1.4: Tabla de constantes de la ecuacin de van der Waals.
ITESCAM
MTC-1017
Fundamentos de Termodinmica
1. Fundamentos de termodinamica
21 de 76
Ecuacin de Redlich-Kwong
Introducida en 1949, la ecuacin de Redlich-Kwong fue una mejora considerable sobre las otras ecuaciones de la poca. An goza de bastante inters debido a su expresin relativamente simple. Aunque es mejor que la ecuacin de Van der Waals, no da buenos resultados sobre la fase lquida y por ello no puede usarse para calcular precisamente los equilibrios lquido-vapor. Sin embargo, puede usarse conjuntamente con expresiones concretas para la fase lquida en tal caso. La ecuacin de Redlich-Kwong es adecuada para calcular las propiedades de la fase gaseosa cuando el cociente entre la presin y la presin crtica es menor que la mitad del cociente entre la temperatura y la temperatura crtica. La ecuacin de estado de Redlich-Kwong se expresa como: p= a RT v b v (v + b) T R2 Tc2.5 pc (1.8)
donde las constantes vienen dadas por: a = 0.4275 b = 0.0867 RTc pc (1.9)
y estn recogidas en la siguiente tabla.
Figura 1.5: Tabla de constantes de la ecuacin de Redlich-Kwong.
ITESCAM
MTC-1017
Fundamentos de Termodinmica
22 de 76
1. Fundamentos de termodinamica
Ecuacin de Peng-Robinson
P = a RT 2 Vm b Vm + 2bVm b2
R = constante de los gases (8.31451 J/mol.K) a=
2 0.45723553R2 Tc Pc
b=
0.07779607RTc Pc
Tr =
T Tc 2
= [1 + (0.37464 + 1.54226 0.26992 2) (1 Tr0.5 )] = factor acntrico del compuesto.
La ecuacin de Peng-Robinson fue desarrollada en 1976 para cumplir los siguientes objetivos: 1. Los parmetros haban de poder ser expresados en funcin de las propiedades crticas y el factor acntrico. 2. El modelo deba ser razonablemente preciso cerca del punto crtico, particularmente para clculos del factor de compresibilidad y la densidad lquida. 3. Las reglas de mezclado no deban emplear ms que un parmetro sobre las interacciones binarias, que deba ser independiente de la presin, temperatura y composicin. 4. La ecuacin deba ser aplicable a todos los clculos de todas las propiedades de los uidos en procesos naturales de gases. El factor acntrico se dene como un parmetro necesario para calcular el factor de compresibilidad de un gas, ste mide la desviacin del gas respecto a gases como el criptn, xenn y argn (tambin llamados uidos simples) para los cuales el factor acntrico toma el valor de cero. El factor acntrico mide la esfericidad de la molcula, es decir nos da un nmero que representa todas las fuerzas presentes en ella no slo las del centro sino las de toda la molcula. Generalmente la ecuacin de Peng-Robinson da unos resultados similares a la de Soave, aunque es bastante mejor para predecir las densidades de muchos compuestos en fase lquida, especialmente los apolares.
ITESCAM
MTC-1017
Fundamentos de Termodinmica
1. Fundamentos de termodinamica
23 de 76
Factor de compresibilidad
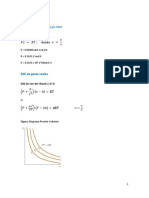
El factor de compresibilidad Z es un factor que compensa la falta de idealidad del gas, as que la ley de los gases ideales se convierte en una ecuacin de estado generalizada. pV = zmRT Una forma de pensar en Z es como un factor que convierte la ecuacin en una igualdad. Si se grca el factor de compresibilidad para una temperatura dada contra la presin para diferentes gases, se obtienen curvas. En cambio, si la compresibilidad se grca contra la presin reducida en funcin de la temperatura reducida, entonces para la mayor parte de los gases los valores de compresibilidad a las mismas temperatura y presin reducidas quedan aproximadamente en el mismo punto. Un valor para Z = 1 signica que el elemento en cuestin es real, y no ideal. Un grco de compresibilidad generalizado representa los valores para los valores reducidos de las condiciones que presente un gas, estos grcos pueden ser utilizados para determinar el valor de Z , con margen de error, el cual suele ser despreciable. Es importante destacar que estos grcos se presentan con los valores reducidos, la presin reducida en el eje x, el factor de compresibilidad en el eje y . Los valores reducidos de temperatura y volumen son representados por medio de lneas continuas curvadas para la temperatura. En su mayora en sentido horizontal y levemente cadas o elevadas. Tambin encontramos lneas que realizan cambios bruscos debido a las altas temperaturas; para los valores de volmenes reducidos encontramos la representacin mediante la indicacin de lneas segmentadas en sentido vertical y levemente inclinados hacia la derecha. Los valores de estas propiedades se encuentran indicadas al nal de las lneas,tanto en las continuas (temperaturas reducidas) como en las segmentadas (volmenes reducidos). Los parmetros reducidos son condiciones de temperatura, presin y volumen corregidas o normalizadas, mediante la divisin entre sus condiciones reducidas,as: Tr = T /Tc Pr = P/Pc Vr = V /Vc
ITESCAM
MTC-1017
Fundamentos de Termodinmica
24 de 76
1. Fundamentos de termodinamica
Ecuacin de estado virial
La ecuacin de estado del virial presenta el producto pv en un desarrollo en serie de potencias. El desarrollo ms comn es: p= B (T ) C (T ) RT + + + ... v v2 v3 (1.10)
donde el inters se centra sobre B (T ), ya que representa la correccin de primer orden a la lay de gas ideal. Las funciones B (T ), C (T ), etc., se deben especicar para cada gas. Aunque generalmente no es la ecuacin de estado ms conveniente, la ecuacin del Virial es importante dado que puede ser obtenida directamente por mecnica estadstica. Si se hacen las suposiciones apropiadas sobre la forma matemtica de las fuerzas intermoleculares, se pueden desarrollar expresiones tericas para cada uno de los coecientes. En este caso B corresponde a interacciones entre pares de molculas, C a grupos de tres, y as sucesivamente.
ITESCAM
MTC-1017
Fundamentos de Termodinmica
Вам также может понравиться
- En El Capítulo 3 Desarrollamos Los Fundamentos Del Flujo de Fluidos A Través de Medios Porosos yДокумент44 страницыEn El Capítulo 3 Desarrollamos Los Fundamentos Del Flujo de Fluidos A Través de Medios Porosos yMelany Grissel AguilarОценок пока нет
- Hysys TermodinamicaДокумент62 страницыHysys TermodinamicaDavid Ballena GuerreroОценок пока нет
- Term Odin A MicaДокумент21 страницаTerm Odin A MicaNel VelaОценок пока нет
- Seminario 2 Fundamentos Ing. Térmica y Flu. BFI05 2020-1Документ11 страницSeminario 2 Fundamentos Ing. Térmica y Flu. BFI05 2020-1Jose Lloclle BellitoОценок пока нет
- Recopilacion Tecnica Ingenieria de Yacim 85Документ85 страницRecopilacion Tecnica Ingenieria de Yacim 85jose benitezОценок пока нет
- Seleccion de Correlaciones Termodinamicas en HysysДокумент13 страницSeleccion de Correlaciones Termodinamicas en HysysIsaac BCОценок пока нет
- PRACTICA 7 (Gases II)Документ4 страницыPRACTICA 7 (Gases II)quispe.14186463Оценок пока нет
- S02 - Propiedades de Los FluidosДокумент42 страницыS02 - Propiedades de Los Fluidosjhony gamboa123Оценок пока нет
- Capitulo 1 Propiedades Del Gas NaturalДокумент43 страницыCapitulo 1 Propiedades Del Gas NaturalMIGUEL ANGEL ZAFRA FONTALОценок пока нет
- Grupo 14 BQF4 002 FisicoquimicaДокумент21 страницаGrupo 14 BQF4 002 FisicoquimicaAlejandra CalizОценок пока нет
- Prueba Ees Gases RealesДокумент6 страницPrueba Ees Gases RealesGrace AguayoОценок пока нет
- P Sem12 Ses2 TCGДокумент17 страницP Sem12 Ses2 TCGjhony gamboa123Оценок пока нет
- Folleto de Gases IdealesДокумент17 страницFolleto de Gases IdealesEliot Muñoz CuroОценок пока нет
- Factor de CompresibilidadДокумент16 страницFactor de CompresibilidadAnderson ArrietaОценок пока нет
- Problemas Gu Ia-01.: Noviembre 26, 2021Документ3 страницыProblemas Gu Ia-01.: Noviembre 26, 2021Gerardo Cerqueda MilánОценок пока нет
- Practica #2Документ18 страницPractica #2yaren david vertel martinezОценок пока нет
- Gas Natural - UdabolДокумент154 страницыGas Natural - UdabolAlejandro Garces NaganoОценок пока нет
- Practica Calificada No 1 - PI-524B - 2020-1Документ2 страницыPractica Calificada No 1 - PI-524B - 2020-1victorОценок пока нет
- Solucion Problemas Tema 1Документ6 страницSolucion Problemas Tema 1Futsal RealityОценок пока нет
- Densidades 1-Propanol A 313.15 KДокумент3 страницыDensidades 1-Propanol A 313.15 KRafael Loza GarcíaОценок пока нет
- Aplicacion de La Computacion para El Calculo de Las Propiedades TermodinámicasДокумент9 страницAplicacion de La Computacion para El Calculo de Las Propiedades TermodinámicasCarlos Gilberto Villamar LinaresОценок пока нет
- Clase 2.3. EdE - SeminarioДокумент10 страницClase 2.3. EdE - SeminarioVale IturraОценок пока нет
- Gas IdealДокумент21 страницаGas Idealaitor22Оценок пока нет
- Carga PiezometricaДокумент13 страницCarga PiezometricaRamírez Vilca Julio100% (3)
- Curso de Redes de Gas NaturalДокумент5 страницCurso de Redes de Gas NaturaldavidrrgОценок пока нет
- s15 Sec 5 Cyt Recurso 5Документ4 страницыs15 Sec 5 Cyt Recurso 5Jhoulleysi L SalazarОценок пока нет
- Taller Mecanica de Fluidos Capitulo1y2Документ3 страницыTaller Mecanica de Fluidos Capitulo1y2Sebastián RodríguezОценок пока нет
- Ecuación de Estado y Proceso de Los Gases Ideales - Sesion 3 - ExplicacionДокумент5 страницEcuación de Estado y Proceso de Los Gases Ideales - Sesion 3 - ExplicacionEskarly SaavedraОценок пока нет
- Clase de Repaso FQ 2do ParcialДокумент4 страницыClase de Repaso FQ 2do ParcialStanley EscobarОценок пока нет
- Marco Teorico de La Ley de Boyle y Gases RealesДокумент8 страницMarco Teorico de La Ley de Boyle y Gases RealesjuanОценок пока нет