Академический Документы
Профессиональный Документы
Культура Документы
3er Punto de Fases 5
Загружено:
David Esteban Soler CamargoИсходное описание:
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
3er Punto de Fases 5
Загружено:
David Esteban Soler CamargoАвторское право:
Доступные форматы
3er punto
Elabore el diagrama TXY, para el sistema ciclohexano etanol, utilizando la ecuacin de Raoult-modificado, a la presin de 2 bar. Utilice el modelo de actividad de Wilson y compare los resultados con el simulador comercial. Respuesta: Se sabe la ecuacin de Raoult-modificad, es una formulacin no simtrica o Gamma-Phi. Primero se tiene que obtener la ecuacin para que se cumpla el equilibrio de fases. (ec. 1) Donde es la fugacidad un componente cualquiera en el vapor y es la fugacidad de la mezcla de cualquier componente en el liquido. Para cada uno de los compuestos en la mezcla se cumple esta regla de equilibrio, sabiendo que la fugacidad parcial para un componente m en una mezcla de vapor es igual a: (ec. 2)
Donde es la fraccin molar del componente m cualquiera en la mezcla de vapor, es el coeficiente de fugacidad parcial en el vapor y P es la presin total del sistema. La fugacidad parcial para un componente m en el lquido es igual a: (ec. 3)
Donde es la fraccin molar del componente m cualquiera en la mezcla de liquido, es el coeficiente de actividad del componente m en el liquido en la mezcla y es la fugacidad del componente m puro en el liquido. Para hallar la fugacidad del componente m en el lquido puro, se modela mediante la siguiente ecuacin. (ec. 4) Sabiendo que para muchos lquidos una ecuacin de estado es incapaz de modelarlos adecuadamente se utiliza la siguiente ecuacin para describir el coeficiente de fugacidad. ( ) * + (ec. 5)
Para efectuar esta integral se toma un camino, de P= a P = P, sera este el camino incapaz de ser modelado por una ecuacin de estado, ya que en estos
rangos de presin el compuesto m est en estado liquido; y de P=0 a P= donde el sistema se encuentra en estado de vapor y se puede modelar con una ecuacin de estado, todo esto a una temperatura constante, entonces la integral se podra reescribir como: ( ) ( )+ ( ) (ec. 6)
La primera parte se modela como sigue. ( ) * + ( ) (ec. 7)
La segunda parte se modela de la siguiente manera: ( ) * + (ec. 8)
Esta integral se puede partir en 2 y resolverse como sigue: ( ( ) ) [ ] [ ] ( * + (ec. 9)
) (ec. 10)
Remplazando la ecuacin 10 y la ecuacin 7 en la ecuacin 6 se obtiene. ( ) [ ] ( )+ ( ) (ec. 11)
Por propiedades de los logaritmos. ( ) [ ] ( ) (ec. 12)
Elevando todo a la Euler. ( [ ] ) (ec. 13)
Donde es el coeficiente de fugacidad del componente puro en el lquido, es el coeficiente de fugacidad del componente puro en vapor, que puede ser modelado mediante una EOS, es la presin de vapor saturado, del componente puto dependiente de la temperatura, R es la constante universal de los gases ideales, T es la temperatura a la cual se encuentra el sistema y es el volumen del liquido dependiente de la presin. Al trmino como . ( [ ] ), se le llama factor de poynting y se abrevia
Se sabe que a bajas presiones el es aproximadamente 1, lo que tambin se podra decir, como que el vapor saturado es un gas ideal (GI); y lejos del punto crtico el factor de poynting se puede decir que es
aproximadamente 1, solo se cumple cuando la diferencia entre la presin del sistema y la presin de saturacin no es muy grande (menos de 30 bar). Para obtener la fugacidad del componente m en estado puro tengo que multiplicar la ecuacin 13, por la presin total del sistema. , (ec. 14)
(ec. 15) Al remplazar la ecuacin 15 en la ecuacin 3 se obtiene: (ec. 16)
Teniendo la fugacidad para el componente m en liquido se puede igualar a la fugacidad del componente m en el vapor, remplazando la ecuacin 16 y la ecuacin 2 en la ecuacin 1, se obtiene lo que sigue. (ec. 17)
Si la presin es baja y las condiciones son lejanas al punto al punto crtico se pueden hacer unas suposiciones, como que , y son aproximadamente 1, para lo cual queda la siguiente ecuacin: (ec. 18) Esta es llamada la ley de Raoult-modificado, donde es la fraccin molar del componente m en el sistema, P es la presin total del sistema, es la fraccin molar del componente m en el liquido, es coeficiente de actividad del componente m y es la presin de saturacin del componente m, a la temperatura del sistema. Para hace el diagrama TXY, es necesario saber la temperatura de burbuja y la composicin del vapor a determinadas temperatura , pero se sabe la composicin del liquido a todas las temperaturas y la presin, hay dos valores en la ecuacin de Raoult- modificada que dependen de la temperatura que son el coeficiente de actividad y la presin de saturacin . Para las presiones de saturacin se puede plantear la ecuacin de Antoine, que es una aproximacin bastante buena para calcular las presiones de saturacin a determinadas temperaturas, esta ecuacin depende de 3 parmetros A, B y C y es la siguiente. ( ) (ec. 19)
Donde T es la temperatura y puede estar en Celsius o en Kelvin dependiendo de las constantes y el logaritmo en base diez, tambin puede estar expresado como logaritmo neperiano dependiendo tambin de las constantes de Antoine. Las constantes de Antoine A, B y C para ambos compuestos con base a la ecuacin 19, con la temperatura en kelvin y la presin en bar son: Constantes de Antoine Etanol Ciclohexano A 5.37229 3.96988 B 1670.409 1203.526 C -40.91 50.287 Nota: estos valores de las constantes de Antoine se tomaron de http://webbook.nist.gov , y son para valores de temperatura entre 273.15 y 368.22 kelvin, se sabe que hay algunos puntos de la curva que salen de esos valores de temperatura, pero no se escogen otros valores para simplificar los clculos. Para los coeficientes de actividad es necesario calcularlos con un modelo de actividad, en este caso se utiliz Wilson, segn el software para simulacin de procesos qumicos Aspen Plus, usado para encontrar como se calculaban los coeficientes de fugacidad, la ecuacin que este sugiere es la siguiente: ( ) ( )
(ec. 20)
Esta sumatoria se resuelve de la siguiente manera: ( ) ( ) ( ( ) ) (ec. 21) (ec. 22)
Donde i en nuestro caso puede ser 1 o 2, tomaremos 1 como etanol y 2 como ciclohexano. Para cada caso de coeficiente de actividad: Para el compuesto 1: ( ) Para el compuesto 2: ( ) Donde los ( )
( ) ( )
(ec. 23)
(ec. 24)
se calculan de la siguiente manera segn Aspen plus. ( ) ( ) (ec. 25)
Y para calcular
es como sigue:
( )
(ec. 26)
Donde es el volumen molar del componente 1 a las condiciones del sistema, es el volumen molar del componente 2 a las condiciones del sistema, T es la temperatura en grados Kelvin, , , y son constantes determinadas de forma experimental por una regresin en el equilibrio lquido vapor. En cuanto los parmetros y son igual a 1, por lo cual la ecuacin para el coeficiente de actividad queda como sigue. Para el compuesto 1: ( ) Para el compuesto 2: ( ) ( ) ( ) (ec. 28) , ( ) ( ) (ec. 27)
Segn aspen plus de donde se sacaron estos datos los valores para , y son los que siguen: 0.2201 -941.8884 -0.19560 -323.4541 Segn Aspen Properties los valores del volumen molar son los siguientes:
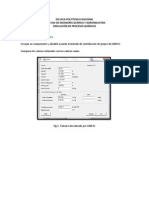
Compuesto Volumen molar (m3/kmol) Etanol (1) 0.0580678 Ciclohexano (2) 0.1075274 Con estos valores ya sera sencillo calcular X, Y y T, para cada intervalo y hacer con estos valores un diagrama de fases, pues ya se tiene como se calcula cada cosa en la ecuacin de Raoult, sin embargo hay que hacer una ltima aclaracin para que el sistema sea consistente y poder armar un sistema de 3x3 o solucionarlo en Excel. Esta aclaracin es que las sumas de las fracciones molares en el vapor deben dar igual a 1. (ec. 29) El sistema 3x3 se plantea con la ecuacin 18 (Raoult modificada) para cada componente y la ecuacin 29. Para hacer el diagrama de fases se hizo una plantilla de clculo en Excel para con esta poder saber los valores de cada temperatura de roci a diferentes composiciones, estos valores fueron calculados con la funcin solver de Excel.
Como se puede observar el diagrama obtenido por Aspen plus, es muy parecido, por no decir el mismo, al obtenido de forma cuasi-manual.
Вам также может понравиться
- Informe Gasotecnia Comportamiento de Fases Sistemas de HidrocarburosДокумент18 страницInforme Gasotecnia Comportamiento de Fases Sistemas de HidrocarburosRichard Dean VelasquezОценок пока нет
- Diagramas ComposicionalesДокумент14 страницDiagramas ComposicionalesChäz XdОценок пока нет
- Guía Práctica 4 - Diagrama TxyДокумент6 страницGuía Práctica 4 - Diagrama TxyLina marcela unriza garciaОценок пока нет
- EVL Benceno-ToluenoДокумент10 страницEVL Benceno-ToluenoMiguel Jiménez FloresОценок пока нет
- Taller Equilibrio #1Документ8 страницTaller Equilibrio #1Maria Paula BuitragoОценок пока нет
- Constantes de EquilibrioДокумент19 страницConstantes de EquilibrioSandro Gonzalez AriasОценок пока нет
- Practica 6 Lab SSFДокумент12 страницPractica 6 Lab SSFAndie Flores0% (1)
- Practica Diagrama de FasesДокумент7 страницPractica Diagrama de FasesCarolina BaesОценок пока нет
- Informe 2-Mezcla MulticomponentesДокумент19 страницInforme 2-Mezcla MulticomponentesSalustria Cabezas SánchezОценок пока нет
- Simulacion Tema 3Документ31 страницаSimulacion Tema 3ingemax1Оценок пока нет
- 5.5 El Cambio de Entropía de Sustancias PurasДокумент4 страницы5.5 El Cambio de Entropía de Sustancias PurasrobertoОценок пока нет
- Mezcla TernariaДокумент57 страницMezcla TernariaDavid Esteban Soler CamargoОценок пока нет
- Informe de Gas Natural 2Документ20 страницInforme de Gas Natural 2Salustria Cabezas SánchezОценок пока нет
- Guía Práctica 4 - Diagrama TxyДокумент6 страницGuía Práctica 4 - Diagrama TxyAngie HernándezОценок пока нет
- Lecciones de RepasoДокумент18 страницLecciones de RepasoRicardoОценок пока нет
- Tarea2 Jhoyosb JsmorenolaДокумент11 страницTarea2 Jhoyosb JsmorenolaJuan David Hoyos BohorquezОценок пока нет
- AzeotroposДокумент13 страницAzeotroposMaggyBalcazarОценок пока нет
- Termo III (Práctica 3)Документ33 страницыTermo III (Práctica 3)Jesus Vazquez60% (5)
- Reglas de FaseДокумент21 страницаReglas de FaseZezy BlueОценок пока нет
- Presión de Vapor SaturanteДокумент20 страницPresión de Vapor SaturanteHilda AnaОценок пока нет
- Ley RaoultДокумент3 страницыLey RaoultEnrique ZarateОценок пока нет
- Coeficientes de FugacidadДокумент12 страницCoeficientes de FugacidadAmi Dizzy Zuñi50% (2)
- Calculo Del Coeficiente de FugacidadДокумент6 страницCalculo Del Coeficiente de FugacidadCheiry Alejandra Perez DuarteОценок пока нет
- En El Caso Del Cálculo Del Punto de BurbujaДокумент4 страницыEn El Caso Del Cálculo Del Punto de BurbujaLuis RuizОценок пока нет
- Simunlacion ChemcadДокумент16 страницSimunlacion ChemcadAxel AbarcaОценок пока нет
- Trabajo 1er Corte de Cinética QuímicaДокумент27 страницTrabajo 1er Corte de Cinética QuímicaDavid Esteban Soler CamargoОценок пока нет
- Talleres Raoult, VanLaar, Wilson NRTLДокумент34 страницыTalleres Raoult, VanLaar, Wilson NRTLMaría José Camacho VelásquezОценок пока нет
- Ingeneria Quimica ComputacionalДокумент18 страницIngeneria Quimica ComputacionalMirellea AndurayОценок пока нет
- Equilibrio Liquido-Vapor Metanol-TiofenoДокумент8 страницEquilibrio Liquido-Vapor Metanol-TiofenoAaLee IsaisОценок пока нет
- Informe de Laboratorio #04Документ20 страницInforme de Laboratorio #04ruttОценок пока нет
- Informe 2 Presi N de VaporДокумент11 страницInforme 2 Presi N de VaporLeidy Daniela Garzon PuentesОценок пока нет
- Termo TesisДокумент30 страницTermo TesisRaquel Jrz SvОценок пока нет
- Ecuaciones de EstadoДокумент4 страницыEcuaciones de Estadoda1031soОценок пока нет
- Labo4 de FicoДокумент26 страницLabo4 de FicoMarco Chang0% (1)
- Tarea 1Документ22 страницыTarea 1Luis Ignacio SalinasОценок пока нет
- Informe 3. Presión de VaporДокумент8 страницInforme 3. Presión de VaporLuis Eduardo PlazasОценок пока нет
- Propiedades Termodinámicas y Evl A Partir de Las Ecuaciones de EstadoДокумент14 страницPropiedades Termodinámicas y Evl A Partir de Las Ecuaciones de Estadojonht_conzzОценок пока нет
- Selección de Modelos TermodinámicosДокумент7 страницSelección de Modelos TermodinámicosArianeth ChamanОценок пока нет
- EQUILIBRIO VAPOR - LíQUIDOДокумент66 страницEQUILIBRIO VAPOR - LíQUIDODavid AyalaОценок пока нет
- Difusividad (Nuestro)Документ15 страницDifusividad (Nuestro)Nicolas Aristizabal HernandezОценок пока нет
- Procesos3 Unidad1Документ112 страницProcesos3 Unidad1Andres LopezОценок пока нет
- VLE Sistema Acetona-BencenoДокумент25 страницVLE Sistema Acetona-Bencenocaabernalra100% (3)
- Taller ELV Ideal-RealДокумент3 страницыTaller ELV Ideal-RealMaria Alejandra Colonia MoyaОценок пока нет
- Operacion UnitariaДокумент5 страницOperacion UnitarialioОценок пока нет
- Guía de Problemas #5. Disoluciones Reales - Segunda ParteДокумент1 страницаGuía de Problemas #5. Disoluciones Reales - Segunda ParteAgostina fОценок пока нет
- Ciclo Combinado-Tula PDFДокумент20 страницCiclo Combinado-Tula PDFAlde EstradaОценок пока нет
- Ecuación de Van Laar (Destilación)Документ50 страницEcuación de Van Laar (Destilación)Mayumy Aguilar SilvaОценок пока нет
- KellogДокумент19 страницKellogKatheryn Contreras SanabriaОценок пока нет
- Tarea9 ExamenДокумент13 страницTarea9 ExamenIvtGuzmAnОценок пока нет
- Ciclo y Proceso TermodinamicosДокумент12 страницCiclo y Proceso TermodinamicosNathaly Reyes RubianoОценок пока нет
- Calculos Flash THISДокумент60 страницCalculos Flash THISAdi JcОценок пока нет
- Equilibrio de Fase Líquido - VaporДокумент28 страницEquilibrio de Fase Líquido - VaporIvan TorresОценок пока нет
- Regla de Las Fases de GibbsДокумент8 страницRegla de Las Fases de GibbsMari Marisol Rodriguez33% (3)
- Termo AplicadaДокумент17 страницTermo AplicadaAura AcostaОценок пока нет
- Objetivo GeneralДокумент11 страницObjetivo GeneralAdal SandovalОценок пока нет
- Gráficas T Vs x1Документ5 страницGráficas T Vs x1carina_gutiОценок пока нет
- Cuestionario Labo de TermoДокумент3 страницыCuestionario Labo de TermoPaola KasandraОценок пока нет
- Sistemas MulticomponenteДокумент62 страницыSistemas MulticomponenteDaniel CruzОценок пока нет
- Modulo de Termodinamica AvanzadaДокумент11 страницModulo de Termodinamica AvanzadaDavid Esteban Soler CamargoОценок пока нет
- Diagrama de Miscibilidad Del Sistema Agua-FenolДокумент5 страницDiagrama de Miscibilidad Del Sistema Agua-FenolDavid Esteban Soler Camargo100% (1)
- Refracción PDFДокумент6 страницRefracción PDFDavid Esteban Soler CamargoОценок пока нет
- Ejercicios Cinética Michaelis MentenДокумент2 страницыEjercicios Cinética Michaelis MentenDavid Esteban Soler Camargo100% (1)
- Construcción Del Diagrama de FasesДокумент16 страницConstrucción Del Diagrama de FasesDavid Esteban Soler CamargoОценок пока нет
- Trabajo 1er Corte de Cinética QuímicaДокумент27 страницTrabajo 1er Corte de Cinética QuímicaDavid Esteban Soler CamargoОценок пока нет
- Mezcla TernariaДокумент57 страницMezcla TernariaDavid Esteban Soler CamargoОценок пока нет
- Guia de Aprendizaje UML ADSIДокумент13 страницGuia de Aprendizaje UML ADSIJhon Sanchez MurilloОценок пока нет
- Modulo 1Документ10 страницModulo 1MARIO24122008Оценок пока нет
- Proyecto RivassssДокумент28 страницProyecto RivassssSimon RivasОценок пока нет
- Informe de Actividades de Mantenimiento ++++ 03-02-2023Документ16 страницInforme de Actividades de Mantenimiento ++++ 03-02-2023FREDDY NICOLAS ESCOBEDO LOZANOОценок пока нет
- Problemas PPL1Документ2 страницыProblemas PPL1RG RonyОценок пока нет
- Diapositivas - La Comunicación Padres A HijosДокумент19 страницDiapositivas - La Comunicación Padres A HijosCristian Núñez100% (1)
- Ap1618 2014 (41069)Документ23 страницыAp1618 2014 (41069)Karolr04Оценок пока нет
- SEÑALÉTICASДокумент7 страницSEÑALÉTICASJulioОценок пока нет
- Fundamentos Filosoficos de Las Garantías ConstitucionalesДокумент5 страницFundamentos Filosoficos de Las Garantías ConstitucionalesanelsabidoОценок пока нет
- Cotización Providencia - MD IIДокумент2 страницыCotización Providencia - MD IIAngel SisoОценок пока нет
- SENA2021n2311939nenglishn6 19615e2d0bb346aДокумент11 страницSENA2021n2311939nenglishn6 19615e2d0bb346aLucy Andrea Tobon LondoñoОценок пока нет
- Esquema Completo - Texto Expositivo - Actividad Que Les ApasionaДокумент7 страницEsquema Completo - Texto Expositivo - Actividad Que Les Apasionaedwin huancay lizanaОценок пока нет
- Tarea SemanalДокумент4 страницыTarea Semanaladrian salazarОценок пока нет
- CAPÍTULO No 2 - GEOMETRÍA ANÁLITICA EN R3Документ10 страницCAPÍTULO No 2 - GEOMETRÍA ANÁLITICA EN R3diegoОценок пока нет
- Marco Teorico InventariosДокумент13 страницMarco Teorico InventariosRicardo CervantesОценок пока нет
- Sesion CCSS Independencia 13 Colonias AmericanasДокумент6 страницSesion CCSS Independencia 13 Colonias Americanasyery ysabel paredes crespinОценок пока нет
- LM-C-363-2017 Juego de Pesas E2 2017-07-25Документ4 страницыLM-C-363-2017 Juego de Pesas E2 2017-07-25Raul SebastiamОценок пока нет
- Parra - La Actividad PoltergeistДокумент11 страницParra - La Actividad PoltergeistClarisa GiovannoniОценок пока нет
- Formato de ConsentimientoДокумент2 страницыFormato de ConsentimientoVanessa BoteroОценок пока нет
- Laboratorio de InternetДокумент10 страницLaboratorio de InternetCamiloCastañedaОценок пока нет
- Calculos de Parametros Morfometricos 1Документ11 страницCalculos de Parametros Morfometricos 1Dayana Suarez RamosОценок пока нет
- Matriz Del Marco Del Buen Desempeño DocenteДокумент3 страницыMatriz Del Marco Del Buen Desempeño Docentec_enrique33742Оценок пока нет
- Unidad 3 Actividad 5 ContabilidadДокумент6 страницUnidad 3 Actividad 5 ContabilidadLeidy GranadosОценок пока нет
- Datos Configuracion Internet MovilnetДокумент1 страницаDatos Configuracion Internet MovilnetDixon Ernesto Lynch S.Оценок пока нет
- Tarea 5 - Recurso DigitalДокумент7 страницTarea 5 - Recurso DigitalUNAD89% (9)
- Manual para Entender e Invertigar Un AtepДокумент13 страницManual para Entender e Invertigar Un Atepsushi290900Оценок пока нет
- Etapas de Un Proyecto EstructuralДокумент3 страницыEtapas de Un Proyecto EstructuralanaОценок пока нет
- Tema Sesion #6Документ20 страницTema Sesion #6CARLOSОценок пока нет
- Diseño de Una Subestacion de Potencia para Grabar en CDДокумент53 страницыDiseño de Una Subestacion de Potencia para Grabar en CDFelixLimaymantaNestaresОценок пока нет
- ACTIVIDAD 1 - Análisis de TendenciasДокумент7 страницACTIVIDAD 1 - Análisis de TendenciasAnamaria CortesОценок пока нет