Академический Документы
Профессиональный Документы
Культура Документы
Phos Cell
Загружено:
Ahmed RabiiАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Phos Cell
Загружено:
Ahmed RabiiАвторское право:
Доступные форматы
1
COURS DE METABOLISME
Chapitre 4 Pr C. ZINSOU
PHOSPHORYLATIONS CELLULAIRES
1 - INTRODUCTION - DEFINITION 2 - FORMATION DE LATP PAR TRANSFERT DENERGIE ET DE GROUPEMENT PHOSPHATE DUN PHOSPHODERIVE RICHE EN ENERGIE 3 - PHOSPHORYLATION OXYDATIVE 3.1- INTRODUCTION -LOCALISATION 3.2 -G DE LOXYDATION DE NADH,H+ ET DE FADH2 3.3 - LES GROUPES TRANSPORTEURS DES ELECTRONS 3.3.1 - Complexe I - NADH,H+ - CoQ Rductase (FP1) 3.3.2 - Complexe II - Succinate - CoQH2 rductase (FP2). 3.3.3 - Complexe III - CoQH2 - Cytochrome rductase 3.3.4 - Complexe IV - Cytochrome c oxydase 3.3.5 - Organisation du transport des lectrons dans la chane respiratoire 3.4 - CREATION DE GRADIENT DE DENSITE DE PROTONS 3.4.1 - Gradient de densit de protons 3.4.2 Calcul de lnergie libre pour la production de lATP 3.5 - MECANISME DE FORMATION DE L'ATP - Thorie de Mitchell 3.6 INHIBITEURS DU COMPLEXE ATP SYNTHETASE 3.6.1 Oligomycine 3.6.2 Les dcouplants 3.7 TRANSPORT DE MOLECULES A TRAVERS LA MEMBRANE MITOCHONDRIALE INTERNE 3.7.1 Systme ADP/ATP translocase + 3.7.2 Roxydation des NAD,H cytosoliques / les navettes 3.8 DEFICIENCES HERITEES LIEES A LA PHOSPHORYLATION OXYDATIVE
(PCEM1)
4 - PHOTOPHOSPHORYLATION 4.1 - DEFINITION -LOCALISATION 4.2 - LES GROUPES TRANSPORTEURS D'ELECTRONS 4.2.1 - Photosystme II ou PSII. 4.2.2 - Le Photosystme I (PSI) 4.2.3 - Groupe 3 : Complexe intermdiaire ou Complexe bf 4.2.4 -Organisation du transport des lectrons 4.3 - CREATION DE GRADIENT DE PROTONS NB : Voir illustrations et figures sur le document de travail
1 - INTRODUCTION - DEFINITION Le premier Principe de la thermodynamique dit : lnergie ne peut ni tre cre ni tre dtruite, elle ne peut qutre transforme . Par opposition aux tres inanims, les tres vivants sont capables de transformer lnergie en ses diffrentes composantes, nergie chimique (ATP), travail, chaleur, etc., ce qui leur permet entre autres ddifier et de maintenir une structure organise au cours de leur volution. La seule source universelle dnergie pour la cellule est lATP. Pour former lATP la cellule dispose de deux sources : - le catabolisme des glucides, des lipides et accessoirement des acides amins et des protines. La cellule va rcuprer une partie de lnergie des liaisons entre les diffrents atomes des composs dgrads. - la lumire. Seules les organismes chlorophylliens sont capables dexploiter cette source dnergie et de la convertir en ATP. Les organismes vivants sont le sige de ractions chimiques au cours desquelles varie l'nergie libre susceptible dtre utilise pour la formation de lATP. En fait il existe trois modalits de formation dATP dans la cellule : - LATP est form par transfert de groupement phosphate et dnergie partir dun phosphodriv riche en nergie. - LATP est form lissue dun ensemble de processus de dgradations pendant lesquels les glucides, lipides (parfois les protines) sont oxyds en CO 2 avec production de + cofacteurs rduits riches en nergie (NADH,H et FADH2). Ces derniers alimentent le transport des lectrons dans la chane respiratoire, laquelle est couple la formation de lATP. Il sagit de la phosphorylation oxydative. - LATP peut tre form chez les vgtaux chlorophylliens, coupl au transport des lectrons dans la photosynthse. Les lectrons transports proviennent de la photolyse de leau. Ce processus est appel conversion de lnergie lumineuse en nergie chimique (ATP). Il sagit de la photophosphorylation ou phosphorylation photosynthtique.
2 - FORMATION DE LATP PAR TRANSFERT DENERGIE ET DE GROUPEMENT PHOSPHATE DUN PHOSPHODERIVE SUR LADP Nous citerons seulement deux exemples. Ils constituent les deux ractions sur lesquelles est base la production de lnergie dans la glycolyse. 2.1 - LE 3-PHOSPHOGLYCEROYL-1-PHOSPHATE (PGP) Il est form par oxydation du 3-phosphoglycraldhyde. Le groupement phosphate fix sur la fonction carboxylique est trs riche en nergie. Son hydrolyse dlivre une variation dnergie libre (G) gale -11,8 kcal/mol alors que la formation de lATP ne ncessite que +7.3 kcal/mol. La raction est catalyse par la 3-phosphoglycrate kinase : 3-glycroyl 1- + ADP 3-glycrate + ATP
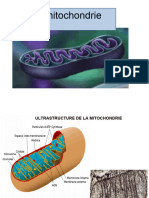
2.2 LE PHOSPHENOLPYRUVATE (PEP) Ce phosphodriv riche en nergie est form dans la glycolyse par dpart dune molcule deau sur le 2-glycrate. Le PEP est le phosphodriv le plus riche en nergie form par la cellule avec une G dhydrolyse gale -14,8 kcal/mol. La raction de transfert de lnergie et du groupement phosphate est catalyse par la pyruvate kinase : Phosphonolpyruvate + ADP Pyruvate + ATP 3 - PHOSPHORYLATION OXYDATIVE 3.1- INTRODUCTION - LOCALISATION En suivant la logique de la production de lnergie partir du glucose en prsence doxygne nous arrivons aprs loxydation des 6 carbones au bilan suivant : Glucose + 2 ADP + 2 GDP + 4 Pi + 10 NAD+ +2 FAD 6 CO2 + 2 ATP + 2 GTP + 10 NADH,H+ + 2 FADH2. Comme nous pouvons le constater, seules 4 liaisons phosphates, riches en nergie, sont directement formes, ce qui reprsente seulement 10,5 % de lnergie totale susceptible dtre libre par le glucose. Mais son oxydation complte en CO2, dans la cellule, saccompagne de la formation de 10 NADH,H+ et de 2 FADH2. Ces derniers alimentent le transport dlectrons dans les mitochondries des htrotrophes et des autotrophes, travers des squences de ractions doxydorductions respiratoires, jusqu loxygne, accepteur final. Ce processus est responsable de la formation de la majeure partie de lATP. La synthse d'ATP, couple ce transport d'lectrons, est appele Phosphorylation oxydative. Tous les tres vivants, pouvant vivre en prsence doxygne, possdent la capacit de produire de lATP par phosphorylation oxydative. La phosphorylation oxydative se droule dans les mitochondries possdant : une membrane externe, semi-permable une membrane interne, prsentant des invaginations appeles crtes, intrinsquement impermable aux ions et aux petites molcules. Ces derniers ne peuvent la traverser que sils disposent de transporteur spcifique. Elle renferme les diffrents complexes impliqus dans le transport dlectrons et la synthse de lATP. un espace intermembranaire un milieu intrieur, appel matrice, entour par la membrane interne. Chaque membrane ou compartiment possde ses enzymes ou ses complexes spcifiques, voir tableau 39, rsumant la distribution des enzymes dans la mitochondrie. 3.2 - VARIATION DENERGIE LIBRE DOXYDATION DE NADH,H+ ET DE FADH2 Les deux principaux coenzymes, donneurs d'lectrons dans la chane respiratoire, + sont le NADH,H et le FADH2. Les lectrons sont transports jusqu' l'oxygne. L'nergie libre d'oxydation de NADH,H+ et de FADH2 peut tre calcule partir de la formule liant E et G'o. Les ractions globales dchange des lectrons entre les couples rdox sont : NADH,H+ + O2 NAD+ + H2O FADH2 + O2 FAD + H2O E' =+1,14 V E' =+0,88 V G'o = - 52 kcal/mol G'o = - 40 kcal/mol
Lnergie libre par loxydation de ces cofacteurs rduits est disponible au niveau de la cellule pour la production de lATP mais la cellule ne peut supporter de brusques variations de potentiel ni d'nergie libre de telle ampleur, qui conduiraient sa destruction. Pour sen protger la cellule met en uvre une squence de groupes de transporteurs. Les lectrons sont alors transports par tape travers une srie de complexes multienzymatiques. La variation de potentiel ou dnergie se fait donc par fractions et par escaliers depuis le cofacteur rduit jusqu' loxygne.
3.3 - LES GROUPES TRANSPORTEURS DES ELECTRONS On distingue 4 groupes qui sont des complexes multi-enzymatiques, voir figure 40 : Complexe I - NADH,H+ - CoQ Rductase (FP1) Complexe II - Succinate - CoQ Rductase (FP2). Complexe III CoQH2 - Cytochrome c rductase Complexe IV - Cytochrome c oxydase
3.3.1 - Complexe I - NADH,H+ - CoQ Rductase (FP1) + C'est un complexe multi-enzymatique qui transporte les lectrons de NADH,H au coenzyme Q appel encore Ubiquinone travers une squence o apparaissent des protines Fer-Soufre (FeS): La circulation des lectrons est spontane et se fait dans le sens dune augmentation du potentiel. NADH,H+ FMN Fe-S CoQ. Lenzyme principale de ce complexe I est la NADH,H+ dshydrognase FMN. Cest une flavoprotine appele FP1, de masse molculaire de 250 000 daltons. Cette enzyme est inhibe par l'Amytal, la rotnone et la ptricidine. Lun de ces composs inhibe le transport des lections dans le complexe I. 3.3.2 - Complexe II - Succinate - CoQ rductase (FP2). Ce complexe enzymatique transporte les lectrons du succinate jusqu'au coenzyme Q. Lenzyme principale du complexe est la succinate dshydroognase FAD. Cest la flavoprotine FP2. Ici encore les protines FeS interviennent pour donner la squence suivante : Succinate . FAD (Fe-S) CoQ. D'autres complexes de moindre importance, non impliqus dans la chane respiratoire, transportent aussi des lectrons jusqu'au niveau du coenzyme Q pour alimenter le transport des lectrons. Les plus importants sont les suivants : - Complexe Acyl-CoA dshydrognase (FP3). Enzyme de la -oxydation des acides gras R-CH2-CH2-CO-SCoA FAD (Fe-S) CoQ. - Glycrol 3-phosphate dshydrognase (FP4) mitochondriale FAD. Cest aussi une flavoprotine. Glycrol 3- FAD (Fe-S) CoQ
3.3.3 - Complexe III - CoQH2 - Cytochrome c rductase Ce complexe multi-enzymatique transporte les lectrons entre le coenzyme Q rduit (CoQH2) et le cytochrome c suivant la squence suivante : CoQH2 Cyt b Fe-S Cyt c1 Cyt c Le transfert des lectrons dans ce complexe est spontan. Il est inhib entre le cyt b et le cyt c1 par l'ANTIMYCINE A. 3.3.4 - Complexe IV - Cytochrome c oxydase Il transporte les lectrons jusqu' l'oxygne. On obtient : Cyt c Cyt a Cyt a3 O2 Le transfert des lectrons entre le cyt a3 et l'oxygne est inhib par lazide, par le CO et par les cyanures qui constituent des poisons respiratoires violents, 3.3.5 - Organisation du transport des lectrons dans la chane respiratoire Lorganisation du transport montre lordre dintervention des diffrents complexes et coenzymes. (Figure 40). Deux coenzymes, le coenzyme Q et le cytochrome c ne sont pas fixs aux membranes et peuvent sy mouvoir.
3.4 - CREATION DE GRADIENT DE DENSITE DE PROTONS 3.4.1 - Gradient de densit de protons Lors du transport des lectrons un gradient de densit de protons (gradient lectrochimique) est cr travers la membrane mitochondriale interne. Des protons sont pomps de faon unidirectionnelle de la matrice vers l'espace intermembranaire. Au niveau des complexes I, III et IV. il existe, dans la membrane mitochondriale interne, des complexes protiques qui se comportent comme des pompes protons, alimentes par lnergie libre fournie par le transport des lectrons. Ceci constitue la thorie chimioosmotique postule par P. Mitchell en 1968. Le pH l'intrieur de la matrice augmente et devient suprieur celui de l'espace intermembranaire. Il se cre un pH ngatif. Les protons sont pomps au niveau de 3 sites (voir figure 41) : + - site 1 : Complexe NADH,H - CoQ rductase (FP1) - site 2 : Complexe CoQH2 - Cytochrome c rductase - site 3 : Cytochrome c oxydase Le passage des lectrons chaque site cre un E. Le G correspondant sera utilis pour la synthse de l'ATP. Ainsi l'oxydation de NADH,H+, dont les lectrons circulent travers les 3 sites, provoque la formation de 3 ATP; celle de FADH2, dont les lectrons entrent au niveau du site 2 provoque la formation de 2 ATP. Les lectrons qui entrent au niveau du site 3 permettent la formation de 1 ATP, voir figure 41. La cration d'un gradient de densit de protons par le flux des lectrons travers les 3 sites de conservation de l'nergie implique que les protines de transport de protons fonctionnent de faon irrversible et asymtrique de telle faon que les protons puissent tre pomps du ct matriciel vers le ct cytoplasmique.
3.4.2 Calcul de lnergie libre pour la production de lATP Le gradient lectrochimique V (exprim en volt) cr par le dplacement dune mole de protons est donn par la formule dans laquelle (= 0,14 V) est le potentiel de membrane ; pH est gal 1,4 par mole de H+ transport. On en dduit : V = -2.3 RTpH/F = 0.14 0.06*(-1,4) = 0.224 V. G = - 96500 * 0.224 = - 21.6 kJ/mol. On voit que, pour couvrir les +30.5 kJ/mol ncessaires la synthse de lATP, il faut dplacer au niveau de chaque site au moins 2 moles de protons. 3.5 - MECANISME DE LA SYNTHESE DE L'ATP - Thorie de Mitchell Les tapes sont les suivantes : En tout premier lieu, le transport des lectrons travers la chane respiratoire est ncessaire. La formation de l'ATP exige la cration de gradient de densit de protons entre la matrice et l'espace intermembranaire. c'est le potentiel lectrochimique cr qui fournit lnergie ncessaire la synthse de l'ATP. Une fois le gradient cr, la synthse de l'ATP est effectue par une enzyme contenue dans des protubrances sphriques situes sur le ct matriciel de la membrane mitochondriale interne. Ces sphres sont connues sous le nom de facteur de couplage 1 ou F1. Son rle physiologique est de catalyser la synthse de l'ATP. Il contient l'ATPase ou l'ATP synthtase. A la base de F1 et constituant son pdoncule membranaire, il existe une autre unit protique essentielle appele Fo ou canal protonique. La liaison entre Fo et F1 est assure par plusieurs autres protines dont l'ensemble est le complexe Fo-F1. Le facteur Fo assure le reflux des protons de lespace intermembranaire vers la matrice travers la membrane interne et permet la libration de lnergie ncessaire la synthse de l'ATP. Quant la synthse de l'ATP on sait peu de choses. On pense que son initiation dbute grce l'action directe du flux de protons travers Fo sur F1. Le Pi est activ et, simultanment, est attaqu par l'ADP pour donner l'ATP (voir figure 42). La vitesse de phosphorylation oxydative est conditionne par le besoin en ATP. Dans les conditions physiologiques le transport des lectrons est troitement li la synthse de l'ATP. Le facteur le plus important qui dtermine la vitesse de phosphorylation est le taux d'ADP dans la cellule. Le transport des lectrons, ncessaire la formation du gradient de densit de protons, et la synthse de l'ATP sont deux processus coupls. Sur le plan exprimental on a montr que lADP stimule la respiration en prsence de NADH,H + et entrane la conversion de l'ADP en ATP. La rgulation de la vitesse de phosphorylation oxydative par le taux d'ADP est appele contrle respiratoire. La signification physiologique est vidente. La consommation d'ATP entrane l'augmentation du taux d'ADP qui constitue un signal important qui dclenche lcoulement des lectrons dans la chane respiratoire partir de NADH,H+ et de FADH2.
3.6 INHIBITION DE LA SYNTHESE DE LATP La formation de lATP utilise lnergie mise en rserve par le potentiel lectrochimique cr lors de la formation du gradient de densit de protons. Elle entrane donc la dissipation de lnergie. Par le reflux des protons vers la matrice elle permet aussi la neutralisation du gradient lectrique (relaxation). Plusieurs composs peuvent affecter le fonctionnement de ce complexe.
3.6.1 - Oligomycine : Cest un antibiotique. Elle se fixe sur le canal protonique (Fo) et le bloque, empchant ainsi le reflux des protons vers la matrice. La synthse de lATP et la relaxation de la membrane sont donc inhibes. Par voie de consquence le transport des lectrons dans la chane respiratoire se trouve son tour arrt. En rsum loligomycine bloque le transport des lectrons et la phosphorylation de lADP do inhibition de la phosphorylation oxydative.
3.6.2 - Les dcouplants Ce sont souvent des transporteurs lipophiles de protons. Le compos souvent cit est le 2,4-dinitrophnol. Il diffuse travers la membrane mitochondriale interne et peut ainsi transporter des protons dun lieu un autre. Par ce fait il annule le gradient de densit de protons associ au transport des lectrons. Les dcouplants inhibent la phosphorylation sans perturber le transport des lectrons. Lnergie libre fournie par le transport des lectrons est, dans ce cas, entirement dissipe sous forme de chaleur. Cette production dnergie en prsence de dcouplant prend le nom de thermogense. Les animaux et les humains dveloppent un tissu adipeux spcial, appel graisse brune. Ce dernier est trs riche en mitochondries qui possdent, dans leur membrane interne, une protine dcouplante appele thermognine. Aprs la cration du gradient, les protons, au lieu de retourner la matrice par le canal protonique (Fo), sont achemins par la thermognine pour produire de la chaleur plutt que de lATP. Ce processus est sollicit pour la lutte contre le froid et pour le maintien de la temprature corporelle des animaux en hibernation.
3.7 TRANSPORT DE MOLECULES A TRAVERS LA MEMBRANE MITOCHONDRIALE INTERNE 3.7.1 Systme ADP/ATP translocase LATP est synthtis dans la mitochondrie qui nest pas le lieu dutilisation. Il doit tre transport hors de la mitochondrie aprs formation. Le transport de lATP est assur par le systme Adnine nuclotide translocase (ADP/ATP translocase) qui couple la sortie dune molcule dATP matriciel lentre dune molcule dADP cytosolique. Ce systme vite lengorgement de la mitochondrie et rgle le flux d'ATP et d'ADP. Cette translocase est localise dans la membrane mitochondriale interne. Elle reprsente 6 % des protines totales de la mitochondrie. Le fonctionnement de ce systme peut tre inhib par une toxine vgtale : latractyloside, qui empche lentre de lADP dans la mitochondrie, ce qui arrte la formation de lATP.
3.7.2 Roxydation des NADH,H+ cytosoliques / Rgnration du pouvoir oxydant de la glycolyse : les navettes Le NADH,H+ a deux origines : cytosolique. Il est form essentiellement dans la raction d'oxydorduction de la glycolyse, par consommation de NAD+ (pouvoir oxydant de la glycolyse). mitochondriale. Il est form dans les ractions d'oxydation du pyruvate, des acides gras et du cycle de Krebs. Le NADH,H+ form dans ces conditions est dj lintrieur de la mitochondrie et sa roxydation est assure par le transport des lectrons jusqu loxygne par la chane respiratoire. La roxydation de NADH,H+ en NAD+, indispensable au maintien de lactivit glycolytique nest pas assure dans le cytosol des organismes arobies et nest possible que si ses lectrons sont transports dans la mitochondrie et jusqu loxygne. La seconde difficult vient du fait que le NADH,H+ ne peut pas traverser la membrane mitochondriale interne qui ne dispose par de transporteur pour les coenzymes nicotiniques (NADH,H+ et NAD+). Pour contourner ces difficults, la cellule a dvelopp des navettes qui assurent le transport des lectrons et des protons du cytosol dans la matrice travers la membrane mitochondriale. Le principe est simple. La navette est assure par des composs qui peuvent tre transports, sous forme oxyde ou rduite, travers la membrane mitochondriale interne grce des transporteurs spcifiques. Elle utilise linterconversion des fonctions ctone et alcool secondaire. Le compos transporteur oxyde, dans le cytosol, le NADH,H+ en rcuprant les lectrons et les protons. Il traverse la membrane interne et restitue, en se roxydant, les lectrons et les protons NAD+ ou FAD mitochondrial. Il retourne ensuite dans le cytosol. Les navettes sont au nombre de 3 (Voir figure 43). Navette -Hydroxybutyrate/actoactate. Elle est base sur la raction ci-dessous catalyse par la -Hydroxybutyrate dshydrognase. La raction se fait de gauche vers la droite dans le cytoplasme et de droite vers la gauche dans la mitochondrie (figure 43-1) : CH3-CO-CH2-COOH + NADH,H+ CH3-CHOH-CH2-COOH + NAD + Navette 3-Glycrol/3-dihydroxyactone La deuxime navette utilise linterconversion du 3-dihydroxyactone et du 3glycrol. La raction est catalyse par la 3-glycrol dshydrognase NADH,H+/NAD+ dans le cytoplasme et FADH2/FAD dans la matrice mitochondriale. Le transport des lectrons et des protons est reprsent sur la figure 43-2. Navette Aspartate/malate e La 3 navette est plus complique car elle suppose dabord la formation de loxaloactate par une raction de transamination entre laspartate et l-ctoglutarate. Loxaloactate form ne dispose pas de transporteur. Il est rduit en malate par les lectrons et les protons de NADH,H+ cytosolique. Le malate, laspartate et l-ctoglutarate sont capables de traverser la membrane mitochondriale interne. Linterconversion du malate et de loxaloactate est catalyse par la malate dshydrognase. Les ractions dans le cytosol et dans la matrice sont illustres sur la figure 43-3.
3.8 DEFICIENCES HERITEES LIEES A LA PHOSPHORYLATION OXYDATIVE A lattention des tudiants de PCEM1 La mitochondrie contient environ 100 protines. Treize des protines, engages dans le transport des lectrons et dans la synthse de lATP, sont synthtises dans la mitochondrie partir de lADN mitochondrial. Les autres sont synthtises dans le cytosol et importes dans la mitochondrie. Les dfauts rencontrs dans la phosphorylation oxydative sont dus aux mutations intervenues dans le DNA mitochondrial (provenant uniquement de la mre). Ces dfauts affectent essentiellement les tissus grands consommateurs dATP comme le foie, le muscle cardiaque et squelettique, le cerveau et les reins. Lune des dficiences graves rencontre est la neuropathie optique hrditaire de Leber. Elle entrane une perte bilatrale de la vision centrale conscutive une insuffisance de production de lATP.
4 - PHOTOPHOSPHORYLATION La phosphorylation oxydative permet tous les tres vivants, htrotrophes et autotrophes, pouvant vivre en prsence doxygne, de fabriquer de lATP partir de composs nergtiques, essentiellement glucides et lipides. Chez les autotrophes, vgtaux et microorganismes chlorophylliens, il existe une voie importante de production de lATP la lumire, par conversion de lnergie lumineuse. Dans ces conditions la synthse d'ATP partir d'ADP et de Pi est indpendante de toute oxydation lie l'oxygne. Sur le plan biochimique, les ractions de la phase lumineuse conduisent la + formation de lnergie sous forme dATP et de pouvoir rducteur sous forme de NADPH,H . + Ces deux composs ATP et NADPH,H sont essentiellement consomms au cours de lassimilation du CO2 en prsence de H2O pour la synthse des glucides (Cycle de Calvin). Le processus de production dATP couple au transport des lectrons dans la chane photosynthtique est la photophosphorylation ou phosphorylation photosynthtique.
4.1 - DEFINITION - LOCALISATION La photophosphorylation est la synthse de l'ATP partir de l'ADP et du Pi, couple au transport des lectrons au cours de la photosynthse. Elle est sous la dpendance de la lumire. Les lectrons sont fournis par la photolyse de leau. Elle est aussi dfinie comme la conversion de l'nergie lumineuse en nergie chimique sous forme d'ATP. La photophosphorylation se droule dans les chloroplastes des vgtaux et des algues, et dans la membrane plasmique ou dans les chromatophores des bactries photosynthtiques. Le chloroplaste a une structure comparable celle de la mitochondrie mais avec une taille plus grande variant de 1 10 nm. Comme la mitochondrie il possde son propre ADN. On distingue : : une membrane externe, unique et continue trs fragile, hautement permable aux petites molcules et aux ions.
10
une membrane interne continue, moins permable et entourant un vaste espace central appel STROMA. La membrane interne du chloroplaste contient un certain nombre de transporteurs de molcules chimiques notamment l'ATP, les acides dicarboxyliques. C'est le site d'interaction entre le chloroplaste et le cytoplasme. Contrairement la membrane interne des mitochondries, elle n'est pas replie en crtes et ne contient pas les complexes de transport d'lectrons. un espace intermembranaire sparant les deux membranes. Le systme photosynthtique qui absorbe la lumire, les complexes de transport des lectrons, les enzymes et protines de synthse de l'ATP sont contenus dans une troisime structure intrachloroplastique appele thylakode (figure 45). La membrane des thylakodes est impermable aux molcules et aux ions. Elle serait lquivalent de la membrane mitochondriale interne. La membrane thylakode enferme un espace intrieur : espace intrathylakode. On distingue deux types de chloroplastes Voir Figure 47 : - les chloroplastes granums (grana), situs dans les cellules msophylliennes des gramines tropicales. Ils constituent le type unique le plus reprsent dans les autres plantes, les algues vertes, etc... - les chloroplastes sans granums situs dans les cellules privasculaires des gramines tropicales, cellules haute production photosynthtique.
4.2 - LES GROUPES TRANSPORTEURS DELECTRONS Comme dans la chane respiratoire, le transport des lectrons est assur par des complexes multi-enzymatiques au nombre de 3 : - Le Photosystme II (PSII) auquel est associe la photolyse de leau - Le Photosystme I (PSI) - Le complexe intermdiaire ou le complexe bf
4.2.1 - Photosystme II ou PSII. Le photosystme II, localis dans les rgions accoles des granums, est organis comme suit, un centre ractionnel appel P680 dont le potentiel rdox standard est E = + 0.90 V. Le P680 est un complexe form dune chlorophylle a et dune protine. Ce complexe absorbe 680 nm do le nom de P680. un centre collecteur dnergie contenant des chlorophylles a, des chlorophylles b, des carotnodes, des phophytines (chlorophylles prives de lion Mg), etc. deux types de plastoquinones : QA fortement associe des protines membranaires, QB moins lie ces protines. Ce sont des accepteurs dlectrons provenant du centre ractionnel. La squence des ractions provoques par lactivation du centre raction par la lumire provoque lmission dun lectron par chaque P680 et son transport jusqu QB : 2 P680 2 P+680 + 2e + QB + 2H + 2e QBH2
11
Cette dernire quinone une fois rduite se dissocie de ses protines et sloigne par diffusion pour rduire une autre plastoquinone PQ. Pour jecter les deux lectrons du centre ractionnel (E=+0,90 V) et leur transport jusquaux quinones accepteuses (E=0 V) il a fallu apporter de lnergie, fournie par la lumire : G' = - 46 (0 - 0.9) =+ 41.4 kcal/mol. Pour compenser le dficit de charge cr sur les P680+ la dissociation de leau apporte les lectrons ncessaires. Ce processus est appel photolyse de leau, qui fait partie intgrante de PS II. + H2O 2e + 2H + O2 Le transfert des lectrons provenant de leau se fait un un vers le P 680+ grce un Complexe de photolyse de leau. Le donneur dlectrons dans ce complexe est un rsidu de tyrosine, appel Z, de la protine D1 du centre ractionnel du PSII. Le complexe de tyrosine rcupre ses lectrons dun autre complexe, (complexe Mn), qui reoit son tour les lectrons de leau. La squence des ractions est la suivante : 2 P680 + 2H+ + QB 2 P+680 + QBH2 2 Z + 2 P+680 2 Z+ + 2 P680 2 Z+ + (complexe Mn) 2 Z + (complexe Mn)2+ (complexe Mn)2+ + H2O (complexe Mn) + 2 H+ + O2 Le bilan du transfert des lectrons dans le photosystme II conduit une raction globale, productrice doxygne : H2O + QB QBH2 + O2
4.2.2 - Le Photosystme I (PSI) Il est localis dans les rgions non accoles des thylakodes et est organis comme suit, un centre ractionnel appel P700 dont le potentiel rdox standard est E =+ 0.43 V. Le P700 est un complexe form dune chlorophylle a et dune protine. Ce complexe absorbe 700 nm do le nom de P700. un centre collecteur dnergie contenant des chlorophylles a et des chlorophylles b Un accepteur A0 dont la structure est trs proche de celle dune chlorophylle Un accepteur A1 qui est une phylloquinone une Ferrdoxine, protine Fer-Soufre, de potentiel redox standard E = - 0.42 V, faiblement lie la membrane Le transport des lectrons est analogue celui du PSII. Les lectrons arrachs aux P700 sont capts par le complexe Ai form de A0, A1 et A2. Les lectrons passent de Ao (phophytine) la phylloquinone (A1) puis A2. Ils sont transfrs par lintermdiaire de protines Fer-Soufre la ferrdoxine faiblement lie la membrane thylakode. Les + lectrons chouent finalement au niveau de NADP par lintermdiaire dune flavoprotine, + . appele ferrdoxine-NADP oxydorductase .
12
La raction rsultante est : 2 Fdred- + 2H+ + NADP+ 2 Fd ox+ NADPH,H+ Le P700 oxyd rcupre ses lectrons de la plastocyanine une protine soluble contenant du cuivre. Le transport d'lectrons du P700 jusqu' la ferrdoxine ncessite lapport de lnergie fournie par la lumire : G'o = - 46 E'o -46 (- 0.42 - 0.43) = + 39 kcal/mol
4.2.3 Complexe III : Complexe bf ou Complexe intermdiaire Les lectrons stocks au niveau de QBH2 sont transports jusquau niveau de P700 par lintermdiaire de protines membranaires connues sous le nom de complexe bf et une plastocyanine. Le premier cytochrome est du type b (b6) contenant deux groupements hminiques, le deuxime est le cytochrome f. Le transport se fait par lintermdiaire dune protine fer-soufre. Le fonctionnement de ce complexe est analogue celui du complexe III des mitochondries, qui transporte les lectrons du CoQH2 (liposoluble) au cyt c (hydrosoluble). Dans la membrane thylakode les lectrons sont transports de QBH2 (liposoluble) la plastocyanine (hydrosoluble). Le transport des lectrons au niveau du complexe bf, qui se comporte comme une pompe protons, entrane la formation dun gradient de densit de protons. Ces derniers sont pomps du stroma vers lintrieur du thylakode. Ce gradient sera indispensable la synthse de lATP. Le transport des lectrons dans ce complexe se fait dans le sens dune augmentation du potentiel, ce qui entrane entre PQ et le cytochrome f une libration dnergie qui peut tre estime comme suit : G' = - 46 (+ 0.365 - 0) = - 16.8 kcal/mol.
4.2.4 - Organisation du transport des lectrons Il existe deux types de transport d'lectrons: - Le transport acyclique ou non cyclique Le flux d'lectrons met en jeu les deux photosystmes et le complexe intermdiaire. Les lectrons arrachs l'eau sont achemins jusqu'au NADP+; le flux d'lectrons est non cyclique. Il lui est associ une synthse d'ATP, appele Photophosphorylation acyclique, et la production doxygne. Voir figure 45 et 46). - Le transport cyclique Le second flux d'lectrons met en jeu uniquement le photosystme I et une partie du complexe intermdiaire. Les lectrons jects du PSI, activ par la lumire, reviennent au PSI travers le cyt.b6, le cyt.f et la plastocyanine. La synthse d'ATP qui y est lie est appele Photophosphorylation cyclique. Son fonctionnement nentrane ni formation de + NADPH,H ni dgagement doxygne. Voir figures 45 et 46.
13
4.3 - CREATION DE GRADIENT DE DENSITE DE PROTONS Lanalogie entre les proprits membranaires de la membrane mitochondriale interne et celles des thylakodes laissait prsager des fonctionnements similaires savoir que la synthse de lATP est couple au transport des lectrons. Ce couplage est assur par la cration de gradient de densit de protons, dcouverte par Jagendorff en 1966. Dans le chloroplaste on observe que : les centres ractionnels, les centres collecteurs dnergie lumineuse, les protines impliques dans le transport des lectrons et lATP synthtase sont localiss dans la membrane thylakode. La photophosphorylation ne peut se faire que si la membrane thylakode est intacte. la membrane thylakode est impermable aux protons. La phosphorylation peut tre dcouple par des agents chimiques qui inhibent la synthse de lATP. la synthse de lATP est assure par un complexe CFo-CF1 analogue celui rencontr dans la membrane mitochondriale interne. L'coulement des lectrons le long du flux non cyclique ou cyclique cre un gradient de densit de protons travers la membrane des thylakodes au niveau du complexe bf qui fonctionne comme une pompe protons. Les protons sont pomps du stroma vers lintrieur du thylakode qui devient ainsi plus acide. Dans la membrane chloroplastique nous avons vu qu'il existait une sgrgation entre PSI et PSII au point de vue localisation. PSI et l'ATPsynthtase sont localiss dans les zones non accoles de la membrane. PSII est situ dans les zones accoles des granums. Le cyt b6 et le cyt f sont uniformment rpartis. On conoit que le transport des lectrons entre les 2 photosystmes soit assur par les lments mobiles savoir la plastoquinone et la plastocyanine. C'est au cours de ce transport que les protons sont pomps du stroma vers lintrieur de la membrane thylakode.
4.4 - MECANISME DE LA SYNTHESE DE LATP : THEORIE DE MITCHELL La formation de lATP exige le transport des lectrons, activ par la lumire. Elle ncessite la cration dun gradient de densit de protons entre le stroma et l'intrieur du thylakode. L'ensemble enzymatique qui assure la synthse de l'ATP est appel complexe CF1CFo. CFo est appel le canal protonique. Il est responsable du reflux des protons de l'espace intrathylakoide vers le stroma qui active la synthse de l'ATP et libre lnergie ncessaire. L'enzyme qui assure la synthse de l'ATP (ATP synthtase) est contenue dans le complexe CF1. Ce complexe est enferm dans les sphres qui font saillie la face externe des membranes thylakodes (Voir figure 49). Dans les mitochondries l'enzyme, jouant le rle similaire, est enferme dans des protubrances sphriques qui font saillie sur la face matricielle de la membrane mitochondriale interne.
14
Le transfert d'lectrons acyclique ou cyclique produit au niveau du complexe bf un vaste gradient de protons travers la membrane des thylakodes. L'espace intrathylakode devient nettement acide avec un pH de l'ordre de 4. Le gradient transmembranaire induit un pH de l'ordre de 3.5. Environ 3 moles de protons s'coulent entre le complexe CF1CFo donnant un G de -14.4 kcal/mol, suffisant pour la formation d'une mole dATP. Aucun ATP n'est form si le gradient cr est infrieur 2 units pH. Comme le complexe enzymatique de synthse de l'ATP se trouve sur la face stromale des thylakodes, l'ATP form et le NADPH,H+ rsultant du transport acyclique d'lectrons sont librs directement dans le stroma o se trouvent toutes les enzymes ncessaires leur utilisation pour la transformation du CO2 en glucides dans le Cycle de Calvin.
15
PHOSPHORYLATIONS CELLULAIRES CE QUIL FAUT RETENIR Caractristiques Localisation Photophosphorylation Chloroplastes - Activation photo-dpendante de PSI et de ractions PSII (ractions endergoniques). Energtique des Squences spontanes (exergoniques) - Autres squences de ractions processus spontanes Transport dlectrons - Localisation. Membrane interne Membrane thylakode - Donneur dlectrons et NADH,H+, FADH2 ou autres H2O (photolyse) de protons composs - CI : NADH,H -CoQ Rductase - PS II : organis autour du P680 Composition des -CII : Succinate-CoQ - PS I : organis autour du P700 Complexes transporteur Rductase - CIII : CoQH2-Cyt c Rductase - Complexe bf - CIV : Cyt c Oxydase Organisation - Transport acyclique : Les lectrons circulent de H2O jusquau NADP+ (Coopration de PSII, PSI et complexe bf) - Transport cyclique : Les lections partent de P700 et retournent P700 Synthse de lATP - Cration de gradient 1 pompe protons au niveau 1 pompe protons au niveau du de densit de protons des complexes CI, CII et CIII. complexe bf. Les protons sont pomps du Les protons sont pomps de la stroma vers lintrieur du thylakode matrice vers lespace travers la membrane thylakode intermembranaire travers la membrane mitochondriale interne - Complexes protiques - Fo (Canal protonique) - CFo (Canal protonique) assure le assure le reflux des protons de reflux des protons de lintrieur du lespace intermembranaire vers thylakode vers le stroma. la matrice. - Complexe F1 (ATP Complexe CFI (ATP synthtase) synthtase) 3 ATP partir de NADH,H+ - transport acyclique : 1 ATP, NADPH,H+ Produits du processus - 2 ATP partir de FADH2 et O2 . - Transport cyclique : 1 ATP ATP transport hors de la ATP et NADPH,H+ sont consomms dans Devenir de lATP mitochondrie par lADP-ATP le stroma : Voies de carboxylation, Cycle form translocase pour couvrir les de Calvin et autres biogenses. besoins de la cellule Htrotrophes et Autotrophes Autotrophes (vgtaux, algues et Organismes vivants (organismes chlorophylliens) microorganismes chlorophylliens) Les lectrons circulent linairement de NADH,H+ ou de FADH2 jusqu loxygne
+
Phosphorylation oxydative Mitochondries
Вам также может понравиться
- Acides nucléiques: Les Grands Articles d'UniversalisОт EverandAcides nucléiques: Les Grands Articles d'UniversalisОценок пока нет
- Chapitre 10Документ21 страницаChapitre 10agirmanmazlum3468Оценок пока нет
- La Respiration Cellulaire 1 PDFДокумент27 страницLa Respiration Cellulaire 1 PDFyyyyy100% (1)
- Chapitre 2Документ25 страницChapitre 2Mohamed OuanaimОценок пока нет
- UE1-Biochimie-9-Phosphorylation OxydativeДокумент24 страницыUE1-Biochimie-9-Phosphorylation Oxydativesun-nee-chan9Оценок пока нет
- UntitledДокумент97 страницUntitledGhita KhalilОценок пока нет
- Chaine RespiratoireДокумент30 страницChaine RespiratoireMadra 30Оценок пока нет
- Les Navettes 2011 PPT 5Документ37 страницLes Navettes 2011 PPT 5SOSOОценок пока нет
- Campbell, Réponses Cahier Coop ch4Документ4 страницыCampbell, Réponses Cahier Coop ch4simmboisОценок пока нет
- Ecosys MicrobДокумент33 страницыEcosys MicrobRanya AchetОценок пока нет
- Métabolisme Bactérien (DAOUDI Romaissa)Документ8 страницMétabolisme Bactérien (DAOUDI Romaissa)sumaleeОценок пока нет
- SMicrobiologie Environnementale Partie 3Документ17 страницSMicrobiologie Environnementale Partie 3Basmã AlilecheОценок пока нет
- Biochimie - Metabolique - 092955 (1) RaДокумент366 страницBiochimie - Metabolique - 092955 (1) Raedouardkandolo36Оценок пока нет
- CoenzymeДокумент11 страницCoenzymemido benОценок пока нет
- 30.09.2015 Catabolisme CellulaireДокумент23 страницы30.09.2015 Catabolisme CellulaireEaОценок пока нет
- Biochimie MetaboliqueДокумент360 страницBiochimie MetaboliqueMafankoloОценок пока нет
- CoenzymesДокумент11 страницCoenzymesCedric arold Sidje tchomguiОценок пока нет
- FC1 GALUSCA Rappels Des Grandes Voies Metaboliques Et Leurs Integrations 10.01Документ20 страницFC1 GALUSCA Rappels Des Grandes Voies Metaboliques Et Leurs Integrations 10.01Romane chapuisОценок пока нет
- 5 - Métabolisme Biochimique BactérienДокумент42 страницы5 - Métabolisme Biochimique BactérienGuerfi RayeneОценок пока нет
- Mitocondria FRДокумент27 страницMitocondria FRAnea Andrei XaveriuОценок пока нет
- Respiration Cellulaire PR Rajaonera TovoДокумент46 страницRespiration Cellulaire PR Rajaonera TovoFahendrenaОценок пока нет
- Chapitre 9Документ39 страницChapitre 9sino spagoОценок пока нет
- Chapitre X Les MitochondriesДокумент12 страницChapitre X Les MitochondriesMichael Alafakis100% (1)
- Energie, Anabolisme D'énergie (Photosythèse)Документ5 страницEnergie, Anabolisme D'énergie (Photosythèse)Chawki MokademОценок пока нет
- La Chaine Respiratoire Mitochondriale Et Mecanisme de Transfert Des ElectronsДокумент8 страницLa Chaine Respiratoire Mitochondriale Et Mecanisme de Transfert Des ElectronsJean-Loïc BauchetОценок пока нет
- Métabolisme 1Документ22 страницыMétabolisme 1[AE]100% (1)
- 3 - Chaine RespiratoireДокумент22 страницы3 - Chaine Respiratoiresoufianezenasni008Оценок пока нет
- La-Chaine-Respiratoire ETUDIANTSДокумент41 страницаLa-Chaine-Respiratoire ETUDIANTSSamehОценок пока нет
- Quelles Sont Les 2 Phases de La PhotosynthèseДокумент7 страницQuelles Sont Les 2 Phases de La PhotosynthèseMasseylasse EvaОценок пока нет
- Le MétabolismeДокумент37 страницLe MétabolismeSOLTANIОценок пока нет
- Production Et Role ATPДокумент3 страницыProduction Et Role ATPWACDОценок пока нет
- 06-Phosphorylation OxydativeДокумент27 страниц06-Phosphorylation OxydativealciaflsОценок пока нет
- FrançaisДокумент5 страницFrançaistiakola031Оценок пока нет
- L Essentiel A RetenirДокумент27 страницL Essentiel A RetenirAziz Abdou100% (1)
- TD Corrigé Métabolisme Des GlucidesДокумент2 страницыTD Corrigé Métabolisme Des GlucidesMbaye AbouОценок пока нет
- Métabolisme Des Glucides Suite 02Документ34 страницыMétabolisme Des Glucides Suite 02Khã WlaОценок пока нет
- Cours 15 - MitochondriesДокумент25 страницCours 15 - Mitochondriesfellah aminaОценок пока нет
- FermentariДокумент53 страницыFermentariBulat AlexandrinaОценок пока нет
- Energie, Anabolisme, CatabolismeДокумент5 страницEnergie, Anabolisme, CatabolismeMohemed MohamedОценок пока нет
- 2.bioener Metab RegulДокумент140 страниц2.bioener Metab RegulKenza Kassab100% (1)
- Chap 1Документ21 страницаChap 1Radjaa AddОценок пока нет
- Chap 9 Et 10Документ11 страницChap 9 Et 10ĄbdÖù CatalonОценок пока нет
- Cours de MétabolismeДокумент22 страницыCours de MétabolismealmnaouarОценок пока нет
- MétabolismeДокумент26 страницMétabolismeAhmedОценок пока нет
- Physiologie Vegetale Cours 5photosynthese2Документ12 страницPhysiologie Vegetale Cours 5photosynthese2SALAH-EDDINE AZIZIОценок пока нет
- Chaine RespiratoireДокумент1 страницаChaine RespiratoireayoubborombaОценок пока нет
- La Production d'ATP - Tle - Cours SVT - KartableДокумент18 страницLa Production d'ATP - Tle - Cours SVT - KartableJawad AamriОценок пока нет
- Diversité Métabolique Des MicroorganismesДокумент4 страницыDiversité Métabolique Des MicroorganismesAzalais Garcia CrosОценок пока нет
- Le Métabolisme ÉnergétiqueДокумент5 страницLe Métabolisme ÉnergétiqueJoses TatsiОценок пока нет
- Cycle de Krebs Pr. CherkaouiДокумент35 страницCycle de Krebs Pr. CherkaouiOumayma El YamaniОценок пока нет
- CRMДокумент40 страницCRMcepОценок пока нет
- A/ Glycolyse (Ou Voie d'Embden-Meyerhof) : A) Les Différentes Étapes de La GlycolyseДокумент6 страницA/ Glycolyse (Ou Voie d'Embden-Meyerhof) : A) Les Différentes Étapes de La GlycolysemaryОценок пока нет
- Photosynthese 2 S3 Licence HorticultureДокумент43 страницыPhotosynthese 2 S3 Licence HorticultureHicham Ait BouhouОценок пока нет
- PhotosyntheseДокумент7 страницPhotosynthesesaraОценок пока нет
- TD Métabolisme 2005-2006Документ4 страницыTD Métabolisme 2005-2006Hana Zidi100% (1)
- Les Mécanismes Fondamentaux de La PhotosynthèseДокумент24 страницыLes Mécanismes Fondamentaux de La PhotosynthèseJohns AtsacwounОценок пока нет
- Chapitre 5-La Glycolyse (Voie D'embden-Meyeroff-Parnas)Документ17 страницChapitre 5-La Glycolyse (Voie D'embden-Meyeroff-Parnas)stephen njemsОценок пока нет
- Cours4 Respiration Cellulaire A23Документ46 страницCours4 Respiration Cellulaire A23MashaimОценок пока нет
- Les Peroxysomes 2015Документ3 страницыLes Peroxysomes 2015Hai TemОценок пока нет
- Elements Dastronomie Fondamentale PDFДокумент78 страницElements Dastronomie Fondamentale PDFLimoune AliОценок пока нет
- Algebre Lineaire Reduction Des Endomorphismes Cours Et Exercices CorrigesДокумент260 страницAlgebre Lineaire Reduction Des Endomorphismes Cours Et Exercices CorrigesAhmed RabiiОценок пока нет
- Un Voyage Dans L'espace Et Le Temps: L. Gallot, J.P. Guillet, E. Pilon, E. Ragoucy, R. TailletДокумент50 страницUn Voyage Dans L'espace Et Le Temps: L. Gallot, J.P. Guillet, E. Pilon, E. Ragoucy, R. TailletAhmed RabiiОценок пока нет
- CosmologieДокумент42 страницыCosmologieAhmed RabiiОценок пока нет
- Adjectifs PDFДокумент1 страницаAdjectifs PDFAhmed RabiiОценок пока нет
- L'eau Et La VieДокумент1 страницаL'eau Et La VieAhmed RabiiОценок пока нет
- InterpolationДокумент15 страницInterpolationAhmed RabiiОценок пока нет
- Polycopié de Jean-Pierre ROZET, Première Partie (2009-2010)Документ30 страницPolycopié de Jean-Pierre ROZET, Première Partie (2009-2010)Ahmed RabiiОценок пока нет
- Elements Dastronomie Fondamentale PDFДокумент78 страницElements Dastronomie Fondamentale PDFLimoune AliОценок пока нет
- Methode Numerique en JavaДокумент230 страницMethode Numerique en JavamauricetappaОценок пока нет
- TPДокумент4 страницыTPAhmed RabiiОценок пока нет
- Des Mathématiques Pour Les Sciences 2Документ72 страницыDes Mathématiques Pour Les Sciences 2Ahmed Rabii67% (3)
- TD1AN17Документ2 страницыTD1AN17manalОценок пока нет
- ExДокумент24 страницыExAhmed RabiiОценок пока нет
- Sujet Corrige EF Analyse Numerique1 16-17Документ4 страницыSujet Corrige EF Analyse Numerique1 16-17Ahmed RabiiОценок пока нет
- Analys Num Exer Corige 1Документ8 страницAnalys Num Exer Corige 1Anonymous ehE1UOTwooОценок пока нет
- TD4 An 2018Документ3 страницыTD4 An 2018Ahmed RabiiОценок пока нет
- Centrale Supelec PC 2006 Maths 1 EpreuveДокумент6 страницCentrale Supelec PC 2006 Maths 1 EpreuveAhmed RabiiОценок пока нет
- Exercices en Langage C++ - Les Fonctions - Wikilivres PDFДокумент9 страницExercices en Langage C++ - Les Fonctions - Wikilivres PDFAhmed RabiiОценок пока нет
- Rombaldi - Problèmes Corrigés D'agrégation Externe - Maths Général PDFДокумент279 страницRombaldi - Problèmes Corrigés D'agrégation Externe - Maths Général PDFAhmed RabiiОценок пока нет
- Examen 2017Документ2 страницыExamen 2017Ahmed RabiiОценок пока нет
- Exercices en Langage C++ - Les Fonctions - Wikilivres PDFДокумент9 страницExercices en Langage C++ - Les Fonctions - Wikilivres PDFAhmed RabiiОценок пока нет
- Livres Astrophysique GlobaleДокумент120 страницLivres Astrophysique GlobaleAhmed RabiiОценок пока нет
- TD5 An 2018Документ2 страницыTD5 An 2018Ahmed RabiiОценок пока нет
- Sujet Corrige CC AnalyseNumerique1Документ3 страницыSujet Corrige CC AnalyseNumerique1Ahmed Rabii100% (1)
- Polynomes Orthogonaux Legendre Ch2Документ42 страницыPolynomes Orthogonaux Legendre Ch2Ahmed RabiiОценок пока нет
- Détermination Du Spectre Relativiste de L'atome D'hydrogéne Par L'approche de BarrosДокумент110 страницDétermination Du Spectre Relativiste de L'atome D'hydrogéne Par L'approche de BarrosAhmed RabiiОценок пока нет
- Residus 12Документ5 страницResidus 12Mohamed BGcityОценок пока нет
- Détermination Du Spectre Relativiste de L'atome D'hydrogéne Par L'approche de BarrosДокумент110 страницDétermination Du Spectre Relativiste de L'atome D'hydrogéne Par L'approche de BarrosAhmed RabiiОценок пока нет
- Equation de BesselДокумент3 страницыEquation de BesselAhmed RabiiОценок пока нет
- Annales de Biocell-QcmДокумент16 страницAnnales de Biocell-QcmMedoumar Alagude100% (2)
- Polycopié de BiochimieДокумент14 страницPolycopié de BiochimienasroddineОценок пока нет
- Chapter I - Structures Des Acide Nucleiques - 2020Документ25 страницChapter I - Structures Des Acide Nucleiques - 2020julien KoudouОценок пока нет
- Ue2 Le Systa Me Endomembranaire PDFДокумент28 страницUe2 Le Systa Me Endomembranaire PDFbaya100% (1)
- QUESTIONNAIRE COURS BIOLOGIE CELLULAIRE 1ERE ANNEE PHARMACIE - No KeyДокумент11 страницQUESTIONNAIRE COURS BIOLOGIE CELLULAIRE 1ERE ANNEE PHARMACIE - No KeyKeishaОценок пока нет
- Banque GénétiqueДокумент19 страницBanque GénétiqueMeryem AnjjarОценок пока нет
- Diaporama Biologie JBD 2020Документ270 страницDiaporama Biologie JBD 2020reemalfhad59Оценок пока нет
- نايل h (2) -1Документ136 страницنايل h (2) -1yasminebou20005Оценок пока нет
- Cycle de KrebsДокумент29 страницCycle de Krebsvague2000Оценок пока нет
- CoagulationДокумент6 страницCoagulationI.m. DanielОценок пока нет
- Controle Acides Nucléiques PDFДокумент6 страницControle Acides Nucléiques PDFMouhssine ELОценок пока нет
- EnzymesДокумент6 страницEnzymesRoudaina BenzeguirОценок пока нет
- FT Geniegen2Документ1 страницаFT Geniegen2Salomé RouleaudОценок пока нет
- Cours Stress oxydant-M2-PCP-2021Документ26 страницCours Stress oxydant-M2-PCP-2021Imane AbОценок пока нет
- M2OSB Exam MS 2020 2021Документ5 страницM2OSB Exam MS 2020 2021ely59000asОценок пока нет
- 2 - Antigènes 2020Документ18 страниц2 - Antigènes 2020إبحث و تعلمОценок пока нет
- Synthèse de Protéines 1Документ3 страницыSynthèse de Protéines 1Aymane KrachiОценок пока нет
- Échelle Arbitraire. La Perception Du Goût Sucré Est Très Subjective. Aspartame: Pouvoir Sucrant 180. Mais Ce N'est Pas Un Glucide C'est Un Dipeptide!Документ14 страницÉchelle Arbitraire. La Perception Du Goût Sucré Est Très Subjective. Aspartame: Pouvoir Sucrant 180. Mais Ce N'est Pas Un Glucide C'est Un Dipeptide!Matéo ROBINОценок пока нет
- TP Bioch Struc - FRДокумент33 страницыTP Bioch Struc - FRGhina El Ess100% (2)
- Fiche TD Enzymologie Réactions Enzymatiques - CopieДокумент2 страницыFiche TD Enzymologie Réactions Enzymatiques - Copiebenali anfalОценок пока нет
- Chapitre XI MitochondrieДокумент18 страницChapitre XI Mitochondrierana timoumiОценок пока нет
- Controle Finale BIOCHIMIE GBMS1 S AUTOMNE 2021Документ7 страницControle Finale BIOCHIMIE GBMS1 S AUTOMNE 2021yassine faradiОценок пока нет
- BIOS 301 TD - Partie Bioénergetique - 2018-2019Документ2 страницыBIOS 301 TD - Partie Bioénergetique - 2018-2019Jalelo AbdelОценок пока нет
- 1 HémoglobineДокумент4 страницы1 HémoglobineMadani KoneОценок пока нет
- Voie Des Pentoses Phosphates (MaJ) - 2Документ1 страницаVoie Des Pentoses Phosphates (MaJ) - 2Hadrien De Greef100% (2)
- Exercices en Biochimie Pour RevisionДокумент8 страницExercices en Biochimie Pour Revisionامة الله100% (1)
- Cyto1an Mitochondrie2022aouatiДокумент12 страницCyto1an Mitochondrie2022aouatiAy ManОценок пока нет
- Cours5 SéquençageДокумент16 страницCours5 SéquençageNicholОценок пока нет
- Memoire PDFДокумент139 страницMemoire PDFNina RytaОценок пока нет
- Listing Eden Medical Mai 2022 CorrigéДокумент6 страницListing Eden Medical Mai 2022 CorrigéGuiselle EhawaОценок пока нет