Академический Документы
Профессиональный Документы
Культура Документы
CG 05
Загружено:
Sotero Alperi ColungaОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
CG 05
Загружено:
Sotero Alperi ColungaАвторское право:
Доступные форматы
Disoluciones 1/7
QUMICA
Mezclas homogneas de slidos, lquidos y gases
Las disoluciones
Con frecuencia, los sistemas qumicos con los que trabajamos no los encontramos formados por sustancias puras, sino por mezclas de varias sustancias qumicas. En la mayora de las ocasiones vamos a trabajar con un tipo especial de estas mezclas, que denominamos disoluciones, ya que stas nos aportan algunas ventajas de tipo prctico, como por ejemplo que diferentes sustancias en disolucin se mezclan fcilmente o que podemos medir cantidades de sustancias de forma relativamente sencilla. Como veremos, cualquier disolucin est constituida, al menos, por dos sustancias: una de ellas, la que encontramos en mayor cantidad, es a la que denominamos disolvente, y la otra, la que est en menor proporcin, es la que se denomina soluto. Tanto el soluto como el disolvente pueden tratarse de un slido, un lquido o un gas. Una de las principales caractersticas de una disolucin es su concentracin, esto es, la cantidad de soluto que tenemos en una cantidad concreta de disolvente.
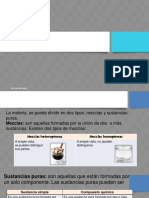
Las sustancias se pueden presentar puras o mezcladas. En qumica, utilizamos mucho un tipo de mezclas homogneas: las disoluciones.
Las distintas sustancias que manejamos no siempre las tenemos como sustancias puras, sino como mezclas. Las sustancias que componen una mezcla se encuentran interactuando en mayor o menor grado, pero no reaccionan qumicamente entre s, sino que cada sustancia sigue manteniendo su entidad (ver ficha: Estequiometra). Estas mezclas pueden ser entre sustancias slidas, como por ejemplos algunas aleaciones entre metales, entre lquidos, por ejemplo el alcohol 95% (etanol + agua), entre gases, por ejemplo el aire (mezcla de O2, N2, vapor de H2O), slido-lquido (azcar en agua), slido-gas (humo), o lquido-gas (en bebidas gaseosas: agua + CO2). El resultado de mezclar dos o ms sustancias puede darnos un material totalmente homogneo, por ejemplo el aire, con el mismo aspecto y propiedades en toda su extensin (mezclas homogneas) o heterogneo, por ejemplo el suelo (mezclas heterogneas). Hay unas mezclas homogneas que son de especial inters para los qumicos debido a su gran utilidad: las disoluciones, en ellas, el tamao de las partculas de las diferentes sustancias que la componen, o los agregados de estas, es tan pequeo que no las podemos observar a simple vista. A la sustancia o sustancias que tenemos en menor proporcin en la disolucin las denominamos solutos. El soluto se disuelve en otra sustancia que ser la mayoritaria y que denominamos disolvente. Muy frecuentemente utilizamos el agua como disolvente, y denominamos a las disoluciones resultantes disoluciones acuosas. Como bien sabemos, no todas las sustancias son solubles entre s, se trata de un juego de fuerzas: para que una sustancia (soluto) sea soluble en otra (el disolvente) las fuerzas de atraccin que mantienen unidas a las molculas o iones en el soluto tienen que ser superadas por las fuerzas que atraen a las partculas del soluto y el disolvente en la disolucin. Esto sucede, por ejemplo, si mezclamos sal (NaCl) y agua. Por el contrario, cuando mezclamos agua y aceite las fuerzas de atraccin de las molculas de agua entre s, y de las molculas de aceite entre s, son superiores a las que pueden existir entre las molculas de agua con aceite: los mezclamos, pero no se disuelven.
Mezcla: Agregacin o incorporacin de varias sustancias, sin que reaccionen qumicamente entre s, cada sustancia en la mezcla conserva sus propias caractersticas. Mezcla homognea Mezcla que tiene una composicin constante en toda su extensin (sus componentes interactan ntimamente entre s). Mezcla heterognea Mezcla que tiene una composicin diferente segn la zona donde se observe (los componentes sufren entre si interacciones muy pequeas). Disolucin: Mezcla homognea en la que el tamao de las partculas que la componen es tan pequeo que no lo podemos observar a simple vista (los tomos, iones o molculas que constituyen el soluto no estn agregados entre s, sino separados por el disolvente). Soluto: Sustancia que encontramos en menor proporcin en una disolucin. Disolvente: Sustancia que encontramos en mayor proporcin en una disolucin.
UNIVERSIDAD NACIONAL DE EDUCACIN A DISTANCIA
Autora: Mercedes de la Fuente Rubio
Disoluciones 2/7
QUMICA
Concentracin de las disoluciones
Mezclas homogneas de slidos, lquidos y gases
Las disoluciones
La concentracin es una de las propiedades que mejor caracterizan una disolucin. Cuando expresamos la concentracin de una disolucin estamos diciendo cul es la proporcin entre soluto y disolvente. As, por ejemplo, podemos dar la masa de un soluto (gramos) disuelta en un determinado volumen (litros) de disolucin o de disolvente, o cantidad de sustancia (moles) disuelta en una determinada cantidad de disolvente, etc Lo digamos como lo digamos, siempre estamos aportando la misma informacin: proporcin entre soluto y disolvente. Qu forma elegimos? La que nos resulte ms cmoda y til, segn el caso Tanto por ciento en masa y tanto por ciento en volumen En general estamos muy acostumbrados a utilizar el porcentaje para indicar la relacin entre dos cantidades, referidas a un total de 100. Cuando indicamos la concentracin de una disolucin como el tanto por ciento en masa (% m/m) estamos dando el porcentaje en masa (gramos) del soluto contenido en 100 g de disolucin. Por ejemplo, una disolucin acuosa al 20% en peso de sacarosa contendr 20 g de sacarosa por cada 100 g de disolucin (sacarosa + agua). Dicho de otra forma: en cada 100 g de disolucin tendremos 20 g de sacarosa y 80 g de disolvente (en este caso agua). Dado que el disolvente en muchas ocasiones ser un lquido, conviene recordar que la conversin entre volumen y masa es inmediata conociendo la densidad de la sustancia (densidad = masa / volumen). Cuando el soluto tambin sea un lquido, nos resultar ms cmodo medir volmenes que masas. En estos casos podemos expresar la concentracin como el tanto por ciento en volumen (% v/v). As por ejemplo, si hablamos de una disolucin acuosa de etanol al 95% en volumen estamos indicando que tendremos 95 mL de etanol en cada 100 mL de disolucin (etanol + agua) (conviene recordad que cuando se mezclan dos sustancias, los volmenes no son aditivos). En algunas ocasiones tambin se utiliza el porcentaje masa/volumen (% m/v) que expresa el porcentaje en masa (gramos) del soluto contenido en 100 mL de disolucin. Fracciones molares
Concentracin: Proporcin entre la cantidad de soluto y la cantidad de disolvente de una disolucin. Tanto por ciento en masa: Porcentaje en masa (gramos) del soluto contenidos en 100 g de disolucin. masa soluto (g) %m/m = 100 masa disolucin (g) Tanto por ciento en volumen: Porcentaje en volumen (mL) del soluto contenidos en 100 mL de disolucin. vol. soluto (mL) % v/v = 100 vol. disolucin (mL) Porcentaje masa/volumen: Porcentaje en masa (g) del soluto contenidos en 100 mL de disolucin. masa soluto (g) %m/v = 100 vol. disolucin (mL) Densidad: Propiedad de una sustancia que expresa el volumen ocupado por una masa concreta de esa sustancia. Fracciones molares: Nmero de moles total de una sustancia en una mezcla, dividida por el nmero total de moles en la mezcla (moles de soluto + moles de disolvente).
s =
no moles soluto no moles totales
Sabemos que la unidad qumica para medir cantidad de sustancia es el mol, por tanto, tambin podemos indicar la cantidad de soluto y de disolvente expresando la relacin entre el nmero de moles de cada uno de los componentes de una disolucin en relacin con el nmero de moles totales que tenemos en la disolucin. Por ejemplo, imaginemos una mezcla de dos sustancias, A y B. La fraccin molar de A ser el nmero de moles de A en relacin con el nmero de moles total (n de moles de A + n de moles de B). La fraccin molar de B ser, de forma anloga, el nmero de moles de B en relacin con el nmero de moles total (n de moles de A + n de moles de B). Disoluciones para reacciones qumicas: Molaridad y Normalidad Cuando queremos provocar una reaccin qumica tenemos que poner en contacto las sustancias que van a reaccionar, lo que hacemos en muchas ocasiones mezclando dos disoluciones que contengan estos reactivos. Para que la reaccin transcurra de una forma ptima (ver ficha: Estequiometra) tendremos que poner una relacin de nmero de moles
Concentracin molar o molaridad: Nmero de moles de soluto por cada litro de disolucin.
M=
n o moles soluto volumen disolucin (L)
UNIVERSIDAD NACIONAL DE EDUCACIN A DISTANCIA
Autora: Mercedes de la Fuente Rubio
Disoluciones 3/7
QUMICA
Mezclas homogneas de slidos, lquidos y gases
Las disoluciones
concretos de cada una de estas sustancias. Por tanto, lo ms cmodo y prctico ser hablar de nmero de moles de cada sustancia para un volumen concreto de disolucin. As, definimos la concentracin molar o molaridad (M) como el nmero de moles (n) de soluto por cada litro de disolucin (mol.L-1). Por ejemplo, una disolucin acuosa 0,5 M de sacarosa contendr 0,5 moles de sacarosa en cada litro de disolucin. Con esta forma de expresar la concentracin no nos estamos preocupando de especificar exactamente la cantidad de disolvente: lo que realmente nos interesa es saber, por ejemplo, que si tenemos una disolucin 0,5 M de sacarosa y tomamos L de ella, en realidad all tendremos 0,25 moles de sacarosa, el resto, hasta completar el volumen de L, ser disolvente, en este caso agua, aunque de forma inmediata no podremos decir el nmero de moles exactos de agua que habr. Existen algunos tipos concretos de reacciones qumicas en las que en lugar de hablar de nmero de moles de sustancia nos resulta ms cmodo hablar de nmero de equivalentes. Este concepto adquiere sentido situndolo en relacin con reacciones cido-base y reacciones de oxidacin-reduccin (tambin denominadas reacciones redox). En las reacciones cido-base, de forma muy general, podemos decir que una de las sustancias que reaccionan, el cido, aportar protones (H+) que se combinarn con aniones OH- provenientes de la otra sustancia, la base, para formar agua (H2O). En las reacciones redox, un reactivo aporta electrones (agente reductor) que son captados por otro (agente oxidante). Lo que nos interesa en este tipo de reacciones es que haya cantidades equivalentes de cidos y bases o de agentes oxidantes y agentes reductores, respectivamente. Ms en concreto, necesitamos que sean equivalentes las cantidades de H+ y OH-, para formar molculas de H2O (en r. cido-base), y que los electrones que aporta el reductor sean equivalentes a los que puede captar el oxidante (en redox).
Nmero de equivalentes: + Nmero de H o de OH que un reactivo pone en juego en una reaccin cido-base, o nmero de electrones que cada reactivo pone en juego en una reaccin redox. Normalidad (N): Equivalente de soluto por cada litro de disolucin. Se debe definir el equivalente de soluto de acuerdo a la reaccin con la cual se trabaje.
Vamos a utilizar unos ejemplos de reacciones cido-base para describir a qu nos referimos con el nmero de equivalentes: . Si un mol de cido aporta un mol de H+ (ej: � NaCl HCl + NaOH + H2O cido clorhdrico) y reacciona con un mol Cl (aq) Na+(aq) de una base que aporta un mol de OH- (ej: NaOH) ambos aportan cantidades + + + equivalentes de H+ y OH- para la formacin OH (aq) H (aq) de molculas de H2O.
+
Cada mol de HCl aporta 1 mol de H
Cada mol de NaOH aporta 1 mol de OH
. Si en vez de HCl hiciramos reaccionar, por ejemplo, cido sulfrico (H2SO4) con esta misma base (NaOH), cada mol de H2SO4 aporta 2 moles de H+, por tanto, necesitaremos 2 moles de NaOH, para tener en nuestra mezcla de reaccin cantidades equivalentes de H+ y OH-, de cara a la formacin de molculas de H2O.
H2SO4 SO42-(aq) + + 2H (aq)
+
2 NaOH 2 Na+(aq) + 2 OH-(aq)
Na2SO4
+ 2H2O
Cada mol de H2SO4 aporta 2 moles de H
Cada mol de NaOH aporta 1 mol de OH
El numero de equivalentes del H2SO4 es 2, o lo que es lo mismo, cada mol de H2SO4 aporta 2 moles H+. El nmero de equivalentes del NaOH o del ClH es 1, es decir, cada mol de NaOH o HCl aporta, respectivamente, 1 mol de OH- o 1 mol de H+ Cuando queramos preparar disoluciones para estos tipos de reacciones, nos interesan que sean equivalente en cuanto al nmero de OH- o H+ que aportan cidos y bases. Por eso utilizamos el concepto de normalidad, para indicar las concentraciones en funcin del nmero de equivalente por litro de disolucin. De esta forma, una disolucin 1 Normal (1N) de H2SO4 ser aquella que contenga 1 mol de H+ por cada litro de disolucin, es fcil deducir que se corresponde con una disolucin que contenga 0,5 moles de H2SO4. De forma anloga, una disolucin 1 N de HCl o NaOH ser aquella que contenga 1 mol de H+ o de OH- por cada litro de disolucin, lo que en ambos casos se corresponde con una disolucin de molaridad 1 (1 mol de HCl o de NaOH por litro de disolucin).
UNIVERSIDAD NACIONAL DE EDUCACIN A DISTANCIA
Autora: Mercedes de la Fuente Rubio
Disoluciones 4/7
QUMICA
Mezclas homogneas de slidos, lquidos y gases
Las disoluciones
Como vemos existe una relacin directa entre la molaridad y la normalidad, determinada por el nmero de equivalentes de cada mol de sustancia. La normalidad ser igual a la molaridad multiplicada por el nmero de equivalentes de cada mol de sustancia, a lo que a veces se denomina valencia (v): Normalidad = Molaridad x valencia; dnde la valencia es igual al nmero de equivalentes por mol Expresiones de concentracin tiles en relacin con las propiedades coligativas de las disoluciones Las disoluciones poseen unas propiedades, que se denominan propiedades coligativas, stas se caracterizan por depender nicamente del nmero de partculas disueltas y no del tipo de stas. Para trabajar con estas propiedades nos resulta til hablar de la concentracin de las disoluciones de forma que indiquemos claramente cual es la cantidad de soluto y la cantidad de disolvente. Hemos visto que expresando concentracin en forma de fracciones molares estamos aportando esta informacin de forma muy clara, por lo que nos puede resultar de utilidad en este sentido. Adems, hay un concepto que nos aporta tambin esta informacin: la molalidad, trmino con el que estamos expresando la cantidad de soluto por masa de disolvente (no de disolucin). En concreto, la molalidad son los moles de soluto contenidos en un kilogramo de disolvente. Cuando las concentraciones son muy pequeas En disoluciones en las que las cantidades de solutos son muy pequeas, como ocurre, en muchas ocasiones, en mezclas de gases, hablamos de partes por milln (ppm). Con ello estamos indicando el volumen (mL) de soluto por cada milln de volmenes (mL) del disolvente. Por ejemplo: la concentracin de dixido de carbono, CO2, en la atmsfera terrestre es de 330 ppm, con ello estamos indicando que hay 300 cm3 (o lo que es lo mismo 300 mL) de CO2 en 106 cm3 (1000 L) de aire.
Propiedades coligativas: Propiedades las disoluciones que dependen del nmero de moles de soluto en relacin con el nmero de moles de disolvente, siendo totalmente independientes del tipo de soluto de que se trate. Estas son: la presin osmtica y la variacin en el punto de ebullicin, en el punto de congelacin y en la presin de vapor. Molalidad (m): Nmero de moles(n) de soluto por masa de disolvente (kg). no moles soluto m= masa disolvente (kg) Partes por milln (ppm): Con ello estamos indicando el volumen (mL) de soluto por cada milln de volmenes (mL) del disolvente
Tabla resumen de algunas de las diferentes formas de expresar la concentracin de disoluciones En funcin de la masa de la disolucin Tanto por ciento en masa masa soluto (g) % m/m = 100 masa disolucin (g) En funcin del volumen de la disolucin
Tanto por ciento en volumen Gramos/litro Molaridad (M) Normalidad (N)
% v/v =
volumen soluto (L) 100 volumen disolucin (L) g masa soluto (g) = L volumen disolucin (L)
no moles soluto volumen disolucin (L)
no equivalentes soluto volumen disolucin (L)
M=
N=
En funcin del nmero de moles en la disolucin
Fraccin molar de soluto (s)
s =
no moles soluto no moles soluto + no moles disolvente
En funcin de la masa de disolvente
Molalidad (m)
m=
no moles soluto masa disolvente (kg)
Autora: Mercedes de la Fuente Rubio
UNIVERSIDAD NACIONAL DE EDUCACIN A DISTANCIA
Disoluciones 5/7
QUMICA
Mezclas homogneas de slidos, lquidos y gases
Las disoluciones
Otros conceptos relacionados que conviene recordar/consultar
Mol: Ver ficha: Mol Reacciones qumicas. Ver ficha Estequiometra
Ejemplo
A. Se aaden 60 gramos de hidrxido sdico en un matraz de 1 litro, aadimos agua hasta aproximadamente la mitad y agitamos cuidadosamente el matraz tratando de disolver todo el soluto. Una vez disuelto, aadimos ms agua al matraz, hasta alcanzar exactamente la marca de 1L: a)Cual sera la molaridad de esta disolucin? b) Teniendo en cuenta que vamos a utilizar esta disolucin para neutralizar un cido cul es su Normalidad? c) Si partimos de un NaOH comercial cuya pureza nos dicen es el 98%, cuanto NaOH debemos pesar para preparar una disolucin con esta misma concentracin? Datos. Masas atmicas: Na=23; O=16; H=1 Solucin: a) Cual sera la molaridad de esta disolucin? Masa molecular del NaOH= 23 + 16 + 1 = 40 Por tanto, 1 mol de NaOH tiene una masa de 40 gr (Ver ficha: Mol), luego 60 gramos sern: Moles de soluto= 60/40 = 1,5 moles de NaOH Estamos poniendo estos 1,5 moles de NaOH en un volumen de disolucin de 1 L, luego la molaridad de esta disolucin ser: Molaridad= 1,5 moles de NaOH / 1L = 1,5 M b) Teniendo en cuenta que vamos a utilizar esta disolucin para neutralizar un cido cul es su Normalidad?
Como cada mol de NaOH aportar 1 mol de aniones hidroxilo (OH ) a la reaccin, la molaridad coincidir con la normalidad.
Es decir, en este caso el nmero de equivalentes por mol es igual a 1, luego en 1,5 moles de NaOH habr 1,5 nmero de equivalentes, y por tanto: Normalidad = 1,5 n equiv. / 1L = 1,5 N c) Si partimos de un NaOH comercial cuya pureza nos dicen es el 98%, cuanto NaOH debemos pesar para preparar 500 mL de disolucin con esta misma concentracin? Como hemos visto, para una disolucin 1,5 M necesitamos 1,5 moles de NaOH por cada litro de disolucin. Ahora queremos preparar 500 mL luego necesitaremos: 1,5 M x 0,500 L = 0,75 moles de NaOH Como 1 mol de NaOH tiene una masa de 40 g, 0,75 moles sern: -1 Gramos de NaOH?= n moles x pM = 0,75 moles x 40 g.mol = 30 g NaOH
UNIVERSIDAD NACIONAL DE EDUCACIN A DISTANCIA
Autora: Mercedes de la Fuente Rubio
Disoluciones 6/7
QUMICA
Mezclas homogneas de slidos, lquidos y gases
Las disoluciones
Ahora bien, nos dicen que el NaOH que estamos utilizando no est al 100%, sino que de cada 100 gramos que tomemos, slo 98 gramos sern NaOH (Pureza 98%). Es decir, tendramos que tomar 30 g de NaOH si el producto que tenemos estuviese al 100%, pero como en realidad est al 98%, necesitaremos pesar algo ms para que haya realmente 30 gramos de NaOH. Es decir: - necesitamos 30 g de NaOH a partir de una muestra en la que hay NaOH al 98% - qu cantidad pesamos de esa muestra para saber que tendremos la cantidad (100%) de NaOH que necesitamos?: 98% ----- 30g 100% ----- X g (30 g x 100 ) / 98 = 36,61 gramos de NaOH a pesar
B. A continuacin mezclamos en otro recipiente 187 gramos de NaOH y 416 gramos de agua, agitamos hasta la completa disolucin y comprobamos que resulta un volumen final de 450 mL: a) Cul sera la densidad de esta disolucin? Y en relacin con su concentracin cul ser sta en: b) Gramos por litro c) Concentracin molar (M) d) Concentracin normal (N) e) Porcentaje en peso (% m/m) f) Concentracin molal (m) g) Fracciones molares de soluto y disolvente a) Densidad Densidad (d) =masa/Volumen Gramos de disolucin=187g + 416g = 603 gramos d= 603 g / 450 mL = 1,340 g/mL b) Gramos por litro tendremos 187 gramos de NaOH en 0,450 L de disolucin. Luego: 187 g / 0,450 L = 0.416 g/L c) Concentracin molar Masa molecular del NaOH = 23 + 16 + 1 = 40 Moles de soluto = 187/40 = 4,675 moles de NaOH Molaridad = 4,675 moles / 0,450 L = 10,39 M d) Concentracin normal Peso equivalente = Masa molecular / valencia = 40/1 = 40 gramos/equivalente
-1 Equivalentes de NaOH = 187 g/40 g*equiv = 4,657 equivalentes Normalidad = 4,675 equiv. / 0,450 L = 10,39 N
UNIVERSIDAD NACIONAL DE EDUCACIN A DISTANCIA
Autora: Mercedes de la Fuente Rubio
Disoluciones 7/7
QUMICA
Mezclas homogneas de slidos, lquidos y gases
Las disoluciones
e) Porcentaje en peso (% m/m) % m/m = (187 g NaOH / 603 g disolucin ) x100 = 31,01 % f) Concentracin molal (m) Molalidad (m) = 4,675 moles de NaOH / 0,416 kg de disolvente = 11,24 g) Fracciones molares de soluto y disolvente Masa molecular del NaOH = 23 + 16 + 1 = 40; Moles de soluto = 187/40 = 4,675 moles de NaOH Masa molecular del H2O = 2 + 16 = 18; Moles de disolvente = 416/18 = 23,111 moles de H2O Moles totales en la disolucin= 4,675 + 23,111 = 27,786 Fraccin molar de soluto = 4,675/27,786 = 0.168 Fraccin molar de disolvente = 23,111/27,786 = 0.832
Ejercicio de autoevaluacin
Con una pteta, tomamos 25 mL de una disolucin de H2SO4 al 44%, cuya densidad es de 1,343 g/cm3. Se colocan estos 25 mL en un matraz de 500 mL en el que previamente habamos aadido agua hasta aproximadamente 1/3 de su capacidad. Despus de aadir el cido, seguimos aadiendo agua, agitando cuidadosamente de vez en cuando, hasta alcanzar exactamente la marca de 500 mL. a) Cul es la Normalidad de esta disolucin? b) Y su molaridad? Solucin: Tomando 25 mL de una disolucin con esa densidad tendremos 33,575 gramos de masa. De esa masa, el 44% es H2SO4, luego tenemos 14,8 g de H2SO4, o lo que es lo mismo 0,151 moles de H2SO4. Como el n equiv.por mol de H2SO4 es 2, tendremos: 0,151 x 2 = 0,302 equivalentes de H2SO4. Por tanto: a) ser una disolucin 0,302 equiv. /0,500 L= 0.6 N; b) 0,151 moles / 0, 500 L = 0,3 M.
UNIVERSIDAD NACIONAL DE EDUCACIN A DISTANCIA
Autora: Mercedes de la Fuente Rubio
Вам также может понравиться
- Soluciones PorcentualesДокумент8 страницSoluciones PorcentualesMarlen Tlapanco43% (7)
- 3 - DisolucionesДокумент17 страниц3 - Disolucionesmehow94461Оценок пока нет
- Soluciones y Leyes de Los GasesДокумент10 страницSoluciones y Leyes de Los GasesCharles MejОценок пока нет
- Material CienciasДокумент5 страницMaterial CienciasIgnacio Antonio Huircán SotoОценок пока нет
- Concentraciones QuiÌ MicasДокумент13 страницConcentraciones QuiÌ MicasOiden Giovanny González100% (1)
- La Solución QuímicaДокумент2 страницыLa Solución QuímicaFatima RolandoОценок пока нет
- Soluciones QuímicasДокумент4 страницыSoluciones QuímicasMIMBELA, GEISELОценок пока нет
- U5 QuimicaДокумент7 страницU5 QuimicaAlexaRamirezRodriguezОценок пока нет
- Apuntes de Disoluciones y Propiedades ColigativasДокумент14 страницApuntes de Disoluciones y Propiedades ColigativasLaboratoriodeciencias AltazorОценок пока нет
- Unidad II DisolucionesДокумент10 страницUnidad II DisolucionesJairo Ramon ZamoraОценок пока нет
- Soluciones, Disperciones, EtcДокумент42 страницыSoluciones, Disperciones, EtcFiLii DiegoОценок пока нет
- Fundamento TeóricoДокумент12 страницFundamento TeóricoStefany XiomAra B SОценок пока нет
- Combinación, Mezclas y Disoluciones.Документ4 страницыCombinación, Mezclas y Disoluciones.Miguel MoleroОценок пока нет
- 4to QUIM GUIA 1 L1 Año 22Документ13 страниц4to QUIM GUIA 1 L1 Año 22dalp262006Оценок пока нет
- La Solvatación Es Un Proceso Que Consiste en La Atracción y Agrupación de Las Moléculas Que Conforman Un DisolventeДокумент7 страницLa Solvatación Es Un Proceso Que Consiste en La Atracción y Agrupación de Las Moléculas Que Conforman Un DisolventeMaria Jose Barraza CОценок пока нет
- Practica 3 Quimica 2Документ16 страницPractica 3 Quimica 2Gabriel Ricardo Gutierrez VivancoОценок пока нет
- (Q.I.) Conceptos de Soluciones de MERINOSДокумент25 страниц(Q.I.) Conceptos de Soluciones de MERINOSJavier AlexisОценок пока нет
- Las SolucionesДокумент22 страницыLas SolucionesDaniel BarónОценок пока нет
- Mezclas y Soluciones CuadroДокумент5 страницMezclas y Soluciones CuadroYerson Tobar ArasОценок пока нет
- SolucionesДокумент9 страницSolucionesJim AvilaОценок пока нет
- Quimica Tema 1Документ8 страницQuimica Tema 1Khrriz CastilloОценок пока нет
- Las Disoluciones en Nuestras VidasДокумент14 страницLas Disoluciones en Nuestras Vidasvirmar0% (1)
- Unidad 5 Introducción A SolucionesДокумент7 страницUnidad 5 Introducción A SolucionesDIEGO ARMANDO SIERRA GARCIAОценок пока нет
- Molaridad y MolalidadДокумент9 страницMolaridad y Molalidad.:("*"BLacK BuLLeT"*"):.88% (16)
- Estequiometria de Disoluciones y Análisis QuímicoДокумент11 страницEstequiometria de Disoluciones y Análisis Químicosalma villegas50% (2)
- Practica 01 SolucionesДокумент7 страницPractica 01 SolucionesDiego Parra TaipeОценок пока нет
- Definicion de Estado LiquidoДокумент5 страницDefinicion de Estado LiquidoJavier Rosales GranadosОценок пока нет
- Soluciones Teoria.Документ6 страницSoluciones Teoria.Oswaldo MoralesОценок пока нет
- La Materia y Sus CaracterísticasДокумент15 страницLa Materia y Sus CaracterísticasemorenocОценок пока нет
- Unidad 5Документ6 страницUnidad 5Anee' GarciaОценок пока нет
- Resumen de Mezclas y Sistemas MaterialesДокумент3 страницыResumen de Mezclas y Sistemas MaterialesSantiago RosalesОценок пока нет
- A Tema 4 Disoluciones TeoriaДокумент7 страницA Tema 4 Disoluciones TeoriaIrene Perez BalbuenaОценок пока нет
- Unidad - 4.disoluciones y Propiedades ColigativasДокумент54 страницыUnidad - 4.disoluciones y Propiedades ColigativasConsueloAndreaRiquelmeCarrascoОценок пока нет
- Informe Preparacion de SolucionesДокумент12 страницInforme Preparacion de SolucionesJavier Pozo Santana100% (1)
- Clases de SolucionesДокумент12 страницClases de Solucionesestefania beltranОценок пока нет
- DISOLUCIONESДокумент9 страницDISOLUCIONESmylenarafaelyОценок пока нет
- Equilibrio Químico y La Teoría Acido BaseДокумент11 страницEquilibrio Químico y La Teoría Acido BaseHaydee HernandezОценок пока нет
- SolubilidadДокумент8 страницSolubilidadAlejandra ArcónОценок пока нет
- Soluciones QuímicasДокумент8 страницSoluciones QuímicasArvyОценок пока нет
- Soluiones y DisolucionesДокумент31 страницаSoluiones y DisolucionesWiliam AcharteОценок пока нет
- 4 SolucionesДокумент4 страницы4 SolucionesBrenda Soledad BonissoneОценок пока нет
- Monografia SolucionesДокумент15 страницMonografia Solucionescomunidad.uiОценок пока нет
- Informe de Laboratorio N°4Документ13 страницInforme de Laboratorio N°4JEANPIERRE ALEJANDRO CHIRITO MAGUIÑAОценок пока нет
- Practica 3Документ16 страницPractica 3neyderОценок пока нет
- Unidad 2 AgroquimicaДокумент21 страницаUnidad 2 AgroquimicagerardoОценок пока нет
- Quimica EstudiarДокумент41 страницаQuimica EstudiarDaniela Paillalef CabreraОценок пока нет
- Clases de Quimica Conclusiones IntroДокумент9 страницClases de Quimica Conclusiones IntroRosendo PatoniОценок пока нет
- PracticaДокумент5 страницPracticaLaIshJoSieОценок пока нет
- Lab 3 Masa Maxima de Una DisolucionДокумент8 страницLab 3 Masa Maxima de Una DisolucionmaidenlainОценок пока нет
- M2a Quimica ResumensolucionesДокумент6 страницM2a Quimica ResumensolucionesLuzmerly FernandezОценок пока нет
- SolucionesДокумент4 страницыSolucionesDiego Alejandro Ruiz PeñaОценок пока нет
- SOLUCIONESДокумент12 страницSOLUCIONESRolando AparicioОценок пока нет
- Unidades para Expresar La Concentración de Disoluciones: Unidades Físicas o Unidades QuímicasДокумент5 страницUnidades para Expresar La Concentración de Disoluciones: Unidades Físicas o Unidades QuímicasflaviaОценок пока нет
- Apuntes de DisolucionesДокумент16 страницApuntes de DisolucionesDignamar CAОценок пока нет
- CONCLUSIÓNДокумент4 страницыCONCLUSIÓNJORGE LUIS RODRIGUEZ ALTAMIRANOОценок пока нет
- 7 HojasДокумент18 страниц7 HojasGilbert GómezОценок пока нет
- Apuntes Tema 7Документ8 страницApuntes Tema 7jorgetonyhc11Оценок пока нет
- Solución Guía de QuímicaДокумент5 страницSolución Guía de QuímicaNaffer VillalbaОценок пока нет
- Solucion QuimicaДокумент4 страницыSolucion QuimicaZahara Camila Montilla ReyesОценок пока нет