Академический Документы
Профессиональный Документы
Культура Документы
6 Conductividad
Загружено:
Wil RonalОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
6 Conductividad
Загружено:
Wil RonalАвторское право:
Доступные форматы
Universidad Nacional Mayor de San Marcos E.A.P.
Ingeniera Agroindustrial
1. RESUMEN
El propsito de este experimento fue la determinacin de la conductividad equivalente lmite para el HCl mediante un mtodo grafico y obtener la constante de ionizacin del HAc. El sistema fue estudiado en un rango de temperaturas de concentraciones de HCl de . !" . #" . $ y . %& ' a las condiciones de (!% mmHg" $)*C y una H.+ del ,%-. .e report una conductividad equivalente lmite para el HAc de & .cm $/eq y para el HCl de ), "! .cm$/eq y un 0i para el HAc de #.#1! x# 2!. A lo que correspondieron porcenta3es de error de 1.)-" $.!%- y )&.#( - respectivamente. .e sugiri que los errores fueron causados por la mala calidad del agua al momento de preparar las soluciones. Al realizar el an4lisis de las curvas de conductividad equivalente vs raz cuadrada para cada electrolito se pudo observar que existen dos diferencias notorias5 al tratarse de un electrolito fuerte" la dispersin de puntos permite establecer una tendencia lineal donde la conductividad aumenta ligeramente cuando la solucin es altamente diluida 6ec6o que permite determinar de forma gr4fica la conductividad equivalente lmite. A diferencia de los electrolitos dbiles la conductividad aumenta abruptamente cuando las soluciones son diluidas. Al analizar los resultados de conductividades elctricas" especficas y equivalentes se concluye que los electrolitos fuertes como el HCl" se disocian totalmente en solucin acuosa a diferencia de los electrolitos dbiles como el HAc" que se disocian totalmente y forman un equilibrio. Es" esto 7ltimo lo que 6ace que no sean tan buenos conductores de la electricidad" pues al no disociarse totalmente los iones" no 6ay suficientes iones que puedan transportar la corriente elctrica al migrar de un lado a otro de su correspondiente electrodo. 8ara obtener buenos resultados" se prefiere que la calidad del agua debe ser ptima" al igual que los reactivos de calibracin.
Universidad Nacional Mayor de San Marcos E.A.P. Ingeniera Agroindustrial
2. INTRODUCCIN
.e denominan electrolitos aquellas sustancias que al disolverse en agua" se disocian en sus iones 9positivos y negativos:. ;os electrolitos pueden ser dbiles" si estos se disocian parcialmente formando un equilibrio" y fuertes si se disocian totalmente. ;a conductividad de los electrolitos fuertes y dbiles tiene una amplia aplicacin en el an4lisis de la calidad" y uso muy importante es en la industria. Algunos materiales biolgicos y alimentos preparados tienen diferentes conductividades seg7n la direccin que se considere" sus propiedades est4n direccionalmente orientadas" es decir son anistropos. E3.< carne y el pescado. ;a conductividad trmica disminuye en la medida que el alimento se vaya secando. Est4 influenciada por< composicin 9el agua e3erce la mayor influencia:" la presin y la temperatura. ;os alimentos deben ser conductores pero no demasiados. ;os valores ptimos de conductividad a $ *C se encuentran en el intervalo . #2# siemens/m. A modo de e3emplo" un alimento adecuado para ser sometido al calentamiento 6mico sera la lec6e cuyo valor de conductividad es .! siemens/m. =tros factores que inciden en la efectividad del calentamiento son la densidad y el calor especfico del alimento" as como el tama>o" la forma y la concentracin de las partculas en el caso de alimentos particulados. Esta experiencia es muy importante en el campo agroindustrial ya que se debe tener muy en cuenta la conservacin de alimentos y la conductividad.
Universidad Nacional Mayor de San Marcos E.A.P. Ingeniera Agroindustrial
3. PRINCIPIOS TERICOS
3.1. Disociacin electroltica .. Arr6enius propuso en #11( la teora de la disociacin electroltica" donde estableci la 6iptesis de que cuando se disuelve en agua un 4cido" una base o una sal" una porcin considerable de la misma se disocia espont4neamente en iones positivos y negativos5 esto es"
MA = M + + A
Estos iones se pueden mover independientemente" y son sencillamente guiados a los electrodos de signo opuesto por el campo elctrico aplicado. .e supuso que la proporcin de molculas que se disociaban en iones variaba con la concentracin" y se consider que el grado de disociacin" 9 : o sea" la fraccin del electrolito total que se divide en iones se aproxima a la unidad a dilucin infinita5 es decir" en disoluciones extremadamente diluidas casi toda la totalidad del 4cido" base o sal" est4 disociado en iones. ;a principal modificacin efectuada en los 7ltimos a>os consiste en suponer que la mayor parte de las sales y de los 4cidos y bases fuertes est4n casi completamente divididos en iones" as que los grados de disociacin son mayores que los propuestos por Arr6enius para disoluciones de concentracin apreciables 3.2. Cond cti!idad de los electrolitos ;as disoluciones" al igual que los conductores met4licos obedecen la ;ey de =6m" excepto en condiciones tan anormales como volta3es muy elevados o corrientes de frecuencia muy alta. .i a un conductor de resistencia + se le aplica una presin elctrica o fuerza electromotriz 9f.e.m.: de valor E seg7n la ;ey de =6m la intensidad de la corriente ? que pasa es< I = E R 9$: .eg7n la ecuacin anterior" la corriente que pasa a travs de un conductor dado" ba3o la influencia de una f.e.m. constante" es inversamente proporcional a la resistencia" la cantidad #/+ ser4 una medida del poder conductor" y se denomina conductividad" como se mencion al principio. @iene expresada en o6mios recprocos" esto es o6ms2#" llamados frecuentemente m6os. 8ara evaluar la conductividad de las soluciones" lo primero que se debe tener presente es el tipo de corriente que debe ser utilizada< .i se utiliza corriente continua" la resistencia variar4 con el tiempo" esto es debido al efecto de polarizacin de cargas" lo cual generara una resistencia adicional en el sistema. Esto afectara en gran escala la facilidad del paso de corriente a travs del mencionado sistema. Este inconveniente puede superarse" si se realizan las medidas utilizando corriente alterna" con lo cual se evita dic6a polarizacin al irse invirtiendo alternativamente la corriente.
Universidad Nacional Mayor de San Marcos E.A.P. Ingeniera Agroindustrial
Como es de todos sabido" la resistencia de un conductor vara directamente con su longitud l 9cm: e inversamente con su superficie A 9cm$:5 esto es< R=
l
A
9o6ms: 9):
donde es una constante" llamada resistencia especfica o resistividad de la sustancia conductora. Esta es la resistencia en o6mios de una muestra de # cm de longitud y # cm$ de seccin. 3.3. Cond cti!idad Es"ec#ica ;a conductividad especfica que se designa por L " de una sustancia dada se define como #/ 9o6mios2#Acm2#:5 por tanto" la ecuacin anterior puede escribirse como<
_
R=
l LA
9&:
.i la conductividad de la disolucin es representada por ;<
1 L A 9o6mios2#: L= = R l
9!: L *l l Be la ecuacin anterior se obtiene< L = " donde se conoce como Constante A A de la celda de Conductividad K " quedando finalmente<
_
L =L * K
9%: ;a constante de la celda se determina" en la mayora de los casos" con una disolucin de 0Cl. En la figura # se observan los valores de las conductividades especficas de referencia5 estas conductividades se obtienen a partir de medidas de electrodos construidos con todo cuidado.
Universidad Nacional Mayor de San Marcos E.A.P. Ingeniera Agroindustrial
C?DE+A #. Conductividad especfica de las disoluciones de 0Cl
Aunque la conductividad especfica es una medida de la facilidad con que la corriente fluye a travs de un cubo de # cm de arista de disolucin" no es una magnitud adecuada para el estudio del fenmeno de la conductividad de las disoluciones de electrolitos. 8or e3emplo" las disoluciones de diferente concentracin tendr4n siempre distinta conductividad especfica" porque cada cm) de las diferentes disoluciones" contiene distinta cantidad de electrolito. F dado que" 6a de tener especial inters compara la capacidad para conducir corriente elctrica de un determinado n7mero de cargas del electrolito" a concentraciones diferentes" es de utilidad definir adem4s de la conductividad especfica otra forma de conductividad. 3.$. Cond cti!idad E% i!alente El poder conductor de todos los iones producidos por # equivalente2g de un electrolito a cualquier concentracin dada se podr4 evaluar imaginando dos grandes electrodos paralelos separados # cm y suponiendo que la totalidad de la disolucin est4 colocada entre ellos. ;a conductividad del sistema resultante se denomina conductividad equivalente ( : a la concentracin dada. .upongamos que se disuelve # equivalente2gr de electrolito en v cc de disolucin5 entonces sta cubrir4 una superficie de v cm$ de los electrodos que est4n separados # cm. .e deduce por tanto de la ecuacin de la conductividad ; que" como" la conductividad es cuando A es v cm$ y l es # cm<
1000 L o6ms2#cm$ /eq =Lv = c
_ _
9(: donde c es la concentracin de la disolucin en equivalentes gramos por litro. .e observa que la conductividad equivalente es numricamente igual al producto de la conductividad especfica por el volumen en cc que contiene # equivalente2gramo y a veces se la define de esta forma. Algunos autores 6an usado la conductividad molar _ 9:5 sta se obtiene cuando se multiplica L por el volumen en cc en que est4 contenido # mol de electrolito. 8ara electrolitos uni2univalentes y son idnticas" ya que el mol y el equivalenteGgramo son iguales. Cabe destacar que para un electrolito fuerte" la conductividad equivalente no debe cambiar al cambiar la concentracin. Hx factor
Universidad Nacional Mayor de San Marcos E.A.P. Ingeniera Agroindustrial
Este factor involucra" tanto a la estequiometrIa" como a las cargas. 8or E3. En el CaC$. El factor es $ CaC$ CaJ$ J $C2
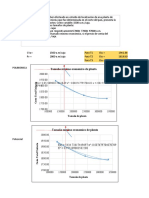
3.&. Relaciones e'"ricas a "artir de las 'ediciones de cond cti!idades e% i!alentes. ;a variacin de la conductividad equivalente de un electrolito fue caracterizada experimentalmente por 0o6lrausc6#" a una temperatura determinada" frente a la raz cuadrada de la concentracin" y" para algunos electrolitos" las gr4ficas obtenidas en el dominio de ba3as concentraciones correspondan con bastante precisin a una lnea recta. Kstas gr4ficas" para varios electrolitos se representan en la figura $. Aqu se observa que aparecen dos tipos diferentes de comportamiento< aquellos electrolitos que presentan esencialmente variacin lineal" se les agrupa entre los electrolitos fuertes5 mientras que" los que se aproximan a la conductividad lmite de forma casi tangencial" est4n agrupados como electrolitos dbiles. Be la figura $ se puede observar una interesante relacin al extrapolar los valores de las conductividades de los electrolitos 6asta la dilucin infinita" para obtener la llamada conductividad equivalente lmite. Kstas conductividades" que se representan por o" son la base de la Ley de Kohlrausch o de la migracin independiente de los iones.
Kohlraush Friedrich Wilhem George (1840-1910) F sico! de"# im$or%a&%es memorias so're la co&duc%i(idad de los elec%roli%os)
Universidad Nacional Mayor de San Marcos E.A.P. Ingeniera Agroindustrial
$. RESU(T)DOS
$.1. D)TOS E*PERIMENT)(ES TA LA !"#$ %ondiciones del laboratorio
PRESION (!%. mmHg TEMPER)TUR) $). LC +UMED)D RE()TI,) ,% -
TA LA !"&$ 'reparacin de la solucin de cloruro de potasio (K%l(.
,ol 'en de la sol cin -'(. # Molaridad -M. . # Masa -/. . (&!
TA LA !")$ *aloraciones del hidr+ido de sodio ( !a,- . /./#!( para -%l y Ac. Actico
Masa del 0i#talato de "otasio -/. HCl CH)C==H . & , . &#$ Concentracin re#erencial de NaO+ -N. . # . # ,ol 'en /astado de NaO+ -'(. $&.( $#.(
TA LA !"0$ *aloracin del 1cido clorhdrico (-%l( y del 1cido actico (%-),,-(.
Concentracin )"ro4. -N. . ! HCl . . # . $ %& . ! CH)C==H . . # . $ %& ,O(UMEN -'(. ).$& 1.# #%.$ ! .% $ ! ! #!.%$! ,O(UMEN 1)ST)DO DE NaO+ 2 3.31N -'(. $!.) #).$ %.$ !.! #).! %.! $ #.&
SO(UCION
TA LA !"2$ %onductividad elctrica del K%l3 -%l y %-)%,,-
Universidad Nacional Mayor de San Marcos E.A.P. Ingeniera Agroindustrial
Concentracin -N. 7Cl . # . ! . # . . $ %& . ! C+3COO+ . . # . $ %&
Cond cti!idad El5ctrica -6S. #&! $!) &,( ##& )&& #&# $!1 ! $ # , )&) )&, #!) %& )$
Pro'edio #&) $!!! &,1! ###! )&).!
+Cl
$.2. D)TOS TERICOS TA LA !"4$ %onductividad equivalente lmite de electrolitos en soluciones acuosas&
+Cl 89 -Se%21c'2 &$%
C+3COO+ ), .%
TA LA !"5$ %onductividad especfica del K%l)
COMPUESTO 7 -S.c'21. . #&#)
0Cl
TA LA !"6$ %onstante de equilibrio inico del 1cido actico)
COMPUESTO CH)C==H 7i #.1x#
2!
$.3. RESU(T)DOS
2
Mabla referenciada de< Daston 8ons Nuzzo" Csico 2 Oumica" segunda edicin" Editorial Eniverso ..A #,%,. pag< ))#. 3 DATOS REFERENCIADO DE RAYMOND CHANG, QUIMICA, SEXTA EDICION, MCGRAW HLL INTERAMERICANA.PAGINA:612.
Universidad Nacional Mayor de San Marcos E.A.P. Ingeniera Agroindustrial
TA LA !"7$ %onstante de la celda a partir de la medicin de la conductividad del cloruro de potasio (K%l(.
Concentracin -N. Cond cti!idad El5ctrica -6S. Constante de la celda 9cm2#: 3.31 #&) .,11#
TA LA !"#/$ %oncentracin e+acta del hidr+ido de sodio (!a,-( /./#! para cada compuesto.
SO(UCION Co'" esto +Cl C+3COO+ E(ECTRO(ITIC) 'a=H Concentracin )"ro4. -N. . # Concentracin E4acta -N. . . 1# ,)
TA LA !"##$ Concentracin exacta del cloruro de potasio 90Cl: y del acido actico
9CH)C==H:.
SO(UCION E(ECTRO(ITIC) Concentracin )"ro4. -N. . ! HCl . . # . $ %& . ! CH)C==H . . # . $ %& . Concentracin E4acta -N. . %)) . #)$ . . )# 11
. %$1 . #$# . )( 1)
TA LA !"#&$ %onductividad especifica (8( y conductividad equivalente (9( con las normalidades e+actas del 1cido clorhdrico (-%l(.
Universidad Nacional Mayor de San Marcos E.A.P. Ingeniera Agroindustrial
Concentracin -N. ; -S.c'21. 8 Sc'2<e%
3.3&
3.31
3.332
3.333:$
$!$&!x#
2%
&,$!.%(1x#
2%
## #.()$x#
2%
)),.&#$x#
2%
),1.1) $
)().#!(
)!!.),(
)1!.%,%
TA LA !"#)$ %onductividad especifica (8( y conductividad equivalente (9( con las normalidades e+actas del 1cido actico (%-),,-(.
Concentracin -N. ; -S.c'21. 8 Sc'2<e%
3.3&
3.31
3.332
3.333:$
)&&.1&(x#
2%
#!#.#(,x#
2%
%).$)1x#
2%
)#.%#,x#
2%
!.&,#
#$.&,&
#(. ,#
)1. ,!
TA LA !"#0$ :atos para la ;<A=>%A ? # para el 1cido clorhdrico (@ vs !A(.
8 Concentracin -N. . %)) . #)$ . . )# 11 -Concentracin. 1<2 Sc' <e% ),1.1) $ )().#!( )!!.),( )1!.%,% .$!#% .##&, . !!( . $,(
2
TA LA !"#2$ :atos para la ;<A=>%A ? & del 1cido actico (@.# vs %@(.
10
Universidad Nacional Mayor de San Marcos E.A.P. Ingeniera Agroindustrial
Concentracin -N. . %$1 . #$# . . )( 1)
8 Sc'2<e% !.&,# #$.&,& #(. ,# )1. ,!
821
C8
8P
7i
.#1$# . 1 . !1! . $%$
.)&&1 .#!#$ .%)$& . )#% &
. #)() . )#$) . &$() . ,!$&
.1(&x# #.$#1x# (. !($x# 1.)$## x#
2! 2! 2%
2%
TA LA !"#4$ 'orcentaBe de error de la conductividad equivalente limite del 1cido actico y del 1cido clorhdrico
SO(UCION E(ECTRO(ITIC) C+3COO+ TEORICO ), .% E*PERIMENT)( & > ERROR $.!%
+Cl
&$%
), .!
1.)
TA LA !"#5$ 'orcentaBe de error de la constante de ioniCacin del acido actico.
SO(UCIN E(ECTRO(?TIC) C+3COO+ TEORICO E*PERIMENT)( -o@tenido de /rA#ica. #.#1!x#
2!
> ERROR
#.1x#
2&
)&.#(
&. EBEMP(O DE CC(CU(OS
C)(CU(O DE () M)S) DE( C(ORURO DE POT)SIO.
11
Universidad Nacional Mayor de San Marcos E.A.P. Ingeniera Agroindustrial
Q H 98.N:.N.@ Q H 9(&.!%g/mol:x . #N x .# Q H . (&!g. Ese valor es la masa utilizada para preparar un solucin . #N de cloruro de potasio -,ER T)0() ND2. ,)(OR)CIN DE () SO(UCIN DE NaO+
3.31 N.
8rimero se debe calcular la masa de biftalato. 'x@H'x@ m/$ &.$$H . #' x . $; m H . & 1g A6ora para el c4lculo de la concentracin exacta se usara la siguiente ecuacin" donde el volumen gastado se encuentra en la T)0() ND 3. Esta concentracin serA sada solo "ara el +ClF Ga % e se Hicieron dos !aloraciones "ara el Hidr4ido de sodio. REqSH0 H REq'a=H QSH0 / 8eqSH0 H ''a=H x @'a=H 9 . & 1g:/9$ &.$$g/mol: H ''a=H x 9 . $&(;: . 1 #' H ''a=H
Be igual manera se 6ace el c4lculo para la concentracin exacta del 6idrxido de sodio para el 4cido actico. -,er T)0() NI13.
C)(CU(O DE () CONST)NTE DE CE(D)
.e usa la conductividad elctrica" para luego reemplazar en la frmula del c4lculo de la constante de la celda. El valor utilizado de T es terico. -,er T)0() NIJ. 9U/A:H T / ; H . #&#)9..cm2#:/ #&) V.
9U/A:H .,11# cm2#
Bonde< K<)L constante de la celda. ;L conductividad especfica.
12
Universidad Nacional Mayor de San Marcos E.A.P. Ingeniera Agroindustrial
C)(CU(O P)R) () T)0() ND11.
Calcularemos la concentracin exacta del Wcido clor6drico con una concentracin de referencia de . ! '. Bonde el volumen utilizado de HCl y el volumen gastado de 'a=H" se encuentra anotado en la T)0() ND$. @HCl x 'HCl H @gastado x ''a=H ).&m; x 'HCl H $!.)m; x . 'HCl H . %))' Be la mismas manera de realiza los c4lculos a las dem4s concentraciones. Calc lare'os la concentracin e4acta del +acL @HCl x 'HCl H @gastado x 'Hac $m; x 'HCl H #).!m; x . 'HCl H . %$1' Be la mismas manera de realiza los c4lculos a las dem4s concentraciones. ,)' 1#'
C)(CU(O P)R) ()S T)0() ND12 M 13.
Calculo de la conductividad especfica y equivalente a una concentracin de . %)) del HCl . +eferencia< Ta@la ND & G 11. -K<).N ; < ( .,11# cm2# x $!!! V. HT T H $!$&!.,!!x# 8 N ;.1333 N X H ),1.1) $ .cm$equiv2# Be la misma manera se calcula para la MAS;A 'L#) a diferentes concentraciones. C)(CU(O DE( 1R)DO DE DISOCI)CIN M () CONST)NTE DE IONIO)CIN -,er T)0() NI1&.
2%
.cm2#
13
Universidad Nacional Mayor de San Marcos E.A.P. Ingeniera Agroindustrial
Nediante el grafico se calculo la conductividad equivalente limite" a6ora con dic6o resultado se calcula el grado de disociacin del acido actico . %$1' mediante la siguiente ecuacin< = H 8 < 8P Y H !.&,# /& Y H . #)() Be la misma forma se calcula a diferentes concentraciones. A6ora con el valor de grado de disociacin se calcula la constante de ionizacin a una concentracin de . !()'" mediante la siguiente ecuacin. 7i N =2 N 12= 0i H 9 . #)():$ x . %$1 #2 . #)() 0i H .1(&x#
2!
C)(CU(O DE( PORCENT)BE DE ERROR.
Be la conductividad equivalente limite del 4cido actico< 9MAS;A '*#%:
, Error = Valorteorico Valore-$ erimental Valorteorico x100,
, Error =
390)* 400 x100, = 2)5*, 390)*
Be la misma manera calculamos para el HCl y para la tabla '*#(
:. DISCUSIN DE RESU(T)DOS
.e obtuvo los siguientes resultados experimentales< Conductividad lmite HCl< ), "! .cm$ /eq y el Hac.< & .cm$ /eq
14
Universidad Nacional Mayor de San Marcos E.A.P. Ingeniera Agroindustrial
0i del HAc< #.#1!x#
2!
El valor experimental de conductividad lmite para el HCl present una desviacin del 1.)-" mientras que para el Hac fue de $.!%- y el 0i present un error del )&.#(-. .e sugiere que los porcenta3es de error ligeramente altos fueron causados debido a que 6aya influido la calidad de desionizacin del agua que se emple como reactivo de traba3o. El 6ec6o de que el agua tenga una alta conductividad" pudo 6aber alterado demasiado los valores de conductividad lmite en la solucin de HCl y la constante de ionizacin del HAc.
Burante el experimento" 6ubieron momentos en que se generaron peque>as burbu3as en el electrodo de lectura del conductmetro" estas burbu3as de aire pueden tambin 6aber sido responsables en el error ligeramente alto para la conductividad lmite del HCl" Hac y el 0i del HAc.
Es probable que durante la valoracin del HCl se 6ayan pasado una o dos gotas de soda de m4s y ese volumen gastado no 6aya representado confiablemente la valoracin del 4cido" de la misma forma pudo 6aber sucedido para el 4cido actico. El grado de disociacin de los iones aumenta con la dilucin" es por eso que en una dilucin infinita la conductividad infinita depende de la velocidad de los iones" as como la temperatura a la que se traba3a ya que a mayor temperatura aumentara. Be acuerdo a los est4ndares del '?.M 9'ational ?nstitute of .tandards:" para un laboratorio educacional" 6asta un m4ximo de # - de error es aceptable" mientras que valores superiores se consideran medianamente aceptable" mientras que pasado la mitad" son considerados como poco confiables. En base a estas normativas" se puede considerar el experimento realizado como medianamente aceptable.
P. CONC(USIONES
15
Universidad Nacional Mayor de San Marcos E.A.P. Ingeniera Agroindustrial
.e estudi el fenmeno de la conductividad de soluciones de electrolitos fuertes y dbiles" para ello se emple dos sistemas" un set de & muestras de soluciones de HCl y HAc. de concentraciones . !" . #" . $" . %& '. A lo cual se observ que los electrolitos fuertes como el HCl y el 0Cl en solucin son buenos conductores de la electricidad" mientras que los electrolitos de tipo debil como el Ac. Actico son conductores dbiles" pues se obtuvieron valores peque>os de conductividad de cada solucin. ;a tendencia de la conductividad equivalente de los electrolitos fuertes versus la raiz cuadrada de la concentracin ex6ibe un comportamiento lineal" es por ello que se puede calcular la conductividad equivalente lmite mediante un mtodo gr4fico. .i aumenta la conductividad equivalente entonces la concentracin disminuye" esto se debe a los iones cargados influyen sobre los otros al moverse 6acia los electrodos. ;a conductividad elctrica 9;: en las soluciones electrolticas aumentan debido a una mayor concentracin 9': en estas.
Q. RECOMEND)CIONES
1*
Universidad Nacional Mayor de San Marcos E.A.P. Ingeniera Agroindustrial
El equipo de conductividad debe calibrarse adecuadamente" y en el momento de tomar la lectura de conductividad debe evitarse que se formen burbu3as en el electrodo pues cada burbu3a de aire altera significativamente la conductividad leda. El electrodo para la medicin deber4 ser lavado muy bien y totalmente secado para evitar que lleve impurezas a las dem4s soluciones. Bebe valorarse cuidadosamente cada solucin para obtener una concentracin precisa de cada solucin.
Es im !"#$%#& '&"i(i)$" *$ )$*i+$+ +&* $,-$ )!% *$ .-& s& &s#/% "& $"$%+! *$s s!*-)i!%&s, -&s -%$ $*#$ )!%+-)#i'i+$+ %! &"mi#& *&&" *$ )!%+-)#i'i+$+ +& *$s s!*-)i!%&s, +$+! .-& *!s i!%&s "&s&%#&s &% &* $,-$ $*#&"$% *$ m&+i+$ +& *$ )!%+-)#i'i+$+ "! i$ +&* )!m -&s#! .-& s& &s#/ $%$*i0$%+!.
Ha de tenerse cuidado al traba3ar con soluciones de 0Cl" estas 3am4s deben ser pipeteadas con la boca" siempre debe usarse propieta. El 0Cl ingerido oralmente en soluciones concentradas provocan par4lisis muscular.
1+
Universidad Nacional Mayor de San Marcos E.A.P. Ingeniera Agroindustrial
J. 0I0(IO1R)R?)
Castellan Dilbert. Cisicoqumica. Ed. 8earson Educacin. .egunda Edicion #,,1 9+eimpresin: 8ag. ,,2#$!. Daston 8ons Nuzzo" Csico 2 Oumica" segunda edicin" Editorial Eniverso ..A #,%,. p4gina< ))#. ;aidler" 0eit6 Z.. 86ysical c6emistry. [ Soston" E.A. Houg6ton Nifflin" A>o #,,! . 8p. 9#! 2#!!: +aymond C6ang" Oumica" .exta Edicion" Ncgra\ 6ll ?nteramericana. 84gina<%#$.
18
Universidad Nacional Mayor de San Marcos E.A.P. Ingeniera Agroindustrial
13. )PENDICE
CUESTION)RIO 1. ST 5 relacin e4iste entre la cond cti!idad G la concentracin del sol toU 8or lo resultados encontrados experimentalmente se obtiene que la relacin entra la conductividad elctrica y la concentracin de soluto est4n en proporcin directa" a medida que aumenta la concentracin del soluto tambin aumenta la conductividad elctrica. 2. E4"li% e el # nda'ento de la (EM DE 7O+(R)USC+. ;a conductividad del electrolito a dilucin infinita se considera como resultado de las contribuciones de las dos clases de iones individuales que forman al electrolito. Be esta forma" se introducen los conceptos de conductividades inicas equivalentes" que para dilucin infinita permiten establecer que< o H oJ J o2 9?dealidad: 91: ;a ley de 0o6lrausc6 sugiere a6ora" que la conductividad a dilucin infinita de un electrolito depende de las contribuciones independientes de los iones que lo conforman. ;a independencia de stas contribuciones se pone de manifiesto al comparar electrolitos que tienen alg7n in com7n5 pero la ley de 0o6lrausc6 no suministra" y as debe destacarse" la forma de calcular las contribuciones individuales de los diferentes iones" solo permite evaluar variaciones 9:. ;a aplicacin pr4ctica e inmediata de la idea de una contribucin independiente de los iones a dilucin infinita" es el camino para deducir el valor de la conductividad lmite de los electrolitos dbiles. 8or e3emplo" para el 4cido actico se puede establecer que< o 9HAc: H o 9'a Ac: J o 9HCl: 2 o 9'aCl: porque el miembro derec6o de la ecuacin cabe interpretarlo como< o'aJ J oAc2 J oHJ J oCl2 2 o'aJ 2 oCl2 H oHJ J oAc2 H o 9HAc: y es evidente" como se observa en la gr4fica determinada para el HAc" que no sera posible lograr el valor exacto" si se intentara alcanzarlo por extrapolacin gr4fica. 3. Mencione al/ nas t5cnicas de conser!acin G e!al acin de la calidad de ali'entos. ;as carnes" las lec6es y sus derivados" las frutas y los vegetales requieren de la tcnica de congelacin que consiste en almacenar los alimentos a temperaturas que
19
Universidad Nacional Mayor de San Marcos E.A.P. Ingeniera Agroindustrial
varan de LC a &LC" esta temperatura no destruye a los microorganismos" pero impiden su reproduccin. Ntodos< #. (a con/elacinL Consiste en almacenar los alimentos a temperaturas que varan entre LC a &LC. Estas temperaturas no destruyen los microorganismos $. (a desecacin o desHidratacinL Consiste en eliminar el agua por medio del aire o del calor" puede ser natural o por medio del calordel .ol y se utiliza en el secado de granos como el caf5 artificial" en el cual se utilizan aparatos evaporizadores" donde se someten a temperatura" que varan entre %1LC y (&LC y se exponen a una corriente de aire. ). El concentrado del aVWcarL Consiste en agregar az7car a preparados de frutas" evitando la oxidacin del fruto" ya que impide que entre en contacto con el oxgeno del aire" por otra parte" cuando la concentracin del almbar es alta" se mantiene la firmeza del producto. &. El enc rtidoL @ara dependiendo de los alimentos" en el caso del avinagrado. Consiste en colocar el alimento previamente en una solucin de agua con vinagre. E3emplo de ello lo constituye el escabec6e" los encurtidos de zana6oria" cebollas" etc. !. )diti!os % 'icosL Consiste en incorporar a los alimentos sustancias qumicas como 4cidos y sales para prevenir el desarrollo de microorganismos y para cambiar las caractersticas fsicas de los alimentos. %. (a salacin o adicin de salL Consiste en salar pescados y otros alimentos para matar los grmenes que puedan da>arlos" ya que la sal act7a como antisptico cuando se emplea en determinadas proporciones. En este caso del pescado salado.
20
Вам также может понравиться
- 2Документ95 страниц2Yessy Belenn Tu Supers StarsОценок пока нет
- D. Experimentales Tema 8Документ64 страницыD. Experimentales Tema 8osman choque rojasОценок пока нет
- Tesis-Completa Chocolate PDFДокумент90 страницTesis-Completa Chocolate PDFPedro GdzОценок пока нет
- 2Документ95 страниц2Yessy Belenn Tu Supers StarsОценок пока нет
- Sisap Aves Vivas 26oct15Документ1 страницаSisap Aves Vivas 26oct15Harold Garrido RuizОценок пока нет
- Separata Evaluación Sensorial de AlimentosДокумент62 страницыSeparata Evaluación Sensorial de AlimentosWil RonalОценок пока нет
- Emerson Tesis Titulo 2014Документ11 страницEmerson Tesis Titulo 2014Wil RonalОценок пока нет
- Manual de Examenes - Lamolina VirtualДокумент5 страницManual de Examenes - Lamolina VirtualsteveОценок пока нет
- 201.054 NTP Carne y Productos Carnicos Aves para ConsumoДокумент28 страниц201.054 NTP Carne y Productos Carnicos Aves para ConsumoRodrigo Fernandez50% (6)
- Sisap Aves Vivas 26oct15Документ1 страницаSisap Aves Vivas 26oct15Harold Garrido RuizОценок пока нет
- Tesis-Completa Chocolate PDFДокумент90 страницTesis-Completa Chocolate PDFPedro GdzОценок пока нет
- D. Experimentales Tema 8Документ64 страницыD. Experimentales Tema 8osman choque rojasОценок пока нет
- Sentencias CondicionalesДокумент15 страницSentencias CondicionalesWil RonalОценок пока нет
- D. Experimentales Tema 8Документ64 страницыD. Experimentales Tema 8osman choque rojasОценок пока нет
- COMPRESORESДокумент18 страницCOMPRESORESMayra Alejandra Vargas FuertesОценок пока нет
- CompresoresДокумент77 страницCompresoresWil RonalОценок пока нет
- Almacenamiento Atmósfera ModificadaДокумент8 страницAlmacenamiento Atmósfera ModificadaWil RonalОценок пока нет
- Snacks Analisis de GrasaДокумент16 страницSnacks Analisis de GrasaWil RonalОценок пока нет
- Post CosechaДокумент9 страницPost CosechaWil RonalОценок пока нет
- Flora Bacteriana IntestinalДокумент6 страницFlora Bacteriana IntestinalElle BanningОценок пока нет
- Balanza de HumedadДокумент70 страницBalanza de HumedadWil RonalОценок пока нет
- 1-COMPOSICION CandidaДокумент9 страниц1-COMPOSICION CandidaLili GarsanОценок пока нет
- BiotoxinasMarinasSanMarcosДокумент22 страницыBiotoxinasMarinasSanMarcosWil RonalОценок пока нет
- ISO 22000 y HACCPДокумент14 страницISO 22000 y HACCPMaría Pía Mogues96% (46)
- Grasa - SoxhletДокумент2 страницыGrasa - SoxhletCataa Cornejo NúñezОценок пока нет
- Almacenamiento Atmósfera ModificadaДокумент8 страницAlmacenamiento Atmósfera ModificadaWil RonalОценок пока нет
- A34907-34913galletas AoacДокумент7 страницA34907-34913galletas AoacWil RonalОценок пока нет
- Coeficiente GiniДокумент4 страницыCoeficiente GiniherneyloboОценок пока нет
- Informe Fisq 7Документ13 страницInforme Fisq 7Wil RonalОценок пока нет
- Laboratorio Instrumental 2 UvДокумент14 страницLaboratorio Instrumental 2 UvWil RonalОценок пока нет
- Norma técnica ambiental Guanajuato manejo residuos agrícolasДокумент13 страницNorma técnica ambiental Guanajuato manejo residuos agrícolasfecofecoОценок пока нет
- Calculo de Valor Presente y FuturoДокумент5 страницCalculo de Valor Presente y FuturoJhovanaОценок пока нет
- Recibo Cfe-1Документ2 страницыRecibo Cfe-1Sara Maria Muñoz FelixОценок пока нет
- 1.trabajo - Red de Tuberías de GasДокумент13 страниц1.trabajo - Red de Tuberías de GasJesus BolivarОценок пока нет
- Redes neuronales: tipos de entrenamiento y arquitecturas principalesДокумент7 страницRedes neuronales: tipos de entrenamiento y arquitecturas principalesDavid Angel Alvarez CayotopaОценок пока нет
- Ley de Hooke laboratorio física resortesДокумент3 страницыLey de Hooke laboratorio física resortesjuan esteban garciОценок пока нет
- INTRODUCCIONДокумент5 страницINTRODUCCIONAlfredoОценок пока нет
- Análisis cinemático mecanismosДокумент25 страницAnálisis cinemático mecanismosJhon SánchezОценок пока нет
- Medición de Tensión y Resistencia EléctricaДокумент14 страницMedición de Tensión y Resistencia EléctricaErick Ruiz100% (1)
- Condiciones Mínimas de Higiene y SeguridadДокумент2 страницыCondiciones Mínimas de Higiene y SeguridadMamani Llanquichoque Nelson OvidioОценок пока нет
- Homologacion CIIUДокумент24 страницыHomologacion CIIUALEJANDRA PALACIOОценок пока нет
- Problema 2Документ2 страницыProblema 2Nilson HornaОценок пока нет
- Manual Corporativo Bar I 29Документ23 страницыManual Corporativo Bar I 29Jennyfer Gutierrez100% (1)
- América en Revolución - Resumen de ChumbitaДокумент6 страницAmérica en Revolución - Resumen de ChumbitaTomás Oñate Rutolo100% (1)
- Derecho AdministrativoДокумент20 страницDerecho AdministrativoHilber Pinedo MendezОценок пока нет
- Fallo Camara Nacional de Apelaciones Del Trabajo Sala 8 Elecciones Comercio 2018Документ7 страницFallo Camara Nacional de Apelaciones Del Trabajo Sala 8 Elecciones Comercio 2018Anonymous 6qGEFdОценок пока нет
- Costo de Personal - Lady Sanchez y Sofia VelasquezДокумент10 страницCosto de Personal - Lady Sanchez y Sofia Velasquezladysanchez1197Оценок пока нет
- Lineamientos de Seguridad para ConductoresДокумент7 страницLineamientos de Seguridad para Conductoresayudante.transportes.alicorpОценок пока нет
- Hallar perímetro cuadrado 81cm2Документ4 страницыHallar perímetro cuadrado 81cm2Leonardo Castillo0% (1)
- Almacenamiento de alimentos perecederos y temperaturas idealesДокумент2 страницыAlmacenamiento de alimentos perecederos y temperaturas idealesEterna LecturaОценок пока нет
- Mapa Conceptual Induccion A La EmpresaДокумент2 страницыMapa Conceptual Induccion A La Empresacarlos riveraОценок пока нет
- Ley 860 de 2003 Reforma Sistema General de PensionesДокумент8 страницLey 860 de 2003 Reforma Sistema General de PensionesYolanda MartinezОценок пока нет
- Examen Estados FinancierosДокумент4 страницыExamen Estados FinancierosAndy TorresОценок пока нет
- Reglamento Interno de Trabajo La MundialДокумент22 страницыReglamento Interno de Trabajo La MundialKARLA MARIA LANZA ZAVALAОценок пока нет
- Analisis TQCДокумент4 страницыAnalisis TQCDaniel CatacheОценок пока нет
- La Auditoría TradicionalДокумент1 страницаLa Auditoría TradicionalfredyОценок пока нет
- 1er Examen Gestion EstrategicaДокумент2 страницы1er Examen Gestion EstrategicaedwinОценок пока нет
- Impact Mapping, User History, Flujograma, Diseño AppДокумент6 страницImpact Mapping, User History, Flujograma, Diseño AppSantisteban Callacna FjОценок пока нет
- Ejemplo de Análisis de Riesgos 2020 IIДокумент7 страницEjemplo de Análisis de Riesgos 2020 IIMayra TovarОценок пока нет
- Caso 1 Clima Organizacional Ges Hum MPДокумент2 страницыCaso 1 Clima Organizacional Ges Hum MPMarian PichardoОценок пока нет