Академический Документы
Профессиональный Документы
Культура Документы
Apoptose - 01fev01
Загружено:
Ana JordãoОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Apoptose - 01fev01
Загружено:
Ana JordãoАвторское право:
Доступные форматы
S. Sol, T. Pedro, H. Ferreira, C. M. P.
Rodrigues
Centro de Patognese Molecular Faculdade de Farmcia da Universidade de Lisboa Av. das Foras Armadas 1600-083 Lisboa
Editado por Rui Gomes e Cristina Bastos
Conceitos gerais
A apoptose ou morte celular programada um acontecimento comum, tanto em situaes patolgicas, contribuindo para fenmenos de inflamao e de disfuno orgnica, como em situaes fisiolgicas, no decurso de processos de embriognese e metamorfose. As caspases so proteases que desempenham um papel central na apoptose e, consequentemente, constituem alvos farmacologicamente atractivos para a inibio e/ou potenciao da apoptose. A activao das caspases durante a apoptose ocorre por um de dois mecanismos: i) activao de receptores de morte celular; ii) perturbao mitocondrial. A inibio da apoptose poder ajudar a combater doenas inflamatrias, do tipo agudo ou crnico, enquanto que a induo da apoptose em clulas T auto-reactivas, poder proteger de doenas auto-imunes. Por fim, a induo selectiva da apoptose em clulas malignas constituir uma estratgia excelente para o tratamento de doenas cancergenas.
Biologias http://www.ordembiologos/Biologias/N2.html
A nica certeza da vida a morte! De facto, os mecanismos fisiolgicos de morte celular so essenciais como estratgia defensiva para remover clulas mutadas ou infectadas, como reposta a fenmenos de citotoxicidade ou, ainda, para um desenvolvimento embrionrio normal. Nesta batalha entre a vida e a morte, a remoo de clulas indesejveis nos organismos multicelulares ocorre por um de dois processos a necrose ou a apoptose ou, mesmo por ambos. Se no passado
os especialistas acreditavam que estes processos ocorriam independentemente um do outro, so agora reconhecidos como co-existindo em muitas situaes de sade ou de doena, sendo por vezes difcil dissoci-los. Esta dificuldade emergiu no s porque existem algumas caractersticas comuns aos dois tipos de morte celular, mas tambm porque frequente a ocorrncia de necrose e apoptose, em simultneo, na mesma clula. Torna-se, por isso, muitas vezes ambguo e problemtico distinguir com exactido estes dois processos, apesar da existncia de algumas caractersticas morfolgicas e bioqumicas diferenciadoras (Tabela 1).
Tabela 1 Caractersticas morfolgicas, bioqumicas e fisiolgicas que distinguem a necrose da apoptose
Caractersticas
NECROSE
Perda da integridade membranar Lise total da clula
APOPTOSE
No h perda da integridade membranar Agregao e marginalizao da cromatina Diminuio do volume citoplasmtico e condensao do ncleo Fragmentao da clula em corpos apoptticos Aumento da permeabilidade mitocondrial Processo altamente regulado, envolvendo activao
Morfolgicas
No h formao de vesculas Desintegrao dos organitos celulares
Perda da regulao da homeostasia inica
enzimtica Dependente de ATP Digesto no aleatria do DNA Libertao de vrios factores mitocondriais Activao da cascata de caspases Alteraes na assimetria da membrana plasmtica
Bioqumicas
No requer energia Digesto aleatria do DNA
Afecta grupos de clulas Iniciada por estmulos no fisiolgicos
Afecta clulas individuais Induzida por estmulos fisiolgicos Fagocitose por clulas adjacentes ou por macrfagos Sem resposta inflamatria
Fisiolgicas
Fagocitose por macrfagos Resposta inflamatria
Necrose ou apoptose: quando e porqu?
De um modo geral, a necrose ocorre quando existe um colapso da homeostasia celular, isto , sempre que a clula sofre variaes extremas das suas condies fisiolgicas, como a hipotermia ou a hipxia, sendo acompanhada por lise da membrana celular e subsequente libertao de componentes intracelulares para o exterior. Como consequncia deste processo catastrfico, a
Biologias , 2, Fevereiro de 2001
Biologias http://www.ordembiologos/Biologias/N2.html
necrose provoca quase sempre inflamao. Pelo contrrio, a apoptose um processo de morte celular activo, mas silencioso, que ocorre em condies fisiolgicas, de resposta a uma variedade de estmulos fisiolgicos ou patolgicos e em que a clula participa na sua prpria destruio. Normalmente, como no h perda da integridade membranar, a apoptose no acompanhada de reaces inflamatrias drsticas. A apoptose , assim, a forma mais generalizada de morte celular, com especial relevncia para o perodo de desenvolvimento embrionrio, onde participa activamente nos processos de organognese e de involuo. Est, tambm, envolvida em processos de metamorfose relacionados com metaplasias, em quadros de alterao hormonal, como na menopausa, envolvendo clulas endometriais, nos tumores em fase de regresso ou de intensa proliferao e em muitas doenas virais. Por exemplo, quando ocorrem leses no DNA, que podem no s interromper o desenvolvimento embrionrio como ainda induzir a transformao de clulas normais, os nveis de expresso da protena p53, indutora de apoptose e, por isso, anti-tumoral, so imediatamente aumentados, desencadeando a eliminao das clulas lesadas. No entanto, e apesar do seu importante papel, a apoptose em nveis elevados pode ser tambm responsvel pelo aparecimento de inmeras situaes patolgicas, como a colestase, as doenas neurodegenerativas, o enfarte de miocrdio e o envelhecimento precoce, entre outras. Pelo contrrio, a apoptose muito reduzida em doenas auto-imunes e no cancro. Este tipo de morte celular exige, por isso, um processo de regulao muito fino, onde o destino de viabilidade ou de morte determinado pelo balano entre as protenas anti e pro-apoptticas. A percentagem de erro na regulao da apoptose dever ser, ento, igual a zero, para que a clula no siga o caminho indesejado.
Como decorre o processo apopttico?
A apoptose, por vezes tambm designada de morte celular programada, caracteriza-se pela ocorrncia de vrias alteraes morfolgicas nas clulas afectadas, nomeadamente ao nvel da simetria dos folhetos fosfolipdicos da membrana, condensao e agregao da cromatina e fragmentao nuclear, terminando com a formao de corpos apoptticos. Estas alteraes morfolgicas so o reflexo de uma sucesso de acontecimentos bioqumicos que culminaram na activao de uma famlia de proteases de cistena, conhecidas como caspases, as quais possuem especificidade para resduos de cido asprtico. As caspases, uma vez activadas, clivam uma variedade de protenas e substratos importantes para a viabilidade celular, numa funo considerada de execuo, sendo as proteases envolvidas designadas de caspases executoras.
Biologias , 2, Fevereiro de 2001
Biologias http://www.ordembiologos/Biologias/N2.html
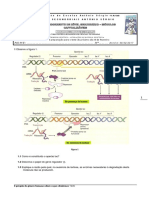
As caspases residem na clula sob pro-formas inactivas, sendo, na maioria dos casos, activadas por clivagem proteoltica. Esta activao consiste na remoo do pro-domnio aminoterminal e na clivagem do polipptido restante, resultando numa subunidade grande e numa subunidade pequena, que constituiro a enzima funcional. A via maioritria de activao das caspases executoras processa-se segundo a aco de outras proteases, designadas de caspases iniciadoras, requerendo estas a ajuda de protenas adaptadoras, as quais se ligam aos motivos de interaco proteica localizados ao nvel dos pro-domnios. A ligao do adaptador promove, assim, a activao das caspases iniciadoras que, de seguida, podem clivar e activar as caspases executoras. As molculas adaptadoras estabelecem, deste modo, a ponte entre os eventos de sinalizao e a activao das caspases, definindo duas vias gerais para a apoptose mitocondrial e a via dos receptores de morte (ver Figura 1 e Caixa). a via
Estmulo apopttico (ligando)
Receptor de morte
Estmulo apopttico
Membrana plasmtica
Bax
Adaptador Pro-caspase-8
Bcl-2 ou Bcl-xL
Mitocndria
Clivagem da Bid Citocromo c Caspase-8 Caspase-9
Pro-caspase-3 Pro-caspase-9 Apaf-1
Caspase-3
Clivagem da polimerase poli(ADP-ribose)
Apoptose
Figura 1 Apoptose mediada pela via mitocondrial, pela via dos receptores de morte ou, ainda, pela convergncia de ambas.
Exemplos de doenas que resultam de elevados nveis de apoptose
Doenas Hepticas Numa grande variedade de doenas hepticas, como os carcinomas ou as doenas virais e imunolgicas, foram observadas alteraes morfolgicas e bioqumicas caractersticas de um
Biologias , 2, Fevereiro de 2001
Biologias http://www.ordembiologos/Biologias/N2.html
processo de morte celular por apoptose. Parece, tambm, claro que a acumulao de cidos biliares hidrfobos no interior do hepatocito poder desempenhar um papel central nas leses hepticas durante a colestase, a qual ocorre em muitas doenas hepticas crnicas incluindo a cirrose biliar primria, a obstruo maligna e iatrognica dos ductos biliares e a atrsia biliar. A toxicidade induzida pelos cidos biliares hidrfobos foi durante muito tempo caracterizada pelo aumento de volume do hepatocito, destruio da membrana plasmtica e libertao dos constituintes celulares, tendo tal poder citotxico sido atribudo capacidade detergente daqueles compostos. Hoje, acredita-se que os cidos biliares hidrfobos, essenciais para a absoro intestinal de gorduras, so tambm capazes de induzir a morte celular por apoptose no tecido heptico in vivo, bem como em culturas primrias de hepatocitos de rato e em linhas celulares de hepatoma humano. A induo da apoptose pelos cidos biliares hidrfobos parece envolver a libertao de citocromo c, como resultado de stress oxidativo, o qual por sua vez aumenta a actividade de caspases especficas, resultando na fragmentao de DNA. Esta activao das capases pode, ainda, estar associada induo da protease cistena catepsina B, que tem um papel importante como enzima efectora durante a apoptose. Foi tambm recentemente descrita uma via dependente da activao do Fas, onde os cidos biliares hidrfobos parecem actuar como indutores importantes. Contrariamente aco txica dos cidos biliares hidrfobos, o cido ursodeosoxiclico um forte inibidor da apoptose, por prevenir a libertao mitocondrial de citocromo c, inibindo a subsequente activao das caspases e a clivagem da polimerase poli-(ADP-ribose). A famlia de protenas Bcl-2 tambm expressa no fgado. A este nvel, a Bcl-2 capaz de inibir a apoptose por prevenir a oxidao dos constituintes celulares como o DNA, para alm de impedir a maturao e libertao de corpos apoptticos suprimindo a activao das caspases. Por outro lado, a protena Bax pode ligar-se ao megaporo de transio da permeabilidade mitocondrial, juntamente com o translocador do nucletido adenina, aumentando a permeabilidade da membrana da mitocndria e desencadeando a morte celular. Doenas Neurodegenerativas A morte prematura de clulas neuronais tem sido muitas vezes associada ao aparecimento de doenas neurodegenerativas, como as doenas de Alzheimer, de Parkinson e de Huntington. No crebro de um doente de Alzheimer encontram-se mltiplas placas senis, que contm um ncleo de substncia amilide predominantemente constitudo pelo pptido -amilide, rodeado por clulas mortas. Segundo muitos investigadores, a deposio de -amilide no crebro desencadeia a
apoptose por activao de uma caspase iniciadora, conduzindo leso cerebral que est na origem dos sinais e sintomas da doena. Na doena de Parkinson, por outro lado, ocorre um
Biologias , 2, Fevereiro de 2001
Biologias http://www.ordembiologos/Biologias/N2.html
decrscimo progressivo do nmero de clulas que constituem uma estrutura nervosa designada por substncia negra e que produzem dopamina. Estas clulas morrem naturalmente em todas as pessoas, mas terminam o seu ciclo de vida a um ritmo muito mais acelerado nos doentes parkinsnicos, manifestando-se a doena quando apenas restam 20% das clulas iniciais. Muitos investigadores constataram que a doena de Parkinson tambm est associada a elevados nveis de apoptose, onde o stress oxidativo e a mitocndria parecem estar envolvidos. Esta doena pode, em alguns casos, ser hereditria ou pode, ainda, ser o resultado da aco txica de substncias que existem no ambiente e que entram na composio de colas, tintas, petrleos, entre outros. Esta ltima convico assenta na descoberta do xenobitico MPTP, com uma estrutura semelhante ao paraquat presente nos herbicidas e pesticidas, o qual provoca, quer in vitro quer in vivo, morte celular por apoptose e sintomas semelhante aos da doena de Parkinson. Por ltimo, na doena de Huntington ocorre uma perda progressiva de neurnios especficos na regio do estriado, com correspondente decrscimo das capacidades motoras e cognitivas do indivduo. Neste caso a sequncia expandida de poliglutamina presente na protena huntingtina, sintetizada pelos doentes, que parece induzir alteraes mitocondriais, stress oxidativo e apoptose, responsveis pela patognese da doena. A fragmentao do DNA tambm tem sido observada nas clulas do estriado destes doentes sugerindo, novamente, que os elevados nveis de apoptose podero estar na origem da doena. Por outro lado, a administrao a ratos de cido 3-nitropropinico provoca apoptose no estriado, induzindo alteraes neuroqumicas e anatmicas caractersticas da doena de Huntington. Utilizando este modelo animal tem sido possvel demonstrar o envolvimento da mitocndria no processo apopttico desencadeado na doena de Huntington.
Qual a estratgia a seguir para controlar nveis desajustados de apoptose?
Actualmente, existem vrios estudos em curso na rea da apoptose, cujo objectivo a identificao de molculas alvo sobre as quais se dever actuar farmacologicamente, no sentido de impedir o processo de doena. Uma das ideias ser a de utilizar os antagonistas dos receptores de morte, assim como os inibidores de capases, na expectativa de prevenir a apoptose em doenas inflamatrias ou destrutivas. Pela sua pequena toxicidade e pelas propriedades inibidoras da apoptose que apresenta, o cido ursodesoxiclico a que acima nos referimos, poder ser um meio teraputico poderoso no tratamento de doenas hepticas, neurodegenerativas ou outras, cuja patognese esteja associada a elevados nveis de apoptose. Outra via de investigao diz respeito potenciao da apoptose em clulas cancerosas, por recurso a ligandos dos receptores de morte, bem como a inibidores da expresso de protenas anti-apoptticas. Assim, este mecanismo de morte
Biologias , 2, Fevereiro de 2001
Biologias http://www.ordembiologos/Biologias/N2.html
celular, em primeira instncia considerado anti-natura, poder tambm ser utilizado pelo organismo para impedir o crescimento de clulas que se tornaram imortais.
Apoptose mediada pela via mitocondrial
A via mitocondrial envolve membros pro-apoptticos da famlia Bcl-2 e, mais precisamente, elementos da sub-famlia BH3 (Figura 1). Estas protenas, que incluem a Bid, a Bim, a Harakiri, a Noxa, entre outras, possuem apenas um dos domnios de homologia (o BH 3) caractersticos da famlia Bcl-2. Em resposta a um estmulo, comprometem um outro conjunto de membros proapoptticos, a sub-famlia da Bax, que inclui a Bax, a Bak e, provavelmente, a Bok, que normalmente se encontram fracamente associados membrana externa da mitocndria, prevalecendo maioritariamente no citosol. A interaco entre protenas das subfamlias BH3 e Bax leva oligomerizao dos elementos do ltimo grupo, seguida de insero na membrana externa da mitocndria. Estas molculas passam, ento, a constituir canais de sada de protenas intermembranares desde a mitocndria at ao citoplasma, incluindo o citocromo c e o factor indutor da apoptose. O citocromo c, uma vez libertado, activa uma protena citoplasmtica designada de Apaf-1, a qual recruta e activa a pro-caspase-9, constituindo um complexo proteico denominado de apoptossoma. A caspase-9, na sua funo de caspase iniciadora, ir requerer e activar a caspase-3 executora, a qual degradar protenas importantes para a viabilidade celular e, tambm, outras caspases. As protenas Bcl-2 e Bcl-XL, membros anti-apoptticos da famlia Bcl-2, bloqueiam a morte celular por prevenirem a libertao das protenas intermembranares da mitocndria. No entanto, uma vez ultrapassada a fase de morte celular que envolve este organito, as protenas anti-apoptticas deixam de ter qualquer efeito na inibio da apoptose. As protenas pro-apoptticas e as anti-apoptticas pertencentes famlia Bcl-2, podem interactuar entre si atravs dos domnios de homologia BH, formando homo e heterodmeros e regular, assim, reciprocamente, as suas funes. Por outro lado, a funo das caspases executoras tambm pode ser modulada por um outro tipo de protenas, as IAPs ( inhibitor of apoptosis proteins), que se podem ligar caspase-9 e inibir a sua actividade de protease, bloqueando a este nvel o processo apopttico. Contudo, tambm a actividade destas protenas pode ser regulada por uma outra protena de nome duplo Smac/DIABLO, a qual, juntamente com o citocromo c, libertada do espao intermembranar da mitocndria durante a apoptose. A Smac/DIABLO associa-se s IAPs e inibe a sua aco, permitindo a activao da caspase-9 a partir do complexo Apaf-1 e, consequentemente, favorecendo a apoptose.
Apoptose mediada pela via dos receptores de morte
Paralelamente via mitocondrial, ocorre tambm a via dos receptores de morte, que vo desencadear a activao das caspases a partir de diferentes tipos de apoptossomas (Figura 1). Existem muitos receptores de morte, sendo os mais conhecidos, o receptor para o factor de necrose tumoral, o receptor para o ligando Fas/CD95 e, ainda, o receptor DR3. Esta via exige, sempre, que um determinado ligando interaja com o seu receptor atravs de protenas adaptadoras, como por exemplo a protena FADD ( Fas associated death domain ). Estas protenas adaptadoras requerem a presena de pro-caspases, em particular a pro-caspases8 e a pro-caspase-10, que quando clivadas activam as caspases executoras, podendo ocorrer a apoptose. Na via mediada pelos receptores de morte, a activao das caspases tambm pode ser inibida pelas IAPs.
Convergncia das duas vias
Apesar da via dos receptores de morte no exigir o envolvimento da famlia de protenas Bcl-2 ou da mitocndria, alguns investigadores apontam para que a Bcl-2 possa inibir a apoptose desencadeada por receptores de morte. O mecanismo ligado sinalizao do receptor de morte e via de inibio pela Bcl-2 surgiu com a descoberta da clivagem da protena Bid pela caspase8 a qual, por sua vez, activada a partir dos receptores de morte. Neste mecanismo, a forma truncada de Bid (tBid), que constitui a sua forma activa, direcciona-se para a membrana mitocondrial externa, constituindo ela prpria um poro e, simultaneamente, desencadeia a oligomerizao de Bax, permitindo tambm a sua insero na membrana externa da mitocndria. A protena Bax, tal como a Bid, pode formar um poro permevel a factores intermembranares. A via maioritria de apoptose ir, ento, depender no s do tipo celular, como tambm do estmulo apopttico, observando-se, muitas vezes simultaneamente, diferentes vias apoptticas na mesma clula .
Biologias , 2, Fevereiro de 2001
Biologias http://www.ordembiologos/Biologias/N2.html
Bibliografia geral
Beal MF. 2000. Energetics in the pathogenesis of neurodegenerative diseases. Trends Neurosci. 23, 298-304. Green DR, Reed JC. 1998. Mitochondria and apoptosis. Science 281, 1309 12. Green DR. 2000. Apoptotic pathways: paper wraps stone blunts scissors. Cell 102: 1 4. Kerr JF, Wyllie AH, Currie AR. 1972. Apoptosis: a basic biological phenomenon with wide ranging implications in tissue kinetics. Br. J. Cancer 26, 239 57. Mehmet H. 2000. Caspases find a new place to hide. Nature 403, 29 30. Patel T, Roberts LR, Jones BA, Gores GJ. 1998. Dysregulation of apoptosis as a mechanism of liver disease: an overview. Semin. Liver Dis. 18, 105 14. Rodrigues CMP, Steer CJ. 1999. Bile acids and hepatocyte apoptosis: living/leaving life in the Fas lane. Gastroenterology 117, 732 6. Rodrigues CMP, Steer CJ. 2000. Mitochondrial membrane perturbations in cholestasis. J. Hepatol. 32, 135 41.
Bibliografia especfica
Du C, Fang M, Li Y, Li L, Wang X. 2000. Smac, a mitochondrial protein that promotes cytochrome cdependent caspase activation by eliminating IAP inhibition. Cell 102, 33 42. Eskes R, Desagher S, Antonsson B, Martinou JC. 2000. Bid induces the oligomerization and insertion of Bax into the outer mitochondrial membrane. Mol. Cell Biol. 20, 929 35. Rodrigues CMP, Fan G, Ma X, Kren BT, Steer CJ. 1998. A novel role for ursodeoxycholic acid in inhibiting apoptosis by modulating mitochondrial membrane perturbation. J. Clin. Invest. 101, 2790 9. Rodrigues CMP, Linehan-Stieers C, Keene CD, Ma X, Kren BT, Low WC, Steer CJ. 2000. Tauroursodeoxycholic acid partially prevents apoptosis induced by 3-nitropropionic acid: evidence for a mitochondrial pathway independent of the permeability transition. J. Neurochem. 75, 2368 79. Rodrigues CMP, Ma X, Linehan-Stieers C, Fan G, Kren BT, Steer CJ. 1999. Ursodeoxycholic acid prevents cytochrome c release in apoptosis by inhibiting mitochondrial membrane depolarization and channel formation. Cell Death Differ. 6, 842 54. Scaffidi C, Fulda S, Srinivasan A, Friesen C, Li F, Tomaselli KJ, Debatin KM, Krammer PH, Peter ME. 1998. Two CD95 (Apo-1/Fas) signaling pathways. EMBO J. 17, 1675 87.
Biologias , 2, Fevereiro de 2001
Biologias http://www.ordembiologos/Biologias/N2.html
Verhagen A, Ekert PG, Pakusch M, Silke J, Connolly LM, Reid GE, Moritz RL, Simpson RJ, Vaux DL. 2000. Identification of DIABLO, a mammalian protein that promotes apoptosis by binding to and antagonizing IAP proteins. Cell 102, 43 53.
Biologias , 2, Fevereiro de 2001
Вам также может понравиться
- 090 Ficha de Revisao - 20 3 2017Документ5 страниц090 Ficha de Revisao - 20 3 2017Ana JordãoОценок пока нет
- 071 Ficha de Revisc3b5es1Документ6 страниц071 Ficha de Revisc3b5es1Ana JordãoОценок пока нет
- Epigenética e Memória Celular Marcelo FantappieДокумент5 страницEpigenética e Memória Celular Marcelo FantappieLuiz Antonio MottaОценок пока нет
- Vacinas Anti Covid 19Документ9 страницVacinas Anti Covid 19Ana JordãoОценок пока нет
- Aspectos Comparativos Entre Os Ciclos de Vida de Diferentes PlantasДокумент3 страницыAspectos Comparativos Entre Os Ciclos de Vida de Diferentes PlantasAna JordãoОценок пока нет
- 072 Teste Escrito - 13 02 2017Документ6 страниц072 Teste Escrito - 13 02 2017Romeu VieiraОценок пока нет
- A Estranha Razão Das Listas Das ZebrasДокумент2 страницыA Estranha Razão Das Listas Das ZebrasAna JordãoОценок пока нет
- Almôndegas Com CarilДокумент1 страницаAlmôndegas Com CarilAna JordãoОценок пока нет
- Almôndegas Com CarilДокумент1 страницаAlmôndegas Com CarilAna JordãoОценок пока нет
- 1 Teste vf1 PDFДокумент9 страниц1 Teste vf1 PDFBárbara Lage GarciaОценок пока нет
- 7 Alongamentos em 7 Minutos para Alívio Completo Da Dor Nas CostasДокумент3 страницы7 Alongamentos em 7 Minutos para Alívio Completo Da Dor Nas CostasAna JordãoОценок пока нет
- 056-Ficha Revisao Dez 2016Документ5 страниц056-Ficha Revisao Dez 2016Ana JordãoОценок пока нет
- Actividade 6Документ2 страницыActividade 6Ana JordãoОценок пока нет
- Alterações ClimáticasДокумент4 страницыAlterações ClimáticasAna JordãoОценок пока нет
- Microsoft Word - Protocolo Experimental - FAZER QUEIJOДокумент1 страницаMicrosoft Word - Protocolo Experimental - FAZER QUEIJOAna JordãoОценок пока нет
- ConveccaoДокумент1 страницаConveccaoAna JordãoОценок пока нет
- Atividade Laboratorial - Subistemas - Proposta de SoluçãoДокумент1 страницаAtividade Laboratorial - Subistemas - Proposta de SoluçãoAna JordãoОценок пока нет
- Acidez Oceanos v3Документ4 страницыAcidez Oceanos v3Ana JordãoОценок пока нет
- Acidez Oceanos v3Документ4 страницыAcidez Oceanos v3Ana JordãoОценок пока нет
- AN FolhaCalculoДокумент4 страницыAN FolhaCalculoAna JordãoОценок пока нет
- Apoio Ao Estudo - Apoio ExameДокумент2 страницыApoio Ao Estudo - Apoio ExameAna JordãoОценок пока нет
- Centro Recursos Cienciaviva Fazer Sabonete 14666265755d95Документ7 страницCentro Recursos Cienciaviva Fazer Sabonete 14666265755d95Ana JordãoОценок пока нет
- A Pílula Masculina Está Cada Vez Mais PróximaДокумент4 страницыA Pílula Masculina Está Cada Vez Mais PróximaAna JordãoОценок пока нет
- Acidez Oceanos v3Документ4 страницыAcidez Oceanos v3Ana JordãoОценок пока нет
- Parecer Acerca Da Prova de Exame Nacional Do Ensino SecundárioДокумент2 страницыParecer Acerca Da Prova de Exame Nacional Do Ensino SecundárioAna JordãoОценок пока нет
- Esclerose Lateral Amiotrófica (ELA)Документ11 страницEsclerose Lateral Amiotrófica (ELA)Ana JordãoОценок пока нет
- As Picadas e Mordidas Mais Perigosas Do Mundo AnimalДокумент1 страницаAs Picadas e Mordidas Mais Perigosas Do Mundo AnimalAna JordãoОценок пока нет
- Carlos Marques Da Silva - Fósseis Ao Virar Da EsquinaДокумент5 страницCarlos Marques Da Silva - Fósseis Ao Virar Da EsquinaAna JordãoОценок пока нет
- Investigadores Que Ganharam Prémio Champalimaud Curam Cegueira HereditáriaДокумент24 страницыInvestigadores Que Ganharam Prémio Champalimaud Curam Cegueira HereditáriaAna JordãoОценок пока нет
- Boletim 5Документ5 страницBoletim 5Ana JordãoОценок пока нет
- Sistema Circulatório Excretor Respiratorio e ReprodutorДокумент20 страницSistema Circulatório Excretor Respiratorio e ReprodutorSaraiva JuniorОценок пока нет
- Gestao GemelarДокумент50 страницGestao Gemelarnatanael sousaОценок пока нет
- Fichamento ALIMENTAÇÃO NOS PRIMEIROS TRÊS MESES DE VIDA 28 - 07Документ3 страницыFichamento ALIMENTAÇÃO NOS PRIMEIROS TRÊS MESES DE VIDA 28 - 07Danielli PiresОценок пока нет
- INFLAMAÇÃOДокумент8 страницINFLAMAÇÃOBernardo Furtado CruzeiroОценок пока нет
- Epidemiologia Estrategia ConcursoДокумент50 страницEpidemiologia Estrategia ConcursoNagla Maria Bezerra MarquesОценок пока нет
- Epidemiologia - Vigilância EpidemiológicaДокумент13 страницEpidemiologia - Vigilância Epidemiológicadom padroОценок пока нет
- Acupuntura Estética Os Três Pontos Da Obesidade para o EmagrecimentoДокумент4 страницыAcupuntura Estética Os Três Pontos Da Obesidade para o EmagrecimentoRoseli De Oliveira SilvaОценок пока нет
- Prã - Projeto TCCДокумент8 страницPrã - Projeto TCCgabrel fariaОценок пока нет
- Pereira Kenp DR BotДокумент76 страницPereira Kenp DR BotGiovani AngeloОценок пока нет
- Clínica Médica Sistema CardioДокумент16 страницClínica Médica Sistema CardioAdriana NunesОценок пока нет
- Depressão Pós-PartoДокумент7 страницDepressão Pós-PartoCida NicolauОценок пока нет
- Bases Patológicas Das Doenças Do Trato GastrointestinalДокумент80 страницBases Patológicas Das Doenças Do Trato GastrointestinalRafael Trindade Burtet100% (1)
- UFCD 9137 - Anatomia Do Sistema Veno-LinfáticoДокумент35 страницUFCD 9137 - Anatomia Do Sistema Veno-LinfáticoFrederico Dinis Rocha100% (1)
- Uti SilДокумент17 страницUti SilOrion TechОценок пока нет
- Caso Clínico DiabetesДокумент2 страницыCaso Clínico DiabetesBrenno AmorimОценок пока нет
- Massagem DesportivaДокумент35 страницMassagem DesportivaClara ZilligОценок пока нет
- Nefrologia Resumo Litiase Renal TSRS 20160323Документ8 страницNefrologia Resumo Litiase Renal TSRS 20160323Danielle Do NascimentoОценок пока нет
- @biomedicina - BR - Fisiologia Aplicada A Reprodução HumanaДокумент68 страниц@biomedicina - BR - Fisiologia Aplicada A Reprodução HumanaBrena SilvaОценок пока нет
- Protocolo Sepse Sirio LibanesДокумент14 страницProtocolo Sepse Sirio LibanesNina NuzzoОценок пока нет
- MAMOGRAFIAДокумент18 страницMAMOGRAFIAAnynhha Mathos100% (1)
- Cuidados No Pós-PartoДокумент38 страницCuidados No Pós-PartoInês CachaçoОценок пока нет
- Relação Estrutura-AtividadeДокумент43 страницыRelação Estrutura-AtividadePedroОценок пока нет
- Laser Tera PiaДокумент110 страницLaser Tera Piadentistasleao100% (1)
- Atividade 2 - Saúde - Anatomia Humana - 54-2023Документ3 страницыAtividade 2 - Saúde - Anatomia Humana - 54-2023Cavalini Assessoria Acadêmica100% (1)
- Revista 12 Maio Junho 2012Документ68 страницRevista 12 Maio Junho 2012Croitort53Оценок пока нет
- Distúrbios CirculatóriosДокумент29 страницDistúrbios CirculatórioslevivetОценок пока нет
- Anamnese de AdultoДокумент5 страницAnamnese de AdultoArlan Pinto100% (1)
- Avancos em Periodontia e Implantodontia - Paradigmas e Desafios - Cap 03Документ18 страницAvancos em Periodontia e Implantodontia - Paradigmas e Desafios - Cap 03francescogregorioОценок пока нет
- Cuidados Na GestaçãoДокумент4 страницыCuidados Na Gestaçãoisabellacassi.opsОценок пока нет
- Reações de HipersensibilidadeДокумент19 страницReações de Hipersensibilidadeamandaterra99Оценок пока нет