Академический Документы
Профессиональный Документы
Культура Документы
Equilíbrio Químico
Загружено:
fernandomecanica0 оценок0% нашли этот документ полезным (0 голосов)
50 просмотров10 страниц1) Um equilíbrio químico ocorre quando a proporção entre reagentes e produtos se mantém constante ao longo do tempo.
2) A constante de equilíbrio é uma relação matemática que descreve essa proporção e depende da temperatura.
3) Equilíbrios heterogêneos envolvem mais de uma fase, como um sólido e um gás.
Исходное описание:
Оригинальное название
Equilíbrio químico.doc
Авторское право
© © All Rights Reserved
Доступные форматы
DOC, PDF, TXT или читайте онлайн в Scribd
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документ1) Um equilíbrio químico ocorre quando a proporção entre reagentes e produtos se mantém constante ao longo do tempo.
2) A constante de equilíbrio é uma relação matemática que descreve essa proporção e depende da temperatura.
3) Equilíbrios heterogêneos envolvem mais de uma fase, como um sólido e um gás.
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOC, PDF, TXT или читайте онлайн в Scribd
0 оценок0% нашли этот документ полезным (0 голосов)
50 просмотров10 страницEquilíbrio Químico
Загружено:
fernandomecanica1) Um equilíbrio químico ocorre quando a proporção entre reagentes e produtos se mantém constante ao longo do tempo.
2) A constante de equilíbrio é uma relação matemática que descreve essa proporção e depende da temperatura.
3) Equilíbrios heterogêneos envolvem mais de uma fase, como um sólido e um gás.
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOC, PDF, TXT или читайте онлайн в Scribd
Вы находитесь на странице: 1из 10
Equilbrio qumico
Um equilbrio qumico a situao em que a proporo entre as quantidades de
reagentes e produtos em uma reao qumica se mantm constante ao longo do tempo.
Foi estudado pela primeira vez pelo qumico francs Claude Louis Bertollet em seu
livro Essai de statique chimique de !"#$.
%!&
'eoricamente( toda a reao qumica ocorre nos dois sentidos) de reagentes se
transformando em produtos e de produtos se transformando de volta em reagentes.
Contudo( em certas rea*es( como a de com+usto( virtualmente !##, dos reagentes
so convertidos em produtos( e no se o+serva o contr-rio ocorrer .ou pelo menos no
em escala mensur-vel/0 tais rea*es so camadas de irreversveis. 1- tam+m uma
srie de rea*es nas quais logo que uma certa quantidade de produto.s/ formada(
este.s/ torna.m/ a dar origem ao.s/ reagente.s/0 essas rea*es possuem o nome de
reversveis. 2 conceito de equil+rio qumico praticamente restringe3se 4s rea*es
reversveis.
Reversibilidade de reaes qumicas
Um e5emplo de reao reversvel a da produo da am6nia .71
$
/( a partir do g-s
idrognio .1
8
/ e do g-s nitrognio .7
8
/ 9 que faz parte do :rocesso de 1a+er)
7
8.g/
; $1
8.g/
871
$.g/
Conceitos em
Equilbrio qumico
Constante de acidez
<oluo tampo
Constante de dissociao
=sta+ilidade qumica
Coeficiente de partio
Constante de equilbrio
=5trao lquido3lquido
>iagrama de fases
?egras das fases de @i++
Coeficiente de reao
=quil+rio de solu+ilidade
<olu+ilidade molar
Constante de esta+ilidade
Constante de esta+ilidade para
comple5os
=quil+rio termodinAmico
=st-gio de equil+rio
=quil+rio vapor3lquido
edit
7ote3se que a seta dupla . / significa que a reao ocorre nos dois sentidos( e que o
su+scrito .g/ indica que a su+stAncia se encontra na fase gasosa.
7esta reao( quando as molculas de nitrognio e as de idrognio colidem entre si -
uma certa cance da reao entre elas ocorrer( assim como quando molculas de am6nia
colidem entre si - uma certa cance de elas se dissociarem e de se reorganizarem em
1
8
e 7
8
.
7o incio do processo( quando - apenas uma mistura de idrognio e nitrognio( as
cances das molculas dos reagentes .1
8
e 7
8
/ colidirem umas com as outras a
m-5ima de toda a reao( o que far- com que a ta5a .ou velocidade/ com que a reao
ocorre tam+m o seBa. :orm 4 medida com que a reao se processa o nCmero de
molculas de idrognio e de nitrognio diminui( reduzindo dessa forma as cances de
elas colidirem entre si e( conseqDntemente( a velocidade desse sentido da reao. :or
outro lado( com o avanar da reao( o nCmero de molculas de am6nia vai
aumentando( o que faz com que cresam as cances de elas colidirem e de se voltar a
formar idrognio e nitrognio( elevando assim a velocidade desse sentido da reao.
:or fim cegar- um momento em que tanto a velocidade de um dos sentidos quanto a
do outro sero idnticas( nesse ponto nenuma das velocidades variar- mais .se forem
mantidas as condi*es do sistema onde a reao se processa/ e ter3se3- atingido o
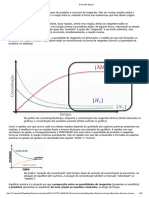
equilbrio qumico( conforme ilustrado nas figuras a+ai5o)
Eelocidade das rea*es direta e inversa em
funo do tempo
Concentrao das su+stAncias envolvidas
em funo do tempo
Um raciocnio similar( em princpio( pode ser aplicado para qualquer equil+rio.
>eve3se salientar que quando uma reao atinge o equil+rio ela no para. =la continua
se processando( porm tanto a reao direta como a inversa ocorrem 4 mesma
velocidade( e desse Beito a proporo entre os reagentes e os produtos no varia . :or
outras palavras( estamos na presena de um equilbrio dinmico .e no de um equilbrio
esttico/.
Constante de equilbrio
F:or e5emplo( a constante dessa reao na temperatura de !### G #(#H!$ LImol .
comum se o+servar a omisso da unidade da constante( uma vez que sua unidade pode
variar de equil+rio para equil+rio/.F
Uma vez atingido o equil+rio a proporo entre os reagentes e os produtos no
necessariamente de !)! .l3se um para um/. =ssa proporo descrita por meio de uma
relao matem-tica( mostrada a seguir)
>ada a reao genrica)
aJ ; +B KL ; zM (
onde A( B( Y e Z representam as espcies qumicas envolvidas e a( b( y e z os seus
respectivos coeficientes estequiomtricos. J fNrmula que descreve a proporo no
equil+rio entre as espcies envolvidas )
2s colcetes representam o valor da concentrao .normalmente em molIL/ da espcie
que est- sim+olizada dentro dele .%J& O concentrao da espcie J( e assim por diante/.
K
c
uma grandeza camada de constante de equilbrio da reao. Cada reao de
equil+rio possui a sua constante( a qual sempre possui o mesmo valor para uma mesma
temperatura. >e um modo geral( a constante de equil+rio de uma reao qualquer
calculada dividindo3se a multiplicao das concentra*es dos produtos .cada uma
elevada ao seu respectivo coeficiente estequiomtrico/ pela multiplicao das
concentra*es dos reagentes .cada uma elevada ao seu relativo coeficiente
estequiomtrico/.
Um e5emplo disso a formao do triN5ido de en5ofre .<2
$
/ a partir do g-s o5ignio
.2
8
/ e do diN5ido de en5ofre .<2
8.g/
/ 9 uma etapa do processo de fa+ricao do -cido
sulfCrico)
8 <2
8.g/
; 2
8.g/
8 <2
$.g/
J constante de equil+rio desta reao dada por)
P possvel determinar e5perimentalmente o valor da constante de equil+rio para uma
dada temperatura. :or e5emplo( a constante dessa reao na temperatura de !### G
#(#H!$ molIL . comum o+servar a omisso da unidade da constante( uma vez que sua
unidade pode variar de equil+rio para equil+rio/. J partir dela( dada uma certa
quantidade conecida de produtos adicionados inicialmente em um sistema nessa
temperatura( possvel calcular por meio da fNrmula da constante qual ser- a
concentrao de todas as su+stAncias quando o equil+rio for atingido.
Constante para a soma de reaes
<e uma reao qumica pode ser e5pressa pela soma de duas ou mais rea*es .ou etapas
individuais/( ento a constante de equil+rio da reao glo+al ser- a multiplicao das
constantes de cada uma das rea*es individuais.
8:
.g/
; $Cl
8.g/
8:Cl
$.g/
:Cl
$.g/
; Cl
8.g/
:Cl
Q.g/
8:
.g/
; QCl
8.g/
8:Cl
Q.g/
7este caso( a terceira reao igual 4 soma da primeira mais duas vezes a segunda)
;
8:
.g/
; $Cl
8.g/
8:Cl
$.g/
:Cl
$.g/
; Cl
8.g/
:Cl
Q.g/
:Cl
$.g/
; Cl
8.g/
:Cl
Q.g/
8:
.g/
; QCl
8.g/
8:Cl
Q.g/
= a sua constante de equil+rio pode ser e5pressa por)
:ode se perce+er que caso uma reao aparea duas ou mais vezes na soma( ela aparece
esse mesmo nCmero de vezes na multiplicao.
[editar] Relao entre a velocidade da reao e a constante de equilbrio
Conforme B- mencionado( no equil+rio a velocidade tanto da reao inversa quanto a da
direta so iguais. :or sua vez( a velocidade de uma reao depende de uma outra
constante camada de constante de velocidade .sim+olizada aqui por k/0 e possvel
encontrar uma relao entre as constantes de velocidade das rea*es direta e indireta( e a
constante de equil+rio.
:ara demonstrar isso( considere3se o seguinte equil+rio genrico .supondo que as suas
rea*es ocorram cada qual em uma Cnica etapa/)
8J R ; L
Jgora veBamos as duas rea*es que ocorrem nele( Buntamente com a e5presso de suas
respectivas velocidades .r/)
8J R ; L
R ; L 8J
P importante frisar que o e5poente que eleva as concentra*es das espcies na fNrmula
da velocidade no necessariamente igual ao respectivo coeficiente estequiomtrico da
espcie na reao( contudo o e5poente certamente ser- assim se a reao se processar
em uma Cnica etapa .conforme se est- considerando nessa situao/.
Uma vez que as velocidades de am+as as rea*es so idnticas no equil+rio( pode3se
igual-3las)
?earranBando a equao( tem3se)
2+servemos que a e5presso do mem+ro esquerdo idntica 4 fNrmula do equil+rio
dessa reao. =nto podemos escrever)
=sta relao v-lida para qualquer equil+rio cuBas rea*es ocorram em uma Cnica
etapa( o que pode ser facilmente constatado por essa mesma deduo para outros
equil+rios.
7o caso de as rea*es se processarem em mais de uma etapa( +asta lem+rar que a reao
glo+al nada mais que a soma das rea*es de cada etapa. :ara cada uma das etapas
pode3se fazer essa mesma deduo( e ento somar cada reao .o que significa
multiplicar as suas constantes/. >essa forma teremos para uma reao de mCltiplas
etapas)
<endo k
!
( kS
!
( k
8
( kS
8
e assim por diante as constantes de velocidades de cada etapa.
Equilbrio heterogneo
Tuando todas as su+stAncias envolvidas no equil+rio se encontram no mesmo estado
fsico diz3se que temos um equilbrio homo!neo( que o caso de todos os equil+rios
apresentados aqui at ento. Jnalogamente( os equil+rios onde esto envolvidas mais
de uma fase so camados de equilbrios hetero!neos( como o seguinte)
7i
.s/
; HC2
.g/
7i.C2/
H.g/
7ote3se que o su+scrito .s/ significa que a espcie se encontra no estado sNlido.
=quil+rios eterogneos( como este( freqDentemente apresentam ao menos um sNlido
puro ou um lquido puro.
7a e5presso da constante de equil+rio temos as concentra*es das espcies
envolvidas. J concentrao pode ser calculada dividindo3se o nCmero de mols da
su+stAncia pelo volume que ela ocupa. 2 nCmero de mols representa a quantidade de
matria e( por isso( ele proporcional a massa0 assim o nCmero de mols dividido pelo
volume proporcional 4 massa dividida pelo volume.
J densidade de algo Bustamente calculada dividindo3se a sua massa pelo seu volume
ocupado. 7o caso de uma su+stAncia pura( toda a sua massa corresponde 4 de uma Cnica
su+stAncia( e assim a sua FconcentraoF do seu nCmero de mols dividido pelo volume
proporcional a sua densidade .massa dividida pelo volume/.
J densidade de uma dada su+stAncia em dadas condi*es uma propriedade intensiva(
ou seBa( a mesma independentemente do quanto dessa su+stAncia ouver. >essa forma
pode3se concluir que a concentrao de um sNlido ou um lquido puro .que so
virtualmente icompressveis/ a mesma independentemente de quanto ouver deles .B-
um g-s( que pode ser comprimido sem dificuldade( tem a sua concentrao variada
facilmente/. :or essa razo se simplifica as e5press*es das constantes de equil+rio
omitindo3se a concentrao de sNlidos e lquidos puros.
Com isso( a e5presso para a constante do Cltimo equil+rio apresentado fica)
Equilbrio gasoso
:ela equao dos gases perfeitos tem3se que para cada g-s de uma mistura gasosa)
(
onde "
#
a presso parcial de um g-s # qualquer .ou seBa( a presso que ele teria caso
estivesse apenas ele no recipiente/( $ o volume ocupado pela mistura( n
#
o nCmero
de mols do g-s( % a constante dos gases perfeitos( e & a temperatura em Uelvin.
?earranBando a equao( teremos)
2 mem+ro esquerdo .n
#
I$/ a fNrmula para o c-lculo da concentrao molar do g-s. J
constante % sempre a mesma e a temperatura & no varia em um sistema que
permanece em equil+rio qumico( assim o Cnico fator que pode variar na equao em
um equil+rio a presso parcial "
#
. >essa forma pode3se dizer que a concentrao do
g-s proporcional 4 sua presso parcial.
Com +ase nisso( tam+m possvel escrever a fNrmula da constante de equil+rio
usando3se as press*es parciais dos gases envolvidos( no lugar de suas concentra*es.
:or e5emplo)
1
8.g/
; V
8.g/
81V
.g/
2+serve3se que agora a constante de equil+rio est- representada por K
p
( em vez de K
c
.quando o c-lculo foi feito usando3se as concentra*es dos gases/. =ssas duas
constantes para um mesmo caso possuem valores diferentes uma da outra( ento
importante especificar qual das duas se est- usando quando se est- lidando com um
equil+rio.
Adio ou remoo de reagentes !o serve para s"lidos#
Jo se alterar a quantidade de uma su+stAncia( tam+m se est- me5endo na velocidade
em que a reao se processa .pois se estar- mudando as cances de as su+stAncias
reagirem entre si/. >essa forma( a velocidade das rea*es direta e inversa dei5a de ser
igual) se uma su+stAncia foi retirada de uma das rea*es( essa passar- a ser mais lenta0 e(
analogamente( ela passar- a ser mais r-pida se uma su+stAncia for adicionada a ela.
Jssim ocorre que se algo for acrescentado( o equil+rio tende a reduzir a quantidade
dessa su+stAncia e vice3versa.
'al resposta do equil+rio pode ser sumarizada pelo assim camado "rincpio de 'e
(hatelier)
)uando um stress * aplicado a um sistema em equilbrio dinmico+ o
equilbrio tende a se a,ustar para diminuir o e-eito do stress.
W medida que as rea*es se processam( as suas velocidades vo se apro5imando at que
se igualem e assim atingido novamente o equil+rio. J constante do equil+rio ser- a
mesma da de antes de se adicionar ou remover su+stAncias.
Compresso
Um equil+rio gasoso pode ser afetado pela compresso. >e acordo com o princpio de
Le Catelier( com o aumento da presso o equil+rio tende a se deslocar no sentido de
diminuir essa presso( o que significa favorecer a reao que resulte no menor nCmero
de molculas no estado gasoso. 7esse caso( a o valor da constante de equil+rio tam+m
no alterado.
:ara se o+servar tal efeito( considere3se esse equil+rio)
7
8
2
H.g/
872
8.g/
Js concentra*es podem ser escritas como o seu nCmero de moles dividido pelo volume
.n
#
I $/( ento teremos)
<e o valor de $ .volume/ diminuir( preciso que o nCmero de mols do 7
8
2
H
aumente
para que o valor da constante de equil+rio permanea o mesmo. 7a reao( esse
reagente representava metade do nCmero de molculas do produto. 2 mesmo raciocnio
pode ser aplicado em qualquer equil+rio gasoso.
$emperatura
P encontrado e5perimentalmente que a formao de produtos de uma reao e5otrmica
.isto ( que li+erta energia/ favorecida com a diminuio da temperatura( ao passo que
a formao de produtos em uma reao endotrmica .isto ( que a+sorve energia/
favorecida com o aumento da temperatura.
=m um equil+rio( se uma reao endotrmica a outra necessariamente e5otrmica( e
vice3versa. Jumentar ou diminuir a temperatura far- com que a velocidade de uma das
rea*es aumente e a da outra diminua. Js velocidades das rea*es se igualaro
novamente depois de um tempo0 porm nesse caso como temos o favorecimento e o
desfavorecimento da formao de certas su+stAncias( a constante de equil+rio nessa
nova temperatura no ser% mais a mesma da temperatura anterior.
Catalisador
J adio de um catalisador direciona a reao para um novo mecanismo( o qual mais
r-pido do que o sem a cat-lise. Contudo( o catalisador no afeta o valor da constante de
equil+rio( ele apenas faz com que o equil+rio seBa atingido em um tempo menor(
conforme mostrado na figura a seguir)
Curvas traceBadas) com catalisador
Curvas ceias) sem catalisador
Jteno) 2 equil+rio no deslocado com a presena do catalisador.
Relao entre as constantes &
p
e &
c
=5iste uma relao matem-tica entre as constantes de equil+rio em funo da
concentrao K
c
e em funo da presso parcial K
p
( +aseada na equao de ClapeKron)
em que) ? a constante universal dos gases( ' a temperatura a+soluta e Xn a
diferena entre a soma dos coeficientes inteiros dos produtos gasosos e a soma dos
coeficientes inteiros dos reagentes gasosos. :or e5emplo( no equil+rio)
aJ
.g/
; +B
.g/
; cC
.s/
KL
.g/
; zM
.g/
Xn O .K ; z/ 3 .a ; +/
=ssa e5presso matem-tica apresenta uma limitao( no admitindo a presena de um
ou mais lquidos na reao em questo. Vsso no significa que a reao no apresente K
p
e K
c
( significa apenas que a e5presso inv-lida para esse caso.
Aplicaes
>ada a constante de equil+rio( possvel sa+er em qual direo a reao vai ocorrer
preferencialmente no incio quando misturamos certas quantidades de su+stAncias que
estaro em equil+rio entre si.
:ara isso +asta calcular o quociente de rea/0o para o incio da mistura. <ua e5presso
e5atamente a mesma que a da constante de equil+rio( o que muda que nesse caso
usamos as concentra*es ou as press*es parciais de um dado instante da reao .no
necessariamente no equil+rio/.
<e o quociente de reao for maior que a constante de equil+rio( isso significa que a
quantidade de produtos alta demais e( pelo princpio de Le Catelier( a reao vai se
processar preferencialmente no sentido de consumir os produtos. Jnalogamente( se o
quociente de reao for menor que a constante de equil+rio( a reao vai se processar
preferencialmente do sentido de consumir os reagentes.
<a+endo3se disso( tam+m possvel favorecer a formao de um produto de interesse o
removendo em uma certa ta5a ao longo do processo .pois assim o equil+rio ser-
deslocado a favor da formao desse produto/.
Вам также может понравиться
- (Apostila) Roscas - SENAIДокумент32 страницы(Apostila) Roscas - SENAIEduardo BandeiraОценок пока нет
- (EQ UFRJ 2017.2) P1 Cinética (Prof. Mônica) (Por Rafael Ratier) PDFДокумент70 страниц(EQ UFRJ 2017.2) P1 Cinética (Prof. Mônica) (Por Rafael Ratier) PDFVictor DiasОценок пока нет
- 60 Termometria, Calorimetria e Transmissão de CalorДокумент40 страниц60 Termometria, Calorimetria e Transmissão de CalorÉrica RamosОценок пока нет
- Estados Físicos Da Matéria e Fatores Que Influenciam Na Mudança Dos Estados FísicosДокумент39 страницEstados Físicos Da Matéria e Fatores Que Influenciam Na Mudança Dos Estados FísicosGildásio Júnior100% (1)
- Capítulo 3 Aula 1: Tensão e Deformação de Corpos Solicitados TangencialmenteДокумент35 страницCapítulo 3 Aula 1: Tensão e Deformação de Corpos Solicitados TangencialmenteGiovani MoreiraОценок пока нет
- Seg Oper Caldeiras Cad Doc2009Документ190 страницSeg Oper Caldeiras Cad Doc2009Luiz Paulo SteinОценок пока нет
- Dinâmica Dos FluidosДокумент60 страницDinâmica Dos FluidosSANDRO SALOMÃO YURIОценок пока нет
- Resumo Equilíbrio-QuímicoДокумент4 страницыResumo Equilíbrio-Químicoantonio josé das chagas100% (1)
- Cap 7 - Energia e Balanços de EnergiaДокумент38 страницCap 7 - Energia e Balanços de EnergiaJoao Pedro Mangueira100% (1)
- 2018 - Equilíbrio QuímicoДокумент83 страницы2018 - Equilíbrio QuímicoAugusto TanamatiОценок пока нет
- UNIDADE II - TEORIA - 2-2020 - Fenômenos de Transportes - Engenharia Elétrica - Campus Contagem - PCO - Noite - G1 - T1 - 2020 - 2Документ8 страницUNIDADE II - TEORIA - 2-2020 - Fenômenos de Transportes - Engenharia Elétrica - Campus Contagem - PCO - Noite - G1 - T1 - 2020 - 2Ciro BragaОценок пока нет
- Pequena Introdução À Termodinâmica Do Equilíbrio de MisturasДокумент32 страницыPequena Introdução À Termodinâmica Do Equilíbrio de MisturasSandro PizzoОценок пока нет
- Equilíbrio QuímicoДокумент94 страницыEquilíbrio QuímicoMicheleОценок пока нет
- Equilíbrio QuímicoДокумент10 страницEquilíbrio QuímicoAbreu Ngongo Filipa KasanjiОценок пока нет
- Equilíbrio Químico 3 TrabalhoДокумент19 страницEquilíbrio Químico 3 TrabalhoLulava AlfredoОценок пока нет
- Resumos - Quimica - 11º - Novo - Programa - 2016Документ10 страницResumos - Quimica - 11º - Novo - Programa - 2016Margarida FonsecaОценок пока нет
- Cinética Química IДокумент3 страницыCinética Química Iambiente.grupodomingaoОценок пока нет
- Apostila 5 - Equilíbrio QuímicoДокумент39 страницApostila 5 - Equilíbrio QuímicoGustavo MarinhoОценок пока нет
- Equilibrio QuimicoДокумент20 страницEquilibrio QuimicoGiulliano Carlos ThomazОценок пока нет
- Estudo Dirigido Equilíbrio Químico - Parte 1Документ20 страницEstudo Dirigido Equilíbrio Químico - Parte 1Carol PontesОценок пока нет
- Introdução: Reações Químicas ReversíveisДокумент6 страницIntrodução: Reações Químicas ReversíveisEduarda SantannaОценок пока нет
- Aula 1 QF 2Документ17 страницAula 1 QF 2Cintya Dos SantosОценок пока нет
- Quimica 11ºДокумент3 страницыQuimica 11ºSaraОценок пока нет
- Química 11Документ8 страницQuímica 11MariassОценок пока нет
- Relatório Do Experimento 7 - INLAB de QGДокумент11 страницRelatório Do Experimento 7 - INLAB de QGmarianne carvalhoОценок пока нет
- Equilibrio QuimicoДокумент30 страницEquilibrio QuimicoAna Raquel DamacenaОценок пока нет
- FQ - II - Eq Quimico e Eletroquimica1Документ41 страницаFQ - II - Eq Quimico e Eletroquimica1Fabiana Monteiro100% (1)
- Aprovar Ano05 Livro22 009Документ1 страницаAprovar Ano05 Livro22 009Aprovar UEA Apostilas100% (2)
- Apfq05. Equilíbrios MolecularesДокумент18 страницApfq05. Equilíbrios MoleculareselizaОценок пока нет
- Resumo Cinetica Quimica (Muito Bom)Документ11 страницResumo Cinetica Quimica (Muito Bom)Anderson CagliariОценок пока нет
- 11511701032012fundamentos de Fisico-Quimica Aula 10Документ9 страниц11511701032012fundamentos de Fisico-Quimica Aula 10Liciani Inae PuttiОценок пока нет
- 11394918082016termodinamica Quimica Aula 10 240418 003344Документ9 страниц11394918082016termodinamica Quimica Aula 10 240418 003344marcijaneОценок пока нет
- Quimica 11Документ22 страницыQuimica 11Diana LopesОценок пока нет
- FT 2 - EqulíbrioДокумент16 страницFT 2 - EqulíbrioMartinha LeãoОценок пока нет
- Apostila de Equilíbrio QuímicoДокумент10 страницApostila de Equilíbrio QuímicoJonacir NovaesОценок пока нет
- Lei de Ação Das MassasДокумент3 страницыLei de Ação Das Massasanastancia mucuhoОценок пока нет
- Reacções Analíticas PDFДокумент83 страницыReacções Analíticas PDFCaltonОценок пока нет
- Cinética e Cálculo de Reatores I - Aula 2Документ15 страницCinética e Cálculo de Reatores I - Aula 2Érick Lara De AlmeidaОценок пока нет
- Termodinâmica de SoluçõesДокумент6 страницTermodinâmica de SoluçõesmarianapeixОценок пока нет
- Trabalho Quimica Miguel N-21 3DДокумент10 страницTrabalho Quimica Miguel N-21 3DMiguel Baptista RodriguesОценок пока нет
- Apresentação 6Документ7 страницApresentação 6Fernanda BonfimОценок пока нет
- Material Química Módulo 5Документ19 страницMaterial Química Módulo 5barbarasuellenquimicaОценок пока нет
- Apostila Leis de VelocidadeДокумент33 страницыApostila Leis de Velocidadeisaaaasss0% (1)
- Cromato e DicromatoДокумент9 страницCromato e DicromatoWolney PiresОценок пока нет
- Medicina-química-Cinética Química - Conceitos Fundamentais, Velocidade Média de Uma Reação e Lei Da Velocidade-12!07!2019Документ21 страницаMedicina-química-Cinética Química - Conceitos Fundamentais, Velocidade Média de Uma Reação e Lei Da Velocidade-12!07!2019Daniel MagalhãesОценок пока нет
- FQE1 EXP3 CineticaДокумент11 страницFQE1 EXP3 Cinetica2003039044Оценок пока нет
- Apostila - Equlíbrio QuímicoДокумент2 страницыApostila - Equlíbrio QuímicoCamille SousaОценок пока нет
- 02-Cinetica de Reacoes HomogeneasДокумент34 страницы02-Cinetica de Reacoes HomogeneasLeticia MendesОценок пока нет
- Equilibrio QuimicoДокумент38 страницEquilibrio QuimicoAnny CarolinaОценок пока нет
- Aula 2 - CRQДокумент32 страницыAula 2 - CRQRenanОценок пока нет
- Apostila Curso Nutrição 2023 QBQ314Документ34 страницыApostila Curso Nutrição 2023 QBQ314nicolasbarrosОценок пока нет
- Cinemática QuímicaДокумент19 страницCinemática Químicalaiane rabelo bragaОценок пока нет
- Tópico - 9 - Introdução Ao Equilíbrio QuímicoДокумент11 страницTópico - 9 - Introdução Ao Equilíbrio QuímicoGiovanna HikariОценок пока нет
- 5 EquilibrioQuimicoДокумент21 страница5 EquilibrioQuimicoRute FidalgoОценок пока нет
- Exercícios Equilibrio QuímicoДокумент48 страницExercícios Equilibrio Químicosrribeiro6363Оценок пока нет
- Trabalho de QuímicaДокумент15 страницTrabalho de QuímicaJean de Liz RosaОценок пока нет
- A Velocidade Média de Consumo de Um Reagente Ou de Formação de Um Produto É Calculada em Função Da Variação Da Quantidade de Reagentes e Produtos Pela Variação Do TempoДокумент14 страницA Velocidade Média de Consumo de Um Reagente Ou de Formação de Um Produto É Calculada em Função Da Variação Da Quantidade de Reagentes e Produtos Pela Variação Do TempoJonathan FrancoОценок пока нет
- Cinética EnzimáticaДокумент47 страницCinética EnzimáticaDébora Barros100% (1)
- 1-Termoquímica ApostilaДокумент18 страниц1-Termoquímica ApostilaVaniely SiqueiraОценок пока нет
- Trabalho de QuimicaДокумент9 страницTrabalho de QuimicaMarciliaОценок пока нет
- Cap Vi - Equilíbrios Químicos HomogêneosДокумент8 страницCap Vi - Equilíbrios Químicos HomogêneosFilipeufcОценок пока нет
- Equilibrio QuimicoДокумент11 страницEquilibrio QuimicoMirelly Richil de Carvalho75% (4)
- Relatório 7 F.QДокумент12 страницRelatório 7 F.QNanda MouraОценок пока нет
- p4 CQ Bioquimica 2009 Cinetica Temperatura-Revcm PCДокумент5 страницp4 CQ Bioquimica 2009 Cinetica Temperatura-Revcm PCJoana FerreiraОценок пока нет
- 1.2 Estado EqulibrioДокумент47 страниц1.2 Estado EqulibriocarlosОценок пока нет
- Cinética QuímicaДокумент4 страницыCinética QuímicaJaciraОценок пока нет
- Tipos de Reações QuimicasДокумент5 страницTipos de Reações QuimicasfernandomecanicaОценок пока нет
- Aula AjusteДокумент22 страницыAula AjustefernandomecanicaОценок пока нет
- Vent Il AdoresДокумент116 страницVent Il Adorescharles cordeiroОценок пока нет
- Lista II de FT IIДокумент4 страницыLista II de FT IIGustavo LacerdaОценок пока нет
- Estudo Dos Gases e Leis Da TermodinmicaДокумент8 страницEstudo Dos Gases e Leis Da Termodinmicajoao salesОценок пока нет
- GasesДокумент10 страницGasesvh85rtc8xpОценок пока нет
- 02 - Exerc - Processos de Transmissão de CalorДокумент4 страницы02 - Exerc - Processos de Transmissão de CalorManu MataОценок пока нет
- Módulo 5 - Estática Dos Fluidos - Lei de StevinДокумент7 страницMódulo 5 - Estática Dos Fluidos - Lei de StevinPatrick LudsonОценок пока нет
- Trabalho Investigação 2019 Refrigeração ISUTC 2019Документ19 страницTrabalho Investigação 2019 Refrigeração ISUTC 2019Rene SeveneОценок пока нет
- Aula - Medição de TemperaturaДокумент29 страницAula - Medição de TemperaturaHelioBernardoОценок пока нет
- Lista de Exercícios - EquilíbrioДокумент2 страницыLista de Exercícios - EquilíbrioRian TorresОценок пока нет
- Simulação de Mci - Avl-Boost - Conemb-2017 - Lrcancino - 02Документ175 страницSimulação de Mci - Avl-Boost - Conemb-2017 - Lrcancino - 02Filipe AlfredoОценок пока нет
- Calculo de Carga Termica CLTD Artigo Usp PDFДокумент10 страницCalculo de Carga Termica CLTD Artigo Usp PDFFelix Freitas OliveiraОценок пока нет
- Alves, 2012Документ87 страницAlves, 2012RafaelОценок пока нет
- Joaquim Manuel Da Silva Vidal - DissertaçãoДокумент180 страницJoaquim Manuel Da Silva Vidal - Dissertaçãojosecarvalho.c30Оценок пока нет
- LISTA 2 Mecflu PDFДокумент6 страницLISTA 2 Mecflu PDFGuilherme OliveiraОценок пока нет
- Ap1 RespostasДокумент2 страницыAp1 RespostasLilian FrancineОценок пока нет
- UNED SERRA Instrumentação Módulo VazãoДокумент49 страницUNED SERRA Instrumentação Módulo VazãoppatrickkkОценок пока нет
- FLUIDOS - Exercícios Fisica 2Документ20 страницFLUIDOS - Exercícios Fisica 2bms.pradoОценок пока нет
- Teoria Cinética Dos GasesДокумент39 страницTeoria Cinética Dos GasesDiego DuarteОценок пока нет
- Curso de DestilaçãoДокумент90 страницCurso de DestilaçãoHilario ZanardiОценок пока нет
- Relatório Fluidos Newtonianos e Não NewtonianosДокумент8 страницRelatório Fluidos Newtonianos e Não NewtonianosLarissa DinizОценок пока нет
- Exercícios Resolvidos Equação de Clapeyron e Transformações GasosasДокумент3 страницыExercícios Resolvidos Equação de Clapeyron e Transformações GasosasAlexandroR.AlmeidaОценок пока нет
- RP20377 DДокумент3 страницыRP20377 DEduardo AugustoОценок пока нет