Академический Документы
Профессиональный Документы
Культура Документы
Inform Labo10
Загружено:
Augusto RodríguezАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Inform Labo10
Загружено:
Augusto RodríguezАвторское право:
Доступные форматы
Informe de Laboratorio de Fisicoqumica II
1
INDICE
I. INTRODUCCION Pg. 2
II. RESUMEN Pg. 3
III. PRINCIPIOS TEORICOS Pg. 4
IV. DATOS EXPERIMENTALES. Pg. 5
V. CALCULOS. Pg. 8
VI. DISCUSION DE RESULTADOSPg. 16
VII. CONCLUSIONES Pg. 17
VIII. RECOMENDACIONESPg. 17
IX. BIBLIOGRAFIA..Pg. 18
X. APENDICE..Pg. 19
Informe de Laboratorio de Fisicoqumica II
2
I.INTRODUCCION
El concepto de sistema heterogneo implica el concepto de fase. Fase es toda porcin de un
sistema con la misma estructura o arreglo atmico, con aproximadamente la misma
composicin y propiedades en todo el material que la constituye y con una interface
definida con toda otra fase vecina. Puede tener uno varios componentes. Debe
diferenciarse del concepto de componente, que se refiere al tipo de material que puede
distinguirse de otro por su naturaleza de sustancia qumica diferente. Por ejemplo, una
solucin es un sistema homogneo (una sola fase) pero sin embargo est constituida por al
menos dos componentes. Por otro lado, una sustancia pura (un solo componente) puede
aparecer en dos de sus estados fsicos en determinadas condiciones y as identificarse dos
fases con diferente organizacin atmica y propiedades cada una y con una clara superficie
de separacin entre ellas (interface). Los equilibrios entre fases pueden corresponder a los
ms variados tipos de sistemas heterogneos: un lquido en equilibrio con su vapor, una
solucin saturada en equilibrio con el soluto en exceso, dos lquidos parcialmente solubles
el uno en el otro, dos slidos totalmente solubles en equilibrio con su fase fundida, dos
slidos parcialmente solubles en equilibrio con un compuesto formado entre ellos, etc. El
objetivo es describir completamente el sistema. El comportamiento de estos sistemas en
equilibrio se estudia por medio de grficos que se conocen como diagramas de fase: se
obtienen graficando en funcin de variables como presin, temperatura y composicin y el
sistema en equilibrio queda definido para cada punto (los grficos de cambio de estado
fsico de presin de vapor de una solucin de dos lquidos son ejemplos de diagramas de
fases). La mayora de los diagramas de fase han sido construidos segn condiciones de
equilibrio (condiciones de enfriamiento lento), siendo utilizadas por ingenieros y cientficos
para entender y predecir muchos aspectos del comportamiento de materiales. A partir de los
diagramas de fase se puede obtener informacin como:
1.- Conocer que fases estn presentes a diferentes composiciones y temperaturas bajo
condiciones de enfriamiento lento (equilibrio).
2.- Averiguar la solubilidad, en el estado slido y en el equilibrio, de un elemento ( o
compuesto) en otro.
3.- Conocer la temperatura a la cual comienzan a fundirse diferentes fases.
Los equilibrios de fase y sus respectivos diagramas de fase en sistemas multicomponentes
tienen aplicaciones importantes en qumica, geologa y ciencia de los materiales. La ciencia
de materiales estudia la estructura, propiedades y aplicaciones de los materiales cientficos
y tecnolgicos.
Informe de Laboratorio de Fisicoqumica II
3
II. Resumen
La presente practica titulada Gases que bajo las condiciones de presin: P=756 mmHg;
temperatura: T=23C Humedad relativa; H=95; tuvo como objetivo la determinacin experimental
de un diagrama de fases y la curva de enfriamiento de una mezcla binaria (cloroformo y
naftaleno) que son solubles en fase liquida pero no miscibles en estado slido.
Para la determinacin del diagrama de fases se har mediante la observacin del punto de
cristalizacin de una muestra que ha sido en primer lugar fusionada en un bao caliente y luego
trasladada a un bao de enfriamiento para su cristalizacin , estas muestras contienen diversas
composiciones de tal manera que la fraccin molar del componente de mayor temperatura de
fusin este de manera ascendente ( 0 1 ) , conocidas estas composiciones y sus temperaturas
de cristalizacin experimental ,se graficara el diagrama de fases binario temperatura cris. Vs
composicin molar. As como el punto eutctico de la mezcla que le corresponde en teora unos
32 C y experimentalmente 31.4C y una composicin molar de 0.64. Con lo que se obtuvo un
error relativo en la temperatura eutctica de 1.87 %.
De manera similar para la curva de enfriamiento se tomara una muestra pura de naftaleno
(muestra N8 ) y una mezcla cuya temperatura de cristalizacin este ms prxima a la terica en
este caso la muestra N 3 de T cristaliza. Experimental =43.1 C y composicin de 0.664, para
ambos casos se fusionara la muestra y luego trasladado a un bao de enfriamiento, debido a
que la muestra estar a varios de grados por encima de la fusin se deber esperar a que esta
este unos 3 a 4 grados por encima de la cristalizacin para comenzar a tomar del descenso de la
temperatura a intervalos de 10 segundos y observar el comportamiento de cada muestra ,,segn
las graficas demostraron que para la sustancia pura de naftaleno la temperatura se hizo
constante a la de su temperatura de cristalizacin ,mientras que la mezcla su temperatura se
hizo constante a la de la eutctica
En conclusin
Informe de Laboratorio de Fisicoqumica II
4
III .PRINCIPIOS TERICOS
La Regla de Fases de Gibbs establece que:
F = C-P + 2
En 1875 J. Willard Gibbs relacion tres variables: fases (P), componente, (C) y
grados de libertad varianza, (F) para sistemas multi-componentes en
equilibrio. Eel nmero de grados de libertad se determina por la ecuacin (1) si
y solo si el equilibrio entre las fases no est influenciado por gravedad, fuerzas
elctricas magnticas y solo se afecte por la temperatura, presin y
concentracin. El nmero dos en la ecuacin corresponde a las variables de
temperatura, T y presin, P.
Cada una de las variables en la ecuacin se define a continuacin:
a) Fase - (P)- es un parte uniforme de un sistema en trminos de composicin
qumica y propiedades fsicas. Est separada de otras partes homogneas del
sistema por medio de superficies lmites. Se representa por la letra "P" donde
se indica el nmero de fases diferentes en un sistema.
b) Componente -(C) - Se refiere al nmero de constituyentes qumicamente
diferentes que son necesarios para describir la composicin de cada fase. Su
concentracin puede variar en forma independiente. Es importante notar que si
los constituyentes no reaccionan entre s el nmero de sustancias en el sistema
ser igual al nmero de componentes. Sin embargo, si estos reaccionan entre s,
el nmero de componentes ser menor que el nmero de sustancias.
Nmero de grados de libertad o varianza - (F)- se refiere al nmero mnimo de
variables intensivas independientes (presin, temperatura, fraccin molar), que
debe especificarse para poder describir completamente el estado de un
sistema.
Informe de Laboratorio de Fisicoqumica II
5
IV.DATOS EXPERIMENTALES
Presin Atmosfrica 756 mmHg
Temperatura 23C
Humedad Relativa 95 %
TABLA N 1
Datos experimentales para realizar el diagrama de fases
Tubo Temp.Exp.(cristalizacin )
1 53,2 C
2 46,8 C
3 43,1 C
4 31,4 C
5 53,2 C
6 59,3 C
7 72,3 C
8 80,5 C
Informe de Laboratorio de Fisicoqumica II
6
TABLA N 2
Datos experimentales del enfriamiento del naftaleno (tubo N8)
t (s) T (C) t (s) T (C)
0 85 310 80,4
10 84,5 320 80,4
20 83,9 330 80,4
30 83,7 340 80,4
40 83,3 350 80,4
50 82,5 360 80,4
60 82,1 370 80,4
70 81,7 380 80,3
80 81,3 390 80,2
90 80,9 400 80,1
100 80,9 410 80,1
110 80,6 420 80,0
120 80,3 430 80,0
130 80,6 440 79,9
140 80,6 450 79,9
150 80,6 460 79,9
160 80,6 470 79,6
170 80,5 480 79,6
180 80,5 490 79,7
190 80,5 500 79,7
200 80,5 510 79,6
210 80,3 520 79,4
220 80,3 530 79,3
230 80,3 540 79,3
240 80,5 550 79,2
250 80,5 560 79,1
260 80,4 570 79,1
270 80,4 580 79,0
280 80,4 590 79,0
290 80,4 600 78,5
300 80,4 610 77,7
Informe de Laboratorio de Fisicoqumica II
7
TABLA N 2 (Datos experimentales para la curva de enfriamiento tubo3)
Los datos en la tabla de la derecha son los correspondientes al final de la total cristalizacin de la
muestra.
t (s) T (C) t (s) T (C) t (s) T (C)
0 44,5 320 42,7 640 41,0
10 44,4 330 42,6 650 40,9
20 44,4 340 42,5 660 40,9
30 44,3 350 42,5 670 40,9
40 44,3 360 42,4 680 40,7
50 44,2 370 42,4 690 40,6
60 44,1 380 42,3 700 40,6
70 44,1 390 42,2 710 40,6
80 44,0 400 42,1 720 40,5
90 43,9 410 42,0 730 40,3
100 43,8 420 41,9 740 40,3
110 43,7 430 42,0 750 40,2
120 43,7 440 41,9 760 40,1
130 43,5 450 41,9 770 40,0
140 43,5 460 41,8 780 39,9
150 43,4 470 41,8 790 39,9
160 43,3 480 41,8 800 39,8
170 43,3 490 41,7 810 39,7
180 43,2 500 41,7 820 39,6
190 43,2 510 41,6 830 39,6
200 43,1 520 41,6 840 39,6
210 43,1 530 41,5 850 39,5
220 43,0 540 41,5 860 39,4
230 43,0 550 41,4 870 39,4
240 43,0 560 41,4 880 39,3
250 43,0 570 41,3 890 39,2
260 43,0 580 41,2 900 39,1
270 43,0 590 41,2 910 39,1
280 43,0 600 41,1 920 39,0
290 42,9 610 41,1 930 39,0
300 42,8 620 41,1 940 38,9
310 42,8 630 41,1 950 38,8
T (C)
37,6
37,5
37,5
37,4
37,4
30,0
30,0
30,0
30,0
30,0
30,0
30,3
30,3
30,3
30,3
30,3
30,3
30,3
30,3
30,3
30,3
30,4
30,4
30,1
30,0
29,8
28,1
28,6
28,4
28,6
28,6
Informe de Laboratorio de Fisicoqumica II
8
V .CLCULOS
a)
TUBO
N
X
B
(p- C
6
H
4
Cl
2
) X
A
(C
10
H
8
)
1 1 0
2 0,8789 0,1211
3 0,8132 0,1868
4 0,6446 0,3554
5 0,4655 0,5345
6 0,3278 0,6722
7 0,1483 0,8517
8 0 1
b) Analizando el diagrama de datos en la
c)
d) El punto eutctico
e) Tenemos la ecuacin :
Para el naftaleno (C
10
H
8
):
Informe de Laboratorio de Fisicoqumica II
9
Log X
A
=
0,0332
Para el punto de cristalizacin del naftaleno (T = 80,5C):
Log X
A
=
0,0332
De aqu : X
A
=0,916452
Para T=59,3 C = 332,45 K
Log X
A
=
0,0332
X
A
= 0,611
Para T=72,3 C = 345,45 K
Log X
A
=
0,0332
X
A
= 0,788
Para T=47,5 C = 320,65 K
Log X
A
=
0,0332
X
A
= 0,48
Para T=31,4 C
Log X
A
=
0,0332
Informe de Laboratorio de Fisicoqumica II
10
X
A
= 0,332
Para T= 28,6 C =301,75 K
Log X
A
=
0,0332
X
A
= 0,312
f) De la misma manera para el p- diclorobenceno
Log X
B
= -0,03302
A una temperatura de cristalizacin de T = 53,2C = 326,35 K
Reemplazando
Log X
B
= -0,03302
X
B
= 1,00
Para T=46,8 C = 320 K
Log X
B
= -0,03302
X
B
= 0,8754
Para T= 43,1 C = 316,25 K
Log X
B
= -0,03302
X
B
= 0,8066
Para T= 37,5 C = 310,65 K
Informe de Laboratorio de Fisicoqumica II
11
Log X
B
= -0,03302
X
B
= 0,711
Para T =31,4 C = 304,55 K
Log X
B
= -0,03302
X
B
= 0,62
g) Calculando el calor latente de fusin de los componentes puros :
Experimentalmente:
p- C
6
H
4
Cl
2
: H = -10250 + 94,07 T 0,1511 T
2
cal/mol
Para una T
fusion
= 53,2 C = 326,35 K
H
fusion
= 4356,94 cal/mol
C
10
H
8
: H = 4265 -26,31 T 0,1525 T
2
-0,000214 T
3
cal/mol
Para una T fusion = 80,5C = 353,65 K
H
fusion
= - 33577,76 cal/mol
Calculando para los valores tericos:
Para el p-diclorobenceno segn teora :
Informe de Laboratorio de Fisicoqumica II
12
T
fusion
= 54 C = 327,15 K
H
fusion
= -10250 + 94,07x 327,15 0,1511 x327,15
2
cal/mol
H
fusion
= 4353,92 cal/mol
Para el naftaleno: T fusion = 80C = 353,15 K
H
fusion
= 4265 -26,31x353,15 0,1525x353,15
2
-0,000214 x353,15
3
cal/mol
H
fusion
= -33470,62 cal/mol
h) Segn la formula :
Al considerar la presin constante , tenemos la ecuacin
F P = C 1
En el punto eutctico, se tienen 2 componentes el naftaleno y p-diclorobenceno, los
cuales estn en una sola fase, slida, por tanto:
F 2 = 2 1
F = 1
F P = C 2
F 2 = 2 2
F = 2
i) Hallando el porcentaje de error
Para las fracciones molares de p- C
6
H
4
Cl
2
Informe de Laboratorio de Fisicoqumica II
13
Tubo 8 :
Error = |
()
()
()
| =|
| =9,12
Tubo 7:
Error = |
()
()
()
| =|
| =9,2
Tubo 6:
Error = |
()
()
()
| =|
| =10,0
Tubo 5:
Error = |
()
()
()
| =|
| =11,9
Para las fracciones molares del naftaleno:
Tubo 1:
Error = |
()
()
()
| =|
| =0,0
Tubo 2:
Error = |
()
()
()
| =|
| =0,
Tubo 3:
Informe de Laboratorio de Fisicoqumica II
14
Error = |
()
()
()
| =|
| =0,82
Tubo 4:
Error = |
()
()
()
| =|
| =3,97
Comparando las composiciones tericas y experimentales
Tubo
X
A
(Teorico ) X
A
(experimental)
Error
8 0,916452 1 9,12
7 0,788 0,8517 8,08
6 0,611 0,6722 10,0
5 0,48 0,5345 11,4
Tubo
X
B
(Teorico ) X
B
(experimental)
Error
1 1,00 1,00 0,00
2 0,8754 0,8789 0,40
3 0,8066 0,8132 0,82
4 0,62 0,6446 3,97
Comparando las entalpias de fusin terica y experimental para:
Informe de Laboratorio de Fisicoqumica II
15
P-diclorobenceno:
Error = |
|x 100 = 0,07
naftaleno
Error = |
()
| x100 = 0,32
Valor terico
(cal/mol)
Valor
experimental
(cal/mol)
Error
H
fusin
(p-
diclorobenceno)
4353,92 4356,94
0,07
H
fusin
(naftaleno)
-33470,6 - 33577,76
0,3
Informe de Laboratorio de Fisicoqumica II
16
VI. Discusin de resultados
Del diagrama de fases se obtuvieron valores muy aproximados a los de los tericos
esto no dice que la composiciones de las muestras estn en proporciones adecuadas
, los errores relativos no exceden el %
De las graficas de curvas de enfriamiento se obtuvo de la muestra pura de naftaleno
un descenso de la temperatura hasta que permaneci constante cerca de los 80.4 C
lo que indica que en este punto empez la cristalizacin del naftaleno , esta
temperatura permaneci constante entre los 4 y 5 min hasta que cristalizo en su
totalidad
En el caso de la mezcla este tomo mucho ms tiempo debido a que el bao de
enfriamiento no fue lo suficientemente frio sin embargo se pudieron apreciar los
cambios fsicos que ocurrieron en la solucin, interpretados por los cambios de
pendiente de la grafica.
En (d) la solucin se mantuvo en
estado lquido mientras descenda la
temperatura hasta que empieza
a cristalizar el naftaleno.
En (e) a medida que A va
cristalizando va cediendo su calor
latente de forma que la velocidad
de enfriamiento en (e) es menor
que en (d) , a su vez la composicin
de la fase liquida A y B va siendo
alterada hasta que se alcanza la
composicin eutctica
En (f) se ha llegado a la composicin eutctica donde la cristalizacin de A y B se da a
razn constante manteniendo la temperatura constante hasta que la cristalizacin se
haya concluido.
En la parte final (g) hay descenso de la temperatura de la fase solida donde ambos
componente estn separados.
Informe de Laboratorio de Fisicoqumica II
17
VII.Conclusiones
El tiempo donde se la temperatura se hace constante en una curva de enfriamiento para
una mezcla, ser ms prolongada en cuanto la composicin de la mezcla este ms
prxima a la composicin eutctica.
La curva de enfriamiento de una mezcla binaria cambia de pendiente debido al que el
slido de T fusin ms elevada empieza a cristalizar y esta al ser un proceso exotrmico
cede el calor a la solucin haciendo que esta se enfre ms lento.
Respecto al diagrama de faces de un sistema binario, en la grafica estas convergen en un
punto en donde se ubica la temperatura mnima a la cual se pueden fusionar las
sustancias a una determinada composicin.
VIII. Recomendaciones
Lavar bien el agitador metlico, ya que al rotar las muestras parte de estas se quedan
impregnadas en el agitador, y podran causar contaminacin de muestras al rotarlas.
Agitar constantemente el bao para que esta reduzca su temperatura a as la muestra no
demore en enfriar.
Para el procedimiento de la curva de enfriamiento , tomar la muestra cuyo punto te
cristalizacin este ms prximo al terico.
Informe de Laboratorio de Fisicoqumica II
18
IX. Bibliografa
http://es.wikipedia.org/wiki/Diagrama_de_fase
La regla de las fases/ F.D.FERGUSON,T.K.Jones pg. 59-60-61
Fisicoqumica Gilbert w .castellan segunda edicin -equilibrio de fases en
sistemas simples pag-284
Informe de Laboratorio de Fisicoqumica II
19
XI. Apndice
Qu es un diagrama de fases? Cul es su importancia?
Se denomina diagrama de fase a la representacin grfica de las fronteras entre diferentes
estados de la materia de un sistema, en funcin de variables elegidas para facilitar el estudio del
mismo
Diagrama de fase de una sustancia pura; Los diagramas de fase ms sencillos son los de presin -
temperatura de una sustancia pura
Diagrama de fase binario, Cuando aparecen varias sustancias, la representacin de los cambios de
fase puede ser ms compleja. Un caso particular, el ms sencillo, corresponde a los diagramas de
fase binarios. Ahora las variables a tener en cuenta son la temperatura y la concentracin,
normalmente en masa.
Qu entiende usted por un sistema eutctico simple?
Un sistema eutctico simple es aquel en donde los componentes son completamente
miscibles en la fase liquida, pero en las fases solidas estn integradas por componentes
puros. El rea designada por liquido corresponde a una sola fase liquida a presin
constante.
El tramo AC representa las temperaturas a las que diferentes mezclas liquidas se
encuentran en equilibrio entre las mezclas liquidas y B solido y puro.
Las dos curvas AC y BC concurren en el punto C, temperatura eutctica, a la cual se
encuentran en equilibrio solido A puro, solido B puro y lquido. La mezcla de esta
composicin se denomina mezcla eutctica
Dado que en C se presentan tres fases coexistentes, se trata de un punto invariable y, si se
separa el liquido, la temperatura permanecer constante hasta que haya cristalizado
completamente; solo se formara dos fases solidas, y una vez ocurrido esto podr disminuir
la temperatura.
Informe de Laboratorio de Fisicoqumica II
20
En un diagrama de punto eutctico simple, explique la aplicacin de la regla de la
palanca
La regla de la palanca nos da a conocer la relacin del numero de moles de solucin de
composicin b con el numero de moles del solido A es igual a la relacin, entre los segmentos de
la lnea ac y ab .
A menor temperatura, mayor es la cantidad relativa del slido para una composicin global
Un punto con a representa la solucin de composicin b en equilibrio con el slido de
composicin c, esto es A puro.
Вам также может понравиться
- Sintesis JijiДокумент4 страницыSintesis JijiAugusto RodríguezОценок пока нет
- Rep N°1 HUMEDAD GRUPO TRITURADO PRODUCCION 02-01-18Документ1 страницаRep N°1 HUMEDAD GRUPO TRITURADO PRODUCCION 02-01-18Augusto RodríguezОценок пока нет
- Geopolitica EnergeticaДокумент13 страницGeopolitica EnergeticaNilton Jesus CuriОценок пока нет
- Historia IquiДокумент3 страницыHistoria IquiAugusto RodríguezОценок пока нет
- Sintesis JijiДокумент4 страницыSintesis JijiAugusto RodríguezОценок пока нет
- Sustenta AiДокумент22 страницыSustenta AiAugusto RodríguezОценок пока нет
- Charla BPMДокумент97 страницCharla BPMAugusto RodríguezОценок пока нет
- Esque Made Loxi Doe Tile NoДокумент61 страницаEsque Made Loxi Doe Tile NoAugusto RodríguezОценок пока нет
- Conceptos BásicosДокумент36 страницConceptos BásicosAugusto RodríguezОценок пока нет
- Manual de Capacitacion Sobre Higiene de Alimentos y HACCP - 3aДокумент52 страницыManual de Capacitacion Sobre Higiene de Alimentos y HACCP - 3aAgustín BiritosОценок пока нет
- 2017 - Eep - Clase #09 - Parte IДокумент107 страниц2017 - Eep - Clase #09 - Parte IAugusto RodríguezОценок пока нет
- Id 61c Recubrimientos MetalicosДокумент2 страницыId 61c Recubrimientos MetalicosAugusto RodríguezОценок пока нет
- Plancha Fenomenos 1er ParcialДокумент4 страницыPlancha Fenomenos 1er ParcialEdison EspinozaОценок пока нет
- Contaminación Del AguaДокумент43 страницыContaminación Del AguaManuel Augusto Alvarado HuancaОценок пока нет
- Energía Eólica - El CulandroДокумент25 страницEnergía Eólica - El CulandroAugusto RodríguezОценок пока нет
- Planxa 3er Parcial FenomenosДокумент5 страницPlanxa 3er Parcial FenomenosAugusto RodríguezОценок пока нет
- Curso Q Analitica 2014 Cont 1Документ20 страницCurso Q Analitica 2014 Cont 1Augusto RodríguezОценок пока нет
- Planxa 3er Parcial FenomenosДокумент5 страницPlanxa 3er Parcial FenomenosAugusto RodríguezОценок пока нет
- Problemas de FenomenosДокумент5 страницProblemas de FenomenosSandra Lucen NoleОценок пока нет
- Sedimentacion FiltracionДокумент72 страницыSedimentacion FiltracionAugusto RodríguezОценок пока нет
- Curso Q Analitica 2014 Cont 1Документ20 страницCurso Q Analitica 2014 Cont 1Augusto RodríguezОценок пока нет
- Espesadores de Minerales Aug InfoДокумент8 страницEspesadores de Minerales Aug InfoAugusto RodríguezОценок пока нет
- Problemas de FenomenosДокумент5 страницProblemas de FenomenosSandra Lucen NoleОценок пока нет
- Planta PilotoДокумент3 страницыPlanta PilotoAugusto RodríguezОценок пока нет
- Dimensionamiento de Molinos de BolasДокумент11 страницDimensionamiento de Molinos de BolasRufino Ampuero Araya100% (15)
- Granulometria PDFДокумент15 страницGranulometria PDFHernando GuerreroОценок пока нет
- Tamizado IndustrialДокумент21 страницаTamizado IndustrialAndresBenjaminMoranJorquera0% (1)
- Ley de Bond (Augusto)Документ6 страницLey de Bond (Augusto)Augusto RodríguezОценок пока нет
- Tamizado IndustrialДокумент21 страницаTamizado IndustrialAndresBenjaminMoranJorquera0% (1)
- Resistencia de Gravas PDFДокумент49 страницResistencia de Gravas PDFNayeli Nadia Flores RaymundoОценок пока нет
- Práctica 8. Fermentación de La Glucosa Por La Levadura de Panificación (Saccharomyces Cerevisiae)Документ8 страницPráctica 8. Fermentación de La Glucosa Por La Levadura de Panificación (Saccharomyces Cerevisiae)Flor IzquierdoОценок пока нет
- Principios de Pavimentacion - 1 de 3Документ65 страницPrincipios de Pavimentacion - 1 de 3Mauricio Tórrez AriasОценок пока нет
- Simbología Neumática e HidráulicaДокумент27 страницSimbología Neumática e HidráulicaFernando Chavarría MarínОценок пока нет
- NEREACLEP2Документ2 страницыNEREACLEP2Ariel FragaОценок пока нет
- Normas Mexicanas TextilesДокумент23 страницыNormas Mexicanas Textilestania50% (2)
- Petróleo Vs ElectricidadДокумент10 страницPetróleo Vs ElectricidadAdrian GustavoОценок пока нет
- B. Subtilis y Antrax TetanoДокумент40 страницB. Subtilis y Antrax TetanoAngeLa Pari100% (3)
- PRACTICA-N-1-CORROSIONДокумент17 страницPRACTICA-N-1-CORROSIONJuvenal TlvОценок пока нет
- Practica 2 Equipo 4 Flores Perez y Jimenez RodriguezДокумент4 страницыPractica 2 Equipo 4 Flores Perez y Jimenez RodriguezGarcia Ortiz Juan PabloОценок пока нет
- Clases de VentiladoresДокумент11 страницClases de VentiladoresDiego J Guerrero NuñezОценок пока нет
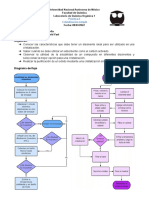
- Diagrama de Flujo 7Документ1 страницаDiagrama de Flujo 7JUAN MANUEL VALENCIA CARVAJALОценок пока нет
- Sangra-2010 1 ResidencialДокумент34 страницыSangra-2010 1 ResidencialCarlos PintoОценок пока нет
- Diferencias Célula Procariota y EucariotaДокумент2 страницыDiferencias Célula Procariota y EucariotaBereMoreno80% (5)
- Infrome Tecnico Tecnologia de Metales I - DoxДокумент7 страницInfrome Tecnico Tecnologia de Metales I - DoxPrevencionista qyhОценок пока нет
- Guia Actividades Fotosintesis DesarrolladaДокумент5 страницGuia Actividades Fotosintesis Desarrolladadmo prat67% (3)
- ExtrusionДокумент9 страницExtrusionMari DaryОценок пока нет
- Mod 3 FF y VíasДокумент27 страницMod 3 FF y VíasLuis BonattiОценок пока нет
- Proceso de Producción ShougangДокумент9 страницProceso de Producción ShougangAstrid MunguiaОценок пока нет
- MamposteríaДокумент47 страницMamposteríaAnonymous rnO4WIbJ100% (1)
- Relleno FluidoДокумент6 страницRelleno FluidoGerardo Iñiguez BayardoОценок пока нет
- Informe Laboratorio 1Документ34 страницыInforme Laboratorio 1JoseJavierToroCaballeroОценок пока нет
- El Cofre VoladorДокумент3 страницыEl Cofre VoladorEdgar CaОценок пока нет
- Propiedades Fisicas de La Madera PDFДокумент29 страницPropiedades Fisicas de La Madera PDFluis romeroОценок пока нет
- Mendez HF PDFДокумент162 страницыMendez HF PDFjoseОценок пока нет
- Composición Química y Mineralización de La DentinaДокумент7 страницComposición Química y Mineralización de La DentinaSantiagoОценок пока нет
- Problemas de Cinética Metalúrgica - 2Документ2 страницыProblemas de Cinética Metalúrgica - 2deus07Оценок пока нет
- CVMДокумент49 страницCVMOscar GuarnerosОценок пока нет
- Proceso de La Exportacion Del CarbonДокумент6 страницProceso de La Exportacion Del CarbonsuryОценок пока нет
- Mermelada de Cúrcuma Con PiñaДокумент40 страницMermelada de Cúrcuma Con Piñaleo floro0% (1)