Академический Документы
Профессиональный Документы
Культура Документы
En Zimas
Загружено:
Antonio AguilarАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
En Zimas
Загружено:
Antonio AguilarАвторское право:
Доступные форматы
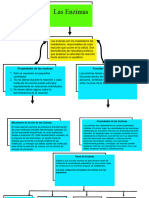
ENZIMAS
Las enzimas son grandes molculas de protena formada por una o varias
cadenas polipeptdicas. Estas molculas presentan las siguientes
caractersticas:
Su conformacin tridimensional da lugar a numerosas
invaginaciones en su superficie, entre las cules se localiza el sitio
activo
El sitio activo es una zona de la molcula formada por 10
aminocidos especializados en la unin con los compuestos sore los
cules act!an las enzimas. Estos compuestos se llaman sustratos
Las enzimas modifican el sustrato " dan lugar a una nueva sustancia
denominada producto.
Los aminocidos #ue no forman parte del sitio activo mantienen la
estructura tridimensional de la molcula o se unen a las memranas
celulares para el ancla$e de las enzimas en los lugares #ue son
necesarios.
%lgunas enzimas re#uieren de un componente adicional en el sitio
activo para poder realizar su actividad catalizadora. Este compuesto se
denomina cofactor " puede ser de dos tipos:
&n metlico como 'e
()
, *n
()
, +n
()
, ,
()
, -i
()
, etc
.or e$emplo, la fosfo/e0osa isomerasa tiene como cofactor el *g
()
1n comple$o o molcula orgnica llamado coenzima, como el
caso de la nicotinamida adenina dinucletido2-%34, la flavina
adenina dinucletido2'%34, la coenzima %25o%4, etc.
Haloenzima = Apoenzima + Cofactor
.arte proteica parte no proteica
Las coenzimas act!an como transportadores transitorios de grupos
funcionales especficos
.or e$emplo la malato des/idrogenasa #ue cataliza la transformacin del
malato en o0aloacetato, se une a la coenzima -%3, la cual transporta 6
(
permitiendo la o0idacin del malato.
Las enzimas se clasifican seg!n la reaccin #ue catalizan.
37glucosa ( %8. 37glucosa797fosfato ( %3.
1
En esta reaccin interviene la glucosa transferasa #ue cataliza la
transferencia de un grupo fosfato desde la molcula de %8. a la 37glucosa.
%lgunas enzimas como la pepsina " la tripsina no tienen nomres #ue se
refieran al sustrato
MECANISMO DE REACCION COMO ACTAN !AS ENZIMAS
Los catalizadores aumentan la velocidad de reacci, pero no modifican el
e#uilirio. Se estalece de transicin donde /a" rotura " formacin de
enlaces.
%un#ue una reaccin sea e0ergnica si su energa de activacin es mu"
elevada la reaccin no se produce o es mu" lenta.
.or e$emplo si colocamos glucosa ( o0geno en un recipiente, pueden
mezclarse en forma indefinida sin reaccionar.
En las clulas, la glucosa es degradada en presencia de o0geno, a
an/drido carnico " agua en una ruta de reacciones catalizada por
enzimas.
Estas enzimas no slo aceleran las reacciones, sino #ue las organizan "
controlan de tal manera gran parte energas lieradas en este proceso se
recupera en otras formas ase#uiles a la clula para #ue realice sus
funciones.
E ( S E7S E ( .
E ( S .
[ ]
[ ] S
P
Keq =
: ; <=S> :elocidad de reaccin de primer orden
< ; cte de velocidad de la reaccin #ue refle$a la proailidad de reaccin
Keq RT F ln ?@ =
'?@; camio de energa lire estndar
E"emplo: si < ; 0 0,0A s
71
, se interpreta como #ue un AB del sustrato
ase#uile ser convertido en producto2.4 en 1 segundo. Si < ; )000 s
71
, el
sustrato2S4 se convierte en producto2.4 en una fraccin de segundo.
)
Relaci#n $e % con la ener&'a $e acti(aci#n Ea
RT
Ea
e
h
KT
k
= Ecuacin de %rr/enius
, ; constante de Coltzman
/ ; cte de .lanc<
RT
Ea
Ae k
=
La interaccin entre E " S en el comple$o E7S, est dada por las mismas
fuerzas #ue estailizan la estructura proteica. La unin de la enzima con el
sustrato para formar el comple$o enzima7 sustrato2E7S4, est acompaDada
de una pe#ueDa lieracin de energa lire #ue proporciona un cierto grado
de estailidad a la interaccin.
La energa proveniente de la interaccin ES, se denomina energa de
fi"aci#n " conlleva a una disminucin de la energa de activacin de la
reaccin enzimtica.
Las interacciones diles formadas en el estado de transicin son las #ue
ms contriu"en a la catlisis.
Cin)tica enzim*tica E+ta$o E+tacionario
<
1
<
)
E ( S E7S E ( .
<
E1
1 )
:elocidad de formacin de pro$,cto-./0
:o ; <
)
=ES>
=Et> ; 5oncentracin total de enzima
=Et> E =ES> ; enzima no fi$ada o lire
:elocidad de formacin de E7S ; <
1
F=Et> E =ES>G=S>
:elocidad de descomposicin de E7S ; <
71
=ES> ( <
)
=ES>
A
Se considera e+ta$o e+tacionario, por lo #ue la concentracin del comple$o
E7S permanece constante:
:elocidad de formacin ; velocidad de descomposicin
<
1
F=Et> E =ES>G=S> ; <
71
=ES> ( <
)
=ES>
Heordenando:
[ ][ ] [ ]
[ ] ES
ES S E
k
k k
Km
t
=
+
=
1
) 1
despe$ando ES:
[ ]
[ ][ ]
[ ] S K
S E
ES
t
+
=
Heemplazando en :o ; <
)
=ES> " considerando #ue cuando la enzima est
saturada se tiene:
=ES> ; =Et> 2punto de saturacin4
:o ;
[ ]
[ ][ ]
[ ] S Km
S E
k ES k
t
+
=
) )
:ma0 ; <
)
=Et>
[ ]
S K
S V
V
m
=
ma0
0
+
=
ECACION DE MICHAE!IS
I
Вам также может понравиться
- Practi de PPT 4Документ1 страницаPracti de PPT 4Antonio AguilarОценок пока нет
- Informe de Ventas Básico0Документ6 страницInforme de Ventas Básico0Antonio AguilarОценок пока нет
- Lista de Contactos1Документ6 страницLista de Contactos1Antonio AguilarОценок пока нет
- EjemploДокумент1 страницаEjemploAntonio AguilarОценок пока нет
- Conciliación Bancaria Mensual1Документ1 страницаConciliación Bancaria Mensual1Norman Tefy M CОценок пока нет
- Gastos 1Документ3 страницыGastos 1Antonio AguilarОценок пока нет
- PracticaДокумент8 страницPracticaAntonio AguilarОценок пока нет
- TurismoДокумент1 страницаTurismoAntonio AguilarОценок пока нет
- PRESENTACION p1Документ1 страницаPRESENTACION p1Antonio AguilarОценок пока нет
- Árbol Genealógico 111Документ4 страницыÁrbol Genealógico 111Antonio AguilarОценок пока нет
- Den Do GramaДокумент8 страницDen Do GramaAntonio AguilarОценок пока нет
- Calculadora EstadisticoДокумент13 страницCalculadora EstadisticoRoberto RodriguezОценок пока нет
- Presentación 1Документ1 страницаPresentación 1Antonio AguilarОценок пока нет
- Sencillos Estados de Flujo de Efectivo Personal1Документ6 страницSencillos Estados de Flujo de Efectivo Personal1Santiago AponteОценок пока нет
- Árbol Genealógico11Документ4 страницыÁrbol Genealógico11Antonio AguilarОценок пока нет
- Plantilla Informe de Rendimiento1Документ2 страницыPlantilla Informe de Rendimiento1Cesar Augusto Castellar OrtegaОценок пока нет
- Banana 1Документ8 страницBanana 1Antonio AguilarОценок пока нет
- Calculadora Personal de Patrimonio Neto1Документ1 страницаCalculadora Personal de Patrimonio Neto1David Ezequiel BethancourtОценок пока нет
- Jugo JarabeДокумент2 страницыJugo JarabeAntonio AguilarОценок пока нет
- IndiceДокумент3 страницыIndiceAntonio AguilarОценок пока нет
- DatosДокумент7 страницDatosAntonio AguilarОценок пока нет
- Calculadora EstadisticoДокумент13 страницCalculadora EstadisticoRoberto RodriguezОценок пока нет
- Nuevo DiseñoДокумент2 страницыNuevo DiseñoAntonio AguilarОценок пока нет
- DISEÑOДокумент2 страницыDISEÑOAntonio AguilarОценок пока нет
- Formulacion Base para La Elaboracion de Biscocho Tipo ChancayДокумент1 страницаFormulacion Base para La Elaboracion de Biscocho Tipo ChancayAntonio AguilarОценок пока нет
- ANEXOДокумент2 страницыANEXOAntonio AguilarОценок пока нет
- Tukey GalletaДокумент4 страницыTukey GalletaAntonio AguilarОценок пока нет
- Analisis Sensorial GalletaДокумент8 страницAnalisis Sensorial GalletaAntonio AguilarОценок пока нет
- Analisis Sensorial GalletaДокумент8 страницAnalisis Sensorial GalletaAntonio AguilarОценок пока нет
- REGRESION CálculosДокумент21 страницаREGRESION CálculosAntonio AguilarОценок пока нет
- Examen Cinc3a9tica b1Документ3 страницыExamen Cinc3a9tica b1Sebastian StrendekОценок пока нет
- Profármacos TorresДокумент22 страницыProfármacos TorresgutierrezptitoОценок пока нет
- TeoriaДокумент21 страницаTeoriaJuan Saavedra GuillenОценок пока нет
- Efecto de La Concentracion y PH en La Velocidad de Una Reacción EnzimaticaДокумент3 страницыEfecto de La Concentracion y PH en La Velocidad de Una Reacción EnzimaticaPosak HernandezОценок пока нет
- Articulo Producción de Pectinasas Por Aspergillus Niger A Partir de Cáscaras de Naranja y de Toronja Como Fuente de CarbonoДокумент7 страницArticulo Producción de Pectinasas Por Aspergillus Niger A Partir de Cáscaras de Naranja y de Toronja Como Fuente de CarbonoLuis Salgado0% (1)
- Infografia 2Документ1 страницаInfografia 2Medina Zeballos Jessica AlejandraОценок пока нет
- Tarea Sumativa EnzimasДокумент5 страницTarea Sumativa EnzimasAngel ManriqueОценок пока нет
- Video 1-7Документ5 страницVideo 1-7Sarai EstradaОценок пока нет
- Intermediarios Del Ciclo de Krebs en Sepsis: Unarevisión SistemáticaДокумент9 страницIntermediarios Del Ciclo de Krebs en Sepsis: Unarevisión SistemáticapiaxtlaОценок пока нет
- Resumen 1.2 de Metil-S-Coenzima-M ReductasaДокумент4 страницыResumen 1.2 de Metil-S-Coenzima-M Reductasazotz21Оценок пока нет
- Mapa Conceptual EnzimasДокумент4 страницыMapa Conceptual EnzimasLiz CastellanosОценок пока нет
- Biomoléculas OrgánicasДокумент8 страницBiomoléculas OrgánicasLindaОценок пока нет
- Bioquimica de CordicepinaДокумент1 страницаBioquimica de CordicepinaJohnyAlexRsОценок пока нет
- MFH Iii PDFДокумент115 страницMFH Iii PDFJennifer RomeroОценок пока нет
- FrutasДокумент20 страницFrutasmarioncadenaОценок пока нет
- Química y seres vivosДокумент46 страницQuímica y seres vivosGaby Pérez OrellanaОценок пока нет
- Producción de aromas y sabores mediante biotecnologíaДокумент21 страницаProducción de aromas y sabores mediante biotecnologíaFatima Velasco HuallancaОценок пока нет
- Seminario Interacciones MedicamentosasДокумент9 страницSeminario Interacciones MedicamentosasJennifferValeraОценок пока нет
- V La Industria Textil y Su Control de Ca PDFДокумент165 страницV La Industria Textil y Su Control de Ca PDFJose De Jesus CastañedaОценок пока нет
- Práctica de La Amilasa SalivalДокумент2 страницыPráctica de La Amilasa SalivalBeatriz Martínez RuizОценок пока нет
- Clasificación de Los Herbicidas y Calibración de Mochila para FumigacionДокумент27 страницClasificación de Los Herbicidas y Calibración de Mochila para Fumigaciona efrainОценок пока нет
- Material de Apoyo. Identificación de Las EnzimasДокумент17 страницMaterial de Apoyo. Identificación de Las EnzimasAnonimus BejaranoОценок пока нет
- Informe N°9Документ11 страницInforme N°9Sol J CLОценок пока нет
- PL 9 Sem 10 Demostracion de La Naturaleza Proteica de La Enzima Catalasa en VegetalesДокумент2 страницыPL 9 Sem 10 Demostracion de La Naturaleza Proteica de La Enzima Catalasa en Vegetalesantony angeles yauceОценок пока нет
- B-Clase Armas QuimicasДокумент11 страницB-Clase Armas QuimicasAbel AlonsoОценок пока нет
- Reacciones de Pardeamiento en Los Alimentos y Sus Aplicaciones AgroindustrialesДокумент22 страницыReacciones de Pardeamiento en Los Alimentos y Sus Aplicaciones AgroindustrialesJulianAndresSanchezRodriguezОценок пока нет
- Producción de bioplásticos a partir de almidón de papaДокумент108 страницProducción de bioplásticos a partir de almidón de papaMari RodriguezОценок пока нет
- Problemas Enzimas 2Документ3 страницыProblemas Enzimas 2Kamila KbelloОценок пока нет
- Informe 3 Amilasa SalivalДокумент9 страницInforme 3 Amilasa SalivalAlejandra León Cardozo0% (1)
- Análisis químicos avanzados de alimentos: métodos para determinar pH, azúcares, salinidad, actividad de agua y caracterización de lípidosДокумент21 страницаAnálisis químicos avanzados de alimentos: métodos para determinar pH, azúcares, salinidad, actividad de agua y caracterización de lípidosLissethОценок пока нет