Академический Документы
Профессиональный Документы
Культура Документы
Agujero Macular
Загружено:
conriveradАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Agujero Macular
Загружено:
conriveradАвторское право:
Доступные форматы
I N F O R M A C I N
I N F O R M A C I N
I N F O R M A C I N
I N F O R M A C I N
I N F O R M A C I N
III. Agujeros maculares
idiopticos, asociados
a la edad
(A. Gaudric, M. Paques, P. Blain)
III.1 Historia
III.2 Epidemiologa
III.3 Semiologa
III.4 Clasificacin de los
agujeros maculares
III.5 Hiptesis patognicas
III.6 Diagnstico diferencial
III.7 Evolucin y pronstico
III.8 Tratamiento quirrgico de los agujeros y amenaza de agujeros
Bibliografa
A los viejos les gusta dar buenos preceptos para
consolarse de que ya no pueden dar malos ejemplos.
(Vauvenargues)
Motor de Innovacin
Jos Sahel y Alain Gaudric
en colaboracin con
Alain Deudon-Combe,
Pascale Massin,
Michel Paques,
Ali Erginay y
Pierre Blain
EL ENVEJECIMIENTO DEL VTREO
Y DE LA UNIN VITREORRETINIANA
2. Parte
28
EL ENVEJECIMIENTO DEL VTREO
Y DE LA UNIN VITREORRETINIANA
3
III. Agujeros maculares idiopticos,
asociados a la edad
Alain Gaudric, Michel Paques, Pierre Blain
Los agujeros maculares idiopticos de espesor total son dehiscencias retinianas redondas, foveola-
res o ligeramente excntricas, que aparecen en ojos con longitud axial normal, sin antecedente de
contusin o patolgico. El agujero macular provoca un dficit variable de la visin central. En ms
del 10% de los casos estn afectados los dos ojos.
Es una afeccin asociada al envejecimiento, que afecta habitualmente a personas de ms de 60 aos
y con ms frecuencia a mujeres. El tratamiento quirrgico, instaurado en 1989 por Kelly y Wen-
del,
148
permite actualmente cerrar los agujeros maculares en ms del 80% de los casos.
III.1 HISTORIA
El primer caso de agujero macular fue descrito por Knapp en 1869.
149
Se trataba de un agujero se-
cundario a una contusin. Ogilvie fue el primero en emplear el trmino de agujero macular (hole
in the macula). En 1904, Kuhnt
150
sugiri que el agujero macular era debido a una atrofia del teji-
do retiniano foveolar. Posteriormente, se consider que la degeneracin qustica era el primum mo-
vens del agujero, que aparecera por rotura de las celdillas centromaculares.
151
Se vincul a una
contusin,
152,153
a la arteriosclerosis,
154
a una insuficiencia vascular.
155-157
Lister
158
parece haber sido el
primero que, en 1924, consider el papel del vtreo en la aparicin de los agujeros maculares, al des-
cribir bandas vtreas fibrosas que ejercen una traccin sobre la mcula. Esta hiptesis fue poco ex-
plotada durante mucho tiempo. Finalmente, Gass,
159
en 1988, formul la hiptesis de una traccin,
no anteroposterior sino tangencial, del crtex vtreo sobre la foveola.
III.2 EPIDEMIOLOGA
III.2.1 Prevalencia
Pocos estudios aportan datos de prevalencia del agujero macular idioptico en la poblacin general;
Yaoeda
160
encontr 66 casos de agujeros maculares en una poblacin de 88.539 pacientes examinados en la
consulta (0,07%); ms recientemente, un estudio de poblacin en busca de degeneracin macular asocia-
da a la edad (Beaver Dam Study), basado en el anlisis de fotografas de la retina, indic que la prevalencia
de agujero macular idioptico senil era del 0,33% en la poblacin de individuos de ms de 55 aos.
161,162
La edad de aparicin del agujero macular idioptico se sita habitualmente en la sptima dcada de
la vida con una edad media alrededor de los 64 aos y existe un claro predominio femenino del or-
den de 2 a 1.
163,171,172
No existe diferencia significativa entre la afectacin de uno u otro ojo.
Extrado de: LE VIEILLISSEMENT DE LOEIL ET SES ANNEXES
Salomon Yves COHEN, coordonnateur, Michel Samson et Jean-Paul ADENIS, Michael ASSOULINE, Gilles CHAINE, Christian CORB, Alain GAUDRIC,
Livia LUMBROSO, Serge MORAX, Gabriel QUENTEL, Jos SAHEL, Eric SELLEM, Ramin TADAYONI, Catherine VIGNAL-CLERMONT, Xavier ZANLONGHI
BULLETIN DES SOCIETES DOPHTALMOLOGIE DE FRANCE. RAPPORT ANNUEL - NUMERO SPECIAL - NOVEMBRE 1999
E L E N V E J E C I MI E N T O D E L V T R E O Y D E L A U N I N V I T R E O R R E T I N I A N A . 2 . P a r t e
III.2.2 Factores de riesgo
Se han planteado factores hormonales, debido a la preponderancia de agujeros maculares en la mu-
jer menopusica. La histerectoma y/o la estrogenoterapia sustitutiva ha sido asociada de manera sig-
nificativa con la aparicin de un agujero macular por algunos autores
165,166
pero no por otros.
169
Otros
factores de riesgo cardiovascular han sido diversamente implicados segn los estudios.
163,166,169,170,173
Ninguno de ellos se ha demostrado claramente. La existencia de ametropa asociada no constituye
un factor de riesgo.
163,165,167,169,170,173
En dos amplios estudios recientes de casos y controles,
174,175
los nicos factores de riesgo asociados al
agujero macular fueron el sexo femenino y la edad. El riesgo relativo para las mujeres disminuye con
la edad. En un estudio se observ una concentracin elevada de fibringeno en sangre, sin explica-
cin plausible. Las enfermedades cardiovasculares, la hipertensin arterial y el antecedente de histe-
rectoma no han mostrado correlacin significativa. En otros estudios, el tratamiento con estrgenos
parece disminuir el riesgo de aparicin de un agujero macular
171
o no aumentar el riesgo.
172
III.3 SEMIOLOGA
III.3.1 Signos funcionales
La disminucin de la agudeza visual ocasionada por un agujero macular es variable. En ocasiones,
los pacientes detectan precozmente los primeros sntomas y consultan rpidamente, sobre todo
cuando se trata del segundo ojo; el diagnstico se puede realizar entonces desde el estadio de ame-
naza de agujero macular. En este caso, los pacientes pueden establecer con bastante precisin el mo-
mento de la aparicin de un microescotoma que borra parcialmente una letra en una palabra,
acompaado de metamorfopsia central muy limitada y, eventualmente, de micropsia.
176,177
Cuando el agujero macular est constituido, el escotoma central suele ser ms manifiesto, aunque
esto no sea constante. En el estadio de amenaza de agujero, la agudeza visual es an, en general, su-
perior a 5/10. Ms tarde, la agudeza visual disminuye progresivamente a medida que se forma el agu-
jero macular y, despus de varios meses de evolucin, se estabiliza alrededor de 1/10.
163,166,169,170,173
Una
vez que el agujero est constituido, Morgan y Schatz
157
observaron que el 80% de sus pacientes se
quejaban de disminucin de la agudeza visual, el 11 % presentaban metamorfopsia y nicamente el
5% un escotoma positivo; el 5% de los pacientes estaban asintomticos. En cambio, en otro estu-
dio, el 46% de los ojos estaban asintomticos.
163
III.3.2 Tests
El test de la lnea de Watzke se usa habitualmente para detectar la existencia de un escotoma cen-
tral:
178
consiste en proyectar sobre la mcula del ojo afectado la luz del biomicroscopio de hendidu-
ra fina y pedir al paciente si la ve interrumpida: el signo no es muy fiable y se considera como
respuesta positiva un simple estrechamiento importante de la lnea.
La oftalmoscopia lser de barrido (SLO = Scanning Laser Ophthalmoscope) ofrece posibilidades inte-
resantes para el examen oftalmoscpico y la exploracin funcional de los agujeros maculares. Permi-
5
te una visualizacin muy precisa del fondo de ojo y un control en tiempo real de la localizacin de las
pruebas presentadas al paciente, haciendo posible una exploracin funcional precisa de la mcula.
Se puede medir la agudeza visual retiniana por la proyeccin de pruebas calibradas sobre la zona ma-
cular.
179
Tambin se puede determinar la localizacin del nuevo punto de fijacin (Preferred Retinal Lo-
cus o PRL) que se desarrolla cuando aparece un agujero macular. Est situado habitualmente en el
borde superior del agujero, ms bien superotemporal o temporal en los ojos derechos y superonasal o
nasal en los ojos izquierdos.
179,180
Esta sistematizacin en la mitad superior de la mcula ya se puso de
manifiesto
181
en pacientes con degeneracin macular. Se puede realizar una microescotometra muy
precisa en la misma superficie del agujero, lo que permite determinar la presencia de un escotoma ab-
soluto superponible en la superficie del agujero.
180,182,183
La prueba de la lnea se puede realizar con SLO:
consiste en presentar una fina lnea oscura vertical y horizontal que pasa por el centro del agujero, con
control del fondo de ojo. La lnea proyectada es mucho ms delgada que el dimetro del agujero, no
existe difusin de luz alrededor del test y el control de la localizacin de la lnea es perfecto. La lnea se
observa interrumpida con mayor frecuencia con el SLO que con la lmpara de hendidura. Sin embar-
go, slo se percibi interrumpida en el 70% de los casos, a pesar de la presencia de un escotoma abso-
luto en el agujero, detectado por microescotometra. Esta discordancia se puede explicar por un proceso
de reparacin cerebral del dficit central o por la ausencia de verdadera prdida de sustancia foveolar,
al estar los fotorreceptores simplemente rechazados y al no interpretar el cerebro la discontinuidad.
Tambin se pueden estudiar los potenciales evocados visuales focales (PEVfs) generados con el SLO.
182
La amplitud de la seal del electrorretinograma foveolar disminuye en funcin del tamao del
agujero macular.
188,189
Una disminucin de la amplitud de la respuesta en el ojo contralateral sera un
factor de riesgo de formacin de un agujero macular.
188
Esta prueba sigue siendo marginal en la ex-
ploracin de los agujeros maculares.
Las fotografas del fondo de ojo con luz verde permiten observar el contorno del agujero. Las foto-
grafas del fondo de ojo con luz azul muestran el defecto en el pigmento xantfilo y, eventualmen-
te, la presencia de una membrana alrededor del agujero. Pero con frecuencia la imgenes del fondo
de ojo estn distorsionadas por la presencia de un artefacto central que dificulta el diagnstico de
agujero macular, si nicamente se realiza esta exploracin.
La angiografa fluorescenica es de poca utilidad para el diagnstico, ya que slo de manera incons-
tante muestra una hiperfluorescencia central por efecto ventana.
La ecografa B ha sido til para diagnosticar DPV parciales del polo posterior.
193,194
La tomografa de coherencia ptica (OCT = Optical Coherence Tomography) es el examen ms til
para confirmar el diagnstico de agujero macular, al establecer el estadio evolutivo y diferenciarlo de
otros aspectos como un seudoagujero o un agujero laminar.
195
Adems, la OCT permite ver bien las
conexiones de la hialoides posterior con la mcula.
195,196
E L E N V E J E C I MI E N T O D E L V T R E O Y D E L A U N I N V I T R E O R R E T I N I A N A . 2 . P a r t e
III.3.3 Signos del fondo de ojo
El diagnstico de agujero macular es esencialmente bio-
microscpico (Figura 18). La utilizacin de una lente de
contacto para el examen del polo posterior permite
apreciar la existencia de una dehiscencia, el engrosa-
miento del borde del agujero o la existencia de un opr-
culo, especialmente cuando la hendidura est colocada
horizontalmente y la columna de la lmpara de hendi-
dura est inclinada hacia delante. La utilizacin de una
hendidura estrecha de lser de helio-nen montada so-
bre la lmpara de hendidura
190,191
permite optimizar el
examen clnico de la interfase vitreomacular.
El examen biomicroscpico tambin permite apreciar el
estado del vtreo, especialmente cuando se utilizan lentillas
de gran campo de observacin. Se investiga si la hialoides
posterior est desprendida y si contiene el anillo prepapilar
o anillo de Weiss, signo de desprendimiento posterior del
vtreo (DPV) completo. De hecho, el DPV completo est
precedido de una fase ms o menos prolongada de DPV
parcial en el que la hialoides posterior ligeramente des-
prendida del polo posterior no se distingue en el examen
biomicroscpico, sino nicamente con la OCT.
192
El agujero macular se presenta como un defecto de espesor total, redondo, en el centro de la retina
macular (Figura 19). En la mitad de los casos aproximadamente, existen puntos de color blanco-ama-
rillento sobre el epitelio pigmentario al descubierto, que corresponden a proliferaciones focales del
epitelio pigmentado.
157,163,165
Los agujeros incipientes tienen un dimetro de unos 200 m que au-
menta progresivamente hasta alcanzar un dimetro medio de 500 m.
157,170,197
El borde del agujero suele estar engrosado por un edema microqustico y ligeramente desprendido
del epitelio pigmentario.
157,163
Con frecuencia, se puede ver una estriacin radial en los bordes del
agujero. La OCT ha demostrado que los bordes del agujero estn engrosados por cavidades micro-
qusticas que aparecen a partir del estadio 2, es decir, cuando el oprculo est parcialmente abierto.
La expansin de estos microquistes, especialmente en las capas externas de la retina, es responsable
de la elevacin del borde del agujero
192,195
como ya se haba demostrado histolgicamente.
198
Con el tiempo pueden aparecer una despigmentacin en la zona del agujero macular y del halo de
elevacin retiniano o un anillo pigmentado de demarcacin en el borde externo de la elevacin re-
tiniana, que se ponen de manifiesto fcilmente con angiografa fluorescenica. Existe un defecto del
pigmento xantfilo que se observa en las imgenes monocromticas con filtro azul, tanto en los agu-
jeros maculares como en las amenazas de agujero.
199
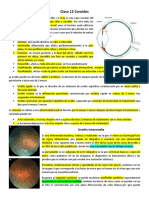
Figura 18. Diferentes estadios de agujeros
maculares observados con hendidura ptica
en el biomicroscopio.
a) Agujero macular de estadio 2: el oprculo
(flecha) no est desprendido del borde del
agujero. b) Agujero macular de estadio 3: el
oprculo (flecha) es visible justo delante del
agujero. c) Agujero macular de estadio 4: la
hialoides est ampliamente desprendida y el
oprculo es ms visible delante del agujero.
a b c
En todos los estadios se puede apreciar hiperfluorescen-
cia foveolar moderada en los tiempos precoces de la
angiografa sin difusin de colorante en los tiempos tar-
dos,
159,200-202
que corresponde a la zona de la abertura re-
tiniana. Se han propuesto diversas explicaciones para
este efecto ventana:
157,163,166
la ms probable es la prdida
o el desplazamiento del pigmento xantfilo contenido
en las capas internas de la retina foveolar.
Tambin puede existir una membrana epimacular alre-
dedor del agujero. El estudio histolgico realizado por
Guyer
198
demostr la presencia de membrana epimacular
en el 73% de los agujeros de espesor total antiguos. La
presencia de MEM es probablemente secundaria a la for-
macin del agujero macular.
203-204
Su frecuencia puede lle-
gar a ms del 75% en los agujeros de estadio 4, frente al
25% aproximadamente en los agujeros de estadio 3.
204
Por delante del plano del agujero se busca el oprculo
prefoveolar, generalmente ms pequeo que el agujero,
translcido y discretamente amarillo; presenta ligera
movilidad con los movimientos oculares, pero inmedia-
tamente recupera su lugar. Se ha encontrado en un
nmero muy variable de casos segn los estudios (26-
80%), debido probablemente a la dificultad para reco-
nocerlo.
157,163,168-170,205,206
La OCT muestra que el oprculo
es adyacente a la hialoides posterior, en forma de una pe-
quea estructura hiperreflectante y que est presente en
casi todos los casos de estadio 3.
192,195
La naturaleza de es-
te oprculo es discutida; algunos autores piensan que est
formado nicamente por crtex vtreo o por una proliferacin neuroglial,
207,208
mientras que otros han
hallado ms recientemente astrocitos, clulas de Mller y pedculos de conos en la mitad de los casos.
209
La presencia de un desprendimiento posterior del vtreo asociado al agujero macular se ha aprecia-
do de forma diversa en la literatura, segn los autores. Gass
159
denomina desprendimiento posterior
del vtreo a la separacin del crtex vtreo de la papila y de la mcula, caracterizada en el biomicros-
copio por la deteccin de la hialoides posterior que contiene el anillo prepapilar mvil delante de la
papila y de la regin macular. Sealemos que el proceso de formacin de un agujero macular se ini-
cia mientras el crtex vtreo est todava por lo menos parcialmente fijado a la retina macular.
La amenaza de agujero y los agujeros de estadio 2 progresan hacia un agujero macular de estadio 3 sin que
el crtex vtreo se desprenda de la papila.
210,211
Por el contrario, los ojos contralaterales con desprendi-
miento posterior del vtreo completo no tienen ningn riesgo de evolucin hacia un agujero macular.
205
7
Figura 19. Agujero macular, estadio 3.
a) Color: visibilidad del epitelio pigmentario
central puesto al descubierto, con algunos puntos
blancos. b) Fotografas con luz verde: mejor
visibilidad del anillo de engrosamiento del borde
del agujero. c) Fotografa con luz azul: defecto en
el pigmento xantfilo. d) Angiografa:
hiperfluorescencia central por defecto del
pigmento xantfilo.
c
a
d
b
E L E N V E J E C I MI E N T O D E L V T R E O Y D E L A U N I N V I T R E O R R E T I N I A N A . 2 . P a r t e
Con la ecografa se puede poner de manifiesto una separacin vitreofoveolar, si existe una fina es-
tructura ecgena delante de la mcula que conecta con la papila y que puede contener el oprculo.
Existe una buena correlacin entre el anlisis ecogrfico y el aspecto biomicroscpico,
193,212
sobre to-
do en el anlisis de la relacin entre el vtreo y la mcula.
213
El anlisis ecogrfico de la interfase vi-
treomacular de los ojos contralaterales podra determinar un grupo de pacientes de riesgo elevado,
si no existe desprendimiento del vtreo, o de poco riesgo si existe separacin vitreofoveolar.
212
La
OCT ha aportado informacin indita y de gran precisin: la aparicin de amenaza de agujero en
el ojo contralateral est precedida por un desprendimiento perifoveolar de la hialoides posterior in-
detectable en el examen biomicroscpico y nicamente visible con OCT. En el estadio de amenaza
de agujero, la hialoides parcialmente desprendida del polo posterior se adhiere al centro de la fove-
ola cuyo suelo est elevado por una formacin qustica. En el estadio 2, la hialoides posterior toda-
va est ligeramente desprendida y se adhiere al borde del oprculo no separado del borde del
agujero, mientras que en el estadio 3 la hialoides que contiene el oprculo est desprendida junto a
la mcula, pero permanece fijada a la papila y al contorno del polo posterior.
192
III.4 CLASIFICACIN DE LOS AGUJEROS MACULARES
III.4.1 Clasificacin segn Gass, 1988-1995
159,203
Estadio 1: desprendimiento foveolar, amenaza de agujero macular
Est presente en pacientes que han consultado inmediatamente despus del comienzo de los signos
funcionales. Corresponde a una trada biomicroscpica: mancha amarilla central profunda de 100-
200 m de dimetro, prdida de la depresin foveolar fisiolgica y ausencia de desprendimiento vi-
treofoveolar (estadio 1A). Existe disminucin de la agudeza visual con frecuencia moderada (0,6 a
0,8) pero que puede reducirse hasta 0,3. Esta lesin es debida al desprendimiento seroso de la fove-
ola y la mancha amarilla se debera a una redistribucin del pigmento xantfilo.
El estadio 1B comprende un anillo amarillo de 200-350 m de dimetro con desaparicin de la depre-
sin foveolar y ausencia de desprendimiento vitreofoveolar. El modelo publicado en 1988 explica este
aspecto por un desprendimiento seroso de la fvea con redistribucin lateral del pigmento xantfilo.
Recientemente, Gass ha sugerido que ya existira un pequeo agujero foveolar subclnico oculto con
desplazamiento lateral de las clulas retinianas y del pigmento xantfilo. El crtex vtreo prefoveolar con-
trado pasara en forma de puente por encima de este nivel y tapara el defecto retiniano central.
Otro aspecto del estadio 1 es el del quiste macular, rodeado por una fina estriacin radial y aso-
ciado a un anillo amarillo ms profundo (estadio 1C).
171
La evolucin del estadio 1 es variable. Cuando aparece la separacin vitreofoveolar, la mcula deja de es-
tar sometida a las tracciones tangenciales: su aspecto se normaliza en ms del 40% de los casos
159
y los sig-
nos funcionales desaparecen. En algunos casos, el crtex vtreo posterior presenta una densificacin
prefoveolar denominada seudooprculo que es testimonio del episodio pasado de amenaza de agujero.
Algunas veces, la separacin vitreofoveolar provoca la formacin de un agujero laminar. Finalmente, en la
9
mitad de los casos, la separacin vitreofoveolar se acompaa de
la formacin de un agujero de espesor completo.
Estadio 2: agujero macular en formacin
Despus de unas semanas o meses aparece una dehiscencia
retiniana de espesor total redonda y centrofoveolar, o en
media luna o herradura, en el borde interno del anillo
amarillo. El borde del agujero est levantado. Inicialmente,
este aspecto se interpret como una verdadera prdida de
sustancia en la retina que aumenta centrfugamente de ta-
mao o se recorta como un abrelatas para dar lugar a la for-
macin de un agujero con oprculo. Esta interpretacin
supone una prdida de sustancia retiniana demasiado im-
portante, a la vista de los buenos resultados anatmicos y
funcionales obtenidos por la ciruga. Recientemente, Gass
ha considerado que el aspecto de media luna, de herra-
dura o de tapa de lata de conservas que adquiere la m-
cula en el estadio 2 se debe ms bien a la contraccin y a la
dehiscencia del crtex vtreo prefoveolar que pasa en forma
de puente por encima de la fvea.
207
El agujero retiniano de
espesor total situado debajo sera poco visible y la prdida
real de tejido retiniano sera inicialmente muy pequea.
La agudeza visual es menor que en el estadio 2.
La gran mayora de los casos de estadio 2 evolucionan a es-
tadio 3.
203,204
Figura 20. Diferentes estadios de los agujeros maculares observados con
OCT (cortes horizontales de 3 mm).
a) Agujero macular de estadio 1A: separacin intrafoveolar, elevacin del
suelo de la foveola. La hialoides posterior parcialmente desprendida se
adhiere al centro de la foveola. b) Agujero macular de estadio 1B: quiste
foveolar: existe separacin centrfuga de los fotorreceptores centrales y
separacin intrafoveolar. c y d) Agujeros maculares de estadio 2: el
techo del quiste se ha abierto, formando un oprculo al que se adhiere
la hialoides. Los bordes del agujero estn engrosados por espacios
microqusticos. e y f) Agujero macular de estadio 3: el oprculo
desprendido y retrado se ha separado del borde del agujero y est
situado junto a la hialoides posterior. La hialoides posterior no se adhiere
a la superficie macular, est desprendida junto al polo posterior, pero
permanece adherida a la papila.
e
b
a
c
d
f
E L E N V E J E C I MI E N T O D E L V T R E O Y D E L A U N I N V I T R E O R R E T I N I A N A . 2 . P a r t e
Estadio 3: agujero macular de espesor total con separacin vitreofoveolar
El agujero macular aumenta progresivamente de tamao debido a la
traccin tangencial del crtex vtreo, sin aumento de la prdida de tejido re-
tiniano. Su tamao supera los 400 m de dimetro. No existe desprendi-
miento posterior del vtreo y el borde del agujero est con frecuencia
ligeramente desprendido. En los agujeros con oprculo existe una opaci-
dad prefoveolar redondeada, ms pequea que el agujero y adherida a la
hialoides posterior separada de la mcula, justo por delante del plano de
la retina. Esta opacidad prefoveolar se observa muy bien con la lmpara
de hendidura usando una hendidura estrecha y retroiluminacin; oscila
discretamente con los movimientos del vtreo. Generalmente, la agudeza
visual y el tamao del agujero se estabilizan. El fondo del agujero puede
contener depsitos puntiformes amarillentos en la superficie del epitelio
pigmentado.
Estadio 4: agujero macular con desprendimiento posterior del vtreo
En algunos casos de agujeros maculares, el desprendimiento posterior del
vtreo termina por completarse. La hialoides posterior presenta entonces
ligera movilidad con los movimientos oculares; contiene el anillo prepa-
pilar y eventualmente el seudooprculo muy distante de la retina.
III.4.2 Contribucin de la OCT: una nueva clasificacin
192
(Figuras 20 y 21)
Con la OCT se han podido observar nuevos aspectos de la evolucin de
los agujeros maculares, tanto a nivel de las modificaciones del tejido ma-
cular como a nivel de la unin vitreomacular. Si bien la clasificacin en
cuatro estadios de Gass sigue siendo vlida en lo esencial, su contenido se
puede revisar:
Estadio 1: amenaza de agujero macular. La imagen de punto amarillo
profundo y de estriacin radial no se debe a una elevacin posterior de los
fotorreceptores sino a la formacin de una separacin, y ms tarde de un
quiste foveolar, que se desarrolla primero en la mitad interna de la foveo-
la. El quiste tiene tendencia a aumentar de tamao y a progresar hacia
atrs, dando lugar a una separacin centrfuga de los fotorreceptores,
mientras que el techo del quiste permanece intacto. Este aspecto corres-
ponde probablemente al estadio 1B.
En el estadio 1 existe una separacin vitreofoveolar parcial: la hialoides pos-
terior est desprendida de la superficie macular, excepto en el centro de la
foveola donde se adhiere al techo del quiste.
Estadio 2: el techo del quiste se ha abierto formando un oprculo que
queda fijado parcialmente al borde del agujero y que se observa en conti-
desprendimiento perifoveal
de la hialoides posterior
amenaza de agujero macular
separacin intrafoveolar
amenaza de agujero macular
quiste foveolar
agujero macular de estadio 2
agujero macular de estadio 3
Figura 21. Evolucin
esquemtica de los
agujeros maculares
(segn datos de la OCT).
11
nuidad con el tejido retiniano. Los bordes del agujero se han engrosado debido a cavidades mi-
croqusticas ms o menos anchas. La hialoides posterior est adherida al oprculo.
Estadio 3: el oprculo es casi siempre detectable en forma de una hiperreflectividad en la hialoi-
des junto al agujero. La hialoides posterior ya no est fijada a la mcula. Sin embargo, contina fi-
jada a la papila y al contorno del polo posterior. Los bordes del agujero son ms gruesos, debido a
las cavidades microqusticas que provocan una elevacin de los mismos.
Estadio 4: la nica diferencia con el estadio 3 es la existencia de un DPV completo.
III.5 HIPTESIS PATOGNICAS
Se han planteado un gran nmero de hiptesis sobre los mecanismos de formacin de los agujeros ma-
culares. En 1983, Avila plante la hiptesis de que tracciones intravtreas anteroposteriores podran ser
la causa de los agujeros. Este concepto fue sustituido a finales de la dcada de 1980 por la hiptesis de
Gass, segn la cual los agujeros maculares se deban a una traccin tangencial del crtex vtreo sobre
los bordes de la foveola; desde entonces se ha dejado de considerar que el oprculo represente una pie-
za de tejido foveolar de grosor total.
157
La buena recuperacin visual, observada despus del xito de la
intervencin quirrgica, se explica por el hecho de que el agujero macular es debido a una simple aber-
tura foveolar causada por una traccin tangencial, ms que por una avulsin de tejido neurorretiniano.
Sin embargo, varios autores han continuado comunicando nuevos elementos a favor de una traccin
anteroposterior. Akiba et al. han insistido en el hecho de que fuerzas anteroposteriores aplicadas a la
mcula podran contribuir al desarrollo del agujero macular.
215
Kakekashi, Schepens y Trempe han
expuesto nuevos ndices biomicroscpicos de una traccin anteroposterior sobre el oprculo de los
agujeros maculares.
216
Kim, que estudi la evolucin espontnea de los agujeros de estadio 2, con-
cluy tambin que fuerzas de traccin vtrea anteroposteriores u oblicuas probablemente tienen un
papel importante en la patogenia de los agujeros maculares.
203
Otras hiptesis se han interesado por la formacin de quistes intrarretinianos como primum movens
de la formacin de los agujeros maculares, ya sea debido a un proceso de traccin o a un proceso de-
generativo.
157,166,217
Este concepto fue ms tarde sustituido durante varios aos por la hiptesis de
Gass, segn la cual el estadio inicial de amenaza de agujero era un desprendimiento posterior focal
de los fotorreceptores y no una formacin qustica intrafoveolar.
Una de las principales dificultades para establecer lo que sucede durante los estadios iniciales de la
formacin de los agujeros maculares es la dificultad de visualizar la hialoides posterior cuando est
ligeramente separada de la retina, especialmente debido a la definicin insuficiente del examen de la
mcula en corte ptico con la lmpara de hendidura.
A pesar de excelentes observaciones hechas en algunos casos gracias a dispositivos especiales de lm-
paras de hendidura fotogrficas, la hialoides posterior ligeramente desprendida de la retina era rara-
mente visible.
168,218
Otras observaciones realizadas con ayuda del SLO han proporcionado argumen-
tos indirectos a favor de la aparicin de un quiste foveolar, como elemento del desarrollo de un agu-
jero macular.
219
Estas observaciones tambin han sido corroboradas por las imgenes proporcionadas
por las fotografas con lmpara de hendidura lser, que han permitido obtener cortes pticos seria-
dos de la mcula y que muestran que el desarrollo de los agujeros maculares se acompaa de modi-
ficaciones qusticas intrarretinianas.
220
Finalmente, la OCT ha aportado recientemente informaciones nuevas, por una parte sobre la unin
vitreomacular y, por otra parte, sobre las modificaciones intrarretinianas, que aparecen en la foveo-
la durante los estadios iniciales de la formacin de los agujeros maculares.
195,221
Sabemos que existe
una correlacin bastante buena entre las imgenes de la OCT y la estructura de la mcula, como ha
sido subrayado recientemente por un trabajo experimental anatomoclnico.
222
En la prctica clnica,
la OCT permite, como mnimo, diferenciar la capa de los fotorreceptores y de las fibras de Henle
de las capas de la retina interna. Adems, cuando el vtreo posterior parcialmente desprendido per-
manece cerca de la retina, se puede visualizar fcilmente y aparece como una estructura continua,
lineal, moderadamente hiperreflectante.
195,221
Cuando se explora el ojo contralateral de un agujero macular, es bastante habitual observar un
desprendimiento parcial de la hialoides posterior alrededor de la mcula. El hecho de que el DPV
comienza en el polo posterior ya se haba considerado, basndose en datos anatmicos
223
o biomi-
croscpicos.
168
Tambin se admita que la foveola era una de las zonas de adherencia vitreorretiniana preferente,
aunque esto nunca se haba podido demostrar claramente. Sin embargo, hasta la utilizacin de la
OCT no fue posible observar dnde comienza el desprendimiento posterior de la hialoides y cmo
evoluciona. Ahora, es seguro que el desprendimiento posterior de la hialoides comienza en la peri-
feria de la mcula, habitualmente del lado nasal, y que se extiende gradualmente rodeando la m-
cula, mientras que la hialoides permanece adherida focalmente al centro de la fovola. Como la
hialoides posterior permanece fijada durante bastante tiempo al centro de la foveola, por una parte,
y a la papila y al contorno del polo posterior, por otra parte; presenta una biconvexidad en los cor-
tes de OCT que parece indicar que sobre la cara vtrea de la hialoides se ejercen fuerzas de traccin
anteroposterior.
El mecanismo que provoca el desprendimiento posterior del vtreo es muy mal comprendido. Se
sabe que el DPV est asociado a la edad y que su prevalencia aumenta a partir de la sexta dcada
de la vida. La presencia de fibras de colgeno anteroposteriores en el gel vtreo tambin est bien
documentada y algunos autores han pensado que estas fibras podran insertarse directamente en
la depresin foveolar a travs de la dehiscencia de la hialoides posterior.
224
Otros autores han des-
crito una bolsa premacular cuya presencia parece contradictoria con una posible traccin ante-
roposterior.
225,226
El examen con OCT muestra, en efecto, que el crtex vtreo posterior constituye una ruptura con-
tinua que tiene caractersticas muy especiales de reflectividad, debido probablemente a la distribu-
E L E N V E J E C I MI E N T O D E L V T R E O Y D E L A U N I N V I T R E O R R E T I N I A N A . 2 . P a r t e
cin laminar de fibras de colgeno condensado. Probablemente se debe al hecho de que esta estruc-
tura est orientada perpendicularmente a la luz incidente de la OCT que produce esta reflectividad,
mientras que esto no sucede con la organizacin ms laxa del gel vtreo. El examen con OCT no
confirma la presencia de dehiscencias en la hialoides posterior junto a la mcula, en los estadios ini-
ciales del desprendimiento vtreo. Muy al contrario, existe una adherencia entre la hialoides poste-
rior y el crtex vtreo que resiste, mientras que el desprendimiento vtreo se extiende alrededor. El
crtex vtreo podra elevarse si el gel vtreo se contrae. Las fuerzas de traccin anteroposterior se
transmitiran, pues, al suelo de la foveola a travs del anclaje de la hialoides posterior a su centro.
192
El primer estadio de la formacin de los agujeros maculares es una separacin intrarretiniana en la
parte interna de la foveola. El espacio creado por esta separacin aumenta con el tiempo y evolucio-
na hacia la formacin de un quiste intrafoveolar. Cuando el techo de este quiste se abre por efecto
de la traccin vtrea, aparece un agujero de espesor total. La aparicin de un quiste intrarretiniano,
como primer estadio de la formacin de los agujeros maculares, era ampliamente aceptada en el pa-
sado,
157,168,217
pero fue puesta en duda por Gass.
159
No obstante, exmenes con SLO,
219
con el Retinal
Thickness Analyser
220
y ms tarde con OCT
195
han podido confirmar la existencia de estas forma-
ciones qusticas intrarretinianas asociadas con el desprendimiento parcial de la hialoides posterior.
La localizacin de la separacin intrarretiniana en la parte interna de la foveola se puede explicar
por su particular ultraestructura, que fue especialmente analizada en el ser humano por Yamada
227
en 1969. Existe, al parecer, un plano de separacin en la parte interna de la foveola. Las expansio-
nes de las clulas de Mller ocupan la mayor parte del tercio interno del centro foveolar y consti-
tuyen el suelo del centro de la foveola. Probablemente se produce a este nivel una separacin
intrafoveolar, debido al efecto de una traccin anteroposterior del vtreo, que provoca diferentes
grados de alteracin de las expansiones de las clulas de Mller centrofoveolares. La desorganiza-
cin de la estructura neuroglial de la foveola podra provocar la formacin de quistes intrafoveola-
res y la extensin pericentral de una separacin entre la capa de las clulas bipolares y ganglionares,
por una parte, y la capa de las fibras de Henle, por otra parte. En este estadio de amenaza de agu-
jero macular, la imagen de la OCT permite observar una estructura interna hiperreflectante (el te-
cho del quiste), un espacio hiporreflectante que corresponde a la separacin o al quiste, y una
estructura hiperreflectante externa que corresponde a la capa engrosada de los fotorreceptores y de
las fibras de Henle. Antes incluso de la abertura del techo del quiste (el oprculo), los fotorrecep-
tores centrales tienden a separarse, abriendo un espacio hiporreflectante posterior centrofoveolar.
El oprculo es probablemente una avulsin laminar del suelo de la foveola que contiene fragmen-
tos de clulas de Mller y, en ocasiones, los pedculos de los conos,
209
lo que representa la parte ms
interna de las fibras de Henle, probablemente arrancados junto con las clulas de Mller. En todos
los casos de estadio 2, el oprculo parece pertenecer claramente al tejido retiniano y no constituir
una proliferacin extrarretiniana.
En el estadio 3 no existe ninguna conexin entre los bordes del agujero y la hialoides posterior, que
est completamente desprendida junto a todo el polo posterior y permanece adherida a la papila.
Siempre existe una estructura hiperreflectante central, ms o menos visible, junto al agujero en el
plano de la hialoides posterior, que constituye el oprculo. Los bordes del agujero son gruesos, de-
13
bido a la presencia de cavidades qusticas intrarretinianas que aumentan con el tiempo, y la eleva-
cin de los bordes se debe a su engrosamiento ms que a un verdadero desprendimiento.
192,221
En resumen, la patogenia de los agujeros maculares se puede comprender de la manera siguiente: el
desprendimiento de la hialoides posterior comienza alrededor de la mcula. Este desprendimiento
tiene una forma biconvexa que sugiere la existencia de fuerzas de traccin anteroposteriores que pue-
den transmitirse al centro de la foveola. La primera modificacin observada en el tejido macular es
una separacin intrarretiniana que evoluciona hacia la formacin de un quiste centrofoveolar, lo que
constituye el estadio 1 o estadio de amenaza de agujero macular. La abertura en crculo del techo de
este quiste, debido a la traccin del crtex vtreo posterior, constituye el estadio 2. En el estadio 3,
la hialoides posterior est completamente desprendida de la mcula y contiene un oprculo.
192
III.6 DIAGNSTICO DIFERENCIAL
El diagnstico diferencial de los agujeros maculares se ha simplificado mucho desde que la OCT ha
proporcionado una representacin detallada de la mcula en corte ptico. Casos que se haban in-
terpretado errneamente
228
son ahora fcilmente recalificados.
Diagnstico diferencial de los estadios 1: Lesiones con mancha o anillo amarillo central
Agujero macular de estadio 2 cuando la abertura es muy pequea e incierta: ni la hiperfluores-
cencia angiogrfica ni el test de la lnea son argumentos suficientes. En cambio, la OCT permite
observar casi con total seguridad si existe una abertura o no en el techo del quiste foveolar.
192,195
Edema macular qustico: puede ser responsable de errores diagnsticos sobre todo en caso de cel-
dilla central redonda, pero la angiografa fluorescenica muestra la acumulacin de colorante en las
celdillas.
Sndrome de traccin vitreomacular:
229-232
sndrome que asocia un desprendimiento posterior del
vtreo parcial con persistencia de adherencias vitreomaculares y traccin anteroposterior, que se
acompaa con frecuencia de celdillas qusticas en una mcula abombada. Sin embargo, existen for-
mas de transicin entre la amenaza de agujero y el sndrome de traccin vitreomacular.
Drusa foveolar, desprendimiento del epitelio pigmentado foveolar o modificaciones del epitelio
pigmentado foveolar: estos distintos procesos patolgicos tienen un aspecto de mancha amarilla
central pero no provocan habitualmente prdida de la depresin foveolar.
Seudooprculo: es consecuencia de la aparicin de una separacin vitreofoveolar durante una ame-
naza de agujero macular. Puede ser responsable de un mnimo escotoma relativo central o para-
central; al estar situado el seudooprculo a nivel de la hialoides posterior, presenta ligera movilidad
con los movimientos oculares. La OCT permite precisar si este seudooprculo se acompaa de un
perfil macular normal o de un agujero laminar.
E L E N V E J E C I MI E N T O D E L V T R E O Y D E L A U N I N V I T R E O R R E T I N I A N A . 2 . P a r t e
15
Distrofia macular seudoviteliforme del adulto.
Maculopata solar.
y de forma anecdtica, las telangiectasias yuxtafoveolares
235
o un anillo de condensacin vtrea
prefoveal.
Diagnstico diferencial de los agujeros maculares de estadios 3 y 4
En estadio 3 o 4 el diagnstico se puede plantear con un agujero laminar o un seudoagujero macu-
lar, porque estas tres situaciones pueden acompaarse de una membrana epimacular.
El seudoagujero macular
234,236
corresponde a una constriccin de la foveola por la contraccin de
una membrana epimacular, lo que provoca una verticalizacin de los bordes foveolares. En la ima-
gen del seudoagujero no hay escotoma,
237
pero en la angiografa puede existir hiperfluorescencia
central. En los casos difciles, la OCT confirma el diagnstico al mostrar el engrosamiento de la
retina alrededor de la imagen de seudoagujero y la presencia de tejido retiniano foveolar de grosor
normal o aumentado
232,238
El agujero macular laminar es un defecto retiniano que slo afecta a una parte del espesor de la re-
tina. Puede ser consecuencia de la aparicin de una separacin vitreofoveolar durante la formacin
de un agujero macular. Cuando se produce esta separacin, las capas internas de la retina pueden
ser desgarradas y dan lugar a un oprculo situado a nivel de la hialoides posterior. El agujero la-
minar es redondo u ovalado, de color rojizo y bordes a veces multilobulados que delimitan clara-
mente el defecto de la retina interna. No hay engrosamiento de los bordes, el test de la lnea es
negativo, la agudeza suele ser buena ( 6/10) y la OCT muestra claramente el adelgazamiento del
tejido retiniano foveolar central.
235
III.7 EVOLUCIN Y PRONSTICO
III.7.1 Regresin espontnea de las amenazas de agujeros y de los agujeros
La aparicin de una separacin vitreofoveolar en el transcurso de un sndrome de amenaza puede
provocar la resolucin de los signos funcionales y la normalizacin de la mcula.
239,241
Este fenme-
no interviene en el 44% aproximadamente de los casos segn Gass
159
y en el 60% aproximadamen-
te en el estudio realizado por de Bustros.
242
La regresin espontnea de un agujero de espesor total es menos frecuente. Lewis
243
comunic un
caso en 1986, donde el agujero de espesor total se haba cerrado espontneamente por proliferacin
de una membrana epirretiniana. En otras publicaciones se ha evaluado el cierre espontneo de los
agujeros maculares de espesor total y se ha observado en el 4-8% de los casos,
157,206,244
principalmen-
te cuando se trataba de casos recientes.
III.7.2 Evolucin de los agujeros de estadio 2
En un estudio prospectivo se observ que los casos de estadio 2 progresaban, en un ao, a estadio 3
o 4 en el 74% de los casos.
203
Por lo tanto, la evolucin de los agujeros de estadio 2 puede tener lu-
gar hacia la cicatrizacin espontnea (raramente) o hacia un estadio 3 o 4 (lo ms frecuente). En al-
gunos casos, el estadio 2 permanece sin cambios durante meses pero la agudeza visual tiende a
disminuir.
170,171,245
III.7.3 Evolucin del tamao y de la agudeza visual de los agujeros maculares
Se ha observado un aumento del tamao de los agujeros maculares con el tiempo.
157,203
Por el con-
trario, en diferentes estudios la agudeza visual se ha hallado curiosamente estable (60-70% de los
casos),
157,163
aunque finalmente disminuye en los agujeros de estadio 3 y 4.
163,173
Aaberg observ, des-
de 1970, que la agudeza disminua raramente por debajo de 1/20 y que en la mayora de los casos
se estabilizaba alrededor de 1/10.
III.7.4 Riesgo de bilateralizacin; futuro del ojo contralateral
La frecuencia de bilateralizacin de los agujeros maculares vara de 0 a 27%, segn los estudios pu-
blicados.
163,165,170,171,246
En un estudio prospectivo, la tasa de agujero macular en el otro ojo a los 5 aos
fue del 15,6%.
247
El riesgo aumenta a partir del momento en que apare-
cen modificaciones anatmicas o signos funcionales en
el ojo contralateral.
246,247
Por tanto, los quistes macula-
res sobre todo con disminucin de visin,
163
un abom-
bamiento foveolar
157
o un punto amarillo foveolar
asociado con prdida del reflejo, disminucin de visin
y/o metamorfopsia
159
hacen temer la aparicin de un
agujero macular.
III.8 TRATAMIENTO QUIRRGICO DE LOS
AGUJEROS Y AMENAZA DE AGUJEROS (Figura 22)
III.8.1 Principio quirrgico
El principio del tratamiento de los agujeros maculares fue
establecido por Wendel y Kelly
148
y consiste en asociar
una vitrectoma central y un desprendimiento del crtex
vtreo posterior, en los casos de estadio 2 y 3, en los que
este crtex permanece parcialmente adherido a la retina.
La intervencin termina con un intercambio lquido-gas
lo ms completo posible y colocacin del paciente boca
abajo durante varios das.
E L E N V E J E C I MI E N T O D E L V T R E O Y D E L A U N I N V I T R E O R R E T I N I A N A . 2 . P a r t e
Figura 22. Agujero macular de estadio 3, antes y
despus del cierre quirrgico (mismo caso que la
figura 19).
a) En la fotografa con luz verde, el agujero se ha
cerrado de nuevo y su contorno ya no es visible.
b) En los cortes de OCT, el agujero se ha cerrado
de nuevo y la continuidad del tejido macular se
ha restablecido, debido a la proliferacin
neuroglial que restituye la depresin foveolar.
a b
Se han utilizado diferentes instrumentos para extirpar el crtex vtreo posterior. La prctica ms fre-
cuente consiste en resecar el anillo prepapilar de la papila y desprender en bloque la hialoides posterior.
Durante esta maniobra se ve que el oprculo prefoveolar se separa junto con la hialoides posterior. El
desprendimiento hialoideo se contina entonces progresivamente hasta el ecuador. Nosotros utiliza-
mos para hacerlo unas pinzas aspirativas que facilitan el desprendimiento del anillo prepapilar.
La vitrectoma debe completarse luego en la periferia. Algunos autores han insistido en la necesidad
de una vitrectoma muy completa, reduciendo lo ms posible la corona de vtreo que se deja inevi-
tablemente a nivel de su base. El objetivo es dejar un mximo de espacio a la burbuja de gas y reducir
el riesgo de desgarros secundarios por contraccin de la base del vtreo.
Durante el desprendimiento de la hialoides y la vitrectoma perifrica, conviene inspeccionar cuida-
dosamente la retina perifrica en 360 con indentacin para asegurarse de que no se ha provocado
ningn desgarro retiniano.
En un estudio reciente de 270 casos operados, hemos observado desgarros retinianos en ms del
15% de los ojos. Si estos desgarros se tratan inmediatamente durante la intervencin con lser o crio-
aplicacin, el riesgo de desprendimiento de retina disminuye mucho y slo se ha encontrado en el
1,5% de nuestra serie.
Al final de la vitrectoma, la inspeccin de la mcula permite detectar la existencia o no de una mem-
brana epimacular adherida al borde del agujero: se trata de una membrana bastante laxa, relativa-
mente poco adherida a la superficie macular, pero adherida al borde del agujero donde adquiere un
color amarillo; es bastante fcil de levantar y de doblar en el borde del agujero. Entonces se puede
extirpar o resecar. Hemos observado una membrana premacular de este tipo en el 25% de los agu-
jeros de estadio 2, pero en el 80% de los agujeros de estadio 4, por lo que parece asociada a la anti-
gedad del agujero macular. No obstante, algunos autores que no extraen esta membrana obtienen,
a pesar de todo, buenos resultados.
Ms recientemente, algunos cirujanos tienden a eliminar la membrana limitante interna alrededor
del agujero, tanto si existe una membrana epimacular asociada como si no. Los resultados publica-
dos parecen favorables, sin que se pueda justificar la necesidad de extirpar esta membrana limitante
interna que no tiene probablemente ningn papel en la patogenia de los agujeros maculares.
Despus de la vitrectoma se realiza un intercambio lquido-aire lo ms completo posible. Hay que
esperar 10 minutos despus del intercambio para permitir el secado de la base del vtreo; una cier-
ta cantidad de lquido endocular se vuelve a acumular entonces en el fondo de la cavidad vtrea y
conviene reaspirarla. Cuando se utiliza un estimulador de la cicatrizacin, se deposita en la regin
macular al final del intercambio lquido-aire. Se procede entonces a la inyeccin de una mezcla ga-
seosa no expansiva. La mayora de los autores utilizan una mezcla de C3F8 14% - aire 86%. La uti-
lizacin de C2F6 17% - aire 83% nos parece mejor. La burbuja de gas es muy eficaz durante 15 das
y deja al descubierto la mcula, en sedestacin, despus de la tercera semana. Despus de cinco se-
manas se ha reabsorbido completamente.
17
E L E N V E J E C I MI E N T O D E L V T R E O Y D E L A U N I N V I T R E O R R E T I N I A N A . 2 . P a r t e
La posicin postoperatoria del paciente se considera un elemento esencial del xito de la interven-
cin. Sin embargo, la opinin sobre la duracin necesaria del taponamiento ha variado con el tiem-
po. Aunque algunos autores preconizan una posicin estricta durante quince das como garanta de
xito, otros han obtenido xitos muy satisfactorios con el mantenimiento de la posicin durante sie-
te das o nicamente durante cuatro das; algunos autores que utilizan silicona incluso han prescin-
dido de la posicin en decbito prono del paciente, cuando se sabe que la silicona tiene una tensin
superficial inferior a la mezcla gaseosa.
El mecanismo de accin del taponamiento interno es probablemente el siguiente: la burbuja de gas
que se aplica contra la superficie anterior de la mcula impide toda emisin de lquido en contacto
con la mcula, permite la deshidratacin de los bordes de los agujeros maculares empapados de l-
quido en la cavidad microqustica y provoca el adelgazamiento y reaplicacin de los bordes del
agujero. El simple efecto mecnico del adelgazamiento de los bordes del agujero produce la reapro-
ximacin de los mismos. La burbuja de gas tambin forma una pared colindante con el epitelio pig-
mentario, un espacio extremadamente mnimo, probablemente propicio a la proliferacin de las
clulas neurogliales a partir de los bordes del agujero. Este proceso de proliferacin es el que condu-
ce a la formacin de un tejido centrofoveolar que suelda de nuevo los bordes del agujero macular.
La duracin del taponamiento depende, pues, del tiempo necesario para esta migracin y prolifera-
cin neuroglial. Cuando la burbuja de gas es suficientemente grande y de tamao estable durante
una semana, el decbito prono se puede reducir a siete das y quiz incluso a menos.
III.8.2 Resultados de la ciruga de la amenaza de agujero macular (estadio 1A y 1B)
La ciruga de la amenaza de agujero macular parece prometedora a la vista de las primeras series pu-
blicadas.
255-258
A diferencia de la ciruga de los agujeros maculares de espesor total, esta intervencin
no contemplaba la inyeccin de gas al final de la vitrectoma. Sin embargo, un estudio multicntri-
co, prospectivo y aleatorizado, realizado entre 1988 y 1993 en EE.UU., desminti estos resultados
optimistas:
242,259
el 37% de los ojos operados evolucionaron hacia un agujero de espesor total, en
comparacin con el 40% de los ojos del grupo control, de evolucin espontnea. Por lo tanto, no se
ha demostrado que la ciruga de la amenaza de agujero macular aporte ventajas con relacin a la evo-
lucin espontnea de la afeccin. Por consiguiente, actualmente no se puede recomendar.
Sin embargo, esta conclusin podra matizarse debido a la reinterpretacin reciente de los estadios 1
hecha por Gass
207
y a la informacin complementaria de un estudio comparativo.
260
Segn esta lti-
ma publicacin, la amenaza de agujero macular cuya agudeza visual era mala es la que tena el mayor
riesgo de evolucin espontnea a un agujero macular de espesor total. Ahora bien, si nos referimos a
los datos aportados actualmente por la OCT, las amenazas de agujero que ya presentan una mnima
abertura de su techo, o de estadio 1B con una gran abertura posterior, son las que tienen mala agu-
deza visual. Eventualmente, se podra pensar en una mejor seleccin de los casos basada en la OCT.
III.8.3 Resultados de la ciruga de los agujeros maculares de espesor total (estadios 3 y 4) (Tabla IV)
La ciruga de los agujeros maculares constituidos plantea por s misma diferentes problemas. La dismi-
nucin de la visin y el escotoma que presentan los pacientes son debidos al defecto retiniano central
de espesor total que se ha producido durante la constitucin del agujero macular; la metamorfopsia
19
central y paracentral se explica por el engrosamiento y el desprendimiento de los bordes del agujero. El
tamao real del agujero, es decir de la prdida de sustancia, sera mucho ms pequeo de lo que hara
pensar el tamao aparente del agujero: dos observaciones histolgicas de agujeros maculares operados
y curados
261,262
han mostrado que, en el postoperatorio, ya no exista ms que un pequeo (15-50 m)
defecto retiniano de espesor total una vez que se han afrontado de nuevo los bordes del agujero. La re-
tina macular alrededor del agujero puede recuperar una cierta funcin visual porque persisten fotorre-
ceptores no atrofiados,
198
por lo menos cuando el agujero todava no es demasiado antiguo.
Los primeros resultados positivos de la ciruga de los agujeros maculares fueron presentados por
Kelly y Wendel, en noviembre de 1989 y publicados luego en mayo de 1991;
148
de entrada, suscita-
ron una cierta incredulidad. En esta primera serie de 52 pacientes, la tasa de cierre del agujero fue
del 58% y se apreci mejora visual en el 42% de los ojos operados. En una serie posterior de Patel
y Wendel
254
de 191 ojos, publicada en 1994, la tasa de xito anatmico aument al 86%.
Las tasas de xito van del 53% (16 de 30 ojos) en el grupo placebo del estudio aleatorizado de Smiddy
y Glaser
263
al 73,5% en el estudio de Ryan en el total de 68 casos (48 ojos con agujero de menos de 6
meses de evolucin y 20 ojos con un agujero de ms de 6 meses).
264
En otros estudios se han obtenido
resultados intermedios.
265,266
Ms recientemente, se han publicado tasas de xito superiores al 90%; es-
tos buenos resultados dependen de la seleccin de los casos (recientes, buena agudeza visual inicial) o
de modificaciones de la tcnica quirrgica (ablacin de la limitante interna de la retina).
267-269
Sin embargo, en los nicos cinco estudios prospectivos aleatorizados disponibles, las tasas de xito
de los grupos operados sin usar estimuladores de la cicatrizacin fueron del 53%, 69%, 61,4 %, 65%
y 82% respectivamente.
263,244,270,271,272
Se han estudiado diferentes factores de pronstico, especialmente el estadio o la antigedad del agu-
jero, la naturaleza o la duracin del taponamiento interno y la eventual adicin de un estimulador
de la cicatrizacin.
Autor xito anatmico
Estim. de cicatrizacin
Ao Con estim. de cicatrizacin Sin estim. de cicatrizacin Observacin
% (nb) % (nb) % (nb)
Thompson
TGF bovino 1998 77,8 % [63] 61,4 % [57]
Freedman 1997 69 % [59] 4% [58]
Smiddy
TGF recombinante 1993 91 % [58] 53 % [30]
Ezra
Suero autlogo 1999 85 % [53] 77 % [47] 11% [51]
Paques
Plaquetas autlogas 1999 96 % [53] 81 % [57]
Tabla IV. Resultados de la ciruga de los agujeros maculares en los estudios aleatorizados
E L E N V E J E C I MI E N T O D E L V T R E O Y D E L A U N I N V I T R E O R R E T I N I A N A . 2 . P a r t e
Al parecer, los mejores resultados anatmicos y visuales se obtienen en los agujeros relativamente re-
cientes: en la serie de 170 casos de Wendel,
253
la tasa de xito anatmico fue inversamente propor-
cional a la antigedad de las lesiones: 80% en los agujeros de menos de 6 meses, 74% en los agujeros
de 6 meses a 2 aos y nicamente del 62% en los agujeros de ms de 2 aos. Desde el punto de vis-
ta visual, se obtuvo mejora de 2 lneas en el grupo de agujeros de menos de 6 meses en compara-
cin con el 26% en el grupo de agujeros de ms de 1 ao. En el estudio de Ryan,
264
la tasa de cierre
inicial fue del 75% en el grupo de agujeros de menos de 6 meses en comparacin con el 60% en los
agujeros de ms de 6 meses.
El taponamiento interno utilizado en un principio fue la mezcla aire-SF6 y ms tarde la mezcla ai-
re-C3F8, cuya duracin til de taponamiento macular es ms larga. Tambin se ha recomendado el
mantenimiento estricto de la posicin del paciente durante 2-3 semanas.
273
En la prctica, hemos ob-
servado que un taponamiento con una mezcla de aire y gas con un 17% de C2F6 y el manteni-
miento de la posicin durante 7-10 das consiguen una tasa de xito del 80% o superior.
Dos publicaciones anatomopatolgicas
261, 262
de 3 ojos operados con xito de agujero macular, obte-
nidos post mortem, han mostrado que tambin existe un buen proceso de cicatrizacin retiniana en
el hombre. En dos casos, el defecto foveolar estaba cubierto por una proliferacin de clulas neuro-
gliales. Estas observaciones indican, pues, que existe un fenmeno cicatricial, lo que justifica que se
intente su estimulacin mediante factores de crecimiento; la diana seran las clulas neurogliales ms
que las clulas del epitelio pigmentario.
Sin embargo, la primera utilizacin de estimuladores de la cicatrizacin en la ciruga de los agujeros
maculares fue la del TGF en 1992
274
cuya diana era la proliferacin de las clulas del epitelio pig-
mentario. En un estudio multicntrico prospectivo aleatorizado
263
se obtuvo una tasa de xito ana-
tmico del 91% frente al 53% en el grupo de placebo. Desgraciadamente, la utilizacin del TGF
de sntesis (recombinante) no ha permitido reproducir esta tasa de xito satisfactorio.
270
En estudios piloto se han utilizado otros estimuladores de la cicatrizacin tisular: plasma-trombi-
na,
275
trombina bovina,
276
adhesivo tisular de fibrina,
277
suero autlogo
278,279
y tissucol.
280
Hasta ahora,
no es posible formular ninguna conclusin sobre el inters de estos productos.
Desde julio de 1993, nosotros utilizamos un concentrado de plaquetas autlogas para favorecer el
cierre de los agujeros maculares.
265
Un concentrado de plaquetas autlogas (0,1 ml), acondicionado
durante el inicio de la intervencin, es depositado en el polo posterior despus del intercambio l-
quido-aire. Un estudio prospectivo aleatorizado
272
ha permitido poner de manifiesto una mejor tasa
de xito en el grupo operado con concentrado plaquetario autlogo (96%) que en el grupo control
(82%, p = 0,04).
III.8.4 Complicaciones de la ciruga de los agujeros maculares
La intervencin quirrgica de los agujeros maculares es bastante sencilla, aunque no est totalmen-
te desprovista de riesgos ni de efectos secundarios.
c
21
Complicaciones intraoperatorias
Durante la intervencin, el principal riesgo es el de provocar desgarros retinianos en el transcurso
del desprendimiento de la hialoides posterior. Al igual que en el transcurso del desprendimiento pos-
terior espontneo del vtreo, se producen en dos lugares: en el ecuador, en el lmite posterior de la
base del vtreo y especialmente a nivel de las zonas de degeneracin en empalizada o su equivalente,
y a nivel de adherencias vitreorretinianas paravasculares, posteriores al ecuador e insospechadas con
anterioridad. La localizacin de estos desgarros yatrgenos se ha investigado ms detalladamente en
un estudio reciente;
281
el desgarro estaba situado cerca de los orificios de esclerotoma con menor fre-
cuencia que en los otros tipos de vitrectoma. Se localizaban ms bien en los cuadrantes inferiores y
temporales. Se puede admitir que el riesgo de desgarros intraoperatorios es del orden del 4-5%.
281,282
Este riesgo justifica un examen cuidadoso de la periferia retiniana antes de la inyeccin del gas, para
poder tratar inmediatamente la dehiscencia por medio de lser o crioaplicacin.
Las alteraciones pigmentarias maculares, visibles cuando se reabsorbe el gas, se han atribuido a fo-
totraumatismo causado por la iluminacin endocular.
148,282-284
Es posible que este tipo de fototrau-
matismos existan, pero nosotros no los hemos observado nunca. Las alteraciones pigmentarias se
deberan ms bien a maniobras prolongadas de succin de la retina macular en bsqueda del crtex,
o a la aspiracin por el agujero macular del lquido subrretiniano, maniobras intiles segn nuestra
tcnica. Asimismo, se puede producir un blanqueamiento localizado de la retina interna en caso de
aspiracin excesiva. Se han sealado ampliaciones del agujero macular.
282
Esta eventualidad es posi-
ble durante la ablacin de una sustancia epimacular adherida al borde del agujero.
Complicaciones postoperatorias
Durante los primeros das o semanas despus de la operacin puede aparecer un desprendimiento de retina.
Su frecuencia se ha apreciado de forma diversa: 1% en el estudio de Wendel et al.,
253
2% en el estudio de
Smiddy et al.
263
Recientemente, Park et al.
282
han observado un 14% de desprendimientos de retina (y un
4% de desgarros intraoperatorios) en una serie de 98 agujeros maculares operados. En 11 de 14 casos, los
desgarros causales eran de localizacin inferior. Aunque esta tasa de desprendimiento parece excesivamente
elevada y no es corroborada por nuestra experiencia (1,5% de desprendimientos de retina en 225 casos ope-
rados), hay que sealar que el riesgo existe. El hecho de que los desgarros sean principalmente inferiores (lo
que resulta poco habitual en los desgarros despus de vitrectoma (generalmente localizados detrs de los ori-
ficios de esclerotomas superiores) hace sospechar el papel de una traccin ejercida por el gas sobre el resto
de vtreo inferior, como causa de los desgarros. Esto debe ser motivo para actuar con especial cuidado al prac-
ticar la vitrectoma perifrica. Tambin es deseable tratar preventivamente todas las zonas de empalizada.
La hipertona intraocular es frecuente durante los primeros das del postoperatorio. Generalmente, es mo-
derada y fcilmente controlada con un colirio betabloqueante y acetazolamida. En algunos casos, sin em-
bargo, puede ser bastante elevada durante varios das, a pesar de un tratamiento mximo. Esta hipertona no
es debida a un llenado gaseoso excesivo porque el menisco inferior de la burbuja de gas siempre es visible.
La aparicin de una catarata secundaria es frecuente y esperada.
285,286
Parece ms precoz que en la ci-
ruga de las membranas epimaculares y no es raro que deba practicarse una operacin de catarata en-
tre 1 y 2 aos despus de la intervencin del agujero macular.
E L E N V E J E C I MI E N T O D E L V T R E O Y D E L A U N I N V I T R E O R R E T I N I A N A . 2 . P a r t e
En el 2-9% de los casos se podra presentar una reabertura del agujero macular,
282,287,288
especialmente des-
pus de la intervencin de catarata.
289
La causa de esta recidiva podra ser el desarrollo y la contraccin de
una membrana epirretiniana. Una reintervencin puede permitir cerrar de nuevo el agujero.
287,289-291
Por ltimo, varios autores han observado recientemente la posibilidad de afectacin del campo visual en
el postoperatorio, sin poder precisar an si es consecuencia del acto operatorio en s mismo o de la hi-
pertona ocular postoperatoria precoz
292-296
o, incluso, de la deshidratacin retiniana por el aire inyectado.
297
III.8.5 Evaluacin postoperatoria de los agujeros maculares
No resulta muy fcil documentar el resultado de la ciruga de los agujeros maculares.
El aumento de la AV de lejos con la mejor correccin ptica proporciona, desde luego, un elemen-
to esencial, pero los resultados son infravalorados por el desarrollo precoz de una catarata. En el es-
tudio de Wendel,
253
el 29% de los pacientes (49/170) lograron una visin igual o superior a 5/10.
Esta cifra aumenta al 61% (20/33) en el estudio de Ruby
298
en los agujeros de estadio 2, al 70%
(19/27) en los agujeros de estadio 3 de menos de 6 meses en el estudio de Ryan
264
y al 74% (23/31)
en el estudio de Thompson utilizando TGF2.
285
El examen biomicroscpico es muy til; las imgenes con luz verde y azul en 40
o 30
proporcio-
nan informacin interesante cuando no estn alteradas por un artefacto central.
La exploracin de la mcula con SLO aporta datos funcionales interesantes: Guez et al. estudiaron
32 ojos operados con xito. La imagen del agujero se haba vuelto indetectable en 25 casos y en los
7 casos restantes el agujero se haba vuelto mucho ms pequeo y los bordes eran planos y estaban
de nuevo sellados. El escotoma absoluto haba desaparecido en 23 casos (72%), la lnea ya no se vea
interrumpida en 25 casos (78%) y la fijacin era central en 28 casos (87%).
La OCT es la tcnica que proporciona la informacin ms precisa, ya que permite observar que el
agujero est realmente cerrado por un tejido que recubre el epitelio pigmentario y que une los bor-
des del agujero, reconstruyendo la depresin foveolar. Este tejido es sin ninguna duda neuroglial, pe-
ro la normalizacin de los bordes del agujero permite una visin yuxtacentral de buena calidad.
CONCLUSIN
La ciruga de los agujeros maculares ha progresado rpidamente desde su invencin en 1988-
89. La patogenia de la afeccin se conoce mejor a partir de los estudios con OCT e implica
una traccin vitreofoveolar. Una vitrectoma muy completa, un taponamiento interno me-
diante una gran burbuja de gas que se aplica sobre la mcula durante una semana o ms pro-
ducen una tasa de xito del 70-80%. La utilizacin de un concentrado plaquetario autlogo
puede mejorar an ms esta tasa de xito. Una intervencin relativamente precoz tambin ofre-
ce una mayor oportunidad de xito anatmico y funcional.
23
Bibliografa
1. Balazs EA. Molecular morphology of the vitreous body. In: Smelser Gk, ed.The structure of the Eye. Academic Press, New
York and London, 1961; pp. 293-310.
2. Streeten BAW, Wilsont DJ. Disorders of the vitreous. In Garner A, Klintworth GK eds. Pathobiology of ocular disease: a
dynamic approach. 2nd ed. Dekker ed, New York, 1994; pp. 701-42.
3. Theopold H, Faulborn J. Scanning electron microscopie aspects of the vitreous body. Mod. Probl. Ophthalmol. 1979; 20: 92-5.
4. Kishi S, Shimizu K. Posterior precortical vitreous pocket. Arch. Ophthalmol. 1990; 108: 979.
5. Scott JE. The Chemical Morphology of the Vitreous. Eye 1992; 6: 553-5.
6. Van der rest M. Type IX collagen. In Structure and Function of Collagen Types. Academic Press ed, New York, 1987; pp.
197-221.
7. Deguine V, Labat-Robert J, Ferrari P, et al. Viellissement du vitr oculaire. Rle de la glycattion et des radicaux libres. Path.
Biol. 1997; 45: 321-30.
8. Seery CM, Davison PF. Collagens of the bovine vitreous. Invest. Ophthalmol. Vis. Sci. 1991; 32: 1540.
9. Esser P, Heimann K, Bartz-Schmidt U. Plasminogen in proliferative vitreoretinal disorders. Br. J. Ophthalmol. 1997; 81: 590-4.
10. Webster L, Stanbury R, Chignell A, Limb GA. Vitreous intercellular adhesion molecule 1 in uveitis complicated by retinal
detachment. Br. J. Ophthalmol. 1998; 82: 438-43.
11. Hogan MJ, Alvarado JA, Weddel JE. Histology of the human eye: An atlas and textbook. WB Saunders ed. Philadelphia,
1971.
12. Bloom GD, Balazs EA. An electron microscope estudy of hyalocytes. Exp. Eye Res. 1965; 4: 249-55.
13. Osterlin SE. The synthesis of hyaluronic acid in the vitreous. I. In vivo metabolism in the owl monkey. Exp. Eye Res. 1968;
7: 524-33.
14. Osterlin SE. The synthesis of hyaluronic acid in the vitreous IV. Regeneration in the owl monkey. Exp. Eye Res. 1969, 8: 27.
15. Bleckman H. Glycosaminoglycan metabolism of cultured fibroblasts from bovine vitreous. Graefes Arch. Clin. Exp. Ophthal-
mol. 1984; 222: 90-4.
16. Jacobson B. Identification of sialyl and galactosyl transferase activities in calf vitreous hyalocytes. Curr. Eye Res. 1984; 3: 1033.
17. Sebag J. Anatomy and pathology of the vitreoretinal interface. Eye 1992; 6: 541-52.
18. Gartner J. Vitreous electron microscopie studies on the fine structure of the normal and pathologically changed vitreoretinal li-
miting membrane. Surv. Ophtalmol. 1964; 9: 291.
19. Birk DE, Zylcbard E. Collagen fibrillogenesis in situ: fibril segments are intermediates in matrix assembly. Proc. Natl Acad.
Sci. USA 1989; 86: 4549-53.
20. Foos RY. Vitreoretinal juncture: topographical variations. Invest. Ophthalmol. Vis. Sci. 1972; 13: 801-8.
21. Matsumoto B, Blanks JC, Ryann SJ. Topographie variation in the rabbit and primate internal limiting membrane. Invest.
Ophthalmol. Vis. Sci. 1984; 25: 71.
22. Heegaard S. Structure of the human vitreoretinal border region. Ophthalmologica 1994; 208: 82-91.
23. Tso MOM. Pathology of cystoid macular edema. Ophthalmology 1972; 89: 902.
24. Heegard S, Jensen OA, Prause JU. Structure of the vitreal face of the monkey optic disc (Macacca mulata): SEM in frozen re-
sin-cracked optic nerve heads supplemented by TEM and immunohistochemistry. Graefes Arch. Clin. Exp. Ophthalmol.
1988; 226: 377-83.
25. Balazs EA. Functional anatomy of the vitreous. In Duane TD, Jaeger EA eds: Biomedical Foundations of Ophthalmology,
Harper and Row ed, Philadelphia, 1982; Vol. 1; pp. 6-12.
26. Mutlu F, Leopold IH. Structure of the human retinal vascular system. Arch Ophthalmol. 1964; 71: 93.
27. Zimmerman LE, Straatsma BR. Anatomic relationships of the retina to the vitreous body and to the pigment epithelium. In
Schepens Cl, ed. Importance of the vitreous body in retina surgery with special emphasis on regeneration. CV Mosby ed., St
Louis, 1960; pp. 15-28.
28. Akiba J, Veno N, Chakrabarti B. Molecular mechanisms of posterior vitreous detachment. Graefes Arch. Clin. Exp. Opht-
halmol. 1993; 231: 408-12.
29. Kampik A, Kenyon KR, Michels RG. Epiretinal and vitreous membranes: a comparative study of 56 cases. Arch. Ophthal-
mol. 1981; 99: 445.
30. Smiddy WE, Michels RG, Green WR. Morphology, pathology, and surgery of idiopathic vitreoretinal macular disorders. Re-
tina 1990; 10: 288-96.
31. Wallow IHL, Stevens TS, Greaser ML, et al. Actin filaments in contracting preretinal membranes. Arch. Ophthalmol. 1984;
102: 1370.
E L E N V E J E C I MI E N T O D E L V T R E O Y D E L A U N I N V I T R E O R R E T I N I A N A . 2 . P a r t e
32. Kono T, Khono T, Inomata H. Epiretinal Membrane Formation. Arch. Ophthalmol. 1995; 113: 359-63.
33. Spencer LM, Foos Ry. Paravascular vitreoretinal attachments. Arch. Ophthalmol. 1970; 84: 575-4.
33bis. Wiznia RA. Posterior vitreous detachment and idiopathic preretinal macular gliosis. Am. J. Ophthalmol. 1986; 102: 196.
34. Clarkson JG, Green WR, Massof D. A histopathologic review of 168 cases of preretinal membrane. Am. J. Ophthalmol.
1977; 84: 1-17.
34bis. Boniuk M. Cystic macular edema secondary to vitreoretinal traction. Surv. Ophthalmol. 1968; 13: 118-21.
35. Folk J, Boldt C, Keenum D. Foveal cysts. Arch. Opthalmol. 1998; 116: 1177-83.
36. Smiddy WE, Michels RG, Glaser BM, de Bustros S. Vitrectomy for macular traction caused by imcomplete vitreous separa-
tion. Arch. Ophthalmol, 1988; 106: 624-8.
37. Margherio RR, Trese MT. Margherio AR, Cartright K. Surgical management of vitreomacular traction syndromes. Ophthal-
mology 1989; 96: 1437-45.
38. Kakehashi A, Kado M, Akiba J, Hirokawa H. Variations of posterior vitreous detachment. Br. J. Ophthalmol. 1997; 81: 527-32.
39. Jaffe NS. Vitreous traction at the posterior pole of the fundus due te, alterations in the vitreous posterior. Trans. Am. Acad.
Ophthalmol. Otolaryngol. 1967; 71: 642-52.
40. Maumenee AE. Further advances in the study of the macula. Arch. Ophthalmol. 1967; 78: 151-65.
41. Harbour JW, Smiddy WE, Rubsammen PE, et al. Pars plana vitrectomy for chronic pseudophakic cystoid macular edema.
Am. J. Ophthalmol. 1995; 120: 302-7.
41bis. Schepens Cl. Clinical aspects of pathologic changes in the vitreous body. Am. J. Ophthalmol. 1954; 38: 8.
42. Margherio RR, Schepens CL. Macular breaks. 1. Diagnosis, etiology, and observations. Am. J. Ophthalmol. 1972; 74: 219.
43. Avila MP, Jalkh AE, Murakami K, et al. Biomicroscopic study of the vitreous in macular breaks. Ophthalmology 1983; 90:
1277.
44. Akiba J, Quiroz MA, Trempe CL. Role of posterior vitreous detachment in idiopathic macular holes. Ophthalmology 1990;
97: 1610-3.
45. Gass JDM. Stereoscopic Atlas of Macular Diseases: Diagnosis and Treatment, 3rd ed. CV Mosby, St Louis, 1987.
46. Johnson RN, Gass JDM. Idiopathic macular holes: Observations, stages of formation and implications for surgical interven-
tion. Ophthalmology 1988; 95: 924.
47. Kishi S, Hagimura N, Shimizu K. The role of the premacular liquefied pocket and premacular vitreous cortex in idiophatic
macular hole development. Am. J. Ophthalmol. 1996; 622-8.
48. Kishi S, Kamei Y, Shimizu K. Tractional elevation of Henles fiber layer in idiopathic macular holes. Am. J. Ophthalmol.
1995; 120: 486-96.
49. Yoos HS, Brooks HL, Capone A. Ultrastructural features os tissue removed during idiophatic macular hole surgery. Am. J.
Ophtalmol. 1996; 122: 67-75.
50. Morgan CM, Schatz H. Involutional macular thinning: A premacular hole condition. Ophthalmology 1986, 93: 153.
51. Guyer DR, de Bustros S, Diener-West M, Fine SL. Observations on patients with idiopathic macular holes and cysts. Arch.
Ophthalmol. 1992; 110: 1264-8.
52. Mc Donnell PJ, Patel A, Green WR. Comparison of intracapsular and extracapsular cataract surgery: histopathologic study of
eyes obtained post mortem. Ophthalmology 1985; 92: 1208.
53. Frangieh GT, Green WR, Engel HM. A histopathologic study of macular cysts and holes. Retina 1981; 1: 311.
54. Madraperla SA, Geiger SA, Funata M, et al. Clinicopathologic correlation of a macular hole treated by cortical vitreous pee-
ling and gas tamponade. Ophtalmology 1994; 101: 682-6.
55. Fekrat S, Wendel RT, de la Cruz Z, Green WR. Clinicopathologic correlation of an epiretinal membrane associated with a
recurrent macular hole. Retina 1995; 15: 53-7.
56. Hikichi T, Fujio N, Akiba J, et al. Association between the short-term natural history of diabetic macular edema and the vi-
treomacular relationship in type II diabetes mellitus. Ophthalmology 1997; 104: 473-8.
57. Madraperla SA, Mc Cuen SA 2nd, Hickingbotham D, Green WR. Clinicopathologie correlation of surgically removed ma-
cular hole opercula. Am. J. Ophthalmol. 1995; 120: 197-207.
58. Irvine SR. A newly defined vitreous syndrome following cataract sugery; interpreted according to recent concepts of structure of
vitreous. Seventh Francis Proctor lecture. Am. J. Ophthalmol. 1953; 36: 599-619.
59. Gass JDM, Norton EW. Cystoid macular edema and papilledema following cataract extraction: A fluorescein fundoscopic and
angiographie study. Arch. Ophthalmol. 1966; 76: 646-61.
60. Gass J. Stereoscopic atlas of macular diseases. Diagnosis and treatment. CV.: Mosby Co., Saint-Louis, 1977; pp. 344-366.
25
61. Mitchell P, Smith W, Chey T, et al. Prevalence and associations of epiretinal membranes. The Blue Mountains Eye Study,
Australia. Ophthalmology 1997; 104: 1033-40.
62. Appiah AP, Hirose T. Secondary causes of premacular fibrosis. Ophthalmology 1989; 96: 389-92.
63. Clarkson J, Green W, Massof D. A histopathologic review of 168 cases of preretinal membrane. Am. J. Ophthalmol. 1977;
84: 1 -17.
64. McLeod D, Hiscott PS, Grierson I. Age-related cellular proliferation at the vitreoretinal juncture. Eye 1987; 1 (Pt 2): 263-81.
65. Jaffe NS. Macular retinopathy after separation of vitreoretinal adherence. Arch. Ophthalmol. 1967; 78: 585-91.
66. Tanenbaum HL, Schepens CL, Elzeneiny I, Freeman HM. Macular pucker following retinal detachment surgery. Arch.
Ophthalmol. 1970; 83: 286-93.
67. Machemer R. The surgical removal of epiretinal macular membranes (macular puckers). Klin. Monatsb Augenheilk 1978;
173: 36-42.
68. Roth AM, Foos RY. Surface wrinkling retinopathy in eyes enucleated at autopsy. Trans. Am. Acad. Ophthalmol. Otolaryn-
gol. 1971; 75: 1047-58.
69. Green WR, Kenyon KR, Michels RG, Gilbert HD, De La Cruz Z. Ultrastructure of epiretinal membranes causing macu-
lar pucker after retinal re-attachment surgery. Trans. Ophthalmol. Soc. UK 1979; 99: 65-77.
70. Appiah A, Hirose M, Kado M. A review of 324 cases of idiopathic premacular gliosis. Am. J. Ophthalmol. 1988; 106: 533-5.
71. Sidd RJ, Fine SL, Owens SL, Patz A. Idiopathic preretinal gliosis. Am. J. Ophthalmol. 1982; 94: 44-8.
72. Wise GN. Clinical features of idiopathic preretinal macular fibrosis. Schoenberg Lecture. Am. J. Ophthalmol. 1975; 79: 349-7.
73. Laatikainen L, Punnonen E. Idiopathic preretinal macular fibrosis in young individuals. Int. Ophthalmol. 1987; 10: 11-4.
74. Gaudric A, Cohen D. Chirurgie des membranes pimaculaires: facteurs pronostiques. J. Fr. Ophtalmol. 1992; 15: 657-68.
75. Klein R, Klein B. The epidemiology of epiretinal membranes. Trans. Am. Opthalmol. Soc. 92 vol. Rochester: Johnson Prin-
ting Company; 1994: pp. 403-429.
76. Hirokawa H, Jalkh AE, Takahashi M. et al. Role of the vitreous in idiopathic preretinal macular fibrosis. Am. J. Ophthal-
mol. 1986; 101: 166-9.
77. Enoch JM. Schwarts A, Chang D, Hirose H. Aniseikonia, metamorphopsia and perceived entoptic pattern: some effects of a
macular epiretinal membrane, and the subsequent spontaneous separation of the membrane. Ophthalmic Physiol. Optics
1995; 15: 339-43.
78. Gaudric A, Cohen D. Membranes pimaculaires. Encycl. Med. Chir. 21, 245A vol. Paris: Elsevier; 1993.
79. Hofeldt AJ, Hofeldt GT, Weiss MJ. Pulfrich psychophysical stereo-illusion and visual-evoked potentials in epiretinal membrane
of the macula. J. Neuro-Ophthalmol. 1996; 16: 36-40.
80. Bisenman WW, Joffe L. Binocular diplopia associated with retinal wrinkling. J. Ped. Ophthalmol. Strab. 1984; 21: 215-9.
81. Wilkins JR, Puliafito CA, Hee MR, et al. Characterization of epiretinal membranes using optical coherence tomography.
Ophthalmology 1996; 103: 2142-51.
82. Arroyo JG, Irvine AR. Retinal distorsion and cottonwool spots associated with epiretinal membrane contraction. Ophthalmo-
logy 1995; 102: 662-8.
83. Michels RG. Vitreous surgery for macular pucker. Am. J. Ophthalmol. 1981; 92: 628-39.
84. Stallman JB, Meyers SM. Spontaneous disappearance of white retinal changes after dissection of epiretinal macular membra-
nes. Retina 1988; 8: 165-8.
85. Gaudric A, Fardeau C, Goberville M, et al. Ablation de la membrane limitante interne, dplissement maculaire et rsultats
visuels de la chirurgie des membranes pimaculaires idiopathiques. J. Fr. Ophtalmol. 1993; 16: 571-6.
86. Trese MT, Chandler DB, Machemer R. Macular pucker. I. Prognostic criteria. Graefes Arch. Clin. Exp. Ophthalmol. 1983;
221: 12-5.
87. Scudder MJ, Eifrig DE. Spontaneous surface wrinkling retinopathy. Ann. Ophthalmol. 1975; 7: 333-6, 339-41.
88. Pesin SR, Olk RJ, Grand MG, et al. Vitrectomy for premacular fibroplasia. Prognostic factors, long-term follow-up, and time
course of visual improvement. Ophthalmology 1991; 98: 1109-14.
89. Poliner LS, Olk RJ, Grand MG, et al. Surgical management of premacular fibroplasias. Arch. Ophthalmol. 1988; 106: 761-4.
90. Maumenee AE. Further advances in the study of the macula. Arch. Ophthalmol. 1967; 78: 151-65.
91. Allen AWJ, Gass JMD. Contraction of perifoveal epiretinal membrane simulating a macular hole. Am. J. Ophthalmol. 1976;
82: 684-91.
92. Klein BR, Hiner CJ, Glaser BM, et al. Fundus photographic and fluorescein angiopraphic characteristics of pseudoholes of the
macula in eyes with epiretinal membranes. Ophthalmology 1995; 102: 768-74.
E L E N V E J E C I MI E N T O D E L V T R E O Y D E L A U N I N V I T R E O R R E T I N I A N A . 2 . P a r t e
93. Massin P, Paques M, Masri H, et al. Visual outcome of surgery for epiretinal membranes with macular pseudoholes. Ophthal-
mology 1999: 106: 580-5.
94. Massin P, Haouchine B, Paques M, Gaudric A. Optical Coherence Tomography of macular pseudoholes. 31st Meeting of the
Club Jules Gonin. Edimburg; 1998.
95. Zarbin MA, Michels RG, Green WR. Epiretinal membrane contracture associated with macular prolapse. Am. J. Ophthal-
mol. 1990; 110: 610-8.
96. Smiddy WE, Michels RG, Glaser BM, de Bustros S. Vitrectomy for macular traction caused by imcomplete vitreous separa-
tion. Arch. Ophthalmol. 1988; 106: 624-8.
97. Massin P, Erginay A, Haouchine B, et al. Results of surgery of vitreomacular traction syndromes. J. Fr. Ophthalmol. 1997;
20: 539-47.
98. Smiddy WE, Michels RG, Green WR. Morphology, pathology, and sugery of idiopathic vitreoretinal macular disorders. A re-
view. Retina 1990; 10: 288-96.
99. Smiddy W. Vitreomacular traction syndrome. In: Bovino J, ed. Macular surgery. Norwalk: Appleton and Lange; 1994: pp. 11-24.
100. Smiddy WE, Green WR, Michels RG, de la Cruz Z. Ultrastructural studies of vitreomacular traction syndrome. Am. J.
Ophthalmol. 1989; 107: 177-85.
101. Puliafito CA, Hee MR, Lin CP, et al. Imaging of macular diseases with optical coherence tomography. Ophthalmology 1995;
102: 217-29.
102. Bonnet M. Papillary hyperfluorescence caused by traction of the vitreous body. J. Fr. Ophthalmol. 1991; 14: 529-36.
103. Hirokawa H, Kado M, Yoshida A. Role of the vitreous in idiopathic preretinal macular fibrosis indicated by visual acuity in
follow-up cases. Nippon Ganka Gakkai Zasshi. Acta Societatis Ophthalmologicae Japonicae 1990; 94: 61-4.
104. Wise GN. Relationship of idiopathic preretinal macular fibrosis to posterior vitreous detachment. Am. J. Ophthalmol. 1975;
79: 358-62.
105. Wiznia RA. Posterior vitreous detachment and idiopathic preretinal macular gliosis. Am. J. Ophthalmol. 1986; 102: 196-8.
106. Foos R. The spectrum of nonvascular proliferative extraretinopathies. In: Nicholson D, ed. Ocular pathology update. New
York: Masson publishing Co; 1980: pp. 107-14.
107. Greven CM, Slusher MM, Weaver RG. Epiretinal membrane release and posterior vitreous detachment. Ophthalmology
1988; 95: 902-5.
108. Messner KH. Spontaneous separation of preretinal macular fibrosis. Am. J. Ophthalmol. 1977; 83: 9-11.
109. Paolillo RD, Burch PG. Contracture of internal surface of retina. Am. J. Ophthalmol. 1969; 67: 418-9.
110. Wiznia RA. Natural history of idiopathic preretinal macular fibrosis. Ann. Ophthalmol. 1982; 14: 876-8.
111. Messner LV, Messner SS. Idiopathic preretinal fibrosis with concurrent cystoid macular edema. J. Am. Optom. Assoc. 1987;
58: 976-8.
112. Grierson I, Hiscott P, Hitchins C, et al. Wich cells are involved in the formation of epiretinal membranes? Seminars of Opht-
halmology 1987; 2: 99-109.
113. Kampik A, Green WR, Michels RG, Nase PK. Ultrastructural features of progressive idiophatic epiretinal membrane remo-
ved by vitreous surgery. Am. J. Ophthalmol. 1980; 90: 797-809.
114. Foos RY. Vitreoretinal juncture; epiretinal membranes and vitreous. Invest. Ophthalmol. Vis. Sci. 1977; 16: 416-22.
115. Hitchins CA, Grierson I, Hiscott PS. The effects of injections of cultured fibroblasts into the rabbit vitreous. Graefes Arch.
Clin. Exp. Ophthalmol. 1985; 223: 237-49.
116. Ohsawa E, Miki T. Scanning electron microscopic observation of glial cells following xenon arc photocoagulation. Graefes
Arch. Clin. Exp. Ophthalmol. 1982; 218: 64-9.
117. Guerin CJ, Wolfshagen RW, Eifrig DE, Anderson DH. Immunocytochemical identification of Mullers glia as a component
of human epiretinal membranes (published erratum appears in Invest. Ophthalmol.Vis. Sci. 1990 Nov.; 31 (11): 2360).
Invest. Ophthalmol. Vis. Sci. 1990; 31: 1483-91.
118. Harada T, Chauvaud D, Pouliquen Y. An electron microscopic study of the epiretinal membrane of human eyes. Graefes Arch.
Klin. Exp. Ophthalmol. 1981; 215: 327-39.
119. Campochiaro PA, Jerdan JA, Glaser BM. Serum contains chemoattractants for human retinal pigment epithelial cells. Arch.
Ophthalmol. 1984; 102: 1830-3.
120. Campochiaro PA, Glaser BM. Platelet-derived growth factor is chemotactic for human retinal pigment epithelial cells. Arch.
Ophthalmol. 1985; 103: 576-9.
121. Campochiaro PA, Jerdan JA, Glaser BM, et al. Vitreous aspirates from patients with proliferative vitreoretinopathy stimula-
te retinal pigment epithelial cell migration. Arch. Ophthalmol. 1985; 103: 1403-5.
27
122. Campochiaro PA, Glaser BM. Endothelial cells release a chemoattractant for retinal pigment epithelial cells in vitro. Arch.
Ophthalmol. 1985; 103: 1876-80.
123. Vidaurri-Leal J, Hohman R, Glaser BM. Effect of vitreous on morphologic characteristics of retinal pigment epithelial cells.
A new approach to the study of proliferative vitreoretinopathy. Arch. Ophthalmol. 1984; 102: 1220-3.
124. Rowen SL, Glaser BM. Retinal pigment epithelial cells relesase a chemoattractant for astrocytes. Arch. Ophthalmol. 1985;
103: 704-7.
125. Amstrong D, Augustin AJ, Spengler R, et al. Detection of vascular endothelial growth factor and tumor necrosis factor alpha
in epiretinal membranes of proliferative diabetic retinopathy, proliferative vitreoretinopathy and macular pucker. Ophthal-
mologica 1998; 212: 410-4.
126. Chen YS, Hackett SF, Schoenfeld Cl, et al. Localisation of vascular endothelial growth factor and its receptors to cells of vas-
cular and avascular epiretinal membranes. Br. J. Ophthalmol. 1997; 81: 919-26.
127. Frank RN, Amin RH, Eliott D, et al. Basic fibroblast growth factor and vascular endothelial growth factor are present in
epiretinal and choroidal neovascular membranes. Am. J. Ophalmol. 1996; 122: 393-403.
128. Schneeberger SA, Hjelmeland LM, Tucker RP, Morse LS. Vascular endothelial growth factor and fibroblast growth factor
5 are colocalized in vascular and avascular epiretinal membranes. Am. J. Ophthalmol. 1997; 124: 447-54.
129. Mittleman D, Green WR, Michels RG, de la Cruz Z. Clinicopathologic correlation of an eye after surgical removal of an
epiretinal membrane. Retina 1989; 9: 143-7.
130. Sivalingam A, Eagle ECJ, Duker JS, et al. Visual prognosis correlated with the presence of internal-limiting membrane in
histophatologic specimens obtained from epiretinal membrane surgery. Ophthalmology 1990; 97: 1549-52.
131. Gaudric A, Massin P, Qinyuan C. An aspirating forceps to remove the posterior hyaloid in the sugery of full-thickness macu-
lar holes. Retina 1996; 16: 261-3.
132. de Bustros S, Thompson JT, Michels RG, et al. Vitrectomy for idiopathic epiretinal membranes causing macular pucker. Br.
J. Ophthalmol. 1988; 72: 692-5.
133. Mc Donald H, Aaberg T. Idiopathic epiretinal membranes. Sem. Ophthalmol. 1986; 1: 189-195.
134. Novak M. Vitrectomy for epiretinal membranes. Sem. Ophthalmol: 9: 29-46.
135. de Bustros S, Rice TA, Michels RG, et al. Vitrectomy for macular pucker. Use after treatment of retinal tears or retinal de-
tachment. Arch. Ophthalmol. 1988; 106: 758-60.
136. Rice TA, De Bustros S, Michels RG, et al. Prognostic factors in vitrectomy for epiretinal membranes of the macula. Opht-
halmology 1986; 93: 602-10.
137. Scott IU, Smiddy WE, Merikansky A, Feuer W. Vitreoretinal surgery outcomes. Impact on bilateral visual function. Opht-
halmology 1997; 104: 1041-8.
138. Haut J, Baudoin F, Le Mer Y, Colliac P. Surgery of idiopathic epiretinal macular membranes. A retrospective statistical study
of the functional result. A propos os 42 treated cases. Journal Franais dOphtalmologie 1989; 12: 81-7.
139. Smiddy WE, Maguire AM. Green WR, et al. Idiopathic epiretinal membranes. Ultrastructural characteristics and clinico-
pathologic correlation. Ophthalmology 1989; 96: 811-20 (discussion 821).
140. Margherio RR, Trese MT, Margherio AR, Cartright K. Surgical management of vitreomacular traction syndromes. Opht-
halmology 1989; 96: 1437-45.
141. McDonald HR, Johnson RN, Schatz H. Surgical results in the vitreomacular traction syndrome. Ophthalmology 1994;
101: 1397-402 (discussion 1403).
142. Melberg NS, Williams DF, Balles MW, et al. Vitrectomy for vitreomacular traction syndrome with macular detachment. Re-
tina 1995; 15: 192-7.
143. Kraushar MF, Harris MJ, Morse PH. Monochromatic endoillumination for epimacular membrane surgery. Ophthalmic Sur-
gery 1989; 20: 508-10.
144. Margherio RR, Cox MS, Jr., Trese MT, et al. Removal of epimacular membranes. Ophthalmology 1985; 92: 1075-83.
145. de Bustros S, Thompson JT, Michels RG, et al. Nuclear sclerosis after vitrectomy for idiopathic epiretinal membranes. Am.
J. Ophthalmol. 1988; 105: 160-4.
146. Grewing R, Mester U. Results of surgery for epiretinal membranes and their recurrences. Br. J. Ophthalmol. 1996; 80: 323-6.
147. McDonald HR, Verre WP, Aaberg TM. Surgical management of idiopathic epiretinal membranes. Ophthalmology 1986;
93: 978-83.
148. Kelly NE, Wendel RT. Vitreous surgery for idiopathic macular holes. Results of a pilot study [see comments]. Arch. Opht-
halmol. 1991; 109: 654-9.
149. Knapp H. Uber isolirte zerreissungen der aderhaut in folge von traumen auf dem augopfel. Arch. Augenhetlkd 1869; 1: 6-29.
E L E N V E J E C I MI E N T O D E L V T R E O Y D E L A U N I N V I T R E O R R E T I N I A N A . 2 . P a r t e
150. Kuhnt H. Ueber eine Eigenthmliche Vernderung der Netzhaut and Maculam (retinitis Atrophicans sive rareficans centra-
lis). Z. Augenheilkd 1900; 3: 105-12.
151. Coats G. The Pathology of Macular Holes. Royal London Ophtal. Hosp. Rep. 1907; 17: 69-97.
152. Fuchs E. Zur Veranderung der Macula Lutea Nach Contusion. Zitsch P Augenh 1901; 6: 181-6.
153. Theil R. Atlas der Augenkrankheiten. Leipzig Georg. Thieme Verlag 1941: 180.
154. De Schweinitz GD. Concerning certain non traumatic perforations of the macula lutea. Trans. Am. Ophthalmol. Soc. 1904;
10: 228-31.
155. Croll LJ, Croll M. Hole in the Macula. Am. J. Ophthalmol. 1960; 33: 248-53.
156. Kornzweig AL, Feldstein M. Studies of The Eye in Old Age: II. Hole in the Macula: A clinicopathologic Study. Am. J. Opht-
halmol. 1950; 33: 243-7.
157. Morgan CM, Schatz H. Involutional macular thinning. A premacular hole condition. Ophthalmology 1986; 93: 153-61.
158. Lister W. Holes in the retina and their clinical significance. Br. J. Ophthalmol. 1924; 8: 1-20.
159. Gass JD. Idiopathic senile macular hole. Its early stages and pathogenesis. Arch. Ophthalmol. 1988; 106: 629-39.
160. Yaoeda H. Clinical observation of a macular hole. Acta Soc. Ophthalmol. Jpn 1967; 71: 1723-36.
161. Fine SL. Macular hole surgery. Retina and Vitreous 1993: 173-74.
162. Klein R, Klein B. The epidemiology of epiretinal membranes. Transactions of the American Ophthalmological Society. Vol.
92. Johnson Printing Company ed, Rochester; 1994: pp. 403-29.
163. Aaberg TM, Blair CJ, Gass JMD. Macular holes. Am. J. Ophthalmol. 1970; 69: 555-62.
164. Margherio RR, Schepens CL. Macular Breaks: Diagnosis, etiology and observations. Am. J. Ophthalmol. 1972; 74: 219-32.
165. James M, Feman SS. Macular Holes. Graefes Arch. Clin. Exp. Ophthalmol. 1980; 215: 59-63.
166. Mc Donnell PJ, Fine SL, Hillis AI. Clinical features of idiopathic macular cysts and holes. Am. J. Ophthalmol. 1982; 93:
777-86.
167. Bronstein MA, Trempe CL, Freeman H. Fellow eyes of eyes with macular holes. AM. J. Ophthalmol. 1981; 92: 757-61.
168. Avila MP, Jalkh AE, Murakami K, et al. Biomicroscopic study of the vitreous in macular breaks. Ophthalmology 1983; 90:
1277-83.
169. Morgan CM, Schatz H. Idiopathic macular holes. Am. J. Ophthalmol. 1985; 99: 437-44.
170. Johnson RN, Gass JD. Idiopathic macular holes. Observations, stages of formation, and implications for surgical interven-
tion. Ophthalmology 1988; 95: 917-24.
171. Guyer DR, de Bustros S. Diener WM, Fine SL. Observations on patients with idiopathic macular holes and cysts. Arch.
Ophthalmol. 1992; 110: 1264-8.
172. Akiba J, Yoshida A, Trempe CL. Risk of developing a macular hole [see comments]. Arch. Ophthalmol. 1990; 108: 1088-90.
173. Gribomont AC, Soyer M. Evolution spontane des trous maculaires. Bull. Soc. Belge Ophtalmol. 1990; 239: 103-10.
174. The Eye Disease Case-Control Study Group. Risk factors for idiopathic macular holes. Am. J. Ophthalmol. 1994; 118:
754-61.
175. Evans JR, Schwartz SD, McHugh JD, et al. Systemic risk factors for idiopathic macular holes: a case-control study. Eye 1998;
12: 256-9.
176. Maumenee AE. Further advances in the study of the macula. Arch. Ophthalmol. 1967; 78: 151-65.
177. Jensen OM, Larsen M. Objective assessment of photoreceptor displacement and metamorphopsia: a study of macular holes.
Arch. Ophthalmol. 1998; 116: 1303-6.
178. Watzke R, Allen L. Subjective slitbeam sign for macular disease. Am. J. Ophthalmol. 1969; 68: 449-53.
179. Legargasson JF, Guez JE, Goberville M, et al. Anatomical and functional of full thickness macular holes with an SLO. In-
vest. Ophthalmol. Vis. Sci. 1994; 35: 2136.
180. Acosta F, Lashkari K, Reynaud X, et al. Characterization of functional changes in macular holes and cysts. Ophthalmology
1991; 98: 1820-3.
181. Guez JE, Legargasson JF, Rigaudire F, ORegan JK. Is there a systematic location for the pseudo-fovea in patients with cen-
tral scotoma. Vision Res. 1993; 33: 1271-9.
182. Legargasson JF, Rigaudire F, Guez JE, et al. Contribution of scanning laser ophtalmoscope (SLO) to the functional investi-
gation of subject with a macular hole. Doc. Ophthalmol. 1994; 86: 227-38.
183. Sjaarda RN, Frank DA, Glaser BM, et al. Assessment of vision in idiopathic macular holes with macular microperimetry
using the scanning laser ophthalmoscope. Ophthalmology 1993; 100: 1513-8.
29
184. Smith RG, Brimlow GM. Lea SJ, Galloway NR. Evoked responses in patients with macular holes. Doc. Ophthalmol. 1990;
75: 135-44.
185. Kato M, Nakagami T, Watanabe I. Visual evoked potentials in macular hole. Doc. Ophthalmol. 1991; 76: 341-9.
186. Johnson LN, Yee RD, Hepler RS, Martin DA. Alteration of the visual evoked potential by macular hole: comparison with
optic neuritis. Graefes Arch. Clin. Exp. Ophthalmol. 1987; 225.
187. Bass SJ, Sherman J, Bodis-Wollner I, Nath S. Visual evoked potentials in macular disease. Invest. Ophthalmol. Vis. Sci.
1985; 26: 1071-4.
188. Birch DG, Jost BF, Fish GE. The focal electroretinogram in fellow eyes of patients with idiopathic macular holes. Arch. Opht-
halmol. 1988; 106: 1558-63.
189. Sugita S, Miyake Y. The focal macular electroretinogram in idiopathic macular hole. Nippon Ganka Gakkai Zasshi 1994;
98: 609-15.
190. Kiryu J, Shahidi M, Ogura Y, et all. Illustration of the stages of idiopathic macular holes by laser biomicroscopy. Arch. Opht-
halmol. 1995; 113: 1156-60.
191. Ogura Y, Shahidi M, Mori MT, et al. Improved visualization of macular hole lesions with laser biomicroscopy. Arch. Opht-
halmol. 1991; 109: 957-61.
192. Gaudric A, Haouchine B, Massin P, et al. Macular hole formation, new data provided by optical coherence tomography. Arch.
Ophthalmol. 1999; 117: 744-51.
193. Dugel PU, Smiddy WE, Byrne SF, et al. Macular hole syndromes. Echographic findings with clinical correlation. Ophthal-
mology 1994; 101: 815-21.
194. Van Newkirk M, Gass JD, Callanan D, et al. Follow-up and ultrasonographic of patients with macular pseudo-operculum.
Am. J. Ophthalmol. 1994; 117: 13-8.
195. Hee MR, Puliafito CA, Wong C, et al. Optical coherence tomography of macular holes. Ophthalmology 1995; 102: 748-56.
196. Puliafito CA, Hee MR, Lin CP, et al. Imaging of macular diseases with optical coherence tomography. Ophthalmology 1995;
102: 217-29.
197. Hikichi T, Akiba J, Trempe CL. Effect of the vitreous on the prognosis of full-thickness idiopathic macular hole. Am. J. Opht-
halmol. 1993; 116: 273-8.
198. Guyer DR, Green WR, de Bustros S, Fine SL. Histopathologic features of idiopathic macular holes and cysts. Ophthalmo-
logy 1990; 97: 1045-51.
199. Cohen SY, Soubrane G, Coscas G. Trous maculaires. J. Fr. Ophtalmol. 1989; 12: 477-88.
200. Gass JDM. Stereoscopic Atlas of Macular diseases: Diagnosis and Treatment. 3nd ed, CV Mosby ed, St Louis 1987; 2: 684-93.
201. Gass JD. Risk of developing macular hole [see comments]. Arch. Ophthalmol. 1991; 109: 610-2.
202. Thompson JT, Hiner CJ, Glaser BM, et al. Fluorescein angiographic characteristics of macular holes before and after vitrec-
tomy with transforming growth factor beta-2. Am. J. Ophthalmol. 1994; 117: 291-301.
203. Kim JW, Freeman WR, EL-Haig W, et al. Baseline characteristics, natural history, and risk factors to progression in eyes with
stage 2 macular holes. Results from a prospective randomized clinical trial. Ophthalmology 1995; 102: 1818-29.
204. Blain P, Paques M, Massin P, et al. Epiretinal membranes surrounding idiopathic macular holes. Retina 1998; 18: 316-21.
205. Trempe CL, Weiter JJ, Furukawa H. Fellow eyes in cases of macular hole. Biomicroscopic study of the vitreous. Arch. Opht-
halmol. 1986; 104: 93-5.
206. Yuzawa M, Watanabe A, Takahashi Y, Matsui M. Observation of idiopathic full-thickness macular holes. Follow-up obser-
vation. Arch. Ophthalmol. 1994: 112: 1051-6.
207. Gass JD. Reappraisal of biomicroscopic classification of stages of development of a macular hole. Am. J. Ophthalmol. 1995;
119: 752-9.
208. Madreperla SA, McCuen BW, Hickingbotham D, Green WR. Clinicopathologic correlation of surgically removed macular
hole opercula. Am. J. Ophthalmol. 1995; 120: 197-207.
209. Ezra E, Munro PM, Charteris DG, et al. Macular hole opercula. Ultrastructural features and clinicopathological correlation
(see comments). Arch Ophthalmol. 1997; 115: 1381-7.
210. Akiba J, Quiroz MA, Trempe CL. Role of posterior vitreous detachment in idiopathic macular holes. Ophthalmology 1990;
97: 1610-3.
211. Kishi S, Yokozuka K, Kamei Y. The state of the vitreous in idiopathic macular holes. Nippon Ganka Gakkai Zasshi 1991;
95: 678-85.
212. Fisher YL, Slakter JS, Yannuzzi LA, Guyer DR. A prospective natural history study and kinetic ultrasound evaluation of idio-
pathic macular holes. Ophthalmology 1994; 101: 5-11.
E L E N V E J E C I MI E N T O D E L V T R E O Y D E L A U N I N V I T R E O R R E T I N I A N A . 2 . P a r t e
213. Kokame GT. Clinical correlation of ultrasonographic findings in macular holes. Am. J. Ophthalmol. 1995; 119: 441-51.
214. Hikichi T, Yoshida A, Akiba J, Trempe CL. Natural outcome of idiopathic macular hole. Nippon Ganka Gakkai Zasshi
1995; 99: 445-9.
215. Akiba J, Ishiko S, Hikichi T, et al. Imaging of epiretinal membranes in macular holes by scanning laser ophthalmoscopy. Am.
J. Ophthalmol. 1996; 121: 177-80.
216. Kakehashi A, Schepens CL, Trempe CL. Vitreomacular observations. I. Vitreomacular adhesion and hole in the premacu-
lar hyaloid. Ophthalmology 1994; 101: 1515-21.
217. Reese AB, Jones IS, Cooper WC. Macular Changes Secondary to Vitreous Traction. Am. J. Ophthalmol. 1967; 64: 544-49.
218. Kakehashi A, Schepens CL, Trempe CL. Vitreomacular observations. II. Data on the pathogenesis of idiopathic macular
breaks. Graefes Arch. Clin. Exp. Ophthalmol. 1996; 234: 425-33.
219. Kishi S, Kamei Y, Shimizu K. Tractional elevation of Henles fiber layer idiopathic macular holes. Am. J. Ophthalmol.
1995; 120: 486-96.
220. Asrani S, Zeimer R, Goldberg MF, Zou S. Serial optical sectioning of macular holes at different stages of development. Opht-
halmology 1998; 105: 66-77.
221. Puliafito C, Hee M, Schuman J, Fujimoto L. Optical Coherence Tomography of Ocular Diseases. Thorofare, NJ: Slack Inc; 1996.
222. Toth CA, Narayan DG, Boppart SA, et al. A comparison of retinal morphology viewed by optical coherence tomography and
by light microscopy. Arch. Ophthalmol. 1997; 115: 1425-8.
223. Foos R. Posterior vitreous detachment. Trans. Am. Acad. Ophthalmol. Otolaryngol. 1972; 76: 480-97.
224. Foos R. Ultrastructural features of posterior vitreous detachment. Graefes Arch. Clin. Exp. Ophthalmol. 1975; 196: 103-11.
225. Kishi S, Shimizu K. Posterior precortical vitreous pocket. Arch. Ophthalmol. 1990; 108: 979-82.
226. Guyer DR, Green WR. Idiopathic macular holes and precursor lesions. Retina and Vitreous 1993: 135-62.
227. Yamada E. Some structural features of the fovea centralis in the human retina. Arch. Ophthalmol. 1969; 82: 151-9.
228. Gass JDM. Idiopathic senile macular hole. Retina and Vitreous 1993: 127-33.
229. Rathschuler L, Bocca L, Terragna F, et al. Vitreous traction maculopathy. Boll. Ocul. 1988; 68: 403-407.
230. Smiddy WE, Michels RG, Glaser BM, de Bustros S. Vitrectomy for macular traction caused by incomplete vitreous separa-
tion. Arch. Ophthalmol. 1988; 106: 624-8.
231. Smiddy WE, Michels RG, Green WR. Morphology, pathology, and surgery of idiopathic vitreoretinal macular disorders. A
review. Retina 1990; 10: 288-96.
232. Massin P, Erginay A, Haouchine B, et al. Rsultats de la chirurgie dans les syndromes de traction vitromaculaire. J. Fr. Opht-
halmol. 1997; 20: 539-47.
233. Patel B, Duvall J, Tullo AB. Lamellar macular hole associated with idiopathic juxtafoveolar telangiectasia. Br. J. Ophthal-
mol. 1988; 72: 550-1.
234. Allen AWJ, Gass JMD. Contraction of perifoveal epiretinal membrane simulating a Macular Hole. Am. J. Ophthalmol.
1976; 82: 684-91.
235. Fish RH, Anand R, Izbrand DJ. Macular pseudoholes. Clinical features and accuracy of diagnosis. Ophthalmology 1992;
99: 1665-70.
236. Martinez J, Smiddy WE, Kim J, Gass JD. Differentiating macular holes from macular pseudoholes. Am. J. Ophthalmol.
1994; 117: 762-7.
237. Guez JE, Legargasson JF, Goberville M, et al. Differential diagnosis of full-thickness and pseudo macular holes with an SLO.
Invest. Ophthalmol. Vis. Sci. 1994; 35: 2135.
238. Massin P, Haouchine B, Paques M, Gaudric A. Optical Coherence Tomography of macular pseudoholes. 31st Meeting of
the Club Jules Gonin. Edimburgh; 1998.
239. Bonavia L, Mantovani A, Colombo D, DAmato L. Reversibility of a case of impending idiopathic macular hole. Ann.
Ophthalmol. Clin. Ocul. 1992; 118: 125-9.
240. Hotehama Y, Nagata A, Oinaka M. Two cases of spontaneous resolution of impending macular hole. Jpn. J. Clin. Ophta-
halmol. 1990; 44: 359-62.
241. Wiznia RA. Reversibility of the early stages of idiopathic macular holes. Am. Ophthalmol. 1989; 107: 241-5.
242. de Bustros S. Vitrectomy for prevention of macular holes. Results of a randomized multicenter clinical trial. Vitrectomy for
Prevention of Macular Hole Study Group. Ophthalmology 1994; 101: 1055-9.
243. Lewis H, Cowan GM, Straatsma BR. Apparent disappearance of a macular hole associated with development of an epireti-
nal membrane. Am. J. Ophthalmol. 1986; 102: 172-5.
31
244. Freeman WR, Azen SP, Kim JW, et al. Vitrectomy for the treatment of full-thickness stage 3 or 4 macular holes. Results of a
multicentered randomized clinical trial. The Vitrectomy for Treatment of Macular Hole Study Group. Arch. Ophthalmol.
1997; 115: 11-21.
245. Hikichi T, Trempe CL. Risk of decreased visual acuity in full-thickness idiopathic macular holes. Am. J. Ophthalmol. 1993;
116: 708-12.
246. Lewis ML, Cohen SM, Smiddy WE, Gass JD. Bilaterality of idiopathic macular holes. Graefes Arch. Clin. Exp. Opht-
halmol. 1996; 234: 241-5.
247. Ezra E, Wells JA, Gray RH, et al. Incidence of idiopathic full-thickness macular holes in fellow eyes. A 5-year prospective na-
tural history study. Ophthalmology 1998; 105: 353-9.
248. Han DP, Abrams GW, Aaberg TM. Surgical excision of the attached posterior hyaloid. Arch. Ophthalmol. 1988; 106: 998-
1000.
249. Mein CE, Flynn HJ. Recognition and removal of the posterior cornical vitreous during vitreoretinal surgery for impending
macular hole. Am. J. Ophthalmol. 1991; 111: 611-3.
250. Gaudric A, Massin P, Chen Q. An aspirating forceps to remove the posterior hyaloid in the surgery of full-thickness macular
holes. Retina 1996; 16: 261-3.
251. Campochiaro PA, Van NE, Vinores SA. Immunocytochemical labeling of cells in cortical vitreous from patients with pre-
macular hole lesions. Arch. Ophthalmol. 1992; 110: 371-7.
252. Lansing MB, Glaser BM, Liss H, et al. The effect of pars plana vitrectomy and transformings growth factor-beta 2 without
epiretinal membrane peeling on full-thickness macular holes. Ophthalmology 1993; 100: 868-71.
253. Wendel RT, Patel AC, Kelly NE, et al. Vitreous surgery for macular holes. Ophthalmology 1993; 100: 1671-6.
254. Patel AC, Wendel RT. Vitrectomy for macular hole. Semin. Ophthalmol. 1994; 9: 47-55.
255. Margherio RR, Trese MT, Martherio AR, Cartright K. Surgical Management of Vitreomacular Traction Syndromes. Opht-
halmology 1989; 96: 1437-45.
256. Chambers RB, Davidorf FH, Gresak P, Stief WT. Modified vitrectomy for impending macular holes. Ophthalmic Surg.
1991; 22: 730-4.
257. Jost BF, Hutton WL, Fuller DG, et al. Vitrectomy in eyes at risk for macular hole formation. Ophthalmology 1990; 97:
843-7.
258. Smiddy WE, Michels RG, Glaser BM, de BS. Vitrectomy for impending idiopathic holes. Am. J. Ophthalmol. 1988; 105:
371-6.
259. de Bustros S. Early stages of macular holes To treat or not to treat. Arch. Ophthalmol. 1990; 108: 1085-6.
260. Kokame GT, de Bustros S. Visual acuity as a prognostic indicator in stage I macular holes. The Vitrectomy for Prevention of
Macular Hole Study Group. Am. J. Ophthalmol. 1995; 120: 112-4.
261. Madreperla SA, Geiger GL, Funata M, et al. Clinicopathologic correlation of a macular hole treated by cortical vitreous pe-
eling and gas tamponade. Ophthalmology 1994; 101: 682-6.
262. Funata M, Wendel RT, de ICZ, Green WR. Clinicopathologic study of bilateral macular holes treated with pars plana vi-
trectomy and gas tamponade. Retina 1992; 12: 289-98.
263. Smiddy WE, Glaser BM, Thompson JT, et al. Transforming growth factor-beta 2 significantly enhances the ability to flat-
ten the rim of subretinal fluid surrounding macular holes. Preliminary anatomic results of a multicenter prospective rando-
mized study. Retina 1993; 13: 296-301.
264. Ryan EH, Jr, Gilbert HD. Results of surgical treatment of recent full-thickness idiopathic macular holes. Arch. Ophthalmol.
1994; 112: 1545-53.
265. Gaudric A, Massin P, Paques M, et al. Autologous platelet concentrate for the treatment of full-thickness macular holes. Gra-
efes Arch. Clin. Exp. Ophthalmol. 1995; 233: 549-54.
266. Orellana J, Lieberman RM. Stage III macular hole surgery. Br. J. Ophthalmol. 1993; 77: 555-8.
267. Park D, Sipperley J, Sneed S, et al. Macular hole surgery with intrernal-limiting membrane peeling and intravitreous air.
Ophthalmology 1999; 106.
268. Smiddy WE, Pimentel S, Williams GA. Macular hole surgery without using adjunctive additives. Ophthalmic Surgery And
Lasers 1997; 28: 713-7.
269. Eckardt C, Eckardt U, Groos S, et al. Removal of the internal limiting membrane in macular holes. Clinical and morpho-
logical findings. Ophthalmologe 1997; 94: 545-51.
270. Thompson JT, Smiddy WE, Williams GA, et al. Comparison of recombinant transforming growth factor-beta-2 and place-
bo as an adjunctive agent for macular hole surgery. Ophthalmology 1998; 105: 700-6.
E L E N V E J E C I MI E N T O D E L V T R E O Y D E L A U N I N V I T R E O R R E T I N I A N A . 2 . P a r t e
271. Ezra E, Gregor Z. Invest. Ophthalmol. Vis. Sci. 1999.
272. Paques M, Chastang C, Mathis A, et al. Effect of autologous platelet concentrate in surgery for idiopathic macular hole: re-
sults of a multicenter, doublemasked, randomized trial. Platelets in Macular Hole Surgery Group. Ophthalmology 1999;
106: 932-8.
273. Thompson JT, Graser BM, Sjaarda RN, et al. Effects of intraocular bubble duration in the treatment of macular holes by
vitrectomy and transforming growth factor-beta 2. Ophthalmology 1994; 101: 1195-200.
274. Glaser BM, Michels RG, Kuppermann BD, et al. Transforming growth factor-beta 2 for the treatment of full-thickness ma-
cular holes. A prospective randomized study. Ophthalmology 1992; 99: 1162-72.
275. Blumenkranz MS, Coll GE, Chang S, Morse LS. Use of autologous plasma-thrombin mixture as adjuvant therapy for ma-
cular hole. Ophthalmology 1994; 101: 769.
276. Johnson MW, Vine AK. Use f thrombin as mitogen therapy in macular hole surgery. Invest. Ophthalmol. Vis. Sci. 1995;
36: 4849.
277. Iwasaki T, Sanada A, Yamamoto K, et al. The use of tissue adhesive in treatment of macular holes. Invest. Ophthalmol. and
Vis. Sci. 1995; 36: 4848.
278. Liggett PE, Skolik SA, Horio B, et al. Human autologous serum for the treatment of full-thickness macular holes. Ophthal-
mology 1995; 102: 1071-76.
279. Garcia-Arumi J, Corcostegui B, Mateo C, et al. Surgical management of idiopathic macular holes by vitrectomy and auto-
logous serum. Communication Club Jules Gonin. Versailles, Septembre 1994.
280. Tilanus M, Deutman AF. Treatment of macular holes with Tissucol. Communication Club Jules Gonin, Versailles, Sep-
tembre 1994.
281. Sjaarda RN, Glaser BM, Thompson JT, et al. Distribution of iatrogenic retinal breaks in macular hole surgery. Ophthal-
mology 1995; 102: 1387-92.
282. Park SS, Marcus DM, Duker JS, et al. Posterior segment complications after vitrectomy for macular hole. Ophthalmology
1995; 102: 775-81.
283. Arindell EL, Abrams GW. Vitrectomy surgery for idiopathic macular holes. Retina and Vitreous 1993: 163-71.
284. Poliner LS, Tornambe PE. Retinal pigment epitheliopathy after macular hole surgery. Ophthalmology 1992; 99: 1671-7.
285. Thompson JT, Glaser BM, Sjaarda RN, Murphy RP. Progression of nuclear sclerosis and long-term visual results of vitrec-
tomy with transforming growth factor beta-2 for macular holes. Am. J. Ophthalmol. 1995; 119: 48-54.
286. Ogura Y, Kitagawa K, Ogino N. Prospective longitudinal studies on lens chanches after vitrectomy-quantitative assessment by
fluorophotometry and refractometry. Nippon Ganka Gakkai Zasshi 1993; 97: 627-31.
287. Duker JS, Wendel R, Patel AC, Puliafito CA. Late reopening of macular holes after initially successful treatment with vitre-
ous surgery. Ophthalmology 1994; 101: 1373-8.
288. Sweterlitsch LH, Sjaarda RN, Thompson JT, et al. Late recurrence of macular hole following successful vitreous surgery: in-
cidence and visual outcome. Invest. Ophthalmol. Vis. Sci. 1995; 36: 4923.
289. Paques M, Massin P, Santiago PY, et al. Late reopening of successfully treated macular holes. Br. J. Ophthalmol. 1997; 81:
658-62.
290. Del Priore LV, Kaplan HJ, Borham R. Laser photo-coagulation and fluid. Gas exchange for recurrent macular hole. Retina
1994; 14: 381-82.
291. Ie D, Glaser BM, Thompson JT, et al. Retreatment of full-thickness macular holes persisting after prior vitrectomy. A pilot
study. Ophthalmology 1993; 100: 1787-93.
292. Paques M, Massin P, Santiago PY, et al. Visual field loss after vitrectomy for full-thickness macular holes. Am. J. Ophthal-
mology 1997; 124: 88-94.
293. Pendergast SD, McCuen BWn. Visual field loss after macular hole surgery. Ophthalmology 1996; 103: 1069-77.
294. Kerrison JB, Haller JA, Elman M, Miller NR. Visual field loss following vitreous surgery. Arch. Ophthalmol. 1996; 114: 564-9.
295. Boldt HC, Munden PM, Folk JC, Mehaffey MG. Visual field defects after macular hole surgery. Am. J. Ophthalmol. 1996;
122: 371-81.
296. Ezra E, Arden GB, Riordan-Eva P, et al. Visual field loss following vitrectomy for stage 2 and 3 macular holes. Br. J. Opht-
halmol. 1996; 80: 519-25.
297. Welch JC. Dehydration injury as a possible cause of visual field defect after pars plana vitrectomy for macular hole. Am. J.
Ophthalmology 1997; 124: 698-9.
298. Ruby AJ, Williams DF, Grand MG, et al. Pars plana vitrectomy for treatment of stage 2 macular holes. Arch. Ophthalmol.
1994: 112: 359-64.
Вам также может понравиться
- Exploración OftalmologicaДокумент25 страницExploración OftalmologicaDr. AlonsoОценок пока нет
- Enfermedades Del Cristalino y GlaucomaДокумент55 страницEnfermedades Del Cristalino y GlaucomaAnonymous VqqtuR100% (1)
- Diagnóstico A Tiempo Del Glaucoma: Evaluación Del Nervio ÓpticoДокумент15 страницDiagnóstico A Tiempo Del Glaucoma: Evaluación Del Nervio ÓpticoMAJOОценок пока нет
- Agujero MacularДокумент16 страницAgujero MacularBazarMaryferОценок пока нет
- Degeneraciones No EctásicasДокумент10 страницDegeneraciones No EctásicasDarwin Quishpe100% (1)
- PAPILEDEMA1Документ40 страницPAPILEDEMA1Patricia GomezОценок пока нет
- Queratitis Por AcanthamoebaДокумент11 страницQueratitis Por Acanthamoebaつを変更するナイキОценок пока нет
- 7 Papila Excavada No GlaucomatosaДокумент27 страниц7 Papila Excavada No GlaucomatosaLeonor PérezОценок пока нет
- Agujero MacularДокумент24 страницыAgujero Macularcarlos hendrick100% (1)
- Interpretacion OctsДокумент29 страницInterpretacion OctsBegoña Molina SamosОценок пока нет
- Tomógrafo de Retina de Heidelberg (HRT) - Glaucoma IIДокумент22 страницыTomógrafo de Retina de Heidelberg (HRT) - Glaucoma IIRichardОценок пока нет
- Cap 03 Defectos de RefraccionДокумент31 страницаCap 03 Defectos de RefraccionShyannaОценок пока нет
- Oftalmopatía TiroideaДокумент17 страницOftalmopatía TiroideaJessica Pilar Arcentales VerdugoОценок пока нет
- Reflejo FotomotorДокумент10 страницReflejo FotomotorOrlando AliagaОценок пока нет
- Anexos Del Globo Ocular 2021Документ48 страницAnexos Del Globo Ocular 2021Viejo Buho100% (1)
- Tumores de Los ParpadosДокумент56 страницTumores de Los ParpadosAna Karen PeraltaОценок пока нет
- Ambliopia y EstrabismoДокумент49 страницAmbliopia y EstrabismoErick ToHu100% (1)
- Glaucoma CFNR y CCG PDFДокумент14 страницGlaucoma CFNR y CCG PDFLeila Oyarzún Juri100% (1)
- 2 Historia Clínica OftalmológicaДокумент4 страницы2 Historia Clínica OftalmológicaMaría Lucía Prieto DíazОценок пока нет
- Oftalmologia Pediatrica PDFДокумент15 страницOftalmologia Pediatrica PDFCarlos José Rey SayagoОценок пока нет
- Historia de La CatarataДокумент29 страницHistoria de La CatarataVanessa BuitragoОценок пока нет
- Celulitis OrbitariaДокумент9 страницCelulitis OrbitariaAlejandra TrillosОценок пока нет
- CATARATASДокумент10 страницCATARATASHospital Veterinario PragaОценок пока нет
- Uveítis - PILAR GRACIA AGUDO PDFДокумент22 страницыUveítis - PILAR GRACIA AGUDO PDFmdpga93Оценок пока нет
- Clase 13.3 Parálisis NuclearesДокумент9 страницClase 13.3 Parálisis NuclearesJohnatan CarmonaОценок пока нет
- Glaucoma de Células FantasmaДокумент36 страницGlaucoma de Células FantasmaRogelio Loya GallegosОценок пока нет
- Oftalmología SemiologíaДокумент30 страницOftalmología SemiologíaItsell Marie MauadОценок пока нет
- Oclusiones VascularesДокумент10 страницOclusiones VascularesSebastian EspinosaОценок пока нет
- Rechazo Corneal. Protocolo de TratamientoДокумент5 страницRechazo Corneal. Protocolo de TratamientoJose Antonio Fuentes VegaОценок пока нет
- Síndrome de Ojo SecoДокумент51 страницаSíndrome de Ojo SecoChristian Eliud Galindo SalazarОценок пока нет
- Gonios PDFДокумент20 страницGonios PDFKelly Herencia Anaya100% (1)
- Manual de OftalmologíaДокумент84 страницыManual de OftalmologíaCamii Castillo ApablazaОценок пока нет
- Caso Vision BajaДокумент31 страницаCaso Vision BajaRoger EspinozaОценок пока нет
- DVDДокумент17 страницDVDMiluska Gutierrez Jauregui100% (1)
- 30 Oftalmopediatría PDFДокумент27 страниц30 Oftalmopediatría PDFSolange ImpresionesОценок пока нет
- Catarata y Su ClasificacionДокумент15 страницCatarata y Su ClasificacionJossie Teneria100% (1)
- Pterigion BioquimicaДокумент7 страницPterigion Bioquimicarithmed5699Оценок пока нет
- QUERATITISДокумент0 страницQUERATITISNoe PaolaОценок пока нет
- Angiografia de La RetinaДокумент20 страницAngiografia de La RetinaJosé Sj100% (1)
- Glaucoma CongenitoДокумент7 страницGlaucoma CongenitoGabriela Pech CeballosОценок пока нет
- Glaucoma NeovascularДокумент7 страницGlaucoma NeovascularCoco Silva VereauОценок пока нет
- Vía VisualДокумент36 страницVía Visualamy100% (1)
- Anomalias Del Segmento AnteriorДокумент14 страницAnomalias Del Segmento Anteriorrithmed5699Оценок пока нет
- OVCR SERVactualДокумент39 страницOVCR SERVactualjochigОценок пока нет
- Angiografia Con Verde Indocianina en Enfermedades CoroidalesДокумент3 страницыAngiografia Con Verde Indocianina en Enfermedades Coroidalesarsun86Оценок пока нет
- Informe Agujero MacularДокумент10 страницInforme Agujero MacularMAGDALENA BEATRIZ LABARTHE CARVALLOОценок пока нет
- 8b EstrabismoДокумент21 страница8b EstrabismoJorge De Vera AlvaradoОценок пока нет
- Clase 12 CoroidesДокумент8 страницClase 12 CoroidesVicente Tamayo MartínezОценок пока нет
- Tomografía de Coherencia Óptica (OCT)Документ33 страницыTomografía de Coherencia Óptica (OCT)alfarhoОценок пока нет
- Glaucoma Pigmentario Expo 2013Документ40 страницGlaucoma Pigmentario Expo 2013Oscar Alberto Rojas CabanillasОценок пока нет
- Campo Visual AlteradoДокумент15 страницCampo Visual AlteradoGabriela Paz Mengoya CidОценок пока нет
- Curs Stratus OCT Var Fin Rumano TraducidoДокумент116 страницCurs Stratus OCT Var Fin Rumano TraducidoEnrique AgurtoОценок пока нет
- Enfermedad de Stargardt Con Fondo Flavimaculatus Caso ClinicoДокумент6 страницEnfermedad de Stargardt Con Fondo Flavimaculatus Caso ClinicoconriveradОценок пока нет
- Master en Optometria ClinicaДокумент30 страницMaster en Optometria ClinicaAndrea Carolina VeraОценок пока нет
- Distrofia de Conos Guia - SERV - 04Документ50 страницDistrofia de Conos Guia - SERV - 04Jorge Alejandro Aracena PerezОценок пока нет
- Tema 19 Neurofisiologia de La Vision de ColorДокумент23 страницыTema 19 Neurofisiologia de La Vision de ColorHouston Ramirez MartelОценок пока нет
- Patología Ocular en Enfermedad SistémicaДокумент36 страницPatología Ocular en Enfermedad SistémicaChristian Molina100% (1)
- Agujero Macular TraumaticoДокумент3 страницыAgujero Macular TraumaticoConstanza VillanuevaОценок пока нет
- Agujero Macular Revista UASДокумент34 страницыAgujero Macular Revista UASjesusОценок пока нет
- APILARNILДокумент2 страницыAPILARNILOrlando ValegaОценок пока нет
- Facultad de Ingeniería: Productividad Y Calidad de ObrasДокумент45 страницFacultad de Ingeniería: Productividad Y Calidad de ObrasJuan Jesús Izarra AndradeОценок пока нет
- Taller Análisis de DatosДокумент4 страницыTaller Análisis de Datossamuel marino100% (1)
- Apuntes Botanica ItfmoyaДокумент129 страницApuntes Botanica ItfmoyaTaronchaОценок пока нет
- 4° SEC. UNI 6 SEMANA 2 CYT Explica 2023 Estudiando A Los Gametos SexualesДокумент10 страниц4° SEC. UNI 6 SEMANA 2 CYT Explica 2023 Estudiando A Los Gametos SexualesDavid Arian Rojas JaraОценок пока нет
- Sesion EducativaДокумент5 страницSesion EducativaRosa Arelis Vega Blanco67% (3)
- Proyecto POMADAS DE EUCALIPTO Y LLANTENДокумент18 страницProyecto POMADAS DE EUCALIPTO Y LLANTENJOEL77% (13)
- Trabajo ComunicacionДокумент4 страницыTrabajo ComunicacionValentina GonzalezОценок пока нет
- Lista de Errores Comunes Del Lenguaje Al Enunciar Un ObjetivoДокумент3 страницыLista de Errores Comunes Del Lenguaje Al Enunciar Un ObjetivojwalbornozОценок пока нет
- Parto Detenido MINSA NicaraguaДокумент19 страницParto Detenido MINSA NicaraguaRose QuintanillaОценок пока нет
- Ciencias 1 IanДокумент5 страницCiencias 1 IanCatalina ZapataОценок пока нет
- Shell Corena S4 R 68 - MSDSДокумент16 страницShell Corena S4 R 68 - MSDStania quispe pilcoОценок пока нет
- Depuracion Rio Choqueyapu Mediante HidroponiaДокумент12 страницDepuracion Rio Choqueyapu Mediante HidroponiaLeon Lizon RomanoОценок пока нет
- Recetario de Paste 2222 PDFДокумент49 страницRecetario de Paste 2222 PDFWilmer Montoya NeyraОценок пока нет
- CAMPOSOL-Principales Plagas y Enfermedades en El Cultivo de EsparragoДокумент91 страницаCAMPOSOL-Principales Plagas y Enfermedades en El Cultivo de EsparragoFERNANDA ORTIZОценок пока нет
- Plantilla RestauranteДокумент1 страницаPlantilla RestauranteSILVIA PATRICIA OSORIO CANTILLOОценок пока нет
- Informe Visita ObraДокумент29 страницInforme Visita ObraBrandon RinconОценок пока нет
- Tarea Semana 11 - Puesta en Marcha Del Plan - 969520353Документ4 страницыTarea Semana 11 - Puesta en Marcha Del Plan - 969520353Mayra Nayely Ortiz PalaciosОценок пока нет
- Bioestrati Pisco PeruДокумент158 страницBioestrati Pisco PeruDavid Bernardo Altamirano ArevaloОценок пока нет
- Examen Microbiologico y Reporte de Control Microbiologico de Productos Farmaceuticos No Esteriles.Документ16 страницExamen Microbiologico y Reporte de Control Microbiologico de Productos Farmaceuticos No Esteriles.Josue Silva100% (2)
- 1generalidades de Los Sistemas de PotenciaДокумент92 страницы1generalidades de Los Sistemas de Potenciatamariz colque bustosОценок пока нет
- Guia Practica 03 Tipo de Sangre - LaboratorioДокумент2 страницыGuia Practica 03 Tipo de Sangre - LaboratorioSULV NOEMI ABREGU MARTINEZОценок пока нет
- Cuestionario Hongos, Algas, Protozoos, PatogenosДокумент17 страницCuestionario Hongos, Algas, Protozoos, PatogenosChela ChelitaОценок пока нет
- Derecho de Peticion Cecilia MartinДокумент5 страницDerecho de Peticion Cecilia MartinCami Y Carlos Rueda VasquezОценок пока нет
- PDF Def Poster Seden 2011Документ1 страницаPDF Def Poster Seden 2011Antonia María Fernández LuqueОценок пока нет
- Tarea 5. Atmosfera y Respiracion.Документ2 страницыTarea 5. Atmosfera y Respiracion.kermitОценок пока нет
- Propuesta de Reforma Al Sistema de SaludДокумент14 страницPropuesta de Reforma Al Sistema de Saludeduardo06064152Оценок пока нет
- Cartilla OSOCNA PDFДокумент134 страницыCartilla OSOCNA PDFszuhanОценок пока нет
- La Neuropsicología Es Una Neurociencia Conductual Que Se Encarga de Estudiar La Relación Del Cerebro y La ConductaДокумент2 страницыLa Neuropsicología Es Una Neurociencia Conductual Que Se Encarga de Estudiar La Relación Del Cerebro y La ConductaPetula Mariana Lopez ReyesОценок пока нет
- Manual Esterilizador BOECO - BTE-23DДокумент15 страницManual Esterilizador BOECO - BTE-23Draul100% (2)