Академический Документы
Профессиональный Документы
Культура Документы
Ecuación de Arrhenius
Загружено:
carina_gutiАвторское право
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документEcuación de Arrhenius
Загружено:
carina_gutiFacultad de Estudios Superiores Zaragoza, UNAM. Mdulo de Estabilidad de Medicamentos y Fisicoqumica 2. Carrera de QFB.
Batalla 5 de
mayo s/n, Colonia Ejrcito de Oriente, Mxico, DF. 09230.
De Los Santos Hernndez Roci
Asesor: M. en F. Idalia Flores Gmez , M. en F. Ma. Martha Ugalde Hernndez , I. Q. Miguel Flores Galaz, QFB Erik de los Santos Mata
OBJETIVO:
El alumno aplicar la ecuacin de Arrhenius e interpretar el grafico
correspondiente as como su uso en el calculo en la Energa de
Activacin.
INTRODUCCIN
La ecuacin de Arrhenius es una expresin matemtica que se utiliza
para establecer la dependencia de la constante de velocidad de
reaccin con respecto a la temperatura a la que se lleva a cabo.
La ecuacin fue propuesta primeramente por el qumico holands J. H.
Vant Hoff en 1884; cinco aos despus en 1889 el qumico sueco Svante
Arrhenius dio una justificacin fsica y una interpretacin para la misma.
DESARROLLO
CONCLUSIONES
La temperatura afecta la velocidad de una reaccin qumica debido a que
se incrementa la energa cintica de las especies qumicas activas que
interaccionan, de acuerdo al modelo matemtico propuesto por Arrhenius.
REFERENCIAS.
1.Gomez C. y Viruela R. Cintica. Universidad de valencia, 2009
2. Florence A y Attwood D. Physicochemical Principes of pharmacy. Pharmaceutical press. 5ta ed. 2011. p.p 119- 121
3. Martin A., Bustamante P. y Chun A. Physical Pharmacy. Lea & febiger. 4ta ed. Phidadelphia, London 1993. p.p 313-316
ECUACIN DE ARRHENIUS
La constante de la rapidez de una reaccin (k) depende tambin de la
temperatura ya que la energa cintica depende de ella. La relacin entre k
y la temperatura est dada por la ecuacin de Arrhenius que es una
expresin matemtica la cual se utiliza para comprobar la dependencia de
la constante de velocidad o cintica de una reaccin con respecto a la
temperatura
2
.
K = A e
Ea/RT
.Ecuacin Exponencial
Donde
K: Constante especifica de velocidad de reaccin (C*t
-1
t
-1
C
-1
*t
-1
)
A: factor pre-exponencial, factor de Arrhenius o factor de frecuencia (t
-1
)
Ea: Energa de activacin (Kcal/mol kJ/mol)
R: constante universal de los gases (1.987 cal/mol K 8.314 j/mol K)
T: temperatura (K)
Ln K = - Ea + Ln A . Ecuacin Lineal
RT
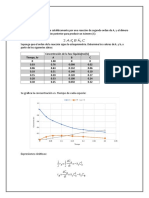
El grafico de Arrhenius muestra los logaritmos neperiano de las constantes
cinticas In(K) en el eje de las ordenadas, graficando con respecto a 1/T en
el eje de las abscisas. Este grfico se utiliza para analizar el efecto de la
temperatura en las tasas de rapidez de las reacciones qumicas.
El qumico Arrhenius sugiri que las molculas deben poseer una
mnima cantidad de energa para reaccionar. Esa energa proviene de la
energa cintica de las molculas que colisionan. La energa cintica
sirve para originar las reacciones, pero si las molculas se mueven muy
lento, las molculas solo rebotarn al chocar con otras molculas y la
reaccin no sucede. Para que reaccionen las molculas, stas deben
tener una energa cintica total que sea igual o mayor que cierto valor
mnimo de energa llamado energa de activacin (Ea barrera). Una
colisin con energa Ea o mayor, consigue que las molculas alcancen el
estado de transicin; para que se lleve a cabo la reaccin es necesario
tambin que las molculas estn orientadas correctamente
1
.
Figura 1. Reaccin Exotrmica
Figura 2. Reaccin endotrmica
Figura 3. Variacin de la constante de la velocidad con el recproco de la
temperatura absoluta, que ilustra la aplicacin de la ecuacin de Arrhenius.
Los mtodos de prueba basados en la ley de Arrhenius son vlidos slo
cuando la ruptura es un fenmeno trmico con una energa de activacin de
aproximadamente 10 a 30 kcal/mol (Kennon). Para algunas reacciones
sencillas se ha observado experimentalmente que por Cada 10 grados de
aumento en la temperatura, la velocidad de reaccin se duplicar (Regla de
Thumbs) Aplica a reacciones de descomposicin cuando estas se realicen
por efectos fotoqumicas, microbiolgicas, trmicos y/o catalizadas (por el
transporte), en la estabilidad de frmacos, medicamentos, alimentos y
cosmticos realizar un estudio a elevadas temperaturas, carece de
significatividad por la poca utilidad en la prediccin de la vida til de del
producto
3
.
Ln K = -Ea/RT + Ln A
Вам также может понравиться
- Mga 0291 Feum DisolucionДокумент14 страницMga 0291 Feum Disolucionhilifemx00100% (2)
- Quimica AnaliticaДокумент8 страницQuimica AnaliticaDaniel QuinteroОценок пока нет
- #9 Pruebas Reologicas Tecnologia FarmaceuticaДокумент9 страниц#9 Pruebas Reologicas Tecnologia FarmaceuticaVanesa condadoОценок пока нет
- Mezclado de LiquidosДокумент11 страницMezclado de LiquidosBrayanm Quispe MolinaОценок пока нет
- Manual Tecnologia Farmaceutica II Modificado 20132Документ41 страницаManual Tecnologia Farmaceutica II Modificado 20132Alberto MoralesОценок пока нет
- Metodo Luedeking - PiretДокумент23 страницыMetodo Luedeking - PiretMayte Guerrero100% (1)
- Informe 2,3-DifenilquinoxalinaДокумент6 страницInforme 2,3-DifenilquinoxalinaOscar Ramirez MartinezОценок пока нет
- Cálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaОт EverandCálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaРейтинг: 5 из 5 звезд5/5 (1)
- MGA 0041 AguaДокумент3 страницыMGA 0041 AguaAxelMagdalenoОценок пока нет
- Cuestionario U3 IdaliaДокумент8 страницCuestionario U3 IdaliaSusanaRamírezAparicioОценок пока нет
- Reporte EmulsionesДокумент30 страницReporte EmulsionesFabian SuasnávarОценок пока нет
- Determinación espectrofotométrica de Azul de TimolДокумент10 страницDeterminación espectrofotométrica de Azul de TimolAdrian Bermudez LoeraОценок пока нет
- Cuestionario Unidad Iii - Cinetica QuimicaДокумент10 страницCuestionario Unidad Iii - Cinetica QuimicaPriscilaОценок пока нет
- Manual de Laboratorio de Quimica CarДокумент113 страницManual de Laboratorio de Quimica CarRomeliaAlbertinaGamboaSolis100% (1)
- Propiedades Reológicas de Los PolvosДокумент4 страницыPropiedades Reológicas de Los PolvosAdriana MarinОценок пока нет
- 2.2 Generación de Datos Cineticos de Una Reacción QuimicadocxДокумент17 страниц2.2 Generación de Datos Cineticos de Una Reacción QuimicadocxJORDIОценок пока нет
- Granulación Via HumedaДокумент2 страницыGranulación Via HumedaAlexisBernal100% (1)
- MGA 1051 Dureza.Документ1 страницаMGA 1051 Dureza.sig100% (1)
- Farmacos SolublesДокумент17 страницFarmacos SolublesPati ObregonОценок пока нет
- Fabricación de Tabletas Por Granulación Vía Húmeda PDFДокумент58 страницFabricación de Tabletas Por Granulación Vía Húmeda PDFHernández Hernández Naima Abigail100% (1)
- 2.3 Metodos para La Determinación de La Velocidad de ReacciónДокумент20 страниц2.3 Metodos para La Determinación de La Velocidad de ReacciónJORDIОценок пока нет
- Conversion, Selectividad y RendimientoДокумент6 страницConversion, Selectividad y RendimientoMemin Morgan85% (46)
- Teoria de LindemannДокумент6 страницTeoria de LindemannCarlos CruzОценок пока нет
- Reologia de PolvosДокумент3 страницыReologia de PolvosAdriana MarinОценок пока нет
- Problemas Unidad Dos IdaliaДокумент5 страницProblemas Unidad Dos Idaliacarina_guti100% (4)
- Monografía AASДокумент1 страницаMonografía AASJaffet StakiОценок пока нет
- Reporte, Practica 2 (Polvos) .Документ8 страницReporte, Practica 2 (Polvos) .Adriana MarinОценок пока нет
- Manual 3roДокумент121 страницаManual 3roevil9BОценок пока нет
- Propiedades reológicas de los polvos: densidad aparente, compactada, índice de Carr, índice de Hausner y fluidezДокумент3 страницыPropiedades reológicas de los polvos: densidad aparente, compactada, índice de Carr, índice de Hausner y fluidezAdriana MarinОценок пока нет
- Elaboración de solución oftálmica para infecciones ocularesДокумент3 страницыElaboración de solución oftálmica para infecciones oculareslupitaОценок пока нет
- Problemas de EstabilidadДокумент2 страницыProblemas de EstabilidadM. en C. Alma Elena Ibarra Cázares100% (1)
- Práctica 2 Eq 3. Sección D02 Revisado y Corregido 1Документ19 страницPráctica 2 Eq 3. Sección D02 Revisado y Corregido 1ana jimenezОценок пока нет
- Reporte F.A (Polvos) .Документ8 страницReporte F.A (Polvos) .Adriana MarinОценок пока нет
- La Energía de ActivaciónДокумент3 страницыLa Energía de ActivaciónAnonymous ReUt4Wn100% (1)
- Determinacion de Metronidazol PDFДокумент12 страницDeterminacion de Metronidazol PDFMiguel Adrian GaonaОценок пока нет
- Reacción de MannichДокумент3 страницыReacción de MannichCristian Neftali González Martínez100% (1)
- Ciclo CatalíticoДокумент1 страницаCiclo CatalíticocarolinehwangОценок пока нет
- Practica 2: Determinación Del Coeficiente de DistribuciónДокумент7 страницPractica 2: Determinación Del Coeficiente de DistribuciónVic LightYearОценок пока нет
- DILANTINДокумент14 страницDILANTINJocelyn Meza100% (1)
- Determinación de La Entalpia, Constante de Equilibrio, Entropía y Energía de Gibbs para La Disolución de La UreaДокумент14 страницDeterminación de La Entalpia, Constante de Equilibrio, Entropía y Energía de Gibbs para La Disolución de La UreaLilian Lucy Tangara ChávezОценок пока нет
- Previa Ac 8Документ4 страницыPrevia Ac 8MattОценок пока нет
- Mga 0881. Sustancias Fácilmente CarbonizablesДокумент2 страницыMga 0881. Sustancias Fácilmente CarbonizablesFrancisco IsaíasОценок пока нет
- 32 Invertasa CinéticaДокумент14 страниц32 Invertasa CinéticaRene Garcia50% (2)
- Determinación Fenazopiridina EspectrofotometríaДокумент8 страницDeterminación Fenazopiridina Espectrofotometríaeder perezОценок пока нет
- PNO MGA 0471 Temperatura de FusionДокумент5 страницPNO MGA 0471 Temperatura de FusionJude LizowskyОценок пока нет
- Determinación de Ambroxol en tabletas por espectrofotometría UVДокумент17 страницDeterminación de Ambroxol en tabletas por espectrofotometría UVHannya CruzОценок пока нет
- Métodos Generales de AnálisisДокумент3 страницыMétodos Generales de AnálisisItz CorОценок пока нет
- Tecnologia Farmaceutica CalorДокумент29 страницTecnologia Farmaceutica CalorMedalyt Huashuayo CusiОценок пока нет
- Normatividad (MGA 0291 y 0521 FEUM, NOM-177-SSA1 y Guía de Estudios de Bioequivalencia de Medicamentos Sólidos Orales de Liberación Modificada.Документ24 страницыNormatividad (MGA 0291 y 0521 FEUM, NOM-177-SSA1 y Guía de Estudios de Bioequivalencia de Medicamentos Sólidos Orales de Liberación Modificada.Liz NietoОценок пока нет
- Control MicrobiologicoДокумент8 страницControl MicrobiologicoYair Rodriguez VillafanОценок пока нет
- Cuantificación de ParacetamolДокумент8 страницCuantificación de Paracetamolb4tipibeОценок пока нет
- Liberación controlada de medicamentosДокумент22 страницыLiberación controlada de medicamentosjesusОценок пока нет
- Laboratorio 3 QS - Sintesis AspirinaДокумент7 страницLaboratorio 3 QS - Sintesis AspirinaBren AcОценок пока нет
- Granulación HúmedaДокумент23 страницыGranulación HúmedaSergioОценок пока нет
- Práctica 3Документ2 страницыPráctica 3Sebastian TomasОценок пока нет
- Copias Del Curso de Fisico Quimica II (2016)Документ115 страницCopias Del Curso de Fisico Quimica II (2016)Israel Amaro EspinosaОценок пока нет
- Ecuacion de Arrhenius Aplicacion de La EДокумент6 страницEcuacion de Arrhenius Aplicacion de La EanaroaxОценок пока нет
- 1.3 Dependencia de La Temperatura-Cinética Química-JgalДокумент15 страниц1.3 Dependencia de La Temperatura-Cinética Química-JgalEudaldo Cime FigueroaОценок пока нет
- La Ecuación de Arrhenius y La Ecuación de VanДокумент3 страницыLa Ecuación de Arrhenius y La Ecuación de VanAndy GuzmanОценок пока нет
- Investigacion Energia de ActivacionДокумент10 страницInvestigacion Energia de ActivacionAnne AlcantaraОценок пока нет
- Ecuación de ArrheniusДокумент5 страницEcuación de ArrheniusRon RiojaОценок пока нет
- Ecuación de ArrheniusДокумент4 страницыEcuación de ArrheniusPiedriTa Jr A Alvarez100% (1)
- Factor de Frecuencia y Energia de ActivacionДокумент23 страницыFactor de Frecuencia y Energia de ActivacionArmando Van BuurenОценок пока нет
- Calendario de Lab Org 2015-2Документ1 страницаCalendario de Lab Org 2015-2carina_gutiОценок пока нет
- Problemas Unidad Dos IdaliaДокумент5 страницProblemas Unidad Dos Idaliacarina_guti100% (4)
- Calendario de Lab Qorg 2015-1Документ1 страницаCalendario de Lab Qorg 2015-1carina_gutiОценок пока нет
- Propiedades ColigativasДокумент14 страницPropiedades Coligativascarina_gutiОценок пока нет
- Regla de La PalancaДокумент4 страницыRegla de La Palancacarina_guti100% (4)
- Gráficas T Vs x1Документ5 страницGráficas T Vs x1carina_gutiОценок пока нет
- Equil L-G Solucion IdealДокумент14 страницEquil L-G Solucion Idealcarina_gutiОценок пока нет
- Contenido TemáticoДокумент4 страницыContenido Temáticocarina_gutiОценок пока нет
- Repaso Equilibrio QuimicoДокумент2 страницыRepaso Equilibrio Quimicocarina_gutiОценок пока нет
- Ejercicios Repaso Soluciones 2153Документ2 страницыEjercicios Repaso Soluciones 2153carina_gutiОценок пока нет
- General I Dad EsДокумент8 страницGeneral I Dad Escarina_gutiОценок пока нет
- Fer Color Aa Liquida SPДокумент3 страницыFer Color Aa Liquida SPcarina_gutiОценок пока нет
- Tarea2 SolucionesДокумент1 страницаTarea2 Solucionescarina_gutiОценок пока нет
- LctogenesisДокумент73 страницыLctogenesiscarina_gutiОценок пока нет
- Rio de Lab Quimorg 2014-2Документ1 страницаRio de Lab Quimorg 2014-2carina_gutiОценок пока нет
- Química Orgánica 2011-2Документ2 страницыQuímica Orgánica 2011-2carina_gutiОценок пока нет
- Tarea EstequiometriaДокумент1 страницаTarea Estequiometriacarina_gutiОценок пока нет
- Problemario Segunda UnidadДокумент3 страницыProblemario Segunda Unidadcarina_gutiОценок пока нет
- Problemario 2a UnidadДокумент3 страницыProblemario 2a Unidadcarina_gutiОценок пока нет
- Respuestas Problemario 1Документ1 страницаRespuestas Problemario 1carina_gutiОценок пока нет
- Respuestas Problemario 1Документ1 страницаRespuestas Problemario 1carina_gutiОценок пока нет
- Equipo 1 Equipo 2 0 0 0Документ2 страницыEquipo 1 Equipo 2 0 0 0carina_gutiОценок пока нет
- Tarea Equilibrio Ac-BaseДокумент1 страницаTarea Equilibrio Ac-Basecarina_gutiОценок пока нет
- Problemario Unidad IДокумент3 страницыProblemario Unidad Icarina_gutiОценок пока нет
- Calendario UNAM 2011Документ1 страницаCalendario UNAM 2011TLALPANOPTICOОценок пока нет
- Problemario 1a. ParteДокумент1 страницаProblemario 1a. Partecarina_gutiОценок пока нет
- QUÍMICA GENERAL - TEO - SEM-13 - SESIÓN-25 - 2023-2 - Cinética QuímicaДокумент42 страницыQUÍMICA GENERAL - TEO - SEM-13 - SESIÓN-25 - 2023-2 - Cinética QuímicaEnzo Carrasco YglesiasОценок пока нет
- Química UNAD tarea balanceo reaccionesДокумент11 страницQuímica UNAD tarea balanceo reaccionesNeida Florez MayorgaОценок пока нет
- Cinetica Quimica 2015 UtpДокумент20 страницCinetica Quimica 2015 UtpErick Panduro RamosОценок пока нет
- Levenspiel Capitulo 5 Tipo de Reactores QuimicosДокумент30 страницLevenspiel Capitulo 5 Tipo de Reactores QuimicosRosa Isela Rojas Hdez100% (1)
- Examen QO Unidad 3 BencenoДокумент5 страницExamen QO Unidad 3 BencenoYamilet MenfozaОценок пока нет
- S17 PPT08 EstequiometríaДокумент38 страницS17 PPT08 EstequiometríaLuisAngelMendozaVilcaОценок пока нет
- HT Balance de Reacciones Quimicas 2014-2Документ2 страницыHT Balance de Reacciones Quimicas 2014-2Joaquín A. MuñozОценок пока нет
- Tarea 9Документ7 страницTarea 9Patricia GaonaОценок пока нет
- Kiwi Ejercicio 1 BioquimicaДокумент6 страницKiwi Ejercicio 1 Bioquimicaleidy xiomara100% (1)
- Diferencias Entre Mecanismo Sn1 y Sn2Документ1 страницаDiferencias Entre Mecanismo Sn1 y Sn2Brenda Sottile100% (2)
- Efectos de La TemperaturaДокумент11 страницEfectos de La TemperaturaSinaí VictoriaОценок пока нет
- Balanceo de Ecuaciones Por El Metodo de Oxido ReduccionДокумент4 страницыBalanceo de Ecuaciones Por El Metodo de Oxido ReduccionkratosipnОценок пока нет
- 2.1 Cinetica de Las Reacciones Elementales-Cinética Química-JgalДокумент17 страниц2.1 Cinetica de Las Reacciones Elementales-Cinética Química-JgalEudaldo Cime FigueroaОценок пока нет
- Introducción a los reactores químicos: Orden de reacciones y constantes de velocidadДокумент10 страницIntroducción a los reactores químicos: Orden de reacciones y constantes de velocidadNatalia GómezОценок пока нет
- Evaluación CONSOLIDADO 2 Quimica I 2013-BДокумент3 страницыEvaluación CONSOLIDADO 2 Quimica I 2013-BJose luis Estrada malagaОценок пока нет
- Aplicaciones de Los Catalizadores en La IndustriaДокумент2 страницыAplicaciones de Los Catalizadores en La IndustriaDavid EspinosaОценок пока нет
- Practica 8.laboratorio de Fisicoquimica.Документ24 страницыPractica 8.laboratorio de Fisicoquimica.Daniela BlancoОценок пока нет
- Reacciones químicas UNAS-ArequipaДокумент23 страницыReacciones químicas UNAS-ArequipaDAYANA NACEROA VELARDE VIGILОценок пока нет
- Problema 2.3 CarberryДокумент4 страницыProblema 2.3 CarberryAbner LugoОценок пока нет
- Síntesis TetrodotoxinaДокумент4 страницыSíntesis TetrodotoxinaJuanОценок пока нет
- Ejercicios de EstequiometriaДокумент4 страницыEjercicios de EstequiometriaRafaela Pinares LinarezОценок пока нет
- TESISДокумент8 страницTESISJazmin Flores MondragónОценок пока нет
- Ejercicios Resueltos. Unidad 8 - QuímicaДокумент7 страницEjercicios Resueltos. Unidad 8 - QuímicaMax ChazzОценок пока нет
- Anexo - Tarea 3Документ9 страницAnexo - Tarea 3maicolОценок пока нет
- Estequiometría: Reacciones químicas y cálculos estequiométricosДокумент8 страницEstequiometría: Reacciones químicas y cálculos estequiométricosERIKA DORIS ARI MAMANIОценок пока нет
- Iii Examen Mecanismos de ReaccionДокумент5 страницIii Examen Mecanismos de ReaccionAlvaro Cabrera DiazОценок пока нет
- Catalisis QuímicaДокумент41 страницаCatalisis QuímicaEduar Moreno LondoñoОценок пока нет