Академический Документы
Профессиональный Документы
Культура Документы
Informe 1 Termo
Загружено:
Lissett Vera CárdenasИсходное описание:
Оригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Informe 1 Termo
Загружено:
Lissett Vera CárdenasАвторское право:
Доступные форматы
I n f o r m e d e Q U I M 1 5 5 | 1
Universidad Austral de Chile
Facultad de Ciencias
Instituto de Qumica
Informe Prctico;
Profesora; Elizabeth Rincn
Asignatura; QUIM 155
Alumnas; Carmina Vjar V. y Lissett Vera C.
Qumica y Farmacia
Universidad Austral de Chile
I n f o r m e d e Q U I M 1 5 5 | 2
Descripcin del Experimento
Objetivo del experimento;
El objetivo de este estudio es determinar las funciones termodinmicas (G, H, S) que
permiten analizar el efecto de la estructura del cido sobre su disociacin en agua. Durante el
practico distintos grupos analizarn 4 cidos; el cido Actico, el cido Cloro Actico, el cido
DiCloro Actico y el cido TriCloro Actico.
El que se analizara a continuacin y el cual corresponde a nuestro grupo es el cido Cloro
Actico.
El experimento se llevo a cabo en dos sesiones:
Primera sesin;
En la primera sesin se prepar una solucin de NaOH con una concentracin de 1.00 M
aproximadamente, la cual fue estandarizada con una solucin de HCl 1.044 M, obtenindose la
molaridad de NaOH obtenida.
Segunda sesin;
La segunda sesin se trabaj en dos partes:
Parte 1;
Se prepar una solucin de cido cloro Actico con una concentracin aproximada de
1.00 M;
Luego se realiz una titulacin de una alcuota de 15 mL del cido recientemente
preparado con la base NaOH estandarizada (0.994 M) que se encuentra en la bureta. A medida
que se iba realizando la titulacin se fue registrando el pH medido, con
un pH-metro previamente calibrado.
La titulacin es realizada para as poder hacer un grafico de pH
v
/
s
V
NaOH
y as determinar la K
a
, para posteriormente encontrar el valor
de G
I
Gramos = 1.00 M x 94,50
g
/
mol
x 0,1 L
Gramos = 9,45 g de CH
2
ClCOOH (cristales)
Gramos = 1.00 M x 40,00
g
/
mol
x 0,2 L
Gramos = 8,00 g de NaOH
I n f o r m e d e Q U I M 1 5 5 | 3
C
HCl
x V
HCl
= C
NaOH
x V
NaOH
1.044 M x 15.0 mL = C
NaOH
x 15.75 mL
C
NaOH
= 0.994 M
C
cido
x V
cido
= C
NaOH
x V
NaOH
C
cido
x 15.0 mL = 0.994 M x 14.65 mL
C
cido
= 0. 971 M
Parte 2;
En esta seccin del experimento se peso 50 mL de CH
2
ClCOOH en una balanza y se le
midi la temperatura inicial, lo mismo se realiz con 50 mL de NaOH.
Luego los 50 mL de CH
2
ClCOOH se hicieron reaccionar con 50 mL de
NaOH (en un termo con termmetro, que acta como calormetro), y se
espera que la temperatura se estabilice.
Con estos resultados se deduce la H
n
Conociendo los valores de H
n
y de G
i
se puede determinar el valor de TS.
Tratamiento de los datos y Resultados
Primera sesin;
Estandarizacin de NaOH con HCl:
Segunda sesin;
Parte 1:
Titulacin cido-Base:
Concentracin del cido
Al titular la alcuota de 15 mL de
cido podemos inferir la
concentracin de ste de la
siguiente manera:
I n f o r m e d e Q U I M 1 5 5 | 4
Vol. = 14,65 ml NaOH = 7,325 ml de NaOH
2
pH = 2,75
Segn la definicin de pK
a
;
K
a
= 10
-2,75
= 1.773 x 10
-3
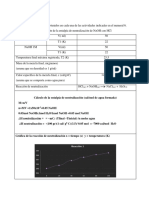
Tabulacin del pH obtenido en la titulacin
K
a
A partir de lo anterior podemos calcular el K
a
a partir
del pKa (pH cuando se ha agregado la mitad de NaOH que se
necesita para llegar al punto de equivalencia), as tenemos:
Punto de equilibrio en 14,65 ml de NaOH;
G
i
A continuacin se puede calcular el valor de G
i
;
Siendo:
R = 1.987 cal / mol K
T = 298K
Ka = 1.773x10
-3
0
2
4
6
8
10
12
14
0 5 10 15 20
p
H
Volumen de NaOH
pH v/s V NaOH
Volumen de NaOH (mL) pH obtenido
1.0 mL 2.05
2.0 mL 2.12
3.0 mL 2.24
4.0 mL 2.36
5.0 mL 2.47
6.0 mL 2.59
7.0 mL 2.70
8.0 mL 2.80
9.0 mL 2.94
10.0 mL 3.06
11.0 mL 3.21
12.0 mL 3.38
12.5 mL 3.50
13.0 mL 3.62
13.5 mL 3.77
14.0 mL 4.04
14.5 mL 4.62
14.6 mL 5.37
14.7 mL 9.57
14.8 mL 10.84
14.9 mL 11.14
15.0 mL 11.30
15.1 mL 11.41
15.2 mL 11.48
15.3 mL 11.55
15.4 mL 11.61
15.5 mL 11.65
16.0 mL 11.80
16.5 mL 11.90
G
i
= -RTlnKa
G
i
= -RTlnKa
G
i
= -1.987
cal
/
molK
x 298K x ln1.773x10
-3
G
i
= 3,752 Kcal / mol
K
A
= 10
-pH
I n f o r m e d e Q U I M 1 5 5 | 5
q
p
= m x C
p
x T = 103,74 g x 1 cal(gK) x (292,3 K 285,5 K)
q
p
= 705,432 cal
n = C
CH2ClCOOH
x V
CH2ClCOOH
= 0,971 M x 0,05 L
n = 0,0486 moles
H
N
= -705,432 / 0,0486
H
N
= -14,52 kcal/mol
Parte 2;
Reaccin en el calormetro:
Entalpa H
i
Donde:
Ya que:
Para el numero de moles,
tenemos en cuenta que
la concentracin del
cido es 0.971 M y que
se midi una alcuota de
50 mL, a partir de esto se
determina que es el
reactivo limitante de la
neutralizacin (menor
concentracin).
De este modo:
CH2ClCOOH NaOH total
Concentracin 0,971 M 0,994 M
Masa (g) 51,62 g 52,12 g 103.74 g
Temperatura Inicial (K) 285 K 286 K 285.5 K
Temperatura Final (K) 292.3 K
H
I
=
HI
/
(Ci x)
H
I
= H
N
+ 13,34 kcal/mol
H
N
=
-qp
/
n
H
I
= H
N
+ 13,34 kcal/mol
H
I
= -14,52 kcal/mol + 13,34 kcal/mol
H
I
= -1,18 kcal/mol
I n f o r m e d e Q U I M 1 5 5 | 6
Ahora bien, el clculo de entalpa
cuando existen molculas de cido
disociado es:
Para encontrar x
procederemos de la siguiente forma;
CH
2
ClCOOH CH
2
ClCOO
-
+ H
+
Inicial Ci - -
Final Ci- x x x
Sabemos que;
Sea:
Ci = 0.971M
K = 1.773 x 10
-3
Teniendo todas las incgnitas;
H
I
=
HI
/
(Ci x)
K = x
2
/ (C
i
- x)
X
2
+Kx Ci K = 0
Resolviendo a travs de
Se obtiene que x = 0,0406
Por tanto (C
i
x) = 0,9304
H
i
= -1,18 kcal/mol
0,9304
H
i
= -1,2683 Kcal/mol
I n f o r m e d e Q U I M 1 5 5 | 7
% de Ionizacin
Sea:
X = 0,0406
C
i
= 0,971 M
Entropa
Despejamos TS
i
;
Sean:
G
i
= 3,752 Kcal/mol
H
i
= -1,2683 Kcal/mol
Comparacin con datos tabulados del cido Cloro Actico
1,00 M 0,971 M
K 1,6 x 10
-3
1,773 x 10
-3
% ionizado 3,9 4,18
G
I
(kcal/mol) 3,82 3,752
H
N
(kcal/mol) -15,6 -14,52
H
I
(kcal/mol) -2,3 -1,18
H
I
(kcal/mol) -2,4 -1,2683
TS
I
(kcal/mol) -6,2 -5,0203
% ionizacin = X x 100
C
i
% ionizacin = 0,0406 x 100
0,971
% ionizacin = 4,18% de cido disociado
G
i
= H
i
- TS
i
TS
i
= H
i
- G
i
TS
i
= (-1,2683 - 3,752) Kcal/mol
TS
i
= - 5,0203 kcal/mol
I n f o r m e d e Q U I M 1 5 5 | 8
Conclusiones
Como se especifico al principio, el experimento en laboratorio consisti en analizar la
termodinmica de la reaccin del cido Actico, el cido Cloro Actico, el cido DiCloro Actico y
el cido TriCloro Actico, comprobando las 3 funciones termodinmicas; G, H, S.
De esta manera segn la bibliografa los datos tabulados para los 4 cidos a concentracin
de 1 M son;
1,00 M
CH
3
COOH
1,00 M
CH
2
ClCOOH
1,00 M
CHCl
2
COOH
1,00 M
CCl
3
COOH
K
a
2,2x10
-5
1,6x10
-3
3,6x10
-2
2,0x10
-1
% ionizacin 0,47 3,9 24 36
G
I
(kcal/mol) 6,36 3,82 1,96 0,94
H
N
(kcal/mol) -13,9 -15,6 -15,4 -15,4
H
I
(kcal/mol) -0,6 -2,3 -2,1 -2,1
H
I
(kcal/mol) -0,6 -2,4 -2,8 -3,3
TS
I
(kcal/mol) -7,0 -6,2 -4,8 -4,2
Y los siguientes datos han sido obtenidos a travs de los experimentos realizados para
cada cido;
0,97 M
CH
3
COOH
0,971 M
CH2ClCOOH
0,5012 M
CHCl
2
COOH
0,9769 M
CCl
3
COOH
K
a
2,14 x 10
-5
1,773 x 10
-3
17,378 x 10
-3
0,048
% ionizado 0,48% 4,18 17,04% 20
G
I
(kcal/mol) 6,37 3,751 2,307017564 1,79
H
N
(kcal/mol) -8,73810 -14,52 -7,148045 -16,66
H
I
(kcal/mol) 4,6019 -1,18 -6,191955 -4,24
H
I
(kcal/mol) 4,76 -1,27 -7,463783751 -4,24
TS
I
(kcal/mol) -1,61 - 5,019 -5,153360811 - 6,04
I n f o r m e d e Q U I M 1 5 5 | 9
Habiendo obtenido todos estos datos durante la experiencia en laboratorio podemos
concluir que;
La presencia de los tomos de cloro en la molcula favorece la disociacin del cido, lo que
puede inferirse del valor de K y del porcentaje de ionizacin, el que es muchsimo ms alto en
el cido tricloro actico, que contiene tres tomos de cloro, y es ms bajo en el cido actico,
que no presenta cloro en su estructura.
Debido a la gran disociacin del cido tricloro actico, podemos concluir que ste es el ms
fuerte de los tres, pues libera mayor cantidad de protones. Le siguen el cido dicloro actico, el
cloro actico y el actico en ese orden. Por ello podemos decir que el cido se hace ms fuerte
al contener mayor cantidad de cloros.
Es posible concluir, a partir de los valores de la energa libre de Gibbs, que las disociaciones de
los cidos actico, cloro actico y dicloro actico son procesos no espontneos, mientras que
el cido tricloro actico se acerca ms al equilibrio, que ocurre en G
I
= 0. Por ello decimos
que la presencia de tomos de cloro aumenta la espontaneidad de la reaccin de ionizacin.
La entalpa de las reacciones de ionizacin con cada uno de los cidos result un valor
negativo, esto significa que la reaccin libera energa al medio ambiente, es decir,
corresponden a proceso exotrmicos. De los datos tabulados se puede concluir que H
I
disminuye a mayor cantidad de tomos de cloro en la molcula, esto se traduce en una mayor
liberacin de energa al medio.
I n f o r m e d e Q U I M 1 5 5 | 10
Posibles fuentes de errores;
Las posibles fuentes de error de los clculos realizados pueden deberse a mltiples
factores;
Durante la preparacin del NaOH en la primera parte del laboratorio, puede haberse
cometido varios errores, como por ejemplo al medir los gramos en la balanza o haber aforado
de forma equivocada en el matraz, conduciendo a una concentracin errnea.
Durante la estandarizacin del NaOH con HCl, pudo haber errores en la lectura de la bureta o
en la determinacin del punto final.
Al preparar el cido cloro actico se puede haber cometido los mismos errores antes
mencionados: durante la medicin de masa en la balanza, al aforar o al valorar.
Como no se ley la temperatura al momento de realizar el proceso, necesaria para calcular
G
i
, pudo obtenerse volmenes de valoracin con cierto grado de variacin.
Si el calormetro estaba mal lavado, la temperatura al final de la reaccin podra haber
variado. Adems pudo producirse una prdida de cido al trasvasijar desde el vaso de
precipitado al interior del calormetro. Una mala lectura del termmetro puede haber
ocasionado un error en los clculos.
Al estar mal calibrado, el pHmetro podra haber dado una lectura errnea, conduciendo a
una curva de calibracin alterada, lo que llevara a un clculo mal realizado de Ka.
I n f o r m e d e Q U I M 1 5 5 | 11
Bibliografa;
Thermodynamics of the ionization of Acetic and Chloroacetic Acids, H.A. Neidig
and R. T. Yingling, Lebanon Valley college, Annville Pennsylvania.
*Journal of Chemical Education Vol. 42, pg 484 (1965)+
Fisico Qumica, Castellan G., pg 138-140-106-212
Вам также может понравиться
- Acido-Acetico Imprimir NocheДокумент8 страницAcido-Acetico Imprimir NocheAbby VásquezОценок пока нет
- Calordeneutralizaci N 2Документ9 страницCalordeneutralizaci N 2Laura Bustamante CalleОценок пока нет
- Informe P2Документ10 страницInforme P2veronica RodriguezОценок пока нет
- Análisis Completo Del AguaДокумент16 страницAnálisis Completo Del AguaMariel BazánОценок пока нет
- Calor de Neutralizacion y de Solucion 1Документ8 страницCalor de Neutralizacion y de Solucion 1Paola SolórzanoОценок пока нет
- Neutralizacion de 03Документ9 страницNeutralizacion de 03Angel Esmit Roca LaurenteОценок пока нет
- Laboratorio 9 Determinacion de La Constante KpsДокумент6 страницLaboratorio 9 Determinacion de La Constante KpsDavid Fernando CipamochaОценок пока нет
- Química TermoquímicaДокумент9 страницQuímica TermoquímicaShalОценок пока нет
- 20092sicq000185 1Документ10 страниц20092sicq000185 1Luis VacaОценок пока нет
- Informe 4Документ16 страницInforme 4Sandra Maldonado PerezОценок пока нет
- Informe Fisicoquimik CALOR DE NEUTRALIZACIÓNДокумент13 страницInforme Fisicoquimik CALOR DE NEUTRALIZACIÓNCristian DiazОценок пока нет
- FQ GNo Rep5 EQ 4Документ12 страницFQ GNo Rep5 EQ 4jose ramonОценок пока нет
- Analis de Agua Labo Aq Informe Labo 6Документ17 страницAnalis de Agua Labo Aq Informe Labo 6EDITH CAROL SUCAPUCA ESPIRITUОценок пока нет
- Calor de NeutralizaciónДокумент5 страницCalor de NeutralizaciónMaribel CallaОценок пока нет
- Titulacion Potenciometrica de Acido ClorhidricoДокумент6 страницTitulacion Potenciometrica de Acido ClorhidricoYUBER SANTOS INQUILLAОценок пока нет
- FICOДокумент8 страницFICOluis ala valenciaОценок пока нет
- Ejercicios MejoramientoДокумент4 страницыEjercicios MejoramientoLuis Vaca100% (1)
- Solubilidad Del Ácido Benzóico y Determinación de Entalpía de Solución.Документ10 страницSolubilidad Del Ácido Benzóico y Determinación de Entalpía de Solución.Oscar Portillo100% (1)
- INFORME 7 QuímicaДокумент11 страницINFORME 7 QuímicaCielomarycris VargasОценок пока нет
- Solubilidad y PrecipitacionДокумент4 страницыSolubilidad y PrecipitacionCecilia PalaciosОценок пока нет
- Informe de Laboratorio N°4 TermodinámicaДокумент17 страницInforme de Laboratorio N°4 TermodinámicaRoger LopezОценок пока нет
- Ejercicios de PH y Tampones ResueltosДокумент16 страницEjercicios de PH y Tampones ResueltosCAMILA MELINA CARRION VEGAОценок пока нет
- G3 - SG3 - Informe Determinación Del KPS Del Bitartrato de PotasioДокумент12 страницG3 - SG3 - Informe Determinación Del KPS Del Bitartrato de PotasioLEONARDO ALCIDES ROMERO ZAPANAОценок пока нет
- Cuestionario N5Документ3 страницыCuestionario N5Marcos CusiОценок пока нет
- TEMA 7 Propiedades Coligativas de Las DisolucionesДокумент11 страницTEMA 7 Propiedades Coligativas de Las DisolucionesDavid DeelavillaОценок пока нет
- Análisis Completo de AguaДокумент12 страницAnálisis Completo de AguaKevin RojasОценок пока нет
- Determinacion de La Dencidad y PM CO2Документ6 страницDeterminacion de La Dencidad y PM CO2lorenaОценок пока нет
- Conclusiones, Recomendaciones y Cuestionario - Laboratorio 2 de FisicoquímicaДокумент8 страницConclusiones, Recomendaciones y Cuestionario - Laboratorio 2 de FisicoquímicaMaria AlessandraОценок пока нет
- Informe 5Документ6 страницInforme 5Nahomi Mina RomeroОценок пока нет
- ESTEQUIOMETRIAДокумент15 страницESTEQUIOMETRIAGc DuránОценок пока нет
- PRACTICA de Calorimetria IIIДокумент6 страницPRACTICA de Calorimetria IIIalexander ruelas zapata0% (1)
- LABO3. Calor de NeutralizaciónДокумент7 страницLABO3. Calor de NeutralizaciónDebbieRuestaОценок пока нет
- Sesión 3 TareaДокумент3 страницыSesión 3 TareaXimena AcОценок пока нет
- Examen RecuperacionДокумент7 страницExamen RecuperacionSamuel LPОценок пока нет
- Calor de Disolución Del Carbonato de Sodio Palma Sánchez Luis EnriqueДокумент10 страницCalor de Disolución Del Carbonato de Sodio Palma Sánchez Luis EnriqueEnrique Palma Sánchez100% (1)
- INFORME-7Документ7 страницINFORME-7AnaisBriggitJacintoChavezОценок пока нет
- Labs de AnáliticaДокумент34 страницыLabs de AnáliticaGiovanny Josue Jarquin Acuña100% (1)
- Informe 5 de Lab. de FisicoquimicaДокумент9 страницInforme 5 de Lab. de FisicoquimicaElmer AlvaradoОценок пока нет
- 1 Bloque de Ejercicios 2020-2Документ4 страницы1 Bloque de Ejercicios 2020-2Isabella Vargas Marin0% (1)
- Determinacion de Carbonato de Calcio Mediante Una Titulacion en RetrocesoДокумент6 страницDeterminacion de Carbonato de Calcio Mediante Una Titulacion en RetrocesoWilmer José Urrutia Orozco33% (6)
- Hidrolisis Del Acetato de EtiloДокумент9 страницHidrolisis Del Acetato de EtiloAlexander Yauri GomezОценок пока нет
- Estequiometria y Propiedades de Los GasesДокумент8 страницEstequiometria y Propiedades de Los GasesMaria Alejandra Martinez Florez0% (1)
- Carolimetria A Presion ConstanteДокумент9 страницCarolimetria A Presion ConstanteLuis Miguel Pauca ChoquehuaytaОценок пока нет
- SOLUCIONARIO TALLER 2 GasesДокумент4 страницыSOLUCIONARIO TALLER 2 GasesMelani SuárezОценок пока нет
- Practica #15 Estudio de Estequiometria de Reacciones Donde Intervienen Sistemas GaseososДокумент7 страницPractica #15 Estudio de Estequiometria de Reacciones Donde Intervienen Sistemas GaseososJorly TorresОценок пока нет
- Kps Del Caoh2Документ9 страницKps Del Caoh2evil9BОценок пока нет
- Determinacion de Carbonato de Calcio Mediante RetrocesoДокумент8 страницDeterminacion de Carbonato de Calcio Mediante RetrocesolorenaОценок пока нет
- Propiedades Coligativas de Las SolucionesДокумент25 страницPropiedades Coligativas de Las SolucionesMaríaОценок пока нет
- Practica 14Документ5 страницPractica 14jonatika_nickjoekevin60% (5)
- Carolimetria A Presion ConstanteДокумент9 страницCarolimetria A Presion Constanteandrea chОценок пока нет
- Calor de NeutralizacionДокумент11 страницCalor de NeutralizacionErik Anchivilca ZavaletaОценок пока нет
- Informe 5Документ7 страницInforme 5Jose Yeison Urquijo HernandezОценок пока нет
- TP 2 QuímicaДокумент7 страницTP 2 QuímicaMartin CasasОценок пока нет
- ESTEQUIOMETRIAДокумент8 страницESTEQUIOMETRIASheyla TRОценок пока нет
- Práctica N°6 Analisis QuimicoДокумент6 страницPráctica N°6 Analisis QuimicoCintbya Ccencho GaribayОценок пока нет
- Equilibrio AcidoДокумент13 страницEquilibrio AcidoAmelia WebsterОценок пока нет
- TERMOQUIMICA InformeДокумент15 страницTERMOQUIMICA InformeWALTHERSITOОценок пока нет
- Coleccion de Ejercicios Con SolucionДокумент179 страницColeccion de Ejercicios Con SolucionacobosaОценок пока нет
- Ingeniería química. Soluciones a los problemas del tomo IОт EverandIngeniería química. Soluciones a los problemas del tomo IОценок пока нет
- HongosДокумент11 страницHongosLissett Vera CárdenasОценок пока нет
- Platelmintos y Nematodos TisularesДокумент6 страницPlatelmintos y Nematodos TisularesLissett Vera Cárdenas100% (1)
- Metodos de Diagnostico PDFДокумент10 страницMetodos de Diagnostico PDFLissett Vera CárdenasОценок пока нет
- Clase Parasito 20 - 16-01-12Документ13 страницClase Parasito 20 - 16-01-12Lissett Vera CárdenasОценок пока нет
- Volumen EspecificosДокумент4 страницыVolumen EspecificosFrancisco Javier Frias JimenezОценок пока нет
- Proyecto de Movimiento - Jhomar JaraДокумент19 страницProyecto de Movimiento - Jhomar JaraJhomar Jara del RosarioОценок пока нет
- Transporte de Membrana PsuДокумент26 страницTransporte de Membrana PsuRomina CamposОценок пока нет
- Pract #4 EmulsionesДокумент9 страницPract #4 EmulsionesDaniel Camilo BustosОценок пока нет
- Laboratorio de Fisica 6Документ28 страницLaboratorio de Fisica 6Diego RodriguezОценок пока нет
- Mezclas GruesasДокумент5 страницMezclas GruesasDaniela VanegasОценок пока нет
- Transporte A Nivel CelularДокумент4 страницыTransporte A Nivel CelularKatherineОценок пока нет
- Medios ContinuosДокумент11 страницMedios ContinuosDavid UchihaОценок пока нет
- CV - Juan C Garay HДокумент6 страницCV - Juan C Garay HCarlitos JesusОценок пока нет
- Clasificacion de La Nubes PareidoliasДокумент18 страницClasificacion de La Nubes PareidoliasCarLos MoyaaОценок пока нет
- Exposicion 2 Estocasticos - Modelos de Colas MM1Документ42 страницыExposicion 2 Estocasticos - Modelos de Colas MM1Richard MeloОценок пока нет
- Estudio de Suelos Real Felipe (Q 1.97)Документ16 страницEstudio de Suelos Real Felipe (Q 1.97)pyxis_mlОценок пока нет
- Diseno de Torres de Absorcion de PlatosДокумент29 страницDiseno de Torres de Absorcion de PlatosCesarIsacupe100% (1)
- 8practica EstaticaДокумент3 страницы8practica EstaticaBeto Huaman CastroОценок пока нет
- Tarea para El Segundo Parcial Sección PДокумент3 страницыTarea para El Segundo Parcial Sección PEduardo Velásquez0% (1)
- Manual Motor San Remo RecuperadoДокумент68 страницManual Motor San Remo RecuperadoDarlyn Iñiguez67% (6)
- Problemas de Hidrostatica - ResueltosДокумент4 страницыProblemas de Hidrostatica - ResueltosJuanma BarriosОценок пока нет
- TERMO CAP15 RefrigeraciónДокумент56 страницTERMO CAP15 RefrigeraciónSergio Alexis ValleОценок пока нет
- 1.-Tema 2 PDFДокумент34 страницы1.-Tema 2 PDFGofoy SamrtОценок пока нет
- Microcapsulas Seqüest PDFДокумент5 страницMicrocapsulas Seqüest PDFDafne CarolinaОценок пока нет
- Primer Parcial Química 1Документ3 страницыPrimer Parcial Química 1Rob Car100% (1)
- SRCVДокумент50 страницSRCVCarlosGordillo100% (1)
- Extracto - Modelo de ManderДокумент4 страницыExtracto - Modelo de ManderRamon Gutierrez0% (1)
- Comportamiento de Componentes Ohmicos, No OhmicosДокумент9 страницComportamiento de Componentes Ohmicos, No OhmicosDertobal100% (7)
- Evaluacion Diag. QuimicaДокумент1 страницаEvaluacion Diag. QuimicaAmira RochaОценок пока нет
- Factor de Riesgo IluminaciónДокумент33 страницыFactor de Riesgo IluminaciónMANUELОценок пока нет
- Manual Oper'n. SolarДокумент57 страницManual Oper'n. SolarJose Notario TorresОценок пока нет
- Radiología OdontológicaДокумент2 страницыRadiología Odontológicaorozco blackpool980% (1)
- SociologíaДокумент7 страницSociologíaTaniaОценок пока нет
- Electricidad EstaticaДокумент2 страницыElectricidad Estaticamarcomota50% (2)