Академический Документы
Профессиональный Документы
Культура Документы
Alexandra Pag 1final2014
Загружено:
Antonella HuizafАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Alexandra Pag 1final2014
Загружено:
Antonella HuizafАвторское право:
Доступные форматы
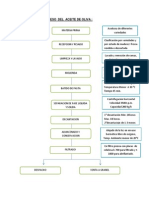
EVAPORACION
Operacin unitaria donde se elimina parte del solvente de una solucin con el fin de concentrar y as reducir su
volumen y bajar costo de transporte empacado y almacenaje o tambin incrementar sus solidos solubles y ayudar la
conservacin del producto (solucin) caso leche condensado o fabricacin mermelada. La evaporacin se realiza en
equipos llamadas evaporadores se realiza en equipos llamados evaporadores siendo los tradicionales los de tubos
horizontales y modernos los de tubos verticales
Para evaporar una solucin hay que ebullir y hay factores que influyen en la ebullicin cuando se trata de una solucin
(sustancia compuesta) o de una sustancia pura.
FACTORES INFLUYEN EN LAA EBULLICION DE UN LIQUIDO
a) PRESION EXTERNA AL LIQUIDO: un lquido puro o compuesto (solucin) hierve si su PVH= P externa. En
evaporadores las solucin que entrar a los mismos son bastante diluidos; es decir tienen gran cantidad de
H2O como es el caso de soluciones alimenticias de all que para facilitar clculos muchas veces se asume
que una solucion se comporta como si fuera el H2O si se considera esto entonces se puede usar la tabla de
vapor de H2O para encontrar la presin de saturacin y la T de saturacin de la solucion en una tabla de
vapor .Que son P y T de ebullicin. En la vida real la T de ebullicin de la solucion sube a medida que esta
se [] comportndose en forma diferente al comportamiento de la agua
b) ELEVACION DE T ebullicin DE LA SOLUCION A SU SOLUTO
A medicin que avanza la evapoacion su T de ebullicin tiende a subir esto conduce a una disminucin
progresiva de la diferencia de Tsuqe hay entre el agente calefactor y la solucion del evaporador que es la
fuerza matriz que hace posible la evaporacin esta fuerza matriz es :
Tc= Tdee condensacin del agente calefactor en el evaporador (T de condensacin)
TE= T de ebullicin de la solucin
Lo que hace posible la evaporacin es decir su fuerza motriz es Tc-TE
La elevacin de la T de ebullicin de la solucin es irrevisable a medida que avanza la evaporacin se hay una
elevacin de la T de ebullicin de la solucin conocida como E.P.E que debe restarse de la fuerza motriz Tc-TE sea:
El valor de este EPE se puede obtener para los clculos usando la regla de DUHRING que dice: el punto de ebullicion
de una de su solvente agua a la misma presin de operacin. La regla de DUHRING implica un grfico lineal que
implica plotearT de ebullicin de solucinVs Tde ebullicin del agua pura
REGLA DE DUHRING T E VS TE
( solucin ) ( agua pura)
Q
Q
SOLUCION
DILUIDA
Agente
calefactor
(vapor saturado)
SOLVENTE
COMO VAPOR
SOLUCION
CONCENTRADA
CONDENSADO
Q Q
SOLUCION
Q
C) ALTURA CARGA HIDROSTATICA DE LA SOLUCION
Un punto por debajo de la superficie de la solucin tiene una presin total que es P1 + P2 donde: presin
correspondiente a la carga hidrosttica
A mayor carga hidrosttica la T de ebullicin de la solucin sube lo cual tambin hace disminuir la diferencia Tc-TE
que es la fuerza motriz en la evaporacin de tal forma que para clculos de diseo de evaporadores se toma de la
solucin basada basada en la presin hidrosttica desde el fondo a la mitad del evaporador. En otras palabras la
solucin debe
Estar solo a nivel medio del evaporador es decir debe ser de la sgt manera:
Si P2 estamas arriba la T de ebullicin va a subir si P2 esta or debajo de la mitad la T no va subir sino va a BAJAR lo
cual tambin tiene su inconveniente ya que alimentar el evaporador con poca solucin y el proceso demorara mucho.
T SUBE T BAJA
( NO CONVIENE) (NO CONVIENE)
Donde :
Q= volumen de transferencia de calor agente calefactor a la solucin (
U= coeficiente global de transferencia de calor (
A= rea de transferencia de calor ( rea interna o extrema del intercambio de calor
= fuerza de motriz que hace posible la evaporacin donde Tc es T de condensacin del agente calefactor
generalmente es vapor saturado a la presin de sat. Correspondiente (tabla de vapor)
de la solucin
EL COEFICIENTE GLOBAL DE U
Este coeficiente es una suma de otros coeficientes como son:
a) Coeficiente de transferencia de calor de la pelicula de mayor condensante de la pared interna del
intercambiador
b) Coeficiente de transferencia de calor de la pelcula de la solucin en contacto con la pared interna del
intercambiador
c) La resistencia trmica de la capa de costras y suciedad en los paredes interna y externa del intercambiador (
bajan el valor U)
d) La resistencia trmica del material del que est hecho el intercambiador
BALANCE DE MATERIA EN UN EVAPORADOR
Fraccin solida
Fraccin liquida Fraccin solida
Fraccin liquida
P HH
P 1
P 2
P HH
P 1
P 2
P HH
P 1
P 2
Q
Q
Q
Q
Q
Q
LC
Xp
Vi
Li
Caldero
(1- Xp)
FRACCION SOLIDA + FRACCION LIQUIDA = A
BALANCE DE MATERIA
(TODO LO QUE ENTRA =A TODO LO QUE SALE)
Li = Lo +Vo
BALANCE DE MATERIA LIQUIDA FLUIDA
FLUIDO QUE ENTRA=FLUIDO QUE SALE
Li(1-Xf)=Lo(1-Xp) + Vo
Li= liquido de ingreso o de alimentacin osea solucin problema a concentrar
Lo= liquido [] o solucin problema concentrada
Vo= vapor producido o el solvente de la solucin problema que sale como vapor
Vi= vapor de ingreso calefactor que ingresa y sale en circuito cerrado no toma contacto con la solucin solamente sede
calor.
C= vapor Vi CONDENSADO
BALANCE DE ENERGIA EN UN EVAPORADOR
ENERGIA TERMICA O CALOR QUE ENTRA = ENERGIA TERMICA O CALOR QUE SALE
Q condensacin de Vi = Q sensible de calentamiento de Li + Q vaporizacin de Vo
Vi c = Li Cp(T2-T1) + Vov
Vi= vapor de ingreso
c= calor latente de condensacion de Vi
Li= kilos de litro de alimentacin o sol problema
Cp= calor especifico a pcte de Li o sol problema
T2= T de ebullicin de Li o sust. Problema
T1= T de ingreso de Li o sol. Problema al evaporador
Vo= kilos de Vo o solvente de Li que sale
v= calor latente de vaporizacin de Vo
EL CALOR Q DE Vi TRANSFERIDO A Li DENTRO DEL EVAPORADOR
Q= UA.T
Q= UA (Tc-Te)
Este calor Q puede igualarse a la ecuacin de balance de energa trmica planteada anteriormente es decir:
Vi c= Li Cp( T2-T1) + Vo v= UA T
Se ha demostrado desde el punto de vista de la economia que los evaporadores simples son costosos y no permiten []
grandes cantidades de ahi que tengan que tienen que usarse evaporadores multiplesteniendoseasi sistemas de
evaporadores multiples.
SISTEMA DE EVAPORADORES MULTIPLES
Cuando en un evaporador no se usa el vapor producido Vo dejndose escapar hacia el medio circundante entonces se
trata de un evaporador simple o de un solo efecto o una sola etapa, cuando este vapor producido Vo se usa pasa
refractar otro evaporador entonces un evaporador de multiples efectos ( si son 2 evaporadores es de dos efectos, si
son de 3 evaporadores son de 3 efectos) asi tenemos el siguiente sistema de evaporadores de 3 efectos.
Sistema multiple de 3 efectos en serie en alimentacion en paralelo (Vi y Li estn en paralelo)
si bajo la presin en el evaporador 2 y 3, estos ebulliran a una T menos debido a las presiones mas bajas.
VENTAJAS DE LOS SISTEMAS DE EVAPORADORES MULTIPLES
Cuando se habla de evaporadores se debe de diferenciar entre economa y capacidad del evaporador. Economa
significa ahorro de vapor de ingreso Vi o agente calefactor ; capacidad es la cantidad de solvente evaporado Vo por Kg
de vapor ingreso Vi usado.
El evaporador de efecto multiple no conduce a capacidades altas, sino a un considerable ahorro de vapor de ingreso Vi
que viene de un caldero y tiene su costo. Ejemplo: un evaporador evaporador de efecto simple consume 1.3 Kg de
vapor Vi por kilo de Vo evaporado; un evaporador de efecto triple o de 3 efectos consume 0.4 Kg de vapor Vi/Kg de Vo
evaporado
TABLA DE VAPOR DE AGUA
Tabal que indica las P y T, a las cuales ebulle el agua tmb indica el vol especifico, entalpia, entropa.
Entalpia: si no fluye equivale a su energa interna
Entropa: mayor o menor desorden de las molculas de una sustancia, el desorden aumenta con la subida de T.
Ejem: a 100 C el agua hierve 100pre y cuando la P sea la normal (14.696). en puno hervir a < P y T los valores de la
tabla son T de ebuliicion.
La tabla de vapor da valores de ebullicin por k hay un equilibrio entre el agua y su vapor. Ebullicin y condensacin
UNIDAD IV: CRISTALIZACION
Proceso de separacion donde se obtienen SOLIDOS en forma de cristales a partir de una soolucion liquida saturada;
los cristales son los solidos que se quieren separar.
EJM: el azucar (sacarosa) se separa en forma de cristales de una solucin que es un jarabe se azucar.
En el proceso acurre una transferencia de masa desde la solucinliquida saturada hacia un cristal solido de naturaleza
pura.
Se puede obtener cristales tambien partiendo no de una solucin sino de una masa FUNDIDA originalmente solida
(Metal); esto ocurre en metaluurgia.
A su vez es posible obtener cristales a partir de ungas con el CO2 que por enfriamiento puede cristalizar formado hielo
seco (inustria quimica).
Se estudiar solo cristalizacin a partir de soluciones.
RAZONES DE LA CRISTALIZACION
R. tecnicas.- los solidos cristalinos son mas manejables que los liquidos.
R. Economicos.- los solidos cristalinos ocupan menos espacio.
R. comerciales.- algunos productos tienen mejor aceptacin y mejor presentacin cuando estan como cristales (sal,
azucar).
R. Quimicas.- se puede purificar una sustancia por cristalizacin. EJM: la winterizacion de aceites (enfriar un aceite
para separar trigliceridos de relativo o alto punto de fusin, es decir cemoran es derretirse; de no realizarse la
cristalizacin romperian una emulsin donde esta presente el aceite).
FUNDAMENTO DE LA CRITALIZACION
Las sustancias pueden ser puras o compuestas (soluciones).
CRISTALIZACIN DE UNA SUSTANCIA PURA
SUSTANCIA PURA.- es aquella homogenea y fija en su composicin. EJM: H2O, CO2, Nitrogeno, etc.
Para cristalizar una sustancia pura, es decir q forman cristales olo tiene q enfriarse por debajo de su punto de
solidificacin o su punto de fusin, no olvidar q en la solificacin se quita capor para congelar, y en la usin se aplica
calor para derretir o fundir, es decir implica calores latentes siendo ambos iguales.
El enfriamineto es unica forma de cristalizar una sustansia pura y la velocidad de este enfriamiento es determinante
para obtener cristales grandes o chicos, si la congelacin es rapida se obtienen cristales pequeos, lo que es
deseable en tecnologia de productos congelados como son la fabricacin de HELADOS, CHOCOLATE, etc. En los
helados lo que congela es el agua y la LACTOSA y en los chocolates lo q congelan son sus TRIGLICERIDOS.EJM:
agua liquida.
CRISTALIZACION DE UNA SUSTANCIA COMPUESTA, CASO DE UNA SOLUCCION
Esta se logra cuando se alcanza una concentracin del soluto que supere a la concentracin de
Saturacin, es decir, cuando se llega a la sobresaturacin (solucin saturada es la que no admite mas soluto, es decir
no puede disolver mas soluto) para lograr la saturacin tiene que haber una dependencia de la temperatura y tambin
depende de la naturaleza del soluto y el solvente de la solucin (tipo de soluto), el soluto de un jugo de caa es
diferente al de una salmuera.
Se puede lograr la sobre saturacin de una solucin por ebullicin y enfriamiento, tambin se puede lograr por
congelamiento solvente solido que es anti econmico ya que implica congelar y luego centrifugar para separar soluto
y solvente.
En algunos casos (helados) el congelamiento es la nica forma de obtener cristales de agua y lactosa que son parte
del helado.
En algunos casos se busca lograr la sobresaturacin de la solucin por evaporacin de un solvente y luego por
enfriamiento subsecuente.
Puede haber mtodo combinado de evaporacin y congelamiento
Cuando un helado esta con bolas quiere decir que ha sido enfriado lentamente.
ANALISIS GRAFICO SOBRE LA SOLUBILIDAD, SATURACION Y SOBRESATURACION DE UNA SOLUCION
BINARIA O SISTEMA BINARIO
Cuando se habla de una solucin es necesario saber el comportamiento de su soluto, es decir cmo se disuelve en el
solvente el soluto.
Solubilidad es la capacidad de mezcla de un soluto en un solvente y es funcin de la temperatura, en alimentos
generalmente sube cuando sube la temperatura y baja cuando baja la temperatura; ejemplo azcar en agua
Tambin hay soluciones cuya solubilidad permanece constante e incluso baja al subir la T ; por ejemplo el sulfato de
sodio cuya solubilidad sube con la T si no baja.
SE TIENE EL SIGUIENTE GRAFICO DE SOLUBILIDAD:
CURVAS DE SOLUBILIDAD PARA SISTEMA BINARIO (1 soluto, 1 solvente)
Sea un punto P de la zona insaturada de la solucin binaria que esta en una T y concentracin determinada en un
momento dado, desde aqu la solucin puede llegar a la saturacin y sobre saturacin o bien por enfriamiento si el
punto se mueve hacia abajo o por ebullicin si el punto a la derecha (ebullicin es cambio de fase y por lo tanto ocurre
a una T constante), asi tenemos:
a) Si desde P hacemos descender la T la solucin evolucionara a una concentracin constante hasta alcanzar
la saturacin en el punto de temperatura T.
b) Ahora si a partir de P lo hacemos es evaporar el solvente de la solucin por ebullicin a T cte. la
concentracin va aumentando hasta alcanzar la saturacin en el punto C.
Sea que se enfri o se ebulla la solucin la cristalizacin del soluto no ocurrir al llegar a la curva de saturacin, sino
que es preciso alcanzar una cierta sobresaturacin.
La sobresaturacin es inaprehensible por que cuando la solucin est solamente saturara su tendencia a evolucionar
es nula, es preciso que haya una diferencia de temperatura caso de enfriamiento o una diferencia de potencial de
concentracin caso de ebullicin para poder vencer la inercia del sistema SOLUTO SOLVENTE y pueda llegar a la
sobresaturacin que es donde se forman los cristales.
La cristalizacion no es otra cosa que sobresaturar una sustancia hasta un punto en que la concentracin del soluto se
hace mayor que la solubilidad tope.(saturacion)
ACOTACIONES:
1: la cristalizacion es un proceso de separacion solido liquido donde hay transferencia de masa de un soluto de un
soluto de la sol. Liquida a un fase cristalina solida pura , todo esto debe cumplirse para el caso de una solucin.
Para el caso de esta sustancia pura que no tiene soluto ni solvente sino que esta en una fase uniforme el enfriamiento
es la nica forma de obtener cristales. Ejemplo: obtencin de cristales de hielo enfriando una masa liquida de agua.
2: el mtodo mas utilizado para obtener cristales a partir de una solucin es por evaporacin de su solvente lo que
implica elevacin de su concentracin hasta que la concentracin del soluto sea superior a la saturacion ,
posteriormente llegara ala sobresaturacin donde se obtendrn los cristales en forma total. Posteriormente casi
siempre se enfria la solucin una vez que esta sobresaturada obtenindose asi los cristales en forma plena es decir a
partir de la curva de sobresaturacin.
En muchos pocesos tecnolgicos se obtienen cristales por enfriamiento solamente a partir de una solucin, esto ocurre
en el caso de helados
Para el caso de enfriamiento solamente se usan como equipos los cristalizadores asi tambin se puede hacer un
balance de materia en un cristalizador.
BALANCE DE MATERIA EN UN CRISTALIZADOR: SEA EL SIG. CRISTALIZADOR
DONDE:
L1= Son libras/Hr de solucin saturado, tambin se le llama Agua madre.
(sila soucion esta insaturada se le debe concentrar en un evaporador hasta saturarla)a una T1
L2= Son libras/Hr de solucin aguas madres residual y que esta saturada de soluto a la temperatura T2 (estas aguas
residuales madres es que contiene soluto que no cristaliza todava en el cristalizador y tienen que volver a mezclarse
con L1 para entrar de nuevo al cristalizador.
S3= Libra/Hr de solidos (cristales HUMEDOS) que se formaran cristalizador y que estn en equilibrio con lasolucion
L2 de aguas madres residuales (porque ya no se forman ms cristales a partir de L2, .
Balance total de Materia
L1= L2 + S3
Balance parcial de Solutos
Solutos que entran = Solutos que salen
L1 . X1 = L2 . X2 + S3 . U3
Valores de x3 y u3 que son concentraciones de L2 Y S3 RESPECTIVAMENTE SE HALLAN EN LOS GRAFICOS DE
SOLUBILIDAD PARA LA SOLUCION QUE SE ESTA HALLANDO , ESTAS GRAFICAS SON ESPECIES DE TABLAS.
Curva de solubilidad para el sist.Binarios que cristalizan por enfriamiento (fotocopia)
SEMINARIO DE EVAPORACION
Vo=?
Se sabe que: POR BALANCE DE MATERIA
(
)
Hallando ahora Lo:
Li=Lo+Vo
Lo=Li-Vo
Lo=61,840-4,367.8828
Lo=57,472.118 lb/hr
REEMPLAZANDO EN EL BALANCE TERMICO:
AREA DE TRANSFERENCIA:
Se sabe que: ojo: Tc de Vi a P=41.858lbf/pulg
2
es 270F
Economa de VAPOR:
Lo
Xp=2
6,9%
Vi
Li
Xf=
25
%
V
o
EQUILIBRIO DE EQUILIBRIO O SOLUBILIDAD DE EQUILIBRIO EN CRISTALIZACION
Eq. De tr5ansf. De calor es cuando se igualan las temperaturas del dador y receptor.
Eq. De transferencia de masa es cuando cesa la transf. De masa por saturacin del receptor por el emisor (emisor ya
no puede transferir)
Eq. De cristalizacin, es cuando cesa la formacin de cristales, este eq. Se alcanza cuando la sol. Saturada (agua
madre o licor madre) logran la sobre saturacin, este eq. Se puede visualizar en una curva de solubilidad.
(Ver fotocopia de cristalizacin)
En base a los graficos vistos se puede deducir q la solubilidad depende primeramente de la temperatura, ya que a
medida que se va bajando la temperatura la solubilidad del soluto en el solvente va a empezar a cambiar
especficamente al empezar la saturacin, y esta solubilidad se detendr a partir de la lnea de sobresaturacin, mas
debajo de esta lnea el proceso de sobre sat. Ya no contina.
En cuanto a la presin circundante al fenmeno de sobresat. Este tiene n efecto despreciable sobre la solubilidad. No
olvidar que el equilibrio empieza en la lnea de sobresat. Y este alcanza un valor pleno en la lnea de sobresat.
CINETICA DE CRISTALIZACION
Se refiere a la velocidad de la evolucin del proceso de cristalizacin.
Este proceso implica 2 etapas:
I) Formacin de os NUCLEOS CRISTALINOS
Ocurre al iniciarse la sobresaturacin, cada nucleo de cristal se forma por la aglomeracin en un instante dado de un
cierto numero de molculas de soluto; a este tipo de nucleacion se le conoce como NUCLEACION ESPONTANEA.
Debido a las dificultades q presenta la nucleacion espontanea (forma de cristales desiguales) se opta por la nucleacion
inducida muchas veces, q consiste en introducir en la solucin ligeramente sobresaturada (osea el inicio de la
sobresat.) un cierto numero de cristales pequeos de otra
Partida, de esta forma se produce un crecimiento uniforme de cristales
II. CRECIMIENTO DE LOS CRISTALES
Se produce en el periodo subsecuente a la nucleacin, los cristales cresen en esta etapa separndose de la fase
liquida.
EQUIPOS DE CRISTALIZACIN
1) CRISTALIZACION PROPIAMENTE DICHA
Puede ser un recipiente cualquiera con su sistema de enfriamiento, en estos aparatos la solucin satura se
enfra para producir la cristalizacin. Se usa para cristalizar helados y pastas de cacao para obtener
chocolates fundamentalmente.
2) EVAPORADORES
Son generalmente los del tipo que usan calandria (intersc. de calor) y puede ser de efecto simple o en
paralelo.
En estos aparatos la solucin se ebulle y se evapora el solvente hasta una concentracin de saturacin del
soluto y posterior mente se le transfiere a un cristalizador donde por enfriamiento la solucin se sobresatura
hasta la formacin de cristales, estos sistemas se usan para jarabe de azcar o salmueras.
APLICACIN DE LA CRISTALIZACION EN LA IND. ALIMENTARIA
Puede usarse en procesos de separacin la winterizacion.
SEPARACIN
- Winterizacion de aceites; consiste en la cristalizacin por enfriamiento de triglicridos de punto de
fusin relativamente altos, los cristales se separan posteriormente por cristalizacin. Los triglicridos
deben separarse ya que podran causar el rompimiento de una emulsin tipo mayonesa si es que el
aceite no esta winterizado, tambin si estos triglicridos no se separan del aceite no se van ha derretir
durante un freimiento creando granos en el aceite que se usa para frer.
- Separacin de los cristales en una solucin (jarabe o salmuera); aqu los cristales se paran del
solvente por evaporacin en evaporadores de efecto simple y al vacio, para el caso de un jarabe se
introduce en el evaporador donde se evapora el solvente y se logra la saturacin del soluto.
Tambin se puede obtener cristales de NaCl o sal a partir de una salmuera usando evaporadores de
efecto mltiple al vacio, donde se logra la saturacin y posterior sobre saturacin por un posterior
enfriamiento en tinas de cristalizacin.
MEJORAMIENTON DE LA CALIDAD
1. Obtencin de alimentos congelados con textura optima; esto se si los cristales de hielo formados
son los mas pequeos posibles, lo cual se obtiene con un enfriamiento rpido del alimento que se
congela.
2. Obtencin de helados de textura optima; ocurre lo mismo, se debe buscar un enfriamiento rpido
para obtener cristales de hielo y lactosa pequesimos para una optima textura.
3. Obtencin de chocolates de textura optima; aqu la materia prima del chocolate que es la masa
fundida del cacao debe tener cristales de grasa lo mas pequeo posible para obtener una textura
optima, la que se logra con un enfriamiento rpido de la pasta; al proceso de obtener cristales de grasa
los mas pequeos posible en un chocolate se le conoce como atemperado.
UNIDAD VI EXTRACCIN
Proceso de separacin donde se extrae un componente de una mezcla usando un lquido extractor llamado solvente.
Hay 2 tipos de extraccin:
1. Extraccin liquida liquida
Ocurre una mezcla en estado lquido, con un solvente liquido ejem: extraccin de acido actico, en una mezcla de
agua, usando como agente extractor como solvente ter isoprpilico( el ter y el acido se unen, por decantacin se
separa del agua). Este ipo de xtracion se utiliza en la ind. Qumica que en la alimentaria.
2. Extraccin solido - liquido
Llamado lixiviacin, lavado (percolacin cuando es en caliente). Ocurre cuando de un slido se extrae un componente
determinado con solvente liquidoejem: extraccion de aceite de semilla de soya usando un solvente liquido hexona.
Aplicacin en la ind. Alimentaria:
Obt. De azcar de la remolacha, usando agua caliente como solvente
Obt de caroteno de la zanahoria seca, usando benceno como solvente
Obt. De caf y te en polvos solubles (se extrae de vegetales secos, usando agua caliente como solvente, proceso
conocido como PERCOLACION.
OJO: por q el aceite de oliva no se extrae con solvente???? X q al usar solvente se tiene q desolventizar el aceite osea
de tiene q aplicar calor, entonces ocurre oxidacin, eliminacin de aromas, reduccin de calidad por eso se extrae en
frio por compresin,
En la semilla de soya es por el solvente hexano, luego se desolventiza con calor y se extrae solo aceite.
PROCESO OPERATIVO DE LA EXTRACCIN SOLIDO LIQUIDO
Consiste en mezclar el slido con el solvente en un mezclador para luego pasar a un decantador, donde por diferencia
de densidad se forma 2 fases consiste en:
EL EXTRACTO (componente extrado o soluto ms el solvente, fase rica en componente que se est buscando
extraer)
EL REFINADO (solido inerte ms agua de solucin soluto solvente, esta solucin est adherida a los solidos
inertes)
OJO: DEL EXTRACTO FINALMENTE SE EXTRAE EL SOLUTO BUSCADO PREVIO CALENTAMIENTO Y
EVAPOACION DEL SOLVENTE.
EN CUANTO AL REFINADO, ESTE PUEDE SEGUIR TRATANDOSE EN ESTA ETAOA DE EXTRACCION.
SOLIDOS INERTES (son las sustancia q no participa en la extraccin, puede ser la fibra, otras partculas vegetales,
etc. Como son tejidos y tambin minerales
EQUILIBRIO DE EXTRACCIN SOLIDO LQUIDO
Etapa de extraccin considerado cuando todo el soluto posible de la mezcla a pasado al solvente, en este punto cesa
la transferencia de masa ( la extraccin es una operacin tpica de transferencia de masa)
FACTORES PREPONDERANTE QUE INFLUYE EN EL EQUILIBRIO SOLIDO LIQUIDO SON:
Naturaleza del soluto (animal, vegetal, mineral) y del solvente (orgnico, inorgnico)
Condiciones de operacin (equipo extraccin, etapas)
VELOCIDAD DE EQUILIBRIO (cuan rpido se alcanza el equilibrio).
Adems de la naturaleza del soluto y el solvente y las condiciones de operacin hay otros factores que tienen que ver
con la velocidad con que se alcanza el equilibrio, esto son:
1) Las proporciones del soluto a extraer respecto a solidos inertes (solidos que no se transfieresn, como son
tejidos, minerales).
2) La naturaleza de los solidos inertes, son de origen animal o vegetal.
3) El estado de divisin de la materia prima (debe estar lo mas finamente divida para que el contacto con el
solvente sea lo mas optimo posible).
4) Presencia de restos de tejidos orgnicos, cuando son sustancias de origen animal.
5) Agitacin de la mezcla SOLIDO-SOLVENTE.
6) Caractersticas del equipo extractos y sistema de extraccin (continuo, discontinuo).
PROCESO FISICO-QUIMICO DE LA EXTRACCION S-L
*DILUCION: Aqu se produce al contacto del solido del liquido solvente ocurre en la interfase solido-liquido (soya
laminado-hexano).
*DIFUSION: del soluto contenido de los poros del solido en el lquido solvente; el proceso no puede ser cuantificado
matemticamente ya que so se conocen el camino exacto que recorre el soluto a travs del solido, la difusin ocurre
por tanto dentro del solido.
*TRANSFERENCIA DEL SOLUTO: ocurre desde la superficie de los solidos hacia la mezcla solido-solvente
previamente formado.
CALCULO DE LA VELOCIDAD DE LA TRANSFERENCIA DE MASA EN LA EXTRACCIN S-L.
Para el calculo de esta velocidad se considra que el sentido de la transferencia de masa considerada es de solido a
liquido y no a la inversa.
Cuando un soluto se esta transfiriendo desde el solido de problema hacia la mezcla, o solucin solido-solvente la
fuerza motriz generadora de esta transferencia es la diferencia entre la concentracin del soluto que se transfiere en la
interfase solido-liquido y el seno de la solucin.
Luego segn la LEY DE FICK, para la transferencia de masa conectiva de un soluto A en una sustancia B (solido
+solvente) a travs de un rea de transferencia dada se tendr:
a= se expresa en moles que se transfiere de una rea , es igual a un coeficiente de transferencia de masa multiplicado
por la diferencia de concentraciones. Donde Cs = a la [ ] del soluto que se extrae en la interfase solido liquido.
C = la [ ] del soluto que se extrae en el seno de la solucin.
Haciendo na=W
Siendo la velocidad entonces: dw/d
KG. A (CS - C)
dw/d: Velocidad de transferenciade masa o constante de proporcionalidad (m/seg)
A: rea superficial de la partcula considerada (m
2
)
El solido (partcula) esta mezclado con el solvente,
formando una solucin solido-solvente.
Si toma una partcula solidos de esa partcula va a salir
el soluto.
[ ] de interfase solido-liquido es Cs.
C es [ ] de la solucin.
Mezcla
S - S
C
Cs
Cs
Cs
Cs
C
C
C
C
Cs
SOLIDO SOLIDO
SOLIDO
SOLI
DO
SOLI
DO
SOLI
DO
SOLIDO
SOLIDO
TANQUE DE EXTRACCION
(Mezclador)
S
O
L
I
D
O
S
O
L
I
D
O
S
O
L
I
D
O
Hay miles de partculas
que esta mezclado con el
solvente.
Solido que alarga
el soluto.
S
O
L
I
D
O
CS: concentracin de soluto en la interfase S-L (mol kg de A/m
3
)
C: concentracin de soluto que se extrae dentro o en el seno de la solucin lquida solido-solvente (mol kg de A/m
3
)
LA ecuacin es slida para un proceso de extraccin S-L discontinuo o de una sola etapa de contacto.
Se puede encontrar en base a sta ecuacin la concentracin del soluto que se extrae en el seno del lquido solucin
es decir C a un tiempo resolviendo la ecuacin diferencial planteada para velocidad de transferenciade masa, es
decir dw/d.
Se tiene la ecuacin de velocidad de transferencia de masa para extraccin S-L
KG. A (CS - C)
La fuerza motriz es la diferencia de masa entre Cs y C, para que ocurra la transferencia de masa.
Esta ecuacin NO puede aplicarse en la prctica ya que el rea A de la partcula es infinitesimal y NO puede calcularse
con precisin.
No obstante se puede calcular la concentracin C (concentracin de soluto en el seno de la solucin) al cabo de un
tiempo resolviendo la ecuacin diferencial planteada.
Se parte de un balance de materia elemental que es:
W =V.C
Mol-kga=m
3
(mol-kga/m
3
)
Significa que los mol-kga de soluto es igual a los moles de soluto en el volumen formado.
Mol-kga = mol-kga
DIFERENCIANDO
Pero V=cte. sale del diferencial
REEMPLAZANDO EN LA EC. De VELOCIDAD DE TRANS. DE MASA
Pero Co al inicio de la extraccin sea a =0 es CERO
FINALMENTE
Esta ecuacin tampoco es posible aplicarla en la prctica por dificultad que implica calcular el rea A de la partcula,
pero enla prctica lo que importa es el tiempo de la extraccin que generalmente se obtiene por experimentacin a
las cond. particulares a la que trabaja la batera de extraccin que para una etapa de contacto puede estar formada por
un mezclador y un decantador respectivo, a su vez para un sistema de extraccin formado por un mezclador y
decantador se pueden encontrar relaciones tiles por balance de materia.
Sea la siguiente batera de extraccin de una sola etapa de contacto formada por un mezclador y un decantador.
Se agita para MAXIMIZAR la transferencia de masa
Sobrenadante o liquido extracto, conocido como MISCELA, rica en solvente, se eleva la T y se va el
solvente y queda el aceite,
LODOS, tiene inertes que son aquella materia que no participa en la extraccin, este lquido refinado es
pobre en solvente.
NOTA: como el lquido refinado todava contiene algo de SOLUTO se le puede seguir tratando en otra etapa de
extraccin.
BALANCE DE MATERIA
EN EL MEZCLADOR:
Donde las X son de cada corriente
EN EL DECANTADOR:
SA + LD = LM(BALANCE TOTAL DE MATERIA )
SA . XA + LD . XD = LM . XM (BALANCE DE SOUTO)
SA . XA
Kg de solidos
LE+ LR = LM(BALANCE TOTAL DE MATERIA )
Mezclador
Ag
ita
do
r
LD(LIQUIDO SOLVENTE)
SA(SOLIDO DE ALIMENTACIN)
Sobrenadante
LE
(LIQUIDO O
EXTRACTO O
MICELA +
SOLUTO +
SOLVENTE;
RICA EN
SOLVENTE
Decantador r
LR
(LIQUIDO DE REFINADO
O CODOS)
SOLUTO + SOLVENTE
+INERTES; POBRE EN
SOLVENTE
L
M
LIQUIDO DE MEZCLA
Donde las X son de cada corriente
Para los clculos de los porecentajes de LE y LRoseaXE y XR se usa el diagrama ternario que consiste en un
triangulo rectngulo isoceles (2 lados iguales y uno desigual que es la hipotenusa).
El diagrama es para un sistema de 3 componentes presin y T constantes.
El lado DS es la lnea de todos los extractos posibles, es decir SOLUTO + SOLVENTE, ambos son miscibles.
La lnea DI es la lnea del disolvente + solidos inertes, ambos componentes son inmisibles.
Lnea IS, es la lnea de solidos inertes + soluto.
Unidad VII: DESTILACION
Es una operacin unitaria de separacin de una o mas componentes de una solucin liquida, cada
componente se separa de acuerdo a su punto de ebullicin.
Durante el calentamiento de la solucionse produce primero el cambio de fase de liquido o vapor del
componente que tiene el menor punto de ebullicin, luego le sigue el siguiente en sentido ascendente
respecto al punto de ebullicin citado.
En la destilacin todos los componentes de la solucin liquida o mezcla que se esta tratando deben ser
propensara cambiar a vapor, ejemplo de algunas soluciones binarias que se destilan: ETANOL AGUA;
AMONIACO AGUA; BENCENO TOLUENO.
Hay soluciones como la salmuera que no se destilan ya que solo el agua se vaporiza, la SAL NO, en este
caso se habla de y no de destilacin. Caso similar es la obtencin de la asi llamada AGUA DESTILADA
que en realidad es agua obtenida por de agua natural con su contenido de solidos.
En destilacin en cuanto a soluciones que se destila hay que distinguir entre solucin ideal (caso benceno - tolueno) y
no ideal (caso etanol - agua)
Las soluciones ideales siguen la ley de RAOULT para la fase liquida y la ley de DALTON para la fase gaseosa
APLICACIN DE LA DESTILACION EN LA INDUSTRIA ALIMENTARIA
Se la usa en la concentracin de aromas, tambin de bebidas alcohlicas y de aceites esenciales, tambin en la
deodorizacion de aceites y grasas.
EQUILIBRIO EN DESTILACION (equilibrio liquido - vapor)
Se produce el equilibrio en destilacin para el caso de una mezcla binaria A + B, donde A es ms voltil que B cuando:
a una temperatura y presin dada de ebullicin se produce una cantidad dada de componente A en la fase liquida (XA)
y otra cantidad dada del mismo componente A pero en la fase de vapor llamado YA
Estas cantidades de expresan como fraccin mol (como parte de un mol total de mezcla)
Este equilibrio se puede reutilizar en grficos de curvas de equilibrio en destilacin que para mezclas binarias se puede
representar convenientemente graficando la temperatura de ebullicin vs. Distribucin de concentracin en fase liquida
y en fase del componente ms voltil (ver diagrama en fotocopia)
El grafico mostrado muestre la distribucin de concentraciones tanto en fase liquida como en vapor como es la del
benceno y tolueno
Qu es una solucin ideal?
Una solucin ideal es aquella que sigue la ley de RAOULT y la ley de DALTON, las caractersticas de una solucin
ideal son las siguientes:
Caractersticas:
Son molculas poseen fuerzas intermoleculares idnticas, pues estn formados por compuestos estructuralmente
semejantes, como es el caso de los hidrocarburos, como ejemplo la mezcla benceno tolueno
El volumen de la solucin es suma de volmenes individuales que tena antes de la mezcla, ejemplo si se mezclan
50 ml de benceno con 50 ml de tolueno el volumen total ser 100 ml de solucin, un caso diferente es la solucin
NO IDEAL de etanol agua ya que 50 ml de etanol mezclados con 50 ml de agua dan 96.4 ml de solucin (hay
contraccin de volumen)
Las soluciones ideales deben seguir la ley de RAOULT aplicable solo a la fase, y la ley de DALTON aplicable solo
a la fase de vapor, ambas leyes son relativas a presiones
LEY DE RAOULT (ley de presiones de vapor para lquidos)
PA = PA + XA
PB = PB + XB para mezcla A + B donde A es ms voltil que B
PA= presin parcial de A
P = presin de mayor saturacin de A
LE . XE + LR . XR = LM . XM (BALANCE DE SOUTO)
XA= fraccin molar o fraccin mol de A
LEY DE DALTON (ley de presiones para gases).
Presin parcial total de la mezcla de gases A +B
= Presin parcial del gas A.
= Presin parcial del gas B.
Cuando destilamos una mezcla (binaria o ternaria) el vapor que sale no solo tiene el vapor que quiero obtener sino
tambin tiene la otra sustancia en menor cantidad.
EJEMPLO: Poner el papel seco en un vaso de agua, a la hora el papel se moja, porque las molculas escapan, porque
el aire de arriba est ms frio.
EJEMPLO:destilacin del pisco (alcohol (etanol) + agua), hay que volver a destilar para seguir eliminando agua. eso
significa que no siempre se obtiene una sustancia pura. No se puede obtener alcohol con 100% de alcohol (ES UNA
MEZCLA NO IDEAL).
Hay mezclas que no son ideales como por ejemplo la mezcla AZEOTROPICAS.
DINAMICA DE DESTILACION:
ETANOL + AGUA
Etanol o agua: el punto de ebullicin de mezcla del etanol agua estar entre 78 y 100 C.
Cuando se tiene una mezcla, el punto de ebullicin o temperatura de ebullicin debe estar entre el punto de ebullicin
del uno y el otro.
Cuando se empieza a formar vapor de la mezcla, este vapor contendr los componentes de esta mezcla original, es
decir tendr cantidades de vapor A y vapor B en diferentes proporciones determinadas por las volatilidades relativas de
estos componentes ( volatilidades comparadas con alguna sustancia), es decir por las presiones de vapor relativas de
los componentes de la mezcla.
El vapor que se produce en el destilador ser ms voltil en algunos componentes, es decir de esta manera se puede
conseguir una cierta separacin de este componente ms voltil que siempre va a tener adherido algo del otro, hay
mezclas como el etanol + agua que son mezclas anormales ya que por ms que se le someta a destilacin una y otra
vez nunca se van a poder obtener etanol puro, siempre va a tener una cantidad de agua, es decir no existe al 100%, se
ha podido llegar hasta el 98% de etanol nada ms.
Es decir esta mezcla de etanol-agua para llegar a tener un punto de ebullicin constante a la cual se va obtener
siempre etanol con algo del otro componente agua, a este tipo de mezclas que no producen un componente puro por
ms que se les destile es decir por ms que se les mantenga una temperatura de ebullicin todo el tiempo jams se va
a poder obtener la sustancia pura etanol en este caso este tipo de mezclas se conoce como mezclas
AZEOTROPICAS.
Para este tipo de mezclas si se quiere obtener una mayor separacin posible lo que se hace es condensar su vapor
producido en la destilacin y luego reintroducirle en el destilador para que vuelva ebullir a este proceso de
redestilacion se le llama destilacin fraccionada que normalmente a nivel industrial se realiza en un destilador especial
que tiene los 2 sgtsvariantes:
1. Columna de contacto continuo vapor-liquido de relleno
2. Columna de contacto por etapas vapor-liquido tambin llamado destilador de platos o pisos ( ver balance de
materia y energa en este destilador)
SEGN EL AUTOR FOUST
En un proceso de destilacin una fase vapor entra en contacto con una fase liquida y la masa se transfiere tanto del
lquido vapor como del vapor al lquido cuando este vapor se condensa al enfriarse
MECHERO
El lquido y el vapor contienen generalmente lo mismos componentes pero en cantidades relativas diferentes. El lquido
se halla en su punto de burbuja comnmente llamado punto de ebullicin y el vapor en equilibrio con el lquido est en
su punto de roci llamado tambin punto de condensacin
Proceso de transferencia de masa: el liquido se transfiere al calor por evaporacin y retornara( viceversa) porque llega
a un punto de condensacin
El resultado de esta evaporacin y condensacin continua es que al cabo de un tiempo ocurre de la concentracin del
componente menos voltil en el lquido
Las cantidades de los sustancias ms voltil que se esta separando estn como fraccin mol que en la fase liquida es
XA y en la fase vapor Y A ( vergrfico de T VS distribucin de []s)
Ejm: si la A de una mezcla A+B tiene en la fase vapor YA = 0.8 que para completar un mol falta 0.2 y osea YB=0.2
YA = 0.8 (sustancia A en fase vapor)
YB=0.2 (sustancia B en fase vapor)
TERMINOLOGIA USADA EN DESTILACION
DESTILACION FRACCIONADA
Proceso de destilacin donde los vapores de la sustancia destilada se condensan y luego se les reintroduce al
destilador para ser redestilado. Normalmente se usa un destilador con reflujo como el destilador de columna de platos o
pisos.
Este mtodo permite obtener una mayor separacin del componente voltil que se quiere extraer y permite lograr un
grado de separacin razonable si los volatilidades de los componentes de la mezcla son suficientemente diferentes.
DESTILACION EN SERIE CONTINUA
Se aplica cuando se precisa un alto grado de la sustancia que se destila
DESTILACION CON ARRASTRE DE VAPOR
Se aplica a mezclar lquidos termolbiles de los cuales se quiere separar algn componente que esta tmb termolbil
.Ejm: el aceite esencial de algn vegetal.
Se basa en el principio fsico de que si se introduce un vapor inerte (es decir qNO reaccione con la sust.que se quiere
separar) como el vapor de agua a una mezcla a ser destilada esta no va a ebullir a una Tmucho menor qsi la mezcla
estuviese sola.
La adicin del inerte debe ser tal qsea fcil de separarlo del destiado, adems No debe reaccionar con ningn de los
componentes de la mezcla ni con el destilado en mencin.
DESTILACION AL VACIO
Aqu la destilacin se realiza a presin d vacio lo qpermite operar con Tde ebullicin baja, es ideal para mezclar
termolbiles qpodrian deteriorarse de usarse T de ebullicin altas.
Actualmente este tipo de ebullicin tiende a sustituir a la destilacin con arrastre de vapor, aunque en algunos casos se
combina estos 2 mtodos en las llamadas instalaciones de destilacin con vapor de agua al vacio.
Вам также может понравиться
- Trabajo Final de Obligaciones LegalesДокумент6 страницTrabajo Final de Obligaciones LegalesAntonella HuizafОценок пока нет
- Vida Util Del Hongo (Boletus Luteus) - AДокумент1 страницаVida Util Del Hongo (Boletus Luteus) - AAntonella HuizafОценок пока нет
- Nombres y ApellidosДокумент1 страницаNombres y ApellidosAntonella HuizafОценок пока нет
- Ácidos NucleicosДокумент14 страницÁcidos NucleicosAntonella HuizafОценок пока нет
- Maestro Es El Humilde Labrieg oДокумент2 страницыMaestro Es El Humilde Labrieg oAntonella HuizafОценок пока нет
- Tablas Peruana de AlimentosДокумент70 страницTablas Peruana de AlimentosMarcos Infantes García100% (1)
- Cavidad NasalДокумент43 страницыCavidad NasalAntonella HuizafОценок пока нет
- 1o Escuelita de BigotesДокумент8 страниц1o Escuelita de BigotesAntonella HuizafОценок пока нет
- Huesos Del CráneoДокумент25 страницHuesos Del CráneoAntonella Huizaf100% (1)
- Presentacion de TruchaДокумент2 страницыPresentacion de TruchaAntonella HuizafОценок пока нет
- Diferencia de Mutualismo y ComefnsalismoДокумент2 страницыDiferencia de Mutualismo y ComefnsalismoAntonella HuizafОценок пока нет
- Informe de Practica Nro 11 Quimica HidrocarburosДокумент14 страницInforme de Practica Nro 11 Quimica HidrocarburosAntonella HuizafОценок пока нет
- Maquinaria y Equipos para La Produccion de Azucar PDFДокумент26 страницMaquinaria y Equipos para La Produccion de Azucar PDFAntonella Huizaf79% (28)
- Planta Haarsvey de Harina de PescadoДокумент8 страницPlanta Haarsvey de Harina de PescadoEduardo Tonino Chavez GaytanОценок пока нет
- Boletin de Cambio Climatico - Año2 - N°2 - Junio2012Документ1 страницаBoletin de Cambio Climatico - Año2 - N°2 - Junio2012Antonella HuizafОценок пока нет
- Pag 18 LuisaДокумент1 страницаPag 18 LuisaAntonella HuizafОценок пока нет
- TRIGO DocxnnnnmДокумент17 страницTRIGO DocxnnnnmAntonella HuizafОценок пока нет
- Analisis Tecnico de Un Programa de Mantenimiento Planta de Harina de Pescado 60 TNДокумент193 страницыAnalisis Tecnico de Un Programa de Mantenimiento Planta de Harina de Pescado 60 TNgerardograzaОценок пока нет
- Diapos de Bio FinalesДокумент19 страницDiapos de Bio FinalesAntonella HuizafОценок пока нет
- Formulacion y Elb - Licores Sin Azuar - DocxnДокумент15 страницFormulacion y Elb - Licores Sin Azuar - DocxnAntonella HuizafОценок пока нет
- GalletaДокумент19 страницGalletaAntonella Huizaf100% (1)
- Deporte PDFДокумент5 страницDeporte PDFAntonella HuizafОценок пока нет
- CeidДокумент1 страницаCeidAntonella HuizafОценок пока нет
- MarketingДокумент3 страницыMarketingAntonella HuizafОценок пока нет
- Tablas Del Agua S InternacionalДокумент18 страницTablas Del Agua S InternacionalIng En Azúcar AcariguaОценок пока нет
- Diseño UnirДокумент9 страницDiseño UnirAntonella HuizafОценок пока нет
- Planta Haarsvey de Harina de PescadoДокумент8 страницPlanta Haarsvey de Harina de PescadoEduardo Tonino Chavez GaytanОценок пока нет
- MarkentingДокумент13 страницMarkentingAntonella HuizafОценок пока нет
- Resume NДокумент1 страницаResume NAntonella HuizafОценок пока нет
- Guía AbsorciónДокумент2 страницыGuía AbsorciónDaniel Andrés Ortiz MontoyaОценок пока нет
- Comportamiento de Las FasesДокумент46 страницComportamiento de Las FasesGunnar Leonardo Gutiérrez QuisbertОценок пока нет
- Operaciones de Circuitos FrigorificosДокумент28 страницOperaciones de Circuitos FrigorificosAldo CubaОценок пока нет
- Practica 6 de Columnas EmpacadasДокумент11 страницPractica 6 de Columnas EmpacadasLiszeth Araceli Pérez ChavezОценок пока нет
- Semestral Termo 2020 PDFДокумент2 страницыSemestral Termo 2020 PDFalberto diazОценок пока нет
- Agua - Concepto, Composición, Funciones e ImportanciaДокумент6 страницAgua - Concepto, Composición, Funciones e ImportanciaPerla Massiel MinayaОценок пока нет
- Tarea1-Proceso de Separación-2-2020Документ1 страницаTarea1-Proceso de Separación-2-2020Bryan ArancibiaОценок пока нет
- Semana 2 - Material de Clase - AVДокумент22 страницыSemana 2 - Material de Clase - AVvivian huaroccОценок пока нет
- ACT#FISICA2Документ3 страницыACT#FISICA2Maye Garcia LaraОценок пока нет
- Gas IdealДокумент21 страницаGas Idealaitor22Оценок пока нет
- Medidor de Venturi y Tubo PiezometricoДокумент10 страницMedidor de Venturi y Tubo PiezometricoMarius K Albengrin PalaviciniОценок пока нет
- S4 - Física en Procesos Industriales - Contenidos (08!05!20)Документ12 страницS4 - Física en Procesos Industriales - Contenidos (08!05!20)williamsОценок пока нет
- Intrusion de Agua Modelo de Flujo No Continuo Segun Van Everdingen y HurtsДокумент13 страницIntrusion de Agua Modelo de Flujo No Continuo Segun Van Everdingen y HurtsJuan Daniel Vega100% (2)
- Evidencia de Aprendizaje Semana 4Документ5 страницEvidencia de Aprendizaje Semana 4Martha CCОценок пока нет
- T8 - Guía de EjerciciosДокумент7 страницT8 - Guía de EjerciciosIgnacio Alvarez BiancoОценок пока нет
- Taller Fuerzas IntermolecularesДокумент9 страницTaller Fuerzas IntermolecularesDina Judith CarpОценок пока нет
- Ejercicios Leyes de Los Gases 3º EsoДокумент1 страницаEjercicios Leyes de Los Gases 3º EsoLauraОценок пока нет
- Práctica #5 Operaciones UnitariasДокумент2 страницыPráctica #5 Operaciones UnitariasCINTYA JOHANA TALAVERANO ORTIZОценок пока нет
- Descripción de Proceso Cloro SodaДокумент44 страницыDescripción de Proceso Cloro SodaJoize HErre DI GengoОценок пока нет
- Demostracion de BernoulliДокумент4 страницыDemostracion de BernoulliLaura Massiel Paulino RodriguezОценок пока нет
- Principio de PascalДокумент3 страницыPrincipio de PascalClaudio Antonio Navarro BustamanteОценок пока нет
- Neumatica Parte 1Документ83 страницыNeumatica Parte 1Martin Angulo100% (1)
- MDP - 05 - e - 01 (PRINCIPIOS BASICOS) PDFДокумент117 страницMDP - 05 - e - 01 (PRINCIPIOS BASICOS) PDFAngel PintoОценок пока нет
- 7mo Informe de Laboratorio de Quimica 1 Liquidos 20162615E 17 1 1Документ17 страниц7mo Informe de Laboratorio de Quimica 1 Liquidos 20162615E 17 1 1Luis VillonОценок пока нет
- La SolubilidadДокумент2 страницыLa SolubilidadDiseños Ex-profesoОценок пока нет
- Cap. - Teoría Cinético MolecularДокумент2 страницыCap. - Teoría Cinético MolecularLuis SandovalОценок пока нет
- Enlace Químico: Regla Del OctetoДокумент5 страницEnlace Químico: Regla Del Octetonaiara sanchezОценок пока нет
- RESULTADOS y Discusiones - SedimentacionДокумент22 страницыRESULTADOS y Discusiones - SedimentacionRosa Mariia Quezada ArteagaОценок пока нет
- Valvulas Expansion TermostaticasДокумент40 страницValvulas Expansion TermostaticasFabio Bernardo Castro PietroboniОценок пока нет
- Problemas Ley de RaoultДокумент317 страницProblemas Ley de RaoultMiguel ParamoОценок пока нет