Академический Документы
Профессиональный Документы
Культура Документы
Informe 3
Загружено:
Angie Paola0%(1)0% нашли этот документ полезным (1 голос)
75 просмотров11 страницАвторское право
© © All Rights Reserved
Доступные форматы
PDF, TXT или читайте онлайн в Scribd
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате PDF, TXT или читайте онлайн в Scribd
0%(1)0% нашли этот документ полезным (1 голос)
75 просмотров11 страницInforme 3
Загружено:
Angie PaolaАвторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате PDF, TXT или читайте онлайн в Scribd
Вы находитесь на странице: 1из 11
1
Laboratorio de Qumica Orgnica I
Supervisor Juan Manuel Urbina G.
PRCTICA No. 3 PRUEBAS DE SOLUBILIDAD
Fecha de realizacin: 20/Junio/2014 Fecha de entrega: 11/Julio/2014
Yesica Bautista Correa Cdigo: 2100973
Angie Paola Tamayo Carreo Cdigo: 2101772
RESUMEN
Aunque el anlisis de compuestos orgnicos va ms all de una sencilla prueba de solubilidad, sta es una buena
manera de clasificar sustancias de acuerdo a su capacidad para solubilizar en diferentes solventes y da
informacin acerca de caractersticas importantes de la muestra en estudio, se debe tener en cuenta que la
solubilidad es un fenmeno en el que actan las fuerzas intermoleculares del solvente con el soluto. En
consecuencia, si una sustancia se disuelve en otra, las fuerzas entre partculas que mantienen la identidad fsica
del soluto y el solvente deben romperse para que las partculas individuales de las sustancias puedan mezclarse.
PALABRAS CLAVE
Solubilidad, miscibilidad, enlace qumico, polaridad, fuerzas intermoleculares.
INTRODUCCIN
En la caracterizacin de cualquier compuesto orgnico desconocido, el conocimiento de los constituyentes
elementales es esencial. Los compuestos orgnicos poseen propiedades fsicas que los diferencian fcilmente de
compuestos inorgnicos, estas diferencias se deben sobre todo al tipo de enlace.
A partir del comportamiento de solubilidad de las sustancias es posible relacionar los grupos funcionales
presentes en ellas y caracterizar las sustancias en estudio. Tambin permite evidenciar la presencia de un grupo
funcional, su naturaleza y por ltimo permite hacer, deducciones acerca del peso molecular de la sustancia en
estudio, es por ello que las pruebas de solubilidad se han convertido en un pilar en los anlisis de identificacin
de compuestos orgnicos y grupos funcionales. En este informe se presentan los resultados de las pruebas
obtenidas durante los ensayos de solubilidad y la clasificacin de dichas sustancias para identificar el o los
grupos funcionales presentes en las muestras analizadas.
MARCO TERICO
Las pruebas que se realizan comnmente para clasificarlas sustancias teniendo en cuenta la solubilidad de una
muestra problema son [1]:
a) Solubilidad en Agua: A los compuestos inicialmente se les examina su solubilidad en agua, que por ser
polar es un disolvente pobre para todos los tipos de hidrocarburos. Sales que son extremadamente polares y
algunos cidos y bases de bajo peso molecular son solubles en agua. Algunos compuestos neutros como los
carbohidratos tambin son solubles en agua
2
b) Solubilidad en ter etlico: Compuestos no polares y ligeramente polares son solubles en ter etlico,
mientras que la sales y compuestos polares no son solubles. En general, si un compuesto tiene solo un grupo
polar en su estructura, se disolver excepto si el grupo es altamente polar como en los cidos sulfnicos. La
mayora de los compuestos orgnicos que no son solubles en agua si lo son en ter de petrleo, sin embargo
aminas, amidas, cidos y alcoholes de bajo peso molecular son solubles en ambos disolventes.
c) Solubilidad en Bicarbonato de Sodio e Hidrxido de Sodio: El bicarbonato de sodio y el hidrxido de
sodio son fundamentalmente usados para detectar sustancias cidas solubles en agua. El hidrxido de sodio
es usado para detectar cidos mientras que el bicarbonato de sodio se emplea para sub-clasificar los cidos,
ya que este sirve para distinguir entre cidos fuertes y dbiles. La solucin alcalina no deber calentarse y la
solubilidad o insolubilidad deber considerarse para su anotacin, despus de 1 o 2 minutos.
d) Solubilidad en cido clorhdrico: Compuestos que contienen un tomo de nitrgeno bsico son solubles
en cido clorhdrico diluido. Los compuestos que caen dentro de esta categora son aminas cuya basicidad
es debida a la presencia de un par de electrones no compartido sobre el tomo de nitrgeno
e) Solubilidad en cido Sulfrico: Compuestos que contienen oxgeno como los alcoholes, teres, esteres,
aldehdos y cetonas son bases dbiles debido a la presencia de pares de electrones no compartidos sobre el
tomo de oxgeno. Estos compuestos reaccionan con el cido sulfrico para formar sales de oxonio que su
vez son solubles en exceso de cido sulfrico. Hidrocarburos insaturados como alquenos experimentan
reacciones de adicin con cido sulfrico para formar hidrogeno sulfatos de alquilo que a travs de puentes
de hidrgeno se hacen solubles en exceso de cido sulfrico.
Tabla 1. Clasificacin de compuestos orgnicos segn su solubilidad [1].
3
Diferencia entre solubilidad y miscibilidad
La miscibilidad es la propiedad de algunos lquidos para mezclarse en cualquier proporcin, formando una
solucin homognea, mientras que la solubilidad de un compuesto es la mxima cantidad del mismo que puede
diluirse en un determinado volumen de disolvente, a una temperatura determinada [2].
Por qu determinados compuestos son solubles en soluciones cidas y otros son solubles en soluciones
bsicas?
La solubilidad de una sustancia se debe a la estructura de la misma y a los compuestos que forman, por ejemplo
las aminas forman sales que son compuestos polares por ello son fciles de diluir en cido clorhdrico diluido.
De manera que estudiar la solubilidad en sustancias bsicas y cidas permite tambin conocer o diferenciar la
presencia de un grupo funcional cido o bsico en la sustancia en estudio [2].
4
Ordenar los siguientes compuestos de acuerdo a su solubilidad creciente en agua. Explicar las razones del
ordenamiento.
C H
3
CH
3
C H
3
OH
O
C H
3
CH
3
CH
3
CH
3
CH
3
C H
3
CH
3
CH
3
C H
3 OH
C H
3 OH
cido caproco
isoctano isopentano
butanol
octanol
eter etlico
n-pentano
CH
3
C H
3
n-nonano
CH
3
C H
3
O
dietilcetona
O CH
3
C H
3
Para que una sustancia sea soluble en agua ha de presentar un grupo polar en su molcula o un grupo capaz de
formar puentes de hidrgeno con las molculas de agua y a su vez tener una cadena carbonada pequea [3]. De
menos a ms soluble en agua:
n-pentano < n-nonano < isooctano < ter etlico < cido caprico < isopentano < dietilcetona < octanol < butanol
PROCEDIMIENTO EXPERIMENTAL [1]
El procedimiento experimental que se describir en esta seccin se realiz para siete sustancias conocidas y dos
muestras desconocidas, las estructuras de las sustancias conocidas se presentan a continuacin:
5
N
-
S
O
O
O
Na
+
OH
Sacarina Ciclohexanol
CH
3
Tolueno
OH
O
cido cinmico
O
NH
2
OH
Glicina
OH
NH
2
p-aminofenol
C H
3
CH
3
O
Acetona
Figura 1. Estructuras de los compuestos orgnicos analizados en la prctica.
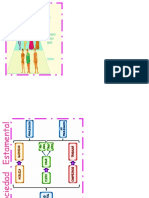
En general el procedimiento que se sigui en la prctica de Laboratorio se puede explicar mediante el esquema
que se muestra a continuacin:
Esquema 1. Clasificacin de compuestos orgnicos segn su solubilidad.
Nota: El cido Sulfrico utilizado en la prueba de solubilidad se cambi por cido sulfrico concentrado.
6
Se tom un peso de aproximadamente 0,1 g de cada una de las muestras y se realiz la prueba de solubilidad en
agua agregando 3 mL de disolvente, dependiendo del resultado de esta prueba se sigui la instruccin del
esquema 1, por ejemplo la sacarina dio un resultado positivo de solubilidad en agua, por lo tanto se realiz la
prueba en ter etlico y su resultado fue insoluble y se clasific en el grupo S2; De esta manera se realizaron las
pruebas para cada una de las sustancias en estudio hasta llegar a la clasificacin correspondiente.
RESULTADOS Y ANLISIS DE RESULTADOS
En la siguiente tabla se presentan los resultados obtenidos durante la prctica de solubilidad de los compuestos
orgnicos analizados:
Tabla 2. Resultados de la prueba de solubilidad y su clasificacin.
Muestra
Peso de la
muestra
[g]
Agua
ter
etlico
HCl
al 5%
NaOH
al 5%
NaHCO
3
al 5%
H
2
SO
4
CONCENTRADO
Clasificacin
Sacarina 0.10 S I S2
Glicina 0.10 S I S2
cido
cinmico
0.10 I I S S A1
p-aminofenol 0.10 I S B
Tolueno 0.07 I I I I I
Ciclohexanol 0.08 I I I S N
Acetona 0.08 S S S1
Muestra
problema 1
0.10 I I I M
Muestra
problema 2
0.07 I I S I A2
S=Soluble; I= Insoluble
Anlisis de la prueba
Sacarina
La sacarina pura no es soluble en agua pero su sal sdica es un compuesto poco soluble en agua (3,3 mg/mL
[4]), aunque en la prctica se utilizaron 0,10 g de sacarina disueltas en 3 mL de agua por lo tanto se solubiliz
completamente.
7
N
S
O
O
O
H
Na
+
+
O H
2
N
-
S
O
O
O
Na
+
OH
-
+
La sacarina al ser una sustancia polar al igual que la glicina no se solubiliza en ter etlico debido a su naturaleza
no polar y de acuerdo al esquema 1 se clasific en el grupo S2 al ser una sal aminada.
Glicina
Las propiedades cido-base de la glicina debidas al grupo amino y al grupo carboxilo son realmente pequeas
(K
a
: 1.6x10
-10
y K
b
: 2.5x10
-12
[4]), lo que permiten que sea soluble en agua, por consiguiente el grupo amino se
protona al reaccionar con el agua liberando amoniaco.
O
NH
2
OH
+ O H
2
O
OH
OH
NH
3 +
Los aminocidos como la glicina son insolubles en disolventes no polares como se observ durante la prctica y
en la tabla 2, la glicina que posee un elevado momento dipolar, no reaccion con el ter etlico debido a su
carcter no polar, lo cual ubic el compuesto en la clasificacin S2 de la Tabla 1 donde se encuentran los
aminocidos.
cido cinmico
El cido cinmico es muy poco soluble en agua (500 mg/L [5]) debido a que a pesar de que es polar posee una
cadena carbonada muy larga y un anillo de benceno que le impide formar puentes de hidrgeno con el agua y al
ser disuelto en HCl al 5 % tampoco reaccion debido a que esta solucin posee un 95 % de agua y se sabe que
no era soluble en agua as que tampoco solubiliz en cido clorhdrico al 5 %; luego, el cido cinmico al ser
orgnico si reaccion con solucin de Hidrxido de sodio al 5% y se form una sal soluble en agua.
OH
O
+
O
O
Na
Na
+
OH
-
+
O H
2
cido cinmico insoluble en H
2
O
Sal soluble en H
2
O
Se comprob que es un cido carboxlico perteneciente al grupo A1 de la Tabla 1 cuando se disolvi en
bicarbonato de sodio al 5% desprendiendo as dixido de carbono en la reaccin.
8
cido cinmico insoluble en H
2
O
Sal soluble en H
2
O
OH
O
+
NaHCO
3
Bicarbonato de sodio
O
O
Na
+ +
O H
2
CO
2
P-aminofenol
Los fenoles son compuestos poco solubles en agua, el p-aminofenol es uno de ellos (1,1 g/100g de agua [6]), una
de las principales caractersticas es que son cidos, pero debido a que el p-aminofenol posee un grupo amino,
ste define su comportamiento ya que el nitrgeno posee un par de electrones libres que reaccionaron con el
cido clorhdrico diluido. Este compuesto se clasific en el grupo B en el cual se encuentran las aminas y
aminofenoles de acuerdo a la Tabla 1.
OH
NH
2
+
HCl
OH
Cl
NH
3 +
Tolueno
El tolueno no solubiliz en ninguno de los disolventes utilizados en la prctica, ya que al ser un anillo aromtico
monosustituido no polar es insoluble en agua que es de carcter polar, y la mayora de los disolventes que se
usaron contenan un 95% de agua, es decir que se encontraban muy diluidos, lo cual hacia muy difcil la reaccin
del tolueno con alguno de los compuestos. De acuerdo a la literatura el tolueno realiza una sustitucin
electroflica llamada sulfonacin que se muestra enseguida, la cual no ocurri ya que ste proceso se presenta a
una temperatura superior a los 35 C [7]. As que se clasific en grupo I en el cual se encuentran los
hidrocarburos.
CH
3
H
2
SO
4
Calor
CH
3
SO
3
H
+
CH
3
SO
3
H
cido p-toluenosulfnico cido o-toluenosulfnico
+
62%
32%
6% m-ismero
9
Ciclohexanol
Present un comportamiento semejante al del tolueno debido a que ambos compuestos son hidrocarburos muy
poco polares, insolubles en agua por lo tanto no solubiliz en ninguno de los solventes diluidos pero lo que
difiere del tolueno es que reaccion con el cido sulfrico concentrado fro debido a que posee un grupo
hidroxilo, esta caracterstica lo puso de acuerdo al esquema 1 en el grupo N donde se encuentran los alcoholes. A
continuacin se presenta la reaccin del ciclohexanol con el cido sulfrico concentrado:
OH
H
2
SO
4
+
O H
2
Acetona
La acetona es miscible en agua debido a que es una sustancia que posee un grupo polar y por lo mismo es que es
soluble en ter etlico ya que a pesar de que el ter es poco polar solo es necesario que la sustancia no posea un
grupo demasiado polar de esta forma puede solubilizar en agua y tambin en ter, como en este caso la acetona
que solo tiene el grupo carboxilo en su estructura por esta razn se hizo soluble en agua por medio de la
siguiente reaccin:
C H
3
CH
3
O
+ O H
2
C H
3
CH
3
OH
O H
Muestra problema 1
Ya que no se conoce la estructura de la sustancia, pero si se pudo observar que la muestra no solubiliz en
ningn disolvente es debido a que la molcula posee una estructura poco polar o no polar, y ya que en la prctica
anterior de anlisis elemental de compuestos orgnicos se encontr que en su estructura no haba azufre se
clasific de acuerdo al esquema 1 en el grupo M donde se encuentran las anilidas, amidas y compuestos
nitrohalogenados, es muy probable que la estructura de la sustancia posea un anillo aromtico con un grupo
amida y como anteriormente se encontr la presencia de cloro y bromo, la estructura ms probable de acuerdo a
lo analizado en la prctica es :
4-bromo-2-cl oro-acetanil ida
C H
3
Cl
Br
O
NH
10
Muestra problema 2
Debido a que no se conoce si no la prueba de solubilidad realizada para la muestra problema 2 lo que se observ
es que no hubo solubilidad en agua lo cual indica que debe poseer baja polaridad o un anillo de benceno con
varios sustituyentes la magnitud del efecto de un sustituyente depende de su distancia al grupo funcional, la
insolubilidad en cido clorhdrico al 5 % revela que el compuesto posee un grupo cido que no debe ser muy
fuerte ya que es una sustancia orgnica y aunque solubiliz en solucin de hidrxido de sodio al 5%, como los
sustituyentes ms alejados tienen efectos mucho ms pequeos sobre la acidez, se pone de manifiesto que los
efectos inductivos decrecen rpidamente con la distancia y ya que no solubiliz con el bicarbonato demuestra la
presencia de sustituyentes, segn la Tabla 1, es una sustancia que posee ms de un grupo funcional en su
estructura.
CONCLUSIONES
Se observ que no todas las sustancias se comportan de la misma forma que se presenta en los libros como
el caso del tolueno que no present solubilidad frente al cido sulfrico concentrado ya que se le deba
proporcionar calor para que ocurriera la reaccin, en la prctica todas las disoluciones se realizaron en fro
pero la solubilidad de los compuestos puede variar de acuerdo a las condiciones en la que se realicen las
pruebas.
Se encontr que hay sustancias que aunque poseen grupos funcionales parecidos se comportan de manera
diferente como la glicina y el p-aminofenol, dos compuestos que poseen en su estructura el grupo amino,
pero esto no indica que los dos se vayan a comportar de la misma forma ya que se observ que cada uno se
disuelve de manera diferente y se debe a que no solo hay que tener en cuenta los grupos funcionales que
poseen, si no el entorno al que se encuentra unido el grupo, los enlaces que se encuentran formando y de
acuerdo con ello la fortaleza, estabilidad del enlace y la rigidez de la molcula, la glicina no posee un anillo
de benceno en su estructura que la hace rgida y a pesar de que ambas sustancias tienen una amina primaria
el carbono al que se encuentran enlazadas esta en un medio diferente lo cual influye en la solubilidad del
compuesto y es lo que genera que la glicina sea soluble en agua y el p-aminofenol no.
Es de gran importancia conocer el tipo de enlace que estn realizando las sustancias ya que esto define la
capacidad de formacin de puentes de hidrgeno que posee una molcula pues es una caracterstica
influyente en el comportamiento de la misma al interactuar con distintos solventes como el agua que fue la
prueba que defini el curso de cada sustancia ya fuera que hubiera o no interaccin con la muestra debido a
los efectos de polaridad que dependen de los en laces atmicos formados.
BIBLIOGRAFA
[1] LOZANO, L; ROMERO, A; URBINA, J. Manual prcticas del laboratorio I de qumica orgnica. Editorial
UIS. Colombia. 2013. Pg.31 - 38.
11
[2] SHRINER, R; HERMANN, C; MORRIL, T; FUSON, R; CURTIN, D. The systematic identification of
organic compounds. John wiley & sons, Inc. USA, 2004. Pg. 75 - 80.
[3] DURST, H. D; GOKEL, G. W. Qumica orgnica experimental, editorial Revert. Espaa. 2007. Pg. 430
436.
[4] MORRISON, R. T; BOYD, R.N. Qumica orgnica, editorial Addison Wesley. Mxico. 1998. Pg: 1323
1330.
[5] MORRISON, R. T; BOYD, R.N. Qumica orgnica, editorial Addison Wesley. Mxico. 1998. Pg: 814
821.
[6] BEYER, R; WALTER, H. Manual de qumica orgnica. Editorial Revert. Espaa. 1997. Pg. 514 -518.
[7] MORRISON, R. T; BOYD, R.N. Qumica orgnica, editorial Addison Wesley. Mxico. 1998. Pg: 490
493.
Вам также может понравиться
- Edad MediaДокумент2 страницыEdad MediaAngie PaolaОценок пока нет
- 2018-114 Tra - Col - J - Torres - Cimga2018Документ6 страниц2018-114 Tra - Col - J - Torres - Cimga2018Angie PaolaОценок пока нет
- Las TermitasДокумент1 страницаLas TermitasAngie PaolaОценок пока нет
- Dialogos de PazДокумент2 страницыDialogos de PazAngie PaolaОценок пока нет
- Informe PDFДокумент10 страницInforme PDFAngie PaolaОценок пока нет
- Informe 4Документ8 страницInforme 4Angie PaolaОценок пока нет
- Preinforme L8Документ11 страницPreinforme L8Angie PaolaОценок пока нет
- TallerДокумент4 страницыTallerAngie PaolaОценок пока нет
- Cafeina Adicion StandarДокумент1 страницаCafeina Adicion StandarAngie PaolaОценок пока нет
- Preinforme L5Документ6 страницPreinforme L5Angie PaolaОценок пока нет
- Preinforme L5Документ6 страницPreinforme L5Angie PaolaОценок пока нет
- Preinforme L3Документ1 страницаPreinforme L3Angie PaolaОценок пока нет
- ALUMINIOДокумент9 страницALUMINIOAngie PaolaОценок пока нет
- Balance de FosforoДокумент7 страницBalance de FosforoHernán Castro SanabriaОценок пока нет
- Identificación de LípidosДокумент5 страницIdentificación de LípidosMicaela MontenegroОценок пока нет
- S15 - S27 - CP14A - Qu Mica Org Nica - Material 2018 PDFДокумент16 страницS15 - S27 - CP14A - Qu Mica Org Nica - Material 2018 PDFDiego R. Cuellar CamachoОценок пока нет
- Informe FinalДокумент15 страницInforme FinalAlexis PiñasОценок пока нет
- Control Vibraciones PDFДокумент353 страницыControl Vibraciones PDFCote Rojas FuentesОценок пока нет
- NQUI U1 ContenidoДокумент50 страницNQUI U1 ContenidoCarolina RubioОценок пока нет
- 3 Guia Covid-19 Grado 11Документ3 страницы3 Guia Covid-19 Grado 11colicoidesОценок пока нет
- Universidad Nacional de PiuraДокумент3 страницыUniversidad Nacional de PiuraGloria Correa RamirezОценок пока нет
- Guia 35 - BiomoleculasДокумент11 страницGuia 35 - BiomoleculasRichard PalaciosОценок пока нет
- Crucigramas de Ciencias Fis y QuimДокумент15 страницCrucigramas de Ciencias Fis y QuimCases Cases100% (1)
- 2do Informe ToxicologiaДокумент11 страниц2do Informe Toxicologiawilmer100% (1)
- Bioelementos PrimariosДокумент23 страницыBioelementos Primariosalheli vasquez paredesОценок пока нет
- Introduccion de La LecheДокумент16 страницIntroduccion de La LecheScaniaОценок пока нет
- Fórmulas Empíricas y MolecularesДокумент10 страницFórmulas Empíricas y MolecularesCARINAОценок пока нет
- Trabajo QuímicaДокумент29 страницTrabajo QuímicaÁngel DayanОценок пока нет
- INTEGRACIÓN METABOLICA - FacMedДокумент10 страницINTEGRACIÓN METABOLICA - FacMedAndrea Arriaga LimónОценок пока нет
- Quimica OrganicaДокумент5 страницQuimica OrganicaDeivids PazОценок пока нет
- Manual de Prcaticas Equipo 4 IQ 303 Quimica Organica y Bioquimica PDFДокумент164 страницыManual de Prcaticas Equipo 4 IQ 303 Quimica Organica y Bioquimica PDFJorge Amaro CortesОценок пока нет
- Informe de Labo - Colorantes FtaleínasДокумент34 страницыInforme de Labo - Colorantes FtaleínasRios Casas Marcelo AndreОценок пока нет
- Guia 3 (III) 10AB Quimica.Документ3 страницыGuia 3 (III) 10AB Quimica.ruthОценок пока нет
- Guia Once Funciones Oxigenadas 2 ParteДокумент24 страницыGuia Once Funciones Oxigenadas 2 Partesergio alarconОценок пока нет
- 11º-Guia Propiedades Del CarbonoДокумент4 страницы11º-Guia Propiedades Del CarbonoJose Jaime Daza RodriguezОценок пока нет
- CLASE SEM 1 - 16-05-22. CT. - 4toДокумент5 страницCLASE SEM 1 - 16-05-22. CT. - 4toJack CgvОценок пока нет
- Grupo 1 Imforme Ciclo Del AzufreДокумент17 страницGrupo 1 Imforme Ciclo Del Azufrejohn lenin sanchez rojasОценок пока нет
- Daniela Aponte - Trabajo de QuimicaДокумент31 страницаDaniela Aponte - Trabajo de QuimicaJhon CaroОценок пока нет
- SA 1 Niveles de Organización Componentes Químicos de La Materia Viva Agua PHДокумент28 страницSA 1 Niveles de Organización Componentes Químicos de La Materia Viva Agua PHARIANY BEATRIZ ROMERO AVILAОценок пока нет
- BIOMOLÉCULASДокумент8 страницBIOMOLÉCULASErica LópezОценок пока нет
- Muestreo ASTMДокумент26 страницMuestreo ASTMHoyos AstridОценок пока нет
- Capitulo 3Документ18 страницCapitulo 3Gillianne MizaОценок пока нет
- Paso 2 Consolidado Biologia 358006 - 15Документ15 страницPaso 2 Consolidado Biologia 358006 - 15Olga Yineth Bolaños OrtizОценок пока нет