Академический Документы
Профессиональный Документы
Культура Документы
Hidrocarburos Aromáticos y SEAr - Tema 8
Загружено:
Jose BelisarИсходное описание:
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Hidrocarburos Aromáticos y SEAr - Tema 8
Загружено:
Jose BelisarАвторское право:
Доступные форматы
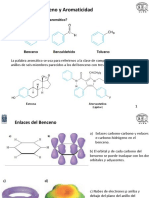
Arenos y aromaticidad
Los arenos son hidrocarburos basados en el benceno como unidad estructural. Por ejemplo,
son arenos el benceno, el tolueno y el naftaleno.
CH
3
Benceno Tolueno Naftaleno
Un factor ue hace ue la conju!aci"n en los arenos sea distinta de la de los polienos
conju!ados ac#clicos es, precisamente, su naturale$a c#clica, pues esto le confiere propiedades
ue difieren mucho de las polienos conju!ados de cadena abierta.
Los arenos son conocidos tambi%n como hidrocarburos aromticos. La palabra arom&tico
usada en este sentido no tiene nada ue 'er con el olor, sino ue est& referida al ni'el de
estabilidad de los arenos, la cual es mucho mayor ue la esperada sobre la base de su
formulaci"n como trieno conju!ado.
Benceno
(n )*+,, -ichael .araday, aisl" del aceite de ballena un l#uido incoloro / p.e. *0,) 1C2 ue
result" ser un nue'o hidrocarburo de f"rmula emp#rica CH y ue se caracteri$aba por su
estabilidad e inercia u#mica. (ste compuesto se llam" benceno y, m&s tarde, se estableci" ue
su f"rmula era C
3
H
3
. (l benceno no e4perimenta f&cilmente las reacciones de adici"n t#picas de
sistemas insaturados, como la hidro!enaci"n catal#tica, la hidrataci"n, la halo!enaci"n o la
o4idaci"n5 por esta inercia u#mica sol#a usarse como sol'ente en las reacciones or!&nicas
)
.
6-n7
8
, +, 1C
No reacciona
H
+
, Pd
Br
+
, +, 1C
H
9
, H
+
7, +, 1C
:eacci"n
e4tremadamente
lenta
No reacciona No reacciona
;arios in'esti!adores propusieron f"rmulas incorrectas para el benceno, al!unas de las
cuales se muestran a continuaci"n<
)
=ctualmente se e'ita su uso debido a sus propiedades cancer#!enas.
)
Benceno >e?ar
Prismano de Landenbur! Ben$'aleno
(l benceno de >e?ar, el prismano y el ben$'aleno se sinteti$aron, pero son compuestos
inestables ue se isomeri$an a benceno en reacciones ue son muy e4ot%rmicas. Kekul y
Loschmidt propusieron como estructura para el benceno el anillo de ),3,,@ciclohe4atrieno /un
anillo de seis &tomos de carbono con tres dobles enlaces conju!ados2.
Ae obser'" ue, a pesar de su inercia reaccional, el benceno reaccionaba con bromo en
presencia de .eBr
3
dando un Bnico producto de sustituci"n, el bromobenceno5 no se formaba
nin!Bn producto de adici"n electrof#lica, caracter#stica de los compuestos insaturados. La
formaci"n de un Bnico producto de monobromaci"n s"lo puede e4plicarse si la mol%cula tiene un
eje de simetr#a de orden 3 /C
3
2. La dibromaci"n produce los is"meros ),+@, ),3@ y ),8@
dibromobenceno.
H
H
H
H
H
H
Br
H
H
H
H
H
9 Br Br
.eBr
3
9 HBr
H
H
H
H
H
Br
H
Br
Producto de adici"n<
N7 A( .7:-=
Br
Br
Br
Br
Br
Br
Br
+
, .eBr
3
@ HBr
Br
Br
9 9
),+@dibromobenceno ),3@dibromobenceno ),8@dibromobenceno
Aon el mismo producto
Ai la mol%cula fuese un ciclohe4atrieno como se propuso, con enlaces simples y dobles
alternados, deber#a obtenerse + compuestos is"meros, ),+@ y ),3@dibromobenceno.
Br Br
Br
Br
+
=nte este dilema, Kekul su!iri" ue el benceno deb#a ser considerado como dos ismeros
de ciclohexatrieno en r&pido euilibrio /%l empleaba la palabra Coscilaci"nD2.
=ctualmente se sabe ue esa idea no es correcta como se 'er& m&s adelante.
Caracterstica estructurales del benceno
(n el benceno todos los &tomos de carbono tienen hibridaci"n sp
2
y cada uno de ellos est&
enla$ado a otros tres &tomos /+ carbonos y ) hidr"!eno2. Eueda sobre cada carbono un orbital p
sin hibridar5 cada uno de estos orbitales p se superpone de i!ual manera con sus dos 'ecinos
!enerando un sistema continuo ue abarca a todos los carbonos de anillo. Los electrones
deslocali$ados forman una nube electr"nica por debajo y por encima del anillo, siendo cero la
densidad electr"nica en el plano del anillo /plano nodal2. (n la .i!ura ) se muestra una
representaci"n orbit&lica del benceno.
Fig. 1. :epresentaci"n orbit&lica del benceno. Cada
carbono contribuye con un orbital +p. La superposici"n de
estos orbitales !enera un sistema ue abarca a todo el
anillo5 la densidad electr"nica es alta por encima y debajo
del mismo.
Numerosos estudios demuestran ue el benceno es una mol%cula plana y su esueleto
carbonado es un he4&!ono re!ular. Todos los enlaces C@C tienen una lon!itud de ),80 , es decir
es intermedia entre un doble enlace sp
+
@sp
+
/),38 ) y un enlace sencillo sp
+
@sp
+
/),83 ) y los
&n!ulos de enlaces son de )+01 ue se corresponden perfectamente con la hibridaci"n sp
+
.
Fig. 2. Lon!itudes y &n!ulos de enlace en el benceno.
3
H
H
H
H
H
H
C
sp
2
-C
sp
2
H
1s
-C
sp
2
)+01
)+01
)+01
1,08
1,40
Resonancia del benceno
Ae!Bn la moderna teor#a electr"nica, el benceno es una Bnica especie, ue se describe con
dos formas resonantes principales tipo ciclohe4atrieno, pero nin!una de ellas representa
correctamente por s# misma el enlace en la mol%cula real. (l benceno es un h#brido de resonancia
en el ue las dos estructuras de 6eFul% contribuyen en un *0G. (ste h#brido se representa a
menudo como un he4&!ono ue contiene un c#rculo en su interior. (l c#rculo representa la
deslocali$aci"n de los electrones , caracter#stica de los sistemas arom&ticos.
es eui'alente a
stabilidad del benceno
Los dienos conju!ados son m&s estables ue los no conju!ados, por lo tanto, bas&ndonos
en estos datos, el benceno debe ser una mol%cula altamente estabili$ada. Pero se debe tener en
cuenta, adem&s, ue los electrones est&n deslocali$ados sobre un sistema cclico con!ugado.
Las dos estructuras de 6eFul% del benceno son de la misma ener!#a, y uno de los principios de la
teor#a de resonancia es ue la estabili$aci"n es mayor cuando las estructuras contribuyentes son
de i!ual ener!#a. La conju!aci"n c#clica en el benceno conduce a una mayor estabili$aci"n ue la
obser'ada en los trienos conju!ados no c#clicos, y la ma!nitud de la misma, puede estimarse a
partir de los calores de hidro!enaci"n.
La hidro!enaci"n del benceno y otros arenos es m&s dif#cil ue la hidro!enaci"n de
aluenos y aluinos, pero es factible de reali$arse con la presencia de catali$adores. (l rodio y el
platino son los catali$adores m&s acti'os y es posible hidro!enar los arenos con estos
catali$adores a temperatura ambiente y a una presi"n moderada /+@3 atm2. (l benceno consume 3
moles de hidr"!eno para dar ciclohe4ano. Para tener una referencia, se compara los calores de
hidro!enaci"n del benceno con los del ciclohe4eno y ),3@ciclohe4adieno.
La hidro!enaci"n del ciclohe4eno es e4ot%rmica con un 'alor del calor de reacci"n similar al
de un alueno cis /H1 H @+*,3 Fcal mol
@)
2. (l calor de hidro!enaci"n del ),3@ciclohe4adieno /H1 H
@,8,I Fcal mol
@)
2 es li!eramente inferior ue el doble del 'alor del ciclohe4eno5 la diferencia, +,3
Fcal mol
@)
, se puede atribuir a la resonancia en un dieno conju!ado.
9 + H
+
H1 H @ ,8,I Fcal mol
@)
H
+
9 H1 H @ +*,3 Fcal mol
@)
Pt
Pt
8
Ai se considera al benceno formado por tres enlaces eui'alentes a los del ciclohe4eno, se
estimar#a su calor de hidro!enaci"n 3 'eces al del ciclohe4eno /H1 H @J*,I Fcal mol
@)
2
+
. Pero
e4perimentalmente esto no ocurre5 el calor de hidro!enaci"n ue se obtiene es H1 H @8I,3 Fcal
mol
@)
, mucho menor ue el estimado. La diferencia es la energa de resonancia del benceno,
unas 30 Fcal mol
@)
. (sta ener!#a se denomina tambi%n energa de deslocalizacin, estabilizacin
aromtica o simplemente aromaticidad del benceno.
Ciclohe4ano
Ciclohe4eno
),3@Ciclohe4adieno
K),3,,@Ciclohe4atrienoK
Benceno
9 H
+
9 + H
+
3 H
+
9
9 3 H
+
@ +*,3
Fcal mol
@)
@ ,8,I
Fcal mol
@)
@ J*,I
Fcal mol
@)
nerga de resonancia
" 2#$ % kcal mol
&1
E
'rbitales moleculares del benceno
La ima!en representada en la .i!ura ) es el modelo habitual de la distribuci"n electr"nica
en el benceno. >e los seis orbitales +p de los carbonos del anillo se !eneran seis orbitales
moleculares . (stos seis orbitales moleculares incluyen tres ue son enla$antes y tres no
enla$antes5 s"lo est&n ocupados los enla$antes ue son de menor ener!#a. Ae dice ue el
benceno tiene una con(iguraci)n electr)nica de ca*a llena< todos los orbitales enla$antes
est&n ocupados y los no enla$antes est&n 'ac#os. (n la .i!ura 3 se muestra la ener!#a relati'a de
estos orbitales y la distribuci"n de los electrones en ellos y se los compara con los del ),3,,@
he4atrieno. (sto nos muestra ue el sistema c#clico es mucho m&s estable ue el ac#clico. Ae
obser'a en la fi!ura ue los orbitales
)
y
3
en el benceno son de menor ener!#a, y aunue
+
es
de mayor ener!#a, la ener!#a !lobal es menor.
+
H1 H 3 /H1 de hidro!enaci"n del 2 9 3 /correcci"n por resonacia en 2
H /3 4 @ +*,32 Fcal mol
@)
9
/3 4 +,32 Fcal mol
@)
H /@ *,,* 9 3,I2 Fcal mol
@)
H @ J*,I Fcal mol
@)
,
Fig. +. Ni'eles ener!%ticos de los orbitales
moleculares del benceno y del ),3,,@
he4atrieno. (n ambos los seis electrones
ocupan los orbitales moleculares enla$antes.
(n el benceno, dos de ellos son de menor
ener!#a y uno de mayor ener!#a ue en el
),3,,@he4atrieno, pero el balance !lobal de
ener!#a es fa'orable para el sistema c#clico.
(n la .i!ura 8 se muestra los orbitales moleculares del benceno. La superposici"n
fa'orable /o enla$ante2 tiene lu!ar entre funciones de onda de i!ual si!no /l"bulo del mismo
si!no2. Un nodo si!nifica un cambio de si!no en la funci"n de onda, ue en la fi!ura se indica con
una l#nea discontinua5 un aumento en el nBmero de nodos indica aumento en la ener!#a de los
orbitales. (n el benceno hay dos !rupos de orbitales de!enerados /de i!ual ener!#a2, pero s"lo
est&n ocupados los de menor ener!#a,
+
y
3
, los de mayor ener!#a,
8
y
,
, est&n 'ac#os.
+
-
+
-
+
-
+
-
+
-
+
-
+
-
-
+
-
+
-
+
-
-
+
-
-
+
-
-
+
-
+
-
+
-
+
-
-
+
-
-
+
-
+
-
-
+
-
+
-
+
-
+
-
-
+
-
+
-
+
+
-
+
-
-
+
-
+
E
--
+
+
6
Fig. ,. Aistema del benceno.
3
5
E
-idrocarburos aromticos *olicclicos
Las mol%culas ue tienen dos o m&s anillos benc%nicos fusionados se denominan
hidrocarburos *olicclicos aromticos o hidrocarburos *olicclicos bencenoides. (n estas
estructuras dos o m&s anillos de benceno comparten dos o m&s &tomos de carbonos.
La nomenclatura sistem&tica de estos compuestos es bastante compleja por lo ue, en
!eneral, se usan los nombres comunes. La mol%cula ue resulta de la fusi"n de dos anillos
benc%nicos es el naftaleno5 la fusi"n de otros anillos en forma lineal da lu!ar a los acenos, como
el antraceno, el tetraceno y el pentaceno. (l fenantreno resulta de la fusi"n an!ular de un anillo de
benceno al naftaleno. Todos estos compuestos tienen una ener!#a de resonancia importante
porue son un conjunto de anillos de bencenos fusionados.
1.
#
/
0
%
1
,
+
2
1
1
2
+
, 1
%
0
/
#
1. /
0
%
1 ,
+
2
1
2
11
/
0 % 1
,
+
1 1.
#
12
Naftaleno
=ntraceno Tetraceno
.enantreno
2a(taleno
(l naftaleno, a diferencia del benceno, es un s"lido cristalino e incoloro, con un punto de
fusi"n de *0 1C. (s utili$ado como repelente de insectos, especialmente de la polilla, aunue ya
ha sido parcialmente reempla$ado por deri'ados clorados como el p@diclorobenceno.
Los estudios reali$ado sobre el naftaleno demuestran ue el naftaleno es arom&tico, ya ue
los 8 electrones ue tiene de m&s con respecto al benceno, se superponen eficientemente con
los del anillo benc%nico al ue est&n unidos. (s posible dibujar 3 formas resonantes para el
naftaleno ue se muestran a continuaci"n<
Forma ms estable
de resonancia3
=mbos anillos corresponden
al benceno de 6eFul%
J
4a mayora de los hidrocarburos bencenoides (usionados son aromticos
Las propiedades del naftaleno ue acabamos de 'er son '&lidas para la mayor#a de
hidrocarburos bencenoides polic#clicos. Parece ser ue la deslocali$aci"n c#clica de los anillos
de benceno indi'iduales no resulta si!nificati'amente perturbada por compartir al menos un
enlace con otro anillo.
=unue el antraceno y el fenantreno son is"meros y parecen muy similares, tienen ener!#a
de resonancia distintas. (l antraceno es apro4imadamente * Fcal mol
@)
menos estable ue el
fenantreno. (sto se e4plica si se obser'an las distintas formas resonantes de ambos compuestos.
(l antraceno tiene s"lo cuatro formas resonantes, y s"lo dos de ellas contienen anillos de
benceno totalmente arom&ticos. (l fenantreno, en cambio, tiene cinco formas resonantes, de las
cuales tres poseen al menos dos anillos totalmente arom&ticos, e incluso una de ellas tiene tres
anillos completamente arom&ticos.
Energa de resonancia: *3 Fcal mol
@)
Formas ms estable de resonancia3
Las dos estructuras tienen + anillos ue
corresponden al benceno de 6eFul%
Resonancia del antraceno
Forma ms estable
de resonancia3
La estructura tienen 3 anillos ue
corresponden al benceno de 6eFul%
Resonancia del (enantreno
Energa de resonancia: I) Fcal mol
@)
Ae conoce un !ran nBmero de hidrocarburos arom&ticos polic#clicos bencenoides. -uchos
han sido sinteti$ados en el laboratorio y otros son productos de combusti"n, por ejemplo, se ha
determinado ue el ben$oLaMpireno est& presente en el humo del tabaco y tambi%n se acumula en
el holl#n de las chimeneas. (sta sustancia es cancer#!ena. (n el h#!ado se con'ierte en un epo4i
diol ue puede inducir mutaciones ue conducen a un crecimiento incontrolado de ciertas c%lulas.
*
Ben5o6a7*ireno
Regla de -8ckel
(n !eneral los polienos c#clicos son arom&ticos si cumplen con la re!la de HNcFel y son lo
suficientemente planos para permitir la deslocali$aci"n de los electrones . La regla de -8ckel se
resume en el si!uiente enunciado< 9e entre los *olienos *lanos$ monocclicos y totalmente
con!ugados$ s)lo los :ue *oseen ;,n < 2= electrones $ donde n es un n>mero entero$
tendrn la estabilidad aromtica es*ecial. Los sistemas ue contienen 8n electrones son
antiarom&ticos y est&n desestabili$ados por conju!aci"n.
La re!la de HNcFel se hace e4tensi'a a los sistemas polic#clicos, por ejemplo, el naftaleno
cumple con estas tres condiciones< es plano, c#clico y tiene /8 4 + 9+2 H )0 electrones , donde
n H +.
(l t%rmino !eneral de anuleno es utili$ado para los hidrocarburos monoc#clicos totalmente
conju!ados. Un prefijo num%rico indica el nBmero de &tomos de carbono5 as# el ciclobutadieno es
el L8M@anuleno, el benceno es el L3M@anuleno y el ciclooctatetraeno es el L*M@anuleno.
Ciclobutadieno
(l ciclobutadieno contiene 8n electrones /n H )2 y es antiarom&tico. (s una mol%cula
inestable al aire y e4tremadamente reacti'a, carente de propiedades arom&ticas y destabili$ada
por efecto de la deslocali$aci"n. (4iste en dos formas de is"meros estructurales rectan!ulares en
r&pido euilibrio, ue se intercon'ierten a tra'%s de un estado de transici"n c#clico. (n resumen, el
ciclobutadieno no es aromtico.
#
Resonancia del ciclobutadieno
(stado de transici"n
Ciclooctatetraeno
(s un liuido amarillo, estable al fr#o, pero ue isomeri$a con el calentamiento. Ae o4ida al
aire, se hidro!ena f&cilmente a cicloocteno y ciclooctano, y puede e4perimentar reacciones de
adici"n electrof#lica y cicloadici"n. (s decir, posee la reacti'idad t#pica de un polieno normal.
I
Los estudios reali$ados confirman la ausencia de aromaticidad dado ue no es plano /tiene
forma de baOera2 ni contiene 8n 9 + electrones . Los dobles enlaces son perpendiculares y se
alternan con enlaces sencillos. Conclusi"n< la mol%cula no es arom&tica.
Ciclooctatetraeno
?ones aromticos
La re!la de HNcFel se aplica tambi%n a especies car!adas ue poseen un sistema
deslocali$ado.
Ani)n ciclo*entadienilo
(l ),3@ciclopentadieno posee una inusual acide$ /pK
a
P )3 comparable al de los alcoholes2,
debido a ue el ani"n resultante de la desprotonaci"n posee un sistema arom&tico con seis
electrones deslocali$ados y la car!a ne!ati'a est& distribuida por i!ual entre los cinco &tomos de
carbono. Comp&rese con el pK
a
del propeno ue es 80.
H -
-
<
9
Resonancia del ani)n ciclo*entadienilo
Cati)n ciclohe*tatrienilo
Cuando se trata el ),3,,@cicloheptatrieno con bromo, se forma una sal estable, el bromuro de
cicloheptatrienilo. (n esta mol%cula, el cati"n or!&nico posee un sistema arom&tico con seis
electrones deslocali$ados y la car!a positi'a se distribuye por i!ual en los siete &tomos de
carbono. = pesar de ser un carbocati"n, es poco reacti'o debido a su aromaticidad, y es conocido
como cati"n tropilio.
)0
Resonancia del cati)n ciclohe*tatrienilo o ion tro*ilio
H
-
9
9
9
9
etc Br
@
Br
+
,
@ HBr
+
'tros iones aromticos
(l cati"n ciclopropenilo /dos electrones , n H 02 es otro ion arom&tico. Ai bien el
ciclooctatetraeno /8n electrones 2 no es arom&tico puede transformarse, por reducci"n con
metales alcalinos, en un diani"n ue es arom&tico /die$ electrones , n H +2.
H
H H
+
cati)n
ciclo*ro*enilo
diani)n
ciclooctatetraeno
Reacciones de los com*uestos aromticos3 @ustituci)n electro(lica aromtica
Qeneralmente los reacti'os ue reaccionan con el anillo del benceno son electr)(ilos. Ra se
'io anteriormente ue los reacti'os electrof#licos se adicionan al doble y al triple enlace en
aluenos y aluinos respecti'amente.
Aecanismo de adici)n electro(lica
C C ( R 9
C C ( 9 9
lenta
R
@
=lueno (lectr"filo Carbocati"n
9 9
C C (
C C ( R
r&pida
R
@
Carbocati"n Nucle"filo Producto de la adici"n electrof#lica
Ai se representa un areno por la f"rmula !eneral =rH, donde =r si!nifica !rupo arilo, la parte
electr"fila del reacti'o reempla$a a uno de los hidr"!enos del benceno< esta reacci"n se llama
sustituci)n electro(lica aromtica.
))
=r -
(lectr"filo
( R 9 =r ( - R
=reno Producto de la Austituci"n
(lectrof#lica =rom&tica
9
-
Aecanismo de @ustituci)n electro(lica aromtica
(l mecanismo de @ustituci)n electro(lica aromtica consta de dos etapas. (n la primera
el electr"filo (
9
ataca al anillo !enerando un intermediario cati"nico conocido como cati"n
ciclohe4adienilo /complejo o intermediario de Sheland2. (n una se!unda etapa el intermediario
formado pierde un prot"n para re!enerar el sistema arom&tico.
Formas de resonancia del un cati)n cicloheBadienilo
H (
9
+
H
(
+
H
(
+
H
(
Benceno (lectr"filo Cati"n ciclohe4adienilo
9
Aecanismo de sustituci)n electro(lica aromtica
1C eta*a3 lenta /determinante de la 'elocidad de reacci"n2
H
(
+
H
+
( R
-
R
@
lenta
#
1
-
+
H
( R
2C eta*a3 r&pida
(
H
+
9
r&pida R
@
(
HR
+
#
2
-
+
H
(
R
La primera etapa termodin&micamente es desfa'orable. =unue en el intermediario la car!a
positi'a puede deslocali$arse en di'ersas posiciones, la formaci"n del enlace C@( implica ue el
carbono ue reacciona cambia la hibridaci"n sp
+
a sp
3
, con lo ue se interrumpe la deslocali$aci"n
c#clica del sistema y, aunue este intermediario es al#lico, no es aromtico /.i!ura ,2. Ain
embar!o, con la p%rdida del prot"n en la etapa si!uiente se restituye la aromaticidad. (ste
proceso est& m&s fa'orecido ue el ataue nucleof#lico del contrai"n de (
9
, ue de producirse
conducir#a a un producto de adici"n no arom&tico.
)+
Fig. 1. ?. :epresentaci"n orbit&lica del cati"n ciclo@
he4adienilo. Ae pierde la aromaticidad porue el
carbono sp
3
interrumpe la conju!aci"n c#clica del
sistema . No se indican los 8 electrones del sistema .
??. :epresentaci"n por l#nea de puntos de la
deslocali$aci"n de la car!a positi'a.
La primera etapa de la reacci"n es la determinante de la 'elocidad como puede 'erse en el
dia!rama de ener!#a potencial de la .i!ura 3. (llo es aplicable a la mayor parte de las reacciones
ue se estudiar&n. La se!unda etapa es mucho m&s r&pida porue conduce a la formaci"n del
producto arom&tico. (sta etapa e4ot%rmica constituye la fuer$a impulsora de todo el proceso.
Coordenada de reacci"n
aromtico
aromtico
-
<
+
r&pida
E
Cati"n
ciclohe4adienilo
lenta
H (
9
#
H
<
1
#2
(
+
H
+
+
H
no aromtico
<
E
a1
E
a2
Fig. %. >ia!rama de ener!#a potencial para la reacci"n del benceno con un electr"filo.
-alogenaci)n del benceno
Ra se 'io ue el benceno es poco reacti'o en presencia de hal"!enos, ya ue %stos no son
lo suficientemente electr"filos. Ain embar!o, el hal"!eno puede hacerse m&s electr"filo mediante
la presencia de &cidos de Le?is como los haluros de hierro /TTT2, .eU
3
, o de aluminio, =lU
3
.
)3
(
H
sp
3
+
( H
+
I
II
H
+
HBr
Br
+ Br
+
Bromobenceno
/3,@J,G2
Bromo Benceno
Bromuro
de hidr"!eno
.e
cuaci)n general
Los &cidos de Le?is se caracteri$an por su car&cter electroatrayente. Cuando una mol%cula
de hal"!eno como el bromo, se pone en contacto con .eBr
3
, se forma un complejo &cido@base de
Le?is. (l tribromuro de hierro se forma al ponerse en contacto el bromo con 'irutas de hierro.
Bromo
3 Br
+
Hierro
+ .e
Bromuro de hierro /TTT2
+ .eBr
3
+
Vcido Le?is Complejo
&cido Le?is @ base Le?is
.eBr
3
+
Br Br Br Br .eBr
3
Base Le?is
(n este complejo, el enlace BrWBr se encuentra polari$ado. Uno de los &tomos de bromo
aduiere suficiente car&cter electr"filo para reaccionar con el benceno, mientras ue el otro se
libera formando parte del buen !rupo saliente .eBr
8
@
. (l .eBr
8
@
actBa como base sustrayendo el
prot"n del cati"n ciclohe4adienilo intermediario. (sta transformaci"n forma el bromobenceno y
bromuro de hidr"!eno y, al mismo tiempo, re!enera el catali$ador.
)8
1C eta*a3 (l complejo bromo@bromuro de hierro /TTT2 es el electr"filo acti'o ue ataca al benceno.
>os de los electrones del benceno se utili$an para formar el enlace con el bromo y
dar el intermediario.
2C eta*a3 P%rdida de un prot"n del cati"n ciclohe4adienilo para dar bromobenceno
H
lenta
+
Benceno (lectr"filo Cati"n ciclohe4adienilo
9
H
Br
+
Br Br .eBr
3
Br .eBr
3
Ton tetrabromoferrato
Br
HBr
+
Br
H
+
9
r&pida
Br .eBr
3
.eBr
3 +
Bromuro
de hidr"!eno
Bromobenceno Ton tetrabromoferrato Bromuro de
hierro /TTT2
La e4otermicidad de la halo!enaci"n arom&tica disminuye al descender la posici"n del
hal"!eno en la tabla peri"dica. La fluoraci"n es tan e4ot%rmica ue esta reacci"n es e4plosi'a. La
cloraci"n reuiere para su acti'aci"n la presencia de catali$adores como el tricloruro de aluminio o
de hierro. (l mecanismo es id%ntico al de la bromaci"n. La yodaci"n electrof#lica es endot%rmica,
y, por lo tanto, dif#cil. La s#ntesis de fluoruros y yoduros de arilo se lle'an a cabo normalmente a
partir de las arilaminas pre'ia transformaci"n de este !rupo funcional.
2itraci)n del benceno
(l benceno no puede ser nitrado con &cido n#trico concentrado ya ue el nitr"!eno del &cido
n#trico no es lo suficientemente electr"filico. Para acti'arlo, se me$cla con &cido sulfBrico
concentrado ue protona al &cido n#trico /se forma la me$cla sulfon#trica2 y produce el ion nitronio,
muy electr"filo, por p%rdida de a!ua.
cuaci)n general
H
+
H
+
7
N7
+
+ H7N7
+
Nitrobenceno
/I,G2
Vcido n#trico Benceno
H
+
A7
8
,0 1 C
),
Formaci)n del ion nitronio
H7 A7
3
H
+
+
Vcido n#trico
H
+
7 +
Ton nitronio
HA7
8
-
H7 N
7
7
H
+
+
-
H7 N
7
7
+
-
H7 N
7
7
H
+
+
-
7 N 7
+
N7
+
H
+
A7
8 +
N7
+
H
+
9
r&pida
Nitrobenceno Ton hidr"!eno
sulfato
7 A7
3
H
1C eta*a3 =taue del ion nitronio al sistema del anillo arom&tico.
2C eta*a3 P%rdida de un prot"n del cati"n ciclohe4adienilo.
H
lenta
+
Benceno Cati"n ciclohe4adienilo
H
N7
+
+
+
7 N 7
Ton nitronio
@ul(onaci)n del benceno
La reacci"n del benceno con &cido sulfBrico es re'ersible.
cuaci)n general
H
+
H
+
7
A7
3
H
+
Vcido bencensulf"nico
Vcido sulfBrico
Benceno
H
+
A7
8
La sulfonaci"n puede lle'arse a cabo con ciertas t%cnicas5 el producto de la reacci"n es el
&cido bencensulf"nico. (sta reacci"n no transcurre a temperatura ambiente con &cido sulfBrico
concentrado, pero si se produce si se utili$a una especie m&s reacti'a, el cido sulfrico fumante
!
ue contiene tri"4ido de a$ufre /A7
3
2, ue puede actuar como electr"filo. (l a$ufre del tri"4ido de
3
(l &cido sulfBrico fumante comercial es una soluci"n apro4imadamente al *G de A73 en &cido sulfBrico
concentrado.
)3
a$ufre es lo suficientemente electrof#lico para reaccionar con el benceno, debido al efecto
electroatrayente de los tres o4#!enos.
cuaci)n general
H
+
H
+
7
A7
3
H
+
Vcido bencensulf"nico
Tri"4ido de a$ufre
Benceno
H
+
A7
8
A7
3
1C eta*a3 =taue del tri"4ido de a$ufre al sistema del anillo arom&tico en la etapa
determinante de la 'elocidad.
H
lenta
+
Benceno Cati"n ciclohe4adienilo Tri"4ido de a$ufre
7 A
7
7
+
-
H
A7
3
+
-
-
H
+
A7
8 +
A7
3
H
+
9
Ton hidr"!eno
sulfato
2C eta*a3 P%rdida de un prot"n del cati"n ciclohe4adienilo.
7 A7
3
H
Ton bencensulfonato
A7
3
-
r&pida
H7 A7
3
H + +
Vcido bencensulf"nico
A7
3
-
A7
3
H
HA7
8
-
+C eta*a3 (l proceso se completa con una r&pida transferencia prot"nica desde el &cido sulfBrico
para dar el &cido bencensulf"nico.
r&pida
Como se dijo, la sulfonaci"n arom&tica es f&cilmente re'ersible. La reacci"n de tri"4ido de
a$ufre con a!ua es tan e4ot%rmica ue al calentar el &cido bencensulf"nico en presencia de &cido
sulfBrico diluido se produce la p%rdida de A7
3
.
ReDersi)n de la sul(onaci)n
+
A7
3
H H
H
+
A7
8
H
+
7, H
+
A7
8
como cat., )00 1C
)J
La re'ersibilidad de la sulfonaci"n es de utilidad sint%tica para controlar otros procesos de
sustituci"n electrof#lica arom&tica. (l carbono unido al !rupo sulf"nico est& bloueado, por lo ue,
los electr"filos reaccionan con otras posiciones. =s# el !rupo sulf"nico puede actuar como !rupo
bloueante diri!ente, ue puede ser eliminado mediante la re'ersi"n de la sulfonaci"n.
A*licaci)n
La sulfonaci"n ha tenido !ran aplicaci"n en la aplicaci"n en la fabricaci"n de detergentes.
Hasta hace poco se sulfonaban los aluilbencenos ramificados de cadena lar!a para dar &cido
sulf"nicos, ue se con'ert#an en las correspondientes sales s"dicas. (stos deter!entes no son
f&cilmente biode!radables, por lo ue han sido sustituidos por otros compuestos ue si lo son.
:
:
A7
3
H
:
A7
3
@
Na
9
A7
3
, H
+
A7
8 Na7H
@ H
+
7
@ntesis de detergentes aromticos
7tra aplicaci"n de la sulfonaci"n es en la obtenci"n de colorantes puesto ue el !rupo
sulf"nico confiere a la mol%cula solubilidad en a!ua.
Al:uilaci)n de Friedel&Cra(ts del benceno
La al:uilaci)n de Friedel&Cra(ts permite la formaci"n de un enlace CWC, ue es uno de los
objeti'os habituales en u#mica or!&nica. Consiste en la reacci"n del benceno con un haloalcano
/halo!enuro de aluilo2 en presencia de un haluro de aluminio. (sta reacci"n, en la ue puede
usarse otros &cidos de Le?is como catali$adores, produce un aluilbeceno y un halo!enuro de
hidr"!eno.
cuaci)n general
H
+
HU
:
+ :U
=lU
3
)*
La reacti'idad del haloalcano aumenta con la polaridad del enlace CWU, por lo tanto el orden
es :T X :Br X :Cl X :.. =l!unos &cidos de Le?is habitualmente empleados, en orden acti'idad
creciente, son< B.
3
, AbCl
,
, .eCl
3
, =lCl
3
y =lBr
3
.
=l i!ual ue en las reacciones de halo!enaci"n electrof#lica, la reacci"n con los halo!enuros
primarios se inicia con la coordinaci"n del &cido de Le?is al hal"!eno del haloalcano. La
formaci"n del complejo &cido de Le?is @ base de Le?is hace ue el carbono unido al hal"!eno
aduiera cierto car&cter cati"nico con lo ue se incrementa su electrofilicidad.
ActiDaci)n del haloalcano
Vcido Le?is
Complejo halo!enuro de aluilo @
halo!enuro de aluminio
Halo!enuro
de aluilo
=lU
3
+
CH
3
CH
+
U CH
3
CH
+
U =lU
3
9
1C eta*a3 =taue electrof#lico
H
lenta
+
Benceno Cati"n ciclohe4adienilo
9
H
CH
+
CH
3
+
Ton tetrahalo@
aluminato
9
U =lU
3
CH
3
CH
+
U =lU
3
2C eta*a3 P%rdida de un prot"n del cati"n ciclohe4adienilo para dar el aluilbenceno
(tilbenceno
CH
+
CH
3
HU +
CH
+
CH
3
H
+
9
r&pida
=lU
3
+
U =lU
3
La reacci"n con haluros secundarios y terciarios transcurre por carbocationes libres como
electr"filos.
cloruro de
t@butilo
=lU
3
+
/CH
3
2
3
C U /CH
3
2
3
C U =lU
3
/CH
3
2
3
C
9
=lU
3
+
cati"n t@butilo
)I
>ado ue un carbocati"n puede reaccionar con el benceno se pueden usar precursores
alternati'os de carbocationes en lu!ar de los :U. Por ejemplo, los aluenos, ue se transforman
en carbocationes en medio &cido, se pueden usar para aluilar al benceno.
+
H
+
A7
8
Ciclohe4ilbenceno
/3,@3*G2
Los alcoholes sufren una reacci"n an&lo!a en medio &cido o cuando son tratados con &cido
de Le?is fuerte y producen la aluilaci"n del benceno.
CH
+
7H
CH
+
+
H.
>ifenilmetano
/3,G2
=lcohol benc#lico Benceno
9 CH
3
CH
+
CHCH
3
7H
9
H
+
7
+@butanol sec@butilbenceno
B.
3
30 1C
CHCH
+
CH
3
CH
3
4imitaciones de las al:uilaciones de Friedel&Cra(ts
Hay dos reacciones importantes ue limitan la utilidad de la reacci"n de .riedel@Crafts. (stas
son<
Polialuilaci"n
Transposiciones de carbocationes
=mbas reacciones pro'ocan una disminuci"n del rendimiento en el producto deseado y
conducen a una me$cla de productos de dif#cil separaci"n.
Polialuilaci"n< (l benceno reacciona con +@bromopropano, con .eBr
3
, como catali$ador
para dar productos de mono@ y disustituci"n del anillo. La disustituci"n se debe a los efectos
electr"nicos de los sustituyentes. La nitraci"n, la sulfonaci"n y la halo!enaci"n conducen a
productos menos reacti'os debido al efecto electroatrayente de los !rupos en el anillo. Un !rupo
aluilo tiene efecto electrodador, por lo ue el anillo es m&s reacti'o ue un benceno no sustituido.
+0
+ /CH
3
2
+
CHBr
CH/CH
3
2
+
CH/CH
3
2
+
CH/CH
3
2
+
+
Tsopropilbenceno
/+,G2
p@>iisopropilbenceno
/),G2
.eBr
3
Transposici"n< (l se!undo tipo de reacciones ue complican la aluilaci"n arom&tica son las
transposiciones de esueleto. Por ejemplo, la aluilaci"n de .riedel@Crafts utili$ando cloruro de
isobutilo /)@cloro@+@metilpropano, un halo!enuro primario2 produce s"lo t@butilbenceno.
9 /CH
3
2
+
CHCH
+
Cl
C/CH
3
2
3
9 HCl
=lCl
3
0 1C
cloruro de isobutilo t@butilbenceno
=u#, el electr"filo es el carbocati"n t@butilo formado por la mi!raci"n de hidruro ue
acompaOa la ioni$aci"n del enlace CWCl.
Erans*osici)n
CH
3
C CH
+
-
CH
3
Cl =lCl
3
9
CH
3
C CH
+
CH
3
-
9
9
=lCl
8
+)
Acilaci)n de Friedel&Cra(ts
(l benceno reacciona con halo!enuros de acilo en presencia de un haluro de aluminio para
dar aluil fenil cetonas. Por ejemplo, se puede preparar acetofenona /fenil metil cetona2 a partir de
benceno y cloruro de etano#lo /cloruro de acetilo2 utili$ando cloruro de aluminio como catali$ador.
CCH
3
7
CH
3
CCl
7
9 HCl
=lCl
3
9
cloruro de acetilo acetofenona
Los cloruros de acilo son deri'ados de los &cidos carbo4#licos y se preparan f&cilmente por
reacci"n de los &cidos con cloruro de tionilo /A7Cl
+
2.
:C7H 9 A7Cl
+
7
:CCl 9 A7
+
9 HCl
7
(l electr"filo en la acilaci"n de .riedel@Crafts es el ion acilio o cati)n acilo ue se !enera
por coordinaci"n de un cloruro de acilo con tricloruro de aluminio, se!uida de la ruptura del enlace
CWCl.
:C Cl
7
=lCl
3
+ :C Cl
7
=lCl
3
+
:C 7
9
+ =lCl
8
(l ion acilio se estabili$a por resonancia.
9
:C 7
9
:C 7
Los anh#dridos de &cidos carbo4#licos, pueden ser'ir tambi%n como fuente de iones acilio y
en presencia de tricloruro de aluminio, acilar benceno. Una unidad acilo del anh#drido ueda unida
al anillo arom&tico y la otra, forma parte del &cido carbo4#lico.
C
7
:
9 9
=lCl
3
:C 7
7
C:
7
:C 7H
7
Una diferencia importante entre las aluilaciones de .riedel@Crafts y las acilaciones es ue
los iones acilio no sufren transposici"n y, por lo tanto, el ion acilio se transfiere inalterado al anillo
++
de benceno. La ra$"n de la ausencia de transposici"n es ue el ion acilio se encuentra
estabili$ado por resonancia ue es m&s estable ue cualuier ion ue pueda concebirse por
despla$amiento de un hidruro o de un !rupo aluilo.
@ntesis de al:uilbencenos *or acilaci)n&reducci)n
La aluilaci"n de .riedel@Crafts del benceno con halo!enuros primarios conduce
!eneralmente a productos ue tienen como sustituyente a !rupos aluilos ue han sufrido
transposici"n, por lo ue, cuando se desea un compuesto del tipo =rCH
+
:, se usa una
transformaci"n en dos etapas, en la ue la primera etapa es una acilaci"n de .riedel@Crafts, y la
se!unda, es una reducci"n del !rupo carbonilo a metileno /CH
+
2.
(l m%todo m&s usado para la reducci"n de un acilbenceno a aluilbenceno es la reducci"n
de Clemmensen5 en este m%todo se utili$a una amal!ama de cinc@mercurio en &cido clorh#drico
concentrado.
Un ejemplo del uso de la secuencia de acilaci"n@reducci"n es la s#ntesis de butilbenceno.
CCH
+
CH
+
CH
3
7
CH
3
CH
+
CH
+
CCl
7
9
cloruro de butano#lo )@fenil@)@butanona /*3G2
/fenil propil cetona2
HCl
Yn/H!2
CH
+
CH
+
CH
+
CH
3
butilbenceno /J3G2
=lCl
3
(ectos de los sustituyentes en la sustituci)n electro(lica aromtica
(ntre los medicamentos m&s utili$ados en la 'ida diaria fi!uran los anal!%sicos orales como
la aspirina, el napro4eno y el ibuprofeno5 todos ellos tienen un anillo arom&tico en su estructura
adem&s de otros sustituyentes y se sinteti$an a tra'%s de la sustituci"n electrof#lica arom&tica.
C77H
7CCH
3
7
CH
3
7
CH
3
7H
7
CH
3
7H
7
=spirina Napro4eno Tbuprofeno
Los sustituyentes del benceno para la sustituci"n electrof#lica arom&tica pueden clasificarse
en<
ActiDantes /dadores de electrones o electrodadores2< ue aumentan la 'elocidad de
reacci"n si se los compara con el benceno.
9esactiDantes /aceptores de electrones o electroatrayentes2< ue disminuyen la 'elocidad
de reacci"n si se lo compara con el benceno.
+3
(n la Tabla ) se resume la orientaci"n /re!ioselecti'idad2 y los efectos sobre la 'elocidad en
las reacciones de sustituci"n electrof#lica arom&tica de 'arios de los sustituyentes m&s frecuentes.
(st&n ordenados en orden decreciente de poder acti'ante. Las principales caracter#sticas de la
tabla pueden resumirse en lo si!uiente<
1. Todos los sustituyentes acti'antes diri!en a las posiciones orto y para.
2. Los sustituyentes hal"!enos son li!eramente desacti'antes pero diri!en a orto y para.
+. Los sustituyentes m&s desacti'antes ue los hal"!enos diri!en a meta"
Fru*os ActiDantes
Los anillos del benceno sustituidos por los !rupos NH
+
y 7H est&n fuertemente acti'ados5
por ejemplo, la halo!enaci"n de la anilina y el fenol no necesitan cat&lisis y, adem&s, son dif#ciles
de detener en el producto de monosustituci"n.
anilina
NH
+
+,8,3@tribromoanilina
3 Br
+
, H
+
7
@ 3 HBr
NH
+
Br Br
Br
7H
Br Br
Br
7H
fenol
+,8,3@tribromofenol
3 Br
+
, H
+
7
@ 3 HBr
La monosustituci"n se puede controlar mejor con deri'ados menos acti'ados ue estos
sustratos, como la #@fenilacetamida /acetanilida2 y el meto4ibenceno /anisol2.
N CCH
3
H
7
N CCH
3
H
7
N7
+
N CCH
3
H
7
N7
+
N CCH
3
H
7
N7
+
acetanilida o@nitroacetanilida
/+)G2
m@nitroacetanilida
/tra$as2
p@nitroacetanilida
/JIG2
+ +
HN7
3
, H
+
A7
8
, +01C
@ H
+
7
Como el nitr"!eno y el o4#!eno de la anilina y el fenol respecti'amente, son m&s
electrone!ati'os ue el carbono, los !rupos NH
+
y 7H son electroatrayentes por efecto inducti'o.
Ain embar!o, el efecto inducti'o es superado por el efecto dador debido a los pares de electrones
+8
no compartidos del N y el 7 ue pueden participar en la resonancia. (sta contribuci"n por
resonancia contrarresta con diferencia el efecto inducti'o.
(ecto inductiDo electroatrayente en la anilina y el (enol
7H NH
+
NH
+
NH
+
NH
+
+ +
NH
+
+
NH
+
Resonancia de la anilina
Resonancia del (enol
7H 7H 7H
+ +
7H
+
7H
La naturale$a acti'ada de estos compuestos as# como la orientaci"n obser'ada frente a la
sustituci"n electrof#lica arom&tica puede e4plicarse por medio de las formas en resonancia de los
di'ersos intermediarios cati"nicos /ion ciclohe4adienilo2.
(n la anilina, el par de electrones no compartidos del nitr"!eno, puede participar en la
resonancia y estabili$ar as# al intermediario resultante de las sustituciones en orto y para, pero no
en meta. (l resultado es una barrera de acti'aci"n mucho menor para el ataue en orto y para, y
en consecuencia, la anilina se encuentra acti'ada en la sustituci"n electrof#lica arom&tica con
relaci"n al benceno y la reacci"n es altamente re!ioselecti'a. Con'iene recordar un concepto ya
estudiado< el carbocatin ms estable se forma ms rpidamente $ue el menos estable.
La mayor estabilidad de los carbocationes ue proceden del ataue en las posiciones orto y
para, comparada con el carbocati"n formado en el ataue en meta al sustituyente con nitr"!eno,
e4plica las propiedades diri!entes orto y para de los !rupos amino, aluilamino, dialuilamino y
acilamino. Un an&lisis similar se hace para los sustituyentes hidro4ilo, alco4ilo y acilo4ilo.
+,
l *ar de electrones no com*artido del 2 no se *uede utili5ar *ara
estabili5ar ninguna de las estructurasG todas tienen seis electrones
alrededor del C con carga *ositiDa.
Ata:ue en meta
9 (
9
Forma de resonancia
ms estable3 el 2 y todos los
C tienen el octeto com*leto
Ata:ue en orto
NH
+
(
H
+
NH
+
(
H
+
NH
+
(
H
+
NH
+
(
H
+
Forma de resonancia
ms estable3 el 2 y todos los
C tienen el octeto com*leto
Ata:ue en para
NH
+
H (
+
NH
+
H (
+
NH
+
H (
+
NH
+
H (
+
NH
+
9
9
9
NH
+
(
H
NH
+
(
H
NH
+
(
H
Los !rupos aluilos son acti'antes d%biles y diri!en a orto y para. Los cationes
ciclohe4adienilos ue conducen a o@ y p@aluilbencenos tienen car&cter de carbocati"n terciario,
cada uno tiene una forma de resonancia principal en la cual la car!a positi'a reside sobre el
&tomo de carbono ue lle'a el !rupo aluilo, por lo ue su formaci"n est& fa'orecida. (l
carbocati"n ue conduce a la sustituci"n en meta tiene tres de estructuras de resonancia donde
todas son carbocationes secundarios.
Un !rupo metilo es donador de electrones, por lo tanto, acti'a todos los carbonos del
tolueno, pero las posiciones orto y para est&n m&s acti'adas ue la meta. La influencia del !rupo
metilo es de tipo electr"nico. (l !rupo metilo ejerce un peueOo impedimento est%rico en las
posiciones orto, haciendo el ataue en el carbono para li!eramente m&s f&cil. Pero se debe tener
en cuenta ue la posici"n orto tiene 'entaja estad#stica ya ue hay dos de ellas y una sola para.
(sto se puede obser'ar en la ecuaci"n !eneral de la nitraci"n del tolueno.
+3
CH
3
CH
3
N7
+
CH
3
N7
+
CH
3
N7
+
HN7
3
/CH
3
C72
+
7
o@nitrotolueno
/33G2
m@nitrotolueno
/3G2
p@nitrotolueno
/38G2
9 9
:
(
H
:
(
H
:
(
H
9 9
9
Ata:ue en orto
sta (orma de resonancia es
un carbocacti)n terciario
Ata:ue en para
:
H (
9
:
H (
9
:
H (
9
sta (orma de resonancia es
un carbocacti)n terciario
Ata:ue en meta
:
(
H
:
(
H
:
(
H
+
+
+
+ NO
2
+
9iagramas de energas com*aratiDos *ara el ata:ue del ion nitronio3 ?= sobre
el benceno y sobre las *osiciones ??= meta$ ???= orto y ?H= para del tolueno
CH
3
+ NO
2
+
N7
+
H
9
E
I II III IV
CH
3
N7
+
H
9
CH
3
N7
+
H
+
CH
3
N7
+
H
9
E
a
E
a
E
a
E
a
+J
Вам также может понравиться
- Compuestos Aromáticos 2Документ9 страницCompuestos Aromáticos 2Betzy Valery Poma PerezОценок пока нет
- Hidrocarburos Aromáticos: Estructura de KekuléДокумент18 страницHidrocarburos Aromáticos: Estructura de KekuléEma ARОценок пока нет
- Tema 9 QOДокумент66 страницTema 9 QOAlexander Rojas TorresОценок пока нет
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaОт EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaРейтинг: 5 из 5 звезд5/5 (1)
- Benceno y DerivadosДокумент65 страницBenceno y DerivadosGustavo Lagos100% (1)
- Benceno y DerivadosДокумент47 страницBenceno y DerivadosRoberto Carlos EspinozaОценок пока нет
- Introducción a la Biología: RESÚMENES UNIVERSITARIOSОт EverandIntroducción a la Biología: RESÚMENES UNIVERSITARIOSРейтинг: 5 из 5 звезд5/5 (1)
- ALQUENOS, Cicloalquenos y DienosДокумент8 страницALQUENOS, Cicloalquenos y DienosDesiree BetancourtОценок пока нет
- Hidrocarburos AromáticosДокумент7 страницHidrocarburos AromáticosREGNER ALONSO ESPINOZA ORTIZОценок пока нет
- Teoria Unidad N 3 Alquenos y AlquinosДокумент27 страницTeoria Unidad N 3 Alquenos y AlquinosSandra Quintana100% (1)
- 29 HidrocarburosДокумент11 страниц29 Hidrocarburostavito_12Оценок пока нет
- Tema IV Enlace Químico 2015 Parte IIДокумент69 страницTema IV Enlace Químico 2015 Parte IIOlmedo Aedo Huyhua AcevedoОценок пока нет
- Tema 1 Compuestos AromaticosДокумент23 страницыTema 1 Compuestos AromaticosIvan Maldonado SuarezОценок пока нет
- Punto 1 QuimicaДокумент3 страницыPunto 1 QuimicaBRANDON FELIPE MOSQUERAОценок пока нет
- Tema 1 Compuestos AromaticosДокумент23 страницыTema 1 Compuestos AromaticosLuque Quispe GabrielОценок пока нет
- AlquenosДокумент41 страницаAlquenosJose OlaisОценок пока нет
- AlquenosДокумент41 страницаAlquenosLaraBen79Оценок пока нет
- Expo Quimica 5Документ43 страницыExpo Quimica 5Victor RodriguezОценок пока нет
- Practica Numero 4Документ30 страницPractica Numero 4JulianaJudithGarbozoSaenz100% (2)
- Hibridación Del Carbono e IsomerosДокумент22 страницыHibridación Del Carbono e IsomerosMafe DrumsОценок пока нет
- Benceno EstructuraДокумент51 страницаBenceno Estructuraeuduardo100% (1)
- Tema 1.1Документ11 страницTema 1.1Yhoselyn MareñoОценок пока нет
- 6 Hidrocarburos AromaticosДокумент13 страниц6 Hidrocarburos AromaticosMónica Paola Gaona RamírezОценок пока нет
- Alquenos Locos QuimicaДокумент21 страницаAlquenos Locos QuimicaSan EdgardoОценок пока нет
- Tema 6 QOДокумент48 страницTema 6 QODANY HERNANDEZ HERNANDEZОценок пока нет
- Estructura Del BencenoДокумент12 страницEstructura Del BencenoJavier AlbaОценок пока нет
- 3-Hidrocarburos InsaturadosДокумент40 страниц3-Hidrocarburos InsaturadosRicarda Montoya MundoОценок пока нет
- Modelos MolecularesДокумент11 страницModelos MolecularesVictor AnDre'z CastilloОценок пока нет
- AromasДокумент13 страницAromasSteward Valenzuela AriasОценок пока нет
- Msc. Abdiel Adriazola MurielДокумент199 страницMsc. Abdiel Adriazola MurielDAYANA SARAY SARMIENTO PEÑARANDAОценок пока нет
- Alquinos y Dienos Tema 3 PDFДокумент48 страницAlquinos y Dienos Tema 3 PDFANDREWОценок пока нет
- Estructura y NomenclaturaДокумент47 страницEstructura y NomenclaturaJovanhy Aparicio0% (2)
- Compuestos Aromaticos BencenoДокумент28 страницCompuestos Aromaticos BencenoRosalva VillarrealОценок пока нет
- Semana5 - Alquenos PDFДокумент41 страницаSemana5 - Alquenos PDFRenzo Flores GomezОценок пока нет
- QUIMICAORGДокумент27 страницQUIMICAORGAna RamirezОценок пока нет
- Quimica Organica 2 Unidad 3Документ30 страницQuimica Organica 2 Unidad 3AharónVázquez0% (1)
- Conjugación Resonancia Aromaticidad QO1D2K14Документ51 страницаConjugación Resonancia Aromaticidad QO1D2K14FioreОценок пока нет
- Introduccion A La Nomenclatura e Isomeria de Los Compuestos OrganicosДокумент32 страницыIntroduccion A La Nomenclatura e Isomeria de Los Compuestos OrganicosAgustín IslaОценок пока нет
- Espectrometría de MasasДокумент4 страницыEspectrometría de MasasJorge WhiteОценок пока нет
- 1 Benceno 001Документ42 страницы1 Benceno 001Donovan Gonzalez BureosОценок пока нет
- Parte 3 - SUSTITUCIÓN ELECTROFÍLICA AROMÁTICAДокумент8 страницParte 3 - SUSTITUCIÓN ELECTROFÍLICA AROMÁTICAVarov50% (2)
- BencenoДокумент65 страницBencenoEsme PilcoОценок пока нет
- AlquinosДокумент19 страницAlquinosAristeo FraustoОценок пока нет
- Enlaces y Sus ConsecuenciasДокумент69 страницEnlaces y Sus ConsecuenciasDavid LeToОценок пока нет
- AlquenoДокумент28 страницAlquenoGuidihan ArzolayОценок пока нет
- AromaticidadДокумент6 страницAromaticidadMilagros Valinotti GaunaОценок пока нет
- Clase 1 QO-I PDFДокумент42 страницыClase 1 QO-I PDFOrtiz Torres Fredy100% (1)
- Chuleta Química OrganicaДокумент4 страницыChuleta Química Organicappeinado00Оценок пока нет
- Formulación y Nomenclatura en Química OrgánicaДокумент14 страницFormulación y Nomenclatura en Química OrgánicaCiro Quispe HilarioОценок пока нет
- Apuntes de NomenclaturaДокумент34 страницыApuntes de NomenclaturaJdhov YskigОценок пока нет
- 08 Enlace QuímicoДокумент17 страниц08 Enlace QuímicogatrenoОценок пока нет
- Estructura y Propiedad de MoléculaДокумент39 страницEstructura y Propiedad de MoléculaLuisMPortillaBenavidesОценок пока нет
- Hidrocarburos AromaticosДокумент69 страницHidrocarburos AromaticosElvis Rogers PakitaОценок пока нет
- UNIDAD III Cap. 4 AlquinosДокумент4 страницыUNIDAD III Cap. 4 AlquinosAndrea Bravo MelgarОценок пока нет
- Reacciones Del BencenoДокумент5 страницReacciones Del BencenoAdriana HernándezОценок пока нет
- SERIE 2 Aula VirtualДокумент13 страницSERIE 2 Aula VirtualGiuliana PerezОценок пока нет
- Leyes, Leguajes y Niveles Del Control de ProcesosДокумент2 страницыLeyes, Leguajes y Niveles Del Control de ProcesosJose BelisarОценок пока нет
- Extraccion de Colorantes Naturales A Partir de Las Inflorescencias para Su Aplicacion Como Indicadores Acido-BaseДокумент145 страницExtraccion de Colorantes Naturales A Partir de Las Inflorescencias para Su Aplicacion Como Indicadores Acido-BaseJose BelisarОценок пока нет
- Algebra de Bloques PDFДокумент11 страницAlgebra de Bloques PDFAlush JoeОценок пока нет
- Propuesta para La Gestion Ambiental de Pilas y Baterias Fuera de Uso en El SalvadorДокумент215 страницPropuesta para La Gestion Ambiental de Pilas y Baterias Fuera de Uso en El SalvadorJose Belisar100% (1)
- Gestion de Los Residuos y Desechos Peligrosos Generados en Practicas de Laboratorio de Quimica Inorganica y Quimica AnaliticaДокумент265 страницGestion de Los Residuos y Desechos Peligrosos Generados en Practicas de Laboratorio de Quimica Inorganica y Quimica AnaliticaJose BelisarОценок пока нет
- Evaluacion de Las Variables de Secado para La Conservacion de Las Hojas de La Planta de AñilДокумент186 страницEvaluacion de Las Variables de Secado para La Conservacion de Las Hojas de La Planta de AñilJose BelisarОценок пока нет
- Caracterizacion Fisicoquimica Del Proceso de Produccion de Colorante de AñilДокумент147 страницCaracterizacion Fisicoquimica Del Proceso de Produccion de Colorante de AñilJose BelisarОценок пока нет
- Clase Tema 3 - Final 11-4-2013Документ12 страницClase Tema 3 - Final 11-4-2013Jose BelisarОценок пока нет
- III Biosintesis de AGs. Elongación. Desaturación.Документ29 страницIII Biosintesis de AGs. Elongación. Desaturación.Maria Sol EscuderoОценок пока нет
- Formato CarbohidratosДокумент12 страницFormato CarbohidratosRicardo Bautista ArguellesОценок пока нет
- Upos Funcionales y NomenclaturaДокумент74 страницыUpos Funcionales y NomenclaturaCARDENAS MEDINA MANUEL DE JESUSОценок пока нет
- IndexДокумент59 страницIndexCaroPérezОценок пока нет
- Ht-2 - Hidrocarburos - Alcanos, Alquenos AlquinosДокумент4 страницыHt-2 - Hidrocarburos - Alcanos, Alquenos AlquinosAlex RyanОценок пока нет
- Lqui U2 A2 JoasДокумент10 страницLqui U2 A2 Joasjorge edgar avendaño salgadoОценок пока нет
- Ácidos CarboxílicosДокумент9 страницÁcidos CarboxílicosJavier Alejos MОценок пока нет
- Identificacion de Alcanos, Alquenos y Alquinos, Organica Informe 6Документ12 страницIdentificacion de Alcanos, Alquenos y Alquinos, Organica Informe 6Carlos Xavier Sanchez Basurto50% (2)
- Lípidos Saponificables InsaponificablesДокумент5 страницLípidos Saponificables InsaponificablesNicole MondoñedoОценок пока нет
- Tema 10 QoДокумент20 страницTema 10 QoFabián Saavedra ValladaresОценок пока нет
- Cuestionario #1. 3ro BGU Primer Quimestre QuímicaДокумент9 страницCuestionario #1. 3ro BGU Primer Quimestre QuímicaMauro MuñozОценок пока нет
- Bloc de Notas Sin TítuloДокумент30 страницBloc de Notas Sin Títuloalejandro H Hyh pacheco peñalozaОценок пока нет
- Tutoría - Mayo 04 - Esteres - AmidasДокумент5 страницTutoría - Mayo 04 - Esteres - AmidasDielitha DiazОценок пока нет
- Nomenclatura Organica e InorganicaДокумент26 страницNomenclatura Organica e InorganicaLe AfujОценок пока нет
- Ester EsДокумент4 страницыEster EskatiaОценок пока нет
- PRÁCTICA 2. Síntesis de Hexan-2-Ol 1.1Документ34 страницыPRÁCTICA 2. Síntesis de Hexan-2-Ol 1.1Isabella Giraldo100% (2)
- Alquenos - QUIMICA ORGANICAДокумент14 страницAlquenos - QUIMICA ORGANICARonaldo1962Оценок пока нет
- 2 - Mini Cartilla - Alqueno Si PDFДокумент3 страницы2 - Mini Cartilla - Alqueno Si PDFLizeth Condori100% (1)
- Quimica III AlquinosДокумент18 страницQuimica III AlquinosMarvin Alexander Andrade AndradeОценок пока нет
- Practica 4. Esterificación EM24Документ7 страницPractica 4. Esterificación EM24a01643469Оценок пока нет
- Practica en ClaseДокумент3 страницыPractica en ClaseSteven España VeraОценок пока нет
- Grupos Funcionales 2.3Документ8 страницGrupos Funcionales 2.3GABRIELA dissaОценок пока нет
- Formulario de Quimica OrganicaДокумент3 страницыFormulario de Quimica OrganicaCristofer Marcial KebОценок пока нет
- Informe 14 QuimicaДокумент5 страницInforme 14 QuimicaZHANELA ROSALINDA ALONSO TORIBIO0% (1)
- Cuaderno Trabajo1 QU334 2023-1Документ30 страницCuaderno Trabajo1 QU334 2023-1ALEXANDER CADENILLAS DIAZОценок пока нет
- Ejercicios de Ácidos Carboxílicos, Esteres - 12-2021Документ12 страницEjercicios de Ácidos Carboxílicos, Esteres - 12-2021Luis SifuentesОценок пока нет
- 02 - Func. Oxig. Fenoles OK OK PDFДокумент35 страниц02 - Func. Oxig. Fenoles OK OK PDFJOEL ERAZO ARRIGUELAОценок пока нет
- Clasificacion de Los Hidrocarburos Cuarto de SecundariaДокумент7 страницClasificacion de Los Hidrocarburos Cuarto de SecundariaMilagros FabianОценок пока нет
- Alqueno Li ..,,.Документ5 страницAlqueno Li ..,,.roberto maldonado100% (1)
- Taller 3-2 Aldehídos y CetonasДокумент4 страницыTaller 3-2 Aldehídos y CetonasJavier ContrerasОценок пока нет