Академический Документы
Профессиональный Документы
Культура Документы
Metodos CReporte Prac 11
Загружено:
Ed ArceОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Metodos CReporte Prac 11
Загружено:
Ed ArceАвторское право:
Доступные форматы
1
INSTITUTO POLITCNICO NACIONAL
UNIDAD PROFESIONAL INTERDISCIPLINARIA DE
BIOTECNOLOGA
VALORACIONES POTENCIOMTRICAS DE COMPUESTOS QUE
FORMAN PRECIPITADOS
_______________________________________________________________
Prctica No. 11
GRUPO: 3BM1
PROFESORES:
Juan Ramrez Balderas
Cndido Lpez Reyes
Velia Palmira Ascencio
EQUIPO 1
INTEGRANTES:
Arce Legorreta Eduardo Martin
Fernndez Betancourt Marisol Mayela
Snchez Vargas Jessica
Trejo Vsquez Jessica Angelina
18 de Marzo del 2014
2
Ilustracin 1. Ejemplo de formacin de
precipitados en una disolucin.
OBJETIVOS
Determinar con precisin el punto final de la valoracin potenciomtrica de
KCl con AgNO
3
Trazar experimentalmente la curva de evaloracin potenciomtrica de KCl
con AgNO
3
Determinar la concentracin de una disolucin de KCl cuando se valora con
AgNO
3
por el mtodo potenciomtrico.
INTRODUCCIN
Por medio de una valoracin potenciomtrica puede determinarse la concentracin
de iones que forman precipitados, siempre y cuando el producto de la reaccin
sea muy insoluble (Chang, 2010).
Un precipitado es el slido que se produce en una disolucin por efecto de
cristalizacin o de una reaccin qumica. La precipitacin puede ocurrir cuando
una sustancia insoluble se forma en una disolucin debido a que la disolucin ha
sido sobresaturada por algn compuesto, es decir, que no se acepta ms soluto,
de tal manera que al no poder ser disuelto dicho soluto, forma el precipitado.
Para valoraciones potenciomtricas que forman
precipitados, es necesario una celda
electroqumica cuyo voltaje de salida sea
proporcional a () , donde es el ion
que ser determinado. Es por ello que nuestro
electrodo de referencia es de ya que
este funciona como parmetro marcando el
potencial conocido del precipitado; mientras que
nuestro electrodo indicador es de
ya que
detectar los iones
.
En la valoracin de con
se lleva a cabo la
siguiente reaccin:
En este caso el electrodo es un electrodo
de segunda especie pues cuando un electrodo
metlico de primera especie se utiliza para medir la
actividad de un anin con el que su ion forma un
Ilustracin 2. Electrodo Ag/AgCl.
3
precipitado o un complejo estable, se tiene un electrodo de segunda especie. As,
por ejemplo, cuando se introduce un hilo de plata en una disolucin conteniendo
iones cloruro, la plata se oxida electro-qumicamente segn el proceso:
Y su potencial de equilibrio ser:
Ecuacin 1. Potencial en el punto de equivalencia del electrodo de Ag/AgCl.
El ion cloruro no intercambia electrones, pero puede determinarse indirectamente
a travs de la medida del potencial que adopta el electrodo de plata.
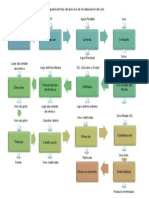
DIAGRAMAS DE BLOQUES
Graficar el potencial en funcin del volumen gastado.
Registrar el volumen gastado y el potencial en cada punto.
Tomar lectura del potencial con valoraciones de 0.5 mL
Llenar la bureta con disolucin AgNO
3
0.1M
Introducir el agitador magntico y el electrodo al vaso de precipitados.
Conectar electrodo de platino al potencimetro.
Calibrar potencimetro con el electrodo de pH y las soluciones bufer.
Encender el conductimtro.
Tomar alicuota de KCl de 10 mL y diluir en un vaso de precipitado con agua desionizada.
Montar dispositivo.
4
RESULTADOS
Tabla 1. Resultados obtenidos de la prctica 11.
mL adicionados de AgNo3 Potencial [mV] mL adicionados de AgNo3 Potencial [mV]
0 392 8.5 454
0.5 399 9 470
1 403 9.5 508
1.5 406 10 639
2 408 10.5 645
2.5 410 11 652
3 412 11.5 661
3.5 414 12 664
4 416 12.5 666
4.5 418 13 668
5 422 13.5 671
5.5 425 14 672
6 428 14.5 673
6.5 431 15 675
7 435 15.5 675
7.5 440 16 676
8 445
ANALISIS DE RESULTADOS
1. Construir la grfica de conductancia en funcin del volumen agregado de
titulante:
300
350
400
450
500
550
600
650
700
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
P
o
t
e
n
c
i
a
l
[
m
V
]
Volumen adicionado de AgNO3 [mL]
Valoracin de KCl con AgNO
3
5
2. Calcular el punto de equivalencia con los siguientes mtodos:
Mtodo del paralelogramo:
mL gastados de AgNO3: 9.55
Concentracin inicial:
=
()(
= 0.0955M
% de error: 4.5%
Mtodo de la primera derivada:
mL gastados de AgNO3: 9.75
300
350
400
450
500
550
600
650
700
0 2 4 6 8 10 12 14 16
P
o
t
e
n
c
i
a
l
[
m
V
]
Volumen adicionado de AgNO3 [mL]
Valoracin de KCl con AgNO
3
-50
0
50
100
150
200
250
300
0 2 4 6 8 10 12 14 16
E
/
V
Volumen promedio adicionado de AgNO
3
[mL]
Mtodo de la 1ra derivada
6
Concentracin inicial:
=
()(
= 0.0975M
% de error: 2.5%
Mtodo de la 2da derivada:
mL gastados de AgNO3: 9.7
Concentracin inicial:
=
()(
= 0.097M
% de error: 3%
Mtodo de Gran:
-600
-500
-400
-300
-200
-100
0
100
200
300
400
500
0 2 4 6 8 10 12 14 16
)
/
Volumen promedio adicionado de AgNO
3
[mL]
Mtodo de la 2da derivada
0
0.005
0.01
0.015
0.02
0.025
0.03
9 9.2 9.4 9.6 9.8 10
V
/
E
Volumen promedio adicionado de AgNo3 [mL]
Mtodo de Gran
7
mL gastados de AgNO3: 9.62
Concentracin inicial:
=
()(
= 0.0962M
% de error: 3.8%
3. Con el punto de equivalencia calcular la concentracin de
en el PE.
De la ecuacin 1, despejamos
CONCLUSIONES
Se lograron los objetivos al obtener un punto final de 9.7 mL de AgNO
3
gastados
en el punto de equivalencia, calculado a partir de diferentes mtodos y
contrastando con la curva de valoracin potenciometrica obtenida. Nuestra
concentracin final de Cl fue de
lo cual es correcto pues en el
punto de equivalencia el ion Cl debe de estar en una concentracin de
aproximadamente 0 ya que casi todo formo un precipitado con la plata.
Finalmente se concluye que el mtodo de valoracin potenciomtrica aplicado a
compuestos que forman precipitados es muy preciso.
MEMORIA DE CLCULO
Tabla 2. Tratamiento de datos de la prctica 11.
Paralelogramo Primer derivada Segunda derivada Gran
Vol. [mL] E
0 392 Vol. Prom.
[mL]
E/V Vol. Prom.
[mL]
V/E
0.5 399 0.25 14
Vol. Prom.
[mL]
(E/V)/V
0.25 0.07142857
1 403 0.75 8 0.5 -12 0.75 0.125
1.5 406 1.25 6 1 -4 1.25 0.16666667
2 408 1.75 4 1.5 -4 1.75 0.25
2.5 410 2.25 4 2 0 2.25 0.25
3 412 2.75 4 2.5 0 2.75 0.25
3.5 414 3.25 4 3 0 3.25 0.25
4 416 3.75 4 3.5 0 3.75 0.25
8
4.5 418 4.25 4 4 0 4.25 0.25
5 422 4.75 8 4.5 8 4.75 0.125
5.5 425 5.25 6 5 -4 5.25 0.16666667
6 428 5.75 6 5.5 0 5.75 0.16666667
6.5 431 6.25 6 6 0 6.25 0.16666667
7 435 6.75 8 6.5 4 6.75 0.125
7.5 440 7.25 10 7 4 7.25 0.1
8 445 7.75 10 7.5 0 7.75 0.1
8.5 454 8.25 18 8 16 8.25 0.05555556
9 470 8.75 32 8.5 28 8.75 0.03125
9.5 508 9.25 76 9 88 9.25 0.01315789
10 639 9.75 262 9.5 372 9.75 0.00381679
10.5 645 10.25 12 10 -500 10.25 0.08333333
11 652 10.75 14 10.5 4 10.75 0.07142857
11.5 661 11.25 18 11 8 11.25 0.05555556
12 664 11.75 6 11.5 -24 11.75 0.16666667
12.5 666 12.25 4 12 -4 12.25 0.25
13 668 12.75 4 12.5 0 12.75 0.25
13.5 671 13.25 6 13 4 13.25 0.16666667
14 672 13.75 2 13.5 -8 13.75 0.5
14.5 673 14.25 2 14 0 14.25 0.5
15 675 14.75 4 14.5 4 14.75 0.25
15.5 675 15.25 0 15 -8 15.25 0.25
16 676 15.75 2 15.5 4 15.75 0.5
Mtodo de la primer derivada:
Ejemplo (datos tomados de la tabla 2):
Mtodo de la segunda derivada:
(
Ejemplo (datos tomados de la tabla 2):
(
9
Mtodo de Gran:
Ejemplo (datos tomados de la tabla 2):
BIBLIOGRAFA
Hernndez, R. (2011). Anlisis instrumental, tcnicas electroanalticas. Mxico: McGraw-Hill. pp.
260-291
Chang, R. (2008). Fisicoqumica (3 ed.). E. U. A.: McGraw-Hill, pp. 768
Chang, R. (2010). Qumica (10 ed.). E. U. A.: McGraw-Hill
Skoog, D., West, D., Holler, F. y Crouch, S. (2001). Qumica analtica (7 ed.). Mxico, D. F.:
McGraw-Hill. pp. 363-374
Вам также может понравиться
- Magistral #1 Movimiento Rectilíneo Acelerado PDFДокумент21 страницаMagistral #1 Movimiento Rectilíneo Acelerado PDFPapelero Jack100% (1)
- 4 Cuadros Mtra. Enriqueta GarcíaДокумент6 страниц4 Cuadros Mtra. Enriqueta GarcíaAli Casas100% (1)
- Formulario de Metodos NumericosДокумент2 страницыFormulario de Metodos NumericosJerson Torres CardenasОценок пока нет
- El Sistema de Fundamentos BartenieffДокумент17 страницEl Sistema de Fundamentos BartenieffAlexis Obreque92% (13)
- Manual de Los Códigos Q en EspañolДокумент79 страницManual de Los Códigos Q en Españolgreiss100% (3)
- Merado Mujeres Con Deficiencia de B12Документ5 страницMerado Mujeres Con Deficiencia de B12Ed ArceОценок пока нет
- PrimerParcial Proyecto TamalesДокумент15 страницPrimerParcial Proyecto TamalesEd ArceОценок пока нет
- TareafinalДокумент18 страницTareafinalEd ArceОценок пока нет
- Practica 1 BioingenieriaДокумент6 страницPractica 1 BioingenieriaEd ArceОценок пока нет
- Diagrama de Flujo Del Proceso de La Elaboraci+ N Del VinoДокумент1 страницаDiagrama de Flujo Del Proceso de La Elaboraci+ N Del VinoEd ArceОценок пока нет
- El Diario de Un ChicoДокумент4 страницыEl Diario de Un ChicoEd ArceОценок пока нет
- LFTДокумент2 страницыLFTEd ArceОценок пока нет
- Capitulo 1 MedicionesДокумент26 страницCapitulo 1 MedicionesbetjodaОценок пока нет
- Introduccion A La Nomenclatura IUPAC de Compuestos OrganicosДокумент36 страницIntroduccion A La Nomenclatura IUPAC de Compuestos Organicosapi-3778539100% (7)
- Taller 3. Estructuras Cristalinas y Amorfas en Los MaterialesДокумент2 страницыTaller 3. Estructuras Cristalinas y Amorfas en Los MaterialesRicardo Chegwin HillembrandОценок пока нет
- Aceros, Perfiles y Comercializacion Del Acero, Luis Lenin Lines AguilarДокумент8 страницAceros, Perfiles y Comercializacion Del Acero, Luis Lenin Lines Aguilaralex100% (1)
- Curso TOFD Llog PDFДокумент50 страницCurso TOFD Llog PDFhenry sanabriaОценок пока нет
- Fisica Cuarto ParcialДокумент3 страницыFisica Cuarto ParcialMariví Alvarez0% (1)
- Pensum ElectronicaДокумент1 страницаPensum ElectronicaCamilo QuimbayaОценок пока нет
- NitrógenoДокумент11 страницNitrógenoNatalia Arana GarduñoОценок пока нет
- Concreto DigitalДокумент25 страницConcreto DigitalLucio APОценок пока нет
- Aguja de Sutura Quirúrgica y Su Procedimiento de FabricaciónДокумент9 страницAguja de Sutura Quirúrgica y Su Procedimiento de FabricaciónLilia HurtadoОценок пока нет
- Marco Teorico - CafeДокумент24 страницыMarco Teorico - CafeYuleisy Matta CanovaОценок пока нет
- Informe Previo1 Tele2Документ2 страницыInforme Previo1 Tele2JesusAlainMedinaApaicoОценок пока нет
- Problemas Grupo-01 PDFДокумент2 страницыProblemas Grupo-01 PDFHiro Manuel Lozada NisshiokaОценок пока нет
- Equipos y Accesorios de Cementación PetroleraДокумент37 страницEquipos y Accesorios de Cementación PetroleraJose Benito Rioja100% (1)
- Filtro Pasa BandaДокумент4 страницыFiltro Pasa BandaLuisa MartinezОценок пока нет
- Tema Ecuacion DiferencialДокумент23 страницыTema Ecuacion DiferencialMerlin Joseph M0% (1)
- Determinacionde Aceites y Grasas en AguaДокумент3 страницыDeterminacionde Aceites y Grasas en AguaJonathan Arley Valencia DurangoОценок пока нет
- Texto Estudiante 4º Medio Parte 2 PDFДокумент113 страницTexto Estudiante 4º Medio Parte 2 PDFCarolina Estefania De La Fuente GermanieОценок пока нет
- Brazo HidráulicoДокумент3 страницыBrazo HidráulicoDelia IngaОценок пока нет
- Photoshop AvanzadoДокумент0 страницPhotoshop AvanzadoggleytonОценок пока нет
- Practica1. Laboratorio Maquinas Eléctricas FIДокумент6 страницPractica1. Laboratorio Maquinas Eléctricas FISevy Tom ZoriuqОценок пока нет
- Fisuras-Fracturas-Grietas en HnAo (Plataforma Arquitectura)Документ10 страницFisuras-Fracturas-Grietas en HnAo (Plataforma Arquitectura)Rodolfo ScippoОценок пока нет
- De Caso Nacional InformeДокумент13 страницDe Caso Nacional InformeJulioAvalosAgurtoОценок пока нет
- Teorema de ThéveninДокумент4 страницыTeorema de ThéveninJúán Cárlos GarrochambaОценок пока нет
- Lista # 2 - Edo 1Документ2 страницыLista # 2 - Edo 1gonzaloОценок пока нет
- Laboratorio Nro. 01 - Normas de Seguridad en LaboratorioДокумент4 страницыLaboratorio Nro. 01 - Normas de Seguridad en LaboratorioLiza Carrion IdmeОценок пока нет
- Malla Matematicas 10 Y11 DBA Yarumito2016Документ8 страницMalla Matematicas 10 Y11 DBA Yarumito2016moises mosquera quinteroОценок пока нет