Академический Документы
Профессиональный Документы
Культура Документы
Ácido Fenoxiacético Previo
Загружено:
Alejandra Mendoza100%(1)100% нашли этот документ полезным (1 голос)
788 просмотров12 страницОригинальное название
Ácido Fenoxiacético previo
Авторское право
© © All Rights Reserved
Доступные форматы
DOCX, PDF, TXT или читайте онлайн в Scribd
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOCX, PDF, TXT или читайте онлайн в Scribd
100%(1)100% нашли этот документ полезным (1 голос)
788 просмотров12 страницÁcido Fenoxiacético Previo
Загружено:
Alejandra MendozaАвторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOCX, PDF, TXT или читайте онлайн в Scribd
Вы находитесь на странице: 1из 12
1
Universidad Nacional Autnoma de Mxico
Facultad de Estudios Superiores Cuautitln
Laboratorio de Qumica Orgnica II
Sntesis de Williamson: Obtencin de cido fenoxiacetico
Investigacin previa
Mendoza Meja Erandeny Monserrat
Moreno Carolina
Lic. Bioqumica Diagnostica
Grupo: 1202
Semestre 2015-I
2
Objetivos:
General: Preparar cido fenoxiacetico mediante la Sntesis de Williamson y as
proporcionar un ejemplo de Nucleoflica Bimolecular.
Particulares:
1. Preparar mediante una reaccin de sustitucin nucleofilica
bimolecular un ter
2. Practicar la tcnica de extraccin selectiva por medio de
solventes, aplicando propiedades de cidos carboxlicos para
separarlos de fenoles (purificar)
3. Distinguir las propiedades acido- base de fenoles y acidos
carboxlicos
4. Observar el cambio9 que ocurre en el rendimiento al variar las
concentraciones de reactivos y el tiempo de reflujo
Fundamento
La reaccin entre un haloalcano primario y un alcxido (o bien alcohol en medio
bsico) es el mtodo ms importante para preparar teres. Esta reaccin es
conocida como sntesis de Williamson.
Esta reaccin transcurre a travs del mecanismo SN2.
La importante basicidad de los alcxidos produce reacciones de eliminacin con
sustratos secundarios y terciarios, formando alquenos en lugar de teres.
Otra situacin en la que Williamson no rinde teres, es en el caso de emplear
alcxidos impedidos, como tert-butxido de potasio. Debido a su gran tamao
el tert-butxido elimina incluso con sustratos primarios.
Con haloalcanos primarios y sobre todo con haloalcanos que carecen de
hidrgenos b el rendimiento de Williamson es muy bueno.
3
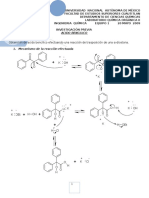
OBTENCIN DE TERES
teres a partir de alcoholes primarios.
Los teres simtricos pueden prepararse por condensacin de alcoholes. La
reaccin se realiza bajo calefaccin (140C) y con catlisis cida. As, dos
molculas de etanol condensan para formar dietil ter.
El mecanismo de la reaccin transcurre en las siguientes etapas:
A partir de alcoholes secundarios o terciarios.
En este caso la reaccin transcurre en condiciones ms suaves, a travs de
mecanismos SN1.
El mecanismo transcurre con formacin de un carbocatin terciario de gran
estabilidad
Etapa 1. Protonacin del alcohol terciario
Etapa 2. Formacin del carbocatin por prdida de agua
4
Etapa 3. Ataque nuclefilo del metanol
Esquema de la reaccin general
Mecanismo de Reaccin
OH
+
Cl
OH
O
O
OH
O
-OH
Acidez de fenoles
Constantes de acidez:
Agua 1 x 10-14
Alcoholes 10-16 a 10-18
Fenol 1,1 x 10-10
cidos carboxlicos 10-5
Si se comparan las constantes de acidez de
los fenoles con las del agua, los alcoholes y
los cidos carboxlicos, se puede concluir
que los fenoles son cidos ms fuertes que
el agua y que los alcoholes, pero ms
dbiles que los cidos carboxlicos.
El fenol presenta cinco estructuras contribuyentes, es
decir que pueden ceder protones. Dos de estas
estructuras corresponden a la resonancia del anillo
bencnico. La resonancia viene dada por la ubicacin de
los dobles enlaces dentro de la molcula.
Las otras tres estructuras son posibles
debido al carcter bsico del oxgeno que
le permiten compartir ms de un par de
electrones con el anillo.
Acidez de cidos Carboxlicos
5
Comportamiento cido: el hidrgeno del grupo hidroxilo de los cidos carboxlicos presenta un pKa
comprendido entre 4 y 5, valores relativamente bajos que tienen su explicacin en la importante
electronegatividad del grupo carbonilo al que est unido y a la estabilizacin por resonancia de la
base conjugada.
Estabilizacin del carboxilato por resonancia
La base de los cidos carboxlicos es dbil, debido a la estabilizacin por resonancia.
Extraccion: La extraccin es la transferencia de un soluto de un disolvente a otro.
Cuandose utiliza un disolvente orgnco el soluto se extrae por un proceso de
distribucin.
Extraccion con disolventes activos
La extraccin con disolventes actvos (selectiva) se emplea para separar
mezclas de compuestos orgnicos en funcin de la acidez, de la basicidad o
de la neutralidad de stos. La extraccin con disolvente actvo se basa en una
reaccin cido-base entre el producto a separar y el disolvente activo adecuado
Desarrollo Experimental:
1. En un matraz de bola de una boca disuelva 0.7 g de fenol en (2-4) mL de NaOH
33% (determine la alcalinidad de la disolucin con papel pH), tape el matraz con
1 tapn y agite vigorosamente durante 5 min., agregue 0.75 g de cido
monocloroactico, vuelva a tapar el matraz y agite otros 5 min., (Si la mezcla se
hace pastosa puede agregar de 1 a 3 mL de agua, si se agrega en exceso puede
disolverse el producto.)
2. Quite el tapn y coloque el matraz en un bao mara con un sistema de reflujo
durante 10-35 min. Enfre la solucin y diluya con 5 mL de agua, acidule con HCl
conc., hasta pH = 1. Coloque la mezcla en el embudo de separacin y extraiga
con:
(a) ter etlico usando tres porciones de 5ml c/u. Junte los extractos orgnicos y
colquelos en el
embudo de separacin.
6
(b) Lave la fase orgnica tres veces con 5ml de agua cada vez. Separe las
fracciones acuosas que, se desecharn al final del experimento
(c) La fraccin orgnica se extrae con Na2CO3 15% tres porciones de 2.5 mL c/u
3. El extracto acuoso alcalino se acidula con HCl concentrado, (PRECAUCIN la
adicin debe ser gota a gota porque se puede producir espuma-), hasta la
precipitacin de todo el producto. Separe el slido por filtracin al vaco. (S es
necesario recristalice con agua caliente).
4. Registre sus resultados en el cuadro y a travs de la graficacin de sus
resultados determine la mnima cantidad de sosa y el mnimo de tiempo
necesarios para obtener el mximo rendimiento.
5. Determinar: ccf comparativa (TAFF; n-hexano/ AcOEt 8:2, I2), punto de fusin
del producto as como el rendimiento de la reaccin.
Calculo del rendimiento terico
Con el fin de observar el efecto de la cantidad de hidrxido de sodio y del tiempo
de reflujo sobre el rendimiento de la reaccin, la obtencin de cido
fenoxiactico se llevar a cabo en diferentes condiciones de reaccin
7
Diagrama de secuencia Experimental Ecolgico
D1, D2 y D4: Mezclar las tres y dependiendo del pH, neutralizar. Filtrar si hay
slidos y tirar al drenaje.
D3: Recuperar disolvente por destilacin, separando slidos por filtracin.
Incinerar colas de destilacin y slidos.
2) Calentar a B.M. 40 min
4) Diluir y llevar a pH=1
Fenol NaOH
cido Monocloro
Actico
Mezcla de
Reaccin
1) Agitar 5 minutos
3) Enfriar
NaOH
+
HCl
Fase
Acuosa
c. Fenoxiactico
c. Hidroxiactico
Fenol
5) Ex.ter Etilico
Fase Acuosa
Fase Acuosa
Fase Orgnica
6) Lavar con agua
Fase Orgnica
6) Na2CO3
Sal sdica de los c.
Hidroxi y Fenoxiacticos
ter Etlico
+
Fenol
Fase Acuosa Fase Orgnica
HCl + c. Hidroxiactico cido Fenoxiactico
8) + HCl 1:1
9) Filtrar
Lquido Slido
D1
D2
D3
D4
8
Toxicidad y Propiedades Fsicas de Reactivos
1. Hidrxido de sodio:
a. Toxicidades: irritacin severa por inhalacin, corrosivo por
ingestin, corrosivo para la piel, corrosivo para los ojos.
b. Propiedades Fsicas: granallas blancas, inodoras,
solubilidad en agua 111g/100g, gravedad especfica 2,13, pH 13-
14 (en solucin al 5%), punto de ebullicin 1390C, punto de fusin 318C.
2. Fenol:
a. Toxicidades: Quemaduras por contacto, txico en
contacto con la piel y al ser ingerido (Corrosivo e irritante).
b. Propiedades Fsicas: slido entre incoloro y rosa plido,
olor dulzn y acre, solubilidad en agua 1g/15 g, Peso molecular: 94.11
g/mol, punto de ebullicin 182 C, punto de fusin 40.5-41 C.
3. cido Fenoxiactico
a. Toxicidades: Irritacin en la piel y ojos por contacto,
adems de ser corrosivo.
b. Propiedades Fsicas: slido, Peso molecular 152.15g/mol,
Se descompone a 285C, punto de fusin 98C.
4. cido Monocloro Actico
a. Toxicidades: Muy irritante y corrosivo en contacto con la
piel, cuidado al inhalar, e ingerir. Es tambin un permeador.
b. Propiedades Fsicas: cristales incoloros, olor acre y
ahogante, soluble en agua, Peso molecular 94.5g/mol, punto de ebullicin
189C, punto de fusin 63C.
5. cido clorhdrico:
a. Toxicidades: corrosivo por inhalacin, corrosivo por
ingestin, corrosivo por contacto con la piel, corrosivo por
contacto con los ojos. En todos los casos puede llegar a ser fatal.
b. Propiedades fscas: lquido fumante incoloro, olor caracterstico,
infinitamente soluble en agua, pH 0,1 (solucin 1,0N), punto de ebullicin
53C, punto de fusin -74C
6. Carbonato de Sodio:
a. Toxicidades: Puede causar irritacin por contacto con la
piel y rganos, especialmente los pulmones.
b. Propiedades fscas: polvo blanco, inodoro, soluble en agua
caliente, parcialmente soluble en agua fra, Peso Molecular: 105.99 g/mol,
punto de fusin 851C
7. cido Hidroxiactico:
a. Toxicidades: Corrosivo e irritante. Daos en la piel,
pulmones, ojos y en caso de ingestin.
9
b. Propiedades Fsicas: slido blanco-amarillento, inodoro,
soluble en agua fra, Peso molecular 76.05g/mol, punto de fusin 79C.
8. ter Etlico:
a. Toxicidades: Irritacin en contacto con la piel, cuidado de
inhalarlo o ingerirlo.
b. Propiedades Fsicas: lquido incoloro, voltil, dulzn, soluble en
acetona, parcialmente soluble en agua fra, Peso molecular 74.12 g/mol,
punto de ebullicin 34.6C, punto de fusin -116.3C.
Propiedades Fsicas, qumicas y toxicolgicas
Fenol
Acidez 9.95 pKa
Solubilidad en agua: 8.3 g/100 ml (20 C)
Momento dipolar 1.7 D
Peso molecular 94.11
Densidad 41/4 1.05 g/cm3
FORMULA: NaOH.
PESO MOLECULAR: 40.01 g/mol
COMPOSICION: Na: 57.48 %; H: 2.52 % y O:40.00%
PROPIEDADES FISICAS Y TERMODINAMICAS:
Punto de ebullicin: 1388C (a 760 mm de Hg)
Punto de fusin: 318.4 C
Indice de refraccin a 589.4 nm: 1.433 ( a 320 ) y 1.421 (a 420 C)
Presin de vapor: 1mm (739 C)
Densidad: 2.13 g/ml (25 C)
Solubilidad: Soluble en agua, alcoholes y glicerol, insoluble en acetona (aunque
reacciona con ella) y ter.1 g se disuelve en 0.9 ml de agua, 0.3 ml de agua
hirviendo, 7.2 ml de alcohol etlico y 4.2 ml de metanol. pH de disoluciones
acuosas (peso/peso): 0.05 %:12; 0.5 %: 13 y 5 %: 14
PROPIEDADES QUIMICAS:
El NaOH reacciona con metales como Al, Zn y Sn, generando aniones como AlO2
-, ZnO2- y SnO32- e hidrgeno. Con los xidos de estos metales, forma esos mismos
aniones y agua. Con cinc metlico, adems, hay ignicin.
cido monocloroacetico
Apariencia:
Cristales incoloros.
Olor:
Penetrante, olor ardiente.
Solubilidad:
Muy soluble en agua.
Densidad:
10
1.580
pH:
No se encontr informacin.
% Voltiles por volumen @ 21C (70F):
No se encontr informacin.
Punto de Ebullicion:
189C (372F)
Punto de Fusin:
61 - 63C (142 - 145F)
Densidad de Vapor (Aire=1):
3.26
CARBONATO DE SODIO (Na2CO3)
Nombre Comercial : Carbonato de Sodio
Sinnimos : Carbonato sdico anhidro, sosa calcinada, soda ash.
Formula Qumica : (Na2CO3)
Peso Molecular : 105.99 g/mol
Uso : Fabricacin de jabn, vidrio y tintes
Estado fsico a 20C :Polvo, granulos
Color :Blanco
Olor :Inodoro
Punto de fusin [C] :851 C
Punto de ebullicin [C] : Descomposicin.
Presin de vapor, 20C :N. A.
Densidad relativa al agua 2,54 g/cm3
Solubilidad en agua [% en peso] : 71 g/l a 0 C / 471 g/l a 32 C
Limites de explosin - Inferior [%] : N.A.
Limites de explosin - Superior [%] : N.A.
Peso molecular : 105.99 g/mol
cido Fenoxiactico
Frmula molecular C8H8O3
Massa molar 152,15 gmol
-1
Aparncia p branco ou esbranquiado,
1
cristais em forma de agulha
Punto de fusin 98100 C
1
1
Punto de ebullicin: 285 C
1
Solubilidad: solvel em cido actico, etanol eter dietlico
2
Acidez (pKa) 3,17 (25 C)
FORMULA: HCl
PESO MOLECULAR: 36.46 g/mol
COMPOSICION: Cl: 97.23 % y H: 2.76 %.
Presin de vapor ( A 17.8 C): 4 atm
Densidad del vapor: 1.27
Densidad del gas (a 0 C): 1.639 g/l
11
Indice de refraccin de disolucin 1.0 N (a 18 C): 1.34168.
Densidad de disoluciones acuosas peso/peso (15 C): 1.05 (10.17 %); 1.1 (20 %);
1.15 (29.57%); 1.2
( 39.11%).
Puntos de congelacin de disoluciones acuosas: -17.14C (10.81 %); -62.25C
(20.69 %); -46.2C
(31.24 %); -25.4C (39.17 %)
Productos de descomposicin de este compuesto: cloruro de hidrgeno.
Reacciona con la mayora de metales desprendiendo hidrgeno.
ETER ETILICO
FORMULA: C4H10O, CH3-CH2-O-CH2-CH3
PESO MOLECULAR: 74.12 g/mol
COMPOSICION: C: 64.81 %; H: 13.60 % y O: 21.59 %.
Punto de ebullicin(oC): 34.6 (a 760 mm de Hg); 17.9 (a 400 mm de Hg); 2.2 (a 200
mm de Hg); -11.5 ( a
100 mm de Hg); -48.1 (a 10 mm de Hg) y -74.3 ( a 1 mm de Hg).
Punto de fusin: -116.2 oC.(cristales estables) y -123.3 oC (cristales metaestable).
Densidad(g/ml ): 0.7364 (a 0 oC); 0.7249 (a 10 oC); 00.7135 (a 20 oC) y 0.7019 (a 30
oC). Indice de
refraccin (a 15 oC): 1.35555.
Presin de vapor (mm de Hg ): 184.9 ( a 0 oC); 290.8 (a 10 oC), 442 (a 20 oC); 1275
(a 50 oC) y 2304 (a 70
oC).
Punto de inflamacin en copa cerrada (Flash point): -45 oC.
PROPIEDADES QUIMICAS:
Este compuesto forma perxidos inestables en presencia de aire y luz solar, los
cuales explotan
espontaneamente, especialmente cuando se concentran durante una
destilacin.
Reacciona violentamente con:
- halgenos y derivados como cloro, bromo, trifluoruro de bromo y heptafluoruro
de yodo
- agentes oxidantes como aire lquido, cido perclrico, cloruro de cromilo, cido
permangnico,
cloruro de sulfurilo, perxido de sodio y agua y xido de yodo (VII).
12
Fuentes bibliogrficas:
Brewster, R. Curso Prctico de Qumica Orgnica. Alhambra, 3ra Edicin. Espaa. 1970
Macy, R. Qumica Orgnica Simplificada. Revert. Espaa, 1992.
John McMurry. Organic Chemistry. Brooks/Cole Publishing Company, 3ra. Edicin.
Estados Unidos, 1992.
Wingrove, A. Organic Chemistry. Harper & Row Publishers. USA, 1939
Fuentes electrnicas:
Science Labs Material Safety Data Sheet Listing (Internet) Disponible en:
<http://www.sciencelab.com/msdsList.php>
[Fecha de consulta: 22/08/2014]
Вам также может понравиться
- Ley de RaoultДокумент12 страницLey de RaoultJimenaSilvarОценок пока нет
- Practica 2 Organica 2 ArticuloДокумент3 страницыPractica 2 Organica 2 ArticuloLuis Miranda GonzalezОценок пока нет
- Problemario2yadocx PDFДокумент52 страницыProblemario2yadocx PDFDiegoОценок пока нет
- Previo Condensación AldolicaДокумент7 страницPrevio Condensación AldolicaRodrigo Colin100% (1)
- Previo 1 IDENTIFICACIÓN DE ALDEHÍDOS Y CETONASДокумент11 страницPrevio 1 IDENTIFICACIÓN DE ALDEHÍDOS Y CETONASYair QuinteroОценок пока нет
- Previo Ácido FenoxiacéticoДокумент6 страницPrevio Ácido FenoxiacéticoJosh Tapia MuciñoОценок пока нет
- E1 Previo 5 Condensación de ClaisenДокумент8 страницE1 Previo 5 Condensación de ClaisenLeslie Karina De León SánchezОценок пока нет
- Taller Aplicacion Leyes de Los Gases 9-2Документ2 страницыTaller Aplicacion Leyes de Los Gases 9-2Ana giselleОценок пока нет
- DicinamalacetonaДокумент4 страницыDicinamalacetonaFanny Venado HernandezОценок пока нет
- Difenil Carbinol Alumno FES-C V 2ggДокумент4 страницыDifenil Carbinol Alumno FES-C V 2ggDanGodAlvОценок пока нет
- Obtención de Ácido Fenoxiacético Por Medio de Una SN2Документ11 страницObtención de Ácido Fenoxiacético Por Medio de Una SN2nashniОценок пока нет
- Acido FenoxiaceticoДокумент7 страницAcido FenoxiaceticoAngel FloresОценок пока нет
- Síntesis Williamson ácido fenoxiacéticoДокумент4 страницыSíntesis Williamson ácido fenoxiacéticoFerОценок пока нет
- Síntesis de Éteres Β- NerolinaДокумент14 страницSíntesis de Éteres Β- NerolinaRoman RamirezОценок пока нет
- Reporte Ácido FenoxiáceticoДокумент3 страницыReporte Ácido FenoxiáceticotertbutilОценок пока нет
- Previo Acido CinamicoДокумент9 страницPrevio Acido CinamicoJose Emmanuel ChemaОценок пока нет
- Práctica 1. SÍNTESIS DE WILLIAMSON - OBTENCIÓN DEL ÁCIDO FENOXIACÉTICo Y DE CLORURO DE TER-BUTILOДокумент16 страницPráctica 1. SÍNTESIS DE WILLIAMSON - OBTENCIÓN DEL ÁCIDO FENOXIACÉTICo Y DE CLORURO DE TER-BUTILODaniela Alejandra Elizalde MancillaОценок пока нет
- Previo de Orgánica P-NitroanilinaДокумент12 страницPrevio de Orgánica P-NitroanilinaAngeles MendezОценок пока нет
- B Nerolina ReporteДокумент2 страницыB Nerolina ReporteArturoPérez100% (1)
- Acetanilida derivados ácidosДокумент7 страницAcetanilida derivados ácidosLiLiana Niño100% (1)
- Informe Final.P NitroanilinaДокумент24 страницыInforme Final.P NitroanilinaJorge OsorioОценок пока нет
- Reporte Benzoína Bencilo Acido BencilicoДокумент3 страницыReporte Benzoína Bencilo Acido BencilicoAlan0% (1)
- Prev 6Документ6 страницPrev 6Gabriela HernandezОценок пока нет
- Previo BenciloДокумент6 страницPrevio BenciloHeber Daniel Andrade Rivera100% (1)
- Azocompuestos PrevioДокумент11 страницAzocompuestos PreviopamelaОценок пока нет
- PrevioДокумент4 страницыPrevioHugo AlemánОценок пока нет
- Previo Obtencion de M NitroanilinaДокумент2 страницыPrevio Obtencion de M NitroanilinaJose Emmanuel ChemaОценок пока нет
- Identificacion de Aldehidos y CetonasДокумент48 страницIdentificacion de Aldehidos y CetonasUriel Ramos100% (1)
- BENCILO PrevioДокумент5 страницBENCILO PrevioDaniel Bautista100% (1)
- Reporte DibenzalacetonaДокумент2 страницыReporte DibenzalacetonaluisОценок пока нет
- Previo 9 Fico 4Документ2 страницыPrevio 9 Fico 4Luis E. Mendoza H.Оценок пока нет
- Síntesis p-nitroanilinaДокумент5 страницSíntesis p-nitroanilinaCésar Mendiola San Róman0% (1)
- Obtención p-nitroanilinaДокумент7 страницObtención p-nitroanilinaLiLiana Niño100% (1)
- Acido Picrico ReporteДокумент3 страницыAcido Picrico ReportePaul ValdezОценок пока нет
- Obtención de rojo de metilo mediante acoplamiento de sales de diazonioДокумент8 страницObtención de rojo de metilo mediante acoplamiento de sales de diazonioErnesto ZavalaОценок пока нет
- Previo Difenil CarbinolДокумент7 страницPrevio Difenil CarbinolOscar Correa100% (1)
- Reporte Practica 2 - Sintesis de AzocompuestosДокумент7 страницReporte Practica 2 - Sintesis de AzocompuestosNicte Llanes0% (1)
- Síntesis de ácido bencílico a partir de benzaldehídoДокумент5 страницSíntesis de ácido bencílico a partir de benzaldehídoZoledad Tavera100% (1)
- Reducción de cetona a alcohol en medio básicoДокумент4 страницыReducción de cetona a alcohol en medio básicogancho2010Оценок пока нет
- Previo Orgánica AcetanilidaДокумент9 страницPrevio Orgánica AcetanilidaAngeles MendezОценок пока нет
- Perkin Acido CinamicoДокумент5 страницPerkin Acido CinamicoFernanda DomínguezОценок пока нет
- Síntesis de β-nerolina a través de la reacción de b-naftol y metanol-ácido sulfúricoДокумент3 страницыSíntesis de β-nerolina a través de la reacción de b-naftol y metanol-ácido sulfúricorubenОценок пока нет
- Previo 3Документ7 страницPrevio 3Diana MoedanoОценок пока нет
- Previo AzocompuestosДокумент10 страницPrevio AzocompuestosJose Emmanuel ChemaОценок пока нет
- Practica 7 NitroanilinaДокумент4 страницыPractica 7 NitroanilinaRomano100% (1)
- Difenil Carbinol PrevioДокумент5 страницDifenil Carbinol PrevioYoselin MartinezОценок пока нет
- Acido Fenoxiacetico Previo y ReporteДокумент5 страницAcido Fenoxiacetico Previo y Reportebrayan gutierrezОценок пока нет
- Previo 10 Acido BencilicoДокумент5 страницPrevio 10 Acido BencilicospellfloresОценок пока нет
- Previo 6 Sintesis de Hantzsch para PiridinasДокумент3 страницыPrevio 6 Sintesis de Hantzsch para PiridinasJulio Cesar Venegas Muñoz50% (2)
- Previo 7 Org IIДокумент3 страницыPrevio 7 Org IIPipö Lopz Lömbardo67% (3)
- Previo para P-NitroanilinaДокумент10 страницPrevio para P-NitroanilinaCarlos CastilloОценок пока нет
- ACIDO PÍCRICO ReporteДокумент5 страницACIDO PÍCRICO ReporteDiana MontebelloОценок пока нет
- Reacción de Claisen SchmidtДокумент3 страницыReacción de Claisen SchmidtKimberly TorresОценок пока нет
- AzocompuestosДокумент11 страницAzocompuestosIsabel Centeno100% (1)
- Practica 1 Reacciones de Sustitucion Nucleofilica Alifatica AutoguardadoДокумент9 страницPractica 1 Reacciones de Sustitucion Nucleofilica Alifatica AutoguardadoDeniseFabelaОценок пока нет
- ComplejosДокумент41 страницаComplejosMartin GonzalezОценок пока нет
- Fluoresceina y FenolftaleinaДокумент6 страницFluoresceina y FenolftaleinaAideth Sâ67% (3)
- PRÁCTICA 8 Analisis Gravimetrico y Conductimetrico de ComplejosДокумент5 страницPRÁCTICA 8 Analisis Gravimetrico y Conductimetrico de ComplejosMarcos Rodrigo0% (2)
- Síntesis de Difenil CarbinolДокумент7 страницSíntesis de Difenil CarbinolAngelОценок пока нет
- Ciclohexanol 3Документ5 страницCiclohexanol 3orale57Оценок пока нет
- Prácticas Química Organica IIIДокумент18 страницPrácticas Química Organica IIIdany_289Оценок пока нет
- Practica 6Документ12 страницPractica 6Luis Charbel Guzman AguilarОценок пока нет
- SOLUBILIDADДокумент8 страницSOLUBILIDADAdrian CorredorОценок пока нет
- Termodinámica y calor: Guía de trabajo sobre conceptos básicosДокумент4 страницыTermodinámica y calor: Guía de trabajo sobre conceptos básicosHansAcevedoОценок пока нет
- Capit-02-Introduccion A Las Turbinas GasДокумент41 страницаCapit-02-Introduccion A Las Turbinas GasRay Rojas100% (1)
- Lab N7 - Maquinas TermicasДокумент13 страницLab N7 - Maquinas TermicasPedro Jose RojasОценок пока нет
- Hoja - Problemas - 2 - Tema 2Документ1 страницаHoja - Problemas - 2 - Tema 2carolina ganado amadorОценок пока нет
- QUÍMICA INVESTIGACION .2da Revision Tya Casi Listo11000 (Autoguardado)Документ40 страницQUÍMICA INVESTIGACION .2da Revision Tya Casi Listo11000 (Autoguardado)Francisco StwolinskyОценок пока нет
- 02 CiclosДокумент49 страниц02 CiclosFernando UrregoОценок пока нет
- Parcial Calor Segunda EntregaДокумент41 страницаParcial Calor Segunda EntregaAgustín Cardona Naranjo100% (1)
- Tecnologia de PolimerosДокумент260 страницTecnologia de Polimerosjomarm46Оценок пока нет
- Preinforme Constante de Solubilidad y Energía Libre de GibbsДокумент7 страницPreinforme Constante de Solubilidad y Energía Libre de GibbsNicolas GarciaОценок пока нет
- Unidad V Quimica Del Agua 1Документ42 страницыUnidad V Quimica Del Agua 1Segundo VillenaОценок пока нет
- PROBLEMA DE EVAPORACIÓN Multiple EfectoДокумент11 страницPROBLEMA DE EVAPORACIÓN Multiple EfectoCoopac CajasolОценок пока нет
- Guía 3 de Química Grado 8° AbrilДокумент13 страницGuía 3 de Química Grado 8° AbrilBrayan David Pion DuranОценок пока нет
- Humidificación - DeshumidificaciónДокумент27 страницHumidificación - DeshumidificaciónFreddy Ortiz Espinoza100% (1)
- Ciclo RankineДокумент6 страницCiclo RankineDaniela CarrilloОценок пока нет
- Capitulo 4 Termodinamica Resuelto PDFДокумент14 страницCapitulo 4 Termodinamica Resuelto PDFJuliana F. OrozcoОценок пока нет
- 2 Parcial Termodinamica G1Документ3 страницы2 Parcial Termodinamica G1Daniz DaniОценок пока нет
- QUIMICA 8 - Sem 5-6 PDFДокумент5 страницQUIMICA 8 - Sem 5-6 PDFImelda GutierrezОценок пока нет
- Guia 4 - Actividad 2Документ19 страницGuia 4 - Actividad 2FedericoОценок пока нет
- Electrones para TanniaДокумент24 страницыElectrones para TanniaMiguel GodinezОценок пока нет
- Laboratorio N3 Acidez y AlcalinidadДокумент10 страницLaboratorio N3 Acidez y AlcalinidadSantiago ForeroОценок пока нет
- Guia 4 Nomenclatura de Ácidos DecimoДокумент5 страницGuia 4 Nomenclatura de Ácidos DecimoalfonsoОценок пока нет
- 5-Integración MúltipleДокумент13 страниц5-Integración Múltipleanon_537209964Оценок пока нет
- G01 Informe #2 PDFДокумент4 страницыG01 Informe #2 PDFmelissaОценок пока нет
- Lista 8Документ17 страницLista 8Gerson LimaОценок пока нет
- Asignatura de Química Analítica e Instrumental: WWW - Unfs.edu - PeДокумент14 страницAsignatura de Química Analítica e Instrumental: WWW - Unfs.edu - PePEDRO AARON REY CHAVEZОценок пока нет
- Razonamiento Matemático SIMULACRO 2Документ5 страницRazonamiento Matemático SIMULACRO 2samuelОценок пока нет