Академический Документы
Профессиональный Документы
Культура Документы
Laboratorio 4 Boyle
Загружено:
jhonalinoechavarriaИсходное описание:
Оригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Laboratorio 4 Boyle
Загружено:
jhonalinoechavarriaАвторское право:
Доступные форматы
Figura 4: Equipo de demostracin
de la Ley de Boyle
Una PC ( con el software logger pro)
LEY DE BOYLE-MARIOTTE
I. LOGROS
Comprobar experimentalmente la ley de Boyle.
Calcular la constante de proporcionalidad establecida en la ley de Boyle.
Confirmar de manera experimental la ley de Boyle.
Medir punto a punto la presin P del aire a temperatura ambiente en dependencia
con la posicin del embolo S.
Determinar experimentalmente la relacin existente entre la presin y el volumen
de aire a temperatura constante.
Calcular experimentalmente el trabajo realizado por un pistn al comprimir un gas.
Analizar con base a grficos obtenidos los datos experimentales de presin y
volumen, qu tanto se ajusta el aire al comportamiento ideal a las condiciones de
trabajo en el laboratorio.
Estimar el valor de la constante k, en la ley de Boyle, para el aire a la temperatura
del laboratorio a partir de las grficas obtenidas.
II. EQUIPOS Y MATERIALES:
Un papel milimetrado
III. MARCO TEORICO:
GASES
Los gases fluyen como lquidos y por esta razn ambos se llaman fluidos la diferencia
principal entre un gas y un lquido es la distancia entre sus molculas. En un gas las
molculas estn alejadas y libres de la fuerza de cohesin que denominan sus
movimientos como en la fase liquida o solida. Sus movimientos tienen menos
restricciones. U gas se expande en forma indefinida, y llena el espacio que tenga
disponible. Solo cuando la cantidad de gas es muy grande, por ejemplo en la atmosfera
de la tierra o en una estrella, las fuerzas de la gravedad si limitan la forma de la masa de
un gas.
LEY DE LOS GASES IDEALES:
La ley de los gases ideales es la ecuacin de estado del gas ideal, un gas hipottico
formado por partculas puntuales, sin atraccin ni repulsin entre ellas y cuyos choques
son perfectamente elsticos (conservacin de momento y energa cintica). Los gases
reales que ms se aproximan al comportamiento del gas ideal son los gases
monoatmicos en condiciones de baja presin y alta temperatura.
Empricamente, se observan una serie de relaciones entre la temperatura, la presin y el
volumen que dan lugar a la ley de los gases ideales, deducida por primera vez por mile
Clapeyron en 1834.
Diagrama presin-volumen a temperatura constante para un gas ideal.
ECUACIN DE ESTADO:
La ecuacin que describe normalmente la relacin entre la presin, el volumen, la
temperatura y la cantidad de un gas ideal es:
PV=nRT.(1)
Donde:
T: es la temperatura del gas
V: es el volumen del gas
P: es la presin del gas
N: es el nmero de moles
R: es la constante universal de los gases
RELACION DE PRESION VOLUMEN: LEY DE BOYLE-MARIOTTE
La Ley de Boyle-Mariotte (o Ley de Boyle), formulada por Robert Boyle y Edme Mariotte,
es una de las leyes de los gases ideales que relaciona el volumen y la presin de una
cierta cantidad de gas mantenida a temperatura constante. La ley dice que el volumen es
inversamente proporcional a la presin:
PV=k
Donde k es constante si la temperatura y la masa del gas permanecen constantes.
Cuando aumenta la presin, el volumen disminuye, mientras que si la presin disminuye
el volumen aumenta. El valor exacto de la constante k no es necesario conocerlo para
poder hacer uso de la Ley; si consideramos las dos situaciones de la figura, manteniendo
constante la cantidad de gas y la temperatura, deber cumplirse la relacin:
P
1
V
1
=
P
2
V
2
Adems se obtiene despejada que:
P
1
= P
2
V
2
/ V
1
V
1
=
P
2
V
2
/ P
1
P
2
= P
1
V
1
/ V
2
V
2
= P
1
V
1
/ P
2
Donde:
P
1
= Presin Inicial
P
2
= Presin Final
V
1
= Volumen Inicial
V
2
= Volumen Final
Esta Ley es una simplificacin de la Ley de los gases ideales particularizada para
procesos isotermos.
Junto con la ley de Charles y Gay-Lussac y la ley de Graham, la ley de Boyle forma las
leyes de los gases, que describen la conducta de un gas ideal. Las tres leyes pueden ser
generalizadas en la ecuacin universal de los gases.
IV. PROCEDIMIENTO:
CASO 1: Compresin del gas (disminucin de volumen y aumento de presin)
1. Disponga del equipo de demostracin de la ley Boyle Mariotte sobre la mesa de trabajo
2. Abrir la vlvula de dosificacin para ventilar el cilindro del equipo de demostracin de la
ley de Boyle (ver figura 4).
3. Cierre la vlvula, lea y anote la presin en la tabla 1
4. Gire el pistn hasta obtener un volumen de 65 ml de la escala graduada del cilindro y
cierre la vlvula de dosificacin (1ml=10
-6
m
3
).
5. Tome lectura de la temperatura del ambiente y regstrelo en la tabla 1.2 y 2.2 en Kelvin.
6. Lea la presin que indica la aguja del manmetro (P
man
) , considerando unidades del SI
(recordar que: 1hPa=100 N/m
2
) . A la presin manomtrica deber sumarle la presin
atmosfrica (P
atm
=1.013x10
5
N/m
2
), obteniendo la presin absoluta P (P=P
man
+P
atm
) .
Luego registre el valor P en la tabla 1.1.
7. Desplace el pistn cada 5ml segn se indica en la tabla 1.1, hasta un volumen de 20
ml, registrando la lectura de la presin en la tabla mencionada para cada caso segn el
procedimiento (4).
CASO 2: Expansin del gas (aumento de volumen y disminucin de presin)
1. Abra la vlvula de dosificacin.
2. Cierre la vlvula de dosificacin y registr los valores de presin.
3. Ubique el pistn en el volumen 20 ml de la escala graduada y cierre la vlvula de
dosificacin.
4. Lea la presin que indica el manmetro teniendo en cuenta el procedimiento (4) y
regstrelo en la tabla 2.1.
5. Desplace el pistn cada 5ml segn se indica en la tabla 2.1, hasta llegar al volumen de
65ml, registrando la lectura de la presin en la tabla en mencin para cada caso.
V. ACTIVIDADES
1. Realice el producto de la presin P y el volumen V en cada caso segn
corresponda para la tabla 1.1 y verifique si el producto permanece constante
segn se indic en la ecuacin (2).
2. Realice la actividad anterior (1) para la tabla 2.1.
3. Ingrese los datos de volumen y presin de la tabla 1.1 a la tabla de datos del
software Logger Pro y posteriormente presione el botn Autoescala grfica para
una mejor visualizacin de la grfica obtenida.
4. Calcule experimentalmente el trabajo W realizado por el gas (ecuacin 3). Para
ello obtenga el rea bajo la curva seleccionando la regin de inters y luego
presionando el botn integral. Registre este dato en la tabla 1.2 indicando si el
gas realiza trabajo positivo o negativo.
5. Realice la actividad (3) para los datos de la tabla 2.1 y registre el trabajo W del
gas en tabla 2.2.
6. Grafique P vs 1/V. con los datos de la tabla 1.1 y tabla 2.1, y realizando un ajuste
lineal obtenga el valor de la pendiente (m) en cada caso. Registre los valores en
la tabla 1.2 y 2.2 segn corresponda.
7. Despejando de la ecuacin (1), obtenga el nmero de moles dentro del cilindro
para el caso 1 y caso 2, registrndolos en la tabla 1.2 y 2.2 respectivamente.
VI. RESULTADOS
Registrar los datos obtenidos en las tablas.
Tabla 1.1: Obtencin de la constante de Boyle (1ml =10
-6
m
3
considerar: y 1 hPa =
100 N/m2)
V(ml) V(m
3
) P(N/m
2
) P.V (constante)
65
60
55
50
45
40
35
30
25
20
Tabla 1.2: Clculo del nmero de moles n y del trabajo.
Tabla 2.1: Obtencin de la Constante de Boyle
Tabla 2.2: Clculo del nmero de moles n y del trabajo.
V. ACTIVIDAD:
2. Obtenga el grafico Presin vs Volumen Qu representa fsicamente la curva de este
grafico? Explique.
De la tabla N1
Prueba #1 Compresin a 21.3 C
T (k) m=PV n=PV/TR W(J)
V(ml) V(m
3
) P(N/m
2
) P.V (constante)
20
25
30
35
40
45
50
55
60
65
T (k) m=PV n=PV/TR W(J)
Prueba #2 Expansion a 22.1 C
Prueba #3 Compresin a 24.0 C
Prueba #4 Expansion a 25.5 C
VII. OBSERVACIONES Y RECOMENDACIONES:
El trabajo realizado en el laboratorio se ve afectado por el calor influenciado en la
zona lo que provoca que no se pueda trabajar a distintas temperaturas y llegar a
tener resultados variados
Los datos obtenidos en la prctica fueron experimentales, por ende existe un
errores en los mismo, se trato de realizar la toma de datos con la mayor exactitud
posible para de esta manera disminuir los errores en los mismos. Al graficar los
datos y realizar la curva utilizando un programa de computadora podemos
minimizar los errores en la pendiente.
Se debe realizar el cambio de presin de manera raudamente puesto que a dejar
de mover el embolo del equipo este hace que se disipe el aire de la presin por las
reas laterales y hasta por el calor que va experimentar el equipo.
Si queremos llegara tener diferentes datos del experimento debemos cambiar la
temperatura como bajor a una temperatura menor al que experimenta el ambiente
o mayor esto se logra utilizando calefactores o enfriadores de ambiente.
VIII. CONCLUSIONES:
Las relaciones de presin-volumen de los gases ideales estn gobernadas por la
ley de Boyle: el volumen es inversamente proporcional a la presin.
El comportamiento del aire se aproxima bastante bien al de un gas ideal
(obsrvese el ajuste de la isoterma a los datos experimentales).
De la tabla No. 1 se puede deducir que, efectivamente, a temperatura constante la
presin de un gas es inversamente proporcional a su volumen de acuerdo con la
ley de Boyle.
La difusin de los gases demuestra el movimiento molecular aleatorio.
Concluimos que si se va a trabajar con cambios altos de presin como en el
ejemplo de buzo que al no tener en cuenta que al estar bajo el agua la presin del
gas que tenia dentro de sus pulmones era mayor que en la superficie, y al querer
subir a la superficie de manera rpida sin descomprimirlo puede sufrir graves
daos en su sistema respiratorio y sanguneo ya que la sangre transporta gases
(aire) y el aire se expande cuando la presin disminuye.
BIBLIOGRAFIA:
http://www.educaplus.org/play-117-Ley-de-Boyle.html
http://html.rincondelvago.com/ley-de-boyle_1.html
http://ar.answers.yahoo.com/question/index;_ylt=Arl8LWJblLQ497d9TFtn.6XM.At.;
_ylv=3?qid=20090719141001AAKYzup
http://www.fisicanet.com.ar/fisica/gases/resueltos/tp02_gases_ideales_problema02
.php
http://es.wikipedia.org/wiki/Ley_de_Boyle-Mariotte
http://www.monografias.com/cgi-bin/search.cgi?query=ley%20de%20boyle
Вам также может понравиться
- Lab 01 - Fisicoquímica-3Документ10 страницLab 01 - Fisicoquímica-3Maricielo CerroОценок пока нет
- 1 Practica de Matematicas 3Документ6 страниц1 Practica de Matematicas 3Rafael CárdenasОценок пока нет
- Tarea 02 FisicoquímicaДокумент5 страницTarea 02 FisicoquímicaPiero MolinaОценок пока нет
- Avance Del Proyecto - Q.OrgánicaДокумент8 страницAvance Del Proyecto - Q.OrgánicaCristhoffer Campos GuerreroОценок пока нет
- 3er Laboratorio - GasesДокумент22 страницы3er Laboratorio - GasesAlex Ivan CernaОценок пока нет
- Práctica 2: Ácidos, Bases y Medición de Ph.Документ25 страницPráctica 2: Ácidos, Bases y Medición de Ph.Enrique DelgadoОценок пока нет
- Practica N°3 Equilibrio TermicoДокумент10 страницPractica N°3 Equilibrio TermicoAbnerEsauEscobarОценок пока нет
- RespuestasДокумент2 страницыRespuestasJUNIOR DOMINGUEZ MARQUEZ50% (4)
- Semana 3-EL MAPA PLANO DEL ADN-zavaleta CapilloДокумент6 страницSemana 3-EL MAPA PLANO DEL ADN-zavaleta CapilloLucero ZavaletaОценок пока нет
- U2 S7 TareaVirtual EP 1Документ17 страницU2 S7 TareaVirtual EP 1frankoОценок пока нет
- Tema 4 TermoquímicaДокумент10 страницTema 4 TermoquímicaPedro A. MartínezОценок пока нет
- Quimica OrganicaДокумент73 страницыQuimica OrganicaJuan Pablo Moran Caballero100% (1)
- Análisis Gráfico de Método DinámicoДокумент2 страницыAnálisis Gráfico de Método DinámicoJose Carlos Blas HuarotoОценок пока нет
- GUIAS DE LABORATORIO DE FISICOQUIMICA 2020 - II - PD PDFДокумент67 страницGUIAS DE LABORATORIO DE FISICOQUIMICA 2020 - II - PD PDFPablo BerrocalОценок пока нет
- INFORME de LABORATORIO (2) Extracción y Reconocimiento de LípidosДокумент8 страницINFORME de LABORATORIO (2) Extracción y Reconocimiento de Lípidosmaria lopezОценок пока нет
- Informe 7 (Principio de Arquimedes)Документ11 страницInforme 7 (Principio de Arquimedes)MATEO ESCORCIA SIERRAОценок пока нет
- Grupo 6 - Práctica de Laboratorio n1Документ15 страницGrupo 6 - Práctica de Laboratorio n1Adriana Vasquez UtaniОценок пока нет
- 3 Informe de MicrobiologiaДокумент9 страниц3 Informe de Microbiologiacarolei capbeОценок пока нет
- Silabo de Fisicoquimica General 2020 2 UnalmДокумент5 страницSilabo de Fisicoquimica General 2020 2 UnalmMeliza Chuquiyauri IrcañaupaОценок пока нет
- Practica para El Segundo Parcial QMC (Autoguardado) - 1Документ9 страницPractica para El Segundo Parcial QMC (Autoguardado) - 1David GirondaОценок пока нет
- Lab Quimica 3.Документ5 страницLab Quimica 3.Mariel RominaОценок пока нет
- Isotermas Tipo I, II, III, IV, V, ViДокумент3 страницыIsotermas Tipo I, II, III, IV, V, ViMaria Camila SotoОценок пока нет
- Cuestionario GasesДокумент4 страницыCuestionario GasesCristian Huauya Valenzuela0% (1)
- Informe Fiqui Densidad Peso Molecular Aire 2012Документ11 страницInforme Fiqui Densidad Peso Molecular Aire 2012Rafael CuicapuzaОценок пока нет
- 07 - Estática de Una Viga Cargada Con Fuerzas PuntualesДокумент4 страницы07 - Estática de Una Viga Cargada Con Fuerzas PuntualesAntonio Velarde Uyuni100% (1)
- Tercera Practica de Fisicoquímica - 2021Документ1 страницаTercera Practica de Fisicoquímica - 2021Gabriel EduardoОценок пока нет
- Práctica 7 Aldehidos y CetonasДокумент2 страницыPráctica 7 Aldehidos y CetonasLaura PachecoОценок пока нет
- A PAUTermo - Resueltos PDFДокумент25 страницA PAUTermo - Resueltos PDFpablonickОценок пока нет
- Informe de Estequiometría JazminДокумент3 страницыInforme de Estequiometría JazminCampos OscarОценок пока нет
- Informe 2Документ6 страницInforme 2Leidy GalvanОценок пока нет
- Diagrama DisolucionesДокумент1 страницаDiagrama DisolucionesYamile FloresОценок пока нет
- Guía N°2 Propiedades ColigativasДокумент8 страницGuía N°2 Propiedades ColigativasJOseMarcos23Оценок пока нет
- Proyecto de Ciclo IIДокумент8 страницProyecto de Ciclo IIcarlosОценок пока нет
- Motor A VaporДокумент18 страницMotor A VaporMichael Huamán TorrejónОценок пока нет
- Guía+de+LДокумент69 страницGuía+de+LChris SoilworkОценок пока нет
- Ley de Enfriamiento de NewtonДокумент12 страницLey de Enfriamiento de NewtonRAMOS GARCIA JENIFER YESENIAОценок пока нет
- Ejercicios de Reacciones de Equilibrio - IIДокумент4 страницыEjercicios de Reacciones de Equilibrio - IIrocrosduОценок пока нет
- QA Problemas de QuímicaДокумент22 страницыQA Problemas de Químicagr4ndeunicornОценок пока нет
- Manejo de Datos Analíticos IДокумент19 страницManejo de Datos Analíticos IBrajhan RosalesОценок пока нет
- Taller Equilibrio de Fases 2020Документ8 страницTaller Equilibrio de Fases 2020Andres RodriguezОценок пока нет
- Informe Entropía de ProcesosДокумент4 страницыInforme Entropía de ProcesosLuis Felipe Caro CaroОценок пока нет
- Laboratorio 3 BQДокумент16 страницLaboratorio 3 BQLEONARDO V�CTOR EUGENIO PACHAS QUISPEОценок пока нет
- Reporte #01Документ6 страницReporte #01FLAVIA FERNANDA GOMEZ MAMANIОценок пока нет
- Efecto QuelatoДокумент9 страницEfecto QuelatoAnonymous ExcNQWv7P0% (1)
- Clase Complementaria-Sem10Документ6 страницClase Complementaria-Sem10luis gabriel ruizОценок пока нет
- Aplicación Con SimuladorДокумент6 страницAplicación Con SimuladorMilagros ZariniОценок пока нет
- Tema 1 PARA EMPEZAR CONCEPTOS Y DEFINICIONES PDFДокумент36 страницTema 1 PARA EMPEZAR CONCEPTOS Y DEFINICIONES PDFJonatanОценок пока нет
- Electrolisis - Leyes de FaradayДокумент9 страницElectrolisis - Leyes de Faradayjoselyn medinaОценок пока нет
- Reconocimiento y Cuantificacion de GrasasДокумент7 страницReconocimiento y Cuantificacion de GrasasAnahí Vasquez RodriguezОценок пока нет
- Informe de Laboratorio FísicaДокумент4 страницыInforme de Laboratorio FísicaEdwar S. CruzОценок пока нет
- Informe 7 Física-2Документ7 страницInforme 7 Física-2David RussiОценок пока нет
- Fundamento TeoricoДокумент7 страницFundamento TeoricoKendrick TeodorОценок пока нет
- Practica N 01 Fisicoquimica (28-04-2021)Документ11 страницPractica N 01 Fisicoquimica (28-04-2021)Heidi MauОценок пока нет
- 7mo Informe - AbsorciónДокумент10 страниц7mo Informe - AbsorciónMaJuTorresRimeyОценок пока нет
- 10 Ejerciccos de FicoДокумент6 страниц10 Ejerciccos de FicoGabriel Rodríguez SuttaОценок пока нет
- Propiedades de Los AlquenosДокумент5 страницPropiedades de Los AlquenosLuis Augusto Calizaya CastilloОценок пока нет
- 42 - 2 - Interpretacion Grafica Ley BoyleДокумент3 страницы42 - 2 - Interpretacion Grafica Ley BoyleajrespinaОценок пока нет
- LEY DE BOYLE Al 85%Документ19 страницLEY DE BOYLE Al 85%Lisacio Gago LopezОценок пока нет
- Ley de BoyleДокумент10 страницLey de BoylejhonalinoechavarriaОценок пока нет
- Laboratorio 13Документ6 страницLaboratorio 13Jurgen Teran ValdezОценок пока нет
- Primera Practica Dirigida de Microeconomia.2016-3Документ7 страницPrimera Practica Dirigida de Microeconomia.2016-3jhonalinoechavarriaОценок пока нет
- Trabajo Proyecto ExponerДокумент6 страницTrabajo Proyecto Exponerjhonalinoechavarria100% (3)
- Evaluación de Proy. C.H. San Gabán IIIДокумент23 страницыEvaluación de Proy. C.H. San Gabán IIIjhonalinoechavarriaОценок пока нет
- Jhonatan Lino E. - Diseño Del Controlador de Robot Móvil en El Proceso de Soldadura de La Construcción NavalДокумент8 страницJhonatan Lino E. - Diseño Del Controlador de Robot Móvil en El Proceso de Soldadura de La Construcción NavaljhonalinoechavarriaОценок пока нет
- UTP LaboratorioДокумент13 страницUTP LaboratoriojhonalinoechavarriaОценок пока нет
- Trabajo en Equipo 15Документ17 страницTrabajo en Equipo 15Juan CarlosОценок пока нет
- Trabajo Autonomo2 151Документ4 страницыTrabajo Autonomo2 151jhonalinoechavarriaОценок пока нет
- Funciones Como Modelo Matemã TicoДокумент22 страницыFunciones Como Modelo Matemã TicojhonalinoechavarriaОценок пока нет
- Ejercicios Resueltos Electricidad Potencial ElectricoДокумент21 страницаEjercicios Resueltos Electricidad Potencial ElectricojhonalinoechavarriaОценок пока нет
- Practica Dirigida No 01 - Ley de CoulombДокумент2 страницыPractica Dirigida No 01 - Ley de CoulombjhonalinoechavarriaОценок пока нет
- Mpes U1 A1 KaamДокумент3 страницыMpes U1 A1 KaamMitchell Hyde100% (2)
- s05.s2 MaterialДокумент30 страницs05.s2 MaterialKary SanchezОценок пока нет
- TZECUDIF333Документ9 страницTZECUDIF333Kevin SanchezОценок пока нет
- PerspectivasДокумент40 страницPerspectivasRosanaMastrandreaОценок пока нет
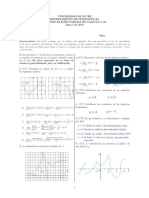
- Parcial 2 Calculo Diferencial-SoluciónpdfДокумент3 страницыParcial 2 Calculo Diferencial-SoluciónpdfEnriqueОценок пока нет
- Quiz 1 Pensamiento de SistemasДокумент6 страницQuiz 1 Pensamiento de SistemasdanielОценок пока нет
- Teoría de TaludesДокумент40 страницTeoría de TaludesCARLOS DANIEL VIELMAN CONTRERASОценок пока нет
- Evolución Del Modelo AtómicoДокумент5 страницEvolución Del Modelo AtómicoLuis Martín Pinedo HerreraОценок пока нет
- Iv Distribución BidimensionalДокумент18 страницIv Distribución BidimensionalYAJAIRA JARA ALVISОценок пока нет
- Componentes Radial y TransversalДокумент1 страницаComponentes Radial y TransversalIsra Mm's50% (2)
- Conceptos de Físico QuimicaДокумент52 страницыConceptos de Físico QuimicaPerafan Garcia HildaОценок пока нет
- Actividad de Puntos Evaluables - Escenario 2 - Primer Bloque-Ciencias Basicas - Calculo II - (Grupo b06) .2Документ4 страницыActividad de Puntos Evaluables - Escenario 2 - Primer Bloque-Ciencias Basicas - Calculo II - (Grupo b06) .2elkin centenoОценок пока нет
- Sesión 2 - CalculoProposicionalДокумент44 страницыSesión 2 - CalculoProposicionalDavid MalaverОценок пока нет
- Plan Mensual 1 FísicaДокумент3 страницыPlan Mensual 1 FísicaJona ValenciaОценок пока нет
- Logica MatematicaДокумент37 страницLogica MatematicaGalo YambayОценок пока нет
- Cinetica de SecadoДокумент6 страницCinetica de SecadoROCIO VALDIVIAОценок пока нет
- Ficha de Lectura de InteresДокумент3 страницыFicha de Lectura de InteresgreysonUTPОценок пока нет
- Balanza de Coulomb PDFДокумент3 страницыBalanza de Coulomb PDFJose Angel RampelОценок пока нет
- LДокумент6 страницLMaria Isabel Arizola SalesОценок пока нет
- Articulo y VerboДокумент5 страницArticulo y VerboMaria LazarteОценок пока нет
- 2009 Inst2 4°Документ3 страницы2009 Inst2 4°Escuela 105, Salto - UruguayОценок пока нет
- Practica Alg PrimeroДокумент1 страницаPractica Alg PrimeroricardosnxzОценок пока нет
- Capitulo2 150819223405 Lva1 App6892 PDFДокумент48 страницCapitulo2 150819223405 Lva1 App6892 PDFCesar EscuderoОценок пока нет
- Manual Centro de Mecanizado ENERO2020Документ129 страницManual Centro de Mecanizado ENERO2020FRANCISCO JOSÉ ARES SANCHEZ100% (2)
- Saul Cabañas, Ejercicio 2 64Документ3 страницыSaul Cabañas, Ejercicio 2 64SAULОценок пока нет
- Laboratorio Integral IIДокумент6 страницLaboratorio Integral IIGabriela Bernal AnotaОценок пока нет
- 06mecánica Cpo RígidoДокумент38 страниц06mecánica Cpo RígidoBrayan Padilla RomeroОценок пока нет
- RazoДокумент4 страницыRazocardonajuansebastian14Оценок пока нет
- Integral DefinidaДокумент26 страницIntegral DefinidaLuis Leodan Vera AlvaОценок пока нет
- Mapa Curricular AreasДокумент1 страницаMapa Curricular AreasmarielaОценок пока нет