Академический Документы
Профессиональный Документы
Культура Документы
Conductividad Electrica
Загружено:
AnaZuñigaSolisИсходное описание:
Оригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Conductividad Electrica
Загружено:
AnaZuñigaSolisАвторское право:
Доступные форматы
1
RESUMEN
La presente experiencia tiene como objetivo la determinacin de la
conductividad de soluciones acuosas de electrolitos fuertes y corregidos.
Las condiciones en las que se trabajo en el laboratorio fueron; una presin de
756 mmHg, temperatura de 21C y una humedad relativa de 96%.
Se preparo 100 ml de solucin de KCI (0,01 N aprox), luego preparamos 250
mL de una solucin de HCI = 0.05 N y 250 mL de una solucin de CH3COOH =
0,05.
Luego de estas dos soluciones preparadas respectivamente, se preparon
diferentes soluciones de cada acido (0.01 N, 0.002 N, 0.00064 N). Luego de la
preparaci0n de las diferentes diluciones del electrolito fuerte y dbil, estos se
valoraron con NaOH = 0.01 N, previamente corregida con BFK. Luego se
procedi a calibrar el conductimetro con una solucin estndar H17030 a 23C
y se procede a medir la conductividad elctrica (L) del KCI 0.01 N, la cual fue
1280 x 10-6S, luego se calcula la conductividad de las dems soluciones
preparadas, tanto para el HCI y para el CH3COOH.
Luego a partir de la constante de celda que fue de 1.0808 cm-1 y las
conductividades elctricas halladas anteriormente, se proceden a hallar la
conductividades especificas (K), las conductividades equivalentes (^ ) y los
grados de disociacin (a) para todas las soluciones y el Ki solamente para el
CH3COOH.
2
INTRODUCCION
La conductividad de las soluciones desempea un importante papel en las
aplicaciones industriales de la electrolisis, ya que el consumo de energa
elctrica en la electrolisis depende en gran medida de ella. Las
determinaciones de la conductividad se usan ampliamente en los estudios de
laboratorios.
El mtodo conductimetrico puede usarse para determinar las solubilidades de
electrolitos escasamente solubles y para hallar concentraciones de electrolitos
en soluciones por titulacin.
La base de las determinaciones de la solubilidad es que las soluciones
saturadas de electrolitos escasamente solubles pueden ser consideradas como
infinitamente diluidas. Midiendo la conductividad especifica de semejante
solucin y calculando la conductividad equivalente segn ella, se halla la
concentracin de electrolito, es decir, sus solubilidad.
3
PRINCIPIOS TEORICOS
CONDUCTIVIDAD ELECTRICA DE LAS SOLUCIONES
Igual que los conductores metlicos, las soluciones siguen la ley de Ohm que
establece que la intensidad de la corriente directamente proporcional a la
fuerza electromotriz aplicada e inversamente proporcional a la resistencia R
ofrecida por la solucin.
I = amperio = voltio
R ohmio
Reemplazando en la ecuacin anterior, 1/R =L, que es la conductividad
elctrica de la solucin, la Ley de Ohm tambin se expresa en la forma
siguiente;
I = L
La resistencia de un conductor depende en forma directamente proporcional de
la longitud I en cm del conductor e inversamente del rea A en cm2 de sus
seccin transversal. De aqu,
R= p _I__
A
Donde p es la resistencia especifica, una constante para un determinado
conductor que depende de su naturaleza, y que se define como la resistencia
en ohmios de una columna de solucin de 1 cm de longitud y 1 cm2 de
seccin.
La conductividad especifica que se designa por la letra griega Kappa, es la
inversa de la resistencia especifica, K = 1/p, y se expresa en ohmios
recprocos, sea ohmios-1 ., que se llama tambin mho. De tal manera que la
ecuacin anterior se podra expresar como;
R= _I__
kA
4
Invirtiendo la ecuacin anterior y teniendo en cuenta que 1/R = L, la
conductividad elctrica de una solucin ser igual a:
L = k A
L
La conductividad especifica K es la conductividad elctrica de 1 cm3 de
solucin electroltica.
La conductividad equivalente se designa por la letra griega lambda mayscula..
y es igual al producto de la conductividad especfica k por el nmero de cm3
que contienen un equivalente gramo del cuerpo disuelto, es decir por 1000/N,
donde N es la normalidad de la solucin o numero de equivalente gramo de
soluto por litro de solucin. As tenemos que:
A = k 1000
N
Conductividad equivalente a Dilucin infinita
El aumento de la conductividad equivalente de todas las soluciones
electrolticas tiende hacia un lmite al crecer la dilucin, valor que se llama
conductividad equivalente o a dilucin infinita y se expresa por
.
Esto implica que una mayor dilucin no cambia el valor de la conductividad
equivalente y no que sea la conductividad del solvente puro.
Para electrolitos fuertes se obtiene una expresin matemtica:
=
0
- A N
Donde A es una constante que depende de la naturaleza del electrolito y de la
temperatura.
5
TABULACION DE DATOS
Tabla N
0
1: Condiciones del laboratorio
Presin(mmHg) Temperatura(
0
C) Humedad Relativa (%)
756 21 90
Tabla N
0
2: Valoracin del NaOH 0.1 con BFK
WBFK (g) Peq BFK (g/mol) V gastado NaOH
(ml)
Normalidad
corregida (N)
0.0518
204.228
3.2
0.0793
Tabla N
0
3:
W KCl (g) 0.0751
Peso equivalente (g/mol) 74.5
Normalidad (N) 0.01
Tabla N
0
4:
Sustancia N aprox. (N) Vg NaOH (ml) V Titul. (ml) N
corregida
(N)
HCl
0.05 3.1 5 0.0492
0.01 1.1 10 0.0087
0.002 0.6 20 0.0024
0.00064 0.4 30 0.0012
Hac
0.05 3.0 5 0.0476
0.01 1.3 10 0.0103
0.002 0.6 20 0.0024
0.00064 0.4 30 0.0011
Tabla N
0
4:
Sustancia N aprox.(N) Conductividad
elctrica (us)
KCl 0.01 1312
HCl
0.05 21400
0.01 3940
0.002 727
0.00064 275
6
Hac
0.05 352
0.01 171.5
0.002 74.6
0.00064 38.8
Tabla N
0
5:
Cte. celda (cm
-1
) 0.9303
Tabla N
0
5: Conductividades especfica y equivalente de las soluciones
a 23.5
0
C
Sustancia N
corregida
(N) Conductividad
especifica(s cm
-1
)
Conductividad
equivalente(s cm
2
mol
-1
)
KCl 0.01 1.22x10
-3
122.00
HCl
0.0492 0.0199 404.47
0.0087 3.66 x10
-3
420.69
0.0024 6.76 x10
-4
281.67
0.0012 2.56 x10
-4
213.33
Hac
0.0476 3.27 x 10
-4
6.87
0.0103 1.59 x10
-4
15.44
0.0024 6.94 x10
-5
28.92
0.0011 3.61 x10
-5
32.82
Tabla N
0
6: Para la grafica vs N
Sustancia N
HCl
404.47 0.2218
420.47 0.0933
281.67 0.0490
231.33 0.0346
Hac
6.87 0.2182
15.44 0.1015
28.92 0.0490
32.82 0.0332
7
Tabla N
0
7: Para la grafica 1/ vs N
Sustancia 1/ N
Hac
0.1456 0.3270
0.0648 0.1590
0.0346 0.0694
0.0305 0.0361
Tabla N
0
8:
Sustancia
experimental
terico
%Error
Hac 62.5 378.9873 83.5
Tabla N
0
8:
Sustancia Ki
experimental
Ki
terico
% Error
Hac 1.01x10
-4
1.75x10
-5
-477
8
Clculos
a) Obtenga la constante de celda a partir de la medicin de la
conductividad del KCl.
Segn la ecuacin: K = L
KCl
(l / A), donde (l / A) es la cte. de celda.
(l/A) = K = 1.2205 x 10
-3
S cm
-1
= 0.9303 cm
-1
L
KCl
1312 x 10
-6
cm
-1
b) Determine las concentraciones exactas de las soluciones y
diluciones.
Primero hallamos la concentracin corregida del NaOH:
N
C (NaOH)
= 0.0518 = 0.0793 N
0.204228 x 3.2
Para el HCl:
N
HCl
0.05 N
V
HCl
x N
HCl
= V
NaOH
x N
NaOH
5 x N
HCL
= 3.1 x 0.0793
N
HCl
= 0.0492 N
N
HCl
0.01 N
V
HCl
x N
HCl
= V
NaOH
x N
NaOH
10 x N
HCL
= 1.1 x 0.0793
N
HCl
= 0.0087 N
9
N
HCl
0.002 N
V
HCl
x N
HCl
= V
NaOH
x N
NaOH
20 x N
HCL
= 0.6 x 0.0793
N
HCl
= 0.0024 N
N
HCl
0.00064 N
V
HCl
x N
HCl
= V
NaOH
x N
NaOH
30 x N
HCL
= 0.4 x 0.0793
N
HCl
= 0.0012 N
Para Hac:
N
Hac
0.05 N
V
Hac
x N
Hac
= V
NaOH
x N
NaOH
5 x N
Hac
= 3.0 x 0.0793
N
Hac
= 0.0476 N
N
Hac
0.01 N
V
Hac
x N
Hac
= V
NaOH
x N
NaOH
10 x N
Hac
= 1.3 x 0.0793
N
Hac
= 0.0103 N
N
Hac
0.002 N
V
Hac
x N
Hac
= V
NaOH
x N
NaOH
20 x N
Hac
= 0.6 x 0.0793
N
Hac
= 0.0024 N
10
N
Hac
0.00064 N
V
Hac
x N
Hac
= V
NaOH
x N
NaOH
30 x N
Hac
= 0.4 x 0.0793
N
Hac
= 0.0011 N
c) Calcule la conductividad especifica (K) de todas las soluciones,
para ellas calcule tambin la conductividad equivalente ().
Para el HCl:(conductividad especfica)
Segn la ecuacin:
K
HCl
= L
HCl
(l / A)
Para (1):
K
HCl
(1) = L
HCl
(l / A)
K
HCl
(1) = 21400 x 10
-6
s x 0.9303 cm
-1
= 0.0199 s cm
-1
Para (2):
K
HCl
(2) = L
HCl
(l / A)
K
HCl
(2) = 3940 x 10
-6
s x 0.9303 cm
-1
= 3.66 x10
-3
s cm
-1
Para (3):
K
HCl
(3) = L
HCl
(l / A)
K
HCl
(3) = 727 x 10
-6
s x 0.9303 cm
-1
= 6.76 x10
-4
s cm
-1
Para (4):
K
HCl
(4) = L
HCl
(l / A)
K
HCl
(4) = 275 x 10
-6
s x 0.9303 cm
-1
= 2.56 x10
-4
s cm
-1
11
Para el Hac: (conductividad especfica)
Segn la ecuacin:
K
Hac
= L
Hac
(l / A)
Para (1):
K
Hac
(1) = L
Hac
(l / A)
K
Hac
(1) = 352 x 10
-6
s x 0.9303 cm
-1
= 3.27 x 10
-4
s cm
-1
Para (2):
K
Hac
(2) = L
Hac
(l / A)
K
Hac
(2) = 171.5 x 10
-6
s x 0.9303 cm
-1
= 1.59 x10
-4
s cm
-1
Para (3):
K
Hac
(3) = L
Hac
(l / A)
K
Hac
(3) = 74.6 x 10
-6
s x 0.9303 cm
-1
= 6.94 x10
-5
s cm
-1
Para (4):
K
Hac
(4) = L
Hac
(l / A)
K
Hac
(4) = 38.8 x 10
-6
s x 0.9303 cm
-1
= 3.61 x10
-5
s cm
-1
Para el HCl:(conductividad equivalente)
Segn la ecuacin:
HCl
= K
HCl
x 1000
N
HCl
Para (1):
HCl
(1) = K
HCl
x 1000 = 0.0199 s cm
-1
x 1000 = 404.47
N
HCl
0.0492 N
Para (2):
HCl
(2) = K
HCl
x 1000 = 3.66x10
-3
s cm
-1
x 1000 = 420.69
N
HCl
0.0087 N
12
Para (3):
HCl
(3) = K
HCl
x 1000 = 6.76 x10
-4
s cm
-1
x 1000 = 281.67
N
HCl
0.0024
N
Para (4):
HCl
(4) = K
HCl
x 1000 = 2.56 x10
-4
s cm
-1
x 1000 = 213.33
N
HCl
0.0012
N
Para el Hac:(conductividad equivalente)
Segn la ecuacin:
Hac
= K
Hac
x 1000
N
Hac
Para (1):
Hac
(1) = K
Hac
x 1000 = 3.27 x 10
-4
s cm
-1
x 1000 = 6.87
N
Hac
0.0476 N
Para (2):
Hac
(2) = K
Hac
x 1000 = 1.59 x10
-4
s cm
-1
x 1000 = 15.44
N
Hac
0.0103 N
Para (1):
Hac
(1) = K
Hac
x 1000 = 6.94 x10
-5
s cm
-1
x 1000 = 28.92
N
Hac
0.0024
N
Para (1):
Hac
(1) = K
Hac
x 1000 = 3.61 x10
-5
s cm
-1
x 1000 = 32.82
N
Hac
0.0011 N
13
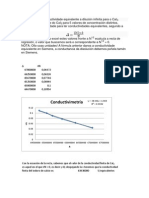
d) Grafique vs N para el Hac y para el HCl.
e) Calcule la conductividad lmite y la constante de ionizacin del Hac
aplicando las variables indicadas en la Ec. 7 y la conductividad
limite para el HCl aplicando la ley de kohlrausch.
Segn la grfica:
m = 1 /
2
ki (1)
Donde la pendiente dio: 2.53 y hallando el valor de b: 1/
= b
= 62.5
, reemplazando en la ecuacin (1) tenemos:
Ki= 1.01x10
-4
f) Compare sus resultados experimentales con los datos tericos de
del Hac y del HCl; y de la constante de ionizacin del Hac.
Para Ki:
% Error = 1.75x10-5 - 1.01x10-4 x 100 = -477%
1.75x10-5
Para :
% Error = 378.9873 - 62.5 x 100 = 83.5 %
378.9873
14
ANALISIS Y DISCUSION DE RESULTADOS
En la grafica la representacin es una curva asinttica; muy
caracterstica de los electrolitos dbiles., como lo es el acido actico,
en ella .. del electrolito dbil aumenta con la dilucin.
La razn de este es que la disminucin de la conductividad especifica
esta ms que compensada por el aumento en el valor I/N en la dilucin
y por lo tanto se incrementa.
Las K del acido actico comienzan en valores bajos en soluciones
diluidas y crecen mucho mas gradualmente, as por que en estos el
incremento en el numero de iones por unidad de volumen de solucin no
puede ser tan grande debido a la cambiante ionizacin parcial del soluto,
y en consecuencia la conductancia no crece rpidamente como en los
electrolitos fuertes.
Las caudas de los errores pueden ser en la determinacin de las
concentraciones corregidas de cada disolucin, el arrastre de errores o
porque el agua posea una cierta conductividad refirindonos a las
diluciones.
15
CONCLUSIONES
La conductividad en los electrolitos fuertes como el HCI es mucho mayor
que la conductividad de los electrolitos dbiles como el CH3COOH.
A medida que la concentracin disminuye, las conductividades
equivalentes aumenta debido a que los iones cargados no pueden
ejercer influencia unos sobre otros al moverse hacia los electrodos,
estos especialmente en soluciones de electrolitos dbiles.
La conductividad equivalente del electrolito dbil (CH3COOH) disminuye
rpidamente al aumento de la concentracin de la solucin debido a que
este acido se disocia mas a mayor dilucin por lo que a una mayor
concentracin la presencia de iones ser mnima.
16
RECOMENDACIONES
El electrodo para la medicin deber ser lavado muy bien y totalmente
secado para evitar que lleve impurezas a las dems soluciones.
La temperatura debe ser mantenida constante para evitar, tambin
errores en la toma de las conductividades de las diferentes soluciones.
Antes de utilizar el conductimetro con las soluciones y diluciones se
debe estandarizar a la temperatura observada.
Debe valorarse cuidadosamente cada solucin para obtener una
concentracin precisa de cada solucin.
17
BIBLIOGRAFIA
Marn Prutto, Fisicoqumica , 2da edicin, Ed. Limusa , Mxico
1984, Pg. 405 - 416; 438 - 441.
Castellan W. Fisicoqumica, 2da edicin, fondo Iberoamericano SA.
Mxico, 1978 , Pg. 462- 465.
18
APENDICE
CUESTIONARIO
1. Indique y explique las tcnicas experimentales utilizadas para
determinar el nmero de transportes.
Aunque los iones positivos y negativos se descargan en cantidades
equivalentes en los electrodos, no es necesario que estos iones se
muevan con velocidades idnticas hacia el ctodo y el nodo, bajo la
influencia de la fuerza electromotriz aplicada.
En 1853 el alemn HITTORF encontr que la velocidad relativa de los
iones durante la electrolisis, se determina por los cambios de
concentracin que se producen alrededor de los electrodos.
En cualquier caso, el nmero total de iones descargados en cada
electrodo, y de aqu la cantidad total de electricidad llevada por la
solucin, es directamente proporcional a la suma de las velocidades de
los dos iones. Si u+ es la velocidad de los cationes y u_ la velocidad
de los aniones en la misma solucin, la cantidad de electricidad que ha
pasado por la celda ser proporcional a la suma de ( U+ + U-) . La
cantidad de electricidad llevada por cada ion es directamente
proporcional a su propia velocidad.
Las fracciones t+ y t- son llamadas nmeros de transportes de los
cationes y aniones, respectivamente, en un electrolito dado. Fueron
formulados por HITTORF . Al mismo tiempo, es evidente que;
T+ + t- = 1
HITTORF ideo el mtodo siguiente para determinar los nmeros de
transportes.
2. Explique la teora de Debye-Huckel y su aplicacin
La teora de la atraccin interionica de los electrolitos segn
Debye-huckel, se basan en que como consecuencia de las atracciones
elctricas entre iones positivos y negativos, hay, por trmino medio, mas
iones de signo contrario que del mismo en las proximidades de un ion.
Cada ion se puede considerar, por tanto como rodeado por una
atmosfera inica de signo opuesto.
19
Mientras el sistema es estacionario, es decir, no est expuesto a la
aplicacin de un campo elctrico o de una fuerza mecnica que tienda a
provocar el flujo del lquido, la atmosfera inica tiene una simetra
central. Sin embargo cuando pasa una corriente a travs de la
disolucin, de forma que los iones de un signo se muevan, por ejemplo,
hacia la derecha, cada ion, durante su movimiento, tendr que formar
constantemente su atmosfera inica a la derecha, mientras que a la
izquierda se extingue la densidad de carga. Si esta formacin y
destruccin de la atmosfera inica se verifica instantneamente, no
existira fuerza final de atraccin sobre el ion en movimiento; pero en
realidad hay un tiempo de relajacin definido durante el cual la atmosfera
de la derecha est creciendo hacia su valor de equilibrio y la de la
izquierda est desapareciendo. Como la carga de la atmosfera inica es
opuesto a la del ion en movimiento, habr un exceso de iones de signo
opuesto a la izquierda y esto retarda el movimiento. La influencia sobre
la velocidad del ion se conoce como efecto de relajacin, o a veces
como efecto de asimetra, debido a que se presenta por la falta de
simetra en la atmosfera elctrica de un ion en movimiento. Adems de
lo anterior, otro factor ayudara a oponerse al movimiento de los iones; la
tendencia de la F.E.M. aplicada a mover la atmosfera inica, con las
molculas de disolvente a ellas asociadas, en direccin opuesta a
aquella en la cual se mueve el ion, acompaado por molculas de
disolvente..
3. Explique el fundamento terico de la ley de Kohirausch.
En 1875, KOLHLRAUSCH llego a la conclusin que a dilucin infinita,
cualquier ion colabora con una contribucin definida o la conductividad
equivalente limite del electrolito, sin importar la naturaleza del otro ion
con el cual se encuentra combinado en la solucin.
En el estado llamado de dilucin infinita, todas las fuerzas activas entre
los iones han cesado. Cada ion se nueve libremente sin importar la
presencia de otros y todos los iones conducen la corriente elctrica. En
tal condicin, la conductividad equivalente de un electrolito, ser igual a
la suma de la conductividad equivalente lmite de su catin
0
+ y la
conductividad equivalente lmite de un anin
0
-.
La ley de KOHLRAUSCH es muy til en el clculo de la conductividad
equivalente lmite de los electrolitos dbiles, que no pueden
determinarse por extrapolacin grafica. As, la conductividad
equivalentes limite del acido actico se halla sumando las
conductividades equivalentes inicas limites de los iones hidrogeno y
acetato.
20
= +
0
= 349, 8 + 40.9
(CH3COOH) (H+) (CH3C00
-
)
= 390.7 ohmio
-1
.cm
2
.equiv.g
-1
En general, es posible averiguar la conductividad equivalente a dilucin
infinita de cualquier electrolito por suma de los valores de las
conductividades equivalentes inicas lmites correspondientes, tomadas
de las tablas. La conductividad equivalente lmite de un electrolito resulta
as un ejemplo de una propiedad aditiva.
La conductividad equivalente inica lmite es una constante para cada
ion en un solvente dado, dependiendo su valor solo de la temperatura.
Aumenta con la elevacin de la temperatura y los coeficientes de
temperatura son los mismo para todos los iones en un determinado
solvente. En las soluciones acuosas, la mayor parte de las
conductividades equivalentes de los iones a dilucin infinita aumentan
cerca del 2% por grado, que es aproximadamente idntico el coeficiente
trmico de disminucin de la viscosidad del agua.
Вам также может понравиться
- Ingeniería química. Soluciones a los problemas del tomo IОт EverandIngeniería química. Soluciones a los problemas del tomo IОценок пока нет
- Taller N°2 Conductimetría y Culombiometría.Документ12 страницTaller N°2 Conductimetría y Culombiometría.joseОценок пока нет
- PRACTICA 2 CONDUCTIVIDAD DE SOLUCIONES ELECTROLITICAS-1 AdalidДокумент9 страницPRACTICA 2 CONDUCTIVIDAD DE SOLUCIONES ELECTROLITICAS-1 AdalidJoel ArismendiОценок пока нет
- Conductividad SolucionesДокумент21 страницаConductividad SolucionesAlejandra MenecesОценок пока нет
- Conductancia de Los ElectrolitosДокумент11 страницConductancia de Los ElectrolitosCamisnzОценок пока нет
- LABO 4 de Fiq IIДокумент12 страницLABO 4 de Fiq IIEduardo TafurОценок пока нет
- PRACTICA 2electroq LabДокумент10 страницPRACTICA 2electroq LabWilma Yola MamaniОценок пока нет
- Conductividad de Soluciones ElectroliticasДокумент23 страницыConductividad de Soluciones ElectroliticasStephanyОценок пока нет
- ConductimetriaДокумент20 страницConductimetriaJulioRaОценок пока нет
- Practica No. 2 Mediciones de ConductividadДокумент3 страницыPractica No. 2 Mediciones de ConductividadAcrossMusic MxОценок пока нет
- Practica No.16. Analisis Instrumental.Документ7 страницPractica No.16. Analisis Instrumental.Maria Del Carmen Esquivel AriasОценок пока нет
- ElectrolitoДокумент8 страницElectrolitoHanny Mirella Rojas RiveraОценок пока нет
- Procedimiento Experimental, Tabulación de Datos y ResultadosДокумент11 страницProcedimiento Experimental, Tabulación de Datos y ResultadosJoselyn Matias BrañezОценок пока нет
- Practica 10Документ8 страницPractica 10wara martha pacheco huancaОценок пока нет
- Química Analítica Instrumental 01 2019 IДокумент23 страницыQuímica Analítica Instrumental 01 2019 IAlex valdezОценок пока нет
- Microsoft Word - Repartido N 1 Transporte Ionico 2010Документ4 страницыMicrosoft Word - Repartido N 1 Transporte Ionico 2010Santiago MedinaОценок пока нет
- DETERMINACIÓN DE MG (OH) 2 EN LECHE DE MAGNESIA POR CONDUCTIMETRIAДокумент8 страницDETERMINACIÓN DE MG (OH) 2 EN LECHE DE MAGNESIA POR CONDUCTIMETRIAPRAYME SACОценок пока нет
- Informe 2Документ12 страницInforme 2Calculadora quimicaОценок пока нет
- Labo 4Документ9 страницLabo 4Kevin FloresОценок пока нет
- Conductividad ElectroliticaДокумент18 страницConductividad ElectroliticaJorge Luis CalleОценок пока нет
- Conductividad de Las Soluciones ElectroliticasДокумент15 страницConductividad de Las Soluciones ElectroliticasAbigail Ancasi LauraОценок пока нет
- Reporte Q.A 2Документ8 страницReporte Q.A 2MisaelОценок пока нет
- Aplicación de Medidas Conductimétricas en La Determinación de Variables Fisicoquímicas para Diferentes ElectrolitosДокумент8 страницAplicación de Medidas Conductimétricas en La Determinación de Variables Fisicoquímicas para Diferentes ElectrolitosNahomi CordobaОценок пока нет
- Conductimetria PDFДокумент13 страницConductimetria PDFGastón G.0% (1)
- Labo 13 Conductividad de Soluciones ElectroliticasДокумент22 страницыLabo 13 Conductividad de Soluciones ElectroliticasWashington Quisperima GaldósОценок пока нет
- Practica 3Документ15 страницPractica 3Pablo Alberto Torres TellezОценок пока нет
- Practica Nº2Документ5 страницPractica Nº2Fausber VОценок пока нет
- Conductancia de Los ElectrolitosДокумент9 страницConductancia de Los ElectrolitosJazmin LeonОценок пока нет
- Informe Analítica LL Acidimetría (Primera Parte)Документ10 страницInforme Analítica LL Acidimetría (Primera Parte)Laura J. León MenesesОценок пока нет
- Practicas Conduct y PotenciomeДокумент11 страницPracticas Conduct y PotenciomeAlex Guijarro PadillaОценок пока нет
- Titulacion ConductimetricaДокумент7 страницTitulacion ConductimetricaGabs VencesОценок пока нет
- Electroquimica InformeДокумент13 страницElectroquimica InformeUlises Ramírez MatheyОценок пока нет
- Cálculos de ConductividadДокумент4 страницыCálculos de ConductividadRONDAN LOPEZ ELIAN PIEROОценок пока нет
- Informe de Conductancia de ElectrolitosДокумент5 страницInforme de Conductancia de ElectrolitosJorge RosalesОценок пока нет
- Conductancia de ElectrolitosДокумент11 страницConductancia de ElectrolitosKamila Quiroz LujánОценок пока нет
- PRACTICA Nº2 ElectroquimicaДокумент6 страницPRACTICA Nº2 ElectroquimicaJaqueline Limachi YujraОценок пока нет
- ConductimetriaДокумент22 страницыConductimetriaJorge Llerena Arroyo100% (1)
- CONDUCTIVIDAD LAb 3Документ11 страницCONDUCTIVIDAD LAb 3Soledad Taipe VallejosОценок пока нет
- CalculosДокумент12 страницCalculosKevin RojasОценок пока нет
- Informe 5Документ12 страницInforme 5KamilaОценок пока нет
- PC PDFДокумент2 страницыPC PDFBrandonОценок пока нет
- Informe de ConductimetríaДокумент6 страницInforme de ConductimetríaJexsy Mata MillánОценок пока нет
- Primer Examen de Metodos Cuantitativos 2LM1 15-Sept-21Документ4 страницыPrimer Examen de Metodos Cuantitativos 2LM1 15-Sept-21Mariela Frias HernandezMZSОценок пока нет
- Informe-Vi Titulacion Conductrimetrica de Una Mezzcla de AcidosДокумент10 страницInforme-Vi Titulacion Conductrimetrica de Una Mezzcla de AcidosDeyvi Heredia VillalobosОценок пока нет
- Conductividad ElectricaДокумент14 страницConductividad Electricaluis romeroОценок пока нет
- Laboratorio 2 Quimica AnaliticaДокумент4 страницыLaboratorio 2 Quimica AnaliticaAlan Gabriel Pizarro AmottОценок пока нет
- Calcular La Conductividad Equivalente de Las Disoluciones de NaClДокумент3 страницыCalcular La Conductividad Equivalente de Las Disoluciones de NaClRina Licet Socompi AguilarОценок пока нет
- Post 9Документ8 страницPost 9MELANY ELIZABETH MONROY CRUZОценок пока нет
- ConductometríaДокумент21 страницаConductometríaArtur FcmОценок пока нет
- Práctica 2Документ12 страницPráctica 2Pamela TeránОценок пока нет
- Práctica #2Документ14 страницPráctica #2ROSMERY TATIANA ORTEGA MUÑOZОценок пока нет
- Conductividad de Un ElectrolitoДокумент12 страницConductividad de Un ElectrolitoPiero Alejandro Estrada AngelesОценок пока нет
- Electroquìmica Ionica para La Interacciòn Ion-Ion PDFДокумент25 страницElectroquìmica Ionica para La Interacciòn Ion-Ion PDFDavid Vp KydОценок пока нет
- Práctica 4. Mediciones de ConductividadДокумент13 страницPráctica 4. Mediciones de ConductividadMendoza Morales Hayde DanielaОценок пока нет
- Preparación y Estandarización de Soluciones de Naoh y HCLДокумент12 страницPreparación y Estandarización de Soluciones de Naoh y HCLLaura Romero0% (1)
- 4.-Titulación ConductimétricaДокумент17 страниц4.-Titulación Conductimétricaalbert doren loydОценок пока нет
- Conductivímetria-Carlos CarballoДокумент2 страницыConductivímetria-Carlos CarballoCarlos Carballo RodriguezОценок пока нет
- Practica N°6lumetria de Neutralizacion de MezclasДокумент16 страницPractica N°6lumetria de Neutralizacion de MezclasJean Pierre Cirilo SosaОценок пока нет
- Taller Analitica IV ConductimetriaДокумент4 страницыTaller Analitica IV ConductimetriaLuis Miguel Alvarez CuadradoОценок пока нет
- CondutanciaДокумент9 страницCondutanciaOmar MuñozОценок пока нет
- Determinación de NBVT en Pescado PDFДокумент8 страницDeterminación de NBVT en Pescado PDFAnaZuñigaSolisОценок пока нет
- Capsaicin AДокумент2 страницыCapsaicin AAnaZuñigaSolisОценок пока нет
- Polaridad DecrecienteДокумент1 страницаPolaridad DecrecienteAnaZuñigaSolisОценок пока нет
- Informe Determinacion de PlomoДокумент3 страницыInforme Determinacion de PlomoAnaZuñigaSolisОценок пока нет
- Determinación Del Rango de Potencial de Indicadores RedoxДокумент2 страницыDeterminación Del Rango de Potencial de Indicadores RedoxAnaZuñigaSolisОценок пока нет
- Coloración A La Perla de BóraxДокумент4 страницыColoración A La Perla de BóraxAnaZuñigaSolis0% (1)
- Determinación de CalcioДокумент6 страницDeterminación de CalcioAnaZuñigaSolisОценок пока нет
- Metodo ArgentometricoДокумент2 страницыMetodo ArgentometricoAnaZuñigaSolis50% (2)
- Solidos Suspendidos TotalesДокумент3 страницыSolidos Suspendidos TotalesAnaZuñigaSolisОценок пока нет
- Quimica Analitica CualitaivaДокумент6 страницQuimica Analitica CualitaivaAnaZuñigaSolis0% (1)
- Balanceo de RedoxДокумент4 страницыBalanceo de Redoxnicole chahuaОценок пока нет
- LopkgjdrfДокумент6 страницLopkgjdrfAraceli CarmonaОценок пока нет
- Problemas de TornillosДокумент4 страницыProblemas de TornillosLuis Enrique Persye WatzonОценок пока нет
- Simon StevinДокумент2 страницыSimon StevinrugeroОценок пока нет
- Aplicación Del Método de Taylor y Casa Grande FORMATO TESISДокумент95 страницAplicación Del Método de Taylor y Casa Grande FORMATO TESISLuis Angel Sanchez RodriguezОценок пока нет
- 6.3 Informe de Drenaje PluvialДокумент37 страниц6.3 Informe de Drenaje PluvialOmar Anderson Zapata MandamientoОценок пока нет
- Normas y Legislacion Esterilización PDFДокумент41 страницаNormas y Legislacion Esterilización PDFernejose0% (1)
- Derivadas Tarea - 4Документ13 страницDerivadas Tarea - 4Yeinis TapiaОценок пока нет
- Radiaciones No Ionizantes - MTC - Junin - Foro Regional HuancayoДокумент34 страницыRadiaciones No Ionizantes - MTC - Junin - Foro Regional Huancayoa.vasquezg.10Оценок пока нет
- Turbina PeltonДокумент4 страницыTurbina PeltonEmanuel Lenin Luza CcorimanyaОценок пока нет
- Taller de Crecimiento Materiales y Procesos Ii 2020Документ2 страницыTaller de Crecimiento Materiales y Procesos Ii 2020Leidy ArangoОценок пока нет
- FT CV425Документ1 страницаFT CV425Juan LopezОценок пока нет
- Foro Riesgos FisicosДокумент3 страницыForo Riesgos FisicosMery DelgadilloОценок пока нет
- DiijdeДокумент5 страницDiijdeRamses RodriguezОценок пока нет
- Diapositivas BronceДокумент12 страницDiapositivas Bronceeduardo3334Оценок пока нет
- Trabajo de Inferencia IДокумент7 страницTrabajo de Inferencia IAna Cristina Garces SandonОценок пока нет
- Tesis y ArgumentosДокумент7 страницTesis y ArgumentosJaniel Reynoso100% (7)
- Prueba Unidad 1 HistoriaДокумент4 страницыPrueba Unidad 1 HistoriaRossana Angelica Castro Escobar50% (2)
- 7 Integrales de Línea en Campos EscalaresДокумент12 страниц7 Integrales de Línea en Campos EscalaresAndrea GomezОценок пока нет
- TESIS YyyДокумент21 страницаTESIS YyyIvan Ccanto CondoriОценок пока нет
- Diseño Por Ladeo y Estabilidad LateralДокумент6 страницDiseño Por Ladeo y Estabilidad LateralJonatan CalderonОценок пока нет
- Tercer Parcial de Fluidos y TermoДокумент2 страницыTercer Parcial de Fluidos y TermoDavid RubioОценок пока нет
- Practica IIIДокумент4 страницыPractica IIIGabo Medina LoaizaОценок пока нет
- Aplicacion de Distribucion ExponencialДокумент8 страницAplicacion de Distribucion ExponencialWalter Carrillo100% (1)
- Datos Univariados Guía #1 Def. - Tablas de FrecuenciasДокумент10 страницDatos Univariados Guía #1 Def. - Tablas de FrecuenciasJoel UrraОценок пока нет
- Dinámica de Sistemas de N Grados de LibertadДокумент19 страницDinámica de Sistemas de N Grados de Libertadjonypres19Оценок пока нет
- Actividades ResueltasДокумент9 страницActividades ResueltasLuis Fernando Rengifo CardenasОценок пока нет
- Termometría en Ambientes AcuáticosДокумент22 страницыTermometría en Ambientes AcuáticosElizabethBarrantesBartraОценок пока нет
- METODO MONTANTEsДокумент4 страницыMETODO MONTANTEsCarlos GarzaОценок пока нет
- Taller 3Документ3 страницыTaller 3JUÁN MANUEL RODRÍGUEZ CASASОценок пока нет