Академический Документы
Профессиональный Документы
Культура Документы
Trabajo de Destilacion Diferencial y Destilacion Del Vino
Загружено:
atilagalianoОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Trabajo de Destilacion Diferencial y Destilacion Del Vino
Загружено:
atilagalianoАвторское право:
Доступные форматы
LABORATORIO DE INGENIERIA QUIMICA
FACULTAD DE INGENIERIA QUIMICA Pgina 1
INTRODUCCIN
Los problemas relacionados con el desarrollo sostenible fomentan la
bsqueda de soluciones que incluyan un uso eficiente de la energa. La
destilacin consume aproximadamente el 3% de la energa consumida a
nivel mundial. que es equivalente a unos 2.87 1018 J/ao (91GW o a unas
54 millones de toneladas de petrleo por ao). Y sin embargo, a pesar de
que la destilacin tiene una eficiencia energtica muy baja (proporciona
calor en la caldera para acto seguido enfriar en el condensador) ha sido, y
muy probablemente contine siendo, durante bastantes aos ms la
tcnica de separacin ms ampliamente utilizada, (aproximadamente el
90% de todas las operaciones de recuperacin y purificacin son
destilaciones) lo que justifica que la destilacin sea una de las
operaciones unitarias ms estudiadas en toda la historia de la industria
qumica. Un dato que pone de manifiesto la importancia de la destilacin
es que slo en Estados Unidos existen ms de 40000 columnas de
destilacin.
As pues, cualquier sistema que permita ahorros de energa en el diseo
de procesos de destilacin tendr un impacto enorme sobre el consumo
energtico global y por lo tanto econmico y medioambiental. La simple
integracin de energa entre las diversas columnas (fijando las presiones
de manera que el calor que debe ser eliminado de un condensador se
pueda utilizar en la caldera de otra) o con el resto del proceso ha
producido ahorros energticos (y por lo tanto de coste total) importantes
(. Sin embargo, las posibilidades de integracin entre columnas o con el
resto del proceso son a menudo limitadas. Otros sistemas como los ciclos
de re-compresin de vapor (bombas de calor) son tiles en algunas
circunstancias, pero en general se debe ser muy cuidadoso con el aumento
de los costes de inversin, sobre todo en los compresores- que podra
hacer que el beneficio en el ahorro energtico no compensase la inversin
necesaria.
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 2
I. MARCO TEORICO
1.1. LA DESTILACIN
Es el proceso que se utiliza para llevar a cabo la separacin de diferentes lquidos, o
slidos que se encuentren disueltos en lquidos, o incluso gases de una mezcla, gracias
al aprovechamiento de los diversos puntos de ebullicin de cada sustancia partcipe,
mediante la vaporizacin y la condensacin. Los puntos de ebullicin de las sustancias
son una propiedad de tipo intensiva, lo que significa que no cambia en funcin de la
masa o el volumen de las sustancias, aunque s de la presin. Si la diferencia entre las
temperaturas de ebullicin o volatilidad de las sustancias es grande, se puede realizar
fcilmente la separacin completa en una sola destilacin. En ocasiones, los puntos de
ebullicin de todos o algunos de los componentes de una mezcla difieren en poco
entre s por lo que no es posible obtener la separacin completa en una sola operacin
de destilacin por lo que se suelen realizar dos o ms. As el ejemplo del alcohol
etlico y el agua. El primero tiene un punto de ebullicin de 78,5 C y el agua de 100
C por lo que al hervir esta mezcla se producen unos vapores con ambas sustancias
aunque diferentes concentraciones y ms ricos en alcohol. Para conseguir alcohol
industrial o vodka es preciso realizar varias destilaciones. Antiguamente, el secreto
de cada productor era el sistema de destilacin que le permita lograr en su
producto el sabor deseado para la bebida. Debido a esto, el proceso de
destilacin tuvo muy variados tipos y funcionamientos, aunque todos,
basndose en el mismo objetivo comn de separar el alcohol de un fermento
para llevarlo a una bebida. Para esto, existieron diversos mtodos de calentar
recipientes y de colectar los vapores condensados en alguna superficie fra
destinada a convertir nuevamente el vapor en lquido, colectarlo y transportarlo
a otro recipiente de baja temperatura.
1.2. TIPOS DE DESTILACIN
1.2.1. Destilacin simple
La destilacin simple consiste en la
separacin de uno o varios componentes
de una mezcla lquida cuyos puntos de
ebullicin difieren entre s en un rango
suficientemente marcado (al menos 25C)
y deben ser inferiores a 150C. El lquido
a destilar se coloca en un matraz, para
despus, mediante la adicin de calor,
impulsar la vaporizacin. Una vez establecido el equilibrio lquido-vapor, parte
del vapor se condensa en las paredes del matraz, pero el resto (mayora) pasa
por la salida lateral, para posteriormente condensarse por efecto del
enfriamiento ocasionado por agua fra que circula por un tubo refrigerante que
forma parte del equipo en esta operacin. Al producto se le conoce como
destilado, mientras la porcin que queda dentro del matraz se denomina residuo.
Con la finalidad de evitar el sobrecalentamiento de los lquidos y ocasionar la
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 3
posible desnaturalizacin de compuestos de inters en la solucin, es importante
adicionar ncleos de ebullicin, que son partculas fsicas, inertes (generalmente
perlas de vidrio), utilizadas para fomentar la homogeneidad de la mezcla y
mantener constante el ritmo de destilacin.
1.2.2. Destilacin Fraccionada
La destilacin fraccionada es un proceso
fsico utilizado para separar mezclas de
lquidos mediante el calor, y con un amplio
intercambio calrico y msico entre
vapores y lquidos. Se emplea
principalmente cuando es necesario separar
compuestos de sustancias con puntos de
ebullicin distintos pero cercanos. La
principal diferencia que tiene con la
destilacin simple es el uso de una columna de fraccionamiento.
sta permite un mayor contacto entre los vapores que ascienden con el lquido
condensado que desciende, por la utilizacin de diferentes "platos" (placas).
Esto facilita el intercambio de calor entre los vapores (que ceden) y los lquidos
(que reciben). Ese intercambio produce un intercambio de masa, donde los
lquidos con menor punto de ebullicin se convierten en vapor, y los vapores de
sustancias con mayor punto de ebullicin pasan al estado lquido.
Este proceso, conocido como rectificacin o destilacin fraccionada, se utiliza
mucho en la industria, no slo para mezclas simples de dos componentes (como
alcohol y agua en los productos de fermentacin, u oxgeno y nitrgeno en el
aire lquido), sino tambin para mezclas ms complejas como las que se
encuentran en el alquitrn de hulla y en el petrleo.
La columna fraccionadora que se usa con ms frecuencia es la llamada torre de
burbujeo, en la que las placas estn dispuestas horizontalmente, separadas unos
centmetros, y los vapores ascendentes suben por unas cpsulas de burbujeo a
cada placa, donde burbujean a travs del lquido. Las placas estn escalonadas
de forma que el lquido fluye de izquierda a derecha en una placa, luego cae a la
placa de abajo y all fluye de derecha a izquierda.
La interaccin entre el lquido y el vapor puede ser incompleta debido a que se
puede producir espuma y arrastre de forma que parte del lquido sea
transportado por el vapor a la placa superior. En este caso, pueden ser
necesarias cinco placas para hacer el trabajo de cuatro placas tericas, que
realizan cuatro destilaciones. Un equivalente barato de la torre de burbujeo es la
llamada columna apilada, en la que el lquido fluye hacia abajo sobre una pila
de anillos de barro o trocitos de tuberas de vidrio.
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 4
1.2.3. Destilacin por arrastre de vapor
Es una tcnica aplicada en la separacin de sustancias poco solubles en agua. La
destilacin por arrastre de vapor se emplea para separar una sustancia de una
mezcla que posee un punto de ebullicin muy alto y que se descomponen al
destilar. De otra manera, la destilacin por arrastre de vapor de agua se lleva a
cabo la vaporizacin selectiva del componente voltil de una mezcla formada
por ste y otros "no voltiles". Lo anterior se logra por medio de la inyeccin de
vapor de agua directamente en el seno de la mezcla, denominndose este "vapor
de arrastre", pero en realidad su funcin no es la de "arrastrar" el componente
voltil, sino condensarse en el matraz formando otra fase inmiscible que ceder
su calor latente a la mezcla a destilar para lograr su evaporacin. En este caso se
tendrn la presencia de dos fases insolubles a lo largo de la destilacin (orgnica
y acuosa), por lo tanto, cada lquido se comportar como si el otro no estuviera
presente. Es decir, cada uno de ellos ejercer su propia presin de vapor y
corresponder a la de un lquido puro a una temperatura de referencia. Tambin
se emplea para purificar sustancias contaminadas por grandes cantidades de
impurezas resinosas y para separar disolventes de alto punto de ebullicin de
slidos que no se arrastran.
En 1918 Hausbrand public un diagrama de presin de vapor til para la
destilacin por arrastre. Se grafic Ptotal - PH2O contra temperatura a tres
presiones totales: 760, 300 y 70 mmHg (curvas descendentes) a las cuales se les
conoce como curvas de agua. A su vez grafic la presin parcial (P) contra
temperatura para diversos materiales a destilar (curvas ascendentes). La
interseccin de la curva de agua con la del material a destilar nos proporciona la
temperatura a la cual se dar la destilacin por arrastre.
La condicin ms importante para que este tipo de destilacin pueda ser
aplicado es que tanto el componente voltil como la impureza sean insolubles
en agua ya que el producto destilado (voltil) formar dos capas al condensarse,
lo cual permitir la separacin del producto y del agua fcilmente.
1.2.4. Destilacin al vaco
Debido a que muchas sustancias, que se desean separar por destilacin, no
pueden calentarse ni siquiera a temperaturas prximas a sus puntos normales de
ebullicin (a una atmsfera de presin), porque se descompondran
qumicamente, o bien, otras sustancias con puntos de ebullicin muy elevados
demandaran gran cantidad de energa para su destilacin a la presin ordinaria,
se emplea el mtodo de destilacin al vaco o a presin reducida. El cual
consiste en reducir la presin de operacin para obtener la ebullicin a
temperaturas bajas, ya que un lquido empieza a hervir cuando su presin de
vapor iguala la presin de operacin.
Se deben utilizar torres empacadas para destilaciones a presiones absolutas del
orden de 7 a 35 KN/m2, se pueden disear platos de capucha y perforados con
cadas de presin cercanas a 350 KN/m2, torres de aspersin para cadas de
presin de 0.015 psi, y columnas de aspersin agitadas mecnicamente y las de
paredes mojadas para cadas de presin an ms pequeas.
La destilacin al vaco se utiliza en productos naturales, como en la separacin
de vitaminas a partir de aceites animales y de pescado, lo mismo que en la
separacin de muchos productos sintticos industriales (como plastificantes).
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 5
1.2.5. Destilacin azeotrpica
Mezcla azeotrpica es aquella mezcla lquida de dos o ms componentes que
poseen una temperatura de ebullicin constante y fija, esta mezcla azeotropica
se forma debido a que al pasar al estado vapor se comporta como un lquido
puro, es decir como si fuese un solo componente, esto se verifica en el hecho
que el vapor producido por la evaporacin parcial del lquido tiene la misma
composicin que el lquido. El azetropo que hierve a una temperatura mxima
se llama azetropo positivo y el que lo hace a una temperatura mnima se llama
azetropo negativo. La mayora de azetropos son del tipo negativo.
Un azetropo, puede hervir a una temperatura superior, intermedia o inferior a
la de los constituyentes de la mezcla, permaneciendo el lquido con la misma
composicin inicial, al igual que el vapor, por lo que no es posible separarlos
por destilacin simple, por lo que es necesario aadir otro componente para
romper la mezcla azeotrpica.
1.3. REFRACTROMETRA
Se denomina refractometra, al mtodo ptico de determinar la velocidad de
propagacin de la luz en un medio/compuesto/substancia/cuerpo, la cual se relaciona
directamente con la densidad de este medio/compuesto/substancia/cuerpo. Para
emplear este principio se utiliza la refraccin de la luz, ((la cual es una propiedad
fsica fundamental de cualquier sustancia), y la escala de medicin de este principio se
llama ndice de refraccin, Los refractmetros son los instrumentos que emplean este
principio de refraccin ya sea el de refraccin, (empleando varios prismas), o el de
angulo critico, (empleando solo un prisma), y su escala primaria de medicin es el
ndice de refraccin, a partir de la cual se construyen las diferentes escalas especficas,
Brix (azcar), Densidad Especfica, % sal, etc. Los refractmetros se utilizan para
medir en lquidos, slidos y gases, como vidrios o gemas.
1.3.1. Principio de refraccin
La luz se mueve a diferentes velocidades en diferentes materiales. Si un rayo de
luz con una longitud de onda definida en un ngulo fijo cruza un superficie
lmite entre dos materiales diferentes el ngulo del rayo cambiar de acuerdo
con el ndice de refraccin de los medios el uno con el otro. En condiciones
constantes con caractersticas de material conocidas se puede determinar el
ndice de refraccin de un segundo medio desconocido mientras el ngulo de
refraccin y el ndice de refraccin del material conocido. Para esta
determinacin se emplea la ley de Snell:
n1 * (sen(angulo1)) = n2 * (sen(angulo2))
donde:
n1 : ndice de refraccin del medio 1, angulo1 = ngulo de incidencia de la luz
al medio 1
n2 : ndice de refraccin del medio 2, angulo2 = ngulo de incidencia de la luz
al medio 2.
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 6
1.3.2. Utilizacin en luz blanca
El dispositivo de base solo es utilizable con una luz monocromtica, ya que el
ndice de un material, sobre todo aquel del vidrio flint, depende de la longitud
de onda. La raya D del sodio (longitud de onda 589 nm) ha sido elegida
histricamente, a causa del carcter monocromtico de la luz de las lmparas de
vapor de sodio, y de la facilidad para obtener una buena intensidad lumnica.
Para trabajar en luz blanca, otros dos prismas se posicionan entre el vidrio flint
y la lente colimatriz de manera que los rayos de colores diferentes converjan
tras su trayectoria. Este dispositivo se denomina compensador. La consecuencia
es la obtencin de un sistema acromtico, utilizable en luz blanca.
Los refractmetros actuales funcionan con luz natural o con la iluminacin de
una lmpara blanca. La luz llega a travs de una ventana sobre una superficie de
entrada del prisma superior. La superficie inferior de ste no est pulida para
evitar las reflexiones secundarias.
1.3.3. Calibracin y lectura de la medicin
Calibracin de la zona iluminada en el cruce de
las retculasLa calibracin del refractmetro
debe tener en cuenta por una parte la
acromatizacin y, por otra parte, la situacin del
rango de luz en el cruce de las retculas. Una
operacin de calibracin se realiza de una vez
con agua destilada. El botn que permite
conducir el rango luminoso hacia el cruce de las
retculas acta sobre el ngulo del espejo
dispuesto a la salida del prisma de flint. Este
ngulo corresponde al ndice que se registra sobre la escala graduada en ndice
de refraccin, visible en el visor. Dos escalas estn disponibles. Una indica
directamente el ndice de refraccin (entre 1,300 y 1,700). La otra indica, entre
0 y 85 %, el tenor de materia seca de los lquidos azucarados.
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 7
II. EQUIPOS Y MATERIALES
2.1 MATERIALES
MATERIALES ESPECIFICACIONES TECNICAS
Baln de destilacin
Material de vidrio
Tamao mediano
Pico esmerilado
Termmetro
Temperatura max. 200C
Tamao mediano
Tubos y gradilla:
Material de vidrio simple
Tamao pequeo
11 tubos
Gradilla pequea
Soportes universales y nueces
Material de metal
Soporte universal mediano
Nueces pequeas
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 8
MATERIALES ESPECIFICACIONES TECNICAS
Probetas
Probeta graduada
Material de vidrio
Capacidad de 100ml
Sensibilidad de 0.1ml
Manta calefactora
Tamao mediano
Matraz recolector
Material de vidrio
Capacidad de 200ml
2.2 REACTIVOS
REACTIVOS ESPECIFICACIONES
TECNICAS
Alcohol Vino
Alcohol puro
Alcohol etlico
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 9
2.3 EQUIPO
EQUIPO ESPECIFICACIONES TECNICAS
Refractmetro
EQUIPO DE DESTILACION
Baln de destilacin
Termmetro
Agua de entrada
Refrigerante
Agua de salida
Matraz recolector
1
2
3
4
5
6
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 10
III. PROCEDIMIENTO EXPERIMENTAL
3.1 PRCTICA N 11: DESTILACION DIFERENCIAL
A. La medicin de la concentracin de soluciones acuosas de etanol utilizando
ndices de refraccin
Figura N1
Fuente: Elaboracin propia
Se evaluarn las concentraciones de soluciones acuosas de etanol midiendo el
ndice de refraccin.
B. Destilacin de una solucin acuosa de etanol al 50%
Se instala el equipo de destilacin
Figura N2
Fuente: Elaboracin propia
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 11
Se procede a llevar nuestra sustancia problema de 200 ml de una solucin acuosa de
etanol al 50% se introduce en un matraz
Figura N3
Fuente: Elaboracin propia
Calentamos la solucin hasta que alcance la temperatura de 78
0
c
que es la
temperatura aproximada a la cual comienza a destilar el alcohol etlico
Figura N4
Fuente: Elaboracin propia
Se espera a que llegue a 10 ml y se tomar la temperatura, trasladando este valor a
una tabla y se repetir esta operacin cada 10 ml recogidos. Simultneamente medir
el peso y el ndice de refraccin de cada porcin fraccin de 10 ml del destilado
obtenido.
Figura N5
Fuente: Elaboracin propia
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 12
La prueba se da por finalizada cuando se han recogido 140 ml de destilado. Medir
el ndice de refraccin y la densidad del destilado global y del residuo, una vez que
este a temperatura ambiente.
3.1 PRCTICA N 12: DESTILACION DEL VINO
Se arma el equipo de destilacin
Figura N6
Fuente: Elaboracin propia
Al verter el vino en el matraz, se enciende el mechero y se comienza a calentar los
250 ml. del vino contenida en el matraz, observando el incremento de temperatura
en el termmetro.
Figura N7
Fuente: Elaboracin propia
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 13
Se esper durante un tiempo, hasta que el vino, alcanz su punto de ebullicin, que
en este caso fue de 84.5c y comenz a destilar, separndose el alcohol del agua.
Figura N8
Fuente: Elaboracin propia
Se empez a medir el tiempo cada 10 ml de destilado
Figura N9
Fuente: Elaboracin propia
Empezaron a caer gotas de alcohol puro, sobre el matraz.
Figura N10
Fuente: Elaboracin propia
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 14
Al finalizar la prctica, se obtuvieron 50 ml de alcohol destilado.
IV. OBSERVACIONES EXPERIMENTALES
4.1 PRCTICA N 11: DESTILACION DIFERENCIAL
El etanol es Incoloro
Su estado de agregacin es el lquido
El etanol debe manipularse con sumo cuidado y precaucin debido a su baja presin
del vapor y a su bajo punto de inflamacin.
4.2 PRCTICA N 12: DESTILACION DEL VINO
La temperatura del vino en este caso era de 20C
El aspecto del vino es limpio brillante la intensidad del color es rojo vivo con
tonalidad cereza purpura morado
El vino usado era de 14% vol en un total de 750 ml
El aroma del vino es muy intenso y potente
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 15
V. DATOS EXPERIMENTALES
5.1 PRCTICA N 11: DESTILACION DIFERENCIAL
A. Medicin de la concentracin de soluciones acuosas de etanol utilizando ndices
de refraccin
Tabla N1
, ml
, ml n
1 0 1.3695 1
0.9 0.1 1.3675 0.7457
0.8 0.2 1.3670 0.5659
0.7 0.3 1.3650 0.4319
0.6 0.4 1.3620 0.3283
0.5 0.5 1.35825 0.2458
0.4 0.6 1.3555 0.1785
0.3 0.7 1.3512 0.1225
0.2 0.8 1.34575 0.0753
0.1 0.9 1.34225 0.0349
0 1 1.3372 0
Fuente: Elaboracin propia
Utilizamos un densmetro para evaluar las densidades de las sustancias puras, en este
caso etanol y agua:
= 0.83 gr/ml ()
= 0.996 gr/ ml ()
Se sabe adems que: T ebullicin (etanol) = 78.4
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 16
B. Destilacin de una solucin acuosa de etanol al 50%
Se completa las siguientes tablas:
Tabla N2
Fuente: Elaboracin propia
Tabla N3
Fuente: Elaboracin propia
Alimentacin Destilado
global
Residuo
Volumen (ml) 300 140 158
Peso (gr) 267 113.65 153
n 1.3598 1.36825 1.3450
Volumen (ml) T ebullicin
()
Peso (gr) n
10 83 8.45 1.3642
20 83.2 17 1.3675
30 83.2 23.85 1.3682
40 83.5 32.75 1.36725
50 83.5 40.95 1.3675
60 84 48.6 1.3680
70 84.5 57 1.3679
80 85 65.05 1.3676
90 85 73.1 1.36725
100 85.5 81.37 1.3680
110 86 89.4 1.3690
120 87 97.035 1.36875
130 88 105.43 1.3685
140 90 113.65 1.36825
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 17
5.2 PRCTICA N 12: DESTILACION DEL VINO
Botella de vino: Vino Tabernero- Cabernet Sauvignon.
Volumen: 750 ml
% de alcohol: 14 %
Volumen de muestra en el matraz de destilacin:
Volumen: 250 ml
Temperatura ambiente: 20 C
Tabla N4
TIEMPO (min,seg) TEMP.(C) VOLUMEN (ml)
00 84.5 0.05(1gota)
28'30 86.5 10
40'09 87.5 15
53'30 88 20
69'13 92 25
77'48 91 30
91'08 93 35
102'53 93.5 40
108'51 95.5 45
115'13 96 50
Fuente: Elaboracin propia
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 18
VI. RESULTADOS OBTENIDOS Y CALCULOS EFECTUADOS
6.1 PRCTICA N 11: DESTILACION DIFERENCIAL
A. Medicin de la concentracin de soluciones acuosas de etanol utilizando ndices
de refraccin
Para determinar la fraccin molar del etanol en cada mezcla se emple la siguiente
ecuacin:
Donde:
Fraccin molar del etanol en la mezcla
Densidad del etanol (gr/ml)
Volumen del etanol en la mezcla
Peso molecular del etanol (46.07 gr/mol)
Densidad del agua (gr/ml)
Volumen del agua en la mezcla
Peso molecular del agua (18.02 gr/mol)
Completados los datos de la tabla, se representa en un grfico, el ndice de
refraccin (n) frente a la fraccin molar del etanol (
):
Grfica N1
Fuente: Elaboracin propia
1.335
1.34
1.345
1.35
1.355
1.36
1.365
1.37
1.375
0 0.2 0.4 0.6 0.8 1 1.2
n
XA
n vs. XA
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 19
B. Destilacin de una solucin acuosa de etanol al 50%
Para cada valor de la temperatura, evaluar la cantidad (W) del residuo en moles y su
composicin (Xw) en fraccin molar. Representar la composicin del residuo como
una funcin de la temperatura.
Mw etanol-agua =
. (1)
F = D + W W = F - D . (2)
F.
= D.
+ W.
..... (3)
Alimentacin (F):
n = 1.3598 en el grfico 1: Zf = 0.2648
F = peso/ (Mw etanol-agua)
De la ecuacin 1:
F = 267 /(0.2648x46.07 + 0.7352x18.02)
F = 10.4921 moles
Destilado (D):
T = 83
n = 1.3642 en el grfico 1:
= 0.4074
D = 8.45 /(0.4074x46.07 + 0.5926x18.02)
D = 0.2870 moles
De la ecuacin 2:
W = F - D = 10.4921 - 0.2870
W = 10.2051 moles
De la ecuacin 3:
F.
= D.
+ W.
= (F.
- D.
) / W
= (10.4921x0.2648 0.2870x0.4074)/10.2051
= 0.2608
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 20
T = 83.2
n = 1.3675 en el grfico 1:
= 0.7032
D = 17 /(0.7032x46.07 + 0.2968x18.02)
D = 0.4504 moles
De la ecuacin 2:
W = F - D = 10.4921 - 0.4504
W = 10.0417 moles
De la ecuacin 3:
F.
= D.
+ W.
= (F.
- D.
) / W
= (10.4921x0.2648 0.4504x0.7032)/10.0417
= 0.2451
Y se sigue as sucesivamente este proceso para cada temperatura del destilado, y se
obtiene el siguiente cuadro:
Tabla N5
Fuente: Elaboracin propia
T
ebullicin
()
n Fraccin
molar del
destilado
(XD)
Residuo en
moles (W)
Fraccin
molar del
residuo (Xw)
83 1.3642 0.4074 10.2051 0.2608
83.2 1.3675 0.7032 10.0417 0.2451
83.2 1.3682 0.8291 9.9141 0.2319
83.5 1.36725 0.6577 9.5941 0.2280
83.5 1.3675 0.7032 9.4071 0.2142
84 1.3680 0.7954 9.3348 0.1990
84.5 1.3679 0.7777 9.0612 0.1838
85 1.3676 0.7221 8.7926 0.1764
85 1.36725 0.6577 8.4876 0.1720
85.5 1.3680 0.7954 8.4746 0.1385
86 1.3690 0.9428 8.8286 0.1370
87 1.36875 0.9101 8.2639 0.0908
88 1.3685 0.8751 8.0153 0.0762
90 1.36825 0.8371 7.8701 0.0741
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 21
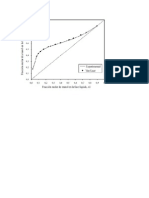
Entonces representamos en un grfico la fraccin molar del residuo (Xw) y la
temperatura de ebullicin del destilado:
Grfica N2
Fuente: Elaboracin propia
Para cada valor de la temperatura, con los datos experimentales calcular la relacin
F/W experimental.
F = 10.4921 moles (Alimentacin)
T = 83 F/W = 10.4921 / 10.2051 = 1.0281
T = 83.2 F/W = 10.4921 / 10.0417 = 1.0448
T = 83.2 F/W = 10.4921 / 9.9141 = 1.0583
T = 83.5 F/W = 10.4921 / 9.5941 = 1.0936
T = 83.5 F/W = 10.4921 / 9.4071 = 1.1153
T = 84 F/W = 10.4921 / 9.3348 = 1.1240
T = 84.5 F/W = 10.4921 / 9.0612 = 1.1580
T = 85 F/W = 10.4921 / 8.7926 = 1.1933
T = 85 F/W = 10.4921 / 8.4876 = 1.2361
T = 85.5 F/W = 10.4921 / 8.4746 = 1.2380
T = 86 F/W = 10.4921 / 8.8286 = 1.1884
T = 87 F/W = 10.4921 / 8.2639 = 1.2696
T = 88 F/W = 10.4921 / 8.0153 = 1.3090
T = 90 F/W = 10.4921 / 7.8701 = 1.3331
82
84
86
88
90
92
0 0.05 0.1 0.15 0.2 0.25 0.3
T
e
b
Xw
Xw vs. Teb
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 22
Se tiene entonces la siguiente tabla:
Tabla N6
T ebullicin () F/W experimental
83 1.0281
83.2 1.0448
83.2 1.0583
83.5 1.0936
83.5 1.1153
84 1.1240
84.5 1.1580
85 1.1933
85 1.2361
85.5 1.2380
86 1.1884
87 1.2696
88 1.3090
90 1.3331
Fuente: Elaboracin propia
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 23
Para cada valor de la temperatura, con la composicin Xw, utilizando la ecuacin de
Rayleigh y los datos de equilibrio del sistema etanol-agua a la presin atmosfrica,
calcular la relacin F/W terica.
Se tiene los datos del sistema de equilibrio etanol-agua, en fraccin molar de etanol a P
total = 1atm
Tabla N7
Composicin del lquido (x) Composicin del vapor (y)
0 0
0.0190 0.17
0.0721 0.3891
0.0966 0.4375
0.1238 0.4704
0.1661 0.5089
0.2337 0.5480
0.2608 0.5580
0.3273 0.5830
0.3965 0.6122
0.5079 0.6564
0.5198 0.6599
0.5732 0.6841
0.6763 0.7385
0.7472 0.7815
0.8954 0.8954
0.93 0.92
0.97 0.96
1 1
Fuente: Elaboracin propia
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 24
Para la alimentacin Zf = 0.2648, usando las tablas del sistema de equilibrio etanol-
agua:
= 0.5595
T = 83 :
= 0.2608
= 0.5580 (usando las tablas etanol-agua)
De la ecuacin de Rayleigh:
Ln
Y por integracin numrica, regla trapezoidal (mtodos numricos):
I =
)
Se calcula el (F/W) terico:
Ln
( ) = 0.002235
= 1.0022
T = 83.2 :
= 0.2451
= 0.5522 (usando las tablas etanol-agua)
Ln
( ) = 0.01095
= 1.0110
T = 83.2 :
= 0.2319
= 0.5470 (usando las tablas etanol-agua)
Ln
( ) = 0.0182
= 1.0184
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 25
T = 83.5 :
= 0.2280
= 0.5447 (usando las tablas etanol-agua)
Ln
( ) = 0.0203
= 1.0205
T = 83.5 :
= 0.2142
= 0.5367 (usando las tablas etanol-agua)
Ln
( ) = 0.0125
= 1.0126
T = 84 :
= 0.1990
= 0.5280 (usando las tablas etanol-agua)
Ln
( ) = 0.0357
= 1.0364
T = 84.5 :
= 0.1838
= 0.5191 (usando las tablas etanol-agua)
Ln
( ) = 0.0437
= 1.0446
T = 85 :
= 0.1764
= 0.5148 (usando las tablas etanol-agua)
Ln
( ) = 0.0475
= 1.0486
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 26
T = 85 :
= 0.1720
= 0.5123 (usando las tablas etanol-agua)
Ln
( ) = 0.0497
= 1.0509
T = 85.5 :
= 0.1385
= 0.4840 (usando las tablas etanol-agua)
Ln
( ) = 0.0659
= 1.0681
T = 86 :
= 0.1370
= 0.4824 (usando las tablas etanol-agua)
Ln
( ) = 0.0666
= 1.0688
T = 87 :
= 0.0908
= 0.4260 (usando las tablas etanol-agua)
Ln
( ) = 0.0857
= 1.0895
T = 88 :
= 0.0762
= 0.3972 (usando las tablas etanol-agua)
Ln
( ) = 0.0902
= 1.0944
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 27
T = 90 :
= 0.0741
= 0.3930 (usando las tablas etanol-agua)
Ln
( ) = 0.0908
= 1.0950
Por lo tanto se tiene la siguiente tabla:
Tabla N8
T ebullicin () F/W terico
83 1.0022
83.2 1.0110
83.2 1.0184
83.5 1.0205
83.5 1.0126
84 1.0364
84.5 1.0446
85 1.0486
85 1.0509
85.5 1.0681
86 1.0688
87 1.0895
88 1.0944
90 1.0950
Fuente: Elaboracin propia
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 28
6.2 PRCTICA N 12: DESTILACION DEL VINO
Volumen de destilado en funcin de la temperatura de destilacin.
Grfica N3
Fuente: Elaboracin propia
Determinacin de la densidad de la mezcla de agua y etanol (usando densmetro) a la
temperatura de trabajo.
Temperatura de trabajo: 20 C
Densidad: 0.984 g/cc
0
10
20
30
40
50
60
84 86 88 90 92 94 96
V (ml)
C
V vs T
V vs T
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 29
Determinacin del grado alcohlico de la mezcla agua y etanol a la temperatura de
trabajo.
Tabla N8
Fuente : Perrys Chemical Engineers-Handbook-7
th
edition..pg 2-112
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 30
Alcohol etlico (%peso) ; densidad: g/cc
Densidad del alcohol puro a 20C:
Densidad (
= 0.78934 g/cc
Densidad del agua a 20 C
Densidad
= 0.99823 g/cc
Convirtiendo el %peso a % en volumen:
(
Tabla N9
Fuente: Elaboracin propia
Para nuestra densidad de 0.984 tenemos un grado alcohlico de 12
DENSIDAD
(g/ml)
GR. ALCOH.
(% vol.)
0.989 8
0.988 9
0.987 10
0.985 11
0.984 12
0.983 13
0.982 14
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 31
Correccin del grado alcohlico obtenido con el alcoholmetro a la temperatura de
trabajo.
Dnde:
Reemplazando:
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 32
VII. ANALISIS DE RESULTADOS
7.1 PRCTICA N 11: DESTILACION DIFERENCIAL
En el grfico 1, el ndice de refraccin es mayor cuando aumenta la fraccin molar
de etanol, debido a que en una solucin se presenta un mayor porcentaje de etanol la
velocidad de la luz en dicha solucin es menor y en una solucin de menor
porcentaje de etanol la velocidad de la luz en dicha solucin es mayor.
En la destilacin del etanol-agua se produce un aumento de la temperatura del
sistema y se nota cada vez menor el etanol en la carga a medida que avanza la
destilacin debido a que el etanol-agua en la alimentacin del sistema vara con el
tiempo.
Para cada valor de temperatura, con los datos experimentales se obtuvo la relacin
F/W experimental, y con la ecuacin de Rayleigh y datos de equilibrio del sistema
etanol-agua la relacin F/W terica; en los cuales lo experimental no vara mucho
con respecto a lo terico porque se realiz una buena destilacin donde el vapor
desprendido estaba en cualquier instante en equilibrio con el lquido.
7.2 PRCTICA N 12: DESTILACION DEL VINO
En la medicin experimental del grado alcohlico del vino, mediante el uso de
tablas obtuvimos un valor de 12 obtenidos a partir de la medicin de la densidad
del alcohol destilado y de la temperatura de trabajo.
Al determinar el grado alcohlico con un alcoholmetro obtuvimos un valor de 15
al cual tuvimos q realizar la correccin respectiva, obteniendo un valor de 13
LABORATORIO DE INGENIERIA QUIMICA
FSCULATAD DE INGENIERIA QUIMICA Pgina 33
VIII. CONCLUSIONES
8.1 PRCTICA N 11: DESTILACION DIFERENCIAL
A mayor fraccin molar de etanol (en una solucin etanol-agua), hay un mayor
ndice de refraccin.
A mayor temperatura de ebullicin del destilado hay una menor fraccin molar de
etanol en el residuo y por ende una mayor fraccin molar de etanol en el destilado.
El vapor que se produce en este tipo de destilacin, est en equilibrio con el lquido
de donde se forma el vapor, variando la composicin de los componentes a medida
que avanza la destilacin.
8.2 PRCTICA N 12: DESTILACION DEL VINO
.
Un vino es una mezcla muy compleja; contiene agua, etanol, azcares, cidos
orgnicos, pigmentos (que le dan color) y otros ingredientes. Los componentes
voltiles que se encuentran en cantidad considerable son precisamente el agua y el
etanol, cuyos puntos de ebullicin son, respectivamente, 100,0 C y 78,3 C. Ambos
pueden formar un azetropo que hierve a 78,2 C y cuya composicin es 96 % de
masa de etanol (97 % en volumen)
En la destilacin de vino no se puede obtener ninguna fraccin que contenga alcohol
al 100 %, debido a que el componente ms voltil es precisamente el azetropo.
En el vino, el contenido en alcohol se expresa en porcentaje de volumen y es algo
mayor del 10 %.
IX. BIBLIOGRAFIA
http://fjartnmusic.com/Personal/8o_Semestre_files/DS.pdf
http://ocw.unizar.es/ciencias-experimentales/tecnicas-basicas-de-laboratorio-
quimico/teoria/Destilacion_teoria.pdf
http://www.galeon.com/mcoronado/ANALISIS_UNIDADES/06DESTILADORES.pd
f
Вам также может понравиться
- Teoría de DestilaciónДокумент18 страницTeoría de DestilaciónNicolás Villagrán100% (1)
- Importancia y Tipos de DestilacionДокумент13 страницImportancia y Tipos de DestilacionAmairani ZuñigaОценок пока нет
- Destilación FraccionadaДокумент15 страницDestilación Fraccionadapostillo123Оценок пока нет
- Teoría y tipos de destilaciónДокумент8 страницTeoría y tipos de destilaciónErick ZmОценок пока нет
- Destilacion PDFДокумент24 страницыDestilacion PDFMinet Gatica100% (1)
- Reporte DestilaciónДокумент15 страницReporte DestilaciónYael Hernandez LopezОценок пока нет
- Destilacion FraccionadaДокумент15 страницDestilacion FraccionadadanielОценок пока нет
- La destilación como técnica de separaciónДокумент5 страницLa destilación como técnica de separaciónRachel PearsonОценок пока нет
- Ingenieria IndustrialДокумент9 страницIngenieria IndustrialEduard Chavez AredoОценок пока нет
- Trabajo - Exposición DestilaciónДокумент9 страницTrabajo - Exposición DestilaciónRaniel RodríguezОценок пока нет
- Marco Teórico - DestilaciónДокумент15 страницMarco Teórico - Destilacióngiancarlos morales diazОценок пока нет
- Destilacion FINALДокумент53 страницыDestilacion FINALkatia_meraОценок пока нет
- Destilación Op3 LaboДокумент12 страницDestilación Op3 LaboAnonymous xq5zSZtОценок пока нет
- Balance de Materia en Varias FasesДокумент18 страницBalance de Materia en Varias FasesCristel HerreraОценок пока нет
- Destilación fraccionada: principios y aplicaciones industrialesДокумент12 страницDestilación fraccionada: principios y aplicaciones industrialesMarcos RuedaОценок пока нет
- Procesos de destilaciónДокумент10 страницProcesos de destilaciónJose Luis TierraОценок пока нет
- Reyes Iturbide Jesus Jonathan-DSFДокумент13 страницReyes Iturbide Jesus Jonathan-DSFDaniela Torres OlveraОценок пока нет
- Practica No 3 Destilación FraccionadaДокумент27 страницPractica No 3 Destilación FraccionadaRodrigo GonzálezОценок пока нет
- DESTILACIONДокумент10 страницDESTILACIONlangarica.albertoОценок пока нет
- Destilacion FraccionadaДокумент7 страницDestilacion FraccionadaJoseline Mimi Aguilar Arguedas80% (15)
- Destilación y SublimaciónДокумент16 страницDestilación y SublimaciónCielitoОценок пока нет
- Operaciones Farmacéuticas 1Документ7 страницOperaciones Farmacéuticas 1Blanca FernandezОценок пока нет
- Tipos de destilación enДокумент15 страницTipos de destilación enLeonel Roberth Conde MamaniОценок пока нет
- Procesos de DestilaciónДокумент14 страницProcesos de DestilaciónGer Canul UcОценок пока нет
- Inf. DestilacionДокумент17 страницInf. DestilacionEdwin Pachacuti ApazaОценок пока нет
- Reporte 3 - Destilación FraccionadaДокумент8 страницReporte 3 - Destilación Fraccionadamario3312100% (1)
- Informe 4Документ8 страницInforme 4Andres SebastianОценок пока нет
- Destilación y Tipos de DestilaciónДокумент14 страницDestilación y Tipos de DestilacióntrensaОценок пока нет
- Manual NuevoДокумент80 страницManual NuevoJavier NessОценок пока нет
- Apuntes Evaporadores Abril 2021 AlumnДокумент7 страницApuntes Evaporadores Abril 2021 AlumnLucario PeelingОценок пока нет
- Procesos de Operaciones Unitarias Basicas en Balance de Materia y EnergiaДокумент9 страницProcesos de Operaciones Unitarias Basicas en Balance de Materia y Energiamia muñizОценок пока нет
- Destilación FraccionadaДокумент3 страницыDestilación FraccionadaluisОценок пока нет
- Destilación intermitente: separación de agua y metanolДокумент9 страницDestilación intermitente: separación de agua y metanolDennis Gutierrez RiojaОценок пока нет
- 2 - Apuntes Evaporadores May 19-1 PDFДокумент9 страниц2 - Apuntes Evaporadores May 19-1 PDFChar HernandezОценок пока нет
- Unidad 1.1 DestilacionДокумент7 страницUnidad 1.1 DestilacionJuan Carlos Martinez FacundoОценок пока нет
- Diseño de Un Condensador para Una Torre de DestilaciónДокумент16 страницDiseño de Un Condensador para Una Torre de DestilaciónSandra Lizbeth Garcia DueñasОценок пока нет
- Diapositiva de DestilacionДокумент25 страницDiapositiva de DestilacionMiguel Reynaldo CabreraОценок пока нет
- Principios TeóricosДокумент13 страницPrincipios TeóricosMILI_89Оценок пока нет
- Practica 4Документ15 страницPractica 4Chechar PerezОценок пока нет
- Destilacion Rectificacion Continua 8im2Документ11 страницDestilacion Rectificacion Continua 8im2Julio Cesar ParedesОценок пока нет
- Separación de mezclas líquidas por destilaciónДокумент30 страницSeparación de mezclas líquidas por destilaciónNelson PerezОценок пока нет
- DestilacionДокумент20 страницDestilacionEstela MaldonadoОценок пока нет
- Destilación Fraccionada Del PetróleoДокумент2 страницыDestilación Fraccionada Del PetróleoKP010Оценок пока нет
- Ensayo de Torres de DestilacionДокумент12 страницEnsayo de Torres de DestilacionV. GongoraОценок пока нет
- Informe DestilacionДокумент10 страницInforme DestilacionWilsonDurandPajaresОценок пока нет
- Trabajo Destilación Fraccionada 1Документ5 страницTrabajo Destilación Fraccionada 1victor JavierОценок пока нет
- Destilacion Molecular TrabajoДокумент18 страницDestilacion Molecular TrabajoMANUEL ENRIQUE VARGAS JIMENEZОценок пока нет
- Destilación: Proceso de Separación de ComponentesДокумент27 страницDestilación: Proceso de Separación de ComponentesVictor Verbeeck Castillo100% (1)
- Cuestionario Previo de Destilación Simple y FraccionadaДокумент4 страницыCuestionario Previo de Destilación Simple y FraccionadaDaniel RomanoОценок пока нет
- E.E.S.T.N° 4 Dr. Ernesto Longobardi: Informe Del Trabajo de Laboratorio N°12Документ20 страницE.E.S.T.N° 4 Dr. Ernesto Longobardi: Informe Del Trabajo de Laboratorio N°12Melina FiselaОценок пока нет
- Destilacion Simple y de EquilibrioДокумент9 страницDestilacion Simple y de EquilibrioAdriana Salas OliveraОценок пока нет
- Destilacion A Reflujo TotalДокумент13 страницDestilacion A Reflujo TotalAnn Hewson75% (4)
- Destilación simple y fraccionadaДокумент9 страницDestilación simple y fraccionadaElizabeth0% (1)
- DestilaciónДокумент5 страницDestilaciónJesus Ricardo Chacon IbarraОценок пока нет
- Ensamblar Aparatos de Laboratorio: Destilación Al VacíoДокумент3 страницыEnsamblar Aparatos de Laboratorio: Destilación Al VacíoWilfredo QuentaОценок пока нет
- Destilacion DiferencialДокумент12 страницDestilacion DiferencialaddaОценок пока нет
- Eficiencia energética en las instalaciones de climatización en los edificios. ENAC0108От EverandEficiencia energética en las instalaciones de climatización en los edificios. ENAC0108Оценок пока нет
- El Mejor Libro de Preparación Para Tu Examen De Licencia De Operador De CalderaОт EverandEl Mejor Libro de Preparación Para Tu Examen De Licencia De Operador De CalderaОценок пока нет
- Anuario Minero 2021: Resumen del desempeño del sector minero peruanoДокумент143 страницыAnuario Minero 2021: Resumen del desempeño del sector minero peruanoatilagalianoОценок пока нет
- DA-053 Código de Ética (Ver 02)Документ5 страницDA-053 Código de Ética (Ver 02)atilagalianoОценок пока нет
- GUNF-PDRGA - SO-2-TDR-015-2021TDR - MONITOREOS AMBIENTALES 3y4 Trimestre 2022Документ24 страницыGUNF-PDRGA - SO-2-TDR-015-2021TDR - MONITOREOS AMBIENTALES 3y4 Trimestre 2022atilagalianoОценок пока нет
- Estado Después de La Globalización Neoliberal (Mabel Thwaites Rey)Документ25 страницEstado Después de La Globalización Neoliberal (Mabel Thwaites Rey)estadoyplanificacion100% (1)
- S11.s1 - PRACTICA CALIFICADA 2Документ1 страницаS11.s1 - PRACTICA CALIFICADA 2atilagalianoОценок пока нет
- Nitrato de Plata FinalДокумент19 страницNitrato de Plata FinalatilagalianoОценок пока нет
- El Estado LiquidoДокумент17 страницEl Estado LiquidoatilagalianoОценок пока нет
- Propiedades y usos del vapor de aguaДокумент6 страницPropiedades y usos del vapor de aguaMariana Vazquez Alvarez100% (1)
- Ficha Tecnica MekДокумент5 страницFicha Tecnica Mekjulian4437Оценок пока нет
- EjerciciosДокумент7 страницEjerciciosNicol Ordoñez RosalesОценок пока нет
- Informe Reactor DiscontinuoДокумент24 страницыInforme Reactor DiscontinuoPABLOОценок пока нет
- Manual VPclimaДокумент32 страницыManual VPclimaRafa Espinosa CamachoОценок пока нет
- Reactores Batch y CSTRДокумент28 страницReactores Batch y CSTRrosaОценок пока нет
- Equilibrio Líquido-Vapor de una solución no ideal a baja presiónДокумент37 страницEquilibrio Líquido-Vapor de una solución no ideal a baja presiónJesus Vazquez60% (5)
- Primer Examen Parcial de Ingeniería de Materiales IДокумент9 страницPrimer Examen Parcial de Ingeniería de Materiales IJemitoОценок пока нет
- Practicas de LaboratorioДокумент7 страницPracticas de Laboratoriohector chavezОценок пока нет
- Polimeros 1Документ48 страницPolimeros 1Glenda Tesen QuispeОценок пока нет
- Propiedades ColigativasДокумент3 страницыPropiedades ColigativasJuan Daniel Hernandez AlejandroОценок пока нет
- Equilibrio RedoxДокумент31 страницаEquilibrio RedoxYONNY JOSUE MERA MACIASОценок пока нет
- Dimensões GeradoresДокумент1 страницаDimensões GeradoresHerménio FerreiraОценок пока нет
- Leticia Suarez - Tesis Doc 2014 PDFДокумент176 страницLeticia Suarez - Tesis Doc 2014 PDFGonzalo GimenezОценок пока нет
- Fascículo de EvaluacionДокумент55 страницFascículo de EvaluacionRaquel Erika Montes RamirezОценок пока нет
- 3-Modelos V4RRДокумент6 страниц3-Modelos V4RRRosember RamirezОценок пока нет
- Cuestionario Sistemas Industriales BoschДокумент3 страницыCuestionario Sistemas Industriales Boschp_guzmanrlОценок пока нет
- Pract 2 Determinacion de La Constante Adiabatica Del AireДокумент14 страницPract 2 Determinacion de La Constante Adiabatica Del AirePod ADОценок пока нет
- Operaciones UnitariasДокумент2 страницыOperaciones UnitariasMaxi ProañoОценок пока нет
- Grupos FuncionalesДокумент8 страницGrupos FuncionalesAdrianОценок пока нет
- Calor Especifico de Un SólidoДокумент10 страницCalor Especifico de Un SólidoRoberto Carrasco OsorioОценок пока нет
- Laboratorios Transferencia de CalorДокумент28 страницLaboratorios Transferencia de CalorJair Andres Arevalo Banoy100% (1)
- Analisis de Presiòn, Mecanica de FluidosДокумент12 страницAnalisis de Presiòn, Mecanica de FluidosLaurence AVENDANO LOPEZОценок пока нет
- 864 Solución Anexo 1 Preguntas TermoДокумент11 страниц864 Solución Anexo 1 Preguntas TermoYeimmy Julieth Cardenas MillanОценок пока нет
- Reacción Química de Ácido Nitrico y Cobre: MaterialesДокумент3 страницыReacción Química de Ácido Nitrico y Cobre: MaterialesBárbara Rebolledo Garrido100% (1)
- Química OrgánicaДокумент20 страницQuímica OrgánicaVerónica Moreno HernándezОценок пока нет
- Guia N°2 Química AplicadaДокумент1 страницаGuia N°2 Química Aplicadayessy89Оценок пока нет
- Resumen ComplejometriaДокумент11 страницResumen ComplejometriaGago_88_Оценок пока нет
- TPE Geometria Molecular GrabaciónДокумент60 страницTPE Geometria Molecular GrabaciónGerardo PelОценок пока нет
- Aceites para Tratamientos TermicosДокумент22 страницыAceites para Tratamientos TermicosELMER BARRIOS DIAZОценок пока нет