Академический Документы
Профессиональный Документы
Культура Документы
Numero 1
Загружено:
Bryan EduОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Numero 1
Загружено:
Bryan EduАвторское право:
Доступные форматы
FOSFORILACION OXIDATIVA
Proceso por el cual los electrones se transfieren desde el NADH y FADH2 al O2 a travs de
tres complejos proteicos de la membrana mitocondrial interna
GENERACION DE ATP
La accin combinada del ciclo de Krebs y la fosforilacin oxidativa es motivo de la mayor
parte de la generacin del ATP.
La transferencia alergnica de electrones del NADH o del FADH a oxigeno por la
fosforilacin oxidativa mantiene la sntesis endergnica del ATP a partir de ADP y Pi , lo
cual requiere de unas cadena de transporte de electrones, oxigeno molecular y ATP
sintasa.
Los electrones van a fluir desde intermediarios catablicos hacia el oxgeno para la
formacin de energa que lleva a la formacin de ATP a partir de ADP y Pi. As, las
molculas formadas en stos procesos se van a reoxidar, generando energa para la
sntesis de ATP.
TEORIA QUIMIOSMOTICA DE MITCHELL
Fue desarrollada por Peter Mitchell (1920-1992)
Le vali el Nobel de 1978
En los comienzos de la dcada del 60 se conoca el papel del ATP como moneda de
energa, pero se supona que su sntesis era por fosforilacin a nivel de sustrato. En
consecuencia, se buscaba un hipottico intermediario de alta energa capaz de fosforilar al
ADP.
La teora postula que la energa para la sntesis de ATP proviene de la formacin de un
gradiente qumico por el cual los H+ son bombeados fuera de la mitocondria.
Las reacciones exergnicas de transporte de energa electrones generan un gradiente de
protones a travs de la membrana que sustenta la formacin de ATP
Explica cmo la energa derivada del transporte de electrones por la cadena de electrones
se utiliza para producir ATP a partir de ADP y Pi. El transporte de electrones est acoplado
al transporte de H+ a travs de la membrana interna mitocondrial, este proceso crea un
gradiente elctrico con ms cargas positivas en el exterior de la membrana que en la
mitocondria y el pH en el exterior de la membrana est ms cido que el interior. La
energa generada por este gradiente es suficiente para realizar la sntesis de ATP. Peter
Mitchell es un bioqumico ingls galardonado con el Premio Nobel de Qumica del ao
1978 por la teora qumiosmtica ,dicho estudio se enfoca en el almacenaje de la energa
en los seres vivos y como gracias a la energa suministrada por la respiracin humana, el
ADP consigue convertirse nuevamente ATP, proceso denominado fosforilacin oxidativa.
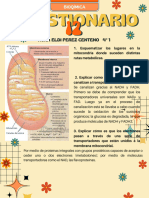
ESTRUCTURA DE LA MITOCONDRIA
Las mitocondrias son orgnulos celulares encargados de suministrar la mayor parte de la
energa necesaria para la actividad celular (respiracin celular). Actan, por lo tanto, como
centrales energticas de la clula y sintetizan ATP a expensas de los carburantes
metablicos (glucosa, cidos grasos y aminocidos). La mitocondria presenta una
membrana exterior permeable a iones, metabolitos y muchos polipptidos. Eso es debido
a que contiene protenas que forman poros llamados porinas o VDAC (canal aninico
dependiente de voltaje), que permiten el paso de molculas.
Las mitocondrias estn rodeadas de dos membranas claramente diferentes en sus
funciones y actividades enzimticas, que separan tres espacios: el citosol, el espacio
intermembrana y la matriz mitocondrial.
Membrana externa
Es una bicapa lipdica exterior permeable a iones, metabolitos y muchos polipptidos. Eso
es debido a que contiene protenas que forman poros, llamadas porinas o VDAC (de canal
aninico dependiente de voltaje), que permiten el paso de grandes molculas de hasta
5.000 dalton y un dimetro aproximado de 20 . La membrana externa realiza
relativamente pocas funciones enzimticas o de transporte. Contiene entre un 60 y un
70% de protenas.
Membrana interna
La membrana interna contiene ms protenas, carece de poros y es altamente selectiva;
contiene muchos complejos enzimticos y sistemas de transporte transmembrana, que
estn implicados en la translocacin de molculas. Esta membrana forma invaginaciones o
pliegues llamados crestas mitocondriales, que aumentan mucho la superficie para el
asentamiento de dichas enzimas. En la mayora de los eucariontes, las crestas forman
tabiques aplanados perpendiculares al eje de la mitocondria, pero en algunos protistas
tienen forma tubular o discoidal.
En la composicin de la membrana interna hay una gran abundancia de protenas (un
80%), que son adems exclusivas de este orgnulo:
La cadena de transporte de electrones, compuesta por cuatro complejos enzimticos fijos
y dos transportadores de electrones mviles:
Complejo I o NADH deshidrogenasa que contiene flavina mononucletido (FMN).
Complejo II o succinato deshidrogenasa; ambos ceden electrones al coenzima Q o
ubiquinona.
Complejo III o citocromo bc1 que cede electrones al citocromo c.
Complejo IV o citocromo c oxidasa que cede electrones al O2 para producir dos molculas
de agua.
Un complejo enzimtico, el canal de H+ ATP sintasa que cataliza la sntesis de ATP
(fosforilacin oxidativa).
Protenas transportadoras que permiten el paso de iones y molculas a su travs, como
cidos grasos, cido pirvico, ADP, ATP, O2 y agua; pueden destacarse:
Nucletido de adenina translocasa. Se encarga de transportar a la matriz mitocondrial el
ADP citoslico formado durante las reacciones que consumen energa y, paralelamente
transloca hacia el citosol el ATP recin sintetizado durante la fosforilacin oxidativa.
Fosfato translocasa. Transloca fosfato citoslico junto con un hidrn a la matriz; el fosfato
es esencial para fosforilar el ADP durante la fosforilacin oxidativa.
Espacio intermembranoso
Entre ambas membranas queda delimitado un espacio intermembranoso que est
compuesto de un lquido similar al hialoplasma; tienen una alta concentracin de
protones como resultado del bombeo de los mismos por los complejos enzimticos de la
cadena respiratoria. En l se localizan diversas enzimas que intervienen en la transferencia
del enlace de alta energa del ATP, como la adenilato kinasa o la creatina quinasa.
Tambin se localiza la carnitina, una molcula implicada en el transporte de cidos grasos
desde el citosol hasta la matriz mitocondrial, donde sern oxidados (beta-oxidacin).
Matriz mitocondrial
La matriz mitocondrial o mitosol contiene menos molculas que el citosol, aunque
contiene iones, metabolitos a oxidar, ADN circular bicatenario muy parecido al de las
bacterias, ribosomas tipo 55S (70S en vegetales), llamados mitorribosomas, que realizan la
sntesis de algunas protenas mitocondriales, y contiene ARN mitocondrial; es decir, tienen
los orgnulos que tendra una clula procariota de vida libre. En la matriz mitocondrial
tienen lugar diversas rutas metablicas clave para la vida, como el ciclo de Krebs y la beta-
oxidacin de los cidos grasos; tambin se oxidan los aminocidos y se localizan algunas
reacciones de la sntesis de urea y grupos hemo.
Algunos compuestos importantes, incluyendo NAD+, NADH, NADP+, NADPH, conenzima A
y sus derivados, y oxalacetato no son transportados a travs de la membrana mitocondrial
interna. La falta de una sistema de transporte para el oxalacetato previene de su
deplecin a partir de la mitocondria. El transporte de equivalentes de reduccin a travs
de la membrana mitocondrial interna es mediado por el intercambiador malato-asparato
y por el intercambiador glicerol-fosfato. Una celula dada contiene predominantemente
uno de estos dos sistemas.
INTERCAMBIADOR MALATA- ASPARATO
FASE I. Trasporte de electrones hacia la matriz
1. El NADH es reoxidado por oxaloacetato citoplsmico a travs de la accin de la
malato deshidrogenasa citoplsmica.
2. El transportador de malato-a -cetoglutarato transporta el malato formado en el paso
1 hacia la matriz mitocondrial en intercambio con a cetoglutarato.
3. En la matriz mitocondrial. El NADH es regenerado a partir de NAD+ a travs de la
oxidacin del malato a oxaloacetato por el malato deshidrogenasa mitocondrial.
Fase II. Regeneracin del oxaloacetato citoplsmico.
4. una transaminasa convierte el oxaloacetato mitocondrial a aspartarto con la
conversin concomitante de glutamato en a cetoglutarato.
5. El aspartato es transportado desde la matriz hacia el citoplasma por el acarreador de
glutamato-aspartato en intercambio con glutamato citoslico.
6. El aspartato citoslico es convertido a oxaloacetato por una transaminasa con la
conversin de a cetoglutarato a glutamato.
El Rendimiento final de ATP es de 2.5 moles por mol de NADH citoplasmtico oxidado
El sistema intercambiador malato-aspartato se localiza en clulas hepticas y cardiacas
INTERCAMBIADOR GLICEROL-FOSFATO
1. Los elementos reductores del NADH pasan al oxalacetato por efecto de la enzima la
malato deshidrogenasa citoslica.
2. As el oxalacetato reducido se transforma en malato, y puede entrar a la mitocondria
por el transaportador "malato alfa-cetoglutarato" el que se ve arribita
3. Una vez adentro todo eso que redujo al malato ahora pasa al NAD que est al interior
de la matriz por efecto de la malato deshidrogenasa mitocondrial, formndose el querido
NADH dentro de la mitocondria, as se puede pasar electrones a la respiracin...
4. As pasa un par de electrones al Oxigeno, formando 2,5 ATP. Cuando se form el NADH
se dio nuevamente creacin al oxalacetato, que no puede pasar directamente al citosol,
debe transformarse en aspartato por efecto de una transaminacin por efecto de la
aspartato aminotransferasa.
5. Una vez hecho aspartato puede salir por el transportador "Glutamato-Aspartato" (5).
Cuando sale al citosol se transforma de nuevo en oxalacetato, para completar as un ciclo.
Rendimiento final de ATP es de 1.5 moles por mol de NADH citoplasmtico oxidado.
El sistema intercambiador glicerol-fosfato, se localiza en clulas cerebrales y musculares
COMPONENTES DE LA CADENA DE TRANSPORTE DE ELECTRONES
FAD
El flavn adenn dinucletido o dinucletido de flavina-adenina (abreviado FAD en su
forma oxidada y FADH2 en su forma reducida) es una coenzima que interviene en las
reacciones metablicas de oxidacin-reduccin.
El FAD es una molcula compuesta por una unidad de riboflavina (vitamina B2),3 unida a
un pirofosfato (PPi), ste unido a una ribosa y sta unida a una adenina. Por tanto, la
molcula es en realidad ADP unido a riboflavina; o tambin AMP unido a la coenzima
FMN.
El FAD es una coenzima que interviene como dador o aceptor de electrones y protones
(poder reductor) en reacciones metablicas redox; su estado oxidado se reduce a FADH2
al aceptar dos tomos de hidrgeno (cada uno formado por un electrn y un protn)
Por tanto, al reducirse capta dos protones y dos electrones, lo que lo capacita para
intervenir como dador de energa y/o poder reductor en el metabolismo.
El FAD est fuertemente unido al complejo II o succinato deshidrogenasa.
FMN
El flavin mononucletido (FMN), o riboflavina-5'-fosfato, es un derivado de la riboflavina
(vitamina B2) que acta como coenzima de diversas oxidoreductasas. Durante el ciclo
cataltico se produce la interconversin reversible entre la forma oxidada (FMN),
semiquinona (FMNH) y reducida (FMNH2) de la coenzima.
El FMN es un agente oxidante ms fuerte que el NAD+ y es particularmente til ya que
puede tranferir uno o dos electrones.
Flavina Mononucletido (FMN) Al igual que la ubiquinona, sus reacciones de transferencia
de electrones estn acopladas a la unin o liberacin de protones. Tambin al poder
existir en forma de semiquinona, transportar tanto un electrn como un par.
El aceptor de los electrones es el anillo de isoaloxazina, que es idntico al del FAD.
EL FMN Sufre reacciones reversibles de oxidoreduccion. Se encuentra unido firmemente al
complejo I de la cadena respiratoria.
UBIQUINONA(COENZIMA Q)
Derivado quinona con larga cadena isoprenoide, el nmero de unidades de isopreno
depende de la especie.
Puede presentar tres estados de oxidacin
Sus reacciones de transferencia de electrones estn acopladas a la unin o liberacin de
protones: propiedad clave a la hora de transportar protones a travs de la membrana ya
que al ser al mismo tiempo pequea e hidrofbica puede difundir libremente a travs de
la membrana interna mitocondrial.
CENTROS FE-S
Fe est presente no en forma de hemo(como en los citocromos) sino en asociacin
con tomos de azufre inorgnico o con tomos de azufre de residuos de Cysde la
protena transportadora, o con los dos al mismo tiempo.
Unidos a sus protenas.
Participan en reacciones de transferencia de un electrn.
Se pueden presentar en tres tipos:
1. Centro de Rieske: complejo [2Fe-2S] donde los S son de Hisen lugar de Cys.
2. El Fe de estos complejos alterna entre los estados oxidado Fe3+y reducido Fe2+
3. Suelen intervenir en reacciones redoxsin aceptar o liberar protones.
CITOCROMOS
Los citocromos que intervienen en la cadena de transporte electrnico se designan a, b, y
c y se distinguen por sus diferentes espectros de absorcin. (cerca de 600 nm para tipo a,,
cerca de 560 en los del tipo b y cerca de 559 nm en los del tipo c). Para distinguir entre
citocromos de un tipo estrechamente relacionados, se utiliza en su nombre la longitud de
onda de absorcin mxima (citocromob562 )
Se llaman citocromos porque son componentes celulares coloridos.
Citocromo B reductosa:
sta es la tercera enzima de la cadena respiratoria, tiene la misma funcin de la enzima
anterior, nada ms que acta sobre el citocromo B y se vuelve a producir otra molcula de
ATP.
Citocromo C reductosa:
Su funcin es transferir electrones del citocromo C al citocromo A de tal forma que se
oxida el citocromo C y se reduce el citocromo A.
Citocromo A oxidasa:
sta es la ltima enzima de la cadena y tiene 3 funciones especficas:
1- Ayuda a que ocurra la ltima fosforilacin, sto es, que se forma la tercera molcula de
ATP.
2- Los electrones que atraviesan los citocromos y que ayudaron a que se den las 3
molculas de ATP, se unan otra vez a sus protones de hidrgeno para volver a formar un
par de hidrgenos.
3- Ayuda a que los hidrgenos se unan a las molculas de O2 (que son cedidas por los
glbulos rojos o eritocitos) para que al final de la respiracin se forma H2O metablica.
Funciona como transportador de electrones y protones en la cadena respiratoria.
Вам также может понравиться
- Fosforilacion OxidativaДокумент11 страницFosforilacion OxidativaJose Alberto Ariza PasoОценок пока нет
- Sopa de letras RESPIRACIONДокумент1 страницаSopa de letras RESPIRACIONRodolfoRinconMontes0% (2)
- Sistemas EnergeticosДокумент54 страницыSistemas EnergeticosSebastian CaicedoОценок пока нет
- Efecto de Los Inhibidores en La Cadena RespiratoriaДокумент10 страницEfecto de Los Inhibidores en La Cadena RespiratoriaKevf Rafhael Diaz Muñoz50% (2)
- InmunocromatografiaДокумент14 страницInmunocromatografiaBryan Edu100% (1)
- Fosforilación OxidativaДокумент25 страницFosforilación OxidativaEmilio Jeanpaul Mitacc GutierrezОценок пока нет
- Metabolismo CelularДокумент6 страницMetabolismo CelularJose Gonzales ChampiОценок пока нет
- Fotosíntesis y respiración celularДокумент4 страницыFotosíntesis y respiración celularJonathan Esquivel Cruz100% (1)
- Hormnoas TiroideasДокумент4 страницыHormnoas TiroideasBryan EduОценок пока нет
- Buscan en Hongos Moléculas Útiles Contra El CáncerДокумент2 страницыBuscan en Hongos Moléculas Útiles Contra El CáncerBryan EduОценок пока нет
- Así Funciona El Gen de La ObesidadДокумент1 страницаAsí Funciona El Gen de La ObesidadBryan EduОценок пока нет
- GeneticaДокумент4 страницыGeneticaBryan EduОценок пока нет
- Quitar manchas sangre mandilДокумент1 страницаQuitar manchas sangre mandilBryan EduОценок пока нет
- Alta Prevalencia de Infección de Hígado Humano Por Amphimerus SPPДокумент9 страницAlta Prevalencia de Infección de Hígado Humano Por Amphimerus SPPBryan EduОценок пока нет
- AnaerobiasДокумент8 страницAnaerobiasBryan EduОценок пока нет
- GeneticaДокумент4 страницыGeneticaBryan EduОценок пока нет
- Diferencia Entre Eficacia y EficienciaДокумент5 страницDiferencia Entre Eficacia y EficienciaBryan EduОценок пока нет
- 7.6 Las Buenas Nuevas de JuanДокумент5 страниц7.6 Las Buenas Nuevas de JuanBryan EduОценок пока нет
- Ex Amenes Genetic OsДокумент15 страницEx Amenes Genetic OsBryan EduОценок пока нет
- Tipos de Inteligencia Son ImporДокумент4 страницыTipos de Inteligencia Son ImporBryan EduОценок пока нет
- La biometría hemática: métodos manuales y automatizadosДокумент4 страницыLa biometría hemática: métodos manuales y automatizadosBryan Edu0% (1)
- La biometría hemática: métodos manuales y automatizadosДокумент4 страницыLa biometría hemática: métodos manuales y automatizadosBryan Edu0% (1)
- Localización de Las Válvulas CardiacasДокумент1 страницаLocalización de Las Válvulas CardiacasBryan EduОценок пока нет
- Fermentación y RespiraciónДокумент15 страницFermentación y RespiraciónMariaОценок пока нет
- Guia# 5 de 10° 21 de Mayo-2020Документ2 страницыGuia# 5 de 10° 21 de Mayo-2020Andres Mauricio BarrosОценок пока нет
- EXPERIMENTO LEVADURAДокумент4 страницыEXPERIMENTO LEVADURASariela Lizeth Ulloa MartínezОценок пока нет
- MetabolismoДокумент3 страницыMetabolismoAyala Angel ValeriaОценок пока нет
- Glicolisis y Respiracion CelularДокумент24 страницыGlicolisis y Respiracion CelularmartijndarmiejntohagОценок пока нет
- Cuestionario 12Документ2 страницыCuestionario 12NoraОценок пока нет
- Bioquimica: GlucolisisДокумент35 страницBioquimica: GlucolisisMedSchoolStuff100% (4)
- Respiración celular: obtención de ATP a través de la glucólisis, ciclo de Krebs y fosforilación oxidativaДокумент1 страницаRespiración celular: obtención de ATP a través de la glucólisis, ciclo de Krebs y fosforilación oxidativaAna MGОценок пока нет
- Unidad 2 Sesión 8 - Mitocondrias FSДокумент26 страницUnidad 2 Sesión 8 - Mitocondrias FSTamara Riquelme PerezОценок пока нет
- Cómo obtienen las células energía de los alimentosДокумент6 страницCómo obtienen las células energía de los alimentoslalo blockОценок пока нет
- Universidad Nacional de Trujillo Sede Guadalupe Escuela de Agronomía Experiencia Curricular: Bioquímica AgrícolaДокумент47 страницUniversidad Nacional de Trujillo Sede Guadalupe Escuela de Agronomía Experiencia Curricular: Bioquímica AgrícolaMaria Julia PinedaОценок пока нет
- Practica n03 1Документ6 страницPractica n03 1Kay MvpОценок пока нет
- PRIMER PARCIAL EYFCH COMISIÓN 5 - Revisión Del IntentoДокумент8 страницPRIMER PARCIAL EYFCH COMISIÓN 5 - Revisión Del IntentoHernández Celina A.Оценок пока нет
- Bioenergética celular y respiración aeróbicaДокумент35 страницBioenergética celular y respiración aeróbicaBoris 07Med-101Оценок пока нет
- FT DeportivaДокумент43 страницыFT DeportivaJoselyne Mares RodriguezОценок пока нет
- Respiración aerobia en reposo y ejercicioДокумент18 страницRespiración aerobia en reposo y ejercicioAby RosalesОценок пока нет
- Lectura 3 - Respiración CelularДокумент33 страницыLectura 3 - Respiración CelularBОценок пока нет
- Metabolismo Aeróbico Lab 5 2023-20Документ15 страницMetabolismo Aeróbico Lab 5 2023-20cotefarias.17Оценок пока нет
- S05.s1.Tarea Calificada 1Документ8 страницS05.s1.Tarea Calificada 1Karen ChumpitazОценок пока нет
- Offiwiz FileДокумент26 страницOffiwiz FileLeonardo MeloОценок пока нет
- Cuestionario 2Документ26 страницCuestionario 2jorgeОценок пока нет
- Clinica de 6to de SecundariaДокумент18 страницClinica de 6to de SecundariaArleth MorelОценок пока нет
- Tarea 4.2 Tabla Comparativa Procesos EnergéticosДокумент5 страницTarea 4.2 Tabla Comparativa Procesos EnergéticosChriisstiiaann AltiieryyОценок пока нет