Академический Документы
Профессиональный Документы
Культура Документы
Lei de Charles
Загружено:
alissonyfaroАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Lei de Charles
Загружено:
alissonyfaroАвторское право:
Доступные форматы
UNIVERSIDADE TIRADENTES
ENGENHARIA DE PETRLEO
ALISSON ANDRADE OLIVEIRA FARO
LUCAS OLIVEIRA CABRAL
THARCYSIO MENDES DO NASCIMENTO
LEI DE CHARLES
Aracaju
2014
ALISSON ANDRADE OLIVEIRA FARO
LUCAS OLIVEIRA CABRAL
THARCYSIO MENDES DO NASCIMENTO
LEI DE CHARLES
Relatrio apresentado ao curso de Engenharia de Petrleo,
sob orientao da prof. Glaucia Regina. Como um dos
pr-requisitos para obteno de aprovao de Qumica III
no 2 Semestre de 2014. Turma: E02.
Aracaju
2014
1.
INTRODUAO
Esta experincia foi realizada para demonstrar a veracidade da lei de Charles, trazendo o
seguinte enunciado: A presso constante, o volume de uma determinada massa de gs
diretamente proporcional a sua temperatura absoluta, ou seja, constante.
2.
OBJETIVOS
Determinar experimentalmente a relao entre o volume e a temperatura de uma amostra de ar
a presso constante, determinando s variaes do volume de um gs com a temperatura
variou a uma presso constante.
3.
REVISO BIBLIOGRAFICA
Segundo ATKINS P.W. A relao entre o volume do gs e a temperatura foi descoberta em
1787 pelo cientista francs Jacques Charles (1746-1823). Charles descobriu que uma
quantidade constante de gs mantida a presso constante tem um volume que aumenta
linearmente com o aumento da temperatura.
Em 1848, o fsico britnico William Thomson (1824-1907), lord kelvin, props uma escala
de temperatura absoluta, que hoje conhecida como a escala kelvin. Nesta escala, o 0k, que
zero absoluto, corresponde a -273,15C. Em termos da escala kelvin, a lei de Charles pode ser
enunciada da seguinte forma: O volume de uma quantidade constante de gs mantida a
presso constante diretamente proporcional temperatura absoluta do gs. Assim, se a
temperatura absoluta for duplicada, por exemplo, de 200 K para 400K, o volume do gs
tambm duplica. Em forma matemtica, a lei de Charles se exprime.
V= constante.T ou V/T= constante
O valor da constante depende da presso e da quantidade de gs.
Em 1787, o fsico francs Jacques Alexandre Csar Charles, estudou as variaes de volume
de amostras de alguns gases e de ar, causadas por variaes de temperatura. Mais tarde, em
1802, o fsico e qumico francs Louis Joseph Gay-Lussac, mostrou que outros gases tinham o
mesmo comportamento que os gases estudados por Charles, isto , se uma amostra de gs
aquecida, mantendo a presso constante, ela sofre um aumento de volume proporcional ao
aumento da temperatura. Gay-Lussac concluiu tambm que, partindo do mesmo valor de
volume inicial, o aumento de volume era igual para todos os gases, para igual aumento de
temperatura. Representando graficamente valores de volume de uma amostra em funo da
temperatura obtm-se um grfico traduzido por uma reta. Prolongando a reta obtida para a
esquerda, verifica-se que o volume da amostra gasosa se anula para um valor de temperatura
igual a -273 C. No entanto, os gases condensam antes de atingirem essa temperatura, pelo
que esse ponto terico, isto , s obtido por extrapolao matemtica. Charles e GayLussac fizeram o estudo de amostras de outros gases e obtiveram grficos semelhantes,
anulando-se o volume para o mesmo valor de temperatura. Como a existncia de volumes
inferiores a zero no tem significado fsico, este valor de temperatura representa a temperatura
mais baixa possvel e designada por zero absoluto. Tomando como referncia o zero
absoluto definiu-se uma nova escala de temperatura, a escala de temperatura absoluta ou
escala Kelvin, admitindo que um grau desta escala corresponde ao intervalo de um grau na
escala Celsius. Para obter um valor de temperatura na escala Kelvin, a partir de um valor de
temperatura medido na escala Celsius, basta somar 273,15 e possvel representar
graficamente o volume em funo da temperatura expressa na escala Kelvin obtm-se uma
representao que traduz o enunciado da lei de Charles e Gay-Lussac: mantendo constante a
presso, o volume de uma dada amostra de gs diretamente proporcional sua temperatura
absoluta. Esta lei traduzida pela seguinte equao matemtica: V = k T, onde k uma
constante.
4.
PARTE EXPERIMENTAL
4.1. MATERIAIS
Garra metlica;
Kitassato de 200 ml;
Mangueira de 5,0 cm
Rolha de borracha com orifcio central para tampar o Kitassato;
Suporte universal;
Termmetro de -50 a 150 C;
Seringa de 50 ml;
Chapa aquecedora.
4.2.
PROCEDIMENTOS
4.2.1. MONTAGEM DO EQUIPAMENTO
Primeiramente foi colocando a seringa o termmetro no orifcio central da rolha
posicionando-o verticalmente, na boca do Kitassato, posteriormente certificamos que a rolha
ficou bem encaixada e se as leituras de temperaturas podiam ser feitas. Em seguida retirado o
mbolo da seringa, removeu-se com auxilio de um pedao de papel higinico, o excesso de
gordura do mbolo e da seringa. Em seguida conectou a mangueira de 5,0 cm na sada/entrada
de ar lateral do Kitassato. Aps desse passo posicionou a seringa horizontalmente com o
auxilio das garras metlicas e do suporte universal. Em seguida inseriu o mbolo da seringa
ate que a leitura seja de zero ml, ou seja, com o mbolo na posio final. E por ultimo
conectou a seringa na mangueira, como observado na mangueira. Como observado na Figura
1.
Figura 1: Ilustrao do equipamento montado para o incio do experimento.
5. COLETANDO OS DADOS EXPERIMENTAIS
Comeou a anotar a temperatura a parti da variao do volume, mediu a temperatura do gs
no interior do Kitassato. Em seguida colocou cuidadosamente o sistema Kitassato, seringa,
suporte entre outros na chapa aquecedora e por ltimo ligar a chapa eltrica e a mantenha no
mnimo a temperatura aproximadamente 250C.
10
6. RESULTADO E DISCUSSES
Utilizando de fundamentos tericos, foi observado a mudana de temperatura, e seu
respectivo volume aumentando, com presso constante.
Antes de ligar a chapa de aquecimento, foi registrado o valor da temperatura ambiente de
26C para tabela 1, 29C para a Tabela 2, e por fim 32C para Tabela 3, aps isso, foi ligada a
chapa de aquecimento para 250c, e assim observado a presso constante empurrando
mbolo.
QUESTES
1) O resultado obtido na Tabela 1, no foi registrado com grande sucesso, apenas as trs
primeiras anotaes com exatido.
Tabela 1
T(c)
28
34
38
40
45
V(ml)
00
12
14
Na tabela 2, o dado foi registrado, pelo deslocamento volumtrico do mbolo e sua respectiva
temperatura.
Tabela 2
T(c)
29
34
39
40
43
V(ml)
10
Na Tabela 3, o dado foi registrado, pelo deslocamento volumtrico do mbolo e sua
respectiva temperatura.
Tabela 3
T(c)
32
37
39
43
45
V(ml)
10
Na Tabela 4, o dado foi registrado, pela mdia aritmtica obtido na Tabela 1, 2 e 3.
11
Tabela 4
T(c)
30
36
39
41
44
V(ml)
2,6
5,3
9,3
11,3
Grfico 3: Mdia Aritmtica variao do volume em funo da temperatura no
experimento 1,2 e 3
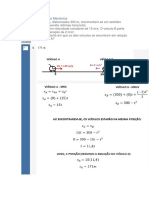
02) Em analise a Lei de Charles, foi visto atravs dos equipamentos que os valores crescem
linearmente, conforme uma constante.
03) Para encontrar o numero de mols basta aplicar a formula P.V= n.R.T onde P= Presso, V=
Volume, n= Nmero de mols, R= constante universal dos gases e T= Temperatura (em
kelvin). Utilizando a formula acima percebemos que no se pode concluir quantos mols de
gs havia no recipiente pela impreciso dos dados coletados, ao realizarmos as contas
percebemos uma variao muito grande entre os resultados.
12
04) A vedao entre a seringa e o kitassato o qual pode fazer com o que o gs escape, fazendo
assim a seringa se mover menos do que deveria;
A vedao entre o kitassato e o termmetro, que tambm faz com que o gs escape;
A seringa, pois esta no apresenta uma escala muito precisa.
13
7. CONCLUSO
Atravs da realizao das atividades experimentais, observou-se diante do experimento, foi
comprovado o feito realizado por Charles, atravs do grfico de regresso linear,
identificamos que a lei, pode-se resumir a uma funo de primeiro grau, e atravs dela
determinar a quantidade de matria num certo volume.
Ainda atravs dos experimentos realizados, viu-se que para um experimento mais detalhado e
preciso, podem utilizar de um processo para isolar apenas o O2 e realizar o experimento, com
certeza ter valores prximos aos esperados.
14
8. REFERNCIAS BIBLIOGRAFICAS
MANUAL DE AULAS DE LABORATRIO. In: MAGISTER. Disponvel em:
https://wwws.unit.br/Portal/Portal.jsp, consultado em 17 de setembro de 2014.
BROWN, Teodore L. Qumica: Cincia Central. In: LENAMAY, Jr; H. Engene; 2005
ATKINS,P.W. Fsico-Qumico. Rio de Janeiro: LCT Editora, 1999.
BURSTEN, Bruce E. Traduao: Horacio Macedo. Rio de Janeiro: LTC, 1999.
ANEXOS
Grfico 1: Variao do volume em funo da temperatura no experimento 1.
Grfico 2: Variao do volume em funo da temperatura no experimento 2.
15
Grfico 3: Variao do volume em funo da temperatura no experimento 3.
Вам также может понравиться
- 13 - Cacb-1-1Документ22 страницы13 - Cacb-1-1viniciusoliveira0% (1)
- Manual Técnico IForms 2021 PDFДокумент37 страницManual Técnico IForms 2021 PDFMarcusОценок пока нет
- Curso de ResinaДокумент7 страницCurso de ResinaPaulo Nogueira100% (1)
- Guia Madeira S Brasileira SДокумент21 страницаGuia Madeira S Brasileira SMarcelo van der Westen100% (1)
- Megabloc Manual ServicoДокумент11 страницMegabloc Manual ServicoLeonardo Silveira100% (1)
- MIT 161703-Procedimentos de Ensaios de Ferramentas e Equipamentos de Linha VivaДокумент118 страницMIT 161703-Procedimentos de Ensaios de Ferramentas e Equipamentos de Linha VivaRoniero BarrosoОценок пока нет
- Apol 1 - Fisica Mecanica UninterДокумент4 страницыApol 1 - Fisica Mecanica UninterCarlosMonteiro201850% (2)
- Relatorio - Ensaios - Solos 1Документ16 страницRelatorio - Ensaios - Solos 1Leandro RibeiroОценок пока нет
- Reboke 25000 Inox PDFДокумент189 страницReboke 25000 Inox PDFFabio Meinerz50% (2)
- Introdução TransformadoresДокумент44 страницыIntrodução TransformadoresWylliam Salviano Gongora100% (1)
- Av Estrutura de Dados 2014.1Документ4 страницыAv Estrutura de Dados 2014.1Wagner WittОценок пока нет
- Catalogo Acoplamentos Metalflex-5 PDFДокумент15 страницCatalogo Acoplamentos Metalflex-5 PDFdesetekОценок пока нет
- Manual xj6 (N) - 2012 - (1bw f8199 w2)Документ124 страницыManual xj6 (N) - 2012 - (1bw f8199 w2)Aline CaldeiraОценок пока нет
- Parruda Ma 2025mДокумент84 страницыParruda Ma 2025mLuan ViniciusОценок пока нет
- Carreta Agricola Graneleira: Modelo - 30.000 Grain em Aço CarbonoДокумент103 страницыCarreta Agricola Graneleira: Modelo - 30.000 Grain em Aço CarbonoJosé Ricardo Barros100% (1)
- Catalogo BrotherДокумент11 страницCatalogo BrothercarloscostacvОценок пока нет
- Analise de Subsidência Na Bacia Do NamibeДокумент8 страницAnalise de Subsidência Na Bacia Do NamibeNelson DireitoОценок пока нет
- Sistemas Auto IIДокумент11 страницSistemas Auto IIricardo FernandesОценок пока нет
- Aula 14 - EntalpiaДокумент11 страницAula 14 - EntalpiaCreeper Droid20Оценок пока нет
- Tratamento de Esgotos Domesticos Introducao A Qual PDFДокумент1 страницаTratamento de Esgotos Domesticos Introducao A Qual PDFAdriele FelintroОценок пока нет
- Tabela de Equivalências de Normas ISOSДокумент5 страницTabela de Equivalências de Normas ISOSedsonssОценок пока нет
- Final 3a Aula (Parte II) 2S 2019 (Potenciometria) 2S 2019 - AaraoДокумент136 страницFinal 3a Aula (Parte II) 2S 2019 (Potenciometria) 2S 2019 - AaraoWashington Oliveira SousaОценок пока нет
- IAC3108Документ107 страницIAC3108Júlio Gallinaro Maranho100% (2)
- Relatório Estagio CefetДокумент29 страницRelatório Estagio CefetAlexandre ManoelОценок пока нет
- Catalogo Barreto 2023 CompletoДокумент19 страницCatalogo Barreto 2023 CompletoGabriela SouzaОценок пока нет
- Ficha TécnicaДокумент2 страницыFicha Técnicaailson alvesОценок пока нет
- Lista I-IIДокумент6 страницLista I-IIIan Matheus Amaral SaraivaОценок пока нет
- 08 - Cabeçote DivisorДокумент22 страницы08 - Cabeçote DivisorrenanventuraОценок пока нет
- Rios Córregos Recuperação PDFДокумент42 страницыRios Córregos Recuperação PDFEduardo MacielОценок пока нет
- Tabela de FiltrosДокумент1 страницаTabela de FiltrosCasa CanteriОценок пока нет