Академический Документы
Профессиональный Документы
Культура Документы
Calorimetro de Joule
Загружено:
Antonio J. Q. PalaciosАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Calorimetro de Joule
Загружено:
Antonio J. Q. PalaciosАвторское право:
Доступные форматы
CALORIMETRO DE JOULE
1. OBJETIVOS
Determinar el equivalente mecnico del calor.
Se pretende poner de manifiesto la gran cantidad de energa que es necesario
transformar en calor para elevar apreciablemente la temperatura de un volumen
pequeo de agua.
2. MATERIALES
Pesas.
Termmetro.
1 reglilla.
1 paleta.
1 recipiente aislado.
3. DESCRIPCION
Un recipiente aislado trmicamente contiene una cierta cantidad de agua, con un
termmetro para medir su temperatura, un eje con unas paletas que se ponen en
movimiento por la accin de una pesa, tal como se muestra en la figura.
La versin original del experimento, consta de dos pesas iguales que cuelgan
simtricamente del eje.
La pesa, que se mueve con velocidad prcticamente constante, pierde energa potencial.
Como consecuencia, el agua agitada por las paletas se clienta debido a la friccin.
Si el bloque de masa M desciende una altura h, la energa potencial disminuye en Mgh, y
sta es la energa que se utiliza para calentar el agua (se desprecian otras prdidas).
Joule encontr que la disminucin de energa potencial es proporcional al incremento de
temperatura del agua. La constante de proporcionalidad (el calor especfico de agua) es
igual a 4.186 J/(g C). Por tanto, 4.186 J de energa mecnica aumentan la temperatura de
1g de agua en 1 C. Se define la calora como 4.186 J sin referencia a la sustancia que se
est calentando.
1 cal=4.186 J
En la simulacin de la experiencia de Joule, se desprecia el equivalente en agua del
calormetro, del termmetro, del eje y de las paletas, la prdida de energa por las paredes
aislantes del recipiente del calormetro y otras prdidas debidas al rozamiento en las
poleas, etc.
Sea M la masa del bloque que cuelga y h su desplazamiento vertical
m la masa de agua del calormetro
T0 la temperatura inicial del aguay T la temperatura final
g=9.8 m/s2 la aceleracin de la gravedad
La conversin de energa mecnica ntegramente en calor se expresa mediante la
siguiente ecuacin.
Mgh=mc(T-T0)
Se despeja el calor especfico del agua que estar expresado en J/(kg K).
Como el calor especifico del agua es por definicin c=1 cal/(g C), obtenemos la
equivalencia entre las unidades de calor y de trabajo o energa.
Ejemplo:
Se introduce
Masa del bloque M=50 kg
Masa del agua en g (o volumen del agua en ml), m=100 g=0.10 kg
Se apunta
Altura h=1 m
Temperatura inicial T0=20C, y la temperatura final T=21.2C
Tenemos que aumentar la diferencia de temperaturas para obtener un mejor resultado.
En la experiencia real se consigue haciendo caer varias veces el bloque. El trabajo total
es nMgh, siendo n el nmero de veces que se suelta el bloque. En la experiencia simulada
conseguimos el mismo efecto aumentando la masa M del bloque
Вам также может понравиться
- Problema 2Документ9 страницProblema 2Alejandra WalterosОценок пока нет
- (Álvarez & Cols.) - Exámenes Resueltos de Química Básica - 1° Edición PDFДокумент266 страниц(Álvarez & Cols.) - Exámenes Resueltos de Química Básica - 1° Edición PDFAlberto Acosta100% (1)
- Clase 01 - Leyes de CorteДокумент17 страницClase 01 - Leyes de CorteÁlvaro Henríquez IbáñezОценок пока нет
- WickhamChris ElLegadoDeRomaUnaHistoriaDeEuropaDe400 1000Документ784 страницыWickhamChris ElLegadoDeRomaUnaHistoriaDeEuropaDe400 1000Volando Voy Volando VengoОценок пока нет
- En El Experimento de Joule Se Determina El Equivalente Mecánico Del CalorДокумент4 страницыEn El Experimento de Joule Se Determina El Equivalente Mecánico Del CalorLuis Altamirano RafaelОценок пока нет
- Experimento de JouleДокумент4 страницыExperimento de JouleMancilla MathiusОценок пока нет
- JouleДокумент3 страницыJoulepablo vargasОценок пока нет
- Experimento JouleДокумент3 страницыExperimento JouleZurisadai OrtegaОценок пока нет
- Experimento de JouleДокумент3 страницыExperimento de JouleEnidlarey FlowersОценок пока нет
- EL Calorímetro de JouleДокумент2 страницыEL Calorímetro de JouleJUAN DIEGO VASQUEZ HERRERAОценок пока нет
- En El Experimento de Joule Se Determina El Equivalente Mecánico Del CalorДокумент7 страницEn El Experimento de Joule Se Determina El Equivalente Mecánico Del CalorShawn McleanОценок пока нет
- Experimento de Joule. Equivalente Mecánico Del CalorДокумент3 страницыExperimento de Joule. Equivalente Mecánico Del CalorMiguel DiazОценок пока нет
- Experimento JouleДокумент3 страницыExperimento JouleCarlos VasquezОценок пока нет
- Experiencia de JouleДокумент2 страницыExperiencia de JouleJose Vilca NinaОценок пока нет
- Informe N 2 Prueba de JarrasДокумент5 страницInforme N 2 Prueba de JarrasHayeDuranОценок пока нет
- Lab 1equivalente Mec Del CalorДокумент4 страницыLab 1equivalente Mec Del CalorDavid Paez GonzalezОценок пока нет
- Laboratorio de Fisica Experimento de JouДокумент9 страницLaboratorio de Fisica Experimento de JoualfredoОценок пока нет
- Equivalente Mecánico Del CalorДокумент9 страницEquivalente Mecánico Del CalorMoller Calderon Sergio HОценок пока нет
- Laboratorio de Fisica Experimento de JouДокумент8 страницLaboratorio de Fisica Experimento de Joualfredo100% (1)
- Calor y Cambios de Fase Del AguaДокумент9 страницCalor y Cambios de Fase Del AguaAna Luisa Tacanga RodriguezОценок пока нет
- Equivalente eléctrico del calorДокумент6 страницEquivalente eléctrico del calorJesusОценок пока нет
- Experimento de JouleДокумент10 страницExperimento de JouleAliCiaОценок пока нет
- Como El Calor Es Una Forma de EnergíaДокумент5 страницComo El Calor Es Una Forma de EnergíaMari DoradoОценок пока нет
- Calor - Transiciones de FaseДокумент18 страницCalor - Transiciones de Faseagustin panichelliОценок пока нет
- Experimento de Joule: Equivalente Mec Anico Del CalorДокумент4 страницыExperimento de Joule: Equivalente Mec Anico Del CalorJulián MejíaОценок пока нет
- Previo 7. Práctica Equivalencia Calor-TrabajoДокумент4 страницыPrevio 7. Práctica Equivalencia Calor-TrabajoClarisse Hernández100% (1)
- Texto 2Документ15 страницTexto 2Diego Masias0% (1)
- Calor latente de fusión y cambios de estadoДокумент15 страницCalor latente de fusión y cambios de estadoSandy100% (1)
- Equivalente Mecanico Del CalorДокумент9 страницEquivalente Mecanico Del CalorLen AbernathyОценок пока нет
- Informe 1. Fisica 2Документ6 страницInforme 1. Fisica 2Liceth Páez100% (1)
- Experimento de Joule PDFДокумент1 страницаExperimento de Joule PDFJulio VásquezОценок пока нет
- Calor Latente de Fusión y de Vaporización Del AguaДокумент8 страницCalor Latente de Fusión y de Vaporización Del AguaDwane Arch Jr.Оценок пока нет
- Cantidad de CalorДокумент14 страницCantidad de CalorCarlItzz Pardo MisariОценок пока нет
- Equivalente Electrico de CalorДокумент30 страницEquivalente Electrico de CalorIVAN DANIEL CANCHALAОценок пока нет
- Guía N°7Документ5 страницGuía N°7Jose Manuel Erazo VidalОценок пока нет
- Calor transferencia cocinar alimentosДокумент35 страницCalor transferencia cocinar alimentosJosue AltamiranoОценок пока нет
- Calor específicos metalesexperimental para cada metal se encuentra entre el1,4% y 12,8%, lo cual indica que los resultadosexperimentales concuerdan razonablemente biencon los valores teóricosДокумент4 страницыCalor específicos metalesexperimental para cada metal se encuentra entre el1,4% y 12,8%, lo cual indica que los resultadosexperimentales concuerdan razonablemente biencon los valores teóricosJulianAndresVarelaОценок пока нет
- Experimento de JouleДокумент3 страницыExperimento de JouleMARISOL CARLOS MARQUEZОценок пока нет
- TP #6 CalorimetríaДокумент7 страницTP #6 CalorimetríaUrs SantellanОценок пока нет
- Preguntas Resueltas FisicaДокумент4 страницыPreguntas Resueltas FisicaLincoln GarciaОценок пока нет
- Calor y La Primera Ley de La Termodinámica FMДокумент44 страницыCalor y La Primera Ley de La Termodinámica FMAmIn20122Оценок пока нет
- Equivalente Mecanico Del Calor VirtuallIIДокумент10 страницEquivalente Mecanico Del Calor VirtuallIIOMAR ISIDRO RIVERA CANOОценок пока нет
- CalorEspecificoMetalДокумент11 страницCalorEspecificoMetalViviana Karen Lima IrigoyenОценок пока нет
- tarea durante 3 angel moza ondas y calorДокумент4 страницыtarea durante 3 angel moza ondas y calorDenis Brian Moza CabanillasОценок пока нет
- Cap13 Primera Ley CursoДокумент50 страницCap13 Primera Ley Cursogustavo_castro_17Оценок пока нет
- Termodinámica 3Документ10 страницTermodinámica 3Ceci TorralbaОценок пока нет
- Lab - Virt - F2 - Equivalente CalorДокумент5 страницLab - Virt - F2 - Equivalente CalorLeo CastilloОценок пока нет
- Tema 2 CPPTДокумент32 страницыTema 2 CPPTAlfredo Enrique Costa OkoОценок пока нет
- Lab #3-Procesos Exotérmicos y EndotérmicosДокумент6 страницLab #3-Procesos Exotérmicos y Endotérmicosmdraa21Оценок пока нет
- CalorimetriaДокумент10 страницCalorimetriaGuido Ticona100% (1)
- Informe de CalorimetriaДокумент11 страницInforme de CalorimetriaYorka Yeivin Arce Gutierrez50% (2)
- Practica 2Документ5 страницPractica 2ANTONIO PACHECOОценок пока нет
- CalorДокумент22 страницыCalorEdward TaceОценок пока нет
- Equivalente Mecanico Del Calor virtuallIIДокумент9 страницEquivalente Mecanico Del Calor virtuallIIKatakuri CaceresОценок пока нет
- Practica 14 Fisica 2Документ5 страницPractica 14 Fisica 2Jesus Noe Molina YocupicioОценок пока нет
- CalorimetriaДокумент33 страницыCalorimetriaKatherine SalasОценок пока нет
- CALORIMETRIAДокумент14 страницCALORIMETRIAIsmael Trejo NuñezОценок пока нет
- Calorimetría, calor específico y calor latente de vaporizaciónДокумент7 страницCalorimetría, calor específico y calor latente de vaporizaciónLeandro LopezОценок пока нет
- Inf N°3 - PQ223 - Carbajal FloresДокумент21 страницаInf N°3 - PQ223 - Carbajal FloresJhandy Carlos Octavio Martinez CondorОценок пока нет
- Termodinámica y el equivalente mecánico del calorДокумент8 страницTermodinámica y el equivalente mecánico del calorJHONNATAN PLACIDO ALDAS MOREJONОценок пока нет
- Informe # 2 CalorimetroДокумент6 страницInforme # 2 CalorimetroLEE JOEL RIVERA GUZMANОценок пока нет
- Turbina de VaporДокумент9 страницTurbina de VaporAntonio J. Q. PalaciosОценок пока нет
- Regla Men To Dead Misi On 2014Документ13 страницRegla Men To Dead Misi On 2014Antony GonzalesОценок пока нет
- ACEZARДокумент1 страницаACEZARAntonio J. Q. PalaciosОценок пока нет
- Movimiento CircularДокумент3 страницыMovimiento CircularAntonio J. Q. PalaciosОценок пока нет
- Movimiento CircularДокумент3 страницыMovimiento CircularAntonio J. Q. PalaciosОценок пока нет
- Primer Principio de La TermodinamicaДокумент6 страницPrimer Principio de La TermodinamicaAntonio J. Q. PalaciosОценок пока нет
- Materiales Ceramicos Vidrios y Polimeros PDFДокумент50 страницMateriales Ceramicos Vidrios y Polimeros PDFRony CrisОценок пока нет
- Circuitos CombinacionalesДокумент33 страницыCircuitos Combinacionalesgerln2Оценок пока нет
- D.S #022-2001-Sa-Dm Reglamento Sanitario Actividades de Saneamiento AmbientalДокумент11 страницD.S #022-2001-Sa-Dm Reglamento Sanitario Actividades de Saneamiento AmbientalricardomrbОценок пока нет
- Primavera .Документ1 страницаPrimavera .Antonio J. Q. PalaciosОценок пока нет
- Primavera .Документ1 страницаPrimavera .Antonio J. Q. PalaciosОценок пока нет
- PrimaveraДокумент1 страницаPrimaveraAntonio J. Q. PalaciosОценок пока нет
- Primer Principio de La TermodinamicaДокумент6 страницPrimer Principio de La TermodinamicaAntonio J. Q. PalaciosОценок пока нет
- Política macroeconómica internacional: efectos de precios de materias primas y equilibrio de balanza de pagosДокумент2 страницыPolítica macroeconómica internacional: efectos de precios de materias primas y equilibrio de balanza de pagosJOSSUE LIZARDO AYALA MONTANCHEZОценок пока нет
- Densidad de Solidos PDFДокумент4 страницыDensidad de Solidos PDFLêonärdoMolänoОценок пока нет
- Grilla ConstructivaДокумент6 страницGrilla ConstructivaJulietaDiazОценок пока нет
- Taller - Aplicación - Del - Sistema - Métrico - Decimal PDFДокумент4 страницыTaller - Aplicación - Del - Sistema - Métrico - Decimal PDFDiego VanegasОценок пока нет
- 1.problema1 Velocidad MediaДокумент15 страниц1.problema1 Velocidad Mediasilvia moreyraОценок пока нет
- Problemas Ontológicos, Epistemológicos y Metodológicos de La Fenomenología HermeneuticaДокумент47 страницProblemas Ontológicos, Epistemológicos y Metodológicos de La Fenomenología HermeneuticaEnrique MoralesОценок пока нет
- Elementos Geometricos de Una Curva EspiralДокумент3 страницыElementos Geometricos de Una Curva EspiralWladiland100% (1)
- Formulario de QuímicaДокумент2 страницыFormulario de QuímicaSalgado Charcas Willy BrianОценок пока нет
- Proyecto de Capacitacion A La Poblacion Agricola y Sociedad Civil Acerca Del Daño Que Genera La Quema de Maleza en Cultivos de ArrosДокумент44 страницыProyecto de Capacitacion A La Poblacion Agricola y Sociedad Civil Acerca Del Daño Que Genera La Quema de Maleza en Cultivos de ArrosLaura FuentesОценок пока нет
- Malla Curricular Ciencias 2013 Biologia Quimica y FisicaДокумент13 страницMalla Curricular Ciencias 2013 Biologia Quimica y Fisicadarkan22Оценок пока нет
- Recolectores de ChatarraДокумент7 страницRecolectores de ChatarraIngLuis Daniel CamamaОценок пока нет
- Aserrado MecánicoДокумент8 страницAserrado Mecánicolucas lopez 18Оценок пока нет
- Desarrollo de TAREA PROBABILIDADESДокумент16 страницDesarrollo de TAREA PROBABILIDADESCarlos Daniel Siesquen YpanaqueОценок пока нет
- Ebola Virus OubinaДокумент5 страницEbola Virus Oubinagerome gregoryОценок пока нет
- Ci31 Ma466 L4 Mares-Diaz-Fernandez-BeltranДокумент12 страницCi31 Ma466 L4 Mares-Diaz-Fernandez-BeltranKatherine Fernandez SamaniegoОценок пока нет
- Un Discurso Sobre Las Ciencias Ensayo (Autoguardado)Документ12 страницUn Discurso Sobre Las Ciencias Ensayo (Autoguardado)alejandro hernandezОценок пока нет
- Linea de Tiempo Movimiento ModernoДокумент2 страницыLinea de Tiempo Movimiento Modernogenesis deluquezОценок пока нет
- Termo PlusДокумент9 страницTermo PlusZeus RamirezОценок пока нет
- Voces Chilenas de Los Reinos Enimal y Vegetal Que Pudieran Incluirse en El Diccionario de La Lengua Castellana........ (1917)Документ158 страницVoces Chilenas de Los Reinos Enimal y Vegetal Que Pudieran Incluirse en El Diccionario de La Lengua Castellana........ (1917)BibliomaniachilenaОценок пока нет
- COMBUSTIBLES Tipos Presentacion DRДокумент5 страницCOMBUSTIBLES Tipos Presentacion DRDaniel ROMERO MEDINAОценок пока нет
- Razones y ProporcionesДокумент9 страницRazones y ProporcionesChris Yunior RDОценок пока нет
- Los Tipos de EmprendimientoДокумент7 страницLos Tipos de EmprendimientoLu Jeny OLIVEROS TRIANAОценок пока нет
- Analisis Por TamizadoДокумент48 страницAnalisis Por TamizadoEdgar Jose Paez VicuñaОценок пока нет
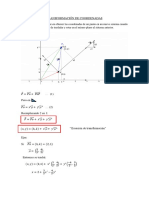
- Transformación de CoordenadasДокумент3 страницыTransformación de CoordenadasJimy el rosqueteОценок пока нет
- Cáncer de Páncreas y CarcinomaДокумент29 страницCáncer de Páncreas y CarcinomaJuan ArgentОценок пока нет
- Ejemplo Formato Informe Medio de Verificacion FotografiasДокумент6 страницEjemplo Formato Informe Medio de Verificacion FotografiasAdonis AndradeОценок пока нет
- Basf Masterair 920 TdsДокумент4 страницыBasf Masterair 920 TdsBracilides Mamani ArizaОценок пока нет