Академический Документы
Профессиональный Документы
Культура Документы
Manual Qu+¡mica
Загружено:
Ronald ChenАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Manual Qu+¡mica
Загружено:
Ronald ChenАвторское право:
Доступные форматы
Divisin de Ingeniera
Departamento de Fsica y Qumica
POLTICAS DEL CURSO
Libro de Texto:
Chemistry
Raymond Chang
Sixth Edition
Exmenes:
3 Parciales y un Final
Exmenes Parciales:
Constarn de 6 problemas.
Duracin de 50min.
Solo se permitir el uso de formulario, que se encuentra en el manual, adems
debes llevar; lpiz, goma, pluma, calculadora.
Exmenes Finales
El examen final tendr una duracin de 120min.
Se calificar procedimiento en parciales y finales.
Solo se permitir el uso de formulario, que se encuentra en el manual, adems
debes llevar; lpiz, goma, pluma, calculadora.
Para poder presentar exmenes se deber estar libre de adeudos.
Para tener derecho a examen final es necesario tener el 88% de asistencia.
Calificaciones:
Parciales
Calificacin de examen parcial
Autoevaluacin y coevaluacin
Cuestionarios
Puntos extra
90%
5%
5%
Finales
Tres parciales
Examen Final
Tareas
Trabajo Final
Exmenes semanales
otras actividades
Q-811
40%
30%
5% 9%
6% 10%
5%
10%
Divisin de Ingeniera
Departamento de Fsica y Qumica
Tareas:
Se entregarn en la fecha indicada por tu profesor.
No se aceptarn posteriormente.
Debern ser entregadas a mquina o computadora (de lo contrario no se
aceptarn), los procedimientos pueden ser a mano.
Trabajos:
Parciales
Se realizaran varias actividades las cuales sern entregadas un da antes del examen
Practica de casa
Practica Virtual
Visita a museo o empresa.
Conferencias.
Finales
La informacin del trabajo final se encuentra en la plataforma LN-LS y se realizar en
equipo mximo de tres personas.
Se debe entregar un anteproyecto en la fecha indicada.
La entrega de tareas y trabajos debe contener la siguiente
informacin:
Instituto Tecnolgico y de Estudios Superiores de Monterrey
Campus Ciudad de Mxico
Divisin de Ingeniera
Qumica, Q*811
Nombre del trabajo o nmero de tarea
Grupo
Nombres y Matrculas de los integrantes
Fecha
Despus de esta informacin el contenido del trabajo o el enunciado del
problema con su solucin.
Los trabajos deben contener al menos los siguientes puntos:
I. Introduccin.
II. Antecedentes.
III. Desarrollo de trabajo.
IV. Bibliografa.
Q-811
Divisin de Ingeniera
Q-811
Departamento de Fsica y Qumica
Divisin de Ingeniera
Q-811
Departamento de Fsica y Qumica
Divisin de Ingeniera
Departamento de Fsica y Qumica
tomo y periodicidad qumica
Objetivos especficos:
Identificar las principales partculas atmicas.
Diferenciar el significado de los nmeros cunticos.
Aplicar los conceptos de la mecnica cuntica en las estructuras
electrnicas.
Describir los conceptos de incertidumbre, de exclusin y de mxima
multiplicidad.
Explicar el concepto de periodicidad qumica.
Evaluar potencial de ionizacin, electroafinidad y electronegatividad
por su posicin en la tabla peridica
Clasificar los elementos por sus propiedades, su posicin en la tabla
peridica y su estructura.
Materia: Todo lo que ocupa un lugar en el espacio y tiene masa.
Masa: Cantidad de materia contenida en un cuerpo o medida de la
materia.
tomo: Unidad bsica de un elemento que puede entrar en combinacin
qumica. Partcula formada por: electrones (e-) con carga negativa,
protones (p+) con carga positiva y neutrones (n) sin carga. Un tomo
neutro tiene el mismo nmero de electrones y protones.
Nmero atmico: El nmero de protones (p+) que caracteriza al tomo
- Ejemplo:
Hidrgeno (H): 1p+, 1e-: nmero atmico 1.
Istopos: tomos de mismo nmero atmico y diferente masa atmica.
-
Ejemplo:
Deuterio: 1p+, 1e- y 1n
Tritio: 1p+, 1e- y 2n
El deuterio y el tritio son istopos del Hidrgeno.
Para explicar cmo estn distribuidas estas partculas en el tomo,
surgieron varias teoras, como la de Dalton, Thomson, Rutherford, Bohr,
mecnica cuntica, etc.
La mecnica cuntica es la teora que describe el comportamiento
de las partculas muy pequeas y explica la estabilidad atmica a travs
de los nmeros cunticos.
Q-811
Divisin de Ingeniera
Departamento de Fsica y Qumica
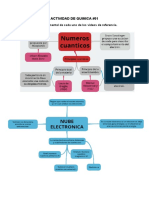
Nmeros cunticos: surgen de la solucin de una ecuacin y
ayudan a construir el tomo de acuerdo a esta teora y son los
siguientes:
n o principal: valores: 1,2,3,4, etc., da los niveles de energa o
distancia del electrn al ncleo
o azimutal: valores: 0, 1, 2,3 hasta n-1, da forma de la regin del
espacio donde se pueden encontrar los electrones y se le conoce
como orbital.
=0: orbital esfrico o tambin conocidos como orbitales s.
=1: orbital lobular o tambin conocido como orbitales p.
=2: orbital de distintas formas y son los orbitales d.
= 3: orbitales f.
ml o magntico: sus valores son -, 0,+ : orientacin o direccin
de la regin y de acuerdo con esto es el nmero de veces que
tenemos cada orbital.
ml =0: un valor, 1 orientacin por lo tanto un orbital s
ml =-1,0,1:3 valores, 3 orientaciones por lo tanto 3 orbitales p
ml =-2,-1,0,1,2: 5 valores, 5 orientaciones por lo tanto 5
orbitales d
ml = -3,-2,-1,0,1,2,3,: orbitales f
ms o spin (giro): valores: y -, indica que los electrones pueden
girar solo en dos direcciones a favor o en contra de las manecillas del
reloj.
- Ejemplo:
Para n=2; = 0 y 1; ml =0 y ml = -1,0,1, esto quiere decir que para el
nivel de energa 2 existen dos tipos de orbitales, los s y los p y que el
orbital s permite una sola orientacin, mientras que los orbitales p
admiten tres orientaciones, cada orbital solo puede acomodar como
mximo dos electrones, uno con un valor de +1/2 y otro con -1/2 y
que por lo tanto los orbitales s solo pueden tener dos electrones,
mientras que los orbitales p pueden tener como mximo seis electrones.
Ejercicio:
Para n=4 determine los valores de y ml, y haga el mismo anlisis
anterior.
Adems de los nmeros cunticos, fue necesario considerar otras
teoras para la construccin del tomo estas son el principio de
Q-811
Divisin de Ingeniera
Departamento de Fsica y Qumica
Incertidumbre de Heisenberg, el principio de exclusin de Pauli y el
principio de construccin.
Principio de Incertidumbre de Heisenberg: Es imposible saber la
posicin y la cantidad de movimiento (mv) de un electrn en el
tomo.
Principio de exclusin de Pauli: En un tomo, 2 electrones no
pueden tener los cuatro nmeros cunticos iguales.
Principio de construccin (Aufbau), los electrones entran primero
en los niveles de menor energa.
Con estos nmeros y postulados se pueden construir los diferentes
tomos, sabiendo que: los tomos son elctricamente neutros y que por
lo tanto existe el mismo nmero de protones y electrones, que el
nmero de neutrones puede variar de un tomo a otro generando los
istopos de un tomo, que los protones y los neutrones se encuentran
en el ncleo y los electrones se encuentran alrededor del ncleo en los
diferentes orbitales.
Por ejemplo para construir el tomo que tiene 11 electrones, 11
protones y 11 neutrones, iniciamos por ver en que orbitales estn
ubicados estos electrones:
- Para el primer nivel de energa: n = 1; =0; ml = 0; s = y -;
esto quiere decir que en el primer nivel de energa hay un orbital s que
tiene una orientacin con 2 electrones. Y que se representara como 1s2.
- Para el segundo nivel de energa: n = 2; =0 y 1; ml = 0 y ml=1,0,1 y finalmente s= y - para cada uno de los valores de ml; por
lo que en el segundo nivel de energa tenemos 8 electrones ya que hay
un orbital s por el valor de ml igual a 0 y que tiene dos electrones y
adems tres orbitales p cada uno con dos electrones en total 6
electrones en los orbitales p y cada orbital orientado en cada uno de los
ejes x, y, z.
- Para el tercer nivel de energa tenemos: n = 3; =0, 1 y 2; ml=
0, ml = -1,0,1 y ml = -2,-1, 0,1,2 y s= y - para cada uno de los
valores de ml, pero como hasta el momento se han acomodado 10
electrones y solo falta uno, este se coloca en el tercer nivel de energa,
en el orbital 3s que es el de menor energa que los otros orbitales. Con
estos datos el tomo quedara representado de la siguiente manera:
Q-811
Divisin de Ingeniera
Departamento de Fsica y Qumica
Como podemos observar la representacin de los tomos no es
muy conveniente, por ejemplo si quisiramos representar al tomo con
78electrones, 78 protones y 78 neutrones siguiendo el esquema
anterior, sera muy complejo, por lo que surge la configuracin
electrnica que es una representacin simplificada del ordenamiento de
los electrones en el tomo. Para determinar que niveles son los que
tienen menor energa, y por lo tanto, que ocupan primero los electrones,
se sigue el siguiente esquema que se conoce como regla de las
diagonales.
1s2
2s2
3s2
4s2
5s2
6s2
7s2
8s2
2p6
3p6
4p6
5p6
6p6
7p6
3d10
4d10 4f14
5d10 5f14
6d10
- Ejemplo:
Na11: 1s2 2s2 2p6 3s1
Pt78: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d8.
Ejercicio: Escribe las configuraciones electrnicas de Al, F, K, Li, Be, B,
C, N, O, Cl, Ca, Br, Na, P, En, Ar, Kr, S, e identifica el ltimo nivel de
energa y el nmero de electrones en el ltimo nivel de energa.
Del ejercicio dos se pueden sacar conclusiones muy importantes,
la primera es que algunos tomos tienen el mismo nivel de energa final,
otros terminan con el mismo nmero de electrones en su ltimo nivel de
energa, otros tienen 8 electrones en su ltimo nivel de energa, otros
tienen electrones un electrn en un orbital, otros tienen los dos
electrones en sus orbitales.
Q-811
Divisin de Ingeniera
Departamento de Fsica y Qumica
Las conclusiones anteriores permiten obtener conceptos muy
importantes, como son la regla del octeto, el paramagnetismo y el
diamagnetismo y el de la Tabla Peridica.
Ya que los tomos que tienen 8 electrones en su ltimo nivel de
energa son muy estables, se conocen como gases inertes, todos los
tomos representativos van a tender a tener 8 electrones en su ltimo
nivel de energa para adquirir estabilidad y obtener la configuracin de
los gases inertes, esto se conoce como regla del octeto.
He2 - 1s2
Ne10 - 1s2 2s2 2p6
Tienen 8 e- en su ltimo nivel de energa.
Ar18 - 1s2 2s2 2p6 3s2 3p6
Kr36: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
Xe54: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6
Para determinar si un tomo tiene un solo electrn en un orbital se
utiliza la regla de Hund, que dice: los electrones entran en los orbitales
de la misma energa (ejemplo, px, py, pz), con un mismo spin hasta
ocupar todos los orbitales, entonces entran con spin contrario, para
llenar los orbitales con dos electrones.
Elementos paramagnticos: tienen electrones desapareados y
son atrados por un campo magntico.
Elementos diamagnticos: tienen todos sus
apareados y no son atrados por un campo magntico.
electrones
- Ejemplo:
P15
1s2 2s2
__ __
2p6
__ __
__
3s2
__
3p3
__ __ __
tomo o elemento paramagntico
Ejercicio:
Escriba la configuracin electrnica del oxgeno (O) con la forma
anterior.
De acuerdo con las similitudes en las configuraciones electrnicas,
surge un arreglo muy importante de los tomos, al que se le conoce
como tabla peridica de los elementos, en la que los tomos se colocan
en horizontales y verticales, y que son los periodos y las familias
Q-811
Divisin de Ingeniera
Departamento de Fsica y Qumica
respectivamente, considerando tambin el nmero atmico en forma
ascendente.
Tabla Peridica: Arreglo de los diferentes tipos de tomos de
acuerdo a sus configuraciones electrnicas
Familias: tomos con el mismo nmero de electrones en el ltimo
nivel de energa. Tienen propiedades similares, los electrones en el
ltimo nivel de energa determinan la familia a la que pertenecen.
Perodos: Tienen el mismo nivel de energa final.
Los elementos en la tabla peridica se pueden clasificar tambin
como metales, no metales o metaloides, como elementos A, Elementos
B, lantnidos, actnidos y adems algunas familias reciben nombres
particulares, como: metales alcalinos, metales alcalinotrreos,
halgenos, etc.
Los metales son los que donan los electrones para formar un enlace y
los no metales son los que aceptan electrones para formar un enlace,
adems de muchas otras propiedades fsicas y qumicas que los
distinguen. Los metaloides tienen caractersticas de ambos.
Elementos A: elementos representativos, terminan en niveles s y p
Elementos B: Elementos de transicin, terminan en niveles s, p, d y f.
Elemento: Unin de tomos iguales.
Del arreglo de los elementos en la tabla peridica, surgen las propiedades peridicas,
que varan de una manera regular en las familias y en los periodos.
Propiedades peridicas: Son las Propiedades que presentan los
tomos por su posicin en la tabla peridica, y que varan de manera
regular, estas propiedades son:
Radio atmico: Est relacionado con el tamao del tomo, y se
define como la mitad de la distancia entre dos ncleos de dos
tomos metlicos adyacentes iguales. Aumenta de derecha a
izquierda en un periodo (por qu?!) y de arriba hacia abajo en
una familia.
Afinidad electrnica: Es el cambio de energa que ocurre al
darle un electrn a un tomo en estado gaseoso y formar un Ion *
con carga negativa (anin): X(g) + 1e- X-, en la tabla peridica, la
variacin es de izquierda a derecha y de abajo hacia arriba, ms
negativa.
Ion: partcula con carga.
Q-811
10
Divisin de Ingeniera
Departamento de Fsica y Qumica
Energa de ionizacin: Energa necesaria para quitarle un
electrn a un tomo en estado gaseosos y generar un in con
carga positiva (catin), este proceso siempre es endotrmico y en
la tabla peridica aumenta de abajo hacia arriba y de izquierda a
derecha
Li + energa Li+ + 1e Electronegatividad: Tendencia relativa de los tomos para atraer
los electrones de otros tomos hacia si cuando se combinan con
otros
tomos.
Pauling
asign
valores
arbitrarios
de
electronegatividad a los tomos. Al ms pequeo y con mayor
carga en el ncleo le asign el valor ms alto de
electronegatividad, por considerar que atrae los electrones con
mayor fuerza cuando se combina con otros tomos siendo ste el
Flor F: con un valor de 4. Al que atrae menos los electrones
cuando se combina que es el Francio Fr, le asign un valor de 0.7,
siendo este tomo el menos electronegativo. Esta propiedad es de
mucha importancia para determinar el tipo de enlace que se dar
entre los tomos cuando se unan.
La energa de ionizacin y la afinidad electrnica, ambas son energas,
y cuando se llevan a cabo estos procesos se puede liberar o absorber
energa, por lo que para diferenciarlos se asigna por convencin un signo
positivo cuando se absorbe la energa y un sigo negativo cuando se
libera la energa. A estos procesos se les conoce como exotrmico y
endotrmico.
Cuando se absorbe energa E(+): Proceso endotrmico
Cuando se libera energa E(-): Proceso exotrmico
Algunos conceptos tiles convenientes de recordar son:
Molcula: Es la cantidad mnima de materia que se puede encontrar y
que conserva sus caractersticas fsicas y qumicas. Se clasifican en
funcin de nmero de tomos que las forman como: mono, di, tri, tetra,
penta, etc., atmicas. Pueden estar formadas por tomos iguales o
diferentes. Algunos ejemplos son:
H2, O2, N2, F2, Cl2, Br2, I2, CO, HFMolculas Diatmicas, formadas
por dos tomos.
Li, Mg, Ca Monoatmicas, formadas por un tomo.
O3, CO2, H2Otriatmicas.
S8 Octatmicas.
P4 Tetratmicas.
Masa atmica: es la masa de un tomo en unidades de masa atmica.
Q-811
11
Divisin de Ingeniera
Departamento de Fsica y Qumica
Ya que la unidad de masa, para medir la masa de los tomos
es muy pequea (unidad de masa atmica 1uma=1.661 x 10-24g y
1g=6.022 x 1023 uma), se toma una gran cantidad de tomos para
poder manejarlos fsicamente, a este nmero se le conoce como mol.
Un mol: es un nmero que equivale a 6.023 x 1023 partculas de las que
se est hablando y que en este caso pueden ser tomos, molculas,
iones etc.
Elemento: sustancia que por mtodos qumicos no se puede
descomponer en otra ms sencilla, est formada por tomos iguales.
El tomo de un elemento puede ser una molcula (monoatmica).
El tomo es la mnima cantidad de materia contenida en un
elemento.
La cantidad mnima de materia que conserva las propiedades
fsicas y qumicas de una sustancia pura se llama molcula.
Molcula es tambin la unin de tomos iguales o diferentes.
Masa molecular: es la suma de las masas atmicas en unidades de
masa atmica de los tomos que constituyen la molcula.
Masa molar: La masa de un mol de tomos, molculas u otras
partculas.
Una uma se defini como un doceavo (1/12) de la masa de un tomo
de carbono12
Un mol es tambin la cantidad de tomos en 12 gramos de carbono
12 y es el nmero de Avogadro.
La masa molar de un elemento en gramos es numricamente igual a su
masa atmica expresada en uma.
En la Tabla peridica se encuentran los valores de masa de los
tomos, adems del nmero atmico. Si se quiere saber la masa de un
tomo la unidad ser uma, si se quiere la masa de un mol de tomos la
unidad ser gramo (g).
- Ejemplo:
Sodio (Na) se encuentra que su nmero atmico es 11.
La masa de un tomo de sodio 23 uma.
La masa de un mol de tomos de sodio 23g.
Para Cloro (Cl) su nmero atmico es 17.
La masa de un tomo de sodio es 35.5 uma.
La masa de un mol de tomos de Sodio es 35.5g.
Por lo que para la Sal (NaCl) tenemos:
masa molecular 23 + 35.5 = 58.5 uma.
Q-811
12
Divisin de Ingeniera
Departamento de Fsica y Qumica
masa molar 23 + 35.5 = 58.5g.
Ejercicio: determine la masa molecular y la masa molar de: KMnO4,
C6H12O6, NaOH.
Q-811
13
Divisin de Ingeniera
Q-811
Departamento de Fsica y Qumica
14
Divisin de Ingeniera
Departamento de Fsica y Qumica
Enlaces Qumicos
Objetivos especficos:
Explicar por qu se forman enlaces inicos, covalentes y metlicos.
Aplicar la regla del octeto para representar estructuras de Lewis.
Predecir la polaridad del enlace qumico
Identificar enlaces y molculas polares y no polares.
Identificar las interacciones ion - molcula y molcula - molcula
Explicar las propiedades de los metales en funcin de su enlace y
estructura.
Una vez que vimos que la materia est construida por tomos, y lo
que hace diferente a un tomo de otro es solo el nmero de protones
que lo forman, determinaremos ahora como se unen estos tomos para
formar los diferentes tipos de materia que conocemos. Para lo cual
definimos a la unin de los tomos como Enlace qumico.
Enlace qumico: fuerza elctrica que mantiene unidos a los tomos
para formar, molculas (elementos y compuestos) y ganar estabilidad.
Electrones de valencia: En los enlaces qumicos participan los
electrones del ltimo nivel de energa llamados electrones de valencia,
los cuales para los elementos representativos se indican mediante los
smbolos de Lewis
Smbolos de Lewis puntos alrededor del smbolo del elemento estos
electrones se pueden transferir de un tomo a otro, compartir entre dos
tomos deslocalizar en una red de tomos.
Con base en este hecho, se clasifican los enlaces en:
Inicos
Covalentes
Polares
No Polares
Puros
Covalentes coordinados
Metlicos
Para determinar si un tomo es capaz de quitarle los electrones a otro,
si solo lo comparten y si los comparten de manera igual o desigual, se
utilizan los valores de electronegatividad.
Enlace Inico: un tomo cede uno o ms electrones y el otro los
acepta. Las condiciones para que esto ocurra son:
Q-811
15
Divisin de Ingeniera
Departamento de Fsica y Qumica
Debe ser la unin de un metal con un no metal con una diferencia de
electronegatividad mayor o igual que 2.0.
Ejemplos:
Na Cl: Metal + No metal
Diferencia de electronegatividades = 2.0 Enlace Inico
Fe Cl: Metal + No Metal
Diferencias de electronegatividades menor a 2.0 por lo tanto el enlace no en Inico
F H: No metal + No metal
No inico, la diferencia de electronegatividad es menor a 2.0 no hay enlace inico.
Enlace Covalente: Los tomos comparten uno o ms pares de
electrones, y esta comparticin se da de manera igual o desigual
dependiendo del valor de electronegatividad, Generalmente cada tomo
aporta un electrn para formar el enlace, sin embargo un solo tomo
puede aportar los dos electrones para formar el enlace, en este caso se
trata de un enlace covalente coordinado.
En el enlace covalente no polar o puro el par de electrones se
comparte por igual, mientras que en el enlace covalente polar los
electrones se comparten desigualmente.
- Ejemplos:
H H HH
No polar
Polar H
F H F
Condiciones para que se d un enlace covalente:
no polar o puro.
No metal + No metal y diferencia de electronegatividad igual a cero.
Condiciones para que se d un enlace covalente polar:
No metal + No metal y diferencia de electronegatividad diferente de
cero.
Metal + No metal, pero con diferencia de electronegatividades menor
a 2.0.
El tomo ms electronegativo atrae el par de electrones del enlace hacia
l, generando una densidad de carga o carga parcial negativa,
formndose en el otro tomo una densidad de carga o carga parcial
positiva, lo que genera un dipolo, el cual se define como la separacin de
cargas parciales en una molcula. Esto indica que dentro de los enlaces
Q-811
16
Divisin de Ingeniera
Departamento de Fsica y Qumica
covalentes polares, algunos tienden a ser puros y otros a ser inicos y
que no hay enlaces 100% covalentes ni 100% inicos.
La magnitud del dipolo se mide con el momento dipolar un vector cuya
magnitud es el producto de la carga por la distancia que separa a estas
cargas parciales de igual magnitud con una direccin que apunta del
tomo menos electronegativo hacia el ms electronegativo.
Ejemplos:
PH:
P
2.1
H No metal + No metal
2.1
Diferencia de electronegatividades=0 por lo tanto Covalente no Polar.
OS:
O S
3.5
2.5
Diferencia de electronegatividad es 1 enlace Covalente Polar.
HF: H F
2.1
4.0
Diferencia de electronegatividad es de 1.9 enlace Covalente Polar.
Enlace metlico: se da entre dos tomos metlicos por deslocalizacin
de electrones, este tipo de unin se explica mediante la teora de
bandas, la que a su vez asocia las propiedades de los metales como alta
conductividad trmica y elctrica, brillo metlico, etc.
Ejemplos de este tipo de enlace son todos los metales que se conocen
como el cobre, oro, plata, sodio, y mezclas de los mismos.
Ejercicio:
Determine el tipo de enlace que se presenta entre los siguientes tomos
(los valores de electronegatividad se pueden consultar en la pgina 341
del libro de texto); H y Cl, O y N, K y I, Al y Cl, P y Te, Hg y Zn.
Para determinar cmo se distribuyen electrones de los tomos en una
molcula y formar los enlaces covalentes, resulta muy sencillo si son
solo dos tomos en la molcula, pero cuando la molcula est formada
por ms de dos tomos, se debe determinar que tomo est unido a que
tomo para poder explicar las propiedades que presenta la molcula.
Para lograr esto surgen las Estructuras de Lewis, que son la
representacin de la distribucin de los electrones de valencia para
formar los enlaces covalentes en una molculas empleando los smbolos
de Lewis.
Q-811
17
Divisin de Ingeniera
Departamento de Fsica y Qumica
Para la elaboracin de las estructuras de Lewis se siguen los siguientes
pasos:
1. Se elige un esqueleto base lo ms simtrico posible (que es la
distribucin de los tomos en la molcula), para lo cual:
Se elige un tomo central (al que se le unirn otros tomos), que
ser el menos electronegativo de los que componen a la molcula,
excepto el Hidrgeno. Ejemplo para H2CO3, las electronegatividades
son: H=2.1, C=2.5, O=3.5, por lo que el tomo central es el C.
Si hay Oxgeno generalmente se une al tomo central.
Si hay Hidrgeno generalmente se une al Oxgeno.
El esqueleto base ser en este caso el siguiente:
H O C O H
O
2. Se distribuyen los electrones de valencia de la siguiente manera:
Se calcula el nmero de electrones necesarios para que cada tomo
cumpla la regla del octeto (tenga ocho electrones en su ltimo nivel
de energa, excepto el Hidrgeno que es con 2 electrones), esto
ser N.
Se calcula el nmero de electrones disponibles esto ser D, y que
son los que aporta cada tomo a la molcula para estabilizarla y
formar los enlaces. (los del ltimo nivel de energa).
Se calcula el nmero de electrones compartidos C=N-D, que son los
que formaran los enlaces.
Se calcula el nmero de enlaces. Como cada enlace debe estar
formado por dos electrones, el nmero de enlaces ser igual a C/2.
Se calcula el nmero de electrones libres en la molcula, ser L,
que son los que no formarn enlace. electrones L = D-C
Para H2CO3:
Electrones necesarios
electrones disponibles
1 C: 8e
8
1 C: 4e4
3 O: 8e
24
3 O: 6e18
2 H: 2e4
2 H: 1e2
N=36e
D=24e
Electrones compartidos=36-24= 12= C
#Enlaces= 12/2= 6enlaces
Electrones Libres= 24-12= 12e-libres.
3. Se distribuyen los electrones en el esqueleto para que cada tomo
tenga 8e alrededor
Q-811
18
Divisin de Ingeniera
Departamento de Fsica y Qumica
Para H2CO3 queda de la siguiente manera:
H O C O H
O
En este caso un tomo de oxgeno comparte un par de electrones de l,
con otro par de electrones del carbono, lo que genera un enlace doble
entre C y O. Se pueden compartir hasta tres y tres electrones para
formar un triple enlace.
- Ejemplos:
O2: Doble enlace
N2: Triple enlace
O=O
N=N
Ejercicio:
Escriba la estructura de Lewis para el HNO3, HCN, H2CO, NH3, CH2N2.
De las estructuras de Lewis se obtiene adems un concepto muy
importante que es el Nmero de oxidacin, el cual se define como el
nmero de electrones compartidos por un tomo y que pertenecen a l,
en un enlace covalente, en el caso de un enlace inico ser el nmero de
electrones ganados o perdidos. El tomo ms electronegativo tendr un
nmero de oxidacin negativo, mientras que el menos electronegativo
tendr un nmero de oxidacin positivo. Algunos tomos presentan
varios nmeros de oxidacin en diferentes molculas, por ejemplo en
cloro tiene los siguientes nmeros de oxidacin, que se obtiene la
desarrollar las estructuras de Lewis e identificando los electrones que
pertenecen a l y que estn formando enlace.
HCl: -1
HClO: +1
HClO2: +3
HClO3: +5
HClO4: +7
Algunas conclusiones que surgen con los nmeros de oxdacin son
las siguientes.
La suma de los nmeros de oxidacin en una molcula neutra debe
ser cero.
La suma de los nmeros de oxidacin de un ion o radical es igual a la
carga del ion o radical.
El nmero de oxidacin de los elementos en su estado ms estable es
cero.
Q-811
19
Divisin de Ingeniera
Departamento de Fsica y Qumica
En ocasiones los tomos que funcionan como centrales en las
estructuras de Lewis no cumplen con la regla del octeto, esto se conoce
como Excepciones a la regla del octeto, estos tomos se pueden rodear
de ms de ocho electrones o de menos de ocho.
- Ejemplos:
1. Los compuestos covalentes de Berilio, ya que el berilio solo tiene dos
electrones de valencia, solo puede formar dos enlaces y rodearse de 4
electrones:
2. Los compuestos covalentes de boro y aluminio (Familia III), que se
rodean de seis electrones:
3. Los compuestos de nitrgeno con nmero impar de electrones se
rodean de 7electrones.
4. Algunos compuestos de fsforo en los que rodea de 10e-.
5. Algunos compuestos de azufre en los que se rodea de 12e-.
Q-811
20
Divisin de Ingeniera
Departamento de Fsica y Qumica
Una vez que se conoce como estn distribuidos los tomos en la
molcula, es importante determinar la Geometra Molecular que es la
que nos indica cmo se distribuyen estos enlaces en el espacio, y que ,
junto con el momento dipolar de los enlaces establece la polaridad de
una molcula.
Ya que los enlaces estn formados por electrones y estos tiene carga
negativa, en los enlaces se presenta una gran densidad de carga
negativa, que soporta el tomo central por tener varios enlaces. Para
que esto suceda y la molcula sea estable lo que propone la teora
RPECV (Repulsin del Par de Electrones en la Capa de Valencia), es que
los enlaces se van a separar en el tomo central con el mayor ngulo
posible, generando as las diferentes geometras, dependiendo del
nmero de enlaces que tengan el tomo central y si tiene o no
electrones libres. Considerando lo anterior, se pueden tener las
siguientes geomtricas, dando el nombre a la geometra por la figura
que forman la unin imaginaria de las puntas de los enlaces:
1) Lineal: 3 tomos, uno central y dos sustituyentes, sin electrones
libres el tomo central
1
BeCl2:
Cl----- Be -----Cl
1
No Polar
BeClF:
Cl -----Be-----F
Polar
El ngulo entre los enlaces es de 180
Los enlaces son covalentes polares en este caso. La molcula puede
ser no polar si los sustituyentes son iguales, ya que se tiene dos
momentos dipolares en la molcula, uno en cada enlace, de la misma
magnitud pero de sentido contrario que al sumarse vectorialmente dan
cero. Si los sustituyentes son diferentes la molcula ser polar, ya que
los momentos dipolares son diferentes por que las electronegatividades
son diferentes y la suma vectorial ser diferente de cero. Sustituyentes
son los tomos unidos al tomo central.
2) Trigonal Planar : tomo central sin electrones libres, con tres
sustituyentes:
BCl3 No polar
Q-811
BF2Cl Polar
21
Divisin de Ingeniera
Departamento de Fsica y Qumica
Los enlaces son covalentes polares y forman ngulos de 120 para
asegurar la mayor separacin posible entre ellos, formando el tringulo
si se unen imaginariamente los sustituyentes.
La molcula es no polar si los sustituyentes son iguales, ya que la
suma vectorial de los momentos dipolares iguales es cero.
La molcula es polar si los sustituyentes son diferentes, por que la
suma de los momentos dipolares ya no es cero, por tener valor
diferente los momentos dipolares.
3) Tetradrica: tomo
sustituyentes:
CCl4 no polar
central
sin
electrones
libres
cuatro
CH3Cl polar
Enlaces covalentes polares para esta molcula y forman ngulos entre ellos de 109.5
La molcula es no polar si los sustituyentes son iguales, por que la
suma vectorial de los momento dipolares iguales de cada enlace es
igual a cero.
La molcula es polar si los sustituyentes son diferentes por que la
suma vectorial de los momentos dipolares diferentes no es cero.
4) Bipirmide triangular: tomo central sin electrones libres y cinco
sustituyentes.
PCl5
Enlaces covalentes polares es esta molcula y forman ngulos de 90,120 y 180
Molcula no polar si los sustituyentes son iguales.
Molcula polar si los sustituyentes son diferentes.
5) Octadrica: tomo central sin electrones libres y seis sustituyentes:
SF6
Enlaces covalentes polares y forman ngulos de 90 y 180
Molcula no polar si los sustituyentes son iguales.
Molcula polar si los sustituyentes son diferentes.
6) Piramidal triangular: tomo central con un par de electrones libres y
tres sustituyentes, ejemplo NH3(amoniaco), tiene enlaces covalentes
Q-811
22
Divisin de Ingeniera
Departamento de Fsica y Qumica
polares y la molcula es polar aun cuando los sustituyentes son iguales,
debido al par de electrones libres en el tomo central, que hace que la
geometra no sea trigonal planar sino un tetraedro deformado, ya que
los ngulos entre los enlaces no son los de un tetraedro, sino de 107.3
por que el par de electrones libres ocupa ms espacio que un enlace.
7)Angular: tomo central con dos pares de electrones libres y dos
sustituyentes ejemplo el H2O (agua), tiene enlaces covalentes polares y
la molcula es polar aun cuando los sustituyentes son iguales, debido a
los dos pares de electrones libres en el tomo central, que hace que la
geometra no sea lineal, sino angular o de un tetraedro deformado, ya
que los ngulos entre los enlaces no son los de un tetraedro, sino de
104. debido a que los dos pares de electrones libres ocupan ms
espacio que un enlace.
La polaridad de las molculas que se determin con la geometra, y esta
a su vez con las estructuras de Lewis, indica si las molculas presentan
interaccin o no y que tipo de interaccin presentan.
Interacciones Intermoleculares: son las fuerzas de atraccin que se
dan entre las molculas y se nombran de acuerdo a la polaridad de las
mismas. Son las responsables de que existan los estados lquidos y
slidos de la materia y que tengan diferentes propiedades fsicas los
slidos y los lquidos.
1ra. Interaccin
Molcula inica con molcula inica.
- Ejemplo
NaCl con NaCl y recibe el nombre de in-in.
2da. Interaccin
Molcula Inica con molcula covalente polar.
- Ejemplo
NaCl y H2O y recibe el nombre de ion - dipolo.
3da. Interaccin
Molcula covalente polar con covalente polar.
- Ejemplo
HCl y H2O a esta interaccin se le llama interaccin dipolo - dipolo
4ta. Interaccin
Molcula covalente polar con covalente no polar.
Q-811
23
Divisin de Ingeniera
Departamento de Fsica y Qumica
- Ejemplo
H2O y O2 a esta interaccin se le conoce como dipolo - dipolo inducido.
5ta Interaccin
Molcula covalente no polar con covalente no polar.
- Ejemplo
CO2 y CO2 a esta interaccin se le conoce como fuerzas de London o
fuerzas de dispersin.
6ta. Interaccin
Puente de Hidrgeno: Dentro de las interacciones entre las molculas
covalentes polares
es decir las dipolo-dipolo, existe una que se
distingue por su fuerza de interaccin, que es muy grande cuando
dentro de la molcula existen tomos de Hidrgeno (H) unido a tomos
de N, O o F a ambos lados.
- Ejemplo
En la molcula de agua el oxgeno tiene unidos dos hidrgenos, estos
pueden interaccionar con dos molculas de agua por el otro oxgeno y
este sera el puente de hidrgeno.
Una de las clasificaciones de las molculas es por el tipo de enlace
que presentan, lo que les proporciona Propiedades fsicas muy
diferentes, pero que se pueden agrupar como propiedades fsicas de
compuestos Inicos y Covalentes, y sirven para distinguir fsicamente
entre un compuesto covalente y uno inico.
Una molcula covalente es aquella que presenta nicamente enlaces
covalente.
- Ejemplo
HNO3, HF, H2SO4, HCl, H3PO4, etc., que en un gran nmero es un
compuesto.
Una molcula inica, tiene enlaces inicos o inicos y covalentes.
- Ejemplo,
NaCl, Na2CO3, K2SO4, LiF, etc.
Q-811
24
Divisin de Ingeniera
Departamento de Fsica y Qumica
Las propiedades fsicas de estos compuestos se distinguen en funcin de
la solubilidad en agua, conductividad elctrica, punto de fusin y estado
fsico, y se pueden agrupar de la siguiente manera:
Propiedad
Inico
Covalente
Punto de fusin
Alto (>350C)
Bajo (<350C)
Slidos
Slidos, Lquidos, Gases
Estado
agregacin
Solubilidad
Conductividad
de
Solubles en lquidos
polares
(H2O),
no
solubles en lquidos no
polares (CCL4, aceite,
gasolina)
Las
Soluciones
acuosas si conducen
corriente elctrica
Sales
fundidas:
si
conducen
No solubles en lquidos
polares (H2O), solubles
en lquidos no polares
Ni soluciones acuosas ni
compuestos
fundidos
conducen
corriente
elctrica
H2SO4: Covalente
HF: Covalente
HNO3: covalente
K2(SO4): Inico
Na2CO3: Inico
KMnO4: Inico
Compuestos que tienen un no metal +
radical son Covalentes, los compuestos
que tienen un metal y un radical son
Inicos.
Con ese cuadro se observa que los enlaces y las interacciones,
determinan las propiedades de las molculas.
Q-811
25
Divisin de Ingeniera
Q-811
Departamento de Fsica y Qumica
26
Divisin de Ingeniera
Departamento de Fsica y Qumica
Estequiometria
Objetivos especficos:
Conocer las leyes de la qumica en que se fundamenta la
estequiometria
Comprender los conceptos de reaccin qumica, peso atmico, peso
molecular y mol.
Calcular moles, tomos -g y frmulas -g.
Calcular frmula mnima y frmula molecular.
Efectuar clculos de reactivos o productos en ecuaciones qumicas
balanceadas.
Calcular reactivo limitante y porciento de rendimiento.
En la unidad anterior se vio que cuando se juntan dos molculas,
estas pueden interreaccionar, pero sin perder sus propiedades qumicas,
es decir conservando sus propios tomos que las forman, a esto es lo
que se le llama mezcla, que pueden ser homognea cuando no se
distinguen los componentes a simple vista o heterognea cuando se
distinguen los componentes, sin embargo en algunas ocasiones cuando
se juntan dos molculas, estas pueden intercambiar sus tomos y
formar nuevas molculas, para lo cual se necesita que haya un
rompimiento de enlaces y formacin de nuevos enlaces, a este proceso
se le conoce como reaccin qumica, que es el tema que se tratar en
esta unidad.
Elemento + Elemento
Mezcla
Elemento + Compuesto
Compuesto + Compuesto Reaccin
Qumica
Homognea
Heterognea
Proceso por el cual se
rompen y forman enlaces
qumicos.
Una reaccin qumica se puede realizar entre dos elementos, dos
compuestos o entre un elemento y un compuesto y se puede
representar de manera general como sigue:
aA (g) + bB (l) cC (s) + dD (ac)
- A y B: son los reactivos.
Son los elementos o compuestos que participan.
- C y D: son los productos.
- a, b, c y d: son los Coeficientes Estequiomtricos, es el nmero de
veces que participa esa entidad (tomo o molcula, mol, etc.)
en la reaccin.
Q-811
27
Divisin de Ingeniera
Departamento de Fsica y Qumica
- (s), (l), (g), (ac): representan el estado fsico en que esta el
compuesto o elemento participante.
La forma de leer la reaccin qumica anterior es: a moles de A
reaccionan con b moles de B para formar o producir c moles de C y d
moles de D.
Toda reaccin qumica cumple las siguientes leyes fundamentales:
Ley de la conservacin de la materia, en toda reaccin qumica la
cantidad de reactivos y productos es constante.
Ley de la conservacin de la energa, la energa no se crea ni se
destruye solo se transforma.
Ley de la conservacin de la materia y la energa, la cantidad
total de materia y de energa en el universo es constante.
La estequiometria solo est relacionada con la primera de estas leyes.
La reaccin debe estar balanceada para verificar que se cumpla la ley de
conservacin de la materia. Debe de haber el mismo nmero de tomos
en productos que en reactivos y en consecuencia la misma cantidad en
gramos de productos que de reactivos, esto se determina con los pesos
molares y con los coeficientes estequiomtricos
- Ejemplo: Na2SO4 Cunto Pesa?
Su peso molecular se mide en uma (unidades de masa atmica):
1uma=1.66x10-24 gramos y 1g= 6.022 x 1023 uma
Peso atmico: Suma de las masas de cada una de las partculas
atmicas (e-, p+, n) dentro de un tomo dadas en uma.(informacin
de la tabla peridica)
Masa o Peso Molar: son las masas de un mol de molculas o
tomos.
1 mol (de tomos o molculas)= 6.022x1023
Un tomo de Na =23uma.
Un mol de tomos Na =23g=masa molar.
Peso Molecular = pesos Atmicos=18g.
2 tomos de Na x 23uma + 1 tomo de azufre x 32 uma + 4 tomos de O x 16 uma =
46 uma
+
32 uma
+
64 uma = 142 uma
Q-811
28
Divisin de Ingeniera
Departamento de Fsica y Qumica
El peso molecular (de una molcula) de Na2SO4 es de 142uma, el peso
molar (de una mol) de Na2SO4es de 142g.
H2O=2(1)+1(16)=18uma.
Masa Molar: 18 gramos.
Para una reaccin Qumica:
2Na
+
2 tomos
2 H20
2 molculas
2 NaOH
2 molculas
+
H2
1 molcula
Se lee: 2 tomos de sodio reaccionan con dos molculas de agua para
dar 2 molculas de hidrxido de sodio y 1 molcula de hidrgeno. Sin
embargo no se trabajan tomos y molculas, sino moles de tomos y
moles de molculas, por lo que se tiene lo siguiente:
2Na
+
2moles
2 H20
2 moles
2 NaOH
2 moles
H2
1 mol
Se lee: 2 moles de tomos de sodio reaccionan con dos moles de
molculas de agua para dar 2 moles de molculas de hidrxido de sodio
y 1 mol de molculas de Hidrgeno, esta sera una primera relacin
estequiomtrica y con los pesos moleculares se tiene una segunda
relacin estequiomtrica PM de Na=23g; PM de H20=18g; PM de
NaOH=40g; PM de H2 =2g.
2Na
+
2(23g)
46g
2 H20
2(18g)
36g
2 NaOH
2(40g)
80g
H2
1(2g)
2g
Se lee: 46g de sodio reaccionan con 36g de agua para dar 80g de
hidrxido de sodio y 2g de hidrgeno. Para comprobar que se cumple la
ley de conservacin de la masa, se suman los gramos de productos y los
gramos de reactivos que deben ser los mismos. En este caso, 46g de Na
+ 36g de H20 = 82g y 80g de NaOH y 2g de H2.
Para identificar cules son los productos obtenidos en una
reaccin, se hace mediante un anlisis de los compuestos obtenidos, en
el que se determina el porciento de cada tomo en la molcula a esto se
le conoce como Composicin Porcentual, que consiste en expresar el
contenido porcentual en masa de un tomo en una molcula.
Conociendo el peso molar de la molcula y su frmula, tambin se puede
determinar esta composicin porcentual.
- Ejemplo:
Q-811
29
Divisin de Ingeniera
Departamento de Fsica y Qumica
NaOH
Masa Molar: 40g
Na:
40 100% O:
23 x
40 100% H:
16 x
40 100%
1 x
x=57.5%
x=40%
x=2.5%
% elemento
( PATOM )(# atomos)(100)
MasaMolar
Con la composicin porcentual se puede establecer una relacin
mnima de tomos que componen a la molcula, la que se conoce como
frmula mnima o emprica. Esta se determina de la siguiente forma:
La cantidad de muestra que se da, ser el 100%, cuando no se da una
cantidad de muestra se toman 100 gramos y este ser el 100%.
Se suman los porcentajes para verificar que sea 100%, en caso de no
ser as, se completa con O.
Se determinar los gramos de cada elemento que se encuentran en el
compuesto, con los porcentajes de los elementos que forman ese
compuesto.
Se divide cada una de las cantidades anteriores entre su peso
atmico.
Se divide cada una de estas cantidades obtenidas entre la ms
pequea obtenida.
Con esto se obtiene el nmero de tomos de cada elemento dentro
del compuesto, la que se escribe entre parntesis con un subndice w.
( XaYb)w
Si se conoce adems el peso molar del compuesto, el que se
determina por espectrometra de masa, se puede determinar la
frmula molecular del compuesto si se divide el peso molar entre el
peso molar de la frmula mnima, esta frmula nos indica la relacin
real de tomos en la molcula.
- Ejemplo:
Determine la frmula mnima y la frmula molecular de un compuesto
formado por 87.5% N y 12.5% H, el peso molar del compuesto es de
32g.
1) Se toman 100g de muestra esto es el 100%.
2) La suma de 87.5% + 12.5% es de 100%.
Q-811
30
Divisin de Ingeniera
Departamento de Fsica y Qumica
3) Se determinan los gramos con factores de conversin o con reglas de
tres:
100% 100 g
87.5% x
100% 100 g
12.5% x
x= 87.5g
x= 12.5g
4) Se divide cada cantidad entre su peso atmico:
87.5/14= 6.25 para N
y 12.5/ 1 = 12.5 para H
5) Se divide entre la ms pequea:
6.25/6.25=1: indica 1 tomo de N y 12.5/ 6.25=2: indica 2 tomos de H
6) Se escribe la relacin:
(N1H2)w (esta es la Frmula mnima, el peso molar es de 16g)
7.- Para determinar w se divide el peso molar entre el peso de la
frmula mnima.
w= ____peso molar_____
Peso frmula mnima
32
2 ; por lo que la frmula molecular ser (N1H2)2 N2H4.
16
Ejercicio:
1) Determine la frmula emprica de un compuesto que tiene 1.6% de
Hidrgeno, 22.2% de Nitrgeno y 76.2% de Oxgeno.
Respuesta: HNO3
2) Determine la formula molecular de un compuesto que tiene 40% de
C, 6.72% de H y 53.3% de O, si el peso molar es de 180g.
Respuesta C6H12O6.
En una reaccin qumica no siempre se colocan las cantidades de
reactivos en una relacin estequiomtrica (cantidad de gramos o moles
necesarios de un reactivo para reaccionar con otro y producir la cantidad
de productos de acuerdo a la ley de conservacin de la materia),
algunas veces se coloca ms de un reactivo que de otro, en este caso
decimos que hay un reactivo limitante y un reactivo en exceso.
Reactivo limitante: Es el que determina la cantidad de productos y
se consume totalmente.
Q-811
31
Divisin de Ingeniera
Departamento de Fsica y Qumica
Reactivo en exceso: no se consume totalmente y queda algo al
final de la reaccin.
Ya que el reactivo limitante se consume completamente, es el que
determina cuanto se obtiene de productos y por este motivo las
relaciones estequiomtricas se hacen en funcin de l.
La mayora de las reacciones qumicas no generan la cantidad de
productos esperados, debido a que hay otras reacciones colaterales que
generan otros productos o porque los reactivos no estn completamente
puros y contienen otros compuestos. A la cantidad de productos
esperados de acuerdo con la relacin estequiomtrica se le llama
rendimiento terico. A la cantidad de productos obtenidos realmente en
la reaccin se le llama rendimiento prctico o real y su porcentaje se
puede determinar de la siguiente forma:
%de Re n dim iento
(Re n dim iento Re al )(100)
Re n dim ientoTeorico
- Ejemplo:
a) Para una reaccin entre sodio y agua se colocan inicialmente 2
gramos de sodio y 1.5 moles de agua, determine: a)cuantos gramos
de hidrxido de sodio (NaOH), y b) cuantas moles de hidrgeno (H 2)
se obtienen, la reaccin es la siguiente:
Na
H2O
NaOH
H2
Los pasos para este tipo de problemas son los siguientes:
1) Se balancea la ecuacin, es decir se colocan los coeficientes
estequiomtricos adecuados para que los tomos sean los mismos en
productos y reactivos.
2) Se establecen las relaciones estequiomtricas en moles a partir de
los coeficientes.
3) Obtener los pesos molares de los reactivos y productos para
establecer las relaciones estequiomtricas en gramos con los
coeficientes y los pesos molares.
4) Se determina el reactivo limitante.
a) Se toma uno de los datos dados con la relacin estequiomtrica
adecuada y se calcula el otro reactivo que es lo que se necesita
para la reaccin.
b) Se compara el resultado obtenido (lo que se necesita), con el dato
dado (que es lo que tengo). Si en la comparacin resulta mayor lo
que se necesita que lo que se tiene este ser el reactivo limitante,
Q-811
32
Divisin de Ingeniera
Departamento de Fsica y Qumica
si lo que se necesita en menor que lo que se tiene entonces ser
reactivo en exceso.
5.- Con base en el reactivo limitante, se toma la relacin adecuada a los
datos y a la cantidad que se quiere obtener.
6.- Se resuelve la relacin anterior con factores de conversin o con reglas de tres.
Solucin:
1.- Balanceo
2Na
2H2O
2NaOH
H2
2.- Relacin estequiomtrica en moles:
2Na
+
2 moles
2H2O
2 moles
2NaOH
2 moles
H2
1 mol
3.- Relacin estequiomtrica en gramos:
2Na
+
2 moles
2(23) =
46g
2H2O
2 moles
2(18g)=
36g
2NaOH
+
2 moles
2(40g)=
80g
H2
1 mol
1(2g)=
2g
4.- Reactivo limitante:
46g de Na reaccionan con 2 moles de agua
2g de Na reaccionaran con X= 0.087moles de agua (necesito).
Tengo 1.5 moles de agua por lo tanto lo que necesito es menor que lo que
tengo y el agua es el reactivo en exceso. En consecuencia el sodio es el
reactivo limitante y con l se establecen las relaciones estequiomtricas.
5.- Para NaOH:
6.5.- Para H2
6.-
46g de Na producen 80g de NaOH
2.0g de Na producen X= 3.48g de NaOH
46g de Na producen 1mol de H2
2.0g de Na producen X= 0.043mol.
Si en la reaccin anterior se producen nicamente 2.7g de NaOH,
determine cul es el porciento de rendimiento real de la reaccin.
% de rendimiento
2.7 100
77.59%
3.48
Ejercicio:
1) Para la Combustin completa del butano: C4H10 + O2 CO2 + H2O
Determine: a) Cuntas moles de O2 son necesarias para quemar 10
moles de butano? b) Cundo se queman 10 gramos de butano,
Cuantos gramos de O2 son necesarios?
Q-811
33
Divisin de Ingeniera
Respuestas. a) 65moles de O2;
Departamento de Fsica y Qumica
b) 17.68g de O2.
2) La fermentacin de la glucosa (C6H12O6) produce alcohol etlico
(C2H5OH) y CO2, a)Cuntas moles de CO2 se producen cuando 0.350
moles de glucosa reaccionan de esta manera?. b)Cuntos gramos de
glucosa se necesitan para formar 10 moles de alcohol etlico?,
c)Cuantos gramos de CO2 se forman al producir 10g de alcohol etlico?,
c)Si se ponen 20 gramos de glucosa y se obtienen 0.5 gramos de
alcohol etlico, determinar el rendimiento de la reaccin.
C6H12O6 (ac) C2H5OH (ac) + CO2 (ac)
Respuestas: a)0.700 moles de CO2; b) 900g de glucosa; c) 9.56g
de CO2; d) 4.89%.
3) La Lacasa fngica, una protena azul que se encuentra en el hongo
que pudre la madera tiene aproximadamente 0.39% de Cu en masa. Si
una molcula de Lacasa contiene 4 tomos de Cobre, Cul es el peso
molecular aproximado?.
Respuesta PM= 65174g
5) La urea se usa como fertilizante, como alimento para animales y en
polmeros, y se prepara haciendo reaccionar amoniaco con CO2. En
un proceso se hacen reaccionar 637.2 gramos de amoniaco con
1142gramos de CO2.
NH3 + CO2 (NH2)2CO + H2O
a) Cul es el reactivo limitante?
b) Qu cantidad de urea se forma si la reaccin procede al 100%
de rendimiento?
c) Qu cantidad de reactivo excedente queda?
d) Si se obtienen nicamente 500g de urea, Cul ser el
porcentaje de rendimiento de la reaccin?
Respuestas: a) NH3; b) 1124g; c) 317.4g; d) 44.5%
Q-811
34
Divisin de Ingeniera
Departamento de Fsica y Qumica
Estados de la Materia
Objetivos Especficos:
Analizar los estados de la materia.
Describir los tres estados de la materia en cuanto a las distancias
intermoleculares, atraccin y caractersticas
Conocer las leyes que se relacionan con el volumen, presin,
temperatura y densidad de los gases y la teora cintica.
Aplicar en problemas numricos las leyes de los gases
Clasificar a los slidos en amorfos y cristalinos.
Describir el mtodo de difraccin de rayos X para determinar
estructuras de cristales.
Explicar los conceptos de celda unitaria y red cristalina.
Diferenciar los sistemas cristalogrficos ms comunes.
Relacionar las propiedades de los slidos con el tipo de partculas y
sus enlaces.
Describir algunas de las propiedades de los lquidos ( presin de
vapor, tensin superficial, viscosidad, etc. ).
Con los enlaces qumicos y las fuerzas intermoleculares se pueden
explicar en gran parte las propiedades de los slidos, lquidos y gases.
En esta unidad se caracterizan los tres estados ms comunes de la
materia y posteriormente se estudian las propiedades de cada uno de
ellos para poder diferenciar a un gas de otro gas, un slido de otro slido
y un lquido de otro lquido. Las propiedades que permiten distinguir los
tres estados son: la forma que tienen cada uno de estos estados, las
distancias intermoleculares, que se refiere a la distancia entre las
molculas que forman a los compuestos, las fuerzas que existen entre
las molculas, los tipos y magnitud de movimientos que presentan las
molculas tanto en su lugar como para trasladarse de un lugar a otro
(fluidez), la densidad de los compuestos, la compresibilidad que es la
disminucin de las distancias intermoleculares y la difusin que es la
facilidad para que una sustancia penetre en otra.
Estas son las caractersticas de los tres estados de la materia:
Forma
Distancias
Q-811
Slido
Definida
Muy pequeas
Lquido
Del recipiente
Pequeas
Gas
No tiene
Grandes
35
Divisin de Ingeniera
Departamento de Fsica y Qumica
Intermoleculares
Fuerzas
Muy Grandes
Intermoleculares
Movimientos
Vibratorios
Densidad
Fluidez
Compresibilidad
Difusin
Muy Grande
Nula
Nula
Nula
Grandes
No Hay
Vibracin/Traslac
in
Grande/Mediana
Grande
Casi Nula
Media/Grande
Aleatorios
Muy Baja
Muy Grande
Grande
Muy Grande
Masa
Volumen
La masa es en gramos y el volumen para los gases es en litros, para
slidos y lquidos es en mililitros
densidad
Ejemplo para el agua, la densidad es de 1g/ml = 1 kg/L.
Para determinar la diferencia entre dos gases, o entre dos slidos o dos
lquidos, es necesario conocer las propiedades que caracterizan a cada
uno de ellos.
Gases y sus propiedades:
Los gases se pueden describir en funcin de las siguientes
caractersticas:
Se pueden comprimir y por lo tanto su densidad aumenta al
aumentar la presin
Se difunden entre si y forman mezclas.
Ocupan todo el volumen del recipiente que lo contiene.
Ejercen presin sobre las paredes del recipiente que lo contiene
Se necesita presin para almacenarlos
Sus propiedades se definen en funcin de:
Presin
Volumen
Temperatura
nmero de moles ( nmero de partculas ).
La presin en la fuerza que se ejerce por unidad de rea y su unidad en
sistema internacional es el Pascal.
Presin P=Fuerza/rea=N/m2=Pascal
Q-811
36
Divisin de Ingeniera
Departamento de Fsica y Qumica
Otras unidades de presin, con sus equivalencias son:
1atm= 76cmHg=760mmHg=760 torr =1 bar = 1.013x105Pa = 101.3kPa = 14.7lb/in2
El volumen generalmente se mide en litros.
1L = 1000ml
1cm3 = 1ml
La temperatura se mide en Kelvin, para pasar de C a Kelvin se le
suman 273 a los C, para quedar:
K = C + 273
Las leyes que describen el comportamiento de los gases, relacionan el
volumen del gas con las otras variables y reciben el nombre de quien
las postulo por primera vez:
Ley de Boyle.- El volumen que ocupa una masa definida de gas es
directamente proporcional al inverso de la presin a temperatura
constante. Relacin de V con P a T y n = constantes:
VP-1
V=kP-1
V1P1=V2P2
Ley de Charles.- El volumen que ocupa una masa dada de gas es
directamente proporcional a su temperatura absoluta. Relacin de V con
T a P y n = constantes:
VT
V= kT
V1 V2
T1 T2
Punto de coincidencia en las escalas termomtricas C-K:
0C = +273K
Conversiones:
C=K-273
K=C+273
Ecuacin Combinada del Estado Gaseoso, resulta de combinar las dos
ecuaciones anteriores, en la que el nmero de moles permanece
constante.
V1 P1 V 2P2
V1 P1 V2 P2
V1 V2
T1
T2
T1 T2
Q-811
37
Divisin de Ingeniera
Departamento de Fsica y Qumica
Ley de Avogadro.- Volmenes iguales de gases (iguales o diferentes),
contienen el mismo nmero de molculas, a la misma temperatura y
presin. Relacin de Volumen y Nmero de moles a P y T = Constantes
Vn
V=kn
Avogadro introdujo distintos gases a TPE en un recipiente para hacer los
experimentos y encontr que un mol de cualquier gas en esas
condiciones ocupa siempre un volumen de 22.4L
TPE significa Temperatura y Presin Estndar (T=0C y P=1atm.).
Ley del Gas Ideal.- Resulta de combinar las tres relaciones
encontradas y combinndolas en una sola mediante una constante que
se conoce como R constante general del estado gaseoso y su valor
depende de las unidades:
R=0.082 atm/mol K = 8.314 Joule / mol K
1
V
P
RnT
nT
VT V
V
P
P
Vn
Otras relaciones importantes en los gases son la ley de Dalton o de las
presiones parciales y la de peso molecular y densidad con la ecuacin de
gas ideal.
Dalton estudi mezclas de gases y encontr que la presin que ejerce
una mezcla de gases ideales es la suma de las presiones parciales de los
gases que la componen. De esta ley se puede encontrar la presin que
ejerce cada gas si se conoce la presin total y el nmero de moles de
cada gas, para lo cual se define la fraccin molar como la relacin del
nmero de moles de un gas entre el nmero de moles totales.
Q-811
38
Divisin de Ingeniera
Departamento de Fsica y Qumica
PT P1 P2 P3 ... Pn
n1 RT n 2 RT n 3 RT
n n RT
...
V
V
V
V
RT
donde n T n1 n 2 n 3 ... n n
V
RT
P1 n1
V
RT
P2 n 2
V
RT
P3 n 3
V
RT
P1 n1
P1 n1
n1
V
donde
X 1 o fraccion molar
RT
PT n T
nT
PT n T
V
P1 X 1 PT
PRESION PARCIAL
PT n T
Relacin entre Peso Molecular, Densidad y la Ecuacin del Gas Ideal.
Esta se obtiene considerando que se conocen el gas y que por lo tanto
se sabe su peso molar y que se conocen los gramos de gas.
1 mol
PM en gramos
x =n moles gramos de gas.
n
P
gramos
Peso Molar
PM
gramos
volumen
PV nRT
RT
Ejemplos:
1.- Una muestra de gas ocupa 500mL a PTE. a qu presin ocupar
250mL, si la temperatura se incrementa a 819C?.
con la ecuacin combinada del estado gaseoso se despeja la presin.
( P 2)(V 2)(T 1) (1atm)( 0.500L)(1092 K )
= 8atm
P1
(273K )( 0.250L)
T 2V 1
2.- Si 4.00 gramos de un gas ocupan 1.12L en condiciones PTE. Cul
4.00 g
es la masa de 6.00 moles de gas?.
=3.57g/L
112
. L
PM
Q-811
RT
357
. g/ L
(0.082 Latm / molK )(273K ) = 79.95g/mol
1atm
39
Divisin de Ingeniera
Departamento de Fsica y Qumica
g=(n)(PM)=(6.00 moles)(79.95g/mol)= 479.7g
Ejercicios:
1.-Se tienen dos recipientes conectados. En uno de ellos se encuentran
480cm3 de O2 a una presin de 520mmHg, en el otro recipiente hay
793ml de Ar con una presin de 0.37atm.
Ambos estn a una
temperatura de 25C. Cuando se abre la llave se mezclan ambos gases
manteniendo la temperatura constante Cul ser la presin de O2 y Ar
en la mezcla resultante?
Respuesta: Po2=0.256 atm ; Par= 0.230atm
2.-El ciangeno es un gas muy venenoso y est formado por 46.2% de
C y 53.8% de N. Encuentre la frmula molecular del Ciangeno si una
muestra de 1.05 gramos del gas ocupa un volumen de 0.5litros a 25C y
una presin de 750mmHg.
Respuesta: C2N2
3.-El hidruro de Calcio (CaH2) reacciona con el agua para formar
Hidrgeno gaseoso:
CaH2(s) +
H2O(l)
H2
2(ac) +
Algunas veces se utiliza esta reaccin para inflar balsas salvavidas,
globos climatolgicos y dispositivos semejantes en donde se desea un
medio sencillo y compacto para generar H2. Cuntos gramos de CaH2
son necesarios para generar 10.0lt de H2 gaseoso, si la presin parcial
de H2 es 740mmHg a 23C?.
Respuesta 3.61g.
Para explicar las observaciones experimentales, que se resumieron en
las ecuaciones de los gases, surgi la teora cintica molecular, cuyos
postulados fundamentales son :
Teora Cintica molecular:
1.- Gases formados por partculas discretas. ( No hay interaccin )
2.- Movimiento aleatorio continuo siempre en lneas rectas, con
velocidades variables y con choques perfectamente elsticos.
3.- La energa cintica de las partculas es directamente proporcional a
la temperatura.
La utilidad de la teora cintica molecular es que explica de manera
satisfactoria la mayor parte del comportamiento observado en los gases.
Q-811
40
Divisin de Ingeniera
Departamento de Fsica y Qumica
Para los lquidos y slidos, solo se vern las caractersticas a nivel
cualitativo que hacen diferente a un lquido de otro y a un slido de otro
a diferencia de los gases en los que adems, con ecuaciones se cubri la
parte cuantitativa.
Lquidos:
Las caractersticas que hacen diferente a un lquido de otro dependen de
las fuerzas de atraccin entre las partculas que los forman, con lo que
estas propiedades son muy variables de un lquido a otro:
Viscosidad: Resistencia de los lquidos a fluir, depende de las fuerzas
intermoleculares, del tamao y la forma de las partculas que los
constituyen, a mayor fuerza intermolecular, mayor tamao y formas
ms irregulares, mayor viscosidad, esta se mide en centipoise, en SI
es N s/m2.
Tensin superficial: Fuerza necesaria para aumentar la superficie de
un lquido. Se relaciona con las fuerzas intermoleculares, a mayor
fuerza intermolecular mayor tensin superficial.
Capilaridad: Comparacin de fuerzas de adhesin con fuerzas de
cohesin, las fuerzas de cohesin son las que mantienen unidos a las
molculas del lquido, las fuerzas de adhesin se dan entre un lquido
y otra superficie.
Evaporacin: Paso de algunas molculas del estado lquido al estado
gaseoso. Mientras mayores sean las fuerzas intermoleculares menor
ser la evaporacin y viceversa. Los lquidos voltiles son aquellos que
se evaporan fcilmente. El proceso inverso a la evaporacin es la
condensacin. En un recipiente cerrado se establece un equilibrio
entre la evaporacin y la condensacin en el que la velocidad de
evaporacin es igual a la velocidad de condensacin.
Presin de Vapor: Fuerza o presin que ejercen las molculas en
fase vapor en un recipiente cerrado.
Mientras ms voltil sea un
lquido habr mayor presin de vapor y viceversa.
Punto de Ebullicin: Temperatura en la que la presin de vapor de
un lquido iguala a la presin externa. El punto de ebullicin del agua a
657.6mmHg es de 96C
Q-811
41
Divisin de Ingeniera
Departamento de Fsica y Qumica
Punto de ebullicin Normal: Temperatura en la que la presin de
vapor de un lquido iguala a la presin externa, siendo esta presin de
una atmsfera. A nivel del mar se tiene una presin de una
atmsfera, a esta presin el punto de ebullicin del agua es de 100C
El punto de ebullicin es una constante muy importante para
caracterizar a los lquidos , as como para separar una mezcla de
lquidos.
Slidos
Una propiedad muy importante que permite distinguir a un slido de
otro, as como clasificar a los diferentes slidos es el punto de fusin,
que se define como:
Punto de Fusin- Temperatura en la que coexisten el slido y el
lquido
Lquido <========> slido
Punto de fusin normal- cuando se mide a una atmsfera de presin
Calor de fusin- cantidad de calor necesaria para fundir un gramo de
slido en su punto de fusin, sus unidades son J/g.
Calor Molar de fusin- cantidad de calor necesaria para fundir un mol
de slido en su punto de fusin, sus unidades son KJ/mol.
El punto de fusin indica si un slido puro presenta un orden regular en
las partculas que lo forman o no, cuando un slido presenta un rango
amplio de temperaturas de fusin, indica que no presenta un orden
regular en sus partculas y se le clasifica como slido amorfo, si el slido
presenta una sola temperatura de fusin indica que presenta un orden
regular en sus partculas y se le conoce como slido cristalino.
Los slidos cristalinos se clasifican a su vez, por el tipo de enlace que
presentan en: slidos inicos,(enlaces inicos), covalentes (enlaces
covalentes), slidos metlicos(enlaces metlicos). Los puntos de fusin
en los slidos covalentes se pueden dividir en dos grupos, aquellos que
presentan puntos de fusin bajos(menores de 400C) que se les conoce
como slidos moleculares, y los que presentan puntos de fusin altos
(mayores de 1200C) que son los slidos covalentes. Lo que hace que
los puntos de fusin en los slidos moleculares sea tan bajo, es porque
aun cuando sus molculas estn formadas por enlaces covalentes, la
formacin del slido en por fuerzas intermoleculares, que son las que se
Q-811
42
Divisin de Ingeniera
Departamento de Fsica y Qumica
tienen que romper para fundirlo, estas son muy dbiles y por lo tanto se
requieren bajas temperaturas para llevar a cabo este proceso, mientras
que los slidos covalentes estn formados por enlaces covalentes, para
los que es necesario grandes temperaturas para romperlos.
Clasificacin general de los slidos:
Cristalinos
Grafito,Diamante,Sal,Ionicos, Covalentes y
(Orden
regular)
Azucar y Metales. Metalicos
1 Temperatura de fusion
Solidos
Amorfos
Vidrio, Hule,
(Orden irregular)
Plasticos
Amplio rango de fusion
Clasificacin y propiedades de los slidos cristalinos.
Los puntos de fusin para los compuestos inicos son mayores a
400C.
Los compuestos covalentes moleculares tienen puntos de fusin entre
-272C y 400C.
Los covalentes tienen puntos de fusin mayores a 1200C y para los
metlicos el punto de fusin es desde -39 hasta 3400C.
Q-811
43
Divisin de Ingeniera
Tipo
Slido
Departamento de Fsica y Qumica
de Partculas
tomos
molculas
Molecular
Covalente
(red)
Inico
Metlico
Fuerzas
o Dispersin o
de
London,
dipolo
dipolo,
Puente de H
Propiedades
Muy
blandos,
puntos
de
fusin bajos a
moderadamente altos,
conductividad.
Trmica
y
elctrica pobre.
tomos
Enlaces
Muy
duros,
conectados
covalentes
puntos
de
en red de
fusin
muy
enlaces
altos.
covalentes
Conduccin
trmica
y
elctrica pobre
Iones
Atraccin
Duros
y
positivos
o electrosttica quebradizos,
negativos
puntos
de
fusin
altos,
cond. Trmica
y
elctrica
pobre
tomos
Enlaces
De blandos a
metlicos
muy
duros,
puntos
de
fusin de bajos
a altos, cond.
Trmica
y
elctrica
excelente,
maleables
y
dctiles
Ejemplos
Argn
metano
azcar, hielo
hielo
seco,
etc.
Diamante
Cuarzo
Cloruro
sodio
NaCl,
Oxido
potasio
K2O, etc.
de
de
Elementos
metlicos:
Cobre
Aluminio
Wolframio
Hierro, etc.
Para determinar cmo se encuentran distribuidos los tomos, iones o
molculas en un cristal, se utiliza la difraccin de rayos X, que son
ondas electromagnticas con una longitud de onda similar a la
separacin intermolecular de tomos en un cristal. Los rayos x se
dirigen, mediante un sistema de rejillas, hacia el cristal el cual se hace
girar para variar el ngulo de incidencia, los rayos x reflejados, chocan
Q-811
44
Divisin de Ingeniera
Departamento de Fsica y Qumica
contra una placa fotogrfica, en la que se observa al revelarla, manchas
ordenadas en forma simtrica debido a la difraccin de los rayos X , a
esto se le conoce como patrn de difraccin de rayos x. Los distintos
tipos de cristal producen diferentes patrones de difraccin.
Difraccin de rayos X: La difraccin de rayos X ha sido un instrumento
muy til para entender la estructura de los slidos. La red de tomos en
un cristal funciona como una serie de barreras y aberturas que difractan
los rayos X que lo atraviesan. Los rayos X difractados forman un
diagrama de interferencia que se puede utilizar para determinar la
distancia entre los tomos del cristal. Esta fotografa muestra el
diagrama de interferencia que resulta cuando los rayos X atraviesan un
complejo de coordinacin de paladio, un compuesto con un tomo de
paladio en el centro de cada molcula.
Puntos reticulares: posicin de los tomos , molculas o iones en el
cristal, la unin de los puntos reticulares genera la red cristalina, esta se
puede describir a partir de una estructura muy sencilla, que se le llama
celda unitaria, la cual
por repeticin genera la red cristalina, el
ordenamiento de los tomos en la celdas unitarias genera las redes de
Bravais.
Se conocen 7 tipos de celdas unitarias con las que se pueden
describir los cristales y 14 formas en las que los tomos se pueden
acomodar en esta celdas unitarias y que son las 14 redes de Bravais.
Celdas unitarias: Arreglo mnimo que describe a una red cristalina
(Siete formas).
Q-811
45
Divisin de Ingeniera
Departamento de Fsica y Qumica
14 formas de arreglo de los tomos en las celdas unitarias: Redes de
Bravais
El punto de ebullicin de un lquido, el punto de fusin de un slido,
caracteriza a estos estados de la materia, pero como se vio,
dependiendo de la presin, un lquido un slido pueden presentar
varios puntos de ebullicin de fusin.
Para determinar cuales sern los valores de temperaturas de fusin a
diferentes presiones, adems de conocer el estado fsico en el que se
encuentra un compuesto a cierta temperatura y presin se diseo el
Diagrama de fases, que son regiones de coexistencia entre las fases
slido, lquido y vapor en una grfica de temperatura contra presin
para una sustancia.
Q-811
46
Divisin de Ingeniera
Departamento de Fsica y Qumica
De este diagrama surgen los conceptos de punto triple, temperatura
crtica y presin crtica.
El Punto triple es un punto de temperatura y presin en el cual
coexisten las tres fases (slido, lquido y gas) de una sustancia .
Temperatura crtica, es aquella por encima de la cual el gas no puede
pasar a la fase lquida, es decir el lquido y el gas no existen como fases
distintas.
Presin Crtica es la que se requiere para licuificar un gas en su
temperatura crtica, la combinacin de temperatura y presin crtica se
conoce como punto crtico. Para el agua el punto crtico es de 374C y
218 atm, para el CO2 31C y 73 atm.
Una aplicacin muy importante de los diagramas de fase es el proceso
de deshidratacin de los alimentos, conocido como liofilizacin, en el cual
se congelan los alimentos y se les disminuye la presin, haciendo que el
agua pase de slido a vapor.
Q-811
47
Divisin de Ingeniera
Departamento de Fsica y Qumica
Soluciones y Propiedades Coligativas.
Objetivos Especficos:
Calcular Concentraciones en diferentes tipos de soluciones y los
cambios en sus propiedades coligativas.
Explicar el concepto de solucin
Clasificar las soluciones segn el estado fsico de sus componentes.
Calcular concentraciones de soluciones: porcentaje en peso, partes
por millar, molar, molal, normal y fraccin molar.
Aplicar en problemas numricos la ley de Raoult en soluciones.
Efectuar clculos de ebulloscopia y crioscopa en soluciones.
Efectuar clculos de cambios de presin osmtica en soluciones
En la unidad 3 se estudiaron las reacciones qumicas que surgen
cuando en una interaccin hay rompimiento y formacin de enlaces,
pero esto no siempre ocurre. Dos o ms molculas pueden interactuar
manteniendo sus componentes, a lo que se le conoce como mezcla. De
los diferentes tipos de mezclas, las que se estudiaran en esta unidad
sern las homogneas formadas por dos componentes a las que se le
llamar soluciones. Cuando a un lquido se le agrega otro compuesto, las
propiedades del lquido cambian. A las propiedades del lquido que
cambian y que dependen del nmero de partculas que se le adicionen,
se le llaman propiedades coligativas, que tambin se estudiarn en esta
unidad.
Solucin: Es una mezcla homognea de dos o ms componentes.
Para las soluciones de dos componentes:
Disolvente: es el componente que se encuentra en mayor
cantidad.
Soluto: es el componente que se encuentra en menor cantidad.
Cuando se encuentran en mismas cantidades:
Si la solucin est formada por un slido y un lquido el disolvente es
el lquido.
Si la solucin est formada por dos lquidos, de acuerdo a la forma de
nombrar la solucin se sabe quin es el disolvente:
Solucin de H2O en alcohol, indica que el agua es el soluto y el
alcohol el disolvente.
Solucin de Alcohol en H2O, indica el alcohol es el soluto y el
agua el disolvente.
Primero se nombra al soluto y despus al disolvente
Q-811
48
Divisin de Ingeniera
Departamento de Fsica y Qumica
Requisitos para formar una solucin:
Para que se forme una solucin la interaccin entre el soluto y el
disolvente debe ser mayor que la interaccin entre soluto- soluto y
tambin mayor que la disolvente- disolvente.
NaCl- Enlaces Inicos (Interacciones soluto- soluto).
H2O- Enlaces Covalentes (Interacciones disolvente- disolvente).
Na+...H2O
Enlaces Ion - Dipolo. Interaccin: soluto- disolvente.
Cl-...H2O
La interaccin soluto disolvente > soluto- soluto y disolvente disolvente
Lo anterior se puede resumir en que lo similar disuelve a lo
similar, es decir polaridades similares, por ejemplo polar con polar,
inico con polar o no polar con no polar.
La clasificacin de las soluciones se hace con base en el estado
fsico de los componentes. El soluto puede ser slido, lquido o gas, lo
mismo que el disolvente, y el estado fsico del disolvente define el
estado fsico de la solucin.
Soluto
Disolvente
Solucin
Interaccin
Ejemplo
Slido
Slida
Metal- Metal
Aleaciones, Au- Cu
Lquido
Lquida
Dipolo- Dipolo
F. de London
In Dipolo
Azcar- H2O
I2- CCl4
NaCl- H2O
Slido
Slida
Metal- Metal
Amalgama, Hg- Zn
Lquido
Lquida
Dipolo- Dipolo
Alcohol- H2O
Hexano- CCl4
Slido
Lquido
F. de London
Gas
Q-811
Slido
Lquido
Gas
Slida
Lquida
Gas
Metal- dipolo inducido
Dipolo- dipolo inducido
Hielo- O2
O2- H2O
N2- O2
49
Divisin de Ingeniera
Departamento de Fsica y Qumica
Cuando dos lquidos forman una solucin se dice que son
miscibles. Ejemplo agua y alcohol, un ejemplo, de dos lquidos no
miscibles, es el del agua y el aceite.
A la relacin de soluto y disolvente se le conoce como concentracin,
esta puede ser en gramos, moles o equivalentes de soluto con respecto
a litros de solucin, kilogramos de disolvente o gramos de solucin, las
diferentes relaciones del soluto con el disolvente se le conoce como
formas de expresar concentracin que son:
Porciento en peso: se define como la relacin de gramos de soluto
entre gramos de solucin por 100.
Gramos solucin Total 100%
Gramos de disolvente X%
Gramos de solucin Total
Gramos de Soluto
100%
X%
Si se transforma esta regla de tres en una ecuacin queda de la siguiente forma:
% en peso de soluto =
gramos de soluto
100
gramos de solucin
Fraccin Molar: relacin de moles de soluto a moles de solucin. Se
representa por X.
X soluto
Molessoluto
Molessolucin
Molaridad: relacin entre moles de soluto y litros de solucin. Se
representa por M.
Nmero de moles de souto
Volumen de solucin en Litros
Molalidad: relacin de moles de soluto con kilogramos de disolvente.
Esta forma de concentracin es muy til cuando se necesita que la
concentracin no cambie con la temperatura. Se representa por m.
Q-811
50
Divisin de Ingeniera
Departamento de Fsica y Qumica
Nmero de moles de soluto
Masa de disolvente en kg.
Normalidad: relacin de nmero de equivalentes de soluto en litros
de solucin. Se representa por N.
Nmeros equivalentes
Litros de solucin
Equivalente: Masa de soluto que proporciona 1 mol de iones H +
Masa de soluto que gana o pierda un mol de e-
Partes por milln: se define como los gramos de soluto entre los
gramos de solucin, por 106, esta forma se utiliza mucho en
soluciones diluidas, que son las que contienen muy poco soluto en una
gran cantidad de disolvente. Se representa como ppm.
(Las que se manejarn en este curso son las 4 primeras)
Soluciones Diluidas en ppm:
ppm soluto
gramos soluto
106
gramos solucin
Algunas ocasiones se considera que una solucin es concentrada
cuando su concentracin es mayor de 0.2M (Molar), para soluciones
diluidas la molalidad es aproximadamente igual a la Molaridad. M ~ m
La forma de expresar la concentracin proporciona, informacin
acerca de la relacin del soluto con el disolvente. Por ejemplo una
solucin 3M de cloruro de sodio en agua indica que hay 3 moles de
cloruro de sodio en un litro de solucin, una solucin al 37% de
hidrxido de sodio en agua indica que en 100g de solucin hay 37g de
hidrxido de sodio y 63g de agua, una solucin 2.3m de azcar en agua
indica que hay 2.3 moles de azcar en un kilogramo de agua.
- Ejemplos:
1.-Calcular la fraccin molar del alcohol metlico CH3OH en las siguientes
soluciones.
Q-811
51
Divisin de Ingeniera
Departamento de Fsica y Qumica
a) 6g CH3OH en 480g H2O
Se determinan los pesos molares de metanol y agua y se calcula el
nmero de moles de cada compuesto, dividiendo los gramos entre el
peso molar y los resultados se sustituyen en la ecuacin de fraccin
molar.
XCH 3OH
nCH 3OH
nCH 3OH nH 2O
0.1875
6.98 10-3
0.1875 26.66
XH 2O .993
X soluto X solvente 1 siempre
b) 4.13g de CH3OH en 48.6g de CCl4
El mismo procedimiento del problema anterior.
0.1290
0.20
0.1920 0.316
0.71
X CH 3OH
X CCl
(La fraccin molar es adimensional)
2.- Calcular la Molaridad de una solucin que contiene 2.78g de
Ca(NO3)2. 4H2O en 450 ml de solucin.
Se determina el peso molar del compuesto, y se determinan las moles,
el resultado se divide entre el volumen en litros y esta es la Molaridad.
Peso Molar 1(40) 2(14) 6(16) 8(1) 4(16)
236 g/mol
2.78
n
0.120 mol
236
n soluto
0.012 mol
M
.026 mol/L 0.026M
V. de solucin en L
0.45 L
3.- Calcular la molalidad de una solucin que contiene 13.0g de benceno
C6H6 en 17.0g de CCl4.
Q-811
52
Divisin de Ingeniera
Departamento de Fsica y Qumica
Se determina el peso molar del compuesto, y se determinan las
moles, el resultado se divide entre la masa en kilogramos y esta es la
molalidad.
PM 6(12) 6(1) 78g/mol
m
13
0.1 mol
78
nsoluto
0.16
9.8 mol/kg 9.8 m
Kg.disolvente 0.017
4.- Calcule el porciento en peso de soluto, de una solucin que contiene
3.25g de Ba(NO3)2 en 85.0g de agua.
Se divide los gramos de soluto entre los gramos de solucin, los
gramos de solucin son los gramos de soluto ms los gramos de
disolvente.
3.25
Porciento en peso
100 3.68%
3.25 85
5.- Calcule la molalidad de una solucin acuosa de H3PO4 al 35.4%
Para calcular la molalidad se necesitan los moles de H3PO4 y los
kilogramos de disolvente, de la concentracin de 35.4%, se sabe que en
100g de solucin hay 35.4g de H3PO4 y 64.6g de agua, los gramos de
H3PO4 se convierten a moles y los gramos de agua a kilogramos y se
sustituye en la ecuacin de molalidad.
Se toman 100g solucin
nsoluto
Kg.disolvente
35.4g H3PO4
64.6g H2O
Q-811
53
Divisin de Ingeniera
Departamento de Fsica y Qumica
PM H3PO 4 3(1) 1(31) 4(16) 98g/mol
35.4
0.361 mol
98
0.361
m
5.59 m
0.646
6.-Una solucin acuosa 2.45 M de metanol(CH3OH) tiene una
densidad de 0.976g/ml, calcule la molalidad de la solucin. (para
calcular la molalidad, se necesita conocer las moles de metanol y los
kilogramos de agua. De la concentracin 2.45M se sabe que hay 2.45
moles de metanol en 1.0L de solucin. Para conocer los gramos de agua:
se convierten las moles de metanol a gramos, con la densidad de la
solucin se determinan los gramos de la solucin y se resta a los gramos
de la solucin los gramos de metanol. Se sustituye en la ecuacin de
molalidad las moles de metanol entre los kilogramos de agua)
nsoluto
kg disolvente
2.45 mol de metanol
Pasar a gramos
1 litro de solucin
Pasar a gramos con densidad
2.45M
La suma de gramos de soluto y disolvente son los gramos de solucin y
se despeja los gramos de disolvente.
PM de metanol 1(12) 3(1) 1(16) 1(1) 32g / mol
gsoluto nsoluto PM (2.45mol )(32g / mol ) 78.4g
gsolucin (0.976g / mol )(1000ml ) .976gsolucin
gsolvente 976g 78.4g 897.6g
m nsoluto / kg disolvente 2.45/0.8976 2.73m
Ejercicios:
1.- Calcule la Molaridad de una solucin de glucosa (C6H12O6) 0.396m si
la densidad de la solucin es de 1.16g/ml.
Respuesta: 0.429M
Q-811
54
Divisin de Ingeniera
Departamento de Fsica y Qumica
2.- Calcule la fraccin mol y el porciento en masa de NH3 ,en una
solucin acuosa 4.3m.
Respuestas: X= 7.2x10-2 y % de NH3 = 6.8%.
3.- a) Cul es el porcentaje en peso de benceno, C 6H6, en una solucin
que contiene 8.75g de benceno y 25.0g de tetracloruro de carbono,
CCl4.
Respuesta: 25.9%
4- Calcular la fraccin molar del etilenglicol, C2H6O2 en las soluciones
siguientes:
a) 120g de C2H6O2 disueltos en 120g de agua
b) 120g de C2H6O2 disueltos en 1.20Kg de acetona, C3H6O.
Respuestas: a) 0.224, b) 0.0853
5- Calcular la molaridad de cada una de las soluciones siguientes:
a) 3.50g de NaOH en 0.650L de solucin
b) 2.50g de Co(NO3)2 .6H2O en 750mL de solucin
c) 20.0mL de H2SO4 6.0M diluido a 0.500L.
Respuestas: a) 0.135M; b) 0.0115M; c) 0.240M
6- Calcular la molalidad de cada una de las soluciones siguientes: a)
2.1g de azufre, S8, disueltos en 95.0g de naftaleno, C10H8; b)1.5 moles
de NaCl disuelto en 15.0 mol de agua.
Respuestas: a) 0.086m; b) 5.55m
7- Una solucin de cido sulfrico que contiene 571.6g de H2SO4 por
litro de solucin tiene una densidad de 1.329g/cm3. Calcular:
a) El porcentaje en peso
b) La fraccin molar
c) La molalidad
d) La molaridad del H2SO4 en esta solucin.
Respuestas: a) 43.0%; b) 0.122; c) 7.70m; d) 5.83M
8- El cido ntrico comercial tiene 69% de HNO3 en peso y tiene una
densidad de 1.42 g/ml. Cul es la molaridad de esta solucin?.
Respuesta 15.0M
9.- El amoniaco acuoso concentrado comercial tiene 29% de NH3 en
peso y tiene una densidad de 0.90 g/ml. Cul es la molaridad de esta
solucin?.
Respuesta 15.0M
Q-811
55
Divisin de Ingeniera
Departamento de Fsica y Qumica
10- Calcular la cantidad de moles de soluto de cada una de las
siguientes soluciones:
a) 60.0g de una solucin acuosa que tiene 1.25% de KI por peso
b) 250g de una solucin acuosa que tiene 0.460% en peso de NaCl
c) 600mL de H2SO4 1.25M.
Respuestas: a) 0.00452moles; b) 0.0197moles; c) 0.750 moles
Diluciones
La dilucin es un proceso en el cual a una solucin se le agrega
ms disolvente, manteniendo la misma cantidad de soluto, por lo que en
la solucin final, la cantidad relativa de soluto con disolvente ser menor
y se tendr una solucin de menor concentracin, esto es una solucin
diluida.
- Ejemplo:
Si se tienen 325ml de una solucin 0.45M de NaCl en agua, y se le
agregan 175mL agua, se tendran 500mL de solucin con una menor
concentracin.
Por lo tanto: Pasamos de una solucin de mayor concentracin a otra de
menor concentracin debido a que agregamos disolvente. Para calcular
la nueva concentracin se considera que el nmero de moles de
soluto(n), no cambi durante el proceso y por lo tanto se puede
despejar de la ecuacin de Molaridad e igualar, para obtener la ecuacin
con la que se puede calcular la nueva Molaridad.
M1
n
V1
M2
n
V2
M1V1 M2 V2
En este caso M1= 0.45M; V1= 325mL; V2= 325mL + 175mL= 500mL y
despejando M2 se tiene:
M2
M1V1
0.2925M
V2
Ejercicios:
1.- Describa como se pueden preparar 380ml de una solucin 0.4M de
azcar en H2O a partir de 35 litros de una solucin 0.59M de azcar en
agua..
Q-811
56
Divisin de Ingeniera
Departamento de Fsica y Qumica
Respuesta: de los 35 litros de la solucin 0.59M se toman
nicamente 258ml y se completan con agua hasta 380ml, es
decir se agregan 122ml de agua.
2.- Calcule el volumen de solucin 0.0500M de Ba(OH)2 que contiene el
mismo nmero de moles de Ba(OH)2 que 120 ml de una solucin
0.0800M de Ba(OH)2.
Respuesta 192ml.
Propiedades Coligativas de las Soluciones
Cuando un disolvente forma parte de una solucin, algunas de sus
propiedades fsicas se modifican, por ejemplo cuando se agrega azcar o
sal al agua al agua, el punto de ebullicin aumenta, es decir hierve a
una mayor temperatura, el punto de congelacin disminuye, se congela
a menor temperatura, la presin de vapor baja, que tan grandes son
estos cambios, depende de la cantidad de azcar y sal que se aada a la
cantidad de agua. Por lo que se puede definir a estas propiedades como:
Propiedades fsicas del disolvente que se modifican cuando se
agrega cierta cantidad de soluto (para esta parte solo se consideran
solutos no voltiles y no ionizables). Estos cambios dependen de la
cantidad de partculas y no del tipo. Estos cambios se pueden analizar a
nivel cualitativo y a nivel cuantitativo.
Para determinar si
cualitativamente
solo
aumenta
disminuye,
lo
hacemos
La presin de vapor
Disminuye
Menos molculas de disolvente
pasan a la fase de vapor por la
interaccin con las molculas de
soluto.
Punto de ebullicin
Aumenta
Se
necesita
una
mayor
temperatura para alcanzar la
temperatura de ebullicin.
Punto de congelacin
Disminuye
La
solucin
congela
temperatura menor
Presin osmtica
Aparece
Esta presin aparece cuando se
forma una solucin
una
Para determinar qu tan grandes son los cambios, se deducen las
ecuaciones con la que se pueden calcular, esto es cuantitativamente.
Q-811
57
Divisin de Ingeniera
Departamento de Fsica y Qumica
Disminucin de la Presin de vapor
Pvsolucin PROPORCIONAL
X disolvente
X disolvente X soluto 1
Psolucin Pdisolvente
X disolvente
X disolvente 1 X soluto
Psolucin Pdisolvente
(1 X soluto )
Psolucin Pdisolvente
- Pdisolvente
X soluto
Pdisolvente
Psolucin Pdisolvente
X soluto
Ley de Raoult
P Pdisolvente
Xsoluto
- Ejemplo:
La presin de vapor de H2O pura a 120C es de 1480mmHg. Si se sigue
la ley de Raoult. Qu cantidad en gramos de etilenglicol (C 2H6O2), se
deben agregar a 800g de H2O para reducir la presin de vapor a
760mmHg (procedimiento: para encontrar los gramos de etilenglicol, se
hace a partir de la ecuacin ms sencilla que es la de n= g/PM, de la que
se necesitan los moles, los cuales se pueden encontrar con la fraccin
molar, la que a su vez se obtiene de la ecuacin de la ley de Raoult, en
la que P se calcula con la diferencia de la presin de vapor del agua
menos la de la solucin).
Q-811
58
Divisin de Ingeniera
Departamento de Fsica y Qumica
PM de etilenglicol 2(12) 6(1) 2(16) 62g/mol
geg ? geg negPMeg X eg neg /neg nH2O
P X eg PH
dato
2O
P PH
Psolucin dato
2O
1)
P = PH2O - Psol
P = 1480mmHg -760mmHg
P = 720 mmHg.
2. -
720mmHg= Xeq (1480mmHg)
720 mmHg
Xeq= --------------------- = 0.486
1480mmHg
neg
3.- Xeq = ------------------ ==>
+ Xeg nH2O = neg ==>
neq + nH2O
Xeg( neq + nH2O ) = neg ===> Xeg neq
Xeg nH2O
==> neg - Xeg neq = Xeg nH2O ====> neg (1 - Xeg ) = Xeg nH2O ===>
neg = ----------(1 - Xeg )
neg= (44.4 )( 0.486) / 1- 0.486
etilenglicol ===> .
g = nPM = (42mol)(62g/mol )
2605.4g.
21.6/0.514
42 moles de
Ejercicios:
1.-Qu cantidad de C2H6O2 se debe de aadir a un kilogramo de Etanol
para reducir su presin de vapor en 9.5mm de Hg a 35C. La presin de
Q-811
59
Divisin de Ingeniera
Departamento de Fsica y Qumica
vapor del etanol a esta temperatura es de 100mmHg. Respuesta 141g
de C2H6O2
2.- Qu cantidad de KBr se debe de aadir a 120g de H2O para reducir
la presin de vapor a 1.50mmHg a 25C?.
Respuesta 26.75g de KBr.
3.- Qu cantidad de urea H2NCONH2 se debe de agregar a 450g de
agua a 25C para dar una disolucin cuya presin de vapor sea inferior
en 2.5mmHg.
Respuesta 176.0g de urea
Aumento del punto de ebullicin:
Teb
nsoluto
Kgdisolv
Tebm
Teb Kebm
0
Teb Teb Teb
Disminucin en el punto de congelacin:
Tc
nsoluto
Kgdisolv
Tcm
Tc K c m
Tc Tc0 TCsolucion
- Ejemplo
Calcule el punto de congelacin de una solucin que contiene 600g de
CHCl3 y 42 g de eucaliptol C10H18O una sustancia fragante que se
encuentra en las hojas del eucalipto. Para cloroformo (CHCl3)
kc=4.68C/m y la Tc =-63.5C. (procedimiento se necesita el T, que se
calcula con la ecuacin correspondiente de las propiedades coligativas,
para la cual se necesita la molalidad, la que se calcula con los datos
dados).
Q-811
60
Divisin de Ingeniera
Departamento de Fsica y Qumica
Tc = Tdisolvente - Tsolucion
de tablas
TC= kcCHCl3m
n=g/PM
n soluto
m
Kg disolv
PM de eucaliptol = 10(12) + 18(1) + 1(16) = 154g/mol.
n de eucaliptol = (42g)/(154g/mol)= 0.273 mol
m= 0.273mol / 0.600Kg = 0.454m.
0.454m) = 2.13C
Tc = Tsolvente - Tsolucion
Tc = ( 4.68 C/m)(
Tsolucion= Tsolv - Tc
Tcsolucion = -63.5 - 2.13= -65.6C
Ejercicios:
1.- Calcule la presin de vapor a 25C, el punto de congelacin y el
punto de ebullicin de una solucin acuosa de sacarosa 1.25m. Consulte
las constantes en su libro de texto.
Respuestas: Teb=100.65C, Tc=-2.32C, P=23.3mmHg=3.1x10-2atm.
2.- El alcanfor C10H16O funde a 179.8C, su constante de abatimiento de
congelacin es de 40C/m. S cuando se disuelven 0.186g de una
sustancia orgnica desconocida en 22.01g de alcanfor lquido, el punto
de congelacin de la solucin es de 176.7C, Cul es el peso molar
aproximado de la sustancia orgnica?
Respuesta PM=108.8 g/mol
Presin Osmtica
La smosis es un proceso en el cual las molculas de disolvente
pasan de una solucin de menor concentracin a otra de mayor
concentracin a travs de una membrana que solo permite el paso de
molculas de disolvente conocida como membrana semipermeable. La
finalidad es la de igualar las concentraciones y ser ms estables. Para
evitar que ocurra la smosis, se necesita aplicar una presin que se
conoce como presin osmtica.
Si las soluciones que estn en contacto, separadas por una membrana
semipermeable, tienen la misma presin osmtica, se dice que las
Q-811
61
Divisin de Ingeniera
Departamento de Fsica y Qumica
soluciones son isotnicas, y no se presenta el fenmeno de smosis. Si
una solucin es de menor presin osmtica se le conoce como hipotnica
con respecto a la de mayor concentracin que se le conoce como
hipertnica..
La presin osmtica sigue una ley similar a la de los gases ideales, ya
que el soluto se puede considerar como el responsable de la aparicin de
la presin y se encuentra en pequeas cantidades, como lo sera un gas
en un volumen muy grande.
nsoluto / L de solucin = M
T
= MRT T en escala Kelvin
R= 0.082 atm l/molK
Ejercicios:
1.- Una solucin diluida de un azcar desconocida se prepar con
16gramos del azcar desconocido y suficiente agua para formar 0.200L
de solucin, si la presin osmtica de la solucin es de = 2.86atm a
25C, calcule el Peso Molar del azcar desconocido. Respuesta:
684g/mol
2.- La lisozima es una enzima que rompe las paredes de las clulas
bacterianas. Una solucin que contiene 0.150g de esta enzima en
210mL de solucin, tiene una presin osmtica de 0.953mmHg a 25C,
determine el peso molar de esta sustancia.
Respuesta: 1.39 x104 g/mol
Propiedades Coligativas de Compuestos Inicos
H2 O
NaCl Na Cl
1mol
1mol
+
1mol
1mol
2moles
Factor de vant Hoff
Indica el nmero de partculas de un compuesto Inico:
i= # de partculas de un compuesto.
P= XPi
Q-811
Teb = Kebmi
Tc = Kcmi
= MRTi
62
Divisin de Ingeniera
Departamento de Fsica y Qumica
Valores de i ideales:
NaCl
FeCl3
CaO
Na2SO4
Al2O3
Al(OH)3
i
i
i
i
i
i
=
=
=
=
=
=
2
4
2
3
5
4
- Ejemplo:
Determine la presin osmtica de una solucin de
20C
=?
CuSO4 0.0020M a
= MRTi
Cu2+
i=2
(SO4)2= (0.0020M)(0.082 atm / k mol )(293K)(2) = 0.096atm.
Ejercicio:
1- El agua de mar contiene 3.4g de sales por cada litro de solucin.
Considerando que el soluto es nicamente NaCl (ms del 90% lo es),
determine la presin osmtica del agua de mar a 20C.
Respuesta: 2.8atm
Q-811
63
Divisin de Ingeniera
Departamento de Fsica y Qumica
Termoqumica.
Objetivos Especficos:
Analizar los cambios de energa involucrados en los procesos qumicos.
6.1 Definir la primera ley de la termodinmica y su funcin de estado.
6.2 Aplicar la primera ley de la termodinmica para calcular los
cambios de entalpa en las reacciones qumicas y en calorimetra
6.3 Definir la segunda ley de la termodinmica en trminos de la
entropa
6.4 Calcular las diferencias de energa libre en reacciones qumicas
para predecir la espontaneidad de las mismas.
La termodinmica tiene cuatro leyes fundamentales para el estudio de la
energa tanto en proceso fsicos como en procesos qumicos y toma la
ley de la conservacin de la energa para enunciar lo que se conoce
como la primera ley de la termodinmica, la segunda ley est
relacionada con la direccin natural de los procesos y el orden de los
sistemas, la tercera con la referencia para determinar el cero de
desorden, y la combinacin de estas leyes determinar si un proceso es
o no espontaneo.
La Termodinmica estudia los cambios de energa y la relacin
entre ellas tanto en procesos fsicos como en procesos qumicos
.
La Termoqumica es la parte de la termodinmica que estudia los
cambios de energa en las reacciones o procesos qumicos.
Tanto los proceso fsicos como los procesos qumicos pueden ser
exotrmicos (E= -) o endotrmicos (E=+).
- Ejemplo de proceso fsico:
H2O(l) H2O(g)
H2O(g) H2O(l)
Endotrmico ( + )
Exotrmico
(-)
- Ejemplo de proceso qumico:
Q-811
64
Divisin de Ingeniera
Departamento de Fsica y Qumica
C4H10(g) + O2(g) H2O(g) + CO2(g)
Exotrmico
H2O(g) H2(g) + O2(g)
Endotrmico
La primera ley de la termodinmica establece que la energa no se crea
ni se destruye solo se transforma esto es que la energa del universo es
constantes .
Euniv. = Constante
De este universo de energa solo estudiaremos una parte.
La Ley cero de la termodinmica, recibe ese nombre debido a que fue
enunciada despus que la primera ley, pero se vio que era ms
fundamental. Esta ley cero dice que el l calor fluye de un cuerpo de
mayor temperatura a uno de menor temperatura hasta alcanzar el
equilibrio trmico.
Sistema: Parte del universo en estudio.
Entorno o alrededores: Lo que resta, lo dems.
Esist + Ealrededores = Euniv = cte.
Esist i + Eentorno i = Euniv.
Esist F + Eentorno F = Euniv.
(Esist F - Esist 0) + (Euniv F - Ealred. 0) = Euniv F - Euniv 0 = 0
Esist = -Ealred.
Esta ecuacin nos dice que lo que gana o pierde de calor el sistema, lo
pierde o lo ganan los alrededores y que solo hay un intercambio de
calor.
Los sistemas para su estudio se pueden clasificar en tres tipos:
Sistemas abiertos:
alrededores.
Sistemas cerrados:
alrededores.
Hay
intercambio
de
masa
energa
con
Solo hay intercambio de energa con los
Sistemas Aislados: No hay intercambio ni de masa ni de energa.
Q-811
65
Divisin de Ingeniera
Departamento de Fsica y Qumica
Para iniciar con el estudio de la energa en los sistemas qumicos, se
necesita conocer la definicin de energa que es de dos maneras:
Energa. Es la capacidad de realizar trabajo
Es la capacidad de transmitir calor.
A partir de estas definiciones se observa que para determinar el cambio
de energa de un sistema se necesita sumar el calor y el trabajo que
entran o salen del sistema.
Esist = Einterna sistema
E = q + w
Para determinar si entra o sale calor y si entra o sale trabajo del sistema existe una
convencin de signos:
q y w son positivos (+) cuando entran al sistema
q y w son negativas (-) cuando salen del sistema.
Propiedades termodinmicas del sistema son aquellas que definen a
un sistema y lo diferencian de otro.
Por ejemplo: q, w, m, V, T, P, E.
Dentro de las propiedades termodinmicas hay algunas que no les
importa el camino por el cul se hace un cambio al sistema, sino
nicamente su estado final e inicial y que por lo tanto se pueden evaluar
mediante un incremento ( estas se les conoce como funciones de
estado.
- Ejemplos de Funciones de estado:
V=(Vf -Vo)
T=(Tf - To)
P=(Pf - Po)
E=(Ef - Eo)
w y q no son funciones de estado
Q-811
66
Divisin de Ingeniera
Departamento de Fsica y Qumica
Las unidades de q y w son:
w Joules Nm
w L atm.
1L atm
1.013 105 N 1m3
101.3 Joules
1000
1atm 1m2
Calora (q)
Es la cantidad de calor necesaria para aumentar 1C 1g de agua de
14.5C a 15.5C
1cal = 4.184Joules
- Ejemplo:
Al comprimir un gas se realiza un trabajo de 462 Joules. Durante el
proceso se transfieren al entorno 30.58 caloras, calcular E.
Solucin: como se est comprimiendo el gas, quiere decir que los
alrededores hacen el trabajo sobre el sistema para comprimirlo y que
sale calor del sistema, por lo que el trabajo es positivo y el calor es
negativo. Para poder sumar las dos cantidades se necesita tener las
mismas unidades.
4.184 Joules
127.95 Joules
1 cal
1 cal
462 Joules
110.42 cal
4.184 Joules
E = q + w
30.58 cal
En Joules:
E= 462 + ( -127.95)= 334.05 Joules
En caloras
E= 110.42 + (-30.58) = 79.84 cal
Q-811
67
Divisin de Ingeniera
Departamento de Fsica y Qumica
Ejercicio:
Un gas se expande a temperatura constante y realiza un trabajo sobre
los alrededores de 325J. Al mismo tiempo absorbe 127 J de calor de los
alrededores. Calcule el cambio de energa del gas.
Como q y w no son funciones de estado se necesita saber cmo
determinarlas:
Como medir W:
W F dr
Producto punto:
A B A B Cos
l2
W F dlCos180
l1
l1
W F dl Fl
l1
l2
F (l 2 l1 )
l2
W F (l 2 l1 )
A
A
W = -PV
- Ejemplo
Cierto gas a temperatura ambiente experimenta una expansin de un
volumen Vo=2.0 a Vf=6.0. Calcule el Trabajo realizado por el gas si
se expande:
a) en contra del vaco
b) en contra de una presin externa de 0.5atm
c) en contra de una presin externa de 1.5atm
a) W = -0 (6.0 - 2.0) = 0 atm
b) W = -0.5 (6.0 - 2.0) = -2.0 -atm
c) W = - 1.5 ( 6.0 - 2.0) = -6.0 -atm
Q-811
68
Divisin de Ingeniera
Departamento de Fsica y Qumica
Como medir calor: A partir de la definicin de calora, se pueden
obtener otras definiciones en las que no se involucre el agua.
1Calora 1C, 1g de H2O
Calor especfico: cantidad de calor necesaria para elevar 1C un gramo
de alguna substancia se representa por la letra S y sus unidades son
J/gC
Capacidad calorfica: cantidad de calor necesaria para elevar 1C
cualquier cantidad de muestra se representa por la letra C = mS sus
unidades son J/C
Calor: cantidad de energa para elevar en cualquier temperatura
cualquier cantidad de masa:
q = mST (en Joules)
m = masa en gramos;
S = calor especfico J/C;
T = diferencia de temperatura en C.
Ejemplos:
Un trozo de Ag cuya masa es de 362g. Tiene una C = 85.7 J/C , Cul es
el calor especfico de la plata?
solucin: se despeja de la ecuacin la S y se sustituye
C 85.7 J / C
0.2367 J / g C
m
362 g
Ejercicio:
1.-El calor especfico del xido de Fierro(III) es 0.75J/g C
a) Cul es la capacidad calorfica de un bloque de 2Kg de Fe2O3.
Respuesta 1500 J/g
b) Cul es la cantidad de calor necesaria para aumentar la temperatura
de 1.75g de Fe2O3 de 25C a 380C?.
Respuesta 466 J
Q-811
69
Divisin de Ingeniera
Departamento de Fsica y Qumica
2.- El calor especfico del etanol es de 2.46 J/gC, determine los joules
de calor que se desprenden al enfriar 193g de etanol de 35.00C a
19.00C.
Respuesta 7600 J
Formas de medir calor en Reacciones Qumicas
Para medir calor en las reacciones qumicas, se tienen dos maneras de
hacerlo, a volumen constante y a presin constante en un equipo
llamado calormetro, el de volumen constante se le llama tambin
calormetro bomba, al de presin constante se le conoce como
calormetro de la taza de caf.
Para determinar el calor de una reaccin en el calormetro bomba, se
coloca la muestra en un recipiente tapado y que contiene una resistencia
elctrica, este recipiente se rodea de agua contenida en otro recipiente
cerrado que tiene adems un agitado y un termmetro, todo el sistema
se encuentra aislado, por lo que se considera que no hay intercambio de
calor ni de masa con los alrededores, se quema la muestra mediante la
resistencia elctrica, y la temperatura del agua se incrementa. El calor
de la reaccin se calcula de la siguiente manera:
qsist = qreac + qH2O + qcalormetro
qsist = 0 = qreac + ( qH2O + qcalormetro )
qreac = -(qH2O + qcalormetro )
qH2O = mH2OSH20T
qcalormetro = mcalormetroScalormetroT
qcalormetro = CcalormetroT
qreac = -(mH2OSH20T + CcalormetroT )
- Ejemplo:
En una bomba calorimtrica se quema a volumen constante 1.435g de
naftaleno en consecuencia la temperatura del agua aumenta de 20.17
grados a 25.84 grados. Si la cantidad de H2O del calormetro es de
Q-811
70
Divisin de Ingeniera
Departamento de Fsica y Qumica
2000g y C del calormetro es de 1.8KJ/C, calcule qcombustin del naftaleno
(C10H8).
Por cada gramo de naftaleno
Por cada mol de naftaleno
Solucin: se sustituye en la ecuacin y despus con reglas de tres
factores de conversin se determina por cada gramo y por cada mol.
qr
=-[(2000g)(4.184J/gC)(25.84C-20.17C) + (1800J/C)(25.84C20.17C)]= -57600J
x
peso molar de naftaleno = 10(12) + (8)( 1) = 128g/mol
1.435g-------57600J
1.00g-------x = -39480J/g
n=1.435g / 128g/mol=0.0112moles-----57000j
1.00 moles--------x=- 5138 kJ/mol
Ejercicios:
1.-Se quema una muestra de 0.5865g de cido lctico ( C3H6O3 ) en un
calormetro bomba cuya C= 4.812kJ/C, en consecuencia la temperatura
del agua se incrementa de 23.10C a 24.95C, calcule qC3H6O3 por cada
gramo y por cada mol.
Respuesta: -13.19kJ/g; -1187kJ/mol
2.- Una muestra de 1.80g de octano C8H18 se quemaron en una bomba
calorimtrica cuya C era de 11.66kJ/C, en consecuencia la temperatura
se elev de 21.36C a 28.78C. Cul es el calor de combustin de esta
reaccin?.
Respuesta: -5475kJ/mol
3.-Bajo condiciones de volumen constante el calor de combustin del
cido benzoico es 26.38kJ/g. Una muestra de 12g se quem en una
bomba calorimtrica, en consecuencia la temperatura del calormetro se
elev de 22.45C a 26.10C.
a) Cul es la capacidad calorfica total del calormetro?.
Q-811
71
Divisin de Ingeniera
Departamento de Fsica y Qumica
Respuesta 86.73 kJ/C
c) Si tena 1500g de H2O Cul es la C del calormetro sin agua?.
Respuesta 84.50kJ/C.
d) Qu aumento de temperatura se puede esperar si haba 1000g de
H2O?.
Respuesta. 3.74C
En el calormetro de la taza de caf o de presin constante, en el mismo
recipiente, el cual est aislado trmicamente y provisto de termmetro
y agitador, se mezclan las dos soluciones que van a reaccionar y se
mide la temperatura de la mezcla de reaccin, el sistema se considera
aislado y el calor especfico de la solucin generalmente se considera
como el del agua, al igual que la densidad de la mezcla de reaccin como
la del agua. La ecuacin quedara de la siguiente forma:
qreac = -(mreac.SreacT + CcalormetroT)
- Ejemplo
50mL de una solucin 0.100M de HCl se mezclan con 50mL de una
solucin 0.100M de AgNO3, en un calormetro a presin constante con
una C de 227J/C, si la temperatura inicial de ambas soluciones es de
22.5C y la temperatura final de la mezcla de reaccin es de 23.03C.
Calcule el qreac por cada mol suponiendo que Sreac y la densidad son las
del agua.
Solucin: sustituyendo directamente en la ecuacin se obtiene el
resultado del calor de la reaccin, para hacerlo por mol se calcula el
nmero de moles de HCl y con una regla de tres se encuentra el
resultado).
qreac = -[(100g)( 4.184J/gC)(23.03C-22.5C) + (227J/C)(23.03C 22.5C)]=342.06J
n= MV=(0.100mol/L)(0.050L)= 0.005mol
0.005mol
1.00mol
Q-811
----- 342.06J
----- x= 68412J/mol
72
Divisin de Ingeniera
Departamento de Fsica y Qumica
Ejercicios
1.-200mL de una solucin 0.862M de HCl se mezclan con 200mL de una
solucin 0.431M de Ba(OH)2, en un calormetro a presin constante que
tiene una capacidad calorfica de 453J/C.
La temperatura inicial de ambas soluciones es la misma de 20.48C.
Sabiendo que el calor de neutralizacin para el proceso:
H+(ac) + OH-(ac) H2O(l) es de -56.2 kJ. Determine la temperatura final
de la solucin mezclada.
Respuesta: 25.03C
2.-Cuando una muestra de 6.50g de NaOH slido se disuelve en 100g de
H2O en un calormetro de taza de caf, la temperatura se eleva de
21.6C a 37.8C. calcule el calor para el proceso de disolucin en
kJ/mol.
NaOH(s) + H2O(l) Na+(ac) + OH-(ac) ,
considere el calor especfico de la solucin como el del agua.
Respuesta: - 44.4kJ/mol
Entalpa
De las dos formas de medir calor, la medicin de calor a presin
constante resulta ser una funcin de estado, y por lo tanto su cambio se
puede evaluar si se conoce su valor al principio y al final de un proceso,
sin importar el camino por el cual se realiz este cambio, y para
distinguirlo se le da el nombre de entalpa y se le representa como H.
Para evaluara un cambio en un proceso H = Hf - Hi
Si la reaccin que se lleva a cabo en el calormetro es con elementos en
su estado ms estable, y se forma solo una mol de producto, en
condiciones estndar, el calor que desprende esta reaccin se le conoce
como Entalpa molar estndar de formacin, que se define como el calor
necesario para formar una mol de un compuesto a partir de elementos
en su estado ms estable, por ejemplo para el agua, la formacin de una
mol de agua a partir de una mol de hidrgeno y media mol de oxgeno
desprende 241 kJ de calor.
H2 + O2 H2O
Hf = -241.8 kJ/mol
Por lo que lo que la entalpa molar estndar de formacin (conocido
tambin como Calor molar estndar de formacin, calor molar de
formacin o simplemente Calor de formacin)
Para el agua ( Hf ) es de -241.8 KJ/mol.
Q-811
73
Divisin de Ingeniera
Departamento de Fsica y Qumica
En este caso la entalpa de la reaccin corresponde a la entalpa de
formacin del agua, ya que para evaluar el cambio de entalpa de la
reaccin, con la resta de final menos inicial, a los elementos en sus
estado ms estable, que en este caso son los reactivos, se les toma
como referencia asignndoles un valor de cero de entalpa, por lo que los
valores de entalpa de formacin sern relativos.
Hreac = Hf = Hfprod
- Hfreactivos
( indica condiciones estndar termodinmicas que son 1atm y 25C)
Cuando en una reaccin no participan nicamente elementos en su
estado ms estable y adems se generan ms productos, la entalpa de
los reactivos es diferente de cero y habr ms valores de entalpa en los
productos. Para calcular la entalpa en estos casos, existe la ley de Hess
que nos dice como calcular el Hreac.
Esta ley de Hess se puede enunciar de dos maneras, lo que generan dos
mtodos para calcular las entalpas de las reacciones.
A partir de calores de formacin y a partir de calores de reacciones
intermedias.
Primera forma a partir de calores de formacin:
Dice que la entalpa de una reaccin se calcula con la suma de los
calores de formacin de los productos multiplicados por su coeficiente
estequiomtrico menos la suma de los calores de formacin de los
reactivos multiplicados por su coeficiente estequiomtrico,
LEY DE HESS:
0
H reac
mH 0fprod nH 0freact
Ejemplo:
Calcular la entalpa de la reaccin de combustin del metano en
condiciones estndar.
Los pasos son los siguientes:
1.- Balancear la ecuacin.
2.- Buscar los valores de los
calores de formacin de los
productos y de los reactivos en la tabla de datos
termodinmicos. (apndice 3 del libro de texto).
3. Multiplicar cada valor de entalpa de formacin de productos y
reactivos por su coeficiente estequiomtrico.
4. Sumar los resultados anteriores de reactivos con reactivos y
productos con productos.
Q-811
74
Divisin de Ingeniera
Departamento de Fsica y Qumica
5. Restar la suma de los reactivos a la de los productos.
1.-
CH4
2O2 CO2
2H2O
2.- -74.1
0
-393.5
-241.8 ( kJ/mol)
(estos valores son datos tomados del apndice del libro de texto)
3.- H0reac = [(1)(-393.5kJ/mol) + (2)(-241.8kJ/mol)]
74.1kJ/mol) + 2(0kJ/mol)]
H0reac= -877.1kJ + 74.1kJ
H0reac= -803kJ
(El signo menos indica que se libera calor)
[(1)(-
Ejercicio
Calcule la entalpa de las siguientes reacciones en condiciones estndar:
a) CH3OH(l) + O2(g) CO2(g) + H2O(l)
b) C6H12(l) +
O2(g) CO2(g) + H2O(l)
H0f para C6H12(l) = - 151.9 kJ/mol
Respuesta:
a)-1452.8kJ
b)-3924kJ
Segunda forma de calcular entalpa, a partir de calores de
reacciones intermedias:
En esta forma la entalpa de reaccin es la suma de las entalpas de las
reacciones intermedias que dan por resultado la reaccin deseada.
Segunda forma de ley de Hess
H0reac=H0reac
Para poder aplicar esta segunda forma, antes es necesario conocer tres
propiedades de la entalpa, que son las siguientes:
Caractersticas de la Entalpa
Es una cantidad termodinmica que depende de la masa , es decir es
una propiedad extensiva de las reacciones. Si se coloca un mol de
metanol se tendr un valor de entalpa, pero si se colocan tres moles
de metanol se tendr el triple de entalpa.
Ejemplo:
Q-811
75
Divisin de Ingeniera
Departamento de Fsica y Qumica
CH4+2O2 CO2 + H2O
3CH4+6O2 3CO2+6H2O
H0rxn= - 803kJ
H0rxn= -2409kJ
Para aplicar esta propiedad se hace de la siguiente forma:
Cuando una ecuacin balanceada se multiplica por un nmero, el H0reac
de la reaccin se multiplica por el mismo nmero.
Es una cantidad que depende de la direccin de la reaccin, debido a
que una reaccin que es exotrmica en una direccin ser
endotrmica si se invierte, por lo que se puede calcular H0rxn para el
inverso de la reaccin:
CH4(g)+2O2(g) CO2(g) + 2H2O(g)
CO2(g)+H2O(g) CH4(g)+2O2(g)
H0rxn= -803kJ
H0rxn= 803kJ
Para aplicar esta propiedad se hace de la siguiente forma:
Si se invierte la direccin de una reaccin, se cambia el signo.
Es una cantidad que depende del estado fsico de productos y
reactivos, por ejemplo, si se tiene agua en una reaccin como
producto, si se obtiene en estado lquido el valor de la entropa de la
reaccin ser mayor que si se encuentra en forma gaseosa, ya que el
agua al pasar del estado gaseoso al estado lquido, se libera ms
calor en la reaccin.
CH4(g)+2O2(g) CO2(g) + 2H2O(g)
CH4(g)+2O2(g) CO2(g) + 2H2O(l)
H2O(g) H2O(l)
H0rxn=-803kJ
H0rxn=-890.3kJ
H0condensacin= -43.2kJ
Para aplicar esta propiedad se debe tener cuidado con el estado fsico de
productos y reactivos. Para poderlos eliminar un producto con un
reactivo deben tener el mismo estado fsico.
Aplicando estas tres propiedades se puede calcular el H0 de una
reaccin si se conocen los valores de H0 de las reacciones intermedias
que sumadas den como resultado la reaccin que se quiere calcular.
Ejemplo: Calcule el H0reac de la reaccin indicada, utilizando las
ecuaciones y H0 de las reacciones indicadas:
Cgrafito(s)
+ H2(g) CH4(g)
H0rxn= ?
Cgrafito(s) + O2(g) CO2(g)
H2(g) + 1/2O2(g) H2O(l)
Q-811
H0rxn= -393.5kJ (1)
H0rxn= -285.8kJ (2)
76
Divisin de Ingeniera
CH4(g)
Departamento de Fsica y Qumica
+ 2O2(g) CO2(g) + 2H2O(l)
H0rxn= -890.3kJ (3)
El procedimiento ser el siguiente:
1. Balancear la ecuacin principal, las reacciones intermedias
deben estar balanceadas.
2. Localizar los reactivos y productos de la reaccin principal en
las reacciones intermedias.
3. Realizar los cambios necesarios en las reacciones intermedias
de acuerdo a la reaccin principal. Los cambios que se le
hagan a las reacciones se le deben hacer tambin a la
entalpa.
4. Si los reactivos y productos de la reaccin principal aparecen
en ms de una reaccin intermedia, se toma como base
aquella reaccin intermedia que contenga un reactivo o
producto que no se repita en las otras reacciones y se hacen
los cambios necesarios a esta reaccin para que se ajuste a la
reaccin principal.
5. Se eliminan los trminos comunes de las reacciones
intermedias, cancelando reactivos con productos, o sumando
reactivos con reactivos y productos con productos.
6. Se escribe la ecuacin final sumando los reactivos y los
productos que quedaron y se calcula la entalpa de la reaccin
sumando la entalpa de las reacciones intermedias.
1.- Balancear:
Cgrafito(s)
2H2(g) CH4(g)
2.- Localizar:
(1)Cgrafito(s) + O2(g) CO2(g)
H0rxn= -393.5kJ (1)
(2)H2(g) + 1/2O2(g) H2O(l)
(3)CH4(g)
H0rxn= -285.8kJ (2)
+ 2O2(g) CO2(g) + 2H2O(l)
H0rxn= -890.3kJ
3.- Cambiar: La ecuacin uno se queda igual, la ecuacin 2 se multiplica
por 2 y la ecuacin 3 se invierte.
(1)Cgrafito(s) + O2(g) CO2(g)
H0rxn= -393.5kJ (1)
(2)2H2(g) + O2(g) 2H2O(l)
H0rxn= -571.6kJ (2)
(3)CO2(g) + 2H2O(l) CH4(g)
Q-811
+ O2(g)
H0rxn= +890.3kJ
77
Divisin de Ingeniera
Departamento de Fsica y Qumica
4.- En este caso no se aplica.
5.- Eliminar:
(1)Cgrafito(s) + O2(g) CO2(g)
(2)2H2(g) + O2(g) 2H2O(l)
(3)CO2(g) + 2H2O(l) CH4(g) + 2O2(g)
6.- Sumar: Cgrafito(s)
H0rxn= -393.5kJ (1)
H0rxn= -571.6kJ (2)
H0rxn= +890.3kJ (3)
2H2(g) CH4(g)
H0rxn= - 74.8kJ
Ejercicios:
1.- Calcular la Entalpa estndar de formacin para la formacin de etino
a partir de las siguientes reacciones:
2C2H2(g) + 5O2(g) 4CO2 + 2H2O(l)
C(s) + O2(g) CO2(g)
2H2(g) + O2(g) 2H2O(l)
C(s) + H2(g) C2H2(g)
__CO2(g)+___H2O(l)
___C(s) + ___O2(g)
__H2(g) + ___O2(g)
___C(s) + ___H2
H0rxn=-2599.92kJ
H0rxn=-393.5kJ
H0rxn=-571.8kJ
H0reac= ?
___C2H2(g) + ___O2(g)
___CO2(g)
___H2O(l)
___C2H2(g)
H0rxn=_______
H0rxn=_______
H0rxn=_______
H0rxn=_______
H0rxn=_____?
2.- Calcular la Entalpa estndar de reaccin para la siguiente ecuacin a
partir de las siguientes reacciones:
N2H4(l) + O2(g) N2(g) + H2O(l)
a partir de:
a) 2NH3(g) + 3N2O(g) 4N2(g) + 3H2O(l)
b) N2O(g) + 3H2(g) N2H4(l) + H2O(l)
c) 2NH3(g) + O2 (g) N2H4(l) + H2O(l)
d) H2(g) + O2(g) H2O(l)
Q-811
H0rxn=-1010kJ
H0rxn=-317kJ
H0rxn=-143kJ
H0rxn=-286kJ
78
Divisin de Ingeniera
___NH3(g) + ___N2O(g
___N2H4(l) + ___H2O(l)
___N2H4(l) + ___H2O(l)
___H2(g) + ___O2(g)
___N2H4(l) + ___O2(g)
Departamento de Fsica y Qumica
___N2(g) + ___H2O(l)
___N2O(g) + ___H2(g)
___NH3(g) + ___O2 (g)
___H2O(l)
___N2(g) +___ H2O(l)
H0rxn=______
H0rxn=______
H0rxn=______
H0rxn=______
H0rxn=______
H0rxn=_____?
Respuestas: 1) 226.6 kJ; 2) -622.5kJ
Una aplicacin muy importante de la entalpa es su relacin con la
espontaneidad de una reaccin.
una reaccin espontnea es aquella que se lleva a cabo bajo las
condiciones planteadas.
La entalpa nos da una primera aproximacin acerca de si una reaccin
es o no espontanea. As tenemos por ejemplo si:
H es negativa: exotrmica Generalmente espontnea
H es positiva: endotrmica Generalmente no espontnea
Como nos podemos dar cuenta, la entalpa no asegura si una reaccin es
o no espontanea, por lo que para poder determinar la espontaneidad de
una reaccin, se necesit de otra cantidad termodinmica. Esta cantidad
surge con la segunda ley de la termodinmica y es la entropa,
representada por la letra S que se define como la medida del desorden
de un sistema.
Esta segunda ley de la termodinmica est relacionada con la direccin
natural de los procesos, que nos dice que entre ms desorden se genere
en el universo debido a un proceso, este proceso ser espontaneo. Pero
el aumento de entropa del universo se puede deber a que el sistema o
los alrededores se desordenaron, y por lo tanto aun cuando se ordene
un sistema el sistema puede ser espontaneo, por lo que para determinar
si una reaccin es espontanea o no se necesitan combinar las dos
cantidades termodinmicas relacionadas con la espontaneidad.
El enunciado de esta segunda ley nos dice que :Para un proceso
espontneo, la entropa del universo va en aumento.,
nuevamente, solo se estudia un sistema, y la entropa del universo
puede ser positiva, aun cuando el sistema tenga un cambio de entropa
negativo.
Suniverso > 0
Ssistema + Salrededor = Suniverso
Q-811
79
Divisin de Ingeniera
Departamento de Fsica y Qumica
Sgas > Slquido > Sslido
Los gases tienen mayor movimiento y desorden por lo tanto mayor
entropa que los lquidos y estos a su vez mayor que la de los slidos.
S(+) (mayor entropa) generalmente la reaccin es espontnea
S(-) (menor entropa) generalmente la reaccin es no espontnea
Para determinar los valores de entropa se considera que un cristal puro
y perfecto a 0K no presenta desorden por lo que tendr cero de
entropa, esto quiere decir que los valores de entropa son absolutos, ya
que se conoce dnde est el cero de entropa.
Tercera ley de la Termodinmica
La Entropa de un cristal puro y perfecto a cero Kelvin es cero Joule
sobre mol kelvin.
Para medir la Entropa de una reaccin qumica se toman los datos de
entropa de las tablas y se aplica la ecuacin siguiente:
S0reac = aS0prod - bS0reac
( a y b son los coeficientes estequiomtricos de los reactivos y de los
productos). Los valores de entropa se toman del apndice del libro de
texto
Ejemplo.- Calcule la entropa de la siguiente reaccin
CH4(g)
+
2O2(g)
CO2(g) +
2H2O(g)
0
S = 186.19
205
213.6
188.7 (J/mol
K)
S0reac =
[(1mol)(213.6 J/mol K) +
(2mol)(188.7 J/mol K)] [(1mol)(186.19 J/mol K) + (2mol)(205 J/mol K)]= -5.19 J/K
Ejercicio
Calcule la entropa de la siguiente reaccin:
a) N2(g) + H2(g) NH3(g)
Respuesta: -199J/K
b) NH4Cl(s) NH3(g) + HCl(g)
Respuesta: 203.74 J/K
Para determinar si una reaccin es espontanea o no, se tienen que
relacionar la entalpa y la entropa, esto se logra con la Ecuacin de
Q-811
80
Divisin de Ingeniera
Departamento de Fsica y Qumica
Gibbs-Haltmotz, que dice ya con certeza si una reaccin es espontanea o
no.
G=H - (TS)
donde:
G es la Energa libre de Gibbs,
T es la temperatura absoluta en Kelvin, y si:
G=(-)
G=(+)
G=0
la reaccin es espontnea
la reaccin es no espontnea
la reaccin est en equilibrio dinmico (Tema 7)
Si las mediciones de H y de S se hacen en condiciones estndar la
energa libre de Gibbs tambin ser estndar y se tendr la siguiente
ecuacin:
G0=H0 - (S0)(T)
esta energa tambin se puede calcular, a partir de las energas libres de
formacin, de los productos y de los reactivos de acuerdo a la siguiente
ecuacin:
G0reac=mG0f prod - nG0f react
Los valores de G0f son de tablas. La energa libre estndar de
formacin de un compuesto es el cambio de energa que ocurre cuando
se forma un mol de un compuesto a partir de elementos en su estado
ms estable, a los elementos se les asigna un valor de cero de energa
libre y los valores obtenidos de cambios de energa libre son
nuevamente relativos como los de entalpa.
Para determinar si una reaccin que no es espontanea a una
temperatura podra ser espontanea a otra temperatura, se analizan los
valores de entalpa y entropa como sigue:
Relacin Espontaneidad Temperatura
H(-)
S(+)
G(-)
Siempre espontnea
H(-)
S(-)
G(-)
Espontnea a bajas temperaturas
H(+) S(+)
G(-)
Solo espontnea a altas temperaturas
H(+) S(-)
G(+)
Nunca espontnea
Q-811
81
Divisin de Ingeniera
Departamento de Fsica y Qumica
- Ejemplo
Diga si la siguiente reaccin es espontnea a 25C si no lo es a que
temperatura ser espontanea:
NH3(g) H2(g) +
N2(g)
H=
-80.3
0
0
(J/mol K)
S =
111.3
131.0
191.5 (J/mol K)
G=
-26.5
0
0
(J/mol K)
Procedimiento:
1.- Balancear la ecuacin.
2.- Calcular G.( con cualquiera de las dos ecuaciones).
3.- Si es no espontanea se calcula la temperatura
espontaneidad.
a) Calcular el H y el S de la reaccin.
b) Resolver la desigualdad.
1.- Balanceo:
2NH3(g) 3H2(g)
de
N2(g)
2.- Calcular G:
G= [(1)(0) + (3)(0)] -[(2)(-26.5)]= 53.0 kJ
Como el resultado es positivo la reaccin es no espontanea a 25C, para
calcular la temperatura de espontaneidad, se necesita calcular la entropa y
entalpa de la reaccin:
3.- Temperatura de espontaneidad:
Hreac = [(3)(0) + (1)(0)] - [(2)(-80.3)] = 160.6 kJ
Sreac = [(3)(131.0) + (1)(191.5)] - [(2)(111.3)] = 361.9 J/K.
0 debe ser menor que cero:
0
0
0
G =H - (S )(T) < 0
160 600 J - 361.9J/K(T) < 0
- 361.9J/K(T) < 160 000 J
T>
Q-811
160000 J
442.1K
3619
.
82
Divisin de Ingeniera
Departamento de Fsica y Qumica
Ejercicio
Diga si la siguiente reaccin es espontnea a Condiciones Estndar
Termodinmicas y si no lo es, A qu temperatura (si es que existe) es
espontnea?
MgO(s)
Mg(s) + O2(g)
Respuesta: no es espontanea a 25C y ser espontnea solo a
temperaturas mayores que 5554K.
Q-811
83
Divisin de Ingeniera
Departamento de Fsica y Qumica
Cintica y Equilibrio Qumico
Objetivos especficos
Explicar el concepto de velocidad de reaccin
Conocer los factores que afectan la velocidad de reaccin
Conocer el mtodo empleado para calcular los rdenes de reaccin 0,
1 y 2 y la constante cintica
Resolver problemas relacionados con la velocidad de reaccin
Conocer la influencia de la temperatura en la velocidad de reaccin
Explicar el concepto de catlisis qumica y sus principales aplicaciones
Describir el equilibrio qumico y la ley de accin de masas en fase gas
Aplicar la ley de accin de masas en el clculo de constantes de
equilibrio en fase gaseosa.
Usar el principio de LE CHATELIER para predecir desplazamientos
ocurridos en un sistema de equilibrio.
En esta unidad se estudiaran las velocidades con que ocurren las
reacciones espontaneas, por lo que es necesario conocer cmo se llevan
a cabo las reacciones, para poder modificar esta velocidad. Se ver
cules son los factores que la afectan y como se determina el orden de
una reaccin.
Para definir el concepto de Cintica Qumica en necesario recordar lo
siguiente:
En fsica existen dos conceptos de velocidad, la media o promedio y la
instantnea, la primera emplea intervalos de tiempo muy grandes y la
segunda intervalos de tiempo diferenciales.
Adems de conocer que la cinemtica estudia el movimiento y las causas
del mismo.
Resultante
r
Velocidad media = V
t
r d r
lim
V
t 0 t
dt
Q-811
Diferencial
84
Divisin de Ingeniera
Departamento de Fsica y Qumica
Mecnica clsica Dinmica: Cintica
Cinemtica
Estudia las causas
No estudia las causas
Esttica
Con lo anteriormente expuesto el concepto de Cintica Qumica se puede
expresar de la siguiente forma:
Cintica Qumica:
Estudia las velocidades de reaccin y los mecanismos por los que se
llevan a cabo. Lo hace midiendo los cambios de concentracin en un
intervalo. La concentracin se maneja en Molaridad a menos que se
especifique otra cosa
Cambios de concentracin:
V
velocidad media.
t
Si se toman varios puntos en la curva se
tendrian muchas velocidades, entonces
tomamos velocidades instantaneas:
d
V lim
t 0 t
dt
La derivada representa la pendiente de la
recta tangente a la curva.
Existen dos teoras de cintica qumica: Estas teoras explican la manera
en que se efectan las reacciones qumicas
1.- De colisiones
2.- Del estado de transicin.
1.- Teora de colisiones.
Para que haya reacciones qumicas debe de haber colisiones
entre los tomos con energa suficiente para reacomodar a los
electrones de valencia.
Las colisiones deben de tener una orientacin adecuada.
2.- Estado de transicin
Para que se d una reaccin se debe formar un estado de
transicin de mayor energa que la que tienen originalmente
reactivos y productos.
Q-811
85
Divisin de Ingeniera
Departamento de Fsica y Qumica
Estado Intermedio o de
transicin.
Ep
React.
Prod.
Avance Reac
Reaccin Exotrmica
E.Activacin inversa
Para rxn exotrmica:
E=EAD - EAI
E=-
Ep
Eai
React.
E
Prod.
Avance Reac
Reaccin Endotrmica
Ep
Eai
Ea
React.
Prod.
E
Para rxn endotrmica:
E=EAD - EAI
E=+
Avance Reac
De acuerdo con estas teoras, para que se lleven a cabo las reacciones
se necesitan que haya colisiones, con lo que se pueden deducir los
Factores que modifican la velocidad de una reaccin:
Concentracin
Temperatura
Naturaleza de reactivos
Catalizadores
Primer Factor que modifica la velocidad de reaccin:
Concentracin:
La concentracin afecta la velocidad de una reaccin por la cantidad de
colisiones que se pueden tener por aumento o disminucin del nmero
de partculas
Q-811
86
Divisin de Ingeniera
Departamento de Fsica y Qumica
Expresin de velocidad:
para la reaccin A + B C + D se determinan las velocidades media de
reactivos y productos, las de reactivos sern velocidades de
desaparicin, y las de productos sern velocidades de aparicin.
A+BC+D
Aen molaridad
VA
en este caso VA es velocidad de
t en segundos
desaparicion.
B
C
VB
, VC
, Pero VC es velocidad de aparicion.
t
t
D
VD
t
Si ahora tenemos: nA + nB nC + nD
A
B C D
Vrxn
t
t
t
t
Esto solo es vlido para coeficientes estequiomtricos iguales.
Los
signos negativos de las concentraciones de A y B son debido a que
desaparecen conforme avanza la reaccin y C y D aparecen.
Si los coeficientes estequiomtricos son distintos:
E
molculas de F, por lo que la velocidad de aparicin de F es el doble que
la velocidad de desaparicin de E. Esto se puede escribir de la siguiente
manera:
E
VE
VF 2VE
t
F E
VF
VE
2
2 t
t
Generalizando para la reaccin : aA + bB cC + dD la relacin de
velocidades medias o promedios entre reactivos y productos se puede
escribir como:
Q-811
87
Divisin de Ingeniera
Expresin de velocidad:
Departamento de Fsica y Qumica
A
B C D
V reac
at
bt
ct
dt
- Ejemplos:
1.- Escriba la expresin de velocidad para la reaccin:
NH3 + O2 NO + H2O
Procedimiento:
1.- balancear la reaccin.
2.- Escribir la ley de velocidad
1.- Balanceo:
4NH3 + 5O2 4NO + 6H2O
2.- Ley de velocidad
NH 3
O2 NO H 2 O
Vreac
4t
5t
4t
6t
2.- Para la reaccin anterior calcular la velocidad de desaparicin de NH3
si la velocidad de aparicin del agua es 3.28M/s.
Solucin: Se toma la relacin de velocidades entre NH3 y H2O y se
despeja la velocidad de NH3.
NH 3 H 2O
Vreac
4 t
6t
4 H 2 O 4(3.28)
H 2 O
NH 3
= 3.28 M/s .:
=
=
= 2.19M/s
6t
t
t
6
Ejercicios:
Considere la reaccin: N2 + H2 NH3. Si se parte de [H2]0 = 0.14M y
despus de 2.35 horas se tiene una concentracin de 0.074M,
determinar la concentracin de NH3 a ese tiempo, si la concentracin
inicial de NH3 es de 0.0M
Respuesta: 0.044M
Orden de Reaccin y ley de velocidad:
Cuando se determin la velocidad promedio de reaccin, se calcul la
velocidad en todo un intervalo de tiempo, y no me dio la informacin de
cul era el valor de la velocidad en un punto.
Para calcular la velocidad en un punto, es necesario definir la velocidad
instantnea; se determinan algunos valores de velocidad y se grafica
contra la concentracin, se obtiene una lnea recta que indica que la
velocidad instantnea es directamente proporcional a la concentracin
Q-811
88
Divisin de Ingeniera
Departamento de Fsica y Qumica
de los reactivos, por lo que se puede establecer una relacin de
proporcionalidad, y para pasar a una igualdad se necesita una constante
que se conoce como constante de velocidad de reaccin; la dependencia
puede no ser lineal, por lo que puede variar la velocidad con la
concentracin de los reactivos de manera exponencial.
Para determinar si es lineal o no, a la ecuacin resultante de la velocidad
se le agregan exponentes X e Y, los cuales se determinan a partir de
datos experimentales, a la ecuacin resultante se le conoce como Ley de
velocidad, a la suma de los exponentes ( X + Y ) se le conoce como
orden de reaccin, a la X se le conoce como orden de reaccin con
respecto a A y a la Y se le conoce como orden de reaccin con respecto
a B.
d
V
dt
V A B
x
y
V k A B Ley de Velocidad
Orden de reaccin = x + y
Para Determinar el orden de Reaccin hay dos formas de manejar los
datos experimentales que son:
Mtodo por inspeccin
Mtodo algebraico
Ejemplo:
Para la reaccin A+2BC a 25C se tienen los siguientes datos:
Experimento
[A]M
[B]M
V0 M/s
1
0.1
0.1
5.5x10-6
2
0.2
0.1
2.2x10-5
3
0.4
0.1
8.8x10-5
4
0.1
0.3
1.65x10-5
5
0.1
0.6
3.3x10-5
Determinar: k(constante de velocidad), x + y(orden de reaccin), y la
Ley de Velocidad
Por inspeccin(procedimiento):
a) Se elige un par de experimentos en los cuales la concentracin de A
sea constante
b) Se divide la concentracin mayor entre la concentracin menor
c) Hacer lo mismo con las velocidades
Q-811
89
Divisin de Ingeniera
Departamento de Fsica y Qumica
d) Se establece la relacin de cambio para x y por inspeccin se
determina el valor de x
a) De experimento 2 y 3, para determinar el valor de X
V=k[A]x[B]y
8.8x10-5=k(0.4)x(0.1)y
2.2x10-5=k(0.2)x(0.1)y
4=2x
.: x=2
De experimento 4 y 5 para determinar el valor de y
V=k[A]x[B]y
3.3x10-5=k (0.1)x(0.6)y
1.6x10-5=k (0.1)x(0.3)y
2=2y .: y=1
El orden de la reaccin es de 3
2
V k A B
55
. 10 6 M / s
55
. 10 3 M-2s-1
2
(01
. M ) (01
. M)
2
V 55
. 10 3 A B
2. Mtodo algebraico.
Este mtodo a diferencia del anterior, utiliza los logaritmos naturales o
base 10. para determinar los exponentes.
a) Se elige un par de experimentos en el que solo cambie uno de los
reactivos de concentracin.
b) Se sustituyen los valores en la expresin de velocidad.
c) Se dividen las dos ecuaciones
d) Se resuelve la ecuacin por logaritmos.
Tomando los dos primeros experimentos del ejercicio anterior:
Q-811
90
Divisin de Ingeniera
Departamento de Fsica y Qumica
x
y
55
. 10 6 M / s k 01
. M 01
. M
2.2 10 5 M / s k 0.2 M 01
. M
En esta ecuacion cancelamos los terminos que son iguales y dividimos los restantes:
x
55
. 10 6 M / s 01
. M
x
5
x 0.25 0.5
2.2 10 M / s 0.2 M
x
ln 0.25 ln(0.5) x
ln 0.25 x ln(0.5)
ln(0.25)
x
2
ln(0.5)
Ahora tomamos los experimentos 4 y 5 para calcular y:
16
. 10 5 k 01
. M 01
. M
y
3.3 10 5 k 0.2 M x 01
. M
x
0.48 (0.5) y
ln 0.48 y ln 0.5
y 105
. 1
El procedimiento sigue igual que en el otro mtodo.
Ejercicios:
1.- Determine para
3A + 2B 2C + D
la ley de velocidad a partir de:
Experimento
1
2
3
[A]M
1x10-2
3x10-2
1x10-2
[B]M
1x10-2
3x10-2
2x10-2
V(M/min)
6x10-3
1.44x10-1
1.2x10-2
Respuesta: V=6.0x103M-2min-1[A]2[B]
2.- Determine la ley de velocidad y el orden de reaccin para
2A + 2B + C A2B + BC
a partir de los siguientes datos experimentales:
Experimento [A]M
[B]M
[C]M
V(M/min)
1
0.2
0.2
0.2
2.4x10-6
2
0.4
0.3
0.2
9.6x10-6
3
0.2
0.3
0.2
2.4x10-6
4
0.2
0.4
0.6
7.2x10-6
Q-811
91
Divisin de Ingeniera
Departamento de Fsica y Qumica
Respuesta: V=k[A]2[C] k=3.0 x 10-4M-2min-1
La determinacin del orden de una reaccin tiene dos aplicaciones
muy importantes. La primera es la de determinar la concentracin a
cualquier tiempo, y la segunda para encontrar el paso lento en un
mecanismo de reaccin.
Primera aplicacin.- Relacin de concentracin a cualquier tiempo. Para
determinar la concentracin de reactivos a cualquier tiempo, se necesita
conocer la ley de velocidad y a partir de esta, generar una ecuacin que
relacione concentracin con tiempo.(solo se har con reacciones de
primero y segundo orden que dependan de un reactivo).
Para Primer Orden.- considerando la reaccin
A B
Ley de velocidad para una reaccin de primer orden ser:
V k A
d A
k A
dt
d A
k dt
dt
Q-811
92
Divisin de Ingeniera
Departamento de Fsica y Qumica
A f
d A
k dt
A
t0
tf
ln x A 0f kt
tf
t0
usando:
x dx ln x
ln A f ln A 0 k (t f t 0 )
como t 0 0
ln A 0 ln A f kt f
ln
A0 k (t )
A f
Durante el transcurso de la reaccin, hay un tiempo en el que la
concentracin final es la mitad de la concentracin inicial. Este tiempo se
conoce como tiempo de vida media.
Para reacciones con ley de
velocidad de primer orden se calcula de la siguiente manera:
A 0
ln
kt inicialmente se tiene una concentracion A o entonces al llegar a la mitad de
A f
la concentracion se tiene una A f 1 2 A 0
A 0
2 A 0
ln 1
kt 1
ln
kt 1 aqui, A 0 A 0 1
2
2
A
A
0
0
2
ln 2 kt 1
t1
2
ln 2
k
unidades de k: cualquier unidad de tiempo a la -1:ej. seg -1
ln[A]
Cmo hacer para obtener una recta en
ln[A]0
[] vs. T?
ln A0 ln A f kt
ln A kt ln A0
y mx b
Se grafica ln[A]o contra tiempo y da
una lnea
recta, adems es una forma de reconocer una
reaccin de primer orden.
Q-811
m=-k
t
93
Divisin de Ingeniera
Departamento de Fsica y Qumica
- Ejemplo:
La descomposicin de Pentxido de Dinitrgeno tiene una constante de
velocidad de k = 5.1 x10-2 min-1 a 45C y se descompone de acuerdo
a la siguiente ecuacin:
N2O5(g) NO2(g) + NO3(g)
para esta reaccin determine lo siguiente:
a) Si la concentracin inicial de pentxido de dinitrgeno [N2O5]0 es de
0.25M, Cul es la concentracin despus de 5.2 minutos?
b) Cunto tiempo le toma a la reaccin disminuir la concentracin de
Pentxido de Dinitrgeno desde 0.25M hasta 0.15M?
c) Cunto tiempo le tomar transformar el 62% de la concentracin
inicial?
d) Cul es el tiempo de vida media de la reaccin?
Solucin: Las unidades de la constante indican que se trata de una
reaccin de primer orden:
a) despejando de la ecuacin de concentracin [A]f = [A]o / ekt
sustituyendo:
[A]f= (0.25M) / e (0.051)(5.2) = 0.192M
b) t = ln([A]o/[A]f) / k = ln([0.25]/[0.15]) / (0.051) = 10.02 min.
c) t = ln ([0.25]/ [0.095]) / (0.051) = 18.97min
0.25100%
x - 38%
x= 0.95 M
d) t1/2= ln2/k = 0.693/ 0.051 = 13.59min
Ejercicio
La descomposicin de un cierto antibitico en agua sigue una cintica de
primer orden y tiene una constante de velocidad de 1.65 ao-1. Si una
solucin 6.0x10-3M del antibitico se guarda a 20C determine la
concentracin del antibitico despus de a) 3 meses, b) 1 ao, c)
determine el tiempo que se requiere para tener una concentracin sea
de 1.0x10-3M, d) encuentre el tiempo de vida media, e) Determine el
tiempo que se requiere para que se descomponga 73% del material
inicial.
Respuestas: a) 3.97x10-3M, b) 1.15x10-3M; c) 1.1 aos, d) 153
das, e) 289.6 das
Q-811
94
Divisin de Ingeniera
Departamento de Fsica y Qumica
SEGUNDO ORDEN
Relacin de concentracin con tiempo para reacciones de Segundo
Orden de Reaccin
Cuando depende solo de un reactivo, en este caso, de B:
2
Reaccin: A2 + 3B 2C + D que tiene una ley de velocidad v k B se
tiene:
d B
2
k B
dt
d B
k t
B 2
1 B
kt
B B0
t
t0
1
1
kt
B B 0
Tiempo de vida media de reaccion de segundo orden:
Empleamos el procedimiento para primer orden, es decir que nuestra concentracion final es
un medio de la concentracion inicial y queda:
1
1
kt 1
1
2
B 0
2 B 0
2
1
kt 1
B 0 B 0
2
1
kt 1
B 0
2
1
1
t1
unidades de k para una reaccion de segundo orden:
( sM ) 1
2
k B 0
sM
1
contra el tiempo, se obtiene una lnea recta con
B
1
ordenada al origen
y pendiente k.
B0
Si se grafica
Q-811
95
Divisin de Ingeniera
Departamento de Fsica y Qumica
1/[B]0
B 0
m=k
t
Ejercicio 27
1.-Para la reaccin I(g)+I(g)I2(g), cuya constante de velocidad es
k=5.1x109 M-1s-1 a 45C.
Determinar:
a) La concentracin de iodo atmico a 45C despus de tres minutos si
su concentracin inicial es 0.86M
b) El tiempo de vida media si la concentracin de iodo atmico es 0.6M
Respuestas: a) 1.1x10-12M, b) 2.3x10-10s.
2.-Cul es el tiempo de vida media de un compuesto que sigue una
cintica de primer orden, si 75% de una muestra 0.375 M se
descompone en 60 minutos?
Respuesta: 30.13 minutos
3.- Para la reaccin B C + D, el tiempo de vida media es 0.8s, y
k=1.46M-1s-1, calcular la concentracin de B despus de 20 minutos de
iniciada la reaccin.
Respuesta: 5.7x10-4M.
El segundo uso de la ley de velocidad es el de plantear el paso lento en
el Mecanismos de una Reaccin: El mecanismo es la serie de reacciones
intermedias en que se considera ocurre una reaccin, ya que no se
llevan a cabo en un solo choque.
La informacin que ofrece el mecanismo de una reaccin es :
1) Las especies involucradas en el paso lento de una reaccin.
2) el nmero de veces que cada especie participa en el paso lento.
- Ejemplo
Si tenemos la reaccin NO2 + CO NO +CO2 y su ley de velocidad es
V=k[NO2]2, De qu manera se lleva a cabo la reaccin?
Q-811
96
Divisin de Ingeniera
Departamento de Fsica y Qumica
En este caso, el exponente 2 de [NO2], nos indica que en la reaccin
lenta, que es la que determina la velocidad total de la reaccin, chocan
dos molculas de NO2 de la siguiente manera:
Paso 1:
LENTO
NO2 + NO2
Paso 2:
RPIDO
N2O4
2O4
(el N2O4 es un intermediario)
+ NO2
PASO
PASO
Sumando: NO2 + CO NO + CO2
Un intermediario es un producto que se forma en una reaccin y que se
consume en otra reaccin por lo que al final no aparece.
(los reactivos/productos en negrillas indican cul de ellos se elimina con
el de la otra reaccin)
Segundo factor que modifica la velocidad de reaccin:
Naturaleza de Reactivos. Son cuatro las formas en que la naturaleza
de los reactivos afecta la velocidad de la reaccin.
A) Estado Fsico: Dependiendo del estado fsico de los reactivos ser
mayor o menor la interaccin que tengan:
C6H14(l) + O2(g) CO2(g) + H2O(g)
C6H14(g) + O2(g) CO2(g) + H2O(g)
La velocidad de reaccin vara: gas>lquido>slido
Para un mismo reactivo el estado gaseoso tiene una mayor velocidad de
reaccin que el estado lquido y este a su vez mayor que la del estado
slido.
B) Superficie de contacto: Mientras mayor sea la superficie de contacto,
mayor ser la velocidad de reaccin: una barra de Fe:
2Fe(s) + 2/3O2(g) Fe2O3(s)
Fe en polvo: misma reaccin, pero hay mayor superficie de contacto,
entonces: a mayor superficie de contacto mayor velocidad de reaccin
C) Formas alotrpicas: Tambin influyen en la velocidad de reaccin
C(grafito) + O2 CO2
C(diamante) + O2 CO2
La forma alotrpica ms estable , tiene menor velocidad de reaccin.
Q-811
97
Divisin de Ingeniera
Departamento de Fsica y Qumica
D) Tipos de compuestos: En una reaccin, los distintos compuestos de
un mismo elemento tienen diferentes velocidades de reaccin:
Na + H2O NaOH + H2O
NaCl + H2O Na+ + Clmismo elemento en este caso sodio Na, diferentes velocidades de
reaccin.
Tercer factor que modifica la velocidad de reaccin:
TEMPERATURA
Relacin de temperatura con velocidad de reaccin.
Considerando la reaccin A + B C + D como una reaccin de primer
orden y que depende solo de A, la ley de velocidad se puede escribir de
la siguiente manera: V=k[A],
si graficamos velocidad contra concentracin, se tendr una lnea recta
y= mx + b , con ordenada al origen cero y el valor de la pendiente k
depende de la temperatura
a mayor k mayor velocidad por mayor frecuencia de colisiones con una
mayor temperatura.
En este caso k2>k1 y T2>T1
T2
T1
A+BC+D
Arrhenius determin como se afectaba la constante de velocidad por la
temperatura de manera emprica:
encontr que a mayor frecuencia de colisiones se tena una mayor k y
que esta variaba exponencialmente con la energa de activacin y con el
inverso de la temperatura.
kA
k e
Ea
RT
k Ae
Q-811
Ea
RT
98
Divisin de Ingeniera
Departamento de Fsica y Qumica
Donde: A es el factor de frecuencia de colisiones con las unidades de k,
e es la constante matemtica, Ea es la energa de activacin (J/mol), T
es temperatura absoluta en Kelvin y R es la constante de los gases
(8.314J/mol K).
Si se determina la constante de velocidad a varias temperaturas, se
puede obtener los valores de A y de la energa de activacin. Si se
grafica el logaritmo natural de k contra el inverso de la temperatura, la
ordenada al origen es ln A y la pendiente es Ea/RT.
ln k
ln k ln( Ae
ln A
1
T
Ea
RT
)
Ea
ln k ln A
RT
Ea 1
ln k
ln A
R T
y mx b
Tomando dos experimentos podemos encontrar una relacin entre dos
constantes de velocidad a dos temperaturas:
Ea 1
ln A
ln k 1
R T1
ln k 2
Ea 1
ln A
R T2
Restando las ecuaciones tenemos:
ln k 1 ln k 2
Ea 1 Ea 1
R T1 R T2
k1 Ea 1 1
ln
k R T
2
2 T1
k1 Ea T1 T2
ln
k R T T
2
1 2
Cualquiera de las dos ecuaciones anteriores se puede utilizar para
determinar una constante a una temperatura dada si se conoce la
constante a otra temperatura.
Q-811
99
Divisin de Ingeniera
Departamento de Fsica y Qumica
Ejercicio:
1.- Cul es la constante de velocidad a 80C para A + B C si a 25C
k=2x10-5s-1 y Ea=50.2kJ/mol?
Respuesta: k = 4.8x10-4s-1.
2.-La reaccin de descomposicin para el bromuro de etano, que
produce eteno y HBr tiene un tiempo de vida media de 9.5 horas a
377C.
Si la energa de activacin es de 226kJ/mol, Cul es la
temperatura en que la constante de velocidad es 6.0x10-5 s-1 si la
concentracin inicial es de 0.9M.
Respuesta: T = 405C
3.- Para las mismas concentraciones, la reaccin de CO + Cl2 COCl2.
A 250C es 1.5x103 veces ms rpida que a 150C. Calcule Ea para
esta reaccin.
Respuesta: 134.3 kJ/mol
Cuarto factor que modifica la velocidad de reaccin:
Catalizadores
Un catalizador es un compuesto o
elemento que aumenta la velocidad de
4
reaccin y se recupera totalmente al final
3
Ea
E. Pot.
de la misma.
2
EaC
A2+B2
Los catalizadores reducen la energa de
1
2AB
activacin necesaria para que se lleve a
0
cabo la reaccin ya que participan en el
1
3
5
7
9
estado de transicin. En la grfica, Ea es
Avance Rxn
la energa de activacin normal, y EaC es
la energa de activacin necesaria cuando existe un catalizador en la
reaccin.
5
De acuerdo a la fase en que se encuentra el catalizador con respecto a
los reactivos estos se clasifican de tres formas.
Catlisis en:
Fase homognea
Fase heterognea
Catlisis Enzimtica
Q-811
100
Divisin de Ingeniera
Departamento de Fsica y Qumica
La catlisis en fase homognea es aquella en que los reactivos y
productos se encuentran en la misma fase, la heterognea los reactivos
y productos se encuentran en distinta fase y la catlisis enzimtica es
aquella en que las enzimas son los catalizadores.
Ejemplo de catlisis en fase homognea:
Acetato de etilo
O
H+Cl(cat)
CH3-C-O-CH2-CH3 + H2O
O
CH3-C-OH + CH3-CH2-OH
O
CH3 - C -||- O - CH2 - CH3
CH3 - C - OH + CH2 - CH3 OH
O
H
H
O
CH3 - C -||- O - CH2 - CH3
O
H
CH3 - C + OH - CH2 - CH3
OH
H+
(|| = se rompe el enlace)
Q-811
101
Divisin de Ingeniera
Departamento de Fsica y Qumica
Ejemplo de fase heterognea:
Convertidor cataltico. gases - slidos(cat.) - gases
O-C
O-O
O-C
________________________ Superficie metlica
2CO + O2 2CO2
2NO N2 + O2
2SO2 + O2 2SO3 + 2H2O 2H2SO4
EQUILIBRIO QUMICO
Esta grfica representa a la
reaccin A + B C + D, en la
cual se puede apreciar que
despus de algn tiempo, las
concentraciones
de
los
reactivos
y
productos
permanecen constantes, es
decir, parece que la reaccin
no contina.
Lo que sucede en realidad es
que despus de alcanzar
ciertas concentraciones, la
probabilidad de que existan colisiones entre molculas de los reactivos
disminuye, pero la probabilidad de que se den colisiones entre molculas
de los productos aumentan.
Cuando las molculas de los productos
chocan, la reaccin se revierte y una parte muy pequea de los
productos regresa a reactivos, mientras que una parte exactamente
igual de reactivos se vuelven productos. A esto se le llama equilibrio
dinmico.
A+B
A B C D
A B C D tiene una constante de velocidad k1
C D A B tiene una constante de velocidad k 2
VDERECHA=VIZQUIERDA
Q-811
102
Divisin de Ingeniera
Departamento de Fsica y Qumica
Equilibrio Qumico: Perodo de tiempo en el cual la velocidad es
constante e igual de izquierda a derecha y viceversa, las
concentraciones se mantienen constantes.
VDERECHA=k1[A][B]
VIZQUIERDA=k2[C][D] entonces
k1 A B k 2 C D :
k 1 C D
donde Kc es la constante de equilibrio en fase acuosa
KC
k 2 A B
E(g) + F(g) G(g) + H(g)
PG PH
KP
donde K P es la constante de equilibrio en funcin de presiones.
PE PF
Ambas ecuaciones son solo vlidas para coeficientes estequiomtricos
iguales a 1.
Para coeficientes estequiomtricos diferentes de 1:
Para soluciones Acuosas: aA bB cC dD
KC
c
d
C D
Aa Bb
Para gases: eE fF gG hH
PGg PHh
KP e f
PE PF
Relacin entre KP y KC:
GRT g H RT h
KP
E RT e F RT f
K P RT
( g h) (e f )
g
h
RT g h G H
KP
esto ltimo es K C
RT e f E e F f
KC
g + h = np nmero de moles en fase gaseosa de productos
e + f = nr nmero de moles en fase gaseosa de reactivos
np - nr = n
reaccin
Q-811
= cambio en nmero de moles en fase gaseosa de la
103
Divisin de Ingeniera
K P K C ( RT ) n
Departamento de Fsica y Qumica
KP y Kc son adimensionales, ya que viene de k1/k2.
Informacin que proporciona KP y KC:
Como est definida, nos da informacin acerca de quin est en mayor
cantidad en el equilibrio en una reaccin si los reactivos o los productos.
Dependiendo de quin est en mayor cantidad, se dice que la reaccin
esta desplazada hacia ese parte.
productos
KC
reactivos
KC>1 [productos]>[reactivos] la reaccin est desplazada hacia
productos
KC<1 [reactivos]>[productos] la reaccin est desplazada hacia
reactivos
KC=1 [reactivos] y [productos] mismo orden de magnitud
Tipos de Equilibrio
Esta clasificacin se hace de acuerdo a la fase en que estn los reactivos
y los productos
a) Equilibrio en fase homognea: reactivos y productos en una mismo
fase.
b) Equilibrio en fase heterognea: reactivos y productos en distinta
fase.
Para los equilibrios en Fase heterognea la constante de equilibrio KC
solo considera a los reactivos y productos en solucin y a los gases, ya
que los slidos y los lquidos puros mantienen su concentracin
constante y ya est incluido en el valor de la constante de equilibrio.
aA(s)+bB(l)+cC(g)+dD(ac) eE(s)+fF(l)+gG(g)+hH(ac)
E e( s) F (fl ) G (gg ) H h( ac)
K C `
A a( s) Bb( l ) C c( g ) D d( ac)
para la concentracin de slidos y lquidos puros se tiene:
Q-811
104
Divisin de Ingeniera
Departamento de Fsica y Qumica
PM
n g / PM
=
=
= constante, ya que el peso molar y la densidad
V
g /
son constantes,
por lo que se tiene:
[A] =
H h( ac) G (gg ))
KC
.
D d( ac) C c( g )
En el caso de KP solo se incluyen gases.
Ejercicios:
1.- La KC para la reaccin N2O4 2NO2 es KC=4.63x10-3 a 25C.
es el valor de KP a esta misma temperatura?
Respuesta: Kp= 0.113
Cul
2.- Para la reaccin de descomposicin de CaCO3(s) CaO(s) + CO2(g)
a 800C, la presin de CO2 es de 0.236atm.
Calcule KP y KC de la
reaccin a esa temperatura.
Respuesta: Kp=0.236, Kc=2.68x10-3
Son tres las Propiedades de K que se pueden aplicar a las reacciones en
equilibrio:
a) Se pueden Invertir reacciones, es decir que los reactivos sean
productos y que los productos sean reactivos
C c D d
KC
Si se tiene aA + bB cC + dD
si se invierte la reaccin
A a B b
A a B b
K C
cC + dD aA + bB
la nueva constante se
C c D d
relaciona con la anterior como su inverso:
K 'C
1
KC
Cuando se invierte una reaccin en equilibrio, se saca el inverso de la
constante de equilibrio para obtener el valor de la nueva constante de
equilibrio.
Q-811
105
Divisin de Ingeniera
Departamento de Fsica y Qumica
b)Se pueden multiplicar las reacciones en equilibrio ya
balanceadas por un nmero y la constante de equilibrio cambia de la
siguiente forma.
Si se multiplica una reaccin por un nmero r tenemos:
(aA + bB cC + dD)r
raA + rbB rcC + rdD.
C c D d
La constante de la ecuacin original es KC
, mientras la nueva
A a B b
C rc D rd C c D d
r
KC
constante sera K C
ra
rb
a
b
A B
A B
r
K C = (Kc)r
Cuando se multiplica una reaccin por un nmero, la constante de
equilibrio se eleva a ese nmero para obtener el valor de la nueva
constante de equilibrio.
c) Si se suman reacciones en equilibrio, la constante de equilibrio de
la reaccin final se puede obtener de la siguiente forma:
C D
A + B C + D K 'C
A B
E F
C + D E + F K ''C
C D
E F
suma:
A + B E + F KC
K C K ' C K ' ' C
A B
Cuando dos reacciones en equilibrio se suman para obtener otra
reaccin en equilibrio, las constantes de equilibrio se multiplican para
obtener la nueva constante de equilibrio.
- Ejemplo:
Determine la constante de equilibrio K para la reaccin:
H2CO3 2H+ + CO32A partir de las siguientes reacciones:
2H2CO3 2H+ + 2HCO31K=17.64x10-14
H+ + CO32- HCO31K=2.1x1010
Procedimiento
1.- Se localizan los reactivos y los productos de la reaccin principal en
las reacciones intermedias.
Q-811
106
Divisin de Ingeniera
Departamento de Fsica y Qumica
2.- Se hacen los cambios necesarios a las reacciones intermedias, para
que los reactivos y productos de la reaccin principal estn en el lugar y
nmero adecuado.
3.- Se hacen los cambios a las constantes de equilibrio de acuerdo a los
cambios que se hicieron en las reacciones intermedias.
4.- Se suman las reacciones y se multiplican las constantes.
1.- Localizar:
H2CO3 2H+ + CO322H2CO3 2H+ + 2HCO31H+
K=17.64x10-14
+ CO32- HCO31- K=2.1x1010
(1)
(2)
2 y 3 - Cambios:
La reaccin 1 se multiplica por y la constante se eleva a la y la
reaccin 2 se invierte por lo que la constante se le saca inverso.
H2CO3 H+ + HCO31K= 4.2x10-7
1+
2HCO3 H + CO3
K= 4.76x10-11
4.- Sumar las reacciones y multiplicar las constantes
H2CO3 H+ + HCO31- K= 4.2x10-7
HCO31-H+ + CO32K= 4.76x10-11
H2CO3 2H+ + CO32- K = 2.0 x 10-17
Ejercicios:
1.- Determine la constante de equilibrio K para la reaccin:
NO2 N2O4
si para la reaccin N2O4 2NO2
Resultado: K=14.7
la constante es de K= 4.63x10-3
Los usos que tiene la constante de equilibrio son principalmente los
siguientes: Usos de K
1.Determinar Concentraciones en el Equilibrio.
2.Calcular
las
concentraciones
concentraciones en el equilibrio.
iniciales
para
determinadas
3. Determinar si una reaccin se encuentra o no en equilibrio.
Q-811
107
Divisin de Ingeniera
Departamento de Fsica y Qumica
1.-Determinacin de concentraciones en el equilibrio
Los datos sern la constante de equilibrio K y las concentraciones
iniciales de A y de B es decir [A]0 y [B]0, por ejemplo, para la reaccin:
aA + bB cC + dD
al inicio: [A]0 + [B]0 0 + 0
durante la reaccin, A disminuir en una forma ax, donde a es el
coeficiente estequiomtrico, y de la misma manera, B disminuye en
forma bx, mientras C y D aumentan de forma cx y dx. De lo anterior
concluimos que la constante de equilibrio.
cx c dx d
KC
A 0 ax a B 0 bx b
De forma resumida:
Reaccin
Inicio de reac
Cambio en []
Conc. en Equilibrio
aA
+
[A]0
-ax
[A]0-ax
bB cC +
[B]0
0
-bx
cx
[B]0-bx + cx +
dD
0
dx
dx
con KC o KP dada
Para conocer las concentraciones en el equilibrio, solo se necesita
sustituir los datos conocidos y despejar la incgnita (por lo general x),
posteriormente substituimos el valor resultante de x en la condicin de
equilibrio planteada (que en este caso sera [A]f=[A]0-ax
[B]f=[B]0bx, [C]f=cx, [D]f=dx).
Los pasos sern los siguientes:
1.- Balanceo
2.- Establecer las condiciones de Inicio.
3.- Establecer las condiciones de Cambio.
4.- Establecer las condiciones de equilibrio
5.- Plantear la ecuacin de la constante de equilibrio
6.- resolver para x
7.- sustituir en las concentraciones en equilibrio y determinarlas.
Ejercicios:
1. Dada la reaccin N2O4(g) 2NO2(g) a 22C, cuya KC=4.63x10-3,
calcular las concentraciones de ambos compuestos en el equilibrio, si
inicialmente se colocan 6 moles de N2O4 en un recipiente de 12 litros.
Respuesta: [NO2]=4.68x10-2M; [N2O4]=4.77x10-1M
2. Calcula las concentraciones en el equilibrio de I, H y HI para la
reaccin H2(g) + I2(g) 2HI(g) si se lleva a cabo a 430C, su KC=54.3
Q-811
108
Divisin de Ingeniera
Departamento de Fsica y Qumica
y se tienen las siguientes cantidades iniciales: [H]=0.5moles, [I]=0.5.
La reaccin se lleva a cabo en un recipiente de 1 litro.
Respuesta: [HI]=0.9M; [H2]=[I2]=0.06M
2.-Calcular
las
concentraciones
iniciales
para
determinadas
concentraciones en el equilibrio. Los datos sern la constante de
equilibrio K, una concentracin inicial de A de B y una concentracin
en el equilibrio de C o de D, es decir [A]0 o [B]0, y [C] [D] por ejemplo,
para la reaccin:
aA + bB cC + dD
Se tiene lo siguiente:
Reaccin
Inicio de reac
Cambio en []
Conc. en Equilibrio
aA + bB
Y
[B]0
-ax
-bx
Y-ax
[B]0-bx +
[A]eq [B]eq
cC
+
0
cx
cx
+
[C]eq
dD
0
dx
dx
[D]eq
En este caso conocemos [C]eq y [B]o, por lo que de la ecuacin [C]eq=cx
encontramos el valor de x. Para determinar la concentracin inicial de
A([A]o) necesitamos encontrar el valor de [A]eq, que se obtiene de la
ecuacin de equilibrio:
[C ]eq c [ D]eq d
KC
[ A]eq a [ B ]eq b
y se sustituye este valor en la ecuacin Y - ax=[A]eq en la que Y es la
concentracin inicial de A que es la que se quiere encontrar.
Los pasos sern los siguientes:
1.- Balanceo
2.- Establecer las condiciones de Inicio.
3.- Establecer las condiciones de Cambio.
4.- Establecer las condiciones de equilibrio
5.- Encontrar el valor de x con la concentracin en equilibrio dada.
6.- Plantear la ecuacin de la constante de equilibrio
7.- Resolver para la concentracin de [A]eq
8.- Encontrar el valor de y
9.- Obtener la concentracin inicial.
10.- Obtener los moles con la molaridad y el volumen.
11.- Obtener los gramos con los moles y el peso molar.
Q-811
109
Divisin de Ingeniera
Departamento de Fsica y Qumica
Ejercicios:
1.- Para la reaccin de equilibrio de ozono y O2 a 2400C se tiene una
KC=2.54x1012.
Calcular la cantidad de O3 en gramos que se deben poner en un
recipiente de 3 litros para que la concentracin en el equilibrio de O 2 sea
de 0.3M.
O3 O2
Respuesta: 28.8g de O3
2.- Para la reaccin:
2NOCl 2NO + Cl2 ,
a una determinada temperatura, la constante de equilibrio Kc es de 8.0.
Cuantos gramos de NOCl se deben poner en un recipiente de 4.00L,
para que la concentracin de NOCl en el equilibrio sea de 1.00M.
Respuesta: 922.24g = 0.922Kg.
3.-Para determinar si una reaccin est en equilibrio, es necesario
definir una nueva cantidad a la que se le conoce como cociente de
reaccin Q y que se calcula igual que la constante de equilibrio K, pero
con la diferencia de que las concentraciones no son necesariamente las
del equilibrio. Los datos sern K, [A], [B], [C], [D].
Por ejemplo para la reaccin: aA + bB cC + dD con K conocida y las
concentraciones de productos y reactivo distintas a cero, podemos
C c D d
Q
determinar el cociente de reaccin (Q) con la ecuacin:
.
A a B b
Una vez obtenido el valor de Q se compara con K y se tienen tres
posibilidades:
Si Q=K: La reaccin est en equilibrio y por lo tanto las concentraciones
son las del
equilibrio.
Si Q<K: La reaccin no est en equilibrio y la cantidad de reactivos es
mayor que la de productos, por lo que la reaccin se desplaza
hacia productos para alcanzar el equilibrio.
Si Q>K: La reaccin no est en equilibrio y la cantidad de productos es
mayor que la de reactivos, por lo que la reaccin se desplaza
hacia reactivos para alcanzar el equilibrio.
Se tiene lo siguiente:
Reaccin
Q-811
aA
bB
cC
dD
110
Divisin de Ingeniera
Inicio
Cambio I
Cambio II
Equilibrio I
Equilibrio II
Departamento de Fsica y Qumica
[A]
[B]
[C]
[D]
ax
bx
-cx
-dx Q>K
-ax
-bx
cx
dx Q<K
[A]+ax=[A]eq [B]+bx=[B]eq [C]-cx=[C]eq [D]-dx=[D]eq
[A]-ax=[A]eq [B]-bx=[B]eq [C]+cx=[C]eq [D]+dx=[D]eq
Q>K
Q<K
Se toma el rengln correspondiente de acuerdo al resultado de la
comparacin entre Q y K para plantear la constante de equilibrio.
C ceq D deq [C] cx c [D] dx d
Kc
A aeq B beq [A] ax a [B] bx b
Se resuelve para x y se encuentran las concentraciones en el equilibrio
Los pasos sern los siguientes:
1.- Balanceo
2.- Calcular Q
3.- Comparar Q con K y establecer la direccin del cambio.
4.- Establecer las condiciones de Inicio.
5.- Establecer las condiciones de Cambio.
6.- Establecer las condiciones de equilibrio
7.- Plantear la ecuacin de la constante de equilibrio
8.- Resolver para x
9.- Sustituir el valor de x en las concentraciones en el equilibrio y
determinarlas.
Ejercicios:
1. Para la reaccin H2(g) + I2(g) 2HI(g) se inicia con concentraciones
de Iodo e Hidrgeno de 2.24x10-3M, y con una concentracin de HI de
6.14x10-2M a 430C. Si la constante de equilibrio KC es de 54.3 a esa
temperatura. Determinar si la reaccin esta en equilibrio. Si no lo
est, determinar hacia qu lado se desplazar la reaccin para
alcanzar el equilibrio, y cules sern las concentraciones en el
equilibrio.
Respuesta: a) no est en equilibrio; b) Se desplaza hacia los
reactivos;
c) [H2]=[I2]=2.62x10-2M; [HI]=3.79x10-2M.
Un sistema que ya se encuentra en equilibrio se puede modificar si
aumenta o disminuye la concentracin de reactivos o productos, si
aumenta o disminuye la temperatura, si hay gases en la reaccin con
aumento o disminucin de la presin y tericamente con la adicin de
catalizador. Estos son los factores que modifican el Equilibrio.
1. Concentraciones
2. Temperatura
Q-811
111
se
se
un
un
Divisin de Ingeniera
Departamento de Fsica y Qumica
3. Presin
4. Catalizadores
Cuando a un sistema en equilibrio se le hace alguno de los cambios
anteriores, el sistema tiende a contrarrestar ese cambio para restablecer
nuevamente el equilibrio, a este principio se le conoce como principio de
Le Chatelier.
A continuacin se analizarn de manera cualitativa cada uno de estos
factores.
1. Concentraciones
Si se tiene una reaccin aA + bB cC + dD en equilibrio (Equilibrio 1),
con concentraciones [A]i + [B]i
i + [D]i y se aumenta la
concentracin de A y/o B, se altera el equilibrio, por lo que el cociente
de reaccin es menor que la K, es decir Q<K C por lo que la reaccin se
desplazar hacia la derecha para restablecer el equilibrio.
Si aumentan C y/o D, Q>K, la reaccin se desplaza hacia la izquierda
para llegar al equilibrio.
Si disminuyen A y/o B Q>K, la reaccin se desplaza hacia la izquierda
para alcanzar el equilibrio.
Si disminuyen C y/o D Q<K, la reaccin se desplaza hacia la derecha
para alcanzar el equilibrio.
2.- Para la Temperatura
Se tienen dos casos, ya que la reaccin puede ser endotrmica o
exotrmica.
Si tenemos una reaccin aA + bB cC + dD y es exotrmica, Qu
pasa si aplicamos calor? Podemos pensar en el calor como un producto
aA + bB cC + dD + calor entonces, si aplicamos calor, la reaccin se
desplaza hacia reactivos.
Reaccin exotrmica, se reduce la temperatura La reaccin se
desplaza hacia productos
Reaccin endotrmica, se aumenta temperatura La reaccin se
desplaza hacia productos
Reaccin endotrmica, se reduce la temperatura La reaccin se
desplaza hacia reactivos
3. Presin
Q-811
112
Divisin de Ingeniera
Departamento de Fsica y Qumica
La presin solo influye cuando existen gases en productos y/o en
reactivos y con distinto nmero de moles, por ejemplo:
2A(g) + bB(s) 3C(g) + dD(l).
Si cambiramos la presin en una reaccin que tuviera gases tanto en
reactivos como productos, pero con el mismo nmero de moles, las
concentraciones aumentaran o disminuiran en la misma proporcin, por
lo que no influira. Para las soluciones un cambio en la presin no
modifica de manera notable el volumen y por lo tanto se puede
considerar a la concentracin constante.
Para la reaccin con ms moles de gas en reactivos que en productos se
tiene:
B
2A(g) B(g), K C
por lo que:
A 2
Si aumenta la presin, Q<K y la reaccin se desplaza hacia productos.
Si disminuye la presin, Q>K y la reaccin se desplaza hacia reactivos
F 2
E(g) 2F(g), KC
entonces:
E
Aumenta presin, Q>K reaccin desplazada hacia la izquierda
Disminuye presin, Q<K reaccin desplazada hacia la derecha
4. Los Catalizadores disminuye la energa de activacin para la reaccin
hacia la derecha y para la reaccin a la izquierda por lo que no modifican
el equilibrio solo lo establecen ms rpido.
A+BC+D
Catalizador
A+B
C+D
Los catalizadores
equilibrio.
establecen
ms
rpido
el
Forma cuantitativa para concentracin: Para poder calcular las nuevas
concentraciones en el equilibrio cuando se hace un cambio en la
concentracin se tiene que conocer la constante de equilibrio, las
concentraciones en el equilibrio I y el cambio de concentracin. Por
ejemplo para la reaccin: aA + bB
cC + dD que ya se
encuentra en equilibrio, se le agrega ms reactivo C para modificar el
equilibrio
Q-811
113
Divisin de Ingeniera
Departamento de Fsica y Qumica
Se tiene lo siguiente:
Reaccin
Equilibrio I
Cambio I
Inicio
Cambio II
Equilibrio II
aA
[A]e
bB
[B]eqI
cC
+
dD
[C]eqI
[D]eqI
+[C]
[A]eqI
[B]eqI
[C]eqI+[C]
[D]eqI
+ax
+bx
-cx
-dx
[A]eqI+ax=[A]eqII [B]eqI+bx=[B]eqII [C]eqI+[C]-cx=[C]eqII [D]eqI-dx=[D]eqII
C ceqII D deqII [C]eqI [C] cx c [D]eqI dx d
Kc
A aeqII B beqII
[A]eqI ax a [B]eqI bxb
Se resuelve para x y se encuentran las concentraciones del equilibrio II.
Los pasos sern los siguientes:
1. Balanceo
2. Establecer las condiciones de equilibrio I y calcular la constante de
equilibrio.
3. Establecer las condiciones de cambio I y determinar la direccin del
cambio.
4. Establecer las condiciones de Inicio.
5. Establecer las condiciones de Cambio II.
6. Establecer las condiciones de equilibrio II.
7. Plantear la ecuacin de la constante de equilibrio
8. Resolver para x
9. Sustituir el valor de x en las concentraciones en el equilibrio y
determinarlas.
Ejercicios:
1.- Para la reaccin CO(g) + H2O(g) CO2(g) + H2(g) ,
las concentraciones en el equilibrio son: [CO]=0.48M; [H2O]= 0.48M;
[CO2]=0.24M; [H2]= 0.24M. Determinar las concentraciones en el
equilibrio cuando:
a) se agrega 0.2M de CO;
Respuesta:[CO2]=[H2]= 0.27M; [CO]=0.65m;[H2O]= 0.45M;
b) se elimina 0.2M de CO.
Respuesta: [CO2]=[H2]= 0.20M; [CO]=0.32M;[H2O]= 0.52M
2.- Para la reaccin
N2(g) + O2(g) 2NO(g) ,
en el equilibrio se encontraron las siguientes cantidades: 0.113mol de
NO, 0.800mol de O2, 0.800mol de N2 en un recipiente de 10 litros,
Q-811
114
Divisin de Ingeniera
Departamento de Fsica y Qumica
determine las concentraciones en el equilibrio si se agregan 0.600mol de
N2.
Respuesta:[NO]=0.0893;[N2]=0.101; [O2]=0.041
La constante de equilibrio varia con la temperatura y esta variacin
depende de si la reaccin es exotrmica o endotrmica lo que se puede
saber con el H. La ecuacin que permite conocer una constante de
equilibrio a otra temperatura si se conoce la constante de equilibrio a
una temperatura y el H, se llama ecuacin de vant Hoff.
Relacin de K1 a T1 y K2 a T2
o
KT 1 H 1 1
ln
KT 2 8.314 T2 T1
ecuacin de vant Hoff.
Donde H est dado en kJ/mol,
R= 8.314 tiene unidades J/mol K y las temperaturas son absolutas (en
Kelvin).
La ecuacin anterior se puede obtener a partir de la relacin que existe
entre la energa libre de Gibbs y la constante de equilibrio. Recordando
la relacin entre la espontaneidad y la energa libre, tenemos lo
siguiente:
G= +
G= G= 0
Reaccin no espontnea
Reaccin espontnea
Equilibrio
Y la relacin entre energa libre en condiciones estndar con condiciones
no estndar est dada por: G = G0 + RTlnQ.
Para una reaccin en equilibrio la energa libre de Gibbs es cero y el
cociente de reaccin Q es igual a la constante de equilibrio K por lo que
podemos escribir:
0G0 + RTlnK .:
G0=-RTlnK
Ejercicios:
Conociendo que G0=H0 - TS0 y con la ecuacin anterior deduce la
ecuacin de ecuacin de vant Hoff.
Q-811
115
Divisin de Ingeniera
Departamento de Fsica y Qumica
1.- Para la reaccin N2O4(g)
2NO2(g) el H de la reaccin es de
58.0kJ y la KcI a 25C es de 4.63x10-3, determine el valor de la
constante de equilibrio KcII a 65C.
2. Dada la reaccin A + B C + D, determinar K25C si:
a) G=23kJ
b) G=-23kJ
Respuesta: a) 9.296x10-5, b) 10756.7
3. Para el sistema CH4(g) + Cl2(g) CH3Cl(g) + HCl(g),
H a 25C es -99kJ y K a esa temperatura es 1x1018, determina:
a) Si se aumenta la temperatura a 100C, aumenta o disminuye K?
b) Cul es la nueva K?
Respuesta: a) disminuye; b) aumenta
Q-811
116
Divisin de Ingeniera
Departamento de Fsica y Qumica
Electroqumica
Objetivos Especficos
Definir los conceptos bsicos de los procesos de xido- reduccin.
Balancear ecuaciones de xido- reduccin por el mtodo de inelectrn.
Describir los componentes de las celdas electroqumicas.
Aplicar los conceptos electroqumicos a los procesos de xidoreduccin
de
importancia
tecnolgica
(corrosin,
pilas,
electrometalurgia, procesos biolgicos).
La electroqumica: estudia la relacin entre la corriente elctrica y las
reacciones qumicas. Esta relacin puede ser de dos tipos:
Generando corriente elctrica a partir de reacciones qumicas.
Generando reacciones qumicas por medio de una corriente elctrica.
Para que
necesitan
este tipo
reduccin
se pueda generar corriente por una reaccin o viceversa se
reacciones en las que ocurra un intercambio de electrones,
de reacciones se conocen como reacciones de oxidacino simplemente reacciones redox.
Para explicar el concepto de Oxidacin y Reduccin
existen tres formas.
Oxidacin
Reduccin
a) Combinacin (ganancia) con a) prdida de oxgeno:
oxgeno, por ejemplo la oxidacin
de un metal:
WO3 + 3H2 W + 3H2O
2Fe + O2 2FeO
Aqu el hierro se oxida y el oxgeno se En este caso el tungsteno se reduce y
el hidrgeno se oxida.
reduce.
b) Prdida de electrones
Ejemplo:
2FeBr3 + 3Cl2 2FeCl3 + 3Br2
b) Ganancia de electrones
Ejemplo:
2FeBr3 + 3Cl2 2FeCl3 + 3Br2
Cada Bromo que esta combinado con El Cloro se est reduciendo, ya que por
el Hierro tiene 8 electrones. 7 que su electronegatividad, cada cloro toma
tena y uno que le quit al Hierro.
uno de los electrones del Hierro
Q-811
117
Divisin de Ingeniera
Departamento de Fsica y Qumica
c) Aumento algebraico del c) Disminucin algebraica del
nmero de oxidacin.
nmero de oxidacin.
Ejemplo:
Ejemplo:
2FeBr3 + 3Cl2 2FeCl3 + 3Br2
2FeBr3 + 3Cl2 2FeCl3 + 3Br2
3+ 10
3+ 10
3+ 10
3+ 10
El bromo pasa de -1 a 0, por lo que El cloro pasa de 0 a -1 por lo que est
est aumentando su nmero de disminuyendo su nmero de oxidacin
oxidacin
El proceso de oxidacin siempre est acompaado del proceso de
reduccin, ya que si alguien pierde electrones, otro ms debe ganarlos
en la misma reaccin.
Otra forma de llamar a la sustancia que se reduce y a la que se
oxida es agente oxidante y agente reductor.
Agente Oxidante
Aquel
que
oxida
al
compuesto,
por lo que l se reduce,
y gana electrones
Agente Reductor
otro Aquel que reduce al otro compuesto
por lo que l se oxida,
y pierde electrones
En las reacciones de oxidacin y reduccin adems de cumplirse las
leyes de:
Conservacin de masa y
Conservacin de energa
Se debe cumplir la ley de:
Conservacin de cargas
Para verificar que esta ley se cumpla y adems, para determinar
cuntos electrones se estn intercambiando en la reaccin es necesario
balancear la reaccin en una forma que indique las cargas y los
electrones intercambiados.
Existen tres Formas de Escribir las Ecuaciones Redox:
Forma molecular: es la forma comn de escribir las reacciones
qumicas, en esta forma se muestran las molculas completas.
- Ejemplo:
FeBr3 + Cl2 FeCl3 + Br2
(No esta balanceada)
Forma inica total: en esta forma se separan las molculas inicas
en sus iones componentes.
- Ejemplo:
Q-811
118
Divisin de Ingeniera
Departamento de Fsica y Qumica
(Fe3+ + 3Br1-) + Cl2 (Fe3+ + 3Cl1-) + Br2
Cuando un ion no cambia su nmero de oxidacin, se le llama ion espectador, como el caso del
Hierro en esta reaccin.
Forma inica neta: indica nicamente los iones o compuestos que
participan en la reaccin, es decir se quitan los iones espectadores.
3Br1- + Cl2 3Cl1- + Br2
Esta forma permite separa la reaccin en dos semireacciones:
semireaccin de oxidacin: 3Br1- Br2
semireaccin de reduccin: Cl2 3Cl1En esta forma se pueden balancear las semireacciones para
obtener el nmero de electrones intercambiados al que se conoce como
n.
6Br1- 3Br2 + 6e6e- + 3Cl2 6Cl1(Nmero de electrones intercambiados)
Para determinar el nmero de electrones intercambiados se necesita
balancear las reacciones y cuando se utilizan las reacciones inicas para
este proceso se le conoce como mtodo de ion-electrn. Este balanceo
se puede llevar a cabo por dos mtodos:
Mtodo I:
1. Escribir la ecuacin inica neta lo ms completa posible.
2. Separarla en semireacciones e identificarlas como oxidacin y
reduccin
3. Balancear la masa, primero los tomos que se oxidan y se reducen y
despus H y O.
Para balancear O y H se debe considerar si es:
En medio cido
En medio bsico
Para balancear en medio cido:
Para balancear O, agregar una de H2O por cada O que falte.
Para Balancear H, agregar un ion H+ por cada H que falte.
Para balancear en medio bsico:
Para balancear O, agregar 2OH- para cada O.
Para balancear H, agregar una molcula de H2O por cada 2 H.
4. Balancear carga con electrones, colocando los electrones del lado de
productos en la reaccin de oxidacin y del lado de reactivos en la
reaccin de reduccin.
5. Igualar el cambio en el nmero de electrones (este ser n ) con el
mnimo comn mltiplo.
Q-811
119
Divisin de Ingeniera
Departamento de Fsica y Qumica
6. Sumar ambas semireacciones, eliminando trminos comunes para
obtener la Ecuacin Inica Neta Balanceada.
Mtodo II: este difiere del mtodo anterior nicamente en el paso 3.
1. Escribir la ecuacin inica neta lo ms completa posible.
2. Separarla en semireacciones e identificarlas como oxidacin y
reduccin
3. Balancear la masa, primero los tomos que no sea O y H y despus
estos.
Para balancear O y H se debe considerar si es:
En medio cido
En medio bsico
Para balancear en medio cido:
a) Para balancear O, agregar una de H2O por cada O que falte.
b) Para Balancear H, agregar un ion H+ por cada H que falte.
- En medio bsico adems de los pasos anteriores se hace lo siguiente:
c) agregar OH- en ambos lados de la semireaccin en el mismo nmero
de H+.
c) Formar molculas de H2O donde quede H+ y OH- y eliminar molculas
de agua.
4. Balancear carga con electrones, colocando los electrones del lado de
productos en la reaccin de oxidacin y del lado de reactivos en la
reaccin de reduccin.
5. Igualar el cambio en el nmero de electrones (este ser n), en
ambas semireacciones con el mnimo comn mltiplo.
6. Sumar ambas semireacciones, eliminando trminos comunes para
obtener la Ecuacin Inica Neta Balanceada.
Para saber si el medio es cido o bsico se hace en referencia al
equilibrio inico del agua:
H2O OH- + H+
2H2O OH-+H3O+
La constante de equilibrio para esta reaccin es K=[H+][OH-]=1x10-14 y
la concentracin de cada uno de estos es de 1x10-7.
Si la sustancia que se agrega al agua aumenta la concentracin
se dice que es un cido y habr un exceso de estos iones
la solucin, si la sustancia que se agrega al agua aumenta
concentracin de OH- es una base y habr un exceso de estos iones
la solucin.
H+(H3O+),
Q-811
120
de
en
la
en
Divisin de Ingeniera
Departamento de Fsica y Qumica
Para determinar cuantitativamente que tanto se aumenta esta
concentracin de H+ se tiene el concepto de pH, donde la p significa -log,
por lo que tenemos que: pH=(-log)[H+], y cuando no se ha agregado
nada al agua el pH es igual a -log[1x10-7]=7, que se conoce como pH
neutro. Si se aumenta la concentracin de H+, el pH ser entre de 0 a
<7 y se dice que es medio cido. Si se aumenta la concentracin de OH, la concentracin de H+ disminuye y el pH ser de >7 a 14 y se dice
que es medio bsico, es decir que en medio cido hay un exceso de H+ y
en medio bsico un exceso de OH-.
- Ejemplo de balanceo por el mtodo de in electrn:
En medio bsico, los iones hipoclorito oxidan a los iones cromito a iones
cromato y se reducen a iones cloruro. Escriba la ecuacin inica neta
balanceada para esta reaccin y determine el nmero de electrones
intercambiados.
1) Reaccin: ClO- + CrO2- CrO42-
Cl-
2) Separar:
CrO2- CrO42- semireaccin de oxidacin (gana
oxgeno el Cr)
ClO- Clsemireaccin de reduccin ( pierde oxgeno
el Cl)
3) Balancear la masa. El Cr y el Cl ya estn balanceados, por lo que se
balancea el O en ambas semireacciones:
Mtodo I
4OH- + CrO2- CrO42- + 2H2O
H2O + ClO- Cl- + 2OHMtodo II
a), b), c) 4OH- + 2H2O + CrO2- CrO42- + 4H+ + 4OH2OH- + 2H+ + ClO- Cl- + H2O + 2OHd)
4OH- + 2H2O + CrO2- CrO42- + 4H2O
2H2O + ClO- Cl- + H2O + 2OH4OH- + CrO2- CrO42- + 2H2O
H2O + ClO- Cl- + 2OHEn los dos mtodos la ecuacin quedo igual
4) Balancear la carga, (los electrones en productos en la semireaccin de
oxidacin y en reactivos en la semireaccin de reduccin):
4OH- + CrO2- CrO42- + 2H2O + 3e2e- + H2O + ClO- Cl- + 2OHQ-811
121
Divisin de Ingeniera
Departamento de Fsica y Qumica
5) Igualar( la primera se multiplica por 2 y la segunda por 3)
(4OH- + CrO2- CrO42- + 2H2O + 3e-)(2)
(2e- + H2O + ClO- Cl- + 2OH-)(3)
6) Sumar y obtener n y la ecuacin:
8OH- + 2CrO2- 2CrO42- + 4H2O + 6e6e- + 3H2O + 3ClO- 3Cl- + 6OH2OH- + 2CrO2- + 3ClO- 2CrO42- + 3Cl- + H2O
n=6
Ejercicio
Balancee las siguientes reacciones y obtenga n.
1. En medio cido: MnO4- + Fe2+ Fe3+ + Mn2+
Respuesta:
MnO4- + Fe2+ Fe3+ + Mn2+
2. En medio bsico: ClO- + Cr CrO42- + Cl3. En medio bsico: Cr2O72- + SO32- SO42- + Cr3+
Reaccin Redox:
Al lugar fsico donde se lleva a cabo la reaccin de oxidacin-reduccin
se le llama Celda.
En una celda se encuentran fsicamente conectadas las reacciones de
oxidacin y las de reduccin. Cuando separamos fsicamente cada una
de las reacciones, se le llama Semicelda. En la semicelda se encuentra la
forma oxidada y reducida del elemento.
Celda Lugar fsico de una reaccin redox.
Zn
Zn
2+
Cu
Q-811
CuSO4
2+
2-
SO4
122
Divisin de Ingeniera
Departamento de Fsica y Qumica
Inicialmente
se
tiene
Sulfato de Zinc en una de
las semiceldas y Sulfato de
Zn
Cu
Cobre en la otra. El Zinc de
la
barra
comienza
a
+
2K2 SO4
2+
disolverse (pasando a Zn
+2e-), y el cobre en la otra
semicelda (Cu2+) pasa a
2+
Zn
ZnSO4
CuSO4 Cu0, depositndose sobre la
Cu
barra. Al suceder esto, en la
2+
2SO4
K SO4
semicelda de Oxidacin hay
deficiencia de iones SO42mientras en la otra celda hay un exceso. El puente salino se encarga de
equilibrar las cargas, liberando Potasio (K+) en la semicelda de reduccin
para compensar al Cobre que se deposita, y iones SO42- en la semicelda
de Oxidacin, ya que al disolverse el Zinc, son necesarios ms iones
SO42-. nodo se define como la semicelda donde ocurre la oxidacin y
ctodo donde ocurre la reduccin. La diferencia de energa potencial de
la celda se mide en volts. A esta diferencia de energa potencial se le
conoce tambin como diferencia de potencial o simplemente potencial de
celda y se le representa como E, tambin se le conoce como fuerza
electromotriz o fem.
1 Voltio: Diferencia de energa potencial necesaria para darle 1 Joule de
energa a una carga de 1 Coulomb.
1V
1J
1C
La celda de Cu y Zn tiene un potencial de 1.1V y en esta el cobre se
reduce y el zinc se oxida. Si se construye una celda de cobre y plata, lo
que ocurre ahora es que la plata se reduce y el cobre se oxida con un
potencial de 0.460V. Para determinar si un elemento se reduce o se
oxida frente a otro, se necesita saber quin tiene mayor energa y para
saber esto se necesita una referencia, esta referencia es la celda se
hidrgeno, con respecto a la cual se comparan todas las dems
semiceldas y se construye una tabla con estos valores, que se conoce
como serie electromotriz en la cual estn reportados los potenciales de
reduccin frente al hidrgeno, un valor negativo en esta tabla indica que
este elemento se oxida frente al hidrgeno.
Energa de Celda
Se define como: ECELDA=EOXID.+EREDUC.
En condiciones estndar (25C, [1M], P=1atm), E0CELDA=E0OXID.+E0REDUC.
Q-811
123
Divisin de Ingeniera
Departamento de Fsica y Qumica
Se toma con referencia a la celda de hidrgeno
Galvanicas/Voltaicas Generan Corriente al reaccionar
Tipos de celda
Electroliticas Necesitan Corriente para Reaccionar
Primarias : La reaccion no se regenera (retrocede)
ej. pilas
Celdas Galvanicas o Voltaicas
Secundarias : La reaccion si se regenera
ej. Acumuladores
Alambre
de Pt
H2 1atm
Celdas Galvnicas o Voltaicas
Se toma como referencia el electrodo
de hidrgeno
Serie electromotriz: Tabulacin de la
comparacin de Semiceldas comparadas
contra el electrodo de Hidrgeno. En
ella solo se reporta la Energa de
reduccin.
Usos de la serie electromotriz:
Determinar
si
una
reaccin
es
espontnea o no: Cuando la E0CEL=(+)
H Cl
1M
Pt
Ejercicios:
1. Determinar si los iones Cr3+ oxidan a los iones Cu2+ o viceversa.
Como resolverlo: Plantear las reacciones de ambas semiceldas, tomando en
cuenta los valores de la serie electromotriz. Balancear por ion-electrn si es
necesario y obtener la E0CEL.
Q-811
124
Divisin de Ingeniera
Departamento de Fsica y Qumica
2. Calcule el potencial estndar de celda para una celda formada por
Aluminio y Yodo: 2Al + 3I2 2Al3+ + 6I-. Diga si es o no espontnea e
indique el nmero de electrones intercambiados.
Clculo en condiciones no estndar (Ecuacin de Nernst):
RT
ECELDA E 0
ln Q
CELDA nF
donde: R es la constante de los gases 8.314J/mol K, Q es el cociente de
reaccin, F es la constante de Faraday 96500 J/Voltmol de e -, n es el
nmero de electrones intercambiados, T es la temperatura en Kelvin.
Esta expresin tambin relaciona concentraciones con potenciales de
celda (por Q).
Relacin entre energa libre y Energa de celda
E = +, G = - la reaccin es espontnea
G=-nFE
G=-nFE
G=G + RTlnQ
G=-RTlnK
Relacin entre K y E
nFE RT ln K
RT
Eo
ln K
nF
nFE o
ln K
RT
Ejercicios:
1. Calcule la Fuerza Electromotriz que se genera en una celda formada
por Al e I:
Al(s) + I2(s) Al3+(ac) + I-(ac) E0celda=2.19V., cuando [Al3+]=4x10-3M
y [I-]=0.1M.
2. Empleando la serie electromotriz, calcule K a 25C para la reaccin:
Q-811
125
Divisin de Ingeniera
Departamento de Fsica y Qumica
2IO-3 (ac) + 5Cu (s) + 12H+ (ac) I2 (s) + 5Cu2+ (ac) + 6H2O (l).
3. Calcule la energa libre de la siguiente reaccin empleando los
potenciales estndar de celda:
I2(s) + 5Cu2+ (ac) + 6H2O(l) 2IO-3(ac) + 5Cu(ac) + 12H+(ac).
4. Calcule la concentracin de iones H+ para la celda formada por Zinc e
Hidrgeno, si: [Zn2+]=1M, [H+]=1 atm, y EZn2+/Zn0=-0.76v.
Zn + 2H+ Zn2+ (ac) + H2 (g)
Celdas Electrolticas
I
Na++1e- Na
(-)
(+)
Na Cl
(Fundido)
reduccin
2Cl- Cl2 (g) + 2e-
Na+ + 1e- Na
1mol + 1mol e- 1 mol(= 23g)
1mol e-=6.023x1023 e-=1 Faraday
Ley de Faraday de la Electrlisis
Los gramos oxidados y/o reducidos son directamente proporcionales a la
corriente elctrica.
Cu2+ + 2e- Cu0
un mol de Cobre 2+, + dos Faradays 1 mol Cobre 0.
Un Faraday = un mol de electrones = 6.023x1023 electrones. Se define
como la cantidad de electrones que deposita un peso equivalente del
elemento.
El peso equivalente del elemento se obtiene dividiendo el peso molecular (o
atmico) entre el nmero de moles de electrones de la reaccin.
Corriente elctrica: se mide en amperes. Ampere = Coulomb/Segundo
Unidad de Carga elctrica:
Q-811
126
Divisin de Ingeniera
Departamento de Fsica y Qumica
Coulomb = (1 Amp)(1 seg)
Coulomb: es la carga transferida cuando un ampere fluye durante un
segundo y es equivalente a la cantidad de electrones que depositan
0.001118g de plata en el ctodo, durante la electrlisis de una disolucin
acuosa de iones plata sin lmite de tiempo. Y la equivalencia entre
Faraday y Coulomb es la siguiente:
1 Faraday 96486C = 96500 Coulombs
Constante de Faraday
Ejercicios:
1. Calcular la cantidad de gramos de Cobre que se depositan cuando se
hace pasar una corriente de dos amperes a travs de una solucin de
sulfato de cobre (CuSO4), durante 45 minutos.
2. Determinar el nmero de oxidacin de una solucin de Bi, si cuando
se hace pasar una corriente de seis amperes durante dos horas se
obtuvieron 3.5g de Bi.
Sugerencia: plantea en la ecuacin el nmero de electrones de ms o
menos y los moles de electrones proporcionados como incgnitas.
3.- Qu masa de platino puede depositarse sobre un anillo mediante
electrlisis de sal de platino(II) con una corriente de 0.150 amperes
durante 60.0 segundos?
4.- Qu volumen de H2 y O2 se producen durante la electrlisis de agua
con una corriente de 1.80amperes durante 4 horas en condiciones PTE?
- Forma de Resolver los problemas:
Corriente y Tiempo Carga en Coulombs Nmero de Faradays
Nmero de moles oxidados o reducidos Gramos de substancia
reducida u oxidada.
Q-811
127
Вам также может понравиться
- Manual Temas (1,2,3,4,5,6,7,8) 2013Документ125 страницManual Temas (1,2,3,4,5,6,7,8) 2013Ali Giselle MaldonadoОценок пока нет
- Tema 3. El ÁtomoДокумент11 страницTema 3. El ÁtomoSam Gonzales100% (1)
- Políticas de Química Q-811Документ125 страницPolíticas de Química Q-811Kiria Alves SilvaОценок пока нет
- Guía de aprendizaje Química Fundamental IДокумент19 страницGuía de aprendizaje Química Fundamental ISimoni ReinosoОценок пока нет
- Guía 2, Ejemplos y TallerДокумент6 страницGuía 2, Ejemplos y Talleranderson yoel galan prietoОценок пока нет
- Que Es El AtomoДокумент10 страницQue Es El AtomoDavidCovicОценок пока нет
- Guía - 02 - Números Cuánticos y Configuración ElecrónicaДокумент13 страницGuía - 02 - Números Cuánticos y Configuración ElecrónicaYayo Pizarro AlarconОценок пока нет
- MateriaДокумент4 страницыMateriaeli gaillardОценок пока нет
- Guía 4. 10 Numero CuanticosДокумент7 страницGuía 4. 10 Numero CuanticosSan Mate El RobleОценок пока нет
- Quimica-009-Niveles de Energia Sub Niveles Orbitales y ElectronesДокумент7 страницQuimica-009-Niveles de Energia Sub Niveles Orbitales y ElectronesMoroni45Оценок пока нет
- Regla de Las Diagonales Configuracion ElectronicaДокумент6 страницRegla de Las Diagonales Configuracion ElectronicaEquipo Bicentenario100% (1)
- Mecánica Cuántica y Configuración ElectrónicaДокумент60 страницMecánica Cuántica y Configuración ElectrónicaWILBERT.AYMA.CC.Оценок пока нет
- CienciasДокумент10 страницCienciasJosé SandovalОценок пока нет
- Guia de Quimica para RevisionДокумент37 страницGuia de Quimica para RevisionLorena Betzabeth Gutierrez GodoyОценок пока нет
- Clase 3 Modelos Atomicos U2Документ23 страницыClase 3 Modelos Atomicos U2Milagros RamirezОценок пока нет
- Guía La Configuración ElectrónicaДокумент2 страницыGuía La Configuración ElectrónicaLiliana HernándezОценок пока нет
- Guía 4 de Química Grado 10Документ11 страницGuía 4 de Química Grado 10yaritza pereaОценок пока нет
- Configuracion ElectronicaДокумент7 страницConfiguracion ElectronicaNAHOMY ALEXANDRA MEZA ALFAROОценок пока нет
- Tabla PeriodicaДокумент16 страницTabla PeriodicaViicky SoledadОценок пока нет
- Configuración electrónica átomosДокумент7 страницConfiguración electrónica átomosjhon jaderОценок пока нет
- Resolución Examen Unidad 2 PDFДокумент6 страницResolución Examen Unidad 2 PDFDanielОценок пока нет
- Trabajo de Quimica3Документ29 страницTrabajo de Quimica3MaggieОценок пока нет
- Configuración electrónica: distribución de electrones en átomosДокумент30 страницConfiguración electrónica: distribución de electrones en átomosJorge MéndezОценок пока нет
- Tarea 1 QuimicaДокумент6 страницTarea 1 QuimicaLymAlonzoОценок пока нет
- Valores de Los 4 Números Cuánticos para Los Siete Niveles Atómicos.Документ9 страницValores de Los 4 Números Cuánticos para Los Siete Niveles Atómicos.Miguel Angel SanchezОценок пока нет
- Configuracion ElectronicaДокумент16 страницConfiguracion ElectronicaEMIR BARRERA RADAОценок пока нет
- Config ElecДокумент8 страницConfig ElecPedro SolaresОценок пока нет
- Materia y Energía. Estructura Atómica. (Segunda Parte) .Документ25 страницMateria y Energía. Estructura Atómica. (Segunda Parte) .Fabricio RodríguezОценок пока нет
- Laboratorio Configuracion Electronica y La Tabla PeriodicaДокумент7 страницLaboratorio Configuracion Electronica y La Tabla PeriodicaErick Jesus quinteroОценок пока нет
- Configuracion ElectronicaДокумент29 страницConfiguracion ElectronicaOmar OrtizОценок пока нет
- Configuración electrónica y números cuánticosДокумент21 страницаConfiguración electrónica y números cuánticosYuleiny Arteaga PereiraОценок пока нет
- EMVZ Tema 2. - NÚMEROS CUANTICOS Y DISTRIBUCION ELECTRÓNICAДокумент24 страницыEMVZ Tema 2. - NÚMEROS CUANTICOS Y DISTRIBUCION ELECTRÓNICAMax TorresОценок пока нет
- Separata Semana 2Документ39 страницSeparata Semana 2quimicocad9891Оценок пока нет
- QC03Números Cuánticos y Configuración ElectrónicaДокумент15 страницQC03Números Cuánticos y Configuración ElectrónicaDiego SosaОценок пока нет
- Química Números CuánticosДокумент4 страницыQuímica Números CuánticosCarlaKarina TC100% (1)
- Números cuánticos y sus aplicacionesДокумент11 страницNúmeros cuánticos y sus aplicacionesJaimeОценок пока нет
- Reporte Tabla PeriodicaДокумент10 страницReporte Tabla Periodicasc0rpi091Оценок пока нет
- Guia N°1 Numeros CuanticosДокумент3 страницыGuia N°1 Numeros CuanticosparinacotaОценок пока нет
- Estructura de la materia, reacciones químicas y nucleares en fisicoquímica de tercer añoДокумент29 страницEstructura de la materia, reacciones químicas y nucleares en fisicoquímica de tercer añoLeandro R. D'Annunzio100% (3)
- Estructura AtómicaДокумент45 страницEstructura AtómicaprofesorcienciaslabОценок пока нет
- Modelo Mecánico CuánticoДокумент5 страницModelo Mecánico CuánticoRuth Monica Colipi JaraОценок пока нет
- Guía de Estudio Números Cuánticos y Configuración ElectrónicaДокумент3 страницыGuía de Estudio Números Cuánticos y Configuración ElectrónicaFrancisco Alejandro Valenzuela Marquez100% (1)
- Trabajo de Quimica 1Документ6 страницTrabajo de Quimica 1CAMILO ERNESTO HERRAN TOROОценок пока нет
- Modelo Mecano Cuántico y Configuracion ElectrónicaДокумент18 страницModelo Mecano Cuántico y Configuracion ElectrónicaFelipe Alejandro JaraОценок пока нет
- Configuración ElectrónicaДокумент23 страницыConfiguración ElectrónicaFabricio Mayta Benitez100% (1)
- Actividad 3°2fisicoquímicaДокумент4 страницыActividad 3°2fisicoquímicaVania DavalosОценок пока нет
- Guia N°1 Numeros cuanticos-NM1-Números Cuánticos LezaetaДокумент3 страницыGuia N°1 Numeros cuanticos-NM1-Números Cuánticos LezaetaLorena Cecilia Peralta Beretta100% (1)
- Numeros Cuanticos y Configuracion ElectronicaДокумент26 страницNumeros Cuanticos y Configuracion ElectronicaArelis GonzalezОценок пока нет
- Tarea 1 QuimicaДокумент6 страницTarea 1 QuimicaLymAlonzo100% (1)
- Configuración Electrónica - Wikipedia, La Enciclopedia LibreДокумент11 страницConfiguración Electrónica - Wikipedia, La Enciclopedia LibrePaola Castro0% (1)
- Los Elementos Químicos y La Tabla PeriódicaДокумент12 страницLos Elementos Químicos y La Tabla PeriódicaLaura Gemma Rodríguez PastorОценок пока нет
- Números cuánticos, configuración electrónica y estructura atómicaДокумент8 страницNúmeros cuánticos, configuración electrónica y estructura atómicaLuis Fernando Noriega LozanoОценок пока нет
- Tema de Numeros CuanticosДокумент11 страницTema de Numeros CuanticosZeta SeiОценок пока нет
- Libro Principal 03 PDFДокумент18 страницLibro Principal 03 PDFFranОценок пока нет
- Orbitales AtómicosДокумент7 страницOrbitales AtómicosCarlos E Castillo GuzmanОценок пока нет
- I02N Material S02.s1Документ37 страницI02N Material S02.s1Aarón M. ReyesОценок пока нет
- ACTIVIDADES A DESARROLLAR QuimicaДокумент6 страницACTIVIDADES A DESARROLLAR Quimicanewarley gonzalezОценок пока нет
- Clase1 36601Документ20 страницClase1 36601dfsadsvgfdsОценок пока нет
- Experiencias sobre circuitos eléctricos en serie operados por corriente directaОт EverandExperiencias sobre circuitos eléctricos en serie operados por corriente directaОценок пока нет
- Mecánica Cuántica Relativista y No Relativista: las dos a la vez: Parte I: Estados estacionariosОт EverandMecánica Cuántica Relativista y No Relativista: las dos a la vez: Parte I: Estados estacionariosОценок пока нет
- Desigualdades de MateДокумент7 страницDesigualdades de MateGeovany HernándezОценок пока нет
- Informe Final de Tesis - Ronald ChénДокумент95 страницInforme Final de Tesis - Ronald ChénRonald ChenОценок пока нет
- CINEMÁTICAДокумент50 страницCINEMÁTICARonald ChenОценок пока нет
- El Caracter de La Ley Fisica PDFДокумент155 страницEl Caracter de La Ley Fisica PDFRonald ChenОценок пока нет
- 2do. Básico - Matemática-Examen Final-3er BloqueДокумент2 страницы2do. Básico - Matemática-Examen Final-3er BloqueRonald ChenОценок пока нет
- Problemas Resueltos de Newton Sears Zemansky, Halliday Resnick, SerwayДокумент106 страницProblemas Resueltos de Newton Sears Zemansky, Halliday Resnick, SerwayJunior84% (38)
- La Fisica de Los Superheroes - James KakaliosДокумент1 444 страницыLa Fisica de Los Superheroes - James KakaliosJerónimo CardanoОценок пока нет
- Contabilidad General 1Документ131 страницаContabilidad General 1Ronald Chen100% (1)
- Calor y temperatura: preguntas conceptuales y experimentos sobre escalas térmicasДокумент2 страницыCalor y temperatura: preguntas conceptuales y experimentos sobre escalas térmicasRonald Chen0% (1)
- Benjamines Semana1Документ10 страницBenjamines Semana1Ronald ChenОценок пока нет
- Linero DemostracionMatematicas AsДокумент15 страницLinero DemostracionMatematicas Asjasan3000Оценок пока нет
- Prueba de Olimpiadas de MatemáticasДокумент12 страницPrueba de Olimpiadas de MatemáticasRonald ChenОценок пока нет
- Aritm y Matem 13 de Febrero 2015 PDFДокумент500 страницAritm y Matem 13 de Febrero 2015 PDFKelly Johanna Gomez ArboledaОценок пока нет
- 10 Acertijos Clasicos Que Pondran A Prueba Tu Capacidad LogicaДокумент3 страницы10 Acertijos Clasicos Que Pondran A Prueba Tu Capacidad LogicaRonald ChenОценок пока нет
- AprestoДокумент54 страницыAprestoElba Godoy CaroОценок пока нет
- Problemas Resueltos Cap 2 Fisica Sears ZemanskyДокумент29 страницProblemas Resueltos Cap 2 Fisica Sears ZemanskyMarin Samaniego Martin40% (5)
- Enseñando Mate PDFДокумент91 страницаEnseñando Mate PDFJonathan SasugaОценок пока нет
- Estudios Regionales Comparativos ExplicativosДокумент9 страницEstudios Regionales Comparativos ExplicativosRonald ChenОценок пока нет
- Informe IIIB2013Документ125 страницInforme IIIB2013Ronald ChenОценок пока нет
- Método Polya en la resolución de problemas aritméticosДокумент110 страницMétodo Polya en la resolución de problemas aritméticosRonald ChenОценок пока нет
- Problemas de Olimpiada Matematica Guanajuto 2003Документ150 страницProblemas de Olimpiada Matematica Guanajuto 2003Matthew WoodsОценок пока нет
- Matematicas Criticas para Las Sociedades PDFДокумент182 страницыMatematicas Criticas para Las Sociedades PDFRonald ChenОценок пока нет
- OMM FavoritosДокумент76 страницOMM FavoritosRonald ChenОценок пока нет
- Material 4 - 17 de Junio 2010Документ97 страницMaterial 4 - 17 de Junio 2010viterickОценок пока нет
- 100 ProblemascompletoДокумент96 страниц100 ProblemascompletoRubenDarioUribeQuejadaОценок пока нет
- Dinosaurio 2017Документ104 страницыDinosaurio 2017Ronald ChenОценок пока нет
- Folleto 9 Olimpiada 2015Документ130 страницFolleto 9 Olimpiada 2015Ronald ChenОценок пока нет
- Examen Om 1basДокумент1 страницаExamen Om 1basRonald ChenОценок пока нет
- Las Matemáticas de La Fórmula de Puntuación de Exámenes TestДокумент6 страницLas Matemáticas de La Fórmula de Puntuación de Exámenes TestRonald ChenОценок пока нет
- Química-Estructura AtómicaДокумент52 страницыQuímica-Estructura AtómicaJorge LuisОценок пока нет
- Carga Formal y Resonancia - 03-2011Документ7 страницCarga Formal y Resonancia - 03-2011Juan Camilo Restrepo LópezОценок пока нет
- Tema 1. Modulo 1, 2012-2013 VFДокумент30 страницTema 1. Modulo 1, 2012-2013 VFEdward MoncadaОценок пока нет
- Practica 4 Qui MicaДокумент16 страницPractica 4 Qui MicaDaniel AvilaОценок пока нет
- Enlace Químico OriginalДокумент4 страницыEnlace Químico OriginalMtra Sofy ChaconОценок пока нет
- Taller - Nomenclatura - Quimica - Inorganica y Tipos de ReaccionesДокумент17 страницTaller - Nomenclatura - Quimica - Inorganica y Tipos de ReaccionesJulieth VarilaОценок пока нет
- Ejercicios Solemnes Quimica General (Qui100)Документ8 страницEjercicios Solemnes Quimica General (Qui100)api-3701781100% (4)
- Guia de Enlaces QuimicosДокумент6 страницGuia de Enlaces QuimicosJonadis Mosquera CoyОценок пока нет
- Química - Semana 3Документ11 страницQuímica - Semana 3EDUARDO SANCHEZ TENAZOA 5 SECUNDARIAОценок пока нет
- ALCOHOLES PROBLEMAS RESUELTOSДокумент20 страницALCOHOLES PROBLEMAS RESUELTOSMario Leonardo Guevara Escalante78% (18)
- Funciones InorgánicasДокумент70 страницFunciones Inorgánicasdmvaldes21Оценок пока нет
- FACULTAD DE CIENCIAS AGROPECUARIAS MEDICINA VETERINARIA QUÍMICA BIOLÓGICAДокумент8 страницFACULTAD DE CIENCIAS AGROPECUARIAS MEDICINA VETERINARIA QUÍMICA BIOLÓGICATERESA DE JESÚS MONSALVES LAGOSОценок пока нет
- Propiedades de los elementos químicos en la tabla periódicaДокумент5 страницPropiedades de los elementos químicos en la tabla periódicaPedro100% (1)
- Taller Periodicidad Quimica - 1.2Документ4 страницыTaller Periodicidad Quimica - 1.2Sennova CSETОценок пока нет
- Guía de aprendizaje de tabla periódica y propiedades periódicasДокумент7 страницGuía de aprendizaje de tabla periódica y propiedades periódicasNatalia Cruz Varón0% (1)
- Polaridad de Las MoléculasДокумент10 страницPolaridad de Las MoléculasWert AssaudОценок пока нет
- Unidad 3 Quim MecДокумент17 страницUnidad 3 Quim MecCRISTINA PATRICIA PINEDA BELMONTESОценок пока нет
- Pre AtomoДокумент43 страницыPre AtomoMaleja LagunaОценок пока нет
- Inter HalogenosДокумент5 страницInter HalogenosLiliana Bueno100% (1)
- Solubilidad y ReactividadДокумент16 страницSolubilidad y ReactividadROMAN CORDOVA DIOLINDAОценок пока нет
- Ejercicios RESUELTOS Del Tema 2 (Enlace Químico)Документ8 страницEjercicios RESUELTOS Del Tema 2 (Enlace Químico)Mavi Gonzales PérezОценок пока нет
- Clase 8 Uniones Iónicas para ClassroomДокумент1 страницаClase 8 Uniones Iónicas para ClassroomMara NavarroОценок пока нет
- Propiedades Periodicas de Los ElementosДокумент16 страницPropiedades Periodicas de Los ElementosLuis Córdova CoxОценок пока нет
- Modalidad de Exámenes - Semana 4 - QuimicaДокумент2 страницыModalidad de Exámenes - Semana 4 - QuimicaPeter NavaОценок пока нет
- Seleccion Modelos TermodinamicosДокумент18 страницSeleccion Modelos TermodinamicosLvane Maria Pimentel100% (1)
- Semana 03Документ8 страницSemana 03Armando RJОценок пока нет
- Material Calculo AvanzadoДокумент142 страницыMaterial Calculo AvanzadontrsupreminuwuОценок пока нет
- Importancia tabla periódica MendeleevДокумент15 страницImportancia tabla periódica MendeleevHERNANDEZ FLORES EMMANUEL100% (1)
- Actividad de Agua en Los Alimentos PDFДокумент32 страницыActividad de Agua en Los Alimentos PDFJuan Anticona ZavaletaОценок пока нет
- Práctica 10. PROPIEDADES DE LOS COMPUESTOS FORMADOS CON ENLACE: IÓNICO, COVALENTE, COVALENTE COORDINADO Y METÁLICOДокумент8 страницPráctica 10. PROPIEDADES DE LOS COMPUESTOS FORMADOS CON ENLACE: IÓNICO, COVALENTE, COVALENTE COORDINADO Y METÁLICOCynthia SoteloОценок пока нет