Академический Документы
Профессиональный Документы
Культура Документы
TD28
Загружено:
Anis SouissiАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
TD28
Загружено:
Anis SouissiАвторское право:
Доступные форматы
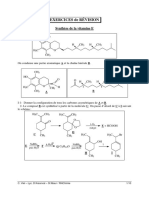
1 Exercices : 28 - Diagrammes E-pH [TD28.
tex]
Sciences Physiques MP 2007-2008
Exercices : 28 - Diagrammes E-pH
A. Lecture et utilisation
1. Diagramme de l
el
ement Cadmium
Le diagramme potentiel-pH de la figure 1 est celui du Cadmium pour une concentration totale de Cadmium
dissous egale `a 0, 01 mol L1 . Cette concentration de trace a ete affectee `a toutes les esp`eces dissoutes, on na
pas pratique lequirepartition.
E(V )
Cd(OH)2 s HCdO
2
Cd2+
0, 46
Cds
b
b
8, 1
11, 3
pH
Fig. 1 Diagramme Potentiel - pH du Cadmium
1. Que peut-on en deduire (quantitativement !) ?
2. On appelle s la solubilite de lhydroxyde de Cadmium (II) dans une solution de pH donne et ps = log(s).
Tracer la courbe donnant ps en fonction de pH. Quelle est la solubilite s de lhydroxyde de Cadmium (II)
dans leau pure ?
3. On introduit du Cadmium metallique dans de leau pure. Que se passera-t-il ? La reaction est tr`es lente
pour un pH compris entre 8 et 11. Proposer une explication.
B. Construction
2. Diagramme du Mercure
Etablir
le diagramme E pH des nombres doxydation 0, (I) et (II) du mercure en prenant pour toutes les
esp`eces dissoutes une concentration de 0, 01 mol L1 . On ne pratiquera pas ici lequirepartition.
On donne : Hg22+ /Hgliquide : E1 = 0, 80 V ; Hg2+ /Hg22+ : E2 = 0, 91 V et Hg(OH)2 solide : pKS = 26.
Reponses : E1 = 0, 74 V, E2 = 0, 85 V jusqu`
a pH = 2 ensuite Hg(OH)2 intervient et E2 = 1, 09 0, 12pH
jusqu`
a lintersection avec E1 = 0, 74 V `
a pH = 2, 9, enfin E3 = 0, 91 0, 06pH.
3. Diagramme de luranium
Le diagramme de luranium sera etabli pour une concentration de toutes les esp`eces dissoutes egale `a 1 molL1 .
On prendra en compte les esp`eces apparaissant dans les tableaux ci-dessous :
U(OH)3 s
pKs
18,5
U3+ /U
E ( V)
-1,80
U(OH)4 s UO2 (OH)2 s
49
24
4+
U4+ /U3+ UO2+
2 /U
-0,61
0,33
1. Determiner le degre doxydation de luranium pour les esp`eces UO2+
2 et UO2 (OH)2 s .
2. Determiner les equations des fronti`eres dans lesquelles sont engagees ces deux esp`eces.
3. Montrer que luranium au degre doxydation III nest pas stable `a partir dun certain pH que lon calculera.
4. Calculer le potentiel redox du couple U4+ /U.
5. Determiner lequation de la fronti`ere entre les esp`eces de degres IV et 0.
6. Tracer le diagramme complet de luranium.
7. Superposer le diagramme de leau. Que peut-on en deduire ?
C. Oxydor
eduction g
en
erale
4. D
etermination dun potentiel standard
Determiner le potentiel standard du couple Fe3+ /Fe.
On donne : E = 0, 77 V pour Fe3+ /Fe2+ et E = 0, 44 V pour Fe2+ /Fe.
JR Seigne
Fauriel
St Etienne
Sciences Physiques MP 2007-2008
Exercices : 28 - Diagrammes E-pH [TD28.tex] 2
5. Pile `
a combustible
On realise la pile `
a combustible representee par :
()
Ptsolide ||H2 gaz ||H2 Oliquide ||O2 gaz ||Ptsolide
(+)
la pression partielle des gaz restant fixee `
a 1 bar. La force electromotrice normale de cette pile vaut E = 1, 23 V
a 25C ; elle depend leg`erement de la temperature avec, dans le domaine 20C < t < 30C :
`
E
= 840 V K1
t
1. Quelle est la reaction chimique qui a lieu lorsque la pile fonctionne ?
2. Quelle est la valeur de lenthalpie libre standard de cette reaction `a 25C ?
3. Evaluer
pour cette meme reaction et toujours `a 25C les valeurs de r S et r H .
6. Potentiel standard apparent
Le potentiel standard apparent dun couple est le potentiel de ce couple quand toutes les activites des participants
sont egales `a lunite, `
a lexception de celle des ions H+ ou H3 O+ .
2+
`
A 298 K, on a Mg /Mg : E1 = 2, 37 V et pKS = 11 pour lhydroxyde de magnesium Mg(OH)2 s .
1. Determiner le potentiel standard du couple hydroxyde de magnesium/magnesium.
2. En deduire le potentiel apparent du couple Mg(II)/Mg(0) en fonction du pH. Tracer la courbe correspondante.
3. On consid`ere le couple S/H2 S dont le potentiel standard est egal `a E2 = 0, 14 V. Les constantes dacidite
de H2 S correspondent aux pKA suivants : 7, 0 et 13, 8. Determiner les intervalles de pH correspondant aux
domaines de predominance des diverses formes du soufre au degre doxydation (II).
4. Ecrire
la formule de Nernst pour le couple S/H2 S et en deduire les potentiels standard des couples S/HS
2
et S/S .
5. En deduire lexpression du potentiel standard apparent du couple S(0)/S(II) en fonction du pH. Tracer
la courbe correspondante.
JR Seigne
Fauriel
St Etienne
Вам также может понравиться
- TD ElectrochimieДокумент8 страницTD ElectrochimieRAMDEОценок пока нет
- Recueil Chimie 3Документ8 страницRecueil Chimie 3Safae RezzoukОценок пока нет
- TRAVAUX DIRIGES N°4 OXYDO - REDUCTION Et DIAGRAME E-pHДокумент4 страницыTRAVAUX DIRIGES N°4 OXYDO - REDUCTION Et DIAGRAME E-pHAlex N'zueОценок пока нет
- bt điện hóaДокумент28 страницbt điện hóaHằng NguyễnОценок пока нет
- Exercices7 Pair PourbaixДокумент4 страницыExercices7 Pair PourbaixEl mrtb hamzaОценок пока нет
- TD Electrochimie Et Applications, L3 Chimie Et M1 SC Phys 2018-2019Документ4 страницыTD Electrochimie Et Applications, L3 Chimie Et M1 SC Phys 2018-2019fernandОценок пока нет
- TD 4,5 Et 6 PDFДокумент5 страницTD 4,5 Et 6 PDFessadikine anassОценок пока нет
- LPro ElectroДокумент23 страницыLPro ElectroYoussef Akr100% (1)
- TD - E-Ph Et I-EДокумент7 страницTD - E-Ph Et I-EBadr BT100% (1)
- Oxydoréduction PC, Énoncés Des ExercicesДокумент30 страницOxydoréduction PC, Énoncés Des ExercicesLili KheОценок пока нет
- Potentiel PH PDFДокумент13 страницPotentiel PH PDFMalek abidiОценок пока нет
- CHIM105BS1DS20708Документ4 страницыCHIM105BS1DS20708tv tv100% (2)
- Séance 04 Juin 2020Документ29 страницSéance 04 Juin 2020Hafsa MajentaОценок пока нет
- C25 - Courbes Intensite Potentiel PDFДокумент8 страницC25 - Courbes Intensite Potentiel PDFAbdelhakim BailalОценок пока нет
- Winkler DiagrammeДокумент3 страницыWinkler Diagrammedemoiselle motivationОценок пока нет
- Travaux Dirigés de Chimie N° 6: Exercice 1: Équations de Réaction Et Constantes D'équilibreДокумент4 страницыTravaux Dirigés de Chimie N° 6: Exercice 1: Équations de Réaction Et Constantes D'équilibreAbderrahman IGHNIHОценок пока нет
- TD 3 Avec Corrigé de Chimie en SolutionДокумент7 страницTD 3 Avec Corrigé de Chimie en SolutionETUSUPОценок пока нет
- Travaux Dirigés CHM101 - Série N°1Документ5 страницTravaux Dirigés CHM101 - Série N°1RV EtseОценок пока нет
- Bilan de La Matiere Exercices Corriges 5Документ5 страницBilan de La Matiere Exercices Corriges 5sine abdellahОценок пока нет
- TP de Cinetique Chimique L2 Polytech - 080923Документ4 страницыTP de Cinetique Chimique L2 Polytech - 080923Alain Ditend100% (1)
- CHM224 2022 2023Документ102 страницыCHM224 2022 2023Franel YolandaОценок пока нет
- Chapitre 25-Diagramme Potentiel-Ph Et Potentiel PL PDFДокумент13 страницChapitre 25-Diagramme Potentiel-Ph Et Potentiel PL PDFRafik DraОценок пока нет
- Diagramme de FrostДокумент19 страницDiagramme de FrostmehdiОценок пока нет
- CF Chimie Des Solutions SMPC2 Ratrappage 2016Документ4 страницыCF Chimie Des Solutions SMPC2 Ratrappage 2016Hamza m'rabet100% (2)
- Apercu Methodes ElectrochimДокумент16 страницApercu Methodes ElectrochimSouhaib KHELIFIОценок пока нет
- TD C4: Electrochimie: Phenomenes de Corrosion Humide: DonnéesДокумент4 страницыTD C4: Electrochimie: Phenomenes de Corrosion Humide: DonnéesFatima BenОценок пока нет
- Chrono Potent I Om Ét RieДокумент33 страницыChrono Potent I Om Ét RieIsmail HisashiОценок пока нет
- AE6 Titrage Destop Conductimétrique-ProfДокумент4 страницыAE6 Titrage Destop Conductimétrique-Profbabouche fesdaОценок пока нет
- TD ChimieДокумент50 страницTD ChimieHoussam BenkerroumОценок пока нет
- Cours PDFДокумент44 страницыCours PDFAdnen LaamouriОценок пока нет
- Oxydo - Réduction Sujet Et CorrigéДокумент6 страницOxydo - Réduction Sujet Et Corrigémehdi benmassoudОценок пока нет
- Les Diagrammes de Phases BinairesДокумент67 страницLes Diagrammes de Phases BinairesSimon Njoh100% (1)
- C Ex23 Cin Ca PDFДокумент4 страницыC Ex23 Cin Ca PDFعادل الحمديОценок пока нет
- Corrigé Type Chimie Des Surfaces Master 1 CHIMIE M S1 2019 2020Документ2 страницыCorrigé Type Chimie Des Surfaces Master 1 CHIMIE M S1 2019 2020Zahra l زهرة50% (2)
- Reactions Equilibrees 2022Документ33 страницыReactions Equilibrees 2022Mira MslОценок пока нет
- Extrait CorrosionДокумент8 страницExtrait CorrosionMOHAMMED31Оценок пока нет
- Courbesintensite 2015 CoursДокумент30 страницCourbesintensite 2015 CourscherniОценок пока нет
- TD CH8 Precipitation PDFДокумент2 страницыTD CH8 Precipitation PDFMohamed OOОценок пока нет
- Electrolyse Exercices Corriges 02Документ4 страницыElectrolyse Exercices Corriges 02Zineddine SahirОценок пока нет
- CHIM105BS1DS20405Документ2 страницыCHIM105BS1DS20405tv tvОценок пока нет
- Examen L1PCSM Octobre 2015-+CorrigéДокумент3 страницыExamen L1PCSM Octobre 2015-+CorrigéSerigne Alassane Dieng100% (1)
- Thermochimie Exercices 11Документ10 страницThermochimie Exercices 11anouar agadir0% (1)
- Chap II ComplexationДокумент17 страницChap II ComplexationyoussefОценок пока нет
- LPro Spectro Picquet PDFДокумент173 страницыLPro Spectro Picquet PDFJunior MbatepОценок пока нет
- Cours Oxydoréduction en Solution AqueuseДокумент4 страницыCours Oxydoréduction en Solution AqueuseFleuretta FleureОценок пока нет
- EF1 Corrige Chimie3 19012016Документ5 страницEF1 Corrige Chimie3 19012016martin souman moulsiaОценок пока нет
- C1Chim Transformations Lentes Rapides Exercices PDFДокумент6 страницC1Chim Transformations Lentes Rapides Exercices PDFAzizElheniОценок пока нет
- Diagrammes E PHДокумент8 страницDiagrammes E PHHssan Driss0% (1)
- TD N°2 2020Документ2 страницыTD N°2 2020Ñar ĎjesОценок пока нет
- TD ElectrochimieДокумент9 страницTD Electrochimiepa75rin95Оценок пока нет
- ds1 Corrige PDFДокумент17 страницds1 Corrige PDFSamah SamahОценок пока нет
- TP Dosage O2 Winkler PDFДокумент7 страницTP Dosage O2 Winkler PDFSabin SamОценок пока нет
- Cinétique Électrochimique (PDFDrive)Документ25 страницCinétique Électrochimique (PDFDrive)Samah SoltaneОценок пока нет
- SMC 3Документ113 страницSMC 3kurts010100% (1)
- Mecanique Serie 3Документ2 страницыMecanique Serie 3maryem sousitaОценок пока нет
- Traitement de Surface Des Meta - NAJIM Mohammed - 253 PDFДокумент32 страницыTraitement de Surface Des Meta - NAJIM Mohammed - 253 PDFRebahi FaresОценок пока нет
- Courbes I F (E) Aspect CinétiqueДокумент13 страницCourbes I F (E) Aspect Cinétiquebchedhly malakОценок пока нет
- Thermochimie SMPC - TDДокумент26 страницThermochimie SMPC - TDoulaidОценок пока нет
- Cours - I-E (Chimie)Документ18 страницCours - I-E (Chimie)Chedly TrimechОценок пока нет
- 44 3 PDFДокумент3 страницы44 3 PDFMuhammad KouddàrОценок пока нет
- AQC Fiches Pathologie Bâtiment Spécial Outre MerДокумент68 страницAQC Fiches Pathologie Bâtiment Spécial Outre MerPfeifferОценок пока нет
- Exercices Analyse FinanciereДокумент224 страницыExercices Analyse Financierezbimbo100% (17)
- Le Nouveau Dictionnaire Visuel (Multilingue)Документ1 094 страницыLe Nouveau Dictionnaire Visuel (Multilingue)Pedro Menezes100% (21)
- Business Plan AQUA-BLUE Laverie (DaphnyLEMIGUI)Документ19 страницBusiness Plan AQUA-BLUE Laverie (DaphnyLEMIGUI)lemiguiОценок пока нет
- Catalogue Mural 2021 - Essid Céramique Fabricant de Carrelage en TunisieДокумент43 страницыCatalogue Mural 2021 - Essid Céramique Fabricant de Carrelage en TunisieAnis SouissiОценок пока нет
- Telerupteur PDFДокумент3 страницыTelerupteur PDFAnis Souissi100% (2)
- CatalogueДокумент1 страницаCatalogueAnis SouissiОценок пока нет
- Notion:: Formes JuridiquesДокумент2 страницыNotion:: Formes JuridiquesAnis SouissiОценок пока нет
- Telerupteur PDFДокумент3 страницыTelerupteur PDFAnis Souissi100% (2)
- Revit NomenclaturesДокумент6 страницRevit NomenclaturesAnis SouissiОценок пока нет
- Determinant1 091220043801 Phpapp01Документ7 страницDeterminant1 091220043801 Phpapp01Anis SouissiОценок пока нет
- Atlanta GroupДокумент60 страницAtlanta GroupAnis SouissiОценок пока нет
- Telerupteur PDFДокумент3 страницыTelerupteur PDFAnis Souissi100% (2)
- Pronopers1 091219144144 Phpapp01Документ5 страницPronopers1 091219144144 Phpapp01Anis SouissiОценок пока нет
- Securite ElectriqueДокумент4 страницыSecurite ElectriqueAnis Souissi100% (1)
- Securite ElectriqueДокумент4 страницыSecurite ElectriqueAnis Souissi100% (1)
- Verbegout 110807162824 Phpapp02Документ7 страницVerbegout 110807162824 Phpapp02Anis SouissiОценок пока нет
- Installations Electriques Domestiques v2007Документ36 страницInstallations Electriques Domestiques v2007Christian Zoundji100% (1)
- Mémento de Schémas Électriques Tome 2 (WWW - Genie-Electromcanique - Com) PDFДокумент62 страницыMémento de Schémas Électriques Tome 2 (WWW - Genie-Electromcanique - Com) PDFAbozou-Esso Pissiyou88% (25)
- Present 110628095155 Phpapp02Документ6 страницPresent 110628095155 Phpapp02Anis SouissiОценок пока нет
- Prepositions 110913135812 Phpapp01Документ8 страницPrepositions 110913135812 Phpapp01Anis SouissiОценок пока нет
- Gnadjectif 091222071813 Phpapp01Документ4 страницыGnadjectif 091222071813 Phpapp01Anis SouissiОценок пока нет
- Telerupteur PDFДокумент3 страницыTelerupteur PDFAnis Souissi100% (2)
- Tableauconjugaison 100117075948 Phpapp01Документ25 страницTableauconjugaison 100117075948 Phpapp01Anis SouissiОценок пока нет
- 6th Central Pay Commission Salary CalculatorДокумент15 страниц6th Central Pay Commission Salary Calculatorrakhonde100% (436)
- Comparaison 091221052049 Phpapp01Документ9 страницComparaison 091221052049 Phpapp01Anis SouissiОценок пока нет
- Matlab PDFДокумент2 страницыMatlab PDFAnis SouissiОценок пока нет
- Auxanglais 100123113533 Phpapp01Документ7 страницAuxanglais 100123113533 Phpapp01Anis SouissiОценок пока нет
- PoutreДокумент1 страницаPoutreAnis SouissiОценок пока нет
- Chimie PHДокумент15 страницChimie PHGuy Myd'ha NzalakandaОценок пока нет
- Serie D'exercices Radioactivité3Документ19 страницSerie D'exercices Radioactivité3oumaimamoussaoui2807Оценок пока нет
- TIVOLY - Scule Aschietoare 2018Документ500 страницTIVOLY - Scule Aschietoare 2018SculegeroОценок пока нет
- TD N°3 Chimie Des SolutionsДокумент6 страницTD N°3 Chimie Des SolutionsKir3SkalОценок пока нет
- Combustion 4emeДокумент6 страницCombustion 4emeAbđė Ěł ŁğđОценок пока нет
- Polycope Complexation FSR 2015Документ6 страницPolycope Complexation FSR 2015PFEEОценок пока нет
- Quelle Est La Différence Entre L'acier Au Carbone Et L'acier InoxДокумент2 страницыQuelle Est La Différence Entre L'acier Au Carbone Et L'acier InoxMiliani AhmedОценок пока нет
- Cin ExoДокумент10 страницCin ExoHarakat ElhoucineОценок пока нет
- RevisionДокумент10 страницRevisionChimiste ChimisteОценок пока нет
- NFcodetiДокумент19 страницNFcodetiDaniel Adde0% (1)
- 1999 Durut Fra Da RicДокумент193 страницы1999 Durut Fra Da RicDiallo SafaiouОценок пока нет
- Le Cobalt: Réaliser Par Baghlifatima Zahra El Khnissi SafaeДокумент4 страницыLe Cobalt: Réaliser Par Baghlifatima Zahra El Khnissi SafaeSkanderОценок пока нет
- Recyclage Des Métaux Version FinaleДокумент34 страницыRecyclage Des Métaux Version FinaleMarwan JBОценок пока нет
- Liste Supplement NutritionnelДокумент11 страницListe Supplement NutritionnelmohamedkadriОценок пока нет
- Cours Emballage Partie 5Документ15 страницCours Emballage Partie 5chifae bahzadОценок пока нет
- Statistique Descriptive TD Serie 4Документ3 страницыStatistique Descriptive TD Serie 4Dzudzogbe Prince Armand KOUMIОценок пока нет
- Exercices Partie 1 Avec CorrectionДокумент5 страницExercices Partie 1 Avec CorrectionEmi GaillardОценок пока нет
- I) Réalisation Et Interprétation Qualitative D'une Réaction ÉlectrochimiqueДокумент3 страницыI) Réalisation Et Interprétation Qualitative D'une Réaction Électrochimiquepedro66Оценок пока нет
- DécouverteДокумент10 страницDécouverteMeriem HamitoucheОценок пока нет
- 02ExosCor PDFДокумент5 страниц02ExosCor PDFHamza El-ghrirОценок пока нет
- k110 Ou X153crmov12Документ67 страницk110 Ou X153crmov12Walid Ben AmirОценок пока нет
- Aciers Pour Traitements Thermiques-2 PDFДокумент18 страницAciers Pour Traitements Thermiques-2 PDFKimo HakimОценок пока нет
- 01.05.01 Leviat F FR Titan Fiche Technique v01 2020-08-10Документ5 страниц01.05.01 Leviat F FR Titan Fiche Technique v01 2020-08-10Ossama El SayedОценок пока нет
- Pile de DanielleДокумент3 страницыPile de DanielleAnis NissouОценок пока нет
- Chimie: Banque D'Epreuves G2EДокумент8 страницChimie: Banque D'Epreuves G2EMihnea GamanОценок пока нет
- Décroissance Radioactive Serie1-5Документ3 страницыDécroissance Radioactive Serie1-5hurrem unsalezОценок пока нет
- Catalogue GSL Avec Liens 103Документ1 страницаCatalogue GSL Avec Liens 103Tantely RazafimahatratraОценок пока нет
- 5lv018 LV Citron 1l Top BudgetДокумент1 страница5lv018 LV Citron 1l Top Budgetpkh29Оценок пока нет
- Stainless Tubes Europe. Tubes Soudés en Acier InoxydableДокумент6 страницStainless Tubes Europe. Tubes Soudés en Acier InoxydableBertrand LaugaОценок пока нет
- Le Grand-Oeuvre Opératoire2 PDFДокумент66 страницLe Grand-Oeuvre Opératoire2 PDFKamala100% (2)