Академический Документы
Профессиональный Документы
Культура Документы
Informe de N Y P
Загружено:
Ruben FonsecaОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Informe de N Y P
Загружено:
Ruben FonsecaАвторское право:
Доступные форматы
UNIVERSIDAD PEDAGOGICA NACIONAL
FACULTAD DE CIENCIA Y TECNOLOGA
SISTEMAS INORGANICOS I
NITROGENO Y FOSFORO
OBJETIVOS
Observar las diferencias entre el fsforo rojo y el fsforo blanco.
Identificar productos de reaccin que se dan con algunos compuestos de
nitrgeno.
Observar e identificar propiedades del nitrgeno y el fsforo.
FUNDAMENTO TEORICO
FOSFORO
El fsforo, al igual que ocurre con el S, se presenta en varias formas
alotrpicas. Sus propiedades (aspecto e incluso reactividad) varan
sustancialmente de unas a otras. Todas ellas contienen enlaces sencillos
PP.
Fsforo blanco
El fsforo blanco fue la sustancia que obtuvo H. Brandt.
Propiedades
Es una sustancia molecular, constituida por
molculas de P4 en las que los tomos de P se
disponen de forma tetradrica
Al ser un slido molecular los puntos de ebullicin y fusin (44C y
280C, respectivamente) son bajos. El slido tiene elevada presin de
vapor y tiene un aspecto como de cera.
Es blando y soluble en disolventes no polares (CS 2) o poco polares (el
rojo y el negro no lo son). Es insoluble en agua. Se almacena bajo ella
para prevenir su oxidacin (las otras formas son estables en contacto
con el aire).
Es muy txico (dosis letal 0.1 g). Provoca necrosis de la mandbula y una
muerte lenta y dolorosa. No se debe permitir su contacto con la piel.
El xido se forma en un estado electrnicamente excitado y es cuando
los electrones decaen a su estado fundamental cuando se emite luz
(fosforescencia).
P4 (s) + 5 O2 (g)
P4O10 (s)
El fsforo blanco se obtiene por reduccin de fosfato clcico con carbn,
utilizndose el dixido de silicio para capturar el Ca en forma de silicato
clcico. La reduccin con carbn requiere una elevada temperatura a
pesar de que la reaccin es exotrmica (DH=-3060 kJ).
2 Ca3(PO4)2 (s) + 10 C (s) + 6 SiO2 (s) 1500 C
CaSiO3(l)
P4 (g) + 10 CO (g) + 6
Por qu existe el P4 y no el N4?
Argumento termodinmico
A partir de la tabla de energas de enlace podemos calcular las
variaciones entlpicas asociadas a los procesos de formacin de ambas
molculas que claramente favorecen la formacin del P 4 frente a la del
N4.
2P2(g)
P4(g) DHo= -220 kJ mol-1
2N2(g)
N4(g) DHo= 930 kJ mol-1
Argumento Estrico
Las tensiones estricas, ya grandes en el P 4, aumentaran en el N al ser
este ms pequeo.
Fsforo rojo
Si calentamos (270-300C) el fsforo blanco en ausencia de aire se
obtiene el P rojo. Es una sustancia amorfa, ms densa, ms dura, con un
punto de fusin mucho mayor (600C).
Es menos txica y reactiva que la forma blanca. Puede ser almacenada
en presencia de aire sin que reaccione con l.
Est formado por redes tridimensionales con cada tomo de fsforo en
un entorno piramidal. Debido a ello el fsforo rojo es insoluble y su
temperatura de fusin es mayor (600oC) que la del blanco.
La densidad del fsforo rojo tambin es mayor que la del blanco
Reactividad
Es termodinmicamente ms estable que el P 4 y, por tanto, menos activo
desde un punto de vista qumico. Arde en contacto con el aire slo si
calentamos a temperaturas aproximadas de 400C. No hay peligro de
combustin al aire en condiciones normales
Cuando se calienta bajo presin (1.2 GPa) se forma una variedad negra
(fsforo negro), ms densa y an menos reactiva con estructura
tridimensional. Es la forma alotrpica ms estable termodinmicamente.
Tiene propiedades de semiconductor. Estructuralmente recuerda al
grafito.
P4 (blanco) (300 C)
P rojo (200C,12000 atm)
P negro
NITROGENO
El nitrgeno es un gas no txico, incoloro, inodoro e inspido. Puede condensarse en forma
de un lquido incoloro que, a su vez, puede comprimirse como un slido cristalino e
incoloro. El nitrgeno aparece en dos formas isotpicas naturales; artificialmente se han
obtenido cuatro istopos radiactivos. Tiene un punto de fusin de -210,01 C, un punto de
ebullicin de -195,79 C y una densidad de 1,251 g/l a 0 C y 1 atmsfera de presin. Su
masa atmica es 14,007.
Se obtiene de la atmsfera haciendo pasar aire por cobre o hierro calientes; el oxgeno se
separa del aire dejando el nitrgeno mezclado con gases inertes. El nitrgeno puro se
obtiene por destilacin fraccionada del aire lquido. Al tener el nitrgeno lquido un punto
de ebullicin ms bajo que el oxgeno lquido, el nitrgeno se destila antes, lo que permite
separarlos.
El nitrgeno constituye cuatro quintos (78,03%) del volumen del aire. Es inerte y acta
como agente diluyente del oxgeno en los procesos de combustin y respiracin. Es un
elemento importante en la nutricin de las plantas. Ciertas bacterias del suelo fijan el
nitrgeno y lo transforman (por ejemplo, en nitratos) para poder ser absorbido por las
plantas, en un proceso llamado fijacin de nitrgeno. En forma de protena es un
componente importante de las fibras animales. El nitrgeno aparece combinado en los
minerales, como el salitre (KNO3) y el nitrato de Chile (NaNO3), dos importantes productos
comerciales.
Se combina con otros elementos nicamente a altas temperaturas y presiones. Se hace
activo sometindolo a una descarga elctrica a baja presin, combinndose con metales
alcalinos para formar azidas; con vapor de cinc, mercurio, cadmio y arsnico para formar
nitruros, y con numerosos hidrocarburos para formar cido cianhdrico y cianuros, tambin
llamados nitrilos. El nitrgeno activado se vuelve nitrgeno ordinario apenas en un minuto.
En estado combinado, interviene en muchas reacciones. Son tantos los compuestos que
forma, que el qumico estadounidense Edward Franklin elabor un esquema de compuestos
que contienen nitrgeno en lugar de oxgeno. En compuestos, el nitrgeno aparece con
todas las valencias que van de -3 a +5. El amonaco, la hidracina y la hidroxilamina son
ejemplos de compuestos en los que la valencia del nitrgeno es -3, -2 y -1, respectivamente.
Los xidos del nitrgeno son un ejemplo de compuestos en los que el nitrgeno tiene todas
las valencias positivas.
PROCEDIMIENTO EXPERIMENTAL
ANEXO EN LOS PREINFORMES
CUESTIONARIO
1. Realizar las ecuaciones de reaccin de los procedimientos.
2. Hallar el porcentaje de rendimiento en la recoleccin N 2 sobre agua.
3. Realizar un cuadro comparativo de las propiedades de las dos formas alotrpicas
del fosforo usadas en la prctica
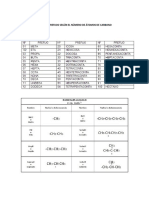
ALOTROPOS DEL FOSFORO
FOSFORO BLANCO O
FOSFORO ROJO
AMARILLO
uno de los enlaces de la estructura
es muy toxico
tetradrica del fosforo blanco se rompe
para unirse a una unidad vecina por tanto
es una molcula tetratmica
el fosforo rojo es un polmero
es una sustancia muy reactiva
arde de manera vigorosa en el
aire para dar daca xido de tetra
su punto de fusin es alrededor de 600 C
fsforo P4 + 5 O2 ---- P4O10
funde a 44 C
es insoluble en disolventes que
forman puentes de hidrogeno
es insoluble en todos los disolventes
es muy soluble en disolventes
orgnicos no polares como el di
sulfuro de carbono
es de mayor estabilidad
es el menos estable
termodinmicamente
termodinmicamente
4. Qu efecto tiene el calor sobre los nitratos metlicos?
TABLAS Y RESULTADOS
1. diferencia entre fosforo rojo y fosforo blanco
P4 + H20 ----> PH3 + H2PO2
OBSERVACION: Al mezclar fosforo blanco y agua no se observo ningn
tipo de reaccin.
OBSERVACION: al mezclar el fosforo rojo y el fosforo blanco; sentimos
un olor ftido y no hubo reaccin aparente
2. Recoleccin de N2 en agua
Presin: 564 mmHg
Temperatura: 18 C
Humedad relativa: 52
NH4Cl + NaNO2 = 2 H2O + N2 + NaCl
0,209
0,2310
VOLUMEN DEZPLAZADO: 146 ML (experimental)
3. 2 Cu + 6 HNO3 ---> 2 Cu(NO3)2 + 2 NO +1/2 O2 + 3 H2O
0,503g
OBSERVACION: burbujea y forma un precipitado rojo
Cu
+ HNO3 ------Diluido
OBSERVACION: forma capas ms dispersas
FeSO4 + H2SO4
ACIDO SULFURICO CONCENTRADO SULFATO FERROSO
------ ACIDO NITRICO
OBSERVACION: Es una reaccin exotrmica y se formo un anillo caf
CONCLUSIONES
Вам также может понравиться
- Carbonoides y NitrogenadosДокумент8 страницCarbonoides y NitrogenadosMiriamОценок пока нет
- Industria Del FosforoДокумент23 страницыIndustria Del FosforoYesenia SCОценок пока нет
- Elementos Quimicos Del Grupo 15-18Документ11 страницElementos Quimicos Del Grupo 15-18JESSICA NATALIA MORENO ESPINOSAОценок пока нет
- Grupo 15 No MetalesДокумент4 страницыGrupo 15 No MetalesINNI COHFIОценок пока нет
- Inorganic A 10Документ7 страницInorganic A 10Jersy Lizarbe100% (1)
- Fiq NitrogenoДокумент24 страницыFiq Nitrogenorichard diegoОценок пока нет
- Fosforo y Arsenico FinalДокумент14 страницFosforo y Arsenico FinalisamelОценок пока нет
- AlótroposДокумент21 страницаAlótroposYoselinRamosОценок пока нет
- Fosforo Arsenico Antimonio Bismuto PDFДокумент9 страницFosforo Arsenico Antimonio Bismuto PDFJosmel PerezОценок пока нет
- Usos Principales de Los Alótropos de FosforoДокумент5 страницUsos Principales de Los Alótropos de FosforoLizz IzidroОценок пока нет
- Grupo 15Документ8 страницGrupo 15FranciscoОценок пока нет
- Fosforo PDFДокумент19 страницFosforo PDFStwar J. Loayza VilcaОценок пока нет
- FósforoДокумент39 страницFósforoAndre VargasОценок пока нет
- Cuadernillo 15Документ39 страницCuadernillo 15Brayan Geovannii TonatoОценок пока нет
- Trabajo Práctico de Laboratorio FosforoДокумент3 страницыTrabajo Práctico de Laboratorio Fosfororoveor2018Оценок пока нет
- SEGUNDOCUESTIONARIOДокумент10 страницSEGUNDOCUESTIONARIOANОценок пока нет
- Alótropos Del FósforoДокумент6 страницAlótropos Del FósforoVíctor TovarОценок пока нет
- Grupo V-A Tabla PeriodicaДокумент17 страницGrupo V-A Tabla Periodicaadrian_rocha_48Оценок пока нет
- Química Inorgánica Grupo V NitrogenoДокумент9 страницQuímica Inorgánica Grupo V NitrogenoRocco Del VecchioОценок пока нет
- Quìmica Inorganica Practica Nº10 - NitrogenoidesДокумент4 страницыQuìmica Inorganica Practica Nº10 - NitrogenoidesEsther Quispe100% (1)
- MARCO TEORICO Grupo 5AДокумент5 страницMARCO TEORICO Grupo 5Akarel caceres huaringaОценок пока нет
- Grupo 15 PnicogenosДокумент11 страницGrupo 15 PnicogenosGeogeneralОценок пока нет
- Nitrogenoides Grupo - 15Документ8 страницNitrogenoides Grupo - 15najislamiОценок пока нет
- T.P DE LABORATORIO NUEVPДокумент13 страницT.P DE LABORATORIO NUEVPlauty esquivelОценок пока нет
- Presentación Grupo VДокумент14 страницPresentación Grupo VItandehui MartinezОценок пока нет
- Características del grupo VA: nitrógeno, fósforo, arsénico, antimonio y bismutoДокумент14 страницCaracterísticas del grupo VA: nitrógeno, fósforo, arsénico, antimonio y bismutoZonomi Fernandes BustamanteОценок пока нет
- NitrogenoidesДокумент46 страницNitrogenoidesJordy GonzagaОценок пока нет
- Familia V-FinalДокумент15 страницFamilia V-Finalmarcosdysse09gmail.com ysseОценок пока нет
- Elementos Grupo 16Документ35 страницElementos Grupo 16Mariajo FernándezОценок пока нет
- Curso de Química: Carbono, Nitrógeno y FósforoДокумент24 страницыCurso de Química: Carbono, Nitrógeno y FósforonixonacostaОценок пока нет
- AlotropíaДокумент4 страницыAlotropíaVictorОценок пока нет
- Elementos Del Grupo 15Документ3 страницыElementos Del Grupo 15JORGE EDUARDO TUNAROZA FUENTESОценок пока нет
- 23Документ5 страниц23Gissela Edith Moreno FuentesОценок пока нет
- Escrito NitrogenoidesДокумент44 страницыEscrito NitrogenoidesBrenda Soto67% (3)
- Elementos Del Grupo 15: Conrado Depratt 1Документ138 страницElementos Del Grupo 15: Conrado Depratt 1Raylin PujolsОценок пока нет
- No MetalesДокумент22 страницыNo MetalesJhocelyn LuanaОценок пока нет
- Practica N°11 Quimica InorganicaДокумент12 страницPractica N°11 Quimica Inorganicakj saavedra narvarteОценок пока нет
- Elementos Del Grupo 16 17 18Документ4 страницыElementos Del Grupo 16 17 18Alx DantheОценок пока нет
- Elementos Del Grupo 15Документ5 страницElementos Del Grupo 15Miriam AlcaideОценок пока нет
- Semin InorgДокумент5 страницSemin InorgAndrea Tatiana Ballesteros BotinaОценок пока нет
- Presentación Proyecto Trabajo Ciencias Química Doodle A Mano Infantil Colorido Verde y RosaДокумент37 страницPresentación Proyecto Trabajo Ciencias Química Doodle A Mano Infantil Colorido Verde y RosaMiiqah BustamanteОценок пока нет
- FOSFOTOДокумент5 страницFOSFOTOAnthony PerezОценок пока нет
- Obtención de compuestos nitrogenados y propiedades del amoniacoДокумент5 страницObtención de compuestos nitrogenados y propiedades del amoniacoNeber Sumire PpaccoОценок пока нет
- AlotropíaДокумент4 страницыAlotropíaEsteban DonadoОценок пока нет
- Fosforo y Sus Compuestos "VISITEN MI BLOG ALLÍ ESTOY SUBIENDO NUEVOS ARCHIVOS Http://quimicofiq - Blogspot.com/"Документ14 страницFosforo y Sus Compuestos "VISITEN MI BLOG ALLÍ ESTOY SUBIENDO NUEVOS ARCHIVOS Http://quimicofiq - Blogspot.com/"denis100% (3)
- Reacciones de los anfígenos: oxígeno y azufreДокумент10 страницReacciones de los anfígenos: oxígeno y azufreEbert De la cruzОценок пока нет
- Elementos Del Grupo IvaДокумент20 страницElementos Del Grupo IvaAndrés ParedesОценок пока нет
- LantánidosДокумент24 страницыLantánidosAldo Reda Muñoz NavarroОценок пока нет
- Lantánidos, elementos estratégicosДокумент24 страницыLantánidos, elementos estratégicosAldo Reda Muñoz NavarroОценок пока нет
- Clase 10 Sem 6 Compuestos Del Fosforo PDFДокумент23 страницыClase 10 Sem 6 Compuestos Del Fosforo PDFqigtcvuvОценок пока нет
- Mi Elemento Favorito.Документ4 страницыMi Elemento Favorito.Gayosso Arellano MaricruzОценок пока нет
- Charla de OrganicaДокумент26 страницCharla de Organicaapi-273018439Оценок пока нет
- Grupo 15. Nitrógeno, Fosforo.Документ1 страницаGrupo 15. Nitrógeno, Fosforo.Camilo HerreraОценок пока нет
- Grupo V Ino NitrogenoidesДокумент22 страницыGrupo V Ino NitrogenoidesRodrigo MullerОценок пока нет
- TP 7 FosforoДокумент2 страницыTP 7 FosforoNicolas AgueroОценок пока нет
- Informe de Anfigenos DocxdocxДокумент10 страницInforme de Anfigenos DocxdocxRodolfo Mayo QuispeОценок пока нет
- Halógenos y Gases NoblesДокумент22 страницыHalógenos y Gases NoblesManuel OrihuelaОценок пока нет
- Taller de Nivelación - Química °11Документ3 страницыTaller de Nivelación - Química °11Ruben FonsecaОценок пока нет
- Biotecnología: aplicaciones, importancia y futuroДокумент3 страницыBiotecnología: aplicaciones, importancia y futuroRuben FonsecaОценок пока нет
- Taller de Nivelación - Química °10Документ4 страницыTaller de Nivelación - Química °10Ruben Fonseca100% (1)
- QuímicaNivДокумент2 страницыQuímicaNivRuben FonsecaОценок пока нет
- Taller Desarrollo Competencias Quimica I PDFДокумент32 страницыTaller Desarrollo Competencias Quimica I PDFYonathan Alberto Charris TorresОценок пока нет
- Parametros Del Informe de LaboratorioДокумент5 страницParametros Del Informe de LaboratorioRuben FonsecaОценок пока нет
- Taller de Factores Que Afectan El EquilibrioДокумент1 страницаTaller de Factores Que Afectan El EquilibrioRuben FonsecaОценок пока нет
- QuímicaNivДокумент2 страницыQuímicaNivRuben FonsecaОценок пока нет
- Preguntas Decimso (Recuperado Automáticamente)Документ1 страницаPreguntas Decimso (Recuperado Automáticamente)Ruben FonsecaОценок пока нет
- Parametros Del Informe de LaboratorioДокумент5 страницParametros Del Informe de LaboratorioRuben FonsecaОценок пока нет
- HeuristicosДокумент3 страницыHeuristicosRuben FonsecaОценок пока нет
- Ensayo Consumo HumanoДокумент5 страницEnsayo Consumo HumanoRuben FonsecaОценок пока нет
- Ean Bioquimica Ácidos Nucleicos, Enzimas y Vitaminas PDFДокумент69 страницEan Bioquimica Ácidos Nucleicos, Enzimas y Vitaminas PDFRuben FonsecaОценок пока нет
- LABORATORIOДокумент3 страницыLABORATORIORuben FonsecaОценок пока нет
- Sintesis Documental Colombia ViveДокумент7 страницSintesis Documental Colombia ViveRuben FonsecaОценок пока нет
- Características Culturales de Estados UnidosДокумент2 страницыCaracterísticas Culturales de Estados UnidosRuben FonsecaОценок пока нет
- PFD NylonДокумент2 страницыPFD NylonRuben FonsecaОценок пока нет
- LEY CHARLES VOLUMEN TEMPERATURAДокумент6 страницLEY CHARLES VOLUMEN TEMPERATURAOe Kryv50% (2)
- 6to Laboratorio Quimica Organica. PractiДокумент21 страница6to Laboratorio Quimica Organica. PractiIsaiasОценок пока нет
- Ean Bioquimica Fermentacion Octubre 2016 PDFДокумент37 страницEan Bioquimica Fermentacion Octubre 2016 PDFRuben FonsecaОценок пока нет
- Proyecto AmbientalДокумент3 страницыProyecto AmbientalRuben FonsecaОценок пока нет
- Tabla de Prefijos Según El Numero de Atomos de CarbonoДокумент1 страницаTabla de Prefijos Según El Numero de Atomos de CarbonoRuben FonsecaОценок пока нет
- Corre GidoДокумент9 страницCorre GidoRuben FonsecaОценок пока нет
- 02 - Ecuación de Cantidad de Movimiento IДокумент29 страниц02 - Ecuación de Cantidad de Movimiento IRuben FonsecaОценок пока нет
- Ejerciciosdebalanceo 110220233026 Phpapp01 (Autoguardado)Документ4 страницыEjerciciosdebalanceo 110220233026 Phpapp01 (Autoguardado)Ruben FonsecaОценок пока нет
- Gimnasio Los SaucesДокумент4 страницыGimnasio Los SaucesRuben FonsecaОценок пока нет
- Determine La Composición Porcentual de Cada Uno de Los Elementos en Los Siguientes CompuestosДокумент2 страницыDetermine La Composición Porcentual de Cada Uno de Los Elementos en Los Siguientes CompuestosRuben Fonseca100% (1)
- Evaluación DisolucionesДокумент2 страницыEvaluación DisolucionesRuben Fonseca50% (2)
- Quimica Decimo Primer TallerДокумент1 страницаQuimica Decimo Primer TallerRuben FonsecaОценок пока нет
- Organ Iz AdoresДокумент9 страницOrgan Iz AdoresRuben FonsecaОценок пока нет
- Ejercicios de Muestreo-Taller 3 U1Документ6 страницEjercicios de Muestreo-Taller 3 U1Bryan100% (1)
- Edificio TerminalДокумент78 страницEdificio TerminalMauricio GarciaОценок пока нет
- 1-Ensayo Existencialismo y MuerteДокумент6 страниц1-Ensayo Existencialismo y MuerteARKANОценок пока нет
- 5 Productos 5ta SesionДокумент5 страниц5 Productos 5ta SesionDante FragaОценок пока нет
- AQ10. Compatibilidad Fungicidas. Rev. Enero 2020Документ2 страницыAQ10. Compatibilidad Fungicidas. Rev. Enero 2020Marisa PradaОценок пока нет
- ACTA ELECCIÓN DE CONSEJO ESTUDIANTIL 2024Документ13 страницACTA ELECCIÓN DE CONSEJO ESTUDIANTIL 2024RAULОценок пока нет
- ConclusionДокумент1 страницаConclusionKevin GonzalezОценок пока нет
- La Paz y El HonorДокумент2 страницыLa Paz y El HonorEduardo B. M. AllegriОценок пока нет
- Acta de Monitoreo en La Microrred ChiriacoДокумент2 страницыActa de Monitoreo en La Microrred ChiriacoJEFFERSON VELA OC100% (1)
- La Ciudadania en La Democracia ModernaДокумент12 страницLa Ciudadania en La Democracia ModernaStephany Rosanna Borbor RobayoОценок пока нет
- Elegía Apu Inka AtawallpamanДокумент46 страницElegía Apu Inka AtawallpamanAdan LunaОценок пока нет
- La EntrevistaДокумент2 страницыLa EntrevistaJoseNovero0% (1)
- El Crecimiento en La Iglesia PDFДокумент4 страницыEl Crecimiento en La Iglesia PDFbeymar_redimido100% (1)
- Consejos Educativos en Venezuela 058Документ20 страницConsejos Educativos en Venezuela 058sin nombreОценок пока нет
- Luis Prieto Sanchís - Los Problemas Interpretativos y Los Métodos de Interpretación Del DerechoДокумент5 страницLuis Prieto Sanchís - Los Problemas Interpretativos y Los Métodos de Interpretación Del DerechoencuentroredОценок пока нет
- Marco Curricular NacionalДокумент88 страницMarco Curricular NacionalJuan Francisco Paco AcasieteОценок пока нет
- Diseño de instalaciones escolares según NTC 4595Документ23 страницыDiseño de instalaciones escolares según NTC 4595Ana MarciaОценок пока нет
- ACTA JUZGAMIENTO Peculado CulposoДокумент17 страницACTA JUZGAMIENTO Peculado CulposoLuisDorregarayОценок пока нет
- Música medieval examen parcialДокумент5 страницMúsica medieval examen parcialSteven MarteОценок пока нет
- Repaso PsicopatoДокумент4 страницыRepaso PsicopatoAna Milena VillotaОценок пока нет
- WECHSELPRÄPOSITIONENДокумент16 страницWECHSELPRÄPOSITIONENIris Aragoneses GuzmánОценок пока нет
- Filosofia - y - Cultura - Inst 1 PDFДокумент30 страницFilosofia - y - Cultura - Inst 1 PDFjharnoldОценок пока нет
- 9 METODOLOGIA Fondo Emprender Word PLAN DE NEGOCIO DERLY ZUÑIGAДокумент21 страница9 METODOLOGIA Fondo Emprender Word PLAN DE NEGOCIO DERLY ZUÑIGAYuly Paola Rodríguez100% (1)
- Trabajo Final de Estadistica 2Документ4 страницыTrabajo Final de Estadistica 2Anderson RamosОценок пока нет
- GlosarioДокумент77 страницGlosariocarlosmortera56Оценок пока нет
- Biografia Jose BonaparteДокумент2 страницыBiografia Jose BonaparteLuchi GianoliniОценок пока нет
- Estrellas en El CieloДокумент4 страницыEstrellas en El CieloEnrique Javier0% (1)
- Qué Es La CienciaДокумент7 страницQué Es La CienciaTania Fiorella Becerra FloresОценок пока нет
- Confort Visual y SonoroДокумент11 страницConfort Visual y SonoroYanet RodriguezОценок пока нет
- Contrato Compraventa Bienes MueblesДокумент3 страницыContrato Compraventa Bienes MueblesArizbeth VázquezОценок пока нет