Академический Документы
Профессиональный Документы
Культура Документы
Cálculos Estequiométricos e Equilíbrio Químico
Загружено:
Maria Do Carmo BrazОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Cálculos Estequiométricos e Equilíbrio Químico
Загружено:
Maria Do Carmo BrazАвторское право:
Доступные форматы
Agrupamento de Escolas S da Bandeira
Escola Secundria de S da Bandeira
FSICA e QUIMICA A - 11ANO
FICHA DE TRABALHO
1.
UNIDADE 1 1.2 e 1.4 - Clculos Estequiomtricos e Equilbrio Qumico
Uma amostra de 24,0 g de benzeno (C6H6) foi adicionada, gota a gota, a 100,0 g de bromo (Br2) na presena
de uma pequena quantidade de brometo de ferro (II), que no atua como reagente. Obtiveram-se 40,0 g de
bromobenzeno. A equao que traduz a reao :
C6H6 (g) + Br2 () C6H5Br (g) + HBr (g)
1.1 Indique, justificando, o reagente limitante.
1.2 Calcule o rendimento da reao.
1.3 Calcule o volume de brometo de hidrognio obtido em condies PTN.
1.4 Qual a funo do brometo de ferro (III)?
2.
Encheu-se o depsito de um automvel com 45,0 L de combustvel o que corresponde a 300 mol de
octano. A equao que traduz a combusto do octano :
2 C8H18 () + 25 O2 (g) 16 CO2 (g) + 18 H2O (g)
2.1 Explique por que razo esta reao considerada completa.
2.2 Calcule a quantidade de oxignio necessria para queimar completamente 12,0 L de combustvel
2.3 Calcule o volume de dixido de carbono libertado, nas condies PTN.
3. O zinco pode ser produzido a partir de um minrio de sulfureto de zinco (ZnS), denominado blenda. O
esquema global que traduz este processo :
ZnS (s) + 2O2 (g) + C (s) Zn (s) + 502 (g) + CO (g)
3.1 Verifique se o esquema est de acordo com a Lei de Lavoisier e, se no estiver, efetue as operaes
necessrias para que fique de acordo com esta lei.
3.2 Calcule a massa de zinco formada a partir de 100 kg de sulfureto de zinco se o rendimento da reao for de
27%.
4. Os tradicionais fsforos so constitudos por sulfureto de fsforo (P4S3). O sulfureto de fsforo feito a partir
de fsforo e enxofre, aquecidos a temperaturas superiores a 100 0C, reao traduzida pela seguinte equao:
P4 (s) + 3S ()
P4S3 (s)
Aqueceu-se uma mistura de 120,0 g de fsforo (P4) e 64.0 g de enxofre (S).
4.1 Qual o reagente limitante?
4.2 Calcule:
4.2.1 a massa de reagente em excesso que ficou por reagir;
4.2.2 a massa de sulfureto de fsforo formada.
5.
As reaes qumicas podem, em determinados sistemas, evoluir para uma situao de equilbrio. Analise o
quadro seguinte e responde s questes formuladas.
Reao
Reagentes
Produtos
Substncias presentes no "final" da reao
CaO (s) e H2O ()
Ca(HO)2 (aq)
Ca(HO)2, (aq) e H2O ()
SO2 (g) e O2 (g)
SO3 (g)
SO3 (g), SO2 (g) e O2 (g)
NH3 (g) e HCl (g)
NH4Cl (s)
NH4Cl (s), NH3 (g) e HCl (g)
C4H10 (g) e O2(g)
CO2 (g) e H2O (g)
CO2 (g). H2O () e O2 (g)
NH3 (g) e O2 (g)
NO (g) e H20 (g)
NO(g), H2O (g), NH3 (g) eO02 (g)
C (s) e CO2 (g)
CO (g)
CO (g), C (s) e CO2 (g)
Ficha de trabalho realizada pelo subgrupo de FQA - 11ano
Pgina 1
5.1 Identifique as reaes reversveis. Justifique.
5.2 Para cada uma das reaes identificadas em 5.1, escreva a equao qumica que representa a reao direta
e a reao inversa
5.3 Identifique as reaes homogneas e as heterogneas.
6.
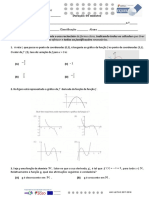
No grfico seguinte representa-se a variao da velocidade da reao direta e da reao inversa no
decorrer do tempo, para uma reao qumica reversvel
6.1 Classifique em verdadeira ou falsa cada uma das afirmaes.
(A) A concentrao dos produtos maior no instante t3 do que no
instante t1
(B) No instante t3 a reao terminou.
(C) A converso dos reagentes e produtos terminou no instante t3
(D) No Instante t2 a reao atinge o estado de equilbrio.
6.2 Identifique o ramo do grfico (I ou II) que corresponde variao da rapidez da reao Inversa. Justifique a
escolha.
7.
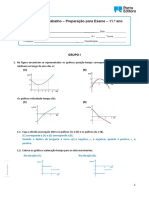
No decorrer das reaes qumicas. a concentrao dos produtos aumenta e a dos reagentes diminui, at
que se atinge o estado de equilbrio ou a reao termina. Observe os grficos seguintes e responde s questes
propostas.
7.1 Indique em qual dos casos se atingiu o equilbrio. Justifique.
7.2 Identifique os reagentes e os produtos de cada uma das reaes.
7.3 Selecione a opo que completa corretamente a seguinte afirmao:
As equaes qumicas representativas das reaes diretas so ...
(A) A + C B
D + E F.
(B) A + 2C B
2D + E 2F.
(C) 2A + C 2B
D + 2E F.
(D) A + 2C B
2D + 3E 2 F
8. Escreva a expresso da constante de equilbrio para cada uma das seguintes reaes:
a) S2 (g) + O2 (g) S02 (g)
c) CO (g) + O2 (g) CO2 (g)
b) NOC (g) NO (g) + C2 (g)
d) HC (g) + O2 (g) H2O (g) + C2 (g)
9. Indique, justificando, qual das seguintes reaes qumicas a mais extensa, s temperaturas indicadas.
Indique, tambm, a ordem crescente da extenso das vrias reaes.
(A) PC5 (g) PC3 (g) + C2 (g)
Kc = 1,77 (a 250 oC)
(B) NOCI (g) NO (g) + C2 (g)
Kc = 2 x 10-10 (a 25 oC)
(C) CO (g) + H20 (g) CO2(g) + H2 (g)
Kc = 302 (a 327 oC)
(D) CdS (s) Cd2+ (aq) + S2- (aq)
Ficha de trabalho realizada pelo subgrupo de FQA - 11ano
Kc = 7,1 x10-28 (a 25 oC)
Pgina 2
10. Considera a reao representada pela equao:
4 HC(g) + 02(g) 2 H20(g) + 2 C2(g)
Um reator com 5 L de capacidade contm, em equilbrio, temperatura T, 0,060 mol de HC, 0,055 mol de 02,
0,070 mol de H20 e 0,050 mol de C2.
10.1 Escreva a expresso da constante de equilbrio.
10.2 Calcule as concentraes de todas as espcies qumicas presentes no equilbrio. 10.3. Calcula o valor da
constante de equilbrio, temperatura T.
11. Realizou-se uma experincia de sntese em laboratrio, fazendo reagir dois compostos, a 30 0C, de
designao genrica A e B, obtendo-se dois produtos, de designao genrica C e D, segundo a equao
qumica:
A (g) + B (g) C (g) + D (g)
Aps a mistura dos reagentes num balo com um volume de
Tempo/min
nA/mol
nB/mol
nC/mol
nD/mol
0,5 L determinaram-se as quantidades de cada um dos
reagentes e dos produtos ao longo do tempo, a temperatura
0
0,83
1,50
0,00
0,00
constante. Os resultados aparecem Indicados na tabela
10
0,68
1,35
0,15
0,15
20
0,57
1,24
0,26
0,26
seguinte.
25
0,53
1,20
0,30
0,30
Determine, justificando:
30
0,50
1,17
0,33
0,33
35
0,49
1,16
0,34
0,34
11.1 o intervalo de tempo em que o sistema est em
40
0,49
1,16
0,34
0,34
desequilbrio qumico.
50
0,49
1,16
0,34
0,34
11.2 O quociente da reao aos 25 minutos.
11.3 A concentrao de A e B quando o sistema atingiu o equilbrio.
11.4 A constante de equilbrio da reao.
12. A constante de equilbrio, KC, da reao de produo do amonaco a partir do azoto e do hidrognio de
2,35 x 10-3 a 350 0C.
12.1 Explique por que motivo necessrio referir sempre a temperatura quando se apresenta um valor da
constante de equilbrio.
12.2 Num determinado estado de equilbrio, as concentraes so:
[N2]e = 0,60 mol dm-3; [H2]e = 9,0 mol dm-3 ; [NH3]e = 1,5 mol dm-3
Calcule a constante de equilbrio e verifique se a temperatura de reao a mesma que a apresentada no
enunciado (350 0C.), sabendo que a presso e o volume no se alteraram
13. Considere a reao 2 SO2 (g) + 02 (g) 2 SO3 (g), a qual mantida temperatura de 250 0C. Se num
determinado instante, a composio do sistema reagente for: [SO2] = 0,149 mol dm-3; [O2] = 0,449 mol dm-3;
[SO3] = 2,62 mol dm-3 e sabendo que a constante de equilbrio da reao, temperatura indicada, 249, indique
se o sistema est ou no em equilbrio no instante em que foi feita a anlise da sua composio. Caso no
esteja, indique, justificando, em que sentido evoluir.
14. O xido de azoto um dos poluentes atmosfricos emitidos durante os processos de combusto,
resultante da reao entre o azoto e o oxignio a temperaturas elevadas dentro dos motores. Esta espcie
intervm na reao de formao de ozono na troposfera, o principal constituinte do nevoeiro fotoqumico,
tendo consequncias perigosas para a sade humana e para os ecossistemas. As manifestaes da ao do NO
ocorrem apenas a nvel local, perto da fonte de origem, uma vez que esta espcie muito reativa. A constante
de equilbrio da reao de formao de NO a partir de oxignio e azoto de 4,72 x 10-31, a 25 0C, e a variao de
entalpia tem um valor positivo.
14.1 Traduza por uma equao qumica a reao de formao de NO a partir de oxignio e azoto.
14.2 Como justifica que, embora a atmosfera seja constituda predominantemente por oxignio e azoto, a
quantidade de NO produzido na atmosfera seja negligencivel?
14.3 Calcule o valor da constante de equilbrio para a reao inversa
14.4 Comente o valor obtido na questo anterior.
Ficha de trabalho realizada pelo subgrupo de FQA - 11ano
Pgina 3
Вам также может понравиться
- Manual Treinamento Portugues VALEO 036-00112-000 Rev02 PDFДокумент176 страницManual Treinamento Portugues VALEO 036-00112-000 Rev02 PDFRodrigo Souza100% (6)
- Pré-dimensionamento de tubulação forçada com critério USBRДокумент8 страницPré-dimensionamento de tubulação forçada com critério USBRLucas GasperinОценок пока нет
- Gases IdeaisДокумент4 страницыGases IdeaisGuilherme AlteiaОценок пока нет
- Matemática A6 - Taxa de VariaçãoДокумент3 страницыMatemática A6 - Taxa de VariaçãoAmália CoutoОценок пока нет
- Questão Aula 46-54 U6 Dados ProbabilidadesДокумент8 страницQuestão Aula 46-54 U6 Dados ProbabilidadesAna MacedoОценок пока нет
- Combustão do amoníaco e equações químicasДокумент4 страницыCombustão do amoníaco e equações químicasmafaldaОценок пока нет
- Átomos, moléculas e reações químicasДокумент4 страницыÁtomos, moléculas e reações químicasRuben LoboОценок пока нет
- Lançamento horizontal - Relatório experimentalДокумент4 страницыLançamento horizontal - Relatório experimentalBeatriz RamosОценок пока нет
- Ae q11 Fich Form 1Документ5 страницAe q11 Fich Form 1Mariana Coelho100% (4)
- Resoluções Dos Exercícios Do ManualДокумент401 страницаResoluções Dos Exercícios Do ManualViОценок пока нет
- Relatorio de Fisico QuimicaДокумент9 страницRelatorio de Fisico Quimicahilaryo83% (12)
- Projeto de máquinas e aparelhos químicos - Classificação e cálculo de reatoresДокумент52 страницыProjeto de máquinas e aparelhos químicos - Classificação e cálculo de reatoresPedro Tiago Batista Coelho100% (1)
- Ficha de GeometriaДокумент6 страницFicha de GeometriaRita CardosoОценок пока нет
- FQ9 - Forças, Movimentos e EnergiaДокумент15 страницFQ9 - Forças, Movimentos e EnergiaJoana PintoОценок пока нет
- Resumo FQ - Teoria Ácido-BaseДокумент11 страницResumo FQ - Teoria Ácido-BasecarlaОценок пока нет
- CDI II - ApontamentpsДокумент182 страницыCDI II - ApontamentpsRui Dinis100% (1)
- Física e Química: Configurações eletrónicasДокумент2 страницыFísica e Química: Configurações eletrónicasSara SilvaОценок пока нет
- Ficha 11 FQДокумент3 страницыFicha 11 FQMónicaRodriguesОценок пока нет
- F T 8º Ano Funções AfinsДокумент6 страницF T 8º Ano Funções AfinsEmília RodriguesОценок пока нет
- Teste Nacional SPM 10.º AnoДокумент10 страницTeste Nacional SPM 10.º AnoDavid Miguel Marques da CostaОценок пока нет
- 6705 Sistemas EletricosДокумент10 страниц6705 Sistemas EletricosManuel VianaОценок пока нет
- Banco de questões múltiplas sobre Som, Luz e Reações QuímicasДокумент41 страницаBanco de questões múltiplas sobre Som, Luz e Reações Químicasmaria100% (1)
- Sistemas de ar condicionado centralizados: evolução histórica e tecnológicaДокумент10 страницSistemas de ar condicionado centralizados: evolução histórica e tecnológicaThomas Schildt SilvaОценок пока нет
- Forças e MovimentosДокумент3 страницыForças e MovimentosFátima AlvesОценок пока нет
- Re82133 Fa11 Teste3 ResolucaoДокумент3 страницыRe82133 Fa11 Teste3 ResolucaoTania FernandesОценок пока нет
- Formação Profissional Vila RealДокумент4 страницыFormação Profissional Vila RealRaquel_DanielaОценок пока нет
- Equação e Inequação Do 1° Grau - Teoria PDFДокумент6 страницEquação e Inequação Do 1° Grau - Teoria PDFmarcolinoeeОценок пока нет
- Cálculos Estequiométricos e Equilíbrio QuímicoДокумент12 страницCálculos Estequiométricos e Equilíbrio QuímicoanamdОценок пока нет
- Exp9 GP Ficha Avaliacao 3Документ4 страницыExp9 GP Ficha Avaliacao 3Lia ManoОценок пока нет
- Teste Diagnóstico Luz FontesДокумент4 страницыTeste Diagnóstico Luz FontesMaria Vítor SantosОценок пока нет
- Reação Química CuSO4-NaOHДокумент3 страницыReação Química CuSO4-NaOHnunomsafigueiredoОценок пока нет
- Ficha de Trabalho 4 Q3Документ2 страницыFicha de Trabalho 4 Q3Maria Joao RamalhoОценок пока нет
- Proposta de Teste de Matemática A 11oДокумент4 страницыProposta de Teste de Matemática A 11orobertochapitomОценок пока нет
- Física e Química AДокумент8 страницFísica e Química AAna Perfeito0% (1)
- Módulo F.2 - Hidrostática e HidrodinâmicaДокумент18 страницMódulo F.2 - Hidrostática e HidrodinâmicaMaria CanudoОценок пока нет
- Locais geométricos em exercícios de exames nacionaisДокумент20 страницLocais geométricos em exercícios de exames nacionaisusernameamilОценок пока нет
- AP PolipódioДокумент4 страницыAP PolipódioClara GomesОценок пока нет
- Teste Sumativo - Módulo Reacções Químicas e Equilíbrio DinâmicoДокумент2 страницыTeste Sumativo - Módulo Reacções Químicas e Equilíbrio DinâmicoGracia RodriguesОценок пока нет
- Revisões-10º+testes IntermédiosДокумент16 страницRevisões-10º+testes IntermédiosDiana PereiraОценок пока нет
- FQ 8 - Recursos Digitais - Ensino-Aprendizagem (Reações Químicas)Документ8 страницFQ 8 - Recursos Digitais - Ensino-Aprendizagem (Reações Químicas)Carlos FerreiraОценок пока нет
- Ficha - FQ - Módulo Q3Документ3 страницыFicha - FQ - Módulo Q3Filomena Costa100% (1)
- Ficha de Trabalho - Acido BaseДокумент2 страницыFicha de Trabalho - Acido Baseblueboy82Оценок пока нет
- MMC MDCДокумент3 страницыMMC MDCCélia FerreiraОценок пока нет
- Resumos Filosofia 2 Teste 10 AnoДокумент4 страницыResumos Filosofia 2 Teste 10 AnoSara MarquesОценок пока нет
- Formulario Geometria Analitica Versao B1Документ2 страницыFormulario Geometria Analitica Versao B1Douglas WallysonОценок пока нет
- Teste de Matemática com Problemas de Geometria e FunçõesДокумент5 страницTeste de Matemática com Problemas de Geometria e FunçõesJoão RibeiroОценок пока нет
- Luz e reflexãoДокумент4 страницыLuz e reflexãoAndrew HernandezОценок пока нет
- Mod F3 - Teste GonçaloДокумент3 страницыMod F3 - Teste GonçaloMaria Papoila CrisОценок пока нет
- Separação Dos Componentes Teste 5Документ44 страницыSeparação Dos Componentes Teste 5ceciliaguiseОценок пока нет
- 10FQA Ficha Trab Ini Q2.2 - N.º 2Документ2 страницы10FQA Ficha Trab Ini Q2.2 - N.º 2HelenabacalhaucfqОценок пока нет
- Ficha II Parte 3 Distribuição Eletronica PDFДокумент3 страницыFicha II Parte 3 Distribuição Eletronica PDFTeresa BernardoОценок пока нет
- Ef11 Questoes Preparacao Exame Resolução PDFДокумент27 страницEf11 Questoes Preparacao Exame Resolução PDFAinsley RapiottОценок пока нет
- Ficha 3Документ5 страницFicha 3Carlos LopesОценок пока нет
- Exercícios de Matemática sobre Potências e RaízesДокумент2 страницыExercícios de Matemática sobre Potências e RaízesIdália Moleirinho de OliveiraОценок пока нет
- 1 Ae Fq11 Avaliacao Diagnostica V1Документ8 страниц1 Ae Fq11 Avaliacao Diagnostica V1TeresaVarao100% (1)
- Teste 4 FQA - 2019 AДокумент13 страницTeste 4 FQA - 2019 Ajmhenriques080% (1)
- Planificação Geometria Vetores IsometriasДокумент16 страницPlanificação Geometria Vetores IsometriasNuno Azevedo100% (1)
- Actividade Experimental Lei-LavoisierДокумент1 страницаActividade Experimental Lei-LavoisiercfbarrosoОценок пока нет
- Triângulo de Pascal Lição 2Документ5 страницTriângulo de Pascal Lição 2WebMatdezaОценок пока нет
- Plano de aulas de Física e Química da Escola Secundária de Vila Real de Santo AntónioДокумент6 страницPlano de aulas de Física e Química da Escola Secundária de Vila Real de Santo AntónioOnaxОценок пока нет
- Fichas de Avalição MACs 10º AnoДокумент4 страницыFichas de Avalição MACs 10º AnoJimi CostaОценок пока нет
- Q2 - Atividade Formativa FinalДокумент8 страницQ2 - Atividade Formativa FinalInês SequeiraОценок пока нет
- Nasceu a Ciência & Tecnologia na Ilha do Fundão: É Pública ou Privada? A Trajetória dos Institutos e Centros de Pesquisa Sediados no Campus da UFRJ na Década de 1970От EverandNasceu a Ciência & Tecnologia na Ilha do Fundão: É Pública ou Privada? A Trajetória dos Institutos e Centros de Pesquisa Sediados no Campus da UFRJ na Década de 1970Оценок пока нет
- Equilíbrio químico e cálculos estequiométricosДокумент3 страницыEquilíbrio químico e cálculos estequiométricosnelson_honorioОценок пока нет
- Ae q11 Fich Form 1Документ5 страницAe q11 Fich Form 1Ana Raquel PintoОценок пока нет
- Metodo KernДокумент5 страницMetodo KernSandroNunesОценок пока нет
- Ligação Hidrogênio vs Ponte HidrogênioДокумент2 страницыLigação Hidrogênio vs Ponte HidrogênioCarlos HenriqueОценок пока нет
- ATIVIDADE 2 - Estudo DirigidoДокумент5 страницATIVIDADE 2 - Estudo DirigidoTOIN INDIAОценок пока нет
- Diagramas de FasesДокумент16 страницDiagramas de FasesclaudiosldfОценок пока нет
- Microestrutura e difusão em materiaisДокумент89 страницMicroestrutura e difusão em materiaisLeonardo FrançaОценок пока нет
- Gabarito de Listas de Exercícios de Transferência de CalorДокумент7 страницGabarito de Listas de Exercícios de Transferência de CalorEugenio ManuelОценок пока нет
- Definições de ácidos e bases: teorias de Arrhenius, Bronsted-Lowry e LewisДокумент15 страницDefinições de ácidos e bases: teorias de Arrhenius, Bronsted-Lowry e LewisLaércio OnnyОценок пока нет
- Relatório - Ponto de FusãoДокумент3 страницыRelatório - Ponto de FusãoAndreh BomfinОценок пока нет
- AULA 1 - Introdução À Química Inorgânica - Funções InorgânicasДокумент64 страницыAULA 1 - Introdução À Química Inorgânica - Funções InorgânicasHassan Gabriel Rodrigues HarbОценок пока нет
- QuímicaДокумент76 страницQuímicabhn7gw4796Оценок пока нет
- Física - TeremodinâmicaДокумент14 страницFísica - TeremodinâmicaAfonso Celso Siqueira SilvaОценок пока нет
- Oro-Tab Farmacotecnica Forma Tepron SublingualДокумент7 страницOro-Tab Farmacotecnica Forma Tepron SublingualfagnercruzОценок пока нет
- QUÍMICAДокумент9 страницQUÍMICAstefaniebuarqueОценок пока нет
- Lista de exercícios revisionais sobre mudanças de estado, calor e temperaturaДокумент3 страницыLista de exercícios revisionais sobre mudanças de estado, calor e temperaturaRonaldo CorrêaОценок пока нет
- Dimensionamento e avaliação do ciclo de refrigeração automotivoДокумент131 страницаDimensionamento e avaliação do ciclo de refrigeração automotivoCAОценок пока нет
- Aula 21 - Equilíbrio Químico 6 - Hidrólise Salina KHДокумент26 страницAula 21 - Equilíbrio Químico 6 - Hidrólise Salina KHJulie SantosОценок пока нет
- Equação de Estado Dos Gases PerfeitosДокумент14 страницEquação de Estado Dos Gases PerfeitosjoaopedrosoeiroОценок пока нет
- Avaliação Progressão Kethlens 2º AnoДокумент3 страницыAvaliação Progressão Kethlens 2º AnoLosango PmОценок пока нет
- Introdução aos Agentes Físicos e ao CalorДокумент18 страницIntrodução aos Agentes Físicos e ao CaloroseiasalbuquerqueОценок пока нет
- Pressão Atmosférica - ExercíciosДокумент2 страницыPressão Atmosférica - ExercíciosAlessandra DoriniОценок пока нет
- Relatorio de Química Orgânica - Cravo-da-ÍndiaДокумент15 страницRelatorio de Química Orgânica - Cravo-da-ÍndiaLéo dAvilaОценок пока нет
- Propriedade QuímicasДокумент13 страницPropriedade QuímicasEder Cezano GonçalvesОценок пока нет
- VolumetriaДокумент13 страницVolumetriaSamuel JosexОценок пока нет
- Quimica Aula 7Документ14 страницQuimica Aula 7Reeves YuhОценок пока нет
- Capítulo 2Документ6 страницCapítulo 2Selma MeloОценок пока нет